官能团保护工作,转换和引入
有机合成——官能团的引入转化消除及保护课件高二化学人教版选择性必修3

氧化
CH3-CHO
CH3-COOH
五、官能团的转化(种类、数目和位置的变化)
2、官能团数目变化
原创:WJ化学研究院
CH3CH2-OH 消去
CH2=CH2
加Br2
水解 CH2Br-CH2Br
HO-CH2CH2-OH
3、官能团位置变化
消去
CH3CH2CH2-Br
CH3CH=CH2
加HBr CH3CH-CH3 Br
卤素原子 烯烃(炔烃)的加成 烷烃(苯及苯的同系物)的取代 醇(酚)的取代
羟基 烯烃与水的加成 酯的水解 卤代烃的水解 醛、酮的加氢
醛基 炔烃水化 烯烃氧化 伯醇的催化氧化 糖类水解
羧基 烯炔烃、苯的同系物、醛、醇的氧化 酯、酰胺、R-CN的水解
酯基
酯化反应、酰氯醇解
八、练习
原创:WJ化学研究院
1.由苯酚制取
①醇的催化氧化引入碳氧双键
2RCH2OH+O2
催化剂 △
2RCHO+2H2O
2RCH(OH)R'+O2 催化△ 剂2R—C—R+2H2O
O
②某些烯烃被氧化
2CH2=CH2+O2 一定条件 2CH3CHO
①O3
②Zn/H2O OHCCH2CH2CH2CH2CHO
三、引入官能团--碳氧双键
2、引入碳氧双键
4、醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,保护一般是把 醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛 也可以先生成醇,然后再氧化恢复
四、官能团的保护--氨基的保护
5、氨基(-NH2)的保护
胺基易被O2、O3、H2O2等氧化,一般采用下列方法保护
高中化学-有机合成路线的分析与设计

有机合成路线的分析与设计一、有机合成中官能团的衍变1、官能团的引入(或转化)方法(1)引入或转化为碳碳双键的三种方法①醇的消去反应引入②卤代烃的消去反应引入③炔烃与H2、HX、X2的不完全加成反应(2)引入卤素原子的三种方法①烷烃、苯及其同系物与卤素单质发生取代反应②不饱和烃与卤素单质、卤化氢的加成反应③醇与氢卤酸的取代反应(3)引入羟基的四种方法①烯烃与水加成生成醇②卤代烃的碱性水解成醇③醛或酮与氢气加成生成醇④酯水解生成醇(4)引入醛基(或羰基)的方法①醇的催化氧化(5)引入羧基的四种方法①醛被氧化成酸②酯在酸性条件下水解③含侧链的芳香烃被强氧化剂氧化④醇被强氧化剂氧化2、官能团的保护:有机合成过程中,为了避免有些官能团发生变化,必须采取措施保护官能团,待反应完成后再使其复原。
有时在引入多官能团时,需要选择恰当的顺序保护特定官能团被保护的官能团被保护的官能团性质保护方法酚羟基易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化碳碳双键易与卤素单质加成,易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化醛基易被氧化3、官能团的消除(1)通过加成消除不饱和键双键或三键(2)通过加成或氧化等消除醛基(—CHO)(3)通过消去、氧化、与氢卤酸取代或酯化反应等消除羟基(—OH)(4)通过水解反应消除酯基、肽键、卤素原子三、有机合成中碳骨架的衍变1、使有机物碳链增长的反应①乙炔自身加成②卤代烃与NaCN的反应③卤代烃与炔钠的反应④卤代烃和钠反应⑤醛、酮与氢氰酸的加成反应⑥醛、酮与格氏试剂反应⑦羟醛缩合反应⑧烯烃、炔烃加聚反应⑨苯环与卤代烃反应(傅克反应)⑩苯环与酰卤反应⑪缩聚反应2、使有机物碳链缩短的反应①脱羧反应②氧化反应③水解反应④烃的裂化或裂解反应3、使有机物碳链的成环的反应①二烯烃成环反应(双烯合成)②羟基酸酸的酯化成环③多元羧酸与多元醇的酯化成环④氨基酸的成环⑤二元羧酸与二氨基化合物成环⑥形成环醚4、使有机物碳链的开环的反应①环酯水解开环②环烯烃氧化开环四、有机合成路线的设计与分析1、常见有机物的转化关系2、有机合成路线设计思路3、常见的有机合成路线 (1)一元化合物合成路线:R —CH===CH 2−→−HX R —CH 2—CH 2X ∆−−−→−溶液NaOH R —CH 2—CH 2OH []−→−O R —CH 2—CHO []−→−OR —CH 2—COOH −−−−→−∆醇、浓硫酸、酯 (2)二元化合物合成路线CH 2===CH 2−→−2X CH 2X —CH 2X ∆−−−→−溶液NaOH HOH 2C —CH 2OH []−→−O OHC —CHO []−→−O HOOC —COOH −−−→−一定条件链酯、环酯、聚酯(3)芳香化合物合成路线 ①∆−−−→−溶液NaOH②光照−→−2Cl ∆−−−→−溶液NaOH −−−−→−∆醇、浓硫酸、芳香酯4、有机合成的分析方法(1)正向合成分析法: (2)逆向合成分析法: (3)正、逆合成分析:(4)逆合成分析法设计有机合成路线的思维程序(5)逆向合成分析法应用例析:利用“逆合成分析法”分析由乙烯合成草酸二乙酯的过程逆合成分析思路,概括如下 具体步骤如下5、解决有机合成题的基本步骤第一步:要正确判断合成的有机物属于何种有机物,它带有什么官能团,它和哪些知识、信息有关,它所在的位置的特点等第二步:根据现有原料、信息和有关反应规律,尽可能合理地把目标有机物解剖成若干片段,或寻找官能团的引入、转换、保护方法,或设法将各片段(小分子化合物)拼接衍变,尽快找出合成目标有机物的关键和突破点。
有机合成 官能团引入转换和保护

3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃 基化,酰基化以及与醛酮羰基的亲核加成反 应。在合成中常采用: (1)氨基质子化 (2)变为酰基衍生物 (3)变为烃基衍生物等方法将氨基保护起 来
3.1
质子化
此方法仅用于防止氨基的氧化,因为理论上说 采用氨基质子化,即占据氮尚未共用电子对,以阻 止取代反应的发生。这是对氨基保护最简单的法。
COCl COOH (C H 3)2C C O O C (C H 3)3 C H 2 ,H 2 S O 4
CH3 加热
S O 3H COOH
叔丁酯可由羧酸先变为酰氯,再与叔丁醇作 用,或者通过羧酸与异丁烯直接作用而得。 它不能氢解,在通常条件下也不被氨解及碱 催化水解.
5.羧基的保护
KOH COOH COOK C H 2C l
4.羰基的保护
羰基具有许多反应性能,是有机化学中 最易发生反应的活性官能团之一. 保护羰基常用的方法:生成缩醛和缩酮 来降低羰基活性而保护羰基.
4.羰基的保护
保护醛酮羰基最常用的方法是通过乙 二醇和2-疏基乙醇的反应,生成相应 的叫做环缩醛或缩酮的产物.
H O C H 2 C H 2 O H ,T sO H
优点:对碱及催化氢化是稳定的。
缺点:对酸敏感,其稳定性低于甲醚。由 于脱保护基所用的酸性条件剧烈,当分子 中存在对酸敏感的基团时不适用
2.1
• 三甲硅醚
转变成醚
三甲硅醚广泛用于保护糖类、甾类及其他醇 羟基。通常引入三甲基硅基保护基所用的试 剂有三甲基氯化硅和碱;六甲基二硅氨烷。 在含水醇溶液中加热回流即可除去保护基。 优点:醇的三甲硅醚对催化氢化、氧化还 原反应是稳定的,该保护基可在非常温和 的条件下引入和去除。 缺点:对酸和碱敏感,只能在中性条件下 使用。
第3章 官能团的导入、除去、互换及保护

§3.1 官能团的导入
3.1.1 饱和碳原子上官能团的导入
1. 饱和烃的卤代反应 氢原子的活性为:叔氢>仲氢>伯氢;卤素活性为: F2>Cl2>Br2>I2, 卤素活性越大,其选择性越差。因此,在饱和烃卤代 反应中溴代反应最为常见。
Br2 / hv r,t.~105℃ Br
+
20℃ C6H5SO2NCl
CH3 CH3 Cl Cl
+
C6H5SO2NH
3. 羰基化合物的α-卤代反应
O C C H H
+
OH C C H
-H+ slow X X C
OH C
fast
-X
-
OH C C X
-H
+
O C C X
fast
fast
O C H C
+ OH
O -H2O slow X X O C X C C C C
Hofmann eliminations
Anti elimination
2. Pyrolytic syn eliminations(顺式热消去反应)
C H O
C O
300 ~ 500 C
o
C
C
+
RCO2 H
R
Applications: Synthesis of terminal alkenes from primary acetates
O C
-X fast
-
① 醛的α-卤代反应
R' R CH CHO R' R' C H O Si(CH3)3 X2 X=Cl, Br R C CHO X
有机合成中有机物官能团的引入、消除和转化方法.

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1通过加成反应消除不饱和键。
(2通过消去反应、氧化反应或酯化反应消除羟基(—OH。
(3通过加成反应或氧化反应消除醛基(—CHO。
(4通过消去反应或水解反应消除卤素原子。
3.官能团的转化(1利用衍变关系引入官能团,如卤代烃伯醇(RCH2OH醛羧酸。
(2通过不同的反应途径增加官能团的个数,如(3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1与HCN的加成反应(2加聚或缩聚反应,如n CH2(3酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O。
3.碳链的减短(1脱羧反应:R—COONa+NaOHR—H+Na2CO3。
(3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4烃的裂化或裂解反应:C16H34C8H18+C8H16;C8H18C4H10+C4H8。
合成路线的选择1.中学常见的有机合成路线(1一元合成路线:卤代烃一元醇―→一元醛―→一元羧酸―→酯(2二元合成路线:二元醇―→二元醛―→二元羧酸―→(3芳香化合物合成路线:2.有机合成中常见官能团的保护(1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH 变为—ONa(或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH。
(2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3氨基(—NH2的保护:如在对硝基甲苯对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。
第七章官能团的引入、转换与保护

NH H2S O4
OCH3
O 2N
Cl
O2N
Cl
SO3Na NH
OCH3
11
CH3O-PhNH2
O 2N
SO3Na
磺基水解
O 2N
NH
OCH3
硝基还原
H 2N
NH
OCH3
安安蓝B色基
12
钝化导向基团
NH2
Br2
起钝化官能团的作用,使反应停留在某一阶段。
NH2
NHCOCH3
(CH3CO)2O
NHCOCH3
选择性好的反应以产生唯一的目标物为最佳结 果,避免进行化合物分离的困扰。
21
选择性反应
对减少反应步骤、提高产物收率具有重 要意义 是具有原子经济性合成的新手段 是有机合成的重要策略
22 22
在有机合成中,反应的选择性一般包括:
化学选择性 区域选择性 立体选择性
23
化学选择性:在不利用保护基或活化
PhCH=CHNO2
H2 , (Ph3P)3RhCl , PhH
PhCH2CH2NO2
39
特别是那些次序较为靠近的基团,或者随 着反应条件的改变、官能团不同位置、或 受其它基团的影响上述活性次序可能会发 生改变。
40
2.负氢转移试剂
铝氢试剂——LiAlH4、LiAlH(OR)3、二 异丁基铝锂(DIBAL) 硼氢试剂——NaBH4、KBH4、 NaBH3CN、NaBHR3
NH2
(CH3CO)2O
NHCOCH3
98%H2SO4
NHCOCH3
NHCOCH3
H2SO4-HNO3
NO2 SO3H
SO3H NH2 NO2
(完整版)官能团的引入和转化关系
CHO
O O=C CH2 O=C CH2
O
COOH COOH
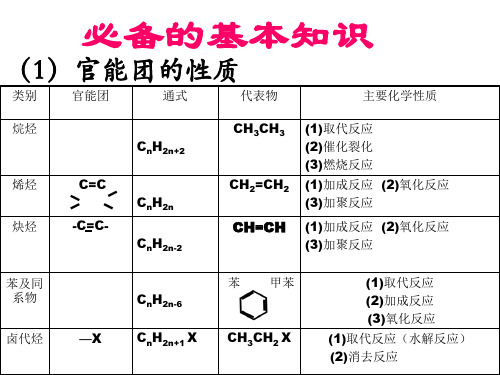
必备的基本知识
➢官能团的引入 ➢官能团的消除 ➢官能团的衍变
➢有机成环反应规律
在碳链上引入卤原子的途径
1.烷烃,苯与卤素反应:CH4 + Cl2
hv CH3Cl + HCl
C6H6 + Br2 Fe C6H5Br + HBr
3.烯/炔加成卤素/卤化氢:CH2=CH2 + Br2 CCl4 CH2BrCH2Br
CH3CH3
水解
氧化
醇类
醛类
氧化
羧酸
酯化
取代 R—OH 加氢 R—CHO
R—COOH 水解
CH3CH2Br
CH3COOC2H5
酯类 RCOOR`
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
CH=CH CH2=CHCl
CH2Br CH2Br
[ CH2—CH ]n Cl
CH2OH
CHO
2OH
类别官能团通式代表物主要化学性质烷烃2n2ch1取代反应2催化裂化3燃烧反应烯烃2nch1加成反应2氧化反应3加聚反应2n2chch1加成反应2氧化反应3加聚反应甲苯1取代反应2加成反应3氧化反应1取代反应水解反应2消去反应类别官能团通式代表物主要化学性质ohrohoh1与钠反应2取代反应3消去反应4分子间脱水5氧化反应6酯化反应oh1有弱酸性2取代反应3显色反应4缩聚反应chorchocho1氧化反应2还原反应加成反应羧酸coohrcoohcooh1具有酸性2酯化反应coorcoor水解反应还原还原羧酸羧酸氧化氧化氧化氧化醇醇水解水解烯烃烯烃烷烃甲烷苯醇的卤代苯的硝化醇的分子间脱水酯化反应酯的水解反应等
有机合成化学2-官能团的引入与转化

benzene
+
O
O
O
O
(1) 共轭二烯烃是以顺式构象参与反应。被固定为反式的二烯体不 能发生此反应,如
而被固定的顺式反应速率大大加快,如
(2) 亲双烯体上有吸电子取代基,有利于反应。 (3) 此反应属协同反应,没有中间体,一步完成。
(4) 顺式加成,保持了二烯体、 亲二烯体的原有构型。
3. 还原反应
RCH CHCH2OH
Br2
RCH CHCH2OH Br Br
RCH CHCOOH
Zn
HNO3 RCHBrCHBrCOOH
3)醇脱水
RCH2CHR' OH
RCH CHR' + H2O
常用的酸性脱水剂有硫酸;磷酸;草酸;五氧化二磷等
CH3 H3C C CH
H3C OH
CH3
85% H3PO4
CH3
H3C C CH CH2
81%
19%
区域选择性——查依采夫(Saytzeff)规则
CH3 CH2CHCHCH3 KOH
Br
ห้องสมุดไป่ตู้
X CH3
CH2CH=C CH3
CH3 CH=CH CH
CH3
当消除能够得到共轭烯烃时,优先得到共轭烯烃。
2) 二卤代物脱卤
RCHCHR' XX
RCH CHR' + X2
常用的脱卤试剂有锌粉(或镍)的乙醇或乙酸溶液;钠的液氨溶液 等
CH3
CH3 + H3C C C CH3
CH3
醇脱水反应特点: ① 脱水速度—— 叔醇 > 仲醇 > 伯醇 ② 酸催化碳正离子中间体—— 易重排 ③ 区域选择性—— Saytzeff规则——形成多取代的烯烃 ④ 立体选择性—— 反式产物为主
[化学]有机合成 官能团引入转换和保护
![[化学]有机合成 官能团引入转换和保护](https://img.taocdn.com/s3/m/87b5e5fdce2f0066f53322d8.png)
• 乙炔及末端炔烃中的炔氢较活泼,它 可以与活泼金属`强碱`强氧化剂及有机金 属化合物反应。 • 常用的炔氢保护基为三甲硅基。将炔 烃转变为格氏试剂后同三甲基氯硅烷作用 。即可引入三甲硅基。该保护基对于金属 有机试剂`氧化剂很稳定。可在使用这类 试剂的场合保护炔基。
2.羟基的保护
• 羟基是一个活性基团,它能够分解格氏试 剂和其他有机金属化合物,本身易被氧化, 叔醇还容易脱水,并可以发生烃基化和酰基 化反应。所以在进行某些反应时,若要保留 羟基,就必须将它保护起来。 醇羟基常用的保护方法有3类:
1. NBS
2. NMe3
3. OH -
CH2NMe3 OH
+
O
+ CH2 NMe3 ¶ þ ¼ × ± ½ 二甲苯
OH
-
O
2. 裂解反应:
X R O H :B R O
X = leaving group, e.g. : -OSO2C6H4CH3-p , -OSO2CH3
例:
OTos H H H OTos H
3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃 基化,酰基化以及与醛酮羰基的亲核加成反 应。在合成中常采用: (1)氨基质子化 (2)变为酰基衍生物 (3)变为烃基衍生物等方法将氨基保护起 来
3.1
质子化
此方法仅用于防止氨基的氧化,因为理论上说 采用氨基质子化,即占据氮尚未共用电子对,以阻 止取代反应的发生。这是对氨基保护最简单的法。
6.5 卤素
6.6 硝基与氰基
6.7 羰基
6.8 羧基
参考文献: 1、有机合成化学及近代技术,徐家业著,西安石油学院出版社. 2、有机合成,黄宪编,高等教育出版社,1992年第一版. 3、有机合成讲义,许杏祥编,中科院上海有机所,1998年. 4、现代有机合成化学,吴毓林等编,科学出版社,2001年. 5、现代杂环化学选论,史真著,陕西科技出版社,1998年.
第三章 有机药物官能团的引入 转换和保护

SH RCH 2 CHR' CN RCH 2 CHR' OOCR'
NH3 LiAIH 4 H 2 / Pd Zn/ HCI NaSR'
RCH 2 CHR' NH 2 RCH 2 CHR'
RCH 2 CH 2 R'
_ NaC= CR'
SR' RCH 2 CHR' C _ CR' = RCH 2 CHR' I RCH 2 CHR' R'
后三种卤代试剂均好的选择性。
例如:
O S O
Cl
+
HO
SO 2 CI 2
hv
+
CH3
(i - Pr) 2 NCI
or H 2 SO 4 / H 2 O
HO Cl
+
[(CH 3 ) 2 CH 2 ] 2
(2)烯丙基化合物和烷基芳烃α―卤代
烯丙基化合物的α―卤代是合成不饱和卤 代烃的重要方法。 此反应也属于自由基历程。 使用的溴化剂为N―溴代丁二酰亚胺 (NBS)。
NaOH /(Me) 2 SO 4 (CH 3 ) 3 SiI
ROH
DMF
ROCH 3
ROH
CHCI 3
②叔丁醚ROC(CH3)3 :
将醇的二氯甲烷溶液或悬浮液在H2SO4或 BF3-H3PO4复合物中,在室温与过量的异 丁烯作用可得到叔丁醚。 脱保护基通常用无水CF3COOH或HBr– CH3COOH溶液。 当分子中存在对酸敏感的基团时不适用。
+
C
C
[O] RCOOH RCHO
[O] RCH 2 OH C [O] RCOR' OH C
官能团的引入、转换与保护

CO2H
Li,NH3 t BuOH
CO2H
• 在无质子溶剂中, α , β -不饱和酮会还原成酮类, 而苯环不进行还原反应;但在质子性溶剂中,酮类进一 步还原成醇类,且苯环进行 Brich 还原反应
29
二、锌金属为还原剂
• 通常加入Cu,银或 Hg 以降低锌的活性,避免其与酸 作用而产生氢气 • 在盐酸或乙酸中,可将醛,酮类还原成烷类,称为 Clemmensen还原反应。
6
醇的转化
R R' -H2O X R R' PX3 or PX5 R OH R' R"COX OCOR R R' O R O R'
7
7.2 官能团的选择性转换
8
•有机合成中,在构成碳架之后,一般情 况下很难甚至不可能直接导入官能团, 无法直接得到所需的目标产物 •通常是官能团的氧化态与目标产物不一 致,官能团中含有其它杂原子或它不是 所需的衍生物,这就需要通过一系列的 官能团的转换来实现目标产物的合成, 达成目标分子的结构 •试剂的选择是官能团转化的重要环节
Br NBS, CCl4 (PhCO2)2 OCOCH3 Pb(OAc)4 (CH3CO)2O
R or
R
3
芳环碳原子上官能团的引入
X
X /F 2 eX 3
COR RCOCl/AlCl3
nCl 2 Z / l C +H HCHO
HCl + CO/AlCl3-Cu2Cl2
CH2Cl
CHO
O n H 2S 4 o C SO3H
• 某些金属氢化物是氢负离子(H-)合成子的合成等 价物,因而是优先作用于缺电子中心的强还原剂 • 氢化物还原剂有一些剧烈地与水,又容易与醇作用 ,因此,反应必须在无水醚或烃溶剂中进行 LiAlH4 + 3 MeOH = LiAlH(OMe)3 + 3H2
有机合成中有机物官能团的引入消除和转化方法

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去1通过加成反应消除不饱和键;2通过消去反应、氧化反应或酯化反应消除羟基—OH;3通过加成反应或氧化反应消除醛基—CHO;4通过消去反应或水解反应消除卤素原子;3.官能团的转化1利用衍变关系引入官能团,如卤代烃错误!伯醇RCH2OH错误!醛错误!羧酸;2通过不同的反应途径增加官能团的个数,如3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的;如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环;2成环反应生成的五元环或六元环比较稳定;2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示;1与HCN的加成反应2加聚或缩聚反应,如n CH23酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O;3.碳链的减短1脱羧反应:R—COONa+NaOH错误!R—H+Na2CO3;3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解;4烃的裂化或裂解反应:C16H34错误!C8H18+C8H16;C8H18错误!C4H10+C4H8;合成路线的选择1.中学常见的有机合成路线2一元合成路线R—CH=CH2错误!卤代烃错误!一元醇错误!一元醛错误!一元羧酸―→酯3二元合成路线CH2=CH2错误!CH2X-CH2X错误!二元醇错误!二元醛错误!二元羧酸→错误!3芳香化合物合成路线:2.有机合成中常见官能团的保护1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH变为—ONa或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH;2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键;3氨基—NH2的保护:如在对硝基甲苯错误!对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2;防止当KMnO4氧化—CH3时,—NH2具有还原性也被氧化;有机合成中有机物官能团的引入、消除和转化方法练习例1工业上用甲苯生产对羟基苯甲酸乙酯,其过程如下:据合成路线填写下列空白:1有机物A的结构简式:____________________________________________________,B的结构简式:_____________________________________________________________;2反应④属于__________反应,反应⑤属于____________反应;3③和⑥的目的是__________________________________________________________;4写出反应⑥的化学方程式:_________________________________________________;例2由环己烷可制备1,4-环己醇二醋酸酯;下面是有关的8步反应其中所有无机产物都已略去;1在上述8步反应中,属于取代反应的有________,属于加成反应的有________,反应④属于________反应;2写出下列化合物的结构简式;B:__________________,C:________________;3写出反应④、⑤、⑥的化学方程式;④____________________________________________________________ ____________,⑤____________________________________________________________ ____________,⑥____________________________________________________________ ____________;4写出在NaOH溶液中水解的化学方程式:______________________;例3乙醇在与浓硫酸混合共热的反应过程中,受反应条件的影响,可发生两类不同的反应类型:1,4-二氧六环是一种常见的溶剂;它可以通过下列合成路线制得:错误!错误!错误!错误!错误!错误!其中的A可能是A.乙烯B.乙醇C.乙二醇D.乙酸例4肉桂酸甲酯M,常用作调制具有草莓、葡萄、樱桃等香味的食用香精;M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应;测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1;1肉桂酸甲酯的结构简式是;2G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示图中球与球之间连线表示单链或双键;G的结构简式为;3以芳香烃A为原料合成G的路线如下:①化合物E中的含氧官能团有________填名称;②E―→F的反应类型是__________,F―→G的化学方程式为_______________________;③写出符合下列条件的F的同分异构体的结构简式只写一种:____________________;ⅰ.分子内含苯环,且苯环上只有一个支链;ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;ⅲ.它不能发生水解反应;例5 食品添加剂必须严格按照食品安全国家标准GB2760-2011的规定使用;作为食品添加剂中的防腐剂G和W,可经下列反应路线得到部分反应条件略;1G的制备①A与苯酚在分子组成上相差一个CH2原子团,它们互称为__________;常温下A在水中的溶解度比苯酚的______填“大”或“小”;②经反应A→B和D→E保护的官能团是__________;③E→G的化学方程式为_____________________________________________________;2W的制备①J→L为加成反应,J的结构简式为__________________________________________;②M→Q的反应中,Q分子中形成了新的____________填“C—C键”或“C—H键”;③用Q的同分异构体Z制备,为避免R—OH+HO—R错误!R—O—R+H2O发生,则合理的制备途径为酯化、______、________填反应类型;④应用M→Q→T的原理,由T制备W的反应步骤为第1步_________________________________________________________________ ____;第2步:消去反应;第3步:_____________________________________________________________第1、3步用化学方程式表示例6 利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品的合成路线如下:提示:根据上述信息回答:1D不与NaHCO3溶液反应,D中官能团的名称是________,B→C的反应类型是________;2写出A生成B和E的化学反应方程式:______________________________________;3A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下,I和J分别生成和,鉴别I和J的试剂为________;500 ℃4A 的另一种同分异构体K 用于合成高分子材料,K 可由 制得,写出K 在浓硫酸作用下生成的聚合物的结构简式:________________________________;例7 狄尔斯-阿德耳Diels-Alder 反应也称双烯合成反应;试回答下列问题:1Diels-Alder 反应属于______反应填有机反应类型;2某实验室以 和 合成 ,请用合成反应的流程图,表示出最合理的合成方案注明反应条件;提示:①RCH 2CH====CH 2+Cl 2――――→RCHClCH====CH 2+HCl②合成过程中无机试剂任选;③合成反应流程图可表示为A 错误!B 错误!C ―→……―→H例8 据中国制药报道,化合物C 是用于合成抗“非典”药品盐酸袪炎痛的中间体,其合成路线为已知:1写出下列物质的结构简式B :__________________,C :__________________反应②产物HCl 中的H元素来自于氨基;2A →D 的转化中涉及的反应类型有________填字母序号;A .加成B .取代C .聚合D .氧化E .还原3反应①②中属于取代反应的是______填数字序号;4请你设计由甲苯→…→D 的反应流程图有机物用结构简式表示,必须注明反应条件;提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:甲苯错误!……错误!D有机合成中有机物官能团的引入、消除和转化方法练习答案例12氧化酯化或取代3保护酚羟基,防止被氧化例21①⑥⑦③⑤⑧消去例3A例4例5 1①同系物小②—OH或酚羟基例6 1醛基取代反应例7 1加成2如图所示:例8。
第77讲-官能团的引入、消除和保护课件

NO2
NO2
NH2
浓硫酸 浓硝酸 △
KMnO4 H+
Fe/HCl
CH3
CH3
COOH
【例】用对氨基苯甲醛合成对氨基苯甲酸 (酰基化保护)
COOH
CHO CH3COCl
CHO KMnO4
COOK H3O+
COOH
NH2
NHCOCH3
NHCOCH3
NH2
导向基在有机合成中的应用
4.保护基 (有机合成中常见官能团的保护) ③碳碳双键的保护: 【例】用CH2 =CHCHO为原料合成CH2 =CHCOOH
⑦某些烯烃、炔烃、芳香烃被酸性KMnO4溶液(或臭氧)氧化。
R1 CH
R2
KMnO4 H+
COOH
+ R1 C R2
CH
R
KMnO4 H+
R1 C
R2
O
RCOOH
一.官能团的引入
引入卤原子
引入羟基
引入碳碳双 键、碳碳叁键
引入碳氧双键、 醛基、羧基 引入高分子
①烃(光照)、苯环(FeX3催化)、酚的取代; ②不饱和烃与HX、X2的加成(马氏加成和反马氏加成); ③醇与氢卤酸(HX)的取代
引引入入卤卤原原子 子 引入羟基
①烃(光照)、苯环(FeX3催化)、酚的取代; ②不饱和烃与HX、X2的加成(马氏加成和反马氏加成); ③醇与氢卤酸(HX)的取代
①烯烃与水加成; ③卤代烃在碱性条件下水解;
②醛酮与氢气加成; ④酯的水解。
引入碳碳双 键、碳碳叁键
引入碳氧双键、 醛基、羧基
引入高分子
一.官能团的引入
4.保护基 (有机合成中常见官能团的保护)
有机物衍生关系及官能团的引入和消除

1、官能团的引入和转换: 、官能团的引入和转换:
(7)酯基的引入方法:①酯化反应的发生;②酯交换反 酯基的引入方法: 酯化反应的发生; 酯基的引入方法 应的发生。 应的发生。 (8)硝基的引入方法:硝化反应的发生。 硝基的引入方法: 硝基的引入方法 硝化反应的发生。 (9)氨基的引入方法:①-NO2的还原;②-CN的加氢 氨基的引入方法: 的还原; 氨基的引入方法 的加氢 还原; 蛋白质的水解。 还原;③肽、蛋白质的水解。 (10) 氰基的引入方法:①烯烃与HCN的加成;②炔烃 氰基的引入方法: 烯烃与 的加成; 的加成 的加成。 与HCN的加成。 的加成
有机合成题的常规解题方法
顺合成法: 顺合成法: 逆合成法: 逆合成法: 综合比较法: 综合比较法:
例题
以对二甲苯和乙醇为主要原料合成聚酯纤维
O HO C O C O CH2CH2O H n
例题
已知①溴单质通常与 起加成反应, 已知①溴单质通常与>C=C<起加成反应,但在高温下 起加成反应 溴易取代与>C=C<直接相连的碳原子上的氢原子②与 直接相连的碳原子上的氢原子② 溴易取代与 直接相连的碳原子上的氢原子 苯环直接相连的侧链碳原子上的氢原子在光照下也易被 溴取代
CH2 CH2 CH3 CH CH CH2 OH OH OH
例题
有机合成上通常通过下述两步反应在有机物分子碳 链上增加一个碳原子。 链上增加一个碳原子。
应用上述反应原理,试以乙炔,甲醇、HCN等物质 应用上述反应原理,试以乙炔,甲醇、 等物质 为主要原料, 为主要原料,通过六步反应合成
例题
已知: 已知:
CH 3 CH 2 CH 2 Br 消去→ CH 3 CH = CH 2 加成 → CH 3 C H CH 3 − HBr + HBr | Br
官能团的引入、转换和保护

Br C CH 1) EtMgBr 2) Me3SiCl Br C CSiMe3
1) Mg, THF 2) CO2
BrMgO2C
C CSiMe3
第二章官能团的引入转换和保护?饱和碳原子上官能团的引入?芳环上官能团的引入?烯烃的官能团化?炔烃的官能团化?羟基的转化?硝基与氨基的转化?羰基的转化?羧基的转化饱和碳原子上官能团的引入1饱和烃的卤代反应so2cl2so2clohhonohh?ohnoohnohnoclbartonreaction2烯丙位和苄位的卤代反应rnbroorbrnhoonbromosuccinimidenbsch31molnbsch2br芳环上官能团的引入rcoclalcl3hno3h2so4conh2so4x2fex3hclcoalcl3cu2cl2hchohclzncl2chono2xcorso3hch2clno2nh2n2xfenano2hxcu2x2hxxcu2cn2c
OHC NMe2
OH CHCl3/NaOH
OH
CHO
OH CF3CH(OH)OC2H5 NMe2 F 3C NMe2 NHR CF3CH=NR/BF3-Et2O NMe2 F 3C NMe2
烯烃的官能团化
HBr Br
1) B2H6 2) H2O2/NaOH OH H
RCO3H O
H2O/NaOH OH OH
ArF
ArI
ArCN
羰基的转化 羰基的还原反应
RCOR'
LiAlH4 NaBH4 RR'CHOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羟基的保护基
• 最常用的醋酸酯保护基一般在温和 的 碱 性 条 件 下 就 可 以 除 去,常 用 的 碱 为 K2CO3、 NH3、 肼、 guanidine、 KCN、 Et3N 或 iPr2NEt 等。 在 水 或 醇 的 体 系 中 ,醋酸酯在酸催化下也能发生水解 或 酯 交 换 除 去, 但 在 无 质 子 性 物 质 参 与 时, 醋 酸 酯 一 般 是 比 较 稳 定 的。
官能团保护工作,转换和引入
羟基的保护基
• 酯类保护基 • 酯 类 保 护 基 的 生 成 (Formation):酯 类
保护基生成方法一般由醇和相应的 酸 酐、 酰 氯 在 吡 啶 或 三 乙 胺 存 在 下, 0-20oC 下 反 应 获 得。 如 果 反 应 过 慢, 可 加 入 催 化 量 4-dimethylaminopyridine (DMA可 以 用 含 氟 试 剂 除 去, 如
通 等
常
用
的
HF/CH3CN、TBAF/THF、HF-Py/CH3CN
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
•生成反应:通常在二氯甲烷或DMF中,使 用R3SiCl or R3SiOTf为试剂,在三乙胺、吡啶 或咪唑等弱碱存在下生成硅醚保护基。 •TES 可 以 用 来 保 护 - 羟 基 醛、 酮 和 酯, 而 不 会 发 生 消 除 反 应。
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
• 硅、tBu醚tPBhu2保MSie护(2TSBi基D(TPB主SDoM要r BSP有oSr):T等BMS。)e、3SiiP(Tr3MSiS()T、IPSE)t、3Si (TES) • 对 酸 水 解 的 相 对 稳 定 次 序 为: TMS (1) < TES
官能团保护工作,转换和引入
羟基的保护基
• 在 多 羟 基 底 物 上, tBuCOCl 可 以 选 择 性 地 保 护 伯 羟 基:
官能团保护工作,转换和引入
羟基的保护基
• 一 般 情 况 下, 酯 类 保 护 基 均 在 碱 性 条 件 下 除 去。 但 各 种 酰 基 的 水 解 敏 感 性 也 不 同, 特 别 是 Me3CCOO 由 于 立 体 位 阻 大, 反 应 很 慢, 在 它 存 在 下 可 以 选 择 性 除 去 醋 酸 酯 保 护; 相 反, CF3COO 在 pH 7 时 就 能 水 解。 这 些 保 护 基 的 水 解 能 力 次 序 大 致 为:tBuCO < PhCO < MeCO < ClCH2CO ......。
官能团保护工作,转换和引 入
官能团的保护,转换 与引入
官能团保护工作,转换和引入
• 引言
官能团的保护
• 羟基的保护基团
• 醛酮的保护基团
• 氨基的保护基团
官能团保护工作,转换和引入
为什么使用保护基
• 有机合成中,合成目标物的直 接 的 办 法 是 采 用 选 择 性 的 反 应 条 件 和 试 剂。
官能团保护工作,转换和引入
羟基的保护基
• 位 阻 较 大 的 Piv 需 要 较 强 的 碱 性 体 系 , 例 如 KOH/MeOH 除 去; 这 种 条 件 下 , TBDMS 醚 是 不 能 承 受 的。
• 除 去 Piv 的 另 一 种 办 法 是 用 金 属 氢 化 物 还 原, 例 LiAlH4、 DIBAL37 或 KBHEt3 等 。
(64) < TBDMS (20,000) < TIPS (700,000) < TBDPS (5,000,000)。
• 对 碱 的 相 对 稳 定 性 次 序 为:TMS (1) < TES
(10~100) < TBDMS = TBDPS (20,000) < TIPS (100,000) 。
• 由 于 F-Si (142 kcal/mol) > O-Si (112 kcal/mol), 因
• 始于Fischer的碳官水能团保化护工合作,转物换和引合入 成;在实验室化
保 护 基 团 的 选择 和互 不 相 干 性 原 则
• 保护试剂易得 • 保护和去保护条件温和,效率要高。 • 当合成过程中存在多种保护基的选
择 性 脱 除 时, 预 先 作 一 周 密 的 考 虑 是 必 需 的, 最 理 想 的 情 形 是 多个 保 护 基 团 之间 符 合 互 不 相 干 性 原 则, 即 其中一个保护基的脱除不影响另外 的 保 护 基(选择性脱除)。
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
• TES 的 水 解 稳 定 性 较 TMS 好 10 到 100 倍 左 右, 但 比 TBDMS 差。 它 对 Grignard 反 应、 Swern 氧 化、 WittigHorner 反 应、 Sulfone LDA 金 属 化、DDQ/CH2Cl2 和 DessMartin 氧 化 都 是 稳 定 的。 一 般 可 以 用 2% HF/Py-THF 、 H2O-HOAc-THF (3:5:11) 等 条 件 除 去。 Merck 公 司 在 FK-506 的 合 成 中 用 下 列 条 件 除 去 TES 而 保 留 其 它 硅 醚不动
• 在 复 杂 分 子 合 成 中, 许 多 情 况 下 尚 未发展出 这 样 的 直 接 条 件, 或 选 择 性 不 好, 于 是 必 须 采 用 另 外 的 办 法, 将 易于发 生 反 应 的 官能团 保 护 起 来 成 为 衍 生 物 形 式, 待 达 到 目 的 后 再将之 恢 复 , 这 样 的 办 法 称 为 “保 护 基 团”(Protecting Groups) 法。
官能团保护工作,转换和引入
羟基的保护基
• 作为保护基的酰基的-位有吸电子 因 素 的 话, 酯 水 解 的 速 度 将 会 大 大 加 快。 如 - 甲 氧 基 醋 酸 酯 比 醋 酸 酯 水 解 快 20 倍; - 苯 氧 基 醋 酸 酯 则 要 快 50 倍; - 卤 代 之 后 水 解 速 度 更 快。 - 氯 代 醋 酸 酯 可 以 用 硫 脲、 NH3/MeOH or benzene、 吡 啶 水 溶 液、 H2NCH2CH2SH、 H2NCH2CH2NH238、 PhHNCH2CH2NH2 等 除 去。
