官能团的引入与消去
有机合成中有机物官能团的引入消除和转化方法

有机合成中有机物官能团的引入消除和转化方法Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1)通过加成反应消除不饱和键。
(2)通过消去反应、氧化反应或酯化反应消除羟基(—OH)。
(3)通过加成反应或氧化反应消除醛基(—CHO)。
(4)通过消去反应或水解反应消除卤素原子。
3.官能团的转化 (1)利用衍变关系引入官能团,如卤代烃水解取代伯醇(RCH 2OH)氧化还原醛――→氧化羧酸。
(2)通过不同的反应途径增加官能团的个数,如(3)通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1)有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2)成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1)与HCN 的加成反应(2)加聚或缩聚反应,如n CH 2(3)酯化反应,如CH 3CH 2OH +CH 3COOH 浓 CH 3COOCH 2CH 3+H 2O 。
3.碳链的减短(1)脱羧反应:R —COONa +NaOH ――→CaO△R —H +Na 2CO 3。
(3)水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4)烃的裂化或裂解反应:C 16H 34――→高温C 8H 18+C 8H 16; C 8H 18――→高温C 4H 10+C 4H 8。
合成路线的选择1.中学常见的有机合成路线(2)一元合成路线R —CH=CH 2――→HX 卤代烃――→NaOH 水溶液△一元醇――→氧化一元醛――→氧化一元羧酸―→酯(3)二元合成路线CH 2=CH 2――→X 2CH 2X-CH 2X ――→NaOH 水溶液△二元醇――→氧化二元醛――→氧化二元羧酸→⎩⎪⎨⎪⎧ 链酯环酯高聚酯(3)芳香化合物合成路线:2.有机合成中常见官能团的保护(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH 反应,把—OH 变为—ONa(或—OCH 3)将其保护起来,待氧化后再酸化将其转变为—OH 。
有机合成——官能团的引入转化消除及保护课件高二化学人教版选择性必修3

氧化
CH3-CHO
CH3-COOH
五、官能团的转化(种类、数目和位置的变化)
2、官能团数目变化
原创:WJ化学研究院
CH3CH2-OH 消去
CH2=CH2
加Br2
水解 CH2Br-CH2Br
HO-CH2CH2-OH
3、官能团位置变化
消去
CH3CH2CH2-Br
CH3CH=CH2
加HBr CH3CH-CH3 Br
卤素原子 烯烃(炔烃)的加成 烷烃(苯及苯的同系物)的取代 醇(酚)的取代
羟基 烯烃与水的加成 酯的水解 卤代烃的水解 醛、酮的加氢
醛基 炔烃水化 烯烃氧化 伯醇的催化氧化 糖类水解
羧基 烯炔烃、苯的同系物、醛、醇的氧化 酯、酰胺、R-CN的水解
酯基
酯化反应、酰氯醇解
八、练习
原创:WJ化学研究院
1.由苯酚制取
①醇的催化氧化引入碳氧双键
2RCH2OH+O2
催化剂 △
2RCHO+2H2O
2RCH(OH)R'+O2 催化△ 剂2R—C—R+2H2O
O
②某些烯烃被氧化
2CH2=CH2+O2 一定条件 2CH3CHO
①O3
②Zn/H2O OHCCH2CH2CH2CH2CHO
三、引入官能团--碳氧双键
2、引入碳氧双键
4、醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,保护一般是把 醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛 也可以先生成醇,然后再氧化恢复
四、官能团的保护--氨基的保护
5、氨基(-NH2)的保护
胺基易被O2、O3、H2O2等氧化,一般采用下列方法保护
有机合成官能团的引入碳链改变

O
+
H2O
CH2 OH CH2 OH
+
HOCH2 HO CH2
O CH 2COH CH 2COH O
O COH COH O
+
HOCH 2 HOCH2
O HO CH C CH3
O H2N CH2 C OH
O
OH
HO
CH2CH2CH2 C
OH
3、其他的信息类型
一、通常由产物逆推到所给原料,采取键的“切割”法。
R H
+
+
催化剂 4 CH3COOH 5 O2 加热加压
COOH
+
2 H2O
KMnO 4
3、水解反应: (酯、蛋白质、多糖等) 4、裂化反应: C4H10→CH4 + C3H6
三、有机成环反应规律——五元、六元环比较稳定
1、低聚反应
3 CH CH C 500 0
O 3 HCH
O 3 RCH
2、分子内(间)脱水——羧酸、醇、酯化、生成酰胺键
1、由溴乙烷合成1,2-二溴乙烷(无机试剂任选) 2、从乙烯合成乙醚 3、以CH2=CH2和H—18OH为原料,并自选必要有机试 剂,合成CH3CO18OC2H5,用化学方程式表示最合理的 反应步骤。 4、以 对—二甲苯、乙烯、食盐、氧化剂、水为原料合 O O 成涤纶树脂
C C OCH 2CH2O n
二、信息给予合成题。 (认真审题、使已有知识与给予知识有机结合)
1、以乙烯为初始原料制取正丁醇(CH3CH2CH2CH2OH)。已知:
O RCH 2 C H H OH CHO RCH 2 CH H C R CHO
有机合成 官能团引入转换和保护

3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃 基化,酰基化以及与醛酮羰基的亲核加成反 应。在合成中常采用: (1)氨基质子化 (2)变为酰基衍生物 (3)变为烃基衍生物等方法将氨基保护起 来
3.1
质子化
此方法仅用于防止氨基的氧化,因为理论上说 采用氨基质子化,即占据氮尚未共用电子对,以阻 止取代反应的发生。这是对氨基保护最简单的法。
COCl COOH (C H 3)2C C O O C (C H 3)3 C H 2 ,H 2 S O 4
CH3 加热
S O 3H COOH
叔丁酯可由羧酸先变为酰氯,再与叔丁醇作 用,或者通过羧酸与异丁烯直接作用而得。 它不能氢解,在通常条件下也不被氨解及碱 催化水解.
5.羧基的保护
KOH COOH COOK C H 2C l
4.羰基的保护
羰基具有许多反应性能,是有机化学中 最易发生反应的活性官能团之一. 保护羰基常用的方法:生成缩醛和缩酮 来降低羰基活性而保护羰基.
4.羰基的保护
保护醛酮羰基最常用的方法是通过乙 二醇和2-疏基乙醇的反应,生成相应 的叫做环缩醛或缩酮的产物.
H O C H 2 C H 2 O H ,T sO H
优点:对碱及催化氢化是稳定的。
缺点:对酸敏感,其稳定性低于甲醚。由 于脱保护基所用的酸性条件剧烈,当分子 中存在对酸敏感的基团时不适用
2.1
• 三甲硅醚
转变成醚
三甲硅醚广泛用于保护糖类、甾类及其他醇 羟基。通常引入三甲基硅基保护基所用的试 剂有三甲基氯化硅和碱;六甲基二硅氨烷。 在含水醇溶液中加热回流即可除去保护基。 优点:醇的三甲硅醚对催化氢化、氧化还 原反应是稳定的,该保护基可在非常温和 的条件下引入和去除。 缺点:对酸和碱敏感,只能在中性条件下 使用。
官能团的衍变规律[1]
![官能团的衍变规律[1]](https://img.taocdn.com/s3/m/157f903ff46527d3240ce0db.png)
官能团的衍变规律1. 官能团的引入和转换(1)C=C的形成:①一元卤代烃在强碱的醇溶液中消去HX②醇在浓硫酸存在的条件下消去H2O③二元卤代烃在锌粉存在的条件下消去X2④烷烃的热裂解和催化裂化(2)C≡C的形成:①二元卤代烃在强碱的醇溶液中消去2分子的HX②一元卤代烯烃在强碱的醇溶液中消去HX③实验室制备乙炔原理的应用(3)卤素原子的引入方法:①烷烃的卤代(主要应用与甲烷)②α-H的卤代(红磷做催化剂)*③烯烃、炔烃的加成(HX、X2)④芳香烃与X2的加成⑤芳香烃苯环上的卤代⑥芳香烃侧链上的卤代⑦醇与HX的取代⑧烯烃与HO-Cl的加成例、已知次氯酸能跟烯烃发生加成反应:RCH=CH2+HOCl R CH2Cl(或R CH2OH)试回答下列问题:(1)写出结构简式A ,C ;(2)从结构上分析,可与A互为同分异构体的结构简式有:、。
(3)上述反应中属于加成反应的是、属于消去反应的是(填反应序号)。
(4)写出反应④的化学方程式:________________ 。
(4)羟基的引入方法:①烯烃与水加成②卤代烃的碱性水解③醛的加氢还原④酮的加氢还原⑤酯的酸性或碱性水解⑥苯氧离子与酸反应⑦烯烃与HO-Cl的加成(5)醛基或羰基的引入方法:①烯烃的催化氧化②烯烃的臭氧氧化分解③炔烃与水的加成④醇的催化氧化(6)羧基的引入方法:①丁烷的催化氧化②苯的同系物被酸性高锰酸钾溶液氧化③醛的催化氧化④酯的水解⑤-CN的酸性水解⑥肽、蛋白质的水解⑦酰氨的水解(7)酯基的引入方法:①酯化反应的发生②酯交换反应的发生(8)硝基的引入方法:硝化反应的发生(9)氰基的引入方法:①烯烃与HCN的加成②炔烃与HCN的加成③卤代烃与CN-的取代(10)氨基的引入方法:①-NO2的还原②-CN的加氢还原③肽、蛋白质的水解例1.(2004广东)根据下面的反应路线及所给信息填空。
(1)A 的结构简式是 ,名称是 。
(2)①的反应类型是 。
第3章 官能团的导入、除去、互换及保护

§3.1 官能团的导入
3.1.1 饱和碳原子上官能团的导入
1. 饱和烃的卤代反应 氢原子的活性为:叔氢>仲氢>伯氢;卤素活性为: F2>Cl2>Br2>I2, 卤素活性越大,其选择性越差。因此,在饱和烃卤代 反应中溴代反应最为常见。
Br2 / hv r,t.~105℃ Br
+
20℃ C6H5SO2NCl
CH3 CH3 Cl Cl
+
C6H5SO2NH
3. 羰基化合物的α-卤代反应
O C C H H
+
OH C C H
-H+ slow X X C
OH C
fast
-X
-
OH C C X
-H
+
O C C X
fast
fast
O C H C
+ OH
O -H2O slow X X O C X C C C C
Hofmann eliminations
Anti elimination
2. Pyrolytic syn eliminations(顺式热消去反应)
C H O
C O
300 ~ 500 C
o
C
C
+
RCO2 H
R
Applications: Synthesis of terminal alkenes from primary acetates
O C
-X fast
-
① 醛的α-卤代反应
R' R CH CHO R' R' C H O Si(CH3)3 X2 X=Cl, Br R C CHO X
消去反应_精品文档

消去反应引言消去反应是化学中一种重要的反应类型,它在有机合成、药物研发、材料科学等领域中都具有广泛的应用。
消去反应是指通过引入一个消去试剂,将分子中的某个官能团移除,从而引发分子结构的改变。
本文将对消去反应的概念、机理以及一些典型的消去反应进行介绍。
概念消去反应是一种化学反应,通常是有机化学反应中的一个步骤。
在消去反应中,一个官能团被移除,从而形成一个新的分子。
这个官能团可以是酸、碱、水或其他的试剂。
消去反应通常以可能形成活化复合物的官能团为基础,通过引入消去试剂将其移除,从而实现化学反应。
消去反应有很多不同的类型,包括酸性消去反应、碱性消去反应、脱水消去反应等。
每一种类型的消去反应都有其特定的条件和机理。
机理在酸性消去反应中,通常通过加入酸性试剂来引发反应。
这些酸性试剂可以是强酸,如硫酸,也可以是弱酸,如醋酸。
酸性消去反应的机理可以分为两个步骤。
首先是亲电性攻击,消去试剂通过亲电性攻击官能团上的电子,从而形成一个中间体。
然后,在中间体的存在下,通过负电离、负荷转移或负电子迁移等方式,得到最终产物。
碱性消去反应和酸性消去反应类似,不同之处在于消去试剂是碱性试剂,如氢氧化钠或碳酸钾。
碱性消去反应的机理也涉及亲电性攻击、负电离等步骤。
脱水消去反应是一种通过去除水分子来引发的反应。
在这种反应中,通常使用脱水剂(如磷酸或三氯化磷)来促进反应。
脱水消去反应的机理涉及亲电性攻击和负离子迁移等步骤。
典型消去反应酸性消去反应一种著名的酸性消去反应是酸性酯加成消去反应。
在这个反应中,酯与酸反应,生成羧酸和醇。
例如,醋酸与硫酸反应,生成乙酸和水。
CH3COOH + H2SO4 -> CH3COOH + H2O碱性消去反应一种常见的碱性消去反应是醇的酸性消去反应。
在这个反应中,醇与碱性试剂反应,生成烯醇。
ROH + NaOH -> R-O-Na+ + H2O脱水消去反应脱水消去反应有很多种,其中一种是醇的脱水消去反应。
有机合成中有机物官能团的引入、消除和转化方法.

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1通过加成反应消除不饱和键。
(2通过消去反应、氧化反应或酯化反应消除羟基(—OH。
(3通过加成反应或氧化反应消除醛基(—CHO。
(4通过消去反应或水解反应消除卤素原子。
3.官能团的转化(1利用衍变关系引入官能团,如卤代烃伯醇(RCH2OH醛羧酸。
(2通过不同的反应途径增加官能团的个数,如(3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1与HCN的加成反应(2加聚或缩聚反应,如n CH2(3酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O。
3.碳链的减短(1脱羧反应:R—COONa+NaOHR—H+Na2CO3。
(3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4烃的裂化或裂解反应:C16H34C8H18+C8H16;C8H18C4H10+C4H8。
合成路线的选择1.中学常见的有机合成路线(1一元合成路线:卤代烃一元醇―→一元醛―→一元羧酸―→酯(2二元合成路线:二元醇―→二元醛―→二元羧酸―→(3芳香化合物合成路线:2.有机合成中常见官能团的保护(1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH 变为—ONa(或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH。
(2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3氨基(—NH2的保护:如在对硝基甲苯对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。
合成任务二官能团的引入消除转化和保护+高二下学期化学人教版(2019)选择性必修3

(3)炔烃与H2、HX、X2的不完全加成(限制物质的量)
(一)官能团的引入
2.引入碳卤键 (1)烃与卤素单质的取代反应
+Br2 催化剂
—Br+HBr
(一)官能团的引入
2.引入碳卤键
(2)不饱和烃与卤素单质、卤化氢等的加成反应
CH2=CH—CH3+HBr
CH3—CHBr—CH3
(2)某些烯烃的氧化
(一)官能团的引入
5.引入羧基
(1)醛的氧化反应
催化剂 △
CH3CHO+2Cu(OH)2+NaOH △
H+
CH3COONa
CH3COOH
CH3COONa+Cu2O↓+3H2O
(2)酯、酰胺的水解反应
稀硫酸
CH3COOC2H5+H2O △ CH3COOH+C2H5OH
(一)官能团的引入
HOCH 2COONa + HCl ==HOCH2COOH+NaCl,故反应类型:氧化——氧化——取代——水解。
达标检测
3.以HOCH2-CH=CH-CH2OH为原料合成HOOC-CH=CH-COOH 的路线为:
HOCH2-CH=CH-CH2OH
HOCH2-CHCl-CH2-CH2OH
HOOC-CH=CH-COOH
COOH
COOH
KMnO4/H+
Fe/H+ 还原
NO2
NH2
达标检测
1.有机合成的关键是构建官能团和碳骨架,下列反应不能引
D 入—OH的是(
)
A.醛还原反应
B.酯类水解反应
C.卤代烃水解
D.烷烃取代反应
达标检测
2.由石油裂解产物乙烯制取HOCH2COOH,需要经历的反应类 型有( )
第77讲-官能团的引入、消除和保护课件

NO2
NO2
NH2
浓硫酸 浓硝酸 △
KMnO4 H+
Fe/HCl
CH3
CH3
COOH
【例】用对氨基苯甲醛合成对氨基苯甲酸 (酰基化保护)
COOH
CHO CH3COCl
CHO KMnO4
COOK H3O+
COOH
NH2
NHCOCH3
NHCOCH3
NH2
导向基在有机合成中的应用
4.保护基 (有机合成中常见官能团的保护) ③碳碳双键的保护: 【例】用CH2 =CHCHO为原料合成CH2 =CHCOOH
⑦某些烯烃、炔烃、芳香烃被酸性KMnO4溶液(或臭氧)氧化。
R1 CH
R2
KMnO4 H+
COOH
+ R1 C R2
CH
R
KMnO4 H+
R1 C
R2
O
RCOOH
一.官能团的引入
引入卤原子
引入羟基
引入碳碳双 键、碳碳叁键
引入碳氧双键、 醛基、羧基 引入高分子
①烃(光照)、苯环(FeX3催化)、酚的取代; ②不饱和烃与HX、X2的加成(马氏加成和反马氏加成); ③醇与氢卤酸(HX)的取代
引引入入卤卤原原子 子 引入羟基
①烃(光照)、苯环(FeX3催化)、酚的取代; ②不饱和烃与HX、X2的加成(马氏加成和反马氏加成); ③醇与氢卤酸(HX)的取代
①烯烃与水加成; ③卤代烃在碱性条件下水解;
②醛酮与氢气加成; ④酯的水解。
引入碳碳双 键、碳碳叁键
引入碳氧双键、 醛基、羧基
引入高分子
一.官能团的引入
4.保护基 (有机合成中常见官能团的保护)
有机物衍生关系及官能团的引入和消除

1、官能团的引入和转换: 、官能团的引入和转换:
(7)酯基的引入方法:①酯化反应的发生;②酯交换反 酯基的引入方法: 酯化反应的发生; 酯基的引入方法 应的发生。 应的发生。 (8)硝基的引入方法:硝化反应的发生。 硝基的引入方法: 硝基的引入方法 硝化反应的发生。 (9)氨基的引入方法:①-NO2的还原;②-CN的加氢 氨基的引入方法: 的还原; 氨基的引入方法 的加氢 还原; 蛋白质的水解。 还原;③肽、蛋白质的水解。 (10) 氰基的引入方法:①烯烃与HCN的加成;②炔烃 氰基的引入方法: 烯烃与 的加成; 的加成 的加成。 与HCN的加成。 的加成
有机合成题的常规解题方法
顺合成法: 顺合成法: 逆合成法: 逆合成法: 综合比较法: 综合比较法:
例题
以对二甲苯和乙醇为主要原料合成聚酯纤维
O HO C O C O CH2CH2O H n
例题
已知①溴单质通常与 起加成反应, 已知①溴单质通常与>C=C<起加成反应,但在高温下 起加成反应 溴易取代与>C=C<直接相连的碳原子上的氢原子②与 直接相连的碳原子上的氢原子② 溴易取代与 直接相连的碳原子上的氢原子 苯环直接相连的侧链碳原子上的氢原子在光照下也易被 溴取代
CH2 CH2 CH3 CH CH CH2 OH OH OH
例题
有机合成上通常通过下述两步反应在有机物分子碳 链上增加一个碳原子。 链上增加一个碳原子。
应用上述反应原理,试以乙炔,甲醇、HCN等物质 应用上述反应原理,试以乙炔,甲醇、 等物质 为主要原料, 为主要原料,通过六步反应合成
例题
已知: 已知:
CH 3 CH 2 CH 2 Br 消去→ CH 3 CH = CH 2 加成 → CH 3 C H CH 3 − HBr + HBr | Br
高考化学专题复习—官能团的引入与消除

高考化学专题复习—官能团的引入与消除1、下列说法正确的是( )A.光照条件下,氯气与乙烷发生化学反应,生成的产物有6种B.甲烷中的乙烯可用酸性高锰酸钾溶液来除去C.只用水就可以鉴别四氯化碳、苯和乙醇D.制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得2、下列有关溴乙烷的说法正确的是( )A.溴乙烷可由乙烯与溴发生加成反应制得B.用溴乙烷制取乙二醇经过以下几步:消去→加成→水解C.溴乙烷与KOH 醇溶液反应:D.向溴乙烷中滴入AgNO 3溶液检验其中的溴元素:Br¯ + Ag + = AgBr↓ 3、已知酸性:苯甲酸>碳酸>苯酚,现将转变为 的方法为( )A.与稀H 2SO 4共热后,加入足量的Na 2CO 3B.加入足量的NaOH 溶液,再通入足量的HClC.与足量NaOH 的溶液共热后,再通入CO 2D.与稀H 2SO 4共热后,加入足量的NaOH4、以下有机反应类型:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥还原反应,其中可能在有机分子中新产生羟基的反应类型是( )A. ①②③B. ①④⑥C. ①②⑥D. ② ④⑤5、下列反应中,不可能在有机物中引入羧基的是( )A. 卤代烃的水解B. 脂类在酸性条件下水解C. 醛的氧化D. 烯烃的氧化32225r KOH CH CH Br H O C H OH KB ∆+−−−→+6、重氮甲烷(CH2N2)与酸性物质反应:RCOOH+CH2N2→RCOOCH3+N2,下列物质中能与重氮甲烷反应但产物不是酯的是( )A.HCHOB.C6H5OHC. C6H5CH2OHD. C6H5COOH7、化合物分子中能引进卤原子的反应是()A. 消去反应B. 酯化反应C. 水解反应D. 取代反应8、有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是()a转化为b a转化为c c转化为bA NaOH Na CO2B Na2CO3NaOH HClC NaHCO3NaOH CO2D NaHCO3Na2CO3HClA. AB. BC. CD. D9、在有机合成中官能团的引入与转化都极为重要,下列说法正确的是( )A.甲苯在光照条件下与Cl2反应时,主反应为苯环上引入氯原子B.引入羧基的方法有醛的氧化反应和酯的水解反应C.CH2=CH-CHO与酸性KMnO4溶液反应可转化为CH2=CH-COOHD.乙醇在浓硫酸作用下加热到140o C生成乙烯10、有下述有机反应类型:①消去反应,①水解反应,①加聚反应,①加成反应,①还原反应,①氧化反应。
高中引入常见官能团的方法总结
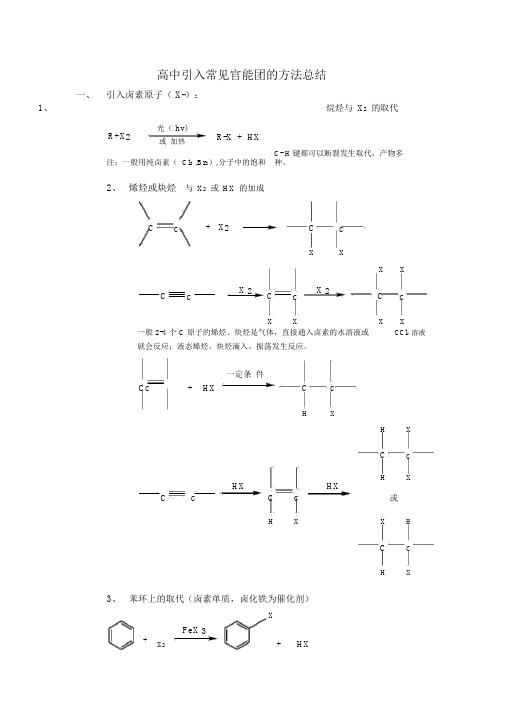
高中引入常见官能团的方法总结一、引入卤素原子( X-):1、烷烃与X2的取代R+X2光( hv)R-X + HX 或加热注:一般用纯卤素( Cl2,Br2),分子中的饱和C- H键都可以断裂发生取代,产物多种。
2、烯烃或炔烃与X2或HX的加成C C+ X2C CX XX XC C X 2C CX 2C CX X X X一般 2-4 个 C 原子的烯烃、炔烃是气体,直接通入卤素的水溶液或就会反应;液态烯烃、炔烃滴入、振荡发生反应。
CCl4溶液C C+一定条件HX C CH XH XC CHXH XCHXC C C或H X X HC CH X3、苯环上的取代(卤素单质,卤化铁为催化剂)XFeX 3+X2+HX一般,苯环上H 原子被卤素原子取代,需要对应的Fe3+盐做催化剂。
4、醇的取代(浓的氢卤酸,加热)△R-OH + HX R-X +H 2O5、酚与浓溴水的取代OH OHBr Br+ 3Br 2+3HBr(白)Br反应位置:酚羟基的邻位和对位。
6、苯的同系物的取代(不同条件取代不同位置)hvCH 2CH 3FeX 3二、引入碳碳双键:1、炔烃的不完全加成C C+ H 2NiC C △2、卤代烃的消去(强碱的醇溶液、加热)C C+ NaOH 醇C C +NaX + H2O △H X记住:邻碳有H,才能消去。
3、醇的消去(浓硫酸,加热)浓 H2SO4C C C C+ H2O△H OH注意:只有乙醇消去才是170℃同样:邻碳有H,才能消去。
4.新信息:羟醛缩合反应三、引入醇羟基:1、烯烃与水加成H2C CH2+ H2O一定条件CH CH OH322、卤代烃的水解(强碱水溶液,加热)C+NaOH H 2OC OH+ NaX △X 3、酯的水解4、醛或酮的还原+NiRCH 2OHR-CHO H 2△RCOR'+H 2Ni H △RC R'OH四、引入酚羟基:Br ONa高温高压+ 2NaOH+ NaBr +H 2OONa OH+ H ++Na+五.引入醛基O2CH 2OH + O2CuC H+2H2O2△六.引入羧基:1、醛的氧化①2R RCHO + O2催化剂2 RCOOH△KMnO 4(H + )CHO RCOOH②银镜反应R-CHO + 2Ag(NH 3)2OH 水浴RCOONH 4+H 2O + 2Ag+3NH3注意:最后加酸酸化③与新制 Cu(OH)2反应R-CHO +2Cu(OH) 2 + NaOH △RCOONa + Cu2O + 3H2O注意:最后加酸酸化2.醇的连续氧化(测酒驾原理)KMnO4 (H +)RCOOHR CH 2OHor K 2Cr 2O 7 (H+)3.苯的同系物与酸性高锰酸钾溶液反应R COOHKMnO 4 (H+)4.酯的水解(酸性条件 / 碱性条件水解后酸化)H +RCOOH + R'OHRCO OR'H+-OHRCOO -+ R'OH5.碳碳双键的氧化CH2CO 2KMnO 4 (H+ )CHCOOHC CO七.引入酯基RCOOH+ HO-R'浓 H 2SO4RCO OR' + H 2O △八.增长碳链R-X + NaCN R-CN H+R-COOHR+R-Xn C C C Cn 九.成环反应+。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
官能团的引入与消去
一.有机合成中官能团的引入方法
(1)引入C─C :C═C 或C≡C 与H 2加成;
(2)引入C═C 或C≡C :卤代烃或醇的消去;
(3)苯环上引入
(4)引入─X :①在饱和碳原子上与X 2(光照)取代;②不饱和碳原子上与X 2或HX 加成;③醇羟基与HX 取代。
(5)引入─OH :①卤代烃水解;②醛或酮加氢还原;③C═C 与H 2O 加成。
(6)引入─CHO 或酮:①醇的催化氧化;②C≡C 与H 2O 加成。
(7)引入─COOH :①醛基氧化;②─CN 水化;③羧酸酯水解。
(8)引入─COOR :①醇酯由醇与羧酸酯化;②酚酯由酚与羧酸酐取代。
(9)引入高分子:①含C═C 的单体加聚;②酚与醛缩聚、二元羧酸与二元醇(或羟基酸)酯化缩聚、二元羧酸与二元胺(或氨基酸)酰胺化缩聚
二.有机合成中官能团的消除方法
(1)通过加成反应可以消除C =C 或C≡C 。
如CH 2=CH 2 + H 2
CH 3CH 3 (2)通过消去、氧化可消除-OH 。
如CH 3CH 2
OH CH 2=CH 2↑ + H 2O 、2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O
(3)通过加成或氧化可消除-CHO 。
如2CH 3CHO + O 2
2CH 3COOH 、CH 3CHO + H 2 CH 3CH 2OH
(4)通过水解反应消除—COO —。
如CH 3COOC 2H 5 + H 2O → CH 3COOH + C 2H 5OH 。
浓硫酸 170℃
三.有机合成中官能团位置和数目
1.官能团数目的改变:如(1)CH3CH2OH CH2=CH2X-CH2CH2-X HO-CH2CH2-OH 。
(2)。
2.官能团位置的改变:如(1)CH3CH2CH2Cl
CH3CH=CH2CH3CHClCH3
(2)CH3CH2CH2OH CH3CH=CH2
CH3CHClCH3CH3CH(OH)CH3。
