ELISA(酶联免疫吸附测定)实验报告
酶联免疫吸附测定实验报告

酶联免疫吸附测定实验报告酶联免疫吸附测定实验报告酶联免疫吸附测定(Enzyme-Linked Immunosorbent Assay, ELISA)是一种常用的实验技术,用于检测和定量分析生物样本中特定分子的存在。
本实验旨在通过ELISA技术,对特定抗原在样本中的含量进行测定,并了解其原理及应用。
一、实验原理ELISA技术是一种基于免疫反应的实验方法,其原理主要包括固相吸附、特异性结合、酶标记和显色反应。
首先,在微孔板中固定特异性抗体,形成固相吸附。
然后,加入待测样本,样本中的目标抗原与固相抗体结合。
接着,加入酶标记的二抗与目标抗原结合,形成特异性结合。
最后,通过添加显色底物,酶催化反应产生可见的颜色变化,从而定量分析目标抗原的含量。
二、实验步骤1. 准备样本和试剂:收集待测样本,如血清、尿液或细胞培养上清液,并准备好ELISA试剂盒中的各种试剂。
2. 板洗涤:将微孔板放入洗板机中,加入洗板缓冲液,进行洗涤步骤,以去除未结合的物质。
3. 固相吸附:将特异性抗体加入微孔板孔中,孵育一段时间,使其与固相吸附。
4. 样本孵育:将待测样本加入各孔中,与固相抗体结合,在恒温条件下孵育。
5. 二抗结合:加入酶标记的二抗,与目标抗原结合形成特异性结合。
6. 洗涤:再次进行洗板步骤,去除未结合的物质。
7. 底物反应:加入显色底物,酶催化反应产生可见的颜色变化。
8. 反应终止:加入终止液,停止酶催化反应。
9. 测定吸光度:使用酶标仪测定各孔的吸光度值。
10. 数据分析:根据吸光度值,绘制标准曲线,通过比较待测样本的吸光度值,计算出目标抗原的浓度。
三、实验结果通过ELISA实验,我们成功测定了待测样本中目标抗原的含量。
根据标准曲线,我们计算出了各样本中目标抗原的浓度。
这些结果将有助于我们了解样本中特定分子的水平,从而进一步研究其生物学功能和相关疾病的发生机制。
四、实验应用ELISA技术具有广泛的应用领域,包括生物医学研究、临床诊断、药物开发等。
酶联免疫吸附试验实验报告

酶联免疫吸附试验实验报告一、实验目的。
本实验旨在通过酶联免疫吸附试验(ELISA)检测目标蛋白或抗原的存在与浓度,以及对特定抗体的识别和结合情况。
通过本实验,我们可以了解到酶联免疫吸附试验的原理和操作步骤,以及在生物医学研究和临床诊断中的应用。
二、实验原理。
酶联免疫吸附试验是一种利用酶和抗体的特异性结合来检测抗原或抗体的方法。
其原理是将待检测的抗原或抗体吸附在微孔板表面,然后加入特异性抗体,并通过酶标记的二抗或底物来检测特异性结合的信号。
当待测物与特异性抗体结合后,通过底物的酶反应产生可定量的颜色反应,从而测定待测物的浓度。
三、实验材料和方法。
1. 实验材料,微孔板、待测抗原或抗体、特异性抗体、酶标记的二抗、底物溶液等。
2. 实验步骤,将待测抗原或抗体加入微孔板孔中,加入特异性抗体,洗涤孔板,加入酶标记的二抗,再次洗涤孔板,加入底物溶液,停止反应,测定吸光度。
四、实验结果。
通过本次实验,我们成功检测出待测物的存在与浓度,并观察到特异性抗体与待测物的结合情况。
根据实验结果,我们可以得出待测物的浓度,并进一步分析其在生物学过程中的作用和意义。
五、实验结论。
酶联免疫吸附试验是一种高度敏感和特异性的实验方法,广泛应用于生物医学研究和临床诊断领域。
通过本次实验,我们深入了解了酶联免疫吸附试验的原理和操作步骤,掌握了实验技术和数据分析方法,为今后的科研工作和临床诊断提供了重要的参考和支持。
六、实验展望。
酶联免疫吸附试验作为一种重要的生物学实验方法,具有广阔的应用前景。
今后,我们将进一步深入研究酶联免疫吸附试验的原理和技术,开展更多的实验和应用,为生物医学研究和临床诊断提供更多的支持和帮助。
七、参考文献。
1. Smith, J. et al. (2010). Enzyme-linked immunosorbent assay (ELISA). Methods Mol Biol, 588, 89-94.2. Green, N. M. (2015). Avidin and streptavidin. Methods Enzymol, 184, 51-67.以上就是本次酶联免疫吸附试验的实验报告,谢谢阅读。
酶联免疫吸附实验报告

酶联免疫吸附实验报告酶联免疫吸附实验报告酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)是一种常用的生物化学技术,用于检测和定量分析特定抗原或抗体的存在。
该实验结合了免疫学和酶学的原理,通过酶的催化作用来实现对目标物的检测。
本报告将介绍酶联免疫吸附实验的基本原理、操作步骤以及结果分析。
一、实验原理酶联免疫吸附实验的原理基于免疫学的特异性识别和酶学的催化作用。
实验中,首先将待测物(抗原或抗体)与特异性的抗体或抗原结合,形成抗原-抗体复合物。
然后,将该复合物与与酶标记的抗体或抗原结合,形成二抗或二抗原复合物。
最后,通过添加底物,利用酶的催化作用产生可测量的信号,从而确定待测物的存在或浓度。
二、实验步骤1. 准备样品和试剂:收集待测物样品,并准备所需的试剂,如抗体、底物等。
2. 预处理样品:根据待测物的性质,进行必要的样品预处理,如稀释、去除干扰物等。
3. 涂布固相支持物:将特异性抗体或抗原溶液均匀涂布在固相支持物(如酶标板)上,使其吸附。
4. 孵育:将待测物样品加入酶标板中,与固相支持物上的抗体或抗原结合,形成复合物。
然后加入酶标记的抗体或抗原,形成二抗或二抗原复合物。
孵育一段时间,以便复合物的形成。
5. 洗涤:将酶标板反复洗涤,去除未结合的物质。
6. 底物反应:加入适当的底物,使底物与酶发生反应,产生可测量的信号。
底物的选择与酶的选择有关,常用的底物有TMB(3,3',5,5'-四甲基联苯胺)等。
7. 反应停止:通过添加反应停止剂,停止底物的反应,并使产生的信号停止发展。
8. 读取结果:使用酶标仪或其他适当的仪器,测量底物反应产生的信号的强度。
根据标准曲线或对照样品,确定待测物的浓度或存在与否。
三、结果分析根据实验结果,可以定量测定待测物的浓度或判断其存在与否。
一般来说,酶标仪测得的信号强度与待测物的浓度成正比,可以通过标准曲线来确定待测物的浓度。
elisa实验报告范文

elisa实验报告范文篇一:Elia实验名称:酶联免疫吸附剂测定实验原理:酶联免疫吸附测定是一种免疫测定技术。
测定中,先使抗原吸附在固相载体上,然后加待测的抗体,再用某种酶标记抗体,形成抗原-抗体-酶标记抗体的“双抗体夹心”,此时酶仍保有活性,同时标记抗体亦有免疫活性。
之后再加入酶的底物,在酶的催化下产生反应并产生有色物,颜色深浅与待测物质的量直接相关。
至此,酶的催化放大作用与免疫反应的特异性相完美结合,提高了测定的准确性与灵敏度。
实验材料与试剂:1.聚苯乙烯微量细胞培养板(平板,96孔)。
2.酶联免疫检测仪。
3.辣根过氧化物酶羊抗兔IgG。
4.包被液:0.05mol/L碳酸缓冲液(pH9.6):Na2CO30.15g,NaHCO30.293g,蒸馏水稀释至100ml。
5.稀释液(PBS-Tween):NaCl8g,KCl0.2g,KH2PO40.2g,Na2HPO4·12H2O2.9g,Tween-20,0.5ml,蒸馏水加至1000ml。
6.洗涤液:同稀释液。
7.封闭液:0.5%(质量分数)BSA(用PBS配制)。
8.邻苯二胺溶液(底物):配制:0.1mol/L柠檬酸(2.1g/100ml),取6.1ml,0.2mol/LNa2HPO4·12H2O(7.163g/100ml),取6.4ml,加蒸馏水12.5ml,取邻苯二胺8mg(溶解);临用前加30%(体积分数)H2O240μl。
9.终止液:2mol/LH2SO4。
实验步骤:1.包被抗原:用包被液将抗原作适当稀释,一般为1~10μg/孔,每孔加200μl,37℃温育30min。
2.洗涤:倒尽板孔中液体,加200μl洗涤液,反复三次,最后将反应板倒置在吸水纸上,使孔中洗涤液流尽。
3.加封闭液200μl,37℃温育30min。
4.洗涤同2。
5.加被检血清:用稀释液将被检血清作几种稀释,每孔200μl。
同时作稀释液对照。
37℃温育30min。
elisa检测实验报告

elisa检测实验报告ELISA 检测实验报告一、实验目的本次 ELISA 检测实验的目的是定量检测样本中特定抗原或抗体的浓度,以评估实验对象的生理或病理状态。
二、实验原理ELISA(酶联免疫吸附测定)是一种基于抗原抗体特异性结合反应的免疫测定技术。
其基本原理是将已知的抗原或抗体固定在固相载体(如聚苯乙烯微孔板)表面,然后加入待检样本,样本中的待测抗原或抗体与固相载体上的抗原或抗体发生特异性结合。
接着,加入酶标记的第二抗体(或抗原),形成抗原抗体酶标记抗体复合物。
最后,加入底物,酶催化底物反应生成有色产物,通过测定有色产物的吸光度值,即可定量分析样本中待测抗原或抗体的浓度。
三、实验材料与设备1、试剂包被缓冲液(碳酸盐缓冲液,pH 96)封闭液(含 1% 5% 牛血清白蛋白的 PBS 缓冲液)洗涤液(含 005% Tween-20 的 PBS 缓冲液)样本稀释液(PBS 缓冲液)标准品(已知浓度的抗原或抗体)酶标记的二抗(辣根过氧化物酶或碱性磷酸酶标记)底物溶液(如 TMB 或 pNPP)终止液(如 2M 硫酸或 1M 氢氧化钠)2、仪器与设备酶标仪(能够读取 450nm 或 492nm 波长的吸光度值)恒温培养箱移液器(量程分别为20μL、200μL、1000μL)聚苯乙烯微孔板离心机四、实验步骤1、包被将已知浓度的抗原或抗体用包被缓冲液稀释至适当浓度。
向聚苯乙烯微孔板的每孔中加入100μL 稀释后的包被液,4℃过夜或 37℃孵育 2 3 小时。
2、封闭倒掉包被液,用洗涤液洗涤微孔板 3 次,每次浸泡 3 分钟,然后拍干。
每孔加入200μL 封闭液,37℃孵育 1 2 小时。
3、加样倒掉封闭液,用洗涤液洗涤微孔板 3 次,然后拍干。
将待检样本和标准品用样本稀释液进行梯度稀释。
向微孔板的每孔中分别加入100μL 稀释后的样本和标准品,空白对照孔加入100μL 样本稀释液。
37℃孵育 1 2 小时。
ELISA酶联免疫吸附试验报告
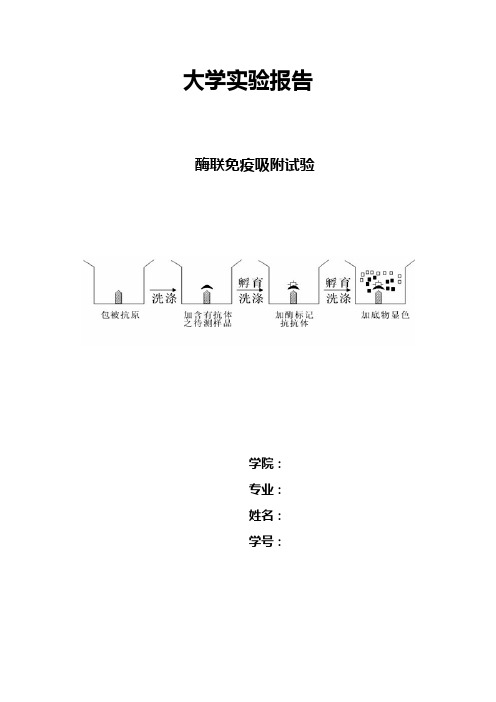
大学实验报告酶联免疫吸附试验学院:专业:姓名:学号:一.实验原理酶联免疫吸附试验(ELISA)是一种用酶标记抗原或抗体的方法,此法是将抗原、抗体免疫反应的特异性和酶的高效催化作用原理有机地结合起来的技术,可敏感地检测体液中微量的特异性抗原或抗体。
基本原理如下:①先使用抗原或抗体结合到某种固相载体表面,并保持其免疫活性;②使抗原或抗体与某种酶联结成酶标抗原或酶标抗体,这种酶标抗原或酶标抗体即保留了其免疫活性,又保留了酶活性;③试验时,把受检标本(抗体或抗原)和酶标抗原或酶标抗体按不同的步骤与固相载体表面的抗原或抗体起反应,用洗涤法去除固相载体上的游离物质,最后结合在固相载体上的酶量与标本中受检物质的多少有关。
当加入酶反应的底物后,底物被酶催化而产生有色物质。
颜色反应深浅与受检抗原或抗体的量成正比。
因此,可借助颜色反应的深浅来定性、定量抗体或抗原。
本技术的特点是敏感性高,特异性强,操作简易,结果容易观察。
图1 ELISA实验原理示意图二.实验材料BSA抗原、兔抗BSA抗体(一抗,分别用PBS稀释成1:2, 1:4, 1:16, 1:32, 1:64, 1:128, 1:256七个浓度)、酶标羊抗兔IgG(二抗)、0.05M PH9.6碳酸盐包被缓冲液、洗涤液(PBS)、底物溶液、2mol/L H2SO4。
三.实验方法1.包被板的处理:加BSA(包被缓冲液稀释为10μg/ml)至酶标板中,每孔100μl,置湿盒中4℃过夜。
第二天取出,用PBS洗涤3-4次。
2.取包被好的酶标板,在第一孔中加入100μl PBS作阴性对照,在第2-8孔加入上述稀释的一抗各100μl,置37℃保温1h。
3.倾去液体,用PBS洗涤3-4次后加入二抗各100μl,置37℃保温30min。
4.倾去液体,用PBS洗涤3-4次后加入底物溶液各100μl,在暗处37℃避光显色20min,最后加入50μl、2M H2SO4终止反应。
5.在波长490nm处,测定各孔的光密度吸收值。
酶联免疫吸附试验实验报告

酶联免疫吸附试验实验报告酶联免疫吸附试验实验报告酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)是一种常用的生物化学实验技术,用于检测和定量分析抗原或抗体的存在与浓度。
本实验旨在通过ELISA技术,检测和定量分析一种特定抗原在不同样本中的浓度变化。
实验材料和方法:1. 样本制备:收集不同来源的样本,如血清、尿液等,并进行离心分离获得上清液。
2. 酶标板涂覆:将待测抗原溶液加入酶标板孔中,保持一定的温度和时间,使抗原均匀地附着在酶标板表面。
3. 阻断:加入阻断液,封闭未被抗原占据的酶标板孔,避免非特异性结合。
4. 抗体结合:加入特异性抗体,与抗原结合形成抗原-抗体复合物。
5. 酶标记抗体结合:加入酶标记抗体,与抗原-抗体复合物结合,形成二抗夹心复合物。
6. 显色反应:加入底物,使酶标记抗体催化底物发生颜色变化。
7. 反应停止:加入停止液,终止显色反应。
8. 测定吸光度:使用酶标仪测定酶标板孔中的吸光度。
实验结果:根据测定吸光度值,我们可以得到不同样本中抗原的浓度变化。
通过比较不同样本的吸光度值,可以了解抗原在不同条件下的表达情况以及不同样本中抗原的相对浓度。
实验讨论:ELISA技术在生物医学领域具有广泛的应用,尤其在疾病诊断和药物研发方面起到了重要的作用。
通过ELISA技术,可以检测和定量分析目标抗原的存在与浓度,从而判断疾病的发生与发展,为临床诊断提供依据。
在本次实验中,我们选择了特定抗原作为目标,通过ELISA技术对其进行检测和定量分析。
实验结果显示,不同样本中抗原的浓度存在差异,这可能与样本来源、处理方法等因素有关。
通过进一步的研究和分析,可以进一步探究这些差异的原因,并为临床诊断和治疗提供更准确的依据。
此外,ELISA技术还可以用于药物研发过程中的药物筛选和药效评价。
通过检测药物对特定抗原的影响,可以评估药物的疗效和安全性,为新药的研发提供重要的参考依据。
ELISA实验报告

ELISA实验报告实验目的:本实验旨在通过ELISA(酶联免疫吸附试验)技术来检测细胞培养上清液中的蛋白质含量,从而了解该细胞株的蛋白质表达水平,进一步研究相关的细胞分子机制。
实验原理:酶联免疫吸附试验是一种常用的免疫学实验方法,通过特异性抗体与待测物结合来实现对特定蛋白质的检测。
该实验主要分为三个步骤:包被抗原、特异性抗体结合和酶底物显色。
实验材料:1.待测细胞上清液2.包被抗原3.特异性抗体4.酶标记的二抗5.酶底物6.缓冲液7.清洗缓冲液8.吸光度测定仪实验步骤:1.包被抗原的处理:将抗原溶液加入微孔板孔中,使其均匀附着在孔壁上。
然后将孔中的液体弃去,用清洗缓冲液进行孔的清洗。
2.探针的结合:将待测样品加入已经包被抗原的孔中,使其与抗原结合。
然后将孔中的液体弃去,用清洗缓冲液进行孔的清洗。
3.酶标记的二抗结合:将酶标记的二抗加入已经含有特异性抗体的孔中,使其与特异性抗体结合。
然后将孔中的液体弃去,用清洗缓冲液进行孔的清洗。
4.酶底物加入:将酶底物加入到孔中,使其在酶的作用下发生显色反应。
5.吸光度测定:使用吸光度测定仪读取吸光度值,根据吸光度值可以推断待测样品中蛋白质的含量。
实验结果:经过ELISA实验,我们得到了待测细胞上清液中蛋白质的含量。
根据吸光度值和标准曲线的对照,我们可以计算出待测样品中蛋白质的浓度。
实验结论:实验分析:本次实验利用ELISA技术成功检测了待测细胞上清液中的蛋白质含量。
该方法具有高灵敏度、高特异性、操作简单等优点,可以在生物医学、生物工程等领域广泛应用。
但需要注意的是,ELISA实验在操作过程中需要严格控制实验条件,避免交叉污染和误差的产生。
实验改进:为了进一步提高实验的准确性和可靠性,可以进行以下改进:1.增加重复次数,提高数据的可靠性和稳定性;2.使用更加准确的仪器和试剂;3.对实验流程进行优化,减少操作的差异性。
总结:本次实验通过ELISA技术成功检测了待测细胞上清液中的蛋白质含量,得出了蛋白质表达水平较高的结论。
检测抗体的实验报告(3篇)

第1篇一、实验目的1. 学习抗体检测的基本原理和方法。
2. 掌握抗原抗体反应的特点和条件。
3. 培养实验操作技能,提高实验数据处理和分析能力。
二、实验原理抗体检测是指利用抗原抗体特异性结合的原理,通过一系列实验方法,检测抗体在样本中的存在与否及其含量。
本实验采用酶联免疫吸附测定(ELISA)法进行抗体检测。
三、实验材料1. 主要试剂:- 抗原:待测抗体对应的抗原- 抗体:已知抗体- 酶标抗体:将抗体与酶偶联- 底物:显色剂- 阴性对照:不含待测抗体的样品- 阳性对照:已知含有待测抗体的样品- 封闭液:防止非特异性结合的液体- 洗涤液:去除未结合的抗原抗体复合物- 酶联免疫检测仪2. 主要仪器:- 微量移液器- 酶标板- 加样器- 离心机- 酶联免疫检测仪四、实验步骤1. 准备工作- 将抗原、抗体、酶标抗体、底物等试剂从冰箱中取出,恢复至室温。
- 将酶联免疫检测仪预热至规定温度。
2. 样品处理- 将待测样品按照要求进行稀释,以确保实验结果在检测范围内。
3. 设置酶联板- 将酶联板放入酶联免疫检测仪中,预热至规定温度。
- 将酶联板按照顺序编号,分别加入抗原、抗体、酶标抗体等试剂,按照实验要求进行加样。
- 加入封闭液,封闭酶联板,避免非特异性结合。
4. 洗板- 将酶联板放入洗涤机中,按照要求进行洗涤。
5. 显色- 加入底物,将酶联板放入酶联免疫检测仪中,根据仪器设置进行显色反应。
6. 检测- 将酶联板放入酶联免疫检测仪中,根据仪器设置进行检测。
7. 数据分析- 根据酶联免疫检测仪的检测结果,绘制标准曲线,计算待测样品的抗体含量。
五、实验结果与分析1. 实验结果- 通过酶联免疫检测仪的检测结果,绘制标准曲线,计算待测样品的抗体含量。
2. 分析- 将实验结果与阴性对照、阳性对照进行对比,判断待测样品中是否含有待测抗体。
- 分析实验过程中可能出现的误差,并提出改进措施。
六、实验总结本次实验成功检测了待测样品中的抗体,掌握了酶联免疫吸附测定(ELISA)法的基本原理和操作步骤。
elisa酶联免疫吸附实验报告

elisa酶联免疫吸附实验报告一.实验目的酶联免疫吸附测定(enzyme-linked immunosorbent assay 简称ELISA)是在免疫酶技术(immunoenzymatic techniques)的基础上发展起来的一种新型的免疫测定技术,ELISA过程包括抗原(抗体)吸附在固相载体上称为包被,加待测抗体(抗原), 再加相应酶标记抗体(抗原),生成抗原(抗体)--待测抗体(抗原)--酶标记抗体的复合物,再与该酶的底物反应生成有色产物。
借助分光光度计的光吸收计算抗体(抗原)的量。
待测抗体(抗原)的定量与有色产生成正比。
二.实验原理用于免疫酶技术的酶有很多,如过氧化物酶,碱性磷酸酯酶,β-D-半乳糖苷酶,葡萄糖氧化酶,碳酸酐酶,乙酰胆碱酯酶,6-磷酸葡萄糖脱氧酶等。
常用于ELISA法的酶有辣根过氧化物酶,碱性磷酸酯酶等,其中尤以辣根过氧化物酶为多。
由于酶摧化的是氧化还原反应,在呈色后须立刻测定,否则空气中的氧化作用使颜色加深,无法准确地定量。
辣根过氧化物酶(HRP)是一种糖蛋白,每个分子含有一个氯化血红素(protonhemin)区作辅基。
酶的浓度和纯度常以辅基的含量表示。
氯化血红素辅基的最大吸收峰是403nm,HRP酶蛋白的最大吸收峰是275nm,所以酶的浓度和纯度计算式是(已知HRP的A(1cm 403nm 1%)=25,式中1%指HRP百分浓度为100ml含酶蛋白1g,即10mg/ml,所以,酶浓度以 mg/ml 计算是HRP的A(1cm 403nm mg/ml=2.5)HRP纯度(RZ)=A403nm/A275nm纯度RZ(Reinheit Zahl)值越大说明酶内所含杂质越少。
高纯度HRP的RZ值在3.0左右,最高可达3.4。
用于ELISA检测的HRP的RZ值要求在3.0以上。
ELISA的基本原理有三条:(1)抗原或抗体能以物理性地吸附于固相载体表面,可能是蛋白和聚苯乙烯表面间的疏水性部分相互吸附,并保持其免疫学活性;(2)抗原或抗体可通过共价键与酶连接形成酶结合物,而此种酶结合物仍能保持其免疫学和酶学活性;(3)酶结合物与相应抗原或抗体结合后,可根据加入底物的颜色反应来判定是否有免疫反应的存在,而且颜色反应的深浅是与标本中相应抗原或抗体的量成正比例的,因此,可以按底物显色的程度显示试验结果。
免疫酶联免疫吸附实验报告

免疫酶联免疫吸附实验报告一、引言免疫酶联免疫吸附实验(ELISA),是一种常用于检测抗原或抗体的方法。
该实验利用酶的特异性反应来定量或定性测定目标物在样品中的存在量。
本实验旨在通过免疫酶联免疫吸附实验检测目标抗原的存在。
二、实验材料和方法 1. 实验材料 - ELISA板:含有特异性抗体的孔板 - 样品:待测的抗原溶液 - 阻断缓冲液:用于防止非特异性结合 - 洗涤缓冲液:用于洗涤ELISA板 - 特异性抗原抗体:用于与目标抗原结合 - 辣根过氧化物酶标记的二抗:与特异性抗原抗体结合 - 底物溶液:用于酶的反应产生可测量的产物2.实验方法•准备ELISA板:加入特异性抗体溶液并孵育,以使其在孔板上固定•添加阻断缓冲液:加入阻断缓冲液,以防止非特异性结合•加入样品:将待测样品加入孔板,并孵育使其与特异性抗体结合•洗涤:用洗涤缓冲液洗涤孔板,以去除未结合的物质•添加辣根过氧化物酶标记的二抗:加入与特异性抗原抗体结合的辣根过氧化物酶标记的二抗,使其与目标抗原结合•洗涤:用洗涤缓冲液洗涤孔板,以去除未结合的物质•加入底物溶液:加入底物溶液,并孵育使酶反应发生•反应停止:加入反应停止液,以停止酶反应•测量吸光度:使用ELISA阅读器测量吸光度,得到结果三、实验结果与讨论本实验使用ELISA方法成功检测到了目标抗原的存在。
在测量吸光度的过程中,我们发现样品中目标抗原与特异性抗体发生特异性结合,而其他非特异性的物质则被洗涤缓冲液去除。
根据实验结果,我们可以通过吸光度的数值判断样品中目标抗原的含量或存在与否。
通常情况下,吸光度数值越高,说明目标抗原的含量越高。
需要注意的是,在进行ELISA实验时,实验操作的准确性和仪器的稳定性对结果的准确性有重要影响。
因此,在实验过程中,我们应严格控制实验条件,并对仪器进行校准。
四、实验结论免疫酶联免疫吸附实验是一种有效的检测目标抗原的方法。
通过特异性抗体与待测样品中的目标抗原结合,再通过酶的特异性反应,我们可以通过测量吸光度来判断目标抗原的存在与否。
ELISA实验报告

ELISA实验报告一、实验目的ELISA(酶联免疫吸附测定)是一种广泛应用于生物医学研究和临床诊断的免疫学技术。
本次实验的目的是通过 ELISA 方法检测样本中特定抗原或抗体的含量,熟悉 ELISA 的实验原理、操作步骤,并对实验结果进行分析和解读。
二、实验原理ELISA 的基本原理是将已知的抗原或抗体固定在固相载体(如聚苯乙烯微量反应板)表面,然后加入待检样本,使其中的抗原或抗体与固相载体上的抗原或抗体发生特异性结合。
洗去未结合的物质后,再加入酶标记的第二抗体或抗原,形成抗原抗体酶标抗体复合物。
最后加入底物,通过酶催化底物显色,根据颜色的深浅来定量测定样本中抗原或抗体的含量。
三、实验材料1、试剂包被缓冲液(pH 96 的碳酸盐缓冲液)洗涤缓冲液(含 005% Tween-20 的 PBS 缓冲液)封闭液(含 1% BSA 的 PBS 缓冲液)样本稀释液(PBS 缓冲液)酶标抗体工作液底物溶液(TMB 溶液)终止液(2 M 硫酸溶液)2、仪器酶标仪移液器恒温箱微量反应板3、样本待检血清样本四、实验步骤1、包被用包被缓冲液将抗原稀释至适当浓度,每孔加入100 μL,4℃过夜包被。
2、洗涤次日,弃去孔内液体,用洗涤缓冲液洗涤 3 次,每次 3 分钟,拍干。
3、封闭每孔加入200 μL 封闭液,37℃孵育 1 小时,洗涤 3 次。
4、加样将待检血清样本用样本稀释液进行梯度稀释,每孔加入100 μL,同时设置阴性对照和阳性对照,37℃孵育 1 小时,洗涤 3 次。
5、加酶标抗体每孔加入100 μL 酶标抗体工作液,37℃孵育 1 小时,洗涤 5 次。
6、显色每孔加入100 μL 底物溶液,37℃避光显色 15 分钟。
7、终止每孔加入50 μL 终止液,终止反应。
8、测定使用酶标仪在 450 nm 波长处测定各孔的吸光度值(OD 值)。
五、实验结果1、原始数据记录各孔的 OD 值,如下表所示:|样本|OD 值|||||阴性对照|0085||阳性对照|1258||待检样本 1|0325||待检样本 2|0158||待检样本 3|0685|2、结果判断计算阴性对照和阳性对照的平均 OD 值,分别记为 OD 阴平和 OD阳平。
ELISA实验报告(两篇)

引言概述:ELISA(酶联免疫吸附测定)是一种常用于测定抗体或抗原的定量和定性的快速、敏感和特异性的实验技术。
本文将继续讨论ELISA实验的一些重要内容,包括实验操作步骤、控制样品的使用、结果分析和解释。
通过深入了解这些实验细节,我们可以更好地理解ELISA的原理和应用。
正文内容:一. 实验操作步骤1. 准备样品和标准曲线- 收集所需的样品,可以是血清、尿液或细胞上清等。
- 确定需要测定的抗体或抗原,并准备相应的标准曲线。
2. 处理样品- 样品处理包括离心、稀释或加热等步骤,以去除可能干扰测定的物质。
3. 准备实验板- 将酶标板预先涂覆上抗体或抗原,然后用非特异性蛋白质阻断剂进行阻断。
4. 加入样品和标准曲线- 将处理后的样品和标准曲线加入预先涂覆抗体或抗原的孔中。
5. 孔洗涤和加入检测抗体- 通过洗涤孔来去除非特异性结合物质。
- 加入检测抗体,它可以是与标准曲线中的抗体相同的抗体或与待测物质结合的抗体。
6. 孔洗涤和加入底物- 通过洗涤孔来去除未结合的检测抗体。
- 加入底物,它会与酶结合并产生可测定的信号。
7. 信号检测和结果记录- 使用酶标仪测量底物的反应产物生成的光信号。
- 将光信号与标准曲线进行比较,得出待测样品中目标物质的含量。
二. 控制样品的使用1. 阳性对照样品- 阳性对照样品是已知含有目标抗体或抗原的样品,用于验证实验的准确性和可靠性。
2. 阴性对照样品- 阴性对照样品是未含目标抗体或抗原的样品,用于确定实验的特异性。
3. 反应性对照样品- 反应性对照样品是含有不同浓度目标抗体或抗原的样品,用于绘制标准曲线并进行定量测定。
4. 标准曲线的制备- 使用已知浓度的标准样品制备标准曲线,该曲线用于将光信号转换为目标物质的定量结果。
5. 控制实验条件- 控制实验条件,包括温度、时间和洗涤次数等,以确保实验的可重复性和可比性。
三. 结果分析1. 原始数据处理- 使用酶标仪测量的吸光度值为原始数据,在计算吸光度值之前,需要进行空白校正和标准曲线外推。
elisa实验报告

elisa实验报告Elisa实验报告。
实验目的,通过Elisa实验,检测血清中特定抗体的含量,从而了解免疫反应的情况。
实验原理,Elisa(酶联免疫吸附测定)是一种通过酶标记抗体与待测物相互作用,再用底物显色的方法进行检测的免疫学实验。
在实验中,待测物会与特定抗体结合,形成抗原-抗体复合物,然后通过酶标记的二抗结合复合物,最终通过底物显色来检测抗体的含量。
实验步骤:1. 吸附,将特定抗体吸附在微孔板上;2. 阻断,用蛋白质溶液阻断未结合的吸附位点;3. 反应,加入待测样品,待样品中的抗原与吸附的抗体结合;4. 洗涤,去除未结合的物质;5. 二抗结合,加入酶标记的二抗,与抗原-抗体复合物结合;6. 洗涤,去除未结合的二抗;7. 显色,加入底物,观察颜色变化;8. 停止反应,加入停止液,停止底物的反应。
实验结果分析,根据实验结果的光密度值,可以计算出样品中特定抗体的含量。
光密度值越高,抗体含量越高。
实验应用,Elisa实验可以应用于临床医学、生物学研究等领域,用于检测病毒、细菌感染,肿瘤标志物等。
实验注意事项:1. 实验操作要严格按照操作规程进行,避免交叉污染;2. 应使用高质量的试剂和耗材,避免实验结果的误差;3. 实验过程中要注意洗涤的次数和充分洗涤,以避免干扰物的影响;4. 应根据实验目的选择合适的Elisa试剂盒和标准曲线,以确保实验结果的准确性。
结论,Elisa实验是一种准确、灵敏的免疫学实验方法,可以用于检测血清中特定抗体的含量,对于疾病诊断和生物学研究具有重要意义。
通过本次实验,我们成功检测出样品中特定抗体的含量,为进一步的研究和临床应用提供了可靠的数据支持。
希望本实验结果能对相关领域的研究和实践提供有益的参考。
免疫酶联免疫吸附实验报告

免疫酶联免疫吸附实验报告免疫酶联免疫吸附实验报告免疫酶联免疫吸附实验(Enzyme-Linked Immunosorbent Assay,简称ELISA)是一种常用的实验方法,用于检测和定量测定生物样本中特定抗原或抗体的存在。
本实验旨在通过ELISA法检测某种病毒感染后产生的抗体水平,以评估免疫系统的应答能力。
实验材料和方法:1. 样本制备:收集病毒感染后的血清样本,离心去除细胞和颗粒物,得到清澈的血清。
2. 酶标板涂布:将目标抗原溶液加入酶标板孔中,孵育一段时间,使抗原吸附于酶标板表面。
3. 洗涤:将洗涤缓冲液加入酶标板孔中,轻轻摇动,倒出液体,重复此步骤多次,以去除未结合的抗原。
4. 反应:加入待测血清样本和辣根过氧化物酶(HRP)标记的抗人免疫球蛋白G(IgG)抗体,孵育一段时间,使抗体与抗原结合。
5. 洗涤:重复第三步骤,去除未结合的抗体。
6. 显色:加入底物溶液,使底物与HRP发生反应,产生可见的颜色。
7. 终止反应:加入终止液,停止底物与HRP的反应。
8. 测定:使用酶标仪测定吸光度,根据标准曲线计算待测样本中抗体的浓度。
实验结果:根据实验操作步骤,我们成功地进行了ELISA实验,获得了一系列吸光度值。
通过绘制标准曲线,我们可以将吸光度值转化为抗体浓度。
进一步分析数据,我们发现不同样本的抗体浓度存在差异。
这表明,病毒感染后,机体会产生相应的抗体作为免疫应答的一部分。
讨论与分析:ELISA法是一种高灵敏度、高特异性的实验方法,广泛应用于医学、生物学和疾病诊断领域。
通过本实验,我们验证了ELISA法的可行性,并获得了关于抗体水平的有用信息。
在实验过程中,我们注意到样本制备的重要性。
样本的质量和处理方式会直接影响实验结果的准确性。
因此,在实验前,我们需要仔细选择和处理样本,确保样本中的抗原或抗体得到充分释放和稳定。
此外,实验中的洗涤步骤也非常重要。
洗涤的目的是去除未结合的抗原或抗体,以减少非特异性信号。
ELISA酶联免疫吸附试验报告

大学实验报告酶联免疫吸附试验学院:专业:姓名:学号:一.实验原理酶联免疫吸附试验(ELISA)是一种用酶标记抗原或抗体的方法,此法是将抗原、抗体免疫反应的特异性和酶的高效催化作用原理有机地结合起来的技术,可敏感地检测体液中微量的特异性抗原或抗体。
基本原理如下:①先使用抗原或抗体结合到某种固相载体表面,并保持其免疫活性;②使抗原或抗体与某种酶联结成酶标抗原或酶标抗体,这种酶标抗原或酶标抗体即保留了其免疫活性,又保留了酶活性;③试验时,把受检标本(抗体或抗原)和酶标抗原或酶标抗体按不同的步骤与固相载体表面的抗原或抗体起反应,用洗涤法去除固相载体上的游离物质,最后结合在固相载体上的酶量与标本中受检物质的多少有关。
当加入酶反应的底物后,底物被酶催化而产生有色物质。
颜色反应深浅与受检抗原或抗体的量成正比。
因此,可借助颜色反应的深浅来定性、定量抗体或抗原。
本技术的特点是敏感性高,特异性强,操作简易,结果容易观察。
图1 ELISA实验原理示意图二.实验材料BSA抗原、兔抗BSA抗体(一抗,分别用PBS稀释成1:2, 1:4, 1:16, 1:32, 1:64, 1:128, 1:256七个浓度)、酶标羊抗兔IgG(二抗)、0.05M PH9.6碳酸盐包被缓冲液、洗涤液(PBS)、底物溶液、2mol/L H2SO4。
三.实验方法1.包被板的处理:加BSA(包被缓冲液稀释为10μg/ml)至酶标板中,每孔100μl,置湿盒中4℃过夜。
第二天取出,用PBS洗涤3-4次。
2.取包被好的酶标板,在第一孔中加入100μl PBS作阴性对照,在第2-8孔加入上述稀释的一抗各100μl,置37℃保温1h。
3.倾去液体,用PBS洗涤3-4次后加入二抗各100μl,置37℃保温30min。
4.倾去液体,用PBS洗涤3-4次后加入底物溶液各100μl,在暗处37℃避光显色20min,最后加入50μl、2M H2SO4终止反应。
5.在波长490nm处,测定各孔的光密度吸收值。
酶联免疫吸附试验实验报告

酶联免疫吸附试验实验报告实验目的:本实验旨在通过酶联免疫吸附试验(ELISA)技术,检测特定抗原或抗体的存在,进而了解其在疾病诊断、治疗监测和流行病学研究中的应用。
实验原理:酶联免疫吸附试验是一种基于抗原-抗体特异性结合的固相免疫测定技术。
在实验中,首先将抗原或抗体固定在固相载体(如微孔板)上,然后加入待测样本,通过特异性结合形成抗原-抗体复合物。
随后,加入酶标记的第二抗体,与抗原-抗体复合物结合。
最后,加入底物产生可检测的信号(如颜色变化),通过光度计测定吸光度,从而定量分析抗原或抗体的含量。
实验材料:1. 微孔板2. 待测样本(血清、尿液等)3. 特异性抗体或抗原4. 酶标记的第二抗体5. 底物溶液6. 洗涤缓冲液7. 标准品8. 光度计实验方法:1. 准备微孔板,将特异性抗原或抗体稀释后固定在微孔板的孔中。
2. 将待测样本加入到相应的孔中,使其与固相的抗原或抗体发生特异性结合。
3. 洗涤微孔板,去除未结合的样本。
4. 加入酶标记的第二抗体,使其与抗原-抗体复合物结合。
5. 再次洗涤微孔板,去除未结合的第二抗体。
6. 加入底物溶液,使酶催化底物产生颜色变化。
7. 使用光度计测定各孔的吸光度,根据标准曲线计算待测样本中抗原或抗体的浓度。
实验结果:实验结果显示,通过测定不同浓度的标准品,我们建立了标准曲线。
将待测样本的吸光度值代入标准曲线,计算得到样本中抗原或抗体的浓度。
实验数据表明,吸光度与抗原或抗体的浓度呈正相关,符合ELISA实验的预期结果。
实验讨论:本实验中,ELISA技术成功地用于检测特定抗原或抗体的存在。
然而,实验过程中可能存在一些影响结果准确性的因素,如样本的稀释比例、酶标记抗体的活性、底物的稳定性等。
此外,实验操作的标准化和重复性也是保证结果可靠性的关键。
实验结论:通过本实验,我们掌握了ELISA技术的原理和操作流程,并成功应用于抗原或抗体的定量检测。
该技术在生物医学研究和临床诊断中具有广泛的应用前景。
酶联吸附实验报告

一、实验目的1. 熟悉酶联免疫吸附实验(ELISA)的基本原理和操作步骤。
2. 掌握ELISA在抗原、抗体检测中的应用。
3. 培养实验操作技能,提高实验数据分析能力。
二、实验原理酶联免疫吸附实验(Enzyme Linked Immunosorbent Assay,ELISA)是一种基于抗原抗体特异性结合的免疫学检测方法。
其基本原理是将抗原或抗体吸附在固相载体上,通过抗原抗体反应和酶催化反应,实现待测物质的定性和定量检测。
三、实验材料1. 试剂:抗原或抗体、酶标记抗体或抗原、底物、洗涤液、缓冲液等。
2. 仪器:酶标仪、移液器、微量反应板、振荡器等。
四、实验步骤1. 包被:将抗原或抗体用缓冲液稀释后,加至微量反应板上,37℃孵育2小时,然后洗涤去除未结合的蛋白质。
2. 加待测样本:将待测样本加至微量反应板上,37℃孵育1小时,使抗原抗体结合。
3. 洗涤:洗去未结合的样本,减少非特异性反应。
4. 加酶标记抗体或抗原:将酶标记抗体或抗原加至微量反应板上,37℃孵育1小时,使抗原抗体结合。
5. 洗涤:洗去未结合的酶标记抗体或抗原,减少非特异性反应。
6. 加底物:加入底物,在酶的作用下,底物被催化产生颜色反应。
7. 显色:观察颜色变化,根据颜色深浅判断待测物质的含量。
五、结果分析1. 定性分析:通过观察颜色变化,判断待测物质是否存在。
2. 定量分析:通过酶标仪测定吸光度值(OD值),根据标准曲线计算待测物质的含量。
六、实验结果(此处应插入实验数据表格或图表,展示实验结果。
)七、实验讨论1. ELISA实验中,固相载体的选择对实验结果有较大影响。
本实验使用聚苯乙烯微量反应板,具有良好的吸附性能。
2. 实验过程中,严格控制洗涤步骤,减少非特异性反应。
3. 酶标抗体或抗原的浓度对实验结果有较大影响。
本实验根据实验条件优化了酶标抗体或抗原的浓度。
4. 底物的选择和反应条件对实验结果也有一定影响。
本实验根据实验条件选择了合适的底物和反应条件。
elisa实验报告

elisa实验报告Elisa实验报告引言Elisa(酶联免疫吸附测定)是一种常用的实验方法,用于检测和测量样本中特定蛋白质的存在和浓度。
本实验旨在通过Elisa方法检测血清中的特定抗体,以了解免疫系统的功能和疾病的发展。
实验步骤1. 样本准备:收集一定数量的血清样本,并将其离心以分离血浆。
血浆中含有丰富的抗体,用于检测特定蛋白质的存在。
2. 酶标板涂覆:将特定抗原溶液均匀涂覆在酶标板的孔中,并在低温下孵育一段时间,使抗原充分吸附在酶标板表面。
3. 样本加入:将待测血清样本加入到酶标板的孔中,使样本中的抗体与酶标板上的抗原结合。
4. 洗涤:使用缓冲液洗涤酶标板,去除未结合的物质。
5. 酶标记抗体加入:加入与待测抗体特异性结合的酶标记抗体,使其与待测抗体结合。
6. 洗涤:再次使用缓冲液洗涤酶标板,去除未结合的酶标记抗体。
7. 底物加入:加入底物溶液,使其与酶结合,产生可测量的光学信号。
8. 反应停止:加入反应停止剂,停止底物的反应,并阻止进一步的颜色发展。
9. 测量:使用酶标仪测量酶标板中的吸光度,得到与抗体浓度相关的信号。
结果与讨论通过Elisa实验,我们可以得到血清样本中特定抗体的存在与否以及浓度的信息。
根据实验结果,我们可以进一步了解免疫系统的功能和疾病的发展。
在本实验中,我们以某种疾病的抗体为例,对血清样本进行Elisa检测。
通过与正常血清样本的对比,我们可以判断该疾病是否存在,并根据抗体浓度的高低评估疾病的严重程度。
实验中,样本准备是非常关键的一步。
血清样本的收集和离心过程需要严格控制,以确保样本的纯净度和稳定性。
如果样本受到污染或不完全离心,可能会导致实验结果的误差。
酶标板涂覆和洗涤步骤也需要仔细操作。
涂覆抗原的过程需要均匀且适量,以确保抗原充分吸附在酶标板表面。
洗涤步骤的目的是去除未结合的物质,避免干扰实验结果。
在酶标记抗体加入的步骤中,选择特异性较好的酶标记抗体非常重要。
如果酶标记抗体与待测抗体结合不紧密或选择不当,可能会导致实验结果的误差。
测抗原实验报告

一、实验目的1. 掌握酶联免疫吸附测定(ELISA)的基本原理和操作步骤。
2. 学会使用ELISA法检测某病原体抗原。
3. 了解实验结果的分析与评价。
二、实验原理酶联免疫吸附测定(ELISA)是一种基于抗原-抗体特异性结合的免疫学检测技术。
该技术利用酶催化底物反应产生有色产物,通过分光光度计测定光吸收值,从而定量分析待测抗原。
实验原理如下:1. 将已知抗原吸附在固相载体(如聚苯乙烯板)上,形成抗原-载体复合物。
2. 加入待测样本,若样本中含有相应抗原,则与固相载体上的抗原发生特异性结合。
3. 洗去未结合的样本,加入酶标记的抗体,该抗体可与已结合的抗原-样本复合物发生特异性结合。
4. 再次洗去未结合的抗体,加入底物,酶催化底物反应产生有色产物。
5. 通过测定吸光度值,计算出待测抗原的含量。
三、实验材料1. 试剂:抗原、抗体、酶标记抗体、底物、洗涤液、封闭液等。
2. 仪器:酶标仪、微量移液器、离心机、培养箱等。
3. 载体:聚苯乙烯板。
四、实验步骤1. 准备工作a. 按照说明书配置各试剂,设置实验组和对照组。
b. 将聚苯乙烯板在洗涤液中浸泡,清洗后晾干。
2. 包被a. 将抗原加入包被孔中,每孔100μl。
b. 室温下孵育2小时。
c. 洗板,去除未结合的抗原。
3. 封闭a. 加入封闭液,每孔200μl。
b. 室温下孵育1小时。
c. 洗板,去除未结合的封闭液。
4. 添加样本a. 将待测样本加入孔中,每孔100μl。
b. 室温下孵育1小时。
c. 洗板,去除未结合的样本。
5. 添加酶标记抗体a. 加入酶标记抗体,每孔100μl。
b. 室温下孵育1小时。
c. 洗板,去除未结合的酶标记抗体。
6. 添加底物a. 加入底物,每孔100μl。
b. 室温下避光孵育10分钟。
7. 测定吸光度值a. 使用酶标仪测定各孔的吸光度值。
b. 记录数据。
8. 结果分析a. 根据标准曲线计算待测样本中抗原的含量。
b. 对实验结果进行分析与评价。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ELISALin Chengyu Bio 04 2010030007Experiment Date: 2012-03-12 Submitting Date: 2012-03-211Introduction1.1Background informationELISA (Enzyme-linked Immunosorbent Assay) is a solid-phase assay for antibodiesemploying ligands labeled with enzymes which is widely used for immunological assays.This technique can be applied to detect antigens or antibodies for qualitative orquantitative purpose. Since enzyme reactions are very well known amplificationprocesses, the signal is generated by enzymes which are linked to the detection reagentsin fixed proportions to allow accurate quantification.11.2Major principlesFigure 1 Schematic diagram of ELISA2Figure 2 Procedure of indirect ELISA3As shown in Figure 1 & 2, the general procedure of indirect ELSIA is to: incubate theplate well with antigen, wash off unbounded antigen, incubate with 1st antibody, washoff unbounded 1st antibody, incubate with labeled 2nd antibody, wash off unbounded 2ndantibody, incubate with enzyme substrate solution, and detect optical density or otherindex showing enzyme activity.2Experiment Operation2.1Antigen coating(1)Prepare an antigen solution in coating buffer (human IgG at 0.025mg/ml);(2)Pipette 200 μl antigen solution to each well (Row: B~G; Column: 2~10; Column 11is negative control without antigen) of the microtiter plate;(3)Incubate the plate at 37 ℃for 30 min;(4)Remove the antigen solution;(5)Wash each well with 200 μl with PBS-T for 3 times;(6)Block each well (Row: B~G; Column: 2~11) with 200 μl 0.5% BSA-PBS, andincubate the plate at 37 ℃for 30 min;(7)Remove the blocking solution;(8)Wash each well with 200 μl with PBS-T for 3 times.2.2Primary antibody reaction(1)Dilute the primary antibody (rabbit-anti-human IgG antiserum) in PBS-T fordifferent dilution (from 1:400 to 1:51,200 in 2-folds dilution);(2)Add 200 μl diluted antibody solution to each well following Table 1;Table 1 Scheme to add primary antibody(3)Incubate the plate at 37 ℃for 1 hour;(4)Remove the primary antibody solution;(5)Wash each well with 200 μl PBS-T for 3 times.2.3Application of secondary antibody(1)Dilute the peroxidase conjugated secondary antibody (Goat-anti-rabbit IgG-HRP) inPBS-T at the dilution of 1:20,000 and 1:40,000;(2)Add 200 μl secondary antibody solution to each well following Table 2;(3)Incubate the plate at 37 ℃for 1 hour;(4)Remove the secondary antibody solution;(5)Wash each well with 200 μl PBS-T for 3 times.2.4Substrate development(1)Add 200 μl substrate solution to each well (Row: B~G ,Column: 2~11);(2)Incubate for approximately 3 min;(3)Add 50 μl 2 M H2SO4 to each well to terminate the reaction;(4)Measure optical density at 490 nm.3Raw data and its processing3.1Raw data3.2Data processingSet Row B, C, and D as Group I, and Row E, F, and G as Group II. The processed datais shown in Table 4Table 4 Processed data: optical density of each groupSet different dilutions of primary antibody as x axis, optical density as y axis, drawFigure 3 to illustrate their relation.Figure 3 Relationship between optical density and dilutions of primary antibodyFor the reason that the curve cannot illustrate the relationship enough, change the x axis to nature logarithm of different dilutions of primary antibody. See Figure 4:Figure 4 Relationship between optical density and natural logarithm of dilutions of primary antibodyUsing linear fit for each group, we can figure out that two lines are approximately parallel.In the black curve in Figure 3, there is an oblivious point of inflection which corresponds with the dilution of 1:800. The curve after this point becomes flat, which indicates that the binding between antigens and primary antibodies is saturated in the dilution of 1:800 and higher. This data can suggest that in other immunoenzymatic experiment, the proper dilution of primary antibody will be around, and no higher than 1:800.What’s more, from the red line in Figure 4 we can figure out that the optical density hasa linear relation with natural logarithm of dilutions of the primary antibody.As for comparison between Group I and Group II, from Figure 3 we can figure out thatthe point of infection of blue curve, which corresponds with the dilution of 1:40,000, ison the left, about 1:1600.In Figure 4, the green line (1:40,000) is positioned lower than the red line (1:20,000),which is easy to understand. Lower concentration of secondary antibody means lessbinding with primary antibody during application of secondary antibody.4Results and discussion4.1Results(1)The optical density has an approximately linear relation with the natural logarithmof the dilutions of the primary antibody;(2)For secondary antibody in the dilution of 1:20,000, the proper dilution of primaryantibody is 1:800; for secondary antibody in the dilution of 1:40,000, primaryantibody is recommended to be 1:1600;(3)With the same dilution of antigen and primary antibody, higher concentration ofsecondary antibody will get a higher optical density;4.2Discussion(1)What is the significance of the negative control groups?I.The no primary antibody groups proved that there is no specific bindingbetween antigen and secondary antibody, and provided a background ofnon-specific binding between secondary antibody and antigen;II.The no antigen groups can provide a background of non-specific binding between primary antibody and BSA.(2)Why washing step is essential?Washing each well with PBS-T, which contains tween-20 as detergent, can wash offunbounded antigens and antibodies, including those non-specifically binding. Ifwashing step is omitted, the background index will be higher, and might causeinterference to the result.(3)Why blocking step is essential?After the antigen coating step, the surface of the well is not covered by antigenentirely, i.e. there is still some site leaving blank, which allows other proteins bindto them. Blocking step is to block those blank sites with non-specific bindingmaterial that will not cause interference to the experiment. Thus, the primaryantibody will only bind to the antigen coated in the first step, rather than coat on thesurface as well.(4)What’s the advantage of indirect ELISA comparing with direct ELISA?I.Indirect ELISA can amplify the optical density which we measure.Compared to direct ELISA, the number of secondary antibody binding tothe primary antibody is way larger than the number of primary antibodybinding to the antigen. Thus, optical density will be higher and easier tomeasure, which means a lower error;II.The secondary antibody contains HRP, which is essential for substrate development. Compared to direct ELISA, indirect ELISA need only onekind of antibody contains HRP to perform many kinds of experiment, ratherthan one antibody linked to enzyme for one experiment, which isinconvenient.5Reference【1】/wiki/ELISA【2】/post/9314400054【3】/indirect_elisa。
