鲁科版必修一化学方程式汇总
鲁科版高中化学必修一离子方程式书写汇总.docx

高中化学学习材料唐玲出品离子方程式书写汇总1、氯化钠溶液滴加硝酸银溶液2、钠与水反应3、钠与硫酸铜溶液4、过氧化钠与水反应5、碳酸氢盐溶液与强酸溶液混合6、碳酸氢盐溶液与醋酸溶液混合7、氢氧化钙溶液与碳酸氢镁反应8、向碳酸氢钙溶液中加入过量的氢氧化钠9、向碳酸氢钙溶液中加入少量的氢氧化钠10、澄清石灰水与少量小苏打溶液混合11、澄清石灰水通入少量CO212、澄清石灰水通入过量CO213、碳酸氢钠溶液与少量石灰水反应14、碳酸氢钠溶液与过量石灰水反应15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合16、碳酸钠溶液与盐酸反应17、向氢氧化钠溶液中通入少量的CO218、过量的CO2通入氢氧化钠溶液中19、碳酸氢铵溶液中加入过量氢氧化钠溶液20、碳酸钙与盐酸反应21、碳酸钙与醋酸反应22、澄清石灰水与稀盐酸反应23、磷酸溶液与少量澄清石灰水24、磷酸溶液与过量澄清石灰水25、碳酸镁溶于强酸26、硫酸镁溶液跟氢氧化钡溶液反应27、硫酸溶液跟氢氧化钡溶液反应28、硫酸氢钠溶液与氢氧化钡反应至中性29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀30、硫酸铝溶液中加入过量氢氧化钡溶液31、氢氧化镁与稀硫酸反应32、铝跟氢氧化钠溶液反应33、物质的量之比为1:1NaAl合金置于水中34、氧化铝溶于强碱溶液35、氧化铝溶于强酸溶液36、氢氧化铝与氢氧化钠溶液37、氢氧化铝与盐酸溶液反应38、硫酸铝溶液与碳酸氢钠溶液39、硫酸铝溶液与碳酸钠溶液40、氯化铝溶液中加入过量氨水41、明矾溶液加热水解生成沉淀42、氯化铝溶液与偏铝酸钠溶液43、偏铝酸钠溶液中加入氯化铁溶液44、偏铝酸钠溶液中加入少量盐酸45、偏铝酸钠溶液中加入过量盐酸46、偏铝酸钠溶液中加入氯化铵溶液47、金属铁溶于盐酸中48、铁粉与氯化铁溶液反应49、铜与氯化铁溶液反应50、硫化亚铁与盐酸反应51、硫化钠与盐酸反应52、硫化钠溶液中加入溴水53、氯化亚铁溶液中通入氯气54、向硫酸铁的酸性溶液中通入足量的H2S55、氯化铁溶液中滴加少量硫化钠溶液56、硫化钠溶液中滴加少量氯化铁溶液57、氯化铁溶液中滴加少量碘化钾溶液58、氯化铁溶液与氢氧化钠溶液反应59、氯化铁溶液跟过量氨水反应60、氯化铁溶液与硫氰化钾溶液61、氯化铁溶液跟过量锌粉反应62、锌与稀硫酸63、锌与醋酸64、锌与氯化铵溶液65、氯化铁溶液加入碘化钾溶液66、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液68、四氧化三铁溶于浓盐酸69、氧化铁溶于盐酸70、氧化铁溶于氢碘酸溶液71、用氯化铁与沸水反应制氢氧化铁胶体72、向溴化亚铁溶液通入足量的氯气73、向溴化亚铁溶液通入少量氯气74、向碘化亚铁溶液通入足量氯气75、向碘化亚铁溶液通入少量氯气76、碘化钾溶液中加入氯水77、碘化钾溶液中加入过量氯水78、溴化钠溶液中加入氯水79、亚硫酸溶液中加入氯水80、亚硫酸溶液中加入氯化铁81、亚硫酸溶液中加入双氧水82、氯气通入水中83、氯气通入碳酸氢钠溶液中84、亚硫酸钠溶液中加入溴水85、亚硫酸钠溶液中加入双氧水86、二氧化硫通入溴水中87、单质铁溶于过量稀硝酸中(NO)88、过量单质铁溶于稀硝酸中(NO)89、单质铜与稀硝酸反应90、单质铜与浓硝酸反应91、铜片插入硝酸银溶液92、用氨水吸收少量SO293、用氨水吸收过量的SO294、稀硝酸中通入SO295、浓硝酸中通入SO296、氯化铵与氢氧化钠两种浓溶液混合加热97、向次氯酸钙溶液中通入SO298、用碳酸钠溶液吸收过量SO299、硫酸铜溶液中通入硫化氢100、硫酸铜溶液中加入硫化钠溶液101、电解饱和食盐水102、电解硫酸铜溶液103、电解氯化铜溶液104、电解熔融氯化钠105、电解熔融氧化铝106、二氧化锰与浓盐酸共热107、氯气通入冷的氢氧化钠溶液中108、氯气通入热的氢氧化钾溶液中109、次氯酸钙溶液通入过量的二氧化碳110、次氯酸钠溶液中加入浓盐酸111、氯酸钾与浓盐酸112、硫化钠、亚硫酸钠混合液中加入稀硫酸113、NO2溶于水114、NO2通入亚硫酸钠溶液115、硫化钠的第一步水解116、碳酸钠的第一步水解117、氯化钡溶液与硫酸反应118、硫溶于热的氢氧化钠溶液119、醋酸钡溶液与硫酸反应120、醋酸与氢氧化钾溶液反应121、醋酸与氨水反应122、苯酚溶于氢氧化钠溶液123、苯酚与氯化铁溶液反应124、苯酚钠溶于醋酸溶液125、苯酚钠溶液中通入少量CO2126、碳酸钠溶液中加入过量苯酚127、碳酸钙跟甲酸反应128、甲酸钠跟盐酸反应129、小苏打溶液与甲酸溶液反应130、Na2C2O4溶液中加入酸性高锰酸钾溶液131、酸性高锰酸钾溶液与双氧水132、酸性氯化亚铁溶液与双氧水133、SO2通入酸性高锰酸钾溶液134、乙烯通入酸性高锰酸钾溶液生成CO2135、乙酸乙酯与氢氧化钠溶液136、硬脂酸甘油酯与氢氧化钠溶液137、氯乙烷在氢氧化钠溶液中水解138、硝酸银溶液中滴入少量氨水139、硝酸银溶液中滴加氨水至过量140、葡萄糖发生银镜反应141、硫酸铜溶液中加入氢氧化钠溶液142、硫酸铜溶液中加入少量氨水143、硫酸铜溶液中加入过量氨水144、硫酸锌溶液中加入少量氨水145、硫酸锌溶液中加入过量氨水146、甘氨酸与氢氧化钠溶液147、甘氨酸与盐酸溶液148、邻羟基苯甲酸与氢氧化钠溶液149、邻羟基苯甲酸与碳酸氢钠溶液150、邻羟基苯甲酸与碳酸钠溶液参考答案:1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3·H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2Fe2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液:Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应:2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸:Zn+2H+=Zn2++H2↑63、锌与醋酸:Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液:2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液:Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H 2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水:2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水:I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水:2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水:H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁:H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水:H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中:Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中:Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水:SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水:SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中:SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液:2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO2:SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2:3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2:SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-NH3↑+H2O97、向次氯酸钙溶液中通入SO2:Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2:CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+ 103、电解氯化铜溶液:Cu2++2Cl-Cu↓+Cl2↑104、电解熔融氯化钠:2Na++2Cl-(熔融)2Na+Cl2↑105、电解熔融氧化铝:4Al3+ +6O2-4Al+3O2↑106、二氧化锰与浓盐酸共热:MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O 107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3- 110、次氯酸钠溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸:ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O 113、NO2溶于水:3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液:SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水解:S2-+H 2O HSO3-+OH-116、碳酸钠的第一步水解:CO 32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液:3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3·H2O=CH3COO-+NH4++2H2O 122、苯酚溶于氢氧化钠溶液:C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应:6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+124、苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应: CaCO 3+HCOOH=Ca 2++CO 2↑+H 2O+HCOO-128、甲酸钠跟盐酸反应: HCOO -+H +=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO 3-=CO 2↑+H 2O+HCOO - 130、Na 2C 2O 4溶液中加入酸性高锰酸钾溶液:5C 2O 42-+2MnO 4-+16H +=10CO 2↑+2Mn 2++8H 2O131、酸性高锰酸钾溶液与双氧水:5H 2O 2+2MnO 4-+6H +=5O 2↑+2Mn 2++8H 2O132、酸性氯化亚铁溶液与双氧水:2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O133、SO 2通入酸性高锰酸钾溶液:5SO 2+2MnO 4-+2H 2O=5SO 42-+2Mn 2++4H +134、乙烯通入酸性高锰酸钾溶液生成CO 2:5C 2H 4+12MnO 4-+36H +=10CO 2↑+12Mn 2++28H 2O135、乙酸乙酯与氢氧化钠溶液:CH 3COOCH 2CH 3+OH -=CH 3COO -+HOCH 2CH 3 136、硬脂酸甘油酯与氢氧化钠溶液:(C 17H 35COO)3(C 3H 5O 3)+3OH -=3C 17H 35COO -+CH 2(OH)CH(OH)CH 2OH137、氯乙烷在氢氧化钠溶液中水解:CH 3CH 2Cl+OH -=CH 3CH 2OH+Cl-138、硝酸银溶液中滴入少量氨水: Ag ++NH 3·H 2O=AgOH ↓+NH 4+139、硝酸银溶液中滴加氨水至过量:Ag ++2NH 3·H 2O=[Ag(NH 3)2]++2H 2O 140、葡萄糖发生银镜反应:CH 2(OH)(CHOH)4CHO+2[Ag(NH 3)2]++2OH -=CH 2(OH)(CHOH)4COO -+NH 4++3NH 3+H 2O+2Ag ↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu 2++2OH -=Cu(OH)2↓ 142、硫酸铜溶液中加入少量氨水:Cu 2++2NH 3·H 2O=Cu(OH)2↓+2NH 4+143、硫酸铜溶液中加入过量氨水:Cu 2++4NH 3·H 2O=[Cu(NH 3)4]2++4H 2O144、硫酸锌溶液中加入少量氨水:Zn 2++2NH 3·H 2O=Zn(OH)2↓+2NH 4+145、硫酸锌溶液中加入过量氨水:Zn 2++4NH 3·H 2O=[Zn(NH 3)4]2++4H 2O146、甘氨酸与氢氧化钠溶液:NH 2CH 2COOH+OH -=NH 2CH 2COO -+H 2O147、甘氨酸与盐酸溶液: NH 2CH 2COOH+H +=[ NH 3CH 2COOH]+148、邻羟基苯甲酸与氢氧化钠溶液:149、邻羟基苯甲酸与碳酸氢钠溶液:150、邻羟基苯甲酸与碳酸钠溶液:2OH- OH COOH + O - COO - +2H 2O OH COO - HCO 3- OH COOH + +H 2O+CO 2↑OHCOOH + O -COO -CO 32-+H 2O+CO 2↑。
鲁科版化学必修一1

必修一1-3章化学方程式专题1、金属钠与水的反应:2、金属钠放置在空气中被氧化:3、金属钠在空气中燃烧:4、过氧化钠与水的反应:5、过氧化钠与二氧化碳的反应:6、氯气与铁反应:7、氯气与铜反应:8、氯气与氢气反应:9、氯气与水反应:10.氯气通入NaOH溶液中:11. 次氯酸见光易分解:12. 氯气与氢氧化钙反应制漂白粉:13. 制备氢氧化铁胶体:14. 铁单质与硫酸反应:15. 氯化铁溶液与铁单质反应:16. 氯化亚铁溶液与锌的反应:17. 氯化亚铁溶液中通入氯气:18. 碳酸钠与盐酸反应:19. 碳酸氢钠与盐酸反应:20. 碳酸氢钠与NaOH溶液反应:21. 碳酸氢钠受热分解:22. 放电条件下,氮气与氧气直接化合:23. 工业上制备氨:24. 一氧化氮常温下与氧气反应:25. 二氧化氮溶于水:26. 氨与水反应:27. 氨与盐酸反应:28. 一水合氨的电离方程式:29. 工业上利用氨制备一氧化氮(氨的催化氧化):30. 碳酸铵受热分解:31. 氯化铵受热分解:32. 铵盐溶液与碱溶液反应的离子方程式:33. 实验室用氯化铵与氢氧化钙制取少量氨气:34. 硝酸见光分解:35. 浓硝酸与铜的反应:36. 稀硝酸与铜的反应:37. 浓硝酸在加热条件下与碳单质的反应:38. 硫单质与铁的反应:39. 硫与氧气的反应:40. 二氧化硫被氧气氧化:41. 二氧化硫与硫化氢反应:42. 在加热时浓硫酸与铜的反应:43. 在加热时浓硫酸与木炭的反应:44. 硫酸形成时发生的主要反应:45. 镁与二氧化碳反应:46. 含Br-溶液中通入氯气反应的离子方程式:。
鲁教版高考化学方程式总结

1.碳与氧气(不足)的反应2C+O2==== 2CO碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3?H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O 二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O 硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓71.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2(2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓(4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br2第四章90.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3 112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4] 115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3?H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3?H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3127.铜与氧气的反应2Cu+O2==== 2CuO128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O2↑130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4?5H2O。
鲁科版必修一化学方程式总结(表格版)

Cl2+ 2Br-= Br2+ 2Cl-
单质溴与碘化钠溶液反应
Br2+ 2NaI = I2+ 2Na Br
Br2+ 2I-= I2+ 2 Br-
氯气的实验室制法
MnO2+ 4HCl(浓) MnCl2+Cl2↑+ 2H2O MnO2+ 4H++2Cl- Mn2++ Cl2↑+ 2H2O
Cl2+H2 2HCl
氯气与磷反应
2P + 3Cl2 2PCl3,PCl3+Cl2 2PCl5
2P + 5Cl2 2PCl5
氯气与金属铁反应
2Fe + 3Cl2点燃2FeCl3
氯气与金属铜反应
Cu +Cl2点燃CuCl2
氯气与金属钠反应
2Na + Cl2点燃2NaCl
氯气与硫化氢反应
Cl2+H2S=2HCl+S
铵盐与碱反应
(NH4)2SO4+2NaOH△2NH3↑+Na2SO4+2H2O
NH4NO3+NaOH△NH3↑+NaNO3+H2O
2NH4Cl+Ca(OH)2△CaCl2+2H2O+2NH3↑
NH4++ OH- NH3↑+ H2O(检验铵盐)
浓硝酸见光受热分解
4HNO3(浓) 4NO2↑+O2↑+2H2O
二价铁化合物+氧化剂→三价铁的化合物
2FeCl2+ Cl2= 2FeCl3
鲁科版必修一化学方程式汇总

鲁科版化学(1)化学方程式汇总1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl*2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl*3、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu*4、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl5、钠在空气中燃烧:2Na + O2Na2O2钠与氧气反应:4Na + O2 = 2Na2O *6、过氧化钠与水反应:2Na2O2+ 2H2O = 4NaOH + O2↑7、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2*8、钠与水反应:2Na + 2H2O = 2NaOH + H2↑9、氯气与金属铁反应:2Fe + 3Cl22FeCl310、氯气与金属铜反应:Cu + Cl2CuCl211、氯气与金属钠反应:2Na + Cl22NaCl12、氯气与氢气反应:H2 + Cl2 2HCl*13、氯气与水反应:Cl2 + H2O = HCl + HClO14、次氯酸光照分解:2HClO 2HCl + O2↑*15、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O*16、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O*17、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO318、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO*19、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑*20、碳酸氢钠与盐酸反应: NaHCO3 + HCl = NaCl + H2O + CO2↑*21、碳酸氢钠与氢氧化钠反应: NaHCO3 + NaOH = Na2CO3 + H2O22、碳酸氢钠受热分解:2NaHCO3Na2CO3+ H2O + CO2↑23.炽热的木炭与二氧化碳反应:CO2+C 2CO24、木炭还原氧化铜: 2CuO + C 2Cu + CO2↑25、氮气与氧气在放电下反应:N2 + O22NO26、一氧化氮与氧气反应:2NO + O2 = 2NO227、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO28、合成氨:N2+3H22NH329、氨气易溶于水:NH3+H2O≒NH3·H2O*30、氨气与酸反应:NH3+HCl=NH4Cl31、氨的催化氧化:4NH3+5O24NO+6H2O32、氯化铵受热分解:NH4Cl NH3↑ + HCl↑33、碳酸氢氨受热分解:NH4HCO3NH3↑ + H2O↑ + CO2↑*34、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O 35、氨气的实验室制取:2NH4Cl(固) + Ca(OH)2(固)CaCl2 + 2H2O + 2NH3↑ *36、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑*37、稀硝酸与铜反应:3 Cu + 8HNO3(稀) =3Cu(NO3)2 + 4H2O + 2NO↑38、浓硝酸与木炭反应:C + 4HNO3(浓) CO2↑+ 4NO2↑ + 2H2O39、硫与金属铁反应:Fe + S FeS40、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O22SO341、二氧化硫与水反应:SO2 + H2O =H2SO342、三氧化硫与水反应:SO3 + H2O = H2SO443、亚硫酸氧化成硫酸:2H2SO3+O2=2H2SO444、SO2 + CaO = CaSO3*SO2 + 2NaOH = Na2SO3 + H2O*45、SO2 + Ca(OH)2 = CaSO3↓ + H2O*46、SO2 + Cl2 + 2H2O = 2HCl + H2SO447、二氧化硫与硫化氢反应:SO2 + 2H2S =3S+2H2O*48、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑49、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O*50、电解饱和食盐水制氢氧化钠:2NaCl+2H2O 2NaOH+H2↑+Cl2↑51、镁与二氧化碳反应:2Mg+CO22MgO+C52、硅与F2的反应:Si + 2F2 = SiF453、硅与2NaOH 的反应:Si + 2NaOH + H2O = Na2SiO3 +2H2↑54、硅单质的实验室制法:粗硅的制取:SiO2 + 2C Si + 2CO55、粗硅转变为纯硅:Si(粗)+ 2Cl2 SiCl4SiCl4 + 2H2Si(纯)+ 4HCl56、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O57、硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑58、二氧化硅与氧化钙高温反应:SiO2 + CaO =CaSiO3*59、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3+ H2O*60、硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓*61、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓62、铝热反应:2Al+Fe2O3Al2O3+2Fe*63、铝与氢氧化钠溶液反应:2Al + 2NaOH + 6H2O = 2Na[Al(OH)4]+ 3H2↑*64、氧化铝与盐酸反应:Al2O3+ 6HCl = 2AlCl3 + 3H2O*65、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]*66、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4 *67、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O*68、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = Na[Al(OH)4]69、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O*70、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2*71、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3*72、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3+ 3H2O*73、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl*74、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 75、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+ 2H2O + O2 = 4Fe(OH)3。
鲁科版化学必修一所有化学方程式

.注: "="代表生成 方程式后符号或文字代表反应条件 "==="代表可逆反应 2Na+2H 2O=2NaOH+H 2↑CuSO 4+2NaOH=Cu(OH)2↓+Na 2SO 42Na+2HCl=2NaCl+H 2↑2NaOH+CO 2=Na 2CO 3+H 2ONa 2CO 3+10H 2O=Na 2CO 3·10H 2O4Na+O 2=2Na 2O2Na+O 2=Na 2O 2 Δ2Na 2O 2+2H 2O=4NaOH+O 2↑2Na 2O 2+2CO 2=2Na 2CO 3+O 2Na 2O+H 2O=2NaOHNa 2O+CO 2=Na 2CO 3Na 2O+2HCl=2NaCl+H 2O2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑2Na 2O+O 2=2Na 2O 2Δ2Fe+3Cl 2=2FeCl 3 点燃Cl 2+H 2=2HCl 点燃Cu+Cl 2=CuCl 2点燃2Na+Cl 2=2NaCl 点燃2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O 工业制漂白粉 Cl 2+H 2O=HCl+HClOCl 2+2NaOH=NaClO+NaCl+H 2ONaClO+CO 2+H 2O=HClO+NaHCO 3 次氯酸钠在空气中变质 2NaClO+CO 2+H 2O=2HClO+Na 2CO 3 消毒2HClO=2HCl+O 2↑光照Ca(ClO)2+CO 2+H 2O=CaCO 3↓+2HClO 漂白粉在空气中变质 SO 2+2NaOH=Na 2CO 3+H 2OFeCl 3+3H 2O=Fe(OH)3(胶体)+3HCl ΔNa 2CO 3+2HCl=2NaCl+CO 2↑+H 2ONa 2CO 3+HCl(少)=NaHCO 3+NaClNaHCO 3+HCl(过量)=NaCl+H 2O+CO 2↑NaHCO 3+HCl=NaCl+CO 2↑+H 2ONaHCO 3+NaOH=Na 2CO 3+H 2ONaHCO 3+Ca(OH)2=2H 2O+Na 2CO 3+CaCO 3↓2NaHCO 3=Na 2CO 3+CO 2↑+H 2O ΔNa 2CO 3+CO 2+H 2O=2NaHCO 3CO 2+2NaOH=Na 2CO 3+H 2O Na 2CO 3+CO 2+H 2O=2NaHCO 3 过量CO 2通入Ca(OH)2 CO 2+CaCO 3+H 2O=Ca(HCO 3)2 Ca(HCO 3)2= CO 2↑+CaCO 3+H 2O ΔFe 2O 3+3CO=2Fe+3CO 2 高温4Fe(OH)2+O 2+2H 2O=4Fe(OH)32FeCl 2+Cl 2=2FeCl 3 →2Fe 2++Cl 2=2Fe 3++2Cl -2FeCl 3+Fe=3FeCl 2 →2Fe 3++Fe=3Fe 2+2FeCl 3+Cu=2FeCl 2+CuCl 2→2Fe 3++Cu=2Fe 2++Cu 2+溶洞 制备. NaHCO3+BaCl2 不反应C+H2O(g)=CO+H2 高温N2+O2===2NO 放电N2+3H2===2NH3高温、高压、催化剂2NO+O2=2NO23NO2+H2O=2HNO3+NONH3+H2O===NH3·H2ONH3·H2O===NH4++OH-NH3+HCl=NH4Cl4NH3+5O2=4NO+6H2O 高温催化剂NH4HCO3=NH3↑+CO2↑+H2OΔNH4Cl=NH3↑+HCl↑ΔNH4++OH-=NH3↑+H2OΔ2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2OΔ4HNO3=4NO2↑+O2↑+2H2O 受热或见光4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O3Cu +8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O4HNO3(浓)+C=CO2↑+4NO2↑+2H2OΔFe+S=FeS ΔS+O2=SO2点燃3S+6NaOH=2Na2S+Na2SO3+3H2OΔS+2KNO3+3C=K2S+3CO2↑+N2↑2SO2+O2===2SO3催化剂ΔSO2+2H2S=3S↓+2H2O2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2OΔ制SO22H2SO4(浓)+C=2SO2↑+CO2↑+2H2OΔSO2+Ca(OH)2=CaSO3↓+H2OSO2+Cl2+2H2O=H2SO4+2HCl2SO2+O2===2SO3粉尘等催化SO3+H2O=H2SO4SO2+H2O===H2SO32H2SO3+O2=2H2SO4Mg+2H+(盐酸、稀硫酸)=Mg2++H2↑3Mg+N2=Mg3N2点燃2Mg+CO2=2MgO+C点燃2Br-+Cl2=Br2+2Cl-Si+O2=SiO2ΔSiO2+2C=Si+2CO↑高温Si+2F2=SiF4Si+4HF=SiF4+2H2Si+2NaOH+H2O=Na2SiO3(黏合剂)+2H2↑SiO2+2NaOH=Na2SiO3+H2O 玻璃与烧碱反应SiO2+CaO=CaSiO3高温SiO2+4HF=SiF4↑+2H2O3+SiO2=CaSiO3+CO2↑高温.Na2CO3+SiO2=Na2SiO3+CO2↑高温工业制玻璃4Al+3O2=2Al2O3点燃2Al+Fe2O3=Al2O3+2Fe高温2Al+6HCl=2AlCl3+3H2↑2Al+2NaOH+6H2O=2Na[Al(OH)4] 四羟基合铝酸钠+3H2↑AlCl3+3NH3·H2O=Al(OH)3↓+3NH4ClAl(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=[Al(OH)4]-Al2O3+6H+=2Al3++3H2OAl2O3+2OH-+3H2O=2[Al(OH)4]-四羟基合铝酸钠离子2Cu+O2+H2O+CO2=Cu2(OH)2CO3 碱式碳酸铜Cu+O2=2CuOΔ2Cu+S=Cu2SΔ4CuO=2Cu2O+O2↑高温CuSO4·5H2O=CuSO4+5H2O↑ΔAl3++3OH-=Al(OH)3↓[Al(OH)4]-+H+=H2O+Al(OH)3↓。
新版鲁科高中化学必修第一册化学方程式总结

51.氢氧化亚铁在空气中转化为氢氧化铁的反应方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
现象:白色沉淀会迅速变为灰绿色,最后变为红褐色
第二节
52.硫在空气中燃烧
53.二氧化硫转化为三氧化硫
54.三氧化硫与水反应
55.二氧化硫与水反应
56.硫与铁在加热时反应
57.SO2与H2S反应
58.SO2与碱反应
59.浓硫酸与碳在加热时反应
60.浓硫酸与铜在加热时反应
61.黄铁矿燃烧的反应
62.钙基固硫
第三节
63.闪电固氮,N2+O2 2NO
64.工业上合成氨
65.氨气的催化氧化
66.一氧化氮与氧气混合制硝酸
67.氨气与水反应
68.氨气与酸反应 ,
69.氨气与氧气反应点燃
70.氨气的实验室制法
第三节无方程式
微项目
18.碳酸氢钠受热分解2NaHCO3 Na2CO3+H2O+CO2↑
19.碳酸氢钠与稀盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑
20.碳酸氢钠与氢氧化钠发反应NaHCO3+NaOH=Na2CO3+H2O
21.碳酸氢钠与氢氧化钙反应
石灰水中加入少量NaHCO3Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
31.
32.
微项目
33.84消毒液的制备
34.84消毒液在空气中变质
35.次氯酸见光易分解
36.84消毒液不与洁厕灵一起使用的原因
37.漂白粉的制备
第2章物质的性质与转化
第一节
鲁科版高一化学有机化学方程式汇总

1、乙烯使溴水褪色
2、乙烯与氯化氢在一定条件下反应
3、苯的硝化反应
4、乙醇的催化氧化
5、乙酸与乙醇的酯化反应
6、乙酸乙酯在稀硫酸中水解
7、乙酸乙酯在NaOH溶液中水解
8、乳酸()与钠反应
9、硬脂酸甘油酯在NaOH溶液中水解
10、甲烷与氯气在光照下生成二氯甲烷
1、丙烯使溴水褪色
2、乙烯与水在一定条件下反应
3、TNT的制备
4、丙醇(CH
3CH
2
CH
2
OH)的催化氧化
5、甲酸与乙醇的酯化反应
6、甲酸甲酯在稀硫酸中水解
7、乙酸甲酯在NaOH溶液中水解
8、乳酸()与钠反应
9、硬脂酸甘油酯在NaOH溶液中水解
10、甲烷与氯气在光照下生成氯仿
1、甲烷的燃烧方程式
2、乙烯的燃烧方程式
3、苯的燃烧方程式
4、乙醇的燃烧方程式
5、乙醛与新制Cu(OH)
悬浊液混合煮沸
2
6、乙酸与饱和碳酸钠溶液混合
7、甲苯的硝化反应
8、硬脂酸与甘油在浓硫酸中加热
在一定条件下反应
9、乙烯与H
2
10、苯与H
在一定条件下反应
2
1、乙烯使溴水褪色
2、由乙烷制备氯乙烷
3、由乙烯制备氯乙烷
4、乙酸与乙醇的酯化反应
5、乙酸乙酯的酸性水解
6、苯的硝化反应
在一定条件下反应
7、丙烯与H
2
8、葡萄糖与新制Cu(OH)
悬浊液反应
2
9、甲烷与氯气光照下生成一氯甲烷
10、乙酸乙酯在NaOH溶液中水解。
鲁科版高中化学必修知识点总结
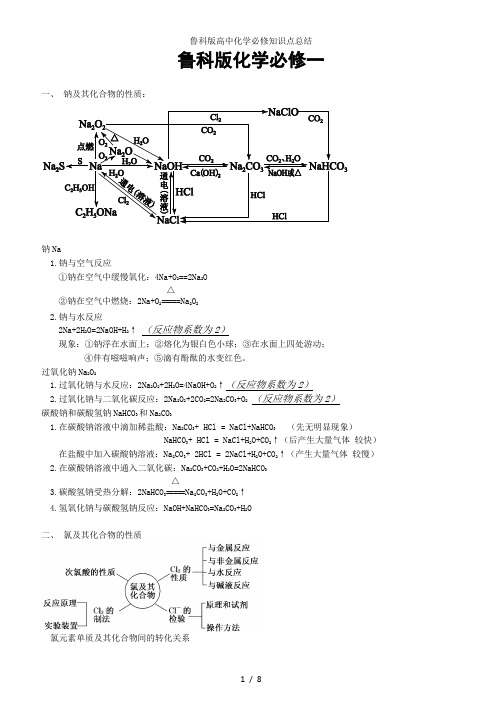
鲁科版化学必修一一、 钠及其化合物的性质:钠Na1.钠与空气反应①钠在空气中缓慢氧化:4Na+O 2==2Na 2O②钠在空气中燃烧:2Na+O 2=====△Na 2O 22.钠与水反应2Na+2H 2O=2NaOH+H 2↑ (反应物系数为2)现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
过氧化钠Na 2O 21.过氧化钠与水反应:2Na 2O 2+2H 2O=4NaOH+O 2↑(反应物系数为2)2.过氧化钠与二氧化碳反应:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 (反应物系数为2)碳酸钠和碳酸氢钠NaHCO 3和Na 2CO 31.在碳酸钠溶液中滴加稀盐酸:Na 2CO 3+ HCl = NaCl+NaHCO 3 (先无明显现象)NaHCO 3+ HCl = NaCl+H 2O+CO 2↑(后产生大量气体 较快)在盐酸中加入碳酸钠溶液:Na 2CO 3+ 2HCl = 2NaCl+H 2O+CO 2↑(产生大量气体 较慢)2.在碳酸钠溶液中通入二氧化碳:Na 2CO 3+CO 2+H 2O=2NaHCO 33.碳酸氢钠受热分解:2NaHCO 3=====△Na 2CO 3+H 2O+CO 2↑4.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO 3=Na 2CO 3+H 2O二、 氯及其化合物的性质氯气Cl 21.与金属单质铁丝在氯气中燃烧:2Fe+3Cl 2=====点燃2FeCl 3 (剧烈燃烧 红棕色烟)铜丝在氯气中燃烧:Cu+Cl 2=====点燃CuCl 2(剧烈燃烧 棕黄色烟)2.与非金属单质氢气在氯气中燃烧:H 2+Cl 2=====点燃2HCl (苍白色火焰 产生白雾)3.氯气与水的反应Cl 2+H 2O=HClO+HCl4.氯气与氢氧化钠的反应Cl 2+2NaOH=NaCl+NaClO+H 2O (氯气的尾气处理)5.制取漂白粉(氯气能通入石灰浆)2Cl 2+2Ca(OH)2=CaCl 2+Ca (ClO )2+2H 2O CaCl 2和Ca (ClO )2叫漂白粉漂白粉在空气中变质:Ca(ClO)2+CO 2+H 2O=CaCO 3↓+2HClO三、 以物质的量为中心的物理量关系1.物理量-物质的量 单位-摩尔(mol )①n= N/N AN 代表微粒个数 N A 阿伏加德罗常数 N A ≈6.02×1023 mol -12.物质的摩尔质量M②n= m/MM 代表物质质量 M 为摩尔质量,数值上等于该物质的相对原子质量或相对分子质量,单位g •mol -1V为气体体积,单位是升(L) Vm是气体摩尔体积,标准状况下,1 mol气体为22.4 L Vm温度、压强一定时为定值,Vm单位为L•mol-14.溶液中溶质的物质的量浓度c④n=cVC为溶液中溶质的物质的量浓度,单位为mol• L -1 V为溶液体积,单位是升(L)四、胶体:1.定义:分散质粒子直径介于1-100nm之间的分散系。
鲁科版化学必修1、必修2化学反应方程式集锦(一)

必修1、必修2化学反应方程式(一)1.1. 钠在空气中燃烧(黄色的火焰)钠在空气中燃烧(黄色的火焰) 2Na + O2Na 2O 22.2. 钠与水反应(浮、熔、游、响、红)钠与水反应(浮、熔、游、响、红) 2Na + 2H2O = 2NaOH + H 2↑3.3. 过氧化钠与水的反应过氧化钠与水的反应 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑4.4. 过氧化钠可用在呼吸面具和潜水艇中作为氧气来源过氧化钠可用在呼吸面具和潜水艇中作为氧气来源 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2 5.5. 氯化铵溶液与氢氧化钠溶液混合加热氯化铵溶液与氢氧化钠溶液混合加热 NH 4Cl + NaOH △NH 3↑+ NaCl + H 2O6.6. 氯化铵溶液中滴加硝酸银溶液氯化铵溶液中滴加硝酸银溶液 NH 4Cl + AgNO 3 === AgCl ↓ + NH 4NO 37.7. 硫酸铵溶液中滴加氯化钡溶液硫酸铵溶液中滴加氯化钡溶液 (NH 4)2SO 4 + BaCl 2 === BaSO 4↓+ 2NH 4Cl8.8. 铜丝在氯气中剧烈燃烧(棕色烟)铜丝在氯气中剧烈燃烧(棕色烟) Cu + Cl 2点燃点燃CuCl 2 9.9. 铁在氯气中剧烈燃烧铁在氯气中剧烈燃烧 2Fe + 3Cl 2点燃点燃3FeCl 3 10.10.氢气在氯气中燃烧或在光照条件下爆炸氢气在氯气中燃烧或在光照条件下爆炸H 2 + Cl 2 点燃点燃2HCl 、H 2 + Cl 2 2HCl 11.11.氯气溶于水氯气溶于水氯气溶于水 Cl 2 + H2O HCl + HClO 12.12.氯气的尾气处理氯气的尾气处理氯气的尾气处理 2NaOH + Cl 2 ===NaClO + NaCl + H 2O 13.13.工业制漂白粉的原理及漂白粉的失效工业制漂白粉的原理及漂白粉的失效工业制漂白粉的原理及漂白粉的失效2Ca(OH)2 + 2Cl 2 ===Ca(ClO)2 + CaCl 2 + 2H 2O Ca(ClO)2 + CO 2 + H 2O =CaCO 3↓ + 2HClO 2HClO 2HCl + O 2↑14.14.氯气的实验室制法氯气的实验室制法氯气的实验室制法 MnO 2 + 4HCl(浓) MnCl 2 +Cl 2↑+ 2H 2O15.15.新制氯水注入盛溴化钠溶液的试管中新制氯水注入盛溴化钠溶液的试管中新制氯水注入盛溴化钠溶液的试管中 Cl 2 + 2NaBr = Br 2 + 2NaCl 16.16.新制氯水注入盛碘化钾溶液的试管中新制氯水注入盛碘化钾溶液的试管中新制氯水注入盛碘化钾溶液的试管中 Cl 2 + 2KI = I 2 + 2KCl 17.17.溴水与碘化钾溶液反应溴水与碘化钾溶液反应溴水与碘化钾溶液反应 Br 2+ 2KI = I 2 + 2KBr18.18.溴化钠溶液与硝酸银溶液反应溴化钠溶液与硝酸银溶液反应溴化钠溶液与硝酸银溶液反应 NaBr + AgNO 3 = AgBr ↓+ NaNO 3 19.19.碘化钠溶液与硝酸银溶液反应碘化钠溶液与硝酸银溶液反应碘化钠溶液与硝酸银溶液反应 NaI + AgNO 3 = AgI ↓ + NaNO 320.20.电解氯化钠溶液电解氯化钠溶液电解氯化钠溶液 2NaCl +2 H 2O 2NaOH + H 2↑ + Cl 2↑(氯碱工业) 21.21.电解熔融氯化钠电解熔融氯化钠电解熔融氯化钠 2NaCl 2Na + Cl 2↑ 22.22.钠放置在空气中钠放置在空气中钠放置在空气中 2Na + O 2=== Na 2O 23.23.铁与盐酸反应铁与盐酸反应铁与盐酸反应 Fe + 2HCl = FeCl 2 + H 2↑24.24.氧化铁溶于盐酸中氧化铁溶于盐酸中氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 25.25.三价铁离子的检验三价铁离子的检验三价铁离子的检验 Fe 3++3SCN -===Fe(SCN)326.26.氯化铁中滴入氢氧化钠溶液(红褐色沉淀)氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl 3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl 27.27.氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)4Fe (OH)2 + O 2 + 2H 2O = 4Fe (OH)328.28.氯化亚铁溶液中通入氯气氯化亚铁溶液中通入氯气氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 2 Fe 2+ + Cl 2 = 2 Fe 3+ + 2Cl - 29.29.氯化铁溶液中加入铁粉氯化铁溶液中加入铁粉氯化铁溶液中加入铁粉 2FeCl 3 + Fe = 3FeCl 2 2Fe 3+ + Fe = 3Fe2+通电通电通电通电光照光照 光照光照30.30.氯化铁溶液中加入铜粉氯化铁溶液中加入铜粉 2Fe 3+ + Cu = 2Fe 2++Cu2+ 31.31.盐酸中滴加纯碱溶液盐酸中滴加纯碱溶液盐酸中滴加纯碱溶液 Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑ 32.32.小苏打与盐酸反应小苏打与盐酸反应小苏打与盐酸反应 NaHCO 3 + HCl = NaCl + H 2O + CO 2↑33.33.小苏打氢氧化钠溶液小苏打氢氧化钠溶液小苏打氢氧化钠溶液 NaHCO 3 + NaOH = Na 2CO 3 + H 2O 34.34.小苏打受热分解小苏打受热分解小苏打受热分解 2NaHCO 3△Na 2CO 3 + H 2O +CO 2 ↑35.35.碳酸钠溶液与石灰水反应碳酸钠溶液与石灰水反应碳酸钠溶液与石灰水反应 Na 2CO 3 + Ca (O H)2 =CaCO 3 ↓+2NaOH 36.36.碳酸钠溶液与氯化钡溶液反应碳酸钠溶液与氯化钡溶液反应碳酸钠溶液与氯化钡溶液反应 Na 2CO 3 + Ba C l 2 =BaCO 3 ↓+2NaCl 37.37.碳酸钠溶液中通入二氧化碳碳酸钠溶液中通入二氧化碳碳酸钠溶液中通入二氧化碳 Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3 38.38. 醋酸电离醋酸电离 CH 3COOHCH 3COO - + H+ 一水合氨电离NH 3·H 2O NH 4+ + OH – 39.氮气和氢气反应(工业合成氨)氮气和氢气反应(工业合成氨) N 2 + 3H 2催化剂催化剂高温高压高温高压 2NH 340.雷雨发庄稼雷雨发庄稼 N 2 + O 2 2NO 2NO + O 22NO 23NO 2 + H 2O 2HNO 3 + NO 41.汽车尾气处理(催化转化)汽车尾气处理(催化转化) 2CO+2NO 催化剂催化剂N 2+2CO 242.氨溶于水氨溶于水 NH 3+H 2ONH 3·H 2ONH 4+ + OH -43.43.氨的催化氧化氨的催化氧化氨的催化氧化 4NH 3 +5O 2 4NO + 6H 2O44. 碳酸氢铵受热分解碳酸氢铵受热分解 NH 4HCO 3△NH 3 ↑+ H 2O ↑ + CO 2 ↑45.45.氯化铵固体和氢氧化钙固体实验室制取氨氯化铵固体和氢氧化钙固体实验室制取氨氯化铵固体和氢氧化钙固体实验室制取氨 2NH 4Cl+Ca(OH)2 △CaCl 2+2H 2O+2NH 3↑46.46.用浓盐酸检验氨气(白烟生成)用浓盐酸检验氨气(白烟生成)用浓盐酸检验氨气(白烟生成) HCl + NH 3 = NH 4Cl 47.47.氨气通入到硫酸中氨气通入到硫酸中氨气通入到硫酸中 H 2SO 4+ 2NH 3 = (NH 4)2SO 4 48.48.硝酸铵溶液与氢氧化钠溶液混合(不加热)硝酸铵溶液与氢氧化钠溶液混合(不加热)硝酸铵溶液与氢氧化钠溶液混合(不加热) NH 4NO 3 + NaOH = NH 3·H 2O + NaNO 3 49.49.浓硝酸见光或加热分解浓硝酸见光或加热分解浓硝酸见光或加热分解 4HNO 3 O 2 ↑ + 2H 2O + 4NO 2 ↑ 50.50.铜与浓硝酸反应铜与浓硝酸反应铜与浓硝酸反应 Cu+4HNO 3(浓)= Cu(NO 3)2+ 2H 2O + 2NO 2 ↑ 51.51.铜与稀硝酸反应铜与稀硝酸反应铜与稀硝酸反应 3Cu+8HNO 3(稀)= 3Cu(NO 3)2+ 4H 2O + 2NO ↑ 52.52.碳与浓硝酸反应碳与浓硝酸反应碳与浓硝酸反应 C+4HNO 3= CO 2 ↑ + 2H 2O + 4NO 2 ↑ 53.53.铁与硫加热反应铁与硫加热反应铁与硫加热反应 Fe + S FeS54.54.汞和硫磺反应汞和硫磺反应汞和硫磺反应 Hg+S ===HgS 55.55.硫酸型酸雨的形成过程硫酸型酸雨的形成过程硫酸型酸雨的形成过程 SO 2 + H 2O H 2SO 3 2H 2SO 3+O 2 ====== 2 2H 2SO 4 2SO 2+O 22SO 3 SO 3+H 2O ======H H 2SO 456.56.石灰石—石膏法脱硫的原理石灰石—石膏法脱硫的原理石灰石—石膏法脱硫的原理 SO 2 +Ca(OH)2 ===CaSO 3 +H 2O 2CaSO 3+O 2=== 2CaSO 4 57.57.氨水法脱硫的原理氨水法脱硫的原理氨水法脱硫的原理 SO 2 +2NH 3+H 2O ===(NH 4)2SO 3 SO 2 +NH 3+H 2O ===NH 4HSO 3 2(NH 4)2SO 3+O 2====== 2(NH 4)2SO 4 58.58.工业制备硫酸工业制备硫酸4FeS 2+11O 2===2 Fe 2O 3+8SO 2 2SO 2+O 2催化剂催化剂加热加热2SO 3 SO 3+H 2O ======H H 2SO 4放电放电光照光照59.59.铜与浓硫酸反应:铜与浓硫酸反应:铜与浓硫酸反应: Cu + 2H 2SO 4 (浓) CuSO 4 + 2H2O+SO 2 ↑ 60.碳与浓硫酸反应:碳与浓硫酸反应: C + 2H 2SO4(浓)2H 2O+CO 2↑+2SO 2↑61.亚硫酸钠与浓硫酸反应制备二氧化硫亚硫酸钠与浓硫酸反应制备二氧化硫 Na 2SO 3 +H 2SO 4 (浓)===Na 2SO 4+H 2O+SO 2 ↑ 62. 亚硫酸钠被空气中的氧气氧化亚硫酸钠被空气中的氧气氧化 2Na 2SO 3+O 2=== 2Na 2SO 4 63.硫化亚铁与稀硫酸反应制备硫化氢硫化亚铁与稀硫酸反应制备硫化氢 FeS+H 2SO 4===FeSO 4+H 2S ↑ 64.硫化氢气体通入氯水硫化氢气体通入氯水 H 2S+Cl 2 ======22HCl+S ↓65.65.氯化镁溶液与石灰水反应氯化镁溶液与石灰水反应氯化镁溶液与石灰水反应 MgCl 2 + Ca(OH)2 === Mg(OH)2↓+ CaCl 2 66.66.氢氧化镁与盐酸反应氢氧化镁与盐酸反应氢氧化镁与盐酸反应 Mg(OH)2+2HCl =MgCl 2+2H 2O 67.67.电解熔融的氯化镁电解熔融的氯化镁电解熔融的氯化镁 MgCl 2 电解电解Mg+Cl 2↑68.68.镁在空气中燃烧镁在空气中燃烧2Mg+O 2点燃点燃2MgO 3Mg+N 2 点燃点燃Mg 3N 2 2Mg+CO 2点燃点燃2MgO+C 69.69.镁与盐酸反应镁与盐酸反应镁与盐酸反应 Mg+2HCl =MgCl 2+H 2↑ 70.70.氧化铝电解氧化铝电解氧化铝电解 2Al 2O 3 Al + 3O 2↑71.71.氧化铝溶于盐酸氧化铝溶于盐酸氧化铝溶于盐酸 Al 2O 3 + 6HCl 2AlCl 3 +3H 2O72.72.氧化铝溶于氢氧化钠溶液氧化铝溶于氢氧化钠溶液氧化铝溶于氢氧化钠溶液 Al 2O 3 + 2NaOH 2NaAlO 2 +H 2O73.73.氢氧化铝溶液中加盐酸氢氧化铝溶液中加盐酸氢氧化铝溶液中加盐酸 Al(OH)3 + 3HCl = AlCl 3 + 3H 2O 74.Al(OH)3与NaOH 溶液反应:溶液反应: Al(OH)3 + NaOH NaAlO 2 +2 H 2O 75.75.铝箔在氧气中剧烈燃烧铝箔在氧气中剧烈燃烧铝箔在氧气中剧烈燃烧 4Al + 3O 2 点燃点燃2Al 2O 3 76.76.铝离子与水反应生成氢氧化铝胶体铝离子与水反应生成氢氧化铝胶体铝离子与水反应生成氢氧化铝胶体 Al 3++3H 2OAl(OH)3(胶体)+3H +77.77.铝片与稀盐酸反应铝片与稀盐酸反应铝片与稀盐酸反应 2Al + 6HCl = 2AlCl 3 + 3H 2↑78.78.铝与氢氧化钠溶液反应铝与氢氧化钠溶液反应铝与氢氧化钠溶液反应 2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑79.79.铝与三氧化二铁高温下反应(铝热反应)铝与三氧化二铁高温下反应(铝热反应)铝与三氧化二铁高温下反应(铝热反应) 2Al + Fe 2O 3 高温高温2Fe + Al 2O 380.80. 硫酸铝溶液中滴过量氨水硫酸铝溶液中滴过量氨水 Al 2(SO 4)3 +6NH 3·H 2O = 2Al(OH)3↓+ 3(NH 4)2SO 4 补充:81.81.氯化氢气体的实验室制法氯化氢气体的实验室制法氯化氢气体的实验室制法 82.82.氯气、二氧化硫同时通入水中氯气、二氧化硫同时通入水中氯气、二氧化硫同时通入水中83.83.硫化氢与硫酸铜、醋酸铅、硝酸银、硝酸汞反应硫化氢与硫酸铜、醋酸铅、硝酸银、硝酸汞反应硫化氢与硫酸铜、醋酸铅、硝酸银、硝酸汞反应 84.84.碳酸钠溶液中逐滴加入盐酸碳酸钠溶液中逐滴加入盐酸碳酸钠溶液中逐滴加入盐酸85.85.氨气与二氧化碳通入饱和氯化钠溶液中(侯式制碱法)氨气与二氧化碳通入饱和氯化钠溶液中(侯式制碱法)氨气与二氧化碳通入饱和氯化钠溶液中(侯式制碱法) 86.86.偏铝酸钠溶液中通入二氧化碳气体偏铝酸钠溶液中通入二氧化碳气体偏铝酸钠溶液中通入二氧化碳气体 87.87.氯化铵受热分解(有类似升华现象)氯化铵受热分解(有类似升华现象)氯化铵受热分解(有类似升华现象) 88.88.银氨溶液的制备银氨溶液的制备银氨溶液的制备89.89.氯化铁与硫化氢、硫化钠、氢碘酸、碘化钾溶液反应氯化铁与硫化氢、硫化钠、氢碘酸、碘化钾溶液反应氯化铁与硫化氢、硫化钠、氢碘酸、碘化钾溶液反应 90.90.氯气通入溴化亚铁、碘化亚铁溶液中氯气通入溴化亚铁、碘化亚铁溶液中氯气通入溴化亚铁、碘化亚铁溶液中 91.91.玻璃制取的反应玻璃制取的反应玻璃制取的反应通电通电。
鲁科版化学必修一方程式汇总

化学必修1方程式汇总1、钠在空气中燃烧:2Na + O 2Na 2O 22、 钠与氧气反应:4Na + O 2 = 2Na 2O*3、过氧化钠与水反应:2Na 2O 2+ 2H 2O = 4NaOH + O 2↑(供氧剂) 4、过氧化钠与二氧化碳反应:2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2 *5、钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑ 6、氯气与金属铁反应:2Fe + 3Cl 22FeCl 3 7、氯气与金属铜反应:Cu + Cl 2CuCl 2 8、氯气与金属钠反应:2Na + Cl 22NaCl 9、 氯气与氢气反应:H 2 + Cl2 2HCl*10、氯气与水反应:Cl 2 + H 2O HCl + HClO 11、次氯酸光照分解:2HClO2HCl + O 2↑*12、氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH = NaCl + NaClO + H 2OCl 2 + 2OH - =Cl - + ClO - + H 2O (氯气尾气处理) *13、氯气与消石灰反应:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O (制漂白粉) 14、漂白粉长期置露在空气中失效:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO 2HClO2HCl + O 2↑*15、碳酸钠与盐酸反应:Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑(盐酸足量),CO 32- +2H +=H 2O+CO 2↑ Na 2CO 3 + HCl = NaCl + NaHCO 3(盐酸不足),CO 32- +H +=HCO 3-*16、碳酸氢钠与盐酸反应: NaHCO 3 + HCl = NaCl + H 2O + CO 2↑,HCO 3- +H +=H 2O+CO 2↑ *17、碳酸氢钠与氢氧化钠反应: NaHCO 3 + NaOH = Na 2CO 3 + H 2O ,HCO 3- +OH -=H 2O+ CO 32- 18、碳酸氢钠受热分解:2NaHCO 3Na 2CO 3+ H 2O + CO 2↑19、.炽热的木炭与二氧化碳反应:CO 2+C2CO20、木炭还原氧化铜: 2CuO + C 2Cu + CO 2↑21、CuO + COCu + CO 2↑(用于除去CO 2气体中的CO )△、溶洞的形成:CaCO 3+CO 2+H 2O=Ca(HCO 3)2 Ca(HCO 3)2CaCO 3↓+CO 2↑+H 2O22、氮气与氧气在放电下反应:N 2 + O 22NO23、一氧化氮与氧气反应:2NO + O 2 = 2NO 2雷雨发庄稼的原理 24、二氧化氮与水反应:3NO 2 + H 2O = 2HNO 3 + NO 25、工业合成氨:N 2+3H 22NH 3 26、氨气易溶于水:NH 3+H 2ONH 3·H 2O*27、氨气与酸反应:NH 3+HCl=NH 4Cl 28、氨的催化氧化:4NH 3+5O 24NO +6H 2O 29、氯化铵受热分解:NH 4ClNH 3↑ + HCl↑30、碳酸氢氨受热分解:NH 4HCO 3NH 3↑ + H 2O↑ + CO 2↑*31、硝酸铵与氢氧化钠反应:NH 4NO 3 + NaOH NH 3↑ + NaNO 3 + H 2O 32、氨气的实验室制取:2NH 4Cl + Ca(OH)2CaCl 2 + 2H 2O + 2NH 3 ↑*33、浓硝酸与铜反应:Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2H 2O + 2NO 2↑ Cu + 4H + + 2NO 3- = Cu 2+ + 2H 2O + 2NO 2↑ *34、稀硝酸与铜反应:3 Cu + 8HNO 3(稀) =3Cu(NO 3)2 + 4H 2O + 2NO↑ 3Cu + 8H + + 2NO 3- = 3Cu 2+ + 4H 2O + 2NO 2↑ 35、浓硝酸与木炭反应:C + 4HNO 3(浓) CO 2 ↑+ 4NO 2↑ + 2H 2O36、硫与金属铁反应:Fe + SFeS37、二氧化硫与氧气在催化剂的作用下反应:2SO 2 + O 2 2SO 338、二氧化硫与水反应:SO 2 + H 2OH 2SO 3 酸雨的形成39、三氧化硫与水反应:SO 3 + H 2O = H 2SO 4 40、亚硫酸氧化成硫酸:2H 2SO 3+O 2=2H 2SO 441、酸性氧化物和碱性氧化物反应:SO2 + CaO = CaSO3*42、二氧化硫尾气处理:SO2 + 2NaOH = Na2SO3 + H2O*43、工业除二氧化硫:SO2 + Ca(OH)2 = CaSO3↓ + H2O*44、二氧化硫的还原性:SO2 + Cl2 + 2H2O = 2HCl + H2SO445、二氧化硫(的氧化性)与硫化氢反应:SO2 + 2H2S =3S↓+2H2O*46、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑47、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O*48、电解饱和食盐水制氯气(氯碱工业):2NaCl+2H2O 2NaOH+H2↑+Cl2↑49、镁与二氧化碳反应:2Mg+CO22MgO+C50、硅与氧气的反应:Si+O 2SiO251、硅与F2的反应:Si + 2F2 = SiF452、硅与氢氧化钠溶液的反应:Si + 2NaOH + H2O = Na2SiO3 +2H2↑53、粗硅的制取:SiO2 + 2CSi + 2CO54、粗硅提纯:Si(粗)+ 2Cl2SiCl4SiCl4 + 2H2Si(纯)+ 4HCl55、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O56、硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑57、二氧化硅与氧化钙高温反应:SiO2 + CaO =CaSiO3*58、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3+ H2O*59、硅酸钠溶液中通入少量二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓*60、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓61、铝热反应:2Al+Fe2O3Al2O3+2Fe*62、铝与氢氧化钠溶液反应:2Al + 2NaOH + 6H2O = 2Na[Al(OH)4]+ 3H2↑2Al + 2OH- + 6H2O = 2[Al(OH)4]-+ 3H2↑*63、氧化铝与盐酸反应:Al2O3+ 6HCl = 2AlCl3 + 3H2O*64、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]*65、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O*66、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = Na[Al(OH)4]*67、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4四羟基合铝酸钠与二氧化碳反应:2Na[Al(OH)4] + CO2 =2Al(OH)3↓+ Na2CO3+ H2O(二氧化碳若过量则生成NaHCO3)68、氢氧化铝加热分解:2Al(OH)3Al2O3 + 3H2O (氢氧化镁和氢氧化铁加热分解类似)*69、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2,2Fe3+ + Fe = 3Fe2+*70、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3*71、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3+ 3H2O*72、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl*73、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO474、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+ 2H2O + O2 = 4Fe(OH)375、铜生锈:2Cu+O2+H2O+ CO2 =Cu2(OH)2CO3(根据反应条件和铜锈的名称“碱式碳酸铜”去记忆方程式)76、铜与氧气的反应:2Cu+O 22CuO77、铜与硫的反应:2Cu+S2Cu2S78、制造印刷线路板:2FeCl3 + Cu = 2FeCl2 + CuCl2 2Fe3+ + Cu = 2Fe2+ + Cu2+79、SO42-检验:SO42- + Ba2+ = BaSO4↓80、Cl-检验:Cl- + Ag+ = AgCl↓81、CO32-检验:CO32- +2H+=H2O+CO2↑,CO32- + Ca2+ + =CaCO3↓,CO2 + Ca2+ + 2OH- =CaCO3↓82、NH4+检验:NH4+ + OH- = NH3↑+ H2O。
鲁科版高中化学必修一知识点总结

高一化学模块I主要知识及化学方程式一、研究物质性质的方法和程序1.根本方法:观察法、实验法、分类法、比拟法2.根本程序:第三步:用比拟的方法对观察到的现象进展分析、综合、推论,概括出结论。
二、钠及其化合物的性质:1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na+O2点燃====Na2O23.钠与水反响:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4.过氧化钠与水反响:2Na2O2+2H2O=4NaOH+O2↑5.过氧化钠与二氧化碳反响:2Na2O2+2CO2=2Na2CO3+O26.碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑7.氢氧化钠与碳酸氢钠反响:NaOH+NaHCO3=Na2CO3+H2O8.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3三、氯及其化合物的性质1.氯气与氢氧化钠的反响:Cl2+2NaOH=NaCl+NaClO+H2O2.铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl33.制取漂白粉〔氯气能通入石灰浆〕2Cl2+2Ca〔OH〕2=CaCl2+Ca〔ClO〕2+2H2O 4.氯气与水的反响:Cl2+H2O=HClO+HCl5.次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO6.次氯酸钙在空气中变质:Ca〔ClO〕2+CO2+H2O=CaCO3↓+2HClO四、以物质的量为中心的物理量关系1.物质的量n〔mol〕= N/N(A)2.物质的量n〔mol〕= m/M3.标准状况下气体物质的量n〔mol〕= V/V(m)4.溶液中溶质的物质的量n〔mol〕=cV五、胶体:1.定义:分散质粒子直径介于1~100nm之间的分散系。
2.胶体性质:①丁达尔现象②聚沉③电泳④布朗运动3.胶体提纯:渗析六、电解质和非电解质1.定义:①条件:水溶液或熔融状态;②性质:能否导电;③物质类别:化合物。
高中化学方程式全集(配鲁科版)

一、非金属单质(F2 ,Cl2 、O2 、S、N2 、P 、 C 、Si)1.氧化性:F2 + H2 === 2HFF2 + Xe(过量) === XeF22F2(过量) + Xe === XeF4nF2 + 2M === 2MFn (表示大部分金属)2F2 + 2H2O === 4HF + O22F2 + 2NaOH === 2NaF + OF2 + H2OF2 + 2NaCl === 2NaF + Cl2F2 + 2NaBr === 2NaF + Br2F2 + 2NaI === 2NaF + I2F2 + Cl2(等体积) === 2ClF3F2 (过量) + Cl2 === 2ClF37F2(过量) + I2 === 2IF7Cl2 + H2 === 2HCl3Cl2 + 2P === 2PCl3Cl2 + PCl3 === PCl5Cl2 + 2Na === 2NaCl3Cl2 + 2Fe === 2FeCl3Cl2 + 2FeCl2 === 2FeCl3Cl2 + Cu === CuCl22Cl2 + 2NaBr === 2NaCl + Br2Cl2 + 2NaI === 2NaCl + I25Cl2 + I2 + 6H2O === 2HIO3 + 10HClCl2 + Na2S === 2NaCl + SCl2 + H2S === 2HCl + SCl2 + SO2 + 2H2O === H2SO4 + 2HClCl2 + H2O2 === 2HCl + O22O2 + 3Fe === Fe3O4O2 + K === KO2S + H2 === H2S2S + C === CS2S + Fe === FeSS + 2Cu === Cu2S3S + 2Al === Al2S3S + Zn === ZnSN2 + 3H2 === 2NH3N2 + 3Mg === Mg3N2N2 + 3Ca === Ca3N2N2 + 3Ba === Ba3N2N2 + 6Na === 2Na3NN2 + 6K === 2K3NN2 + 6Rb === 2Rb3NP2 + 6H2 === 4PH3P + 3Na === Na3P2P + 3Zn === Zn3P22.还原性S + O2 === SO2S + O2 === SO2S + 6HNO3(浓) === H2SO4 + 6NO2 + 2H2O3S + 4HNO3(稀) === 3SO2 + 4NO + 2H2ON2 + O2 === 2NO4P + 5O2 === P4O10(常写成P2O5)2P + 3X2 === 2PX3 (X表示F2,Cl2,Br2)PX3 + X2 === PX5P4 + 20HNO3(浓) === 4H3PO4 + 20NO2 + 4H2OC + 2F2 === CF4C + 2Cl2 === CCl42C + O2(少量) === 2COC + O2(足量) === CO2C + CO2 === 2COC + H2O === CO + H2(生成水煤气)2C + SiO2 === Si + 2CO(制得粗硅)Si(粗) + 2Cl2 === SiCl4(SiCl4 + 2H2 === Si(纯) + 4HCl)Si(粉) + O2 === SiO2Si + C === SiC(金刚砂)Si + 2NaOH + H2O === Na2SiO3 + 2H23(碱中)歧化Cl2 + H2O === HCl + HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2 + 2NaOH === NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O3Cl2 + 6KOH(热浓) === 5KCl + KClO3 + 3H2O3S + 6NaOH === 2Na2S + Na2SO3 + 3H2O4P + 3KOH(浓) + 3H2O === PH3 + 3KH2PO211P + 15CuSO4 + 24H2O === 5Cu3P + 6H3PO4 + 15H2SO4 3C + CaO === CaC2 + CO3C + SiO2 === SiC + 2CO二、金属单质(Na,Mg,Al,Fe)的还原性2Na + H2 === 2NaH4Na + O2 === 2Na2O2Na2O + O2 === 2Na2O22Na + O2 === Na2O22Na + S === Na2S(爆炸)2Na + 2H2O === 2NaOH + H22Na + 2NH3 === 2NaNH2 + H24Na + TiCl4(熔融) === 4NaCl + TiMg + Cl2 === MgCl2Mg + Br2 === MgBr22Mg + O2 === 2MgOMg + S === MgSMg + 2H2O === Mg(OH)2 + H22Mg + TiCl4(熔融) === Ti + 2MgCl2Mg + 2RbCl === MgCl2 + 2Rb2Mg + CO2 === 2MgO + C2Mg + SiO2 === 2MgO + SiMg + H2S === MgS + H2Mg + H2SO4 === MgSO4 + H22Al + 3Cl2 === 2AlCl34Al + 3O2 === 2Al2O3(钝化)4Al(Hg) + 3O2 + 2xH2O === 2(Al2O3.xH2O) + 4Hg 4Al + 3MnO2 === 2Al2O3 + 3Mn2Al + Cr2O3 === Al2O3 + 2Cr2Al + Fe2O3 === Al2O3 + 2Fe2Al + 3FeO === Al2O3 + 3Fe2Al + 6HCl === 2AlCl3 + 3H22Al + 3H2SO4 === Al2(SO4)3 + 3H22Al + 6H2SO4(浓) === Al2(SO4)3 + 3SO2 + 6H2O (Al、Fe在冷、浓的H2SO4、HNO3中钝化)Al + 4HNO(稀) === Al(NO3)3 + NO + 2H2O2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H22Fe + 3Br2 === 2FeBr3Fe + I2 === FeI2Fe + S === FeS3Fe + 4H2O(g) === Fe3O4 + 4H2Fe + 2HCl === FeCl2 + H2Fe + CuCl2 === FeCl2 + CuFe + SnCl4 === FeCl2 + SnCl2(铁在酸性环境下、不能把四氯化锡完全还原为单质锡Fe + SnCl2==FeCl2 + Sn)三、非金属氢化物(HF、HCl、H2O、H2S、NH3)1、还原性:4HCl(浓) + MnO2 === MnCl2 + Cl2 + 2H2O4HCl(g) + O2 === 2Cl2 + 2H2O16HCl + 2KMnO4 === 2KCl + 2MnCl2 + 5Cl2 + 8H2O14HCl + K2Cr2O7 === 2KCl + 2CrCl3 + 3Cl2 + 7H2O2H2O + 2F2 === 4HF + O22H2S + 3O2(足量) === 2SO2 + 2H2O2H2S + O2(少量) === 2S + 2H2O2H2S + SO2 === 3S + 2H2OH2S + H2SO4(浓) === S + SO2 + 2H2O3H2S + 2HNO(稀) === 3S + 2NO + 4H2O5H2S + 2KMnO4 + 3H2SO4 === 2MnSO4 + K2SO4 + 5S + 8H2O3H2S + K2Cr2O7 + 4H2SO4 === Cr2(SO4)3 + K2SO4 + 3S + 7H2O H2S + 4Na2O2 + 2H2O === Na2SO4 + 6NaOH2NH3 + 3CuO === 3Cu + N2 + 3H2O2NH3 + 3Cl2 === N2 + 6HCl8NH3 + 3Cl2 === N2 + 6NH4Cl4NH3 + 3O2(纯氧) === 2N2 + 6H2O4NH3 + 5O2 === 4NO + 6H2O4NH3 + 6NO === 5N2 + 6H2O(用氨清除NO)NaH + H2O === NaOH + H24NaH + TiCl4 === Ti + 4NaCl + 2H2CaH2 + 2H2O === Ca(OH)2 + 2H22、酸性:4HF + SiO2 === SiF4 + 2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF + CaCl2 === CaF2 + 2HClH2S + Fe === FeS + H2H2S + CuCl2 === CuS + 2HClH2S + 2AgNO3 === Ag2S + 2HNO3H2S + HgCl2 === HgS + 2HClH2S + Pb(NO3)2 === PbS + 2HNO3H2S + FeCl2 ===2NH3 + 2Na==2NaNH2 + H2(NaNH2 + H2O === NaOH + NH3)3,碱性:NH3 + HCl === NH4ClNH3 + HNO3 === NH4NO32NH3 + H2SO4 === (NH4)2SO4NH3 + NaCl + H2O + CO2 === NaHCO3 + NH4Cl (此反应用于工业制备小苏打,苏打)4,不稳定性:2HF === H2 + F22HCl === H2 + Cl22H2O === 2H2 + O22H2O2 === 2H2O + O2H2S === H2 + S2NH3 === N2 + 3H2四、非金属氧化物低价态的还原性:2SO2 + O2 === 2SO32SO2 + O2 + 2H2O === 2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2 + Cl2 + 2H2O === H2SO4 + 2HClSO2 + Br2 + 2H2O === H2SO4 + 2HBrSO2 + I2 + 2H2O === H2SO4 + 2HISO2 + NO2 === SO3 + NO2NO + O2 === 2NO2NO + NO2 + 2NaOH === 2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO + O2 === 2CO2CO + CuO === Cu + CO23CO + Fe2O3 === 2Fe + 3CO2CO + H2O === CO2 + H2氧化性:SO2 + 2H2S === 3S + 2H2OSO3 + 2KI === K2SO3 + I2NO2 + 2KI + H2O === NO + I2 + 2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2 + H2S === 4NO + SO3 + H2O2NO2 + Cu === 4CuO + N2CO2 + 2Mg === 2MgO + C(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾)SiO2 + 2H2 === Si + 2H2OSiO2 + 2Mg === 2MgO + Si3、与水的作用:SO2 + H2O === H2SO3SO3 + H2O === H2SO43NO2 + H2O === 2HNO3 + NON2O5 + H2O === 2HNO3P2O5 + H2O === 2HPO3P2O5 + 3H2O === 2H3PO4(P2O5极易吸水、可作气体干燥剂P2O5 + 3H2SO4(浓) === 2H3PO4 + 3SO3)CO2 + H2O === H2CO34、与碱性物质的作用:SO2 + 2NH3 + H2O === (NH4)2SO3SO2 + (NH4)2SO3 + H2O === 2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理: 2NH4HSO3 + H2SO4 === (NH4)2SO4 + 2H2O + 2SO2 生成的硫酸铵作化肥、SO2循环作原料气)SO2 + Ca(OH)2 === CaSO3 + H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3 + MgO === MgSO4SO3 + Ca(OH)2 === CaSO4 + H2OCO2 + 2NaOH(过量) === Na2CO3 + H2OCO2(过量) + NaOH === NaHCO3CO2 + Ca(OH)2(过量) === CaCO3 + H2O2CO2(过量) + Ca(OH)2 === Ca(HCO3)2CO2 + 2NaAlO2 + 3H2O === 2Al(OH)3 + Na2CO3CO2 + C6H5ONa + H2O === C6H5OH + NaHCO3SiO2 + CaO === CaSiO3SiO2 + 2NaOH === Na2SiO3 + H2O(常温下强碱缓慢腐蚀玻璃)SiO2 + Na2CO3 === Na2SiO3 + CO2SiO2 + CaCO3 === CaSiO3 + CO2五、金属氧化物1、低价态的还原性:6FeO + O2 === 2Fe3O4FeO + 4HNO3 === Fe(NO3)3 + NO2 + 2H2O2、氧化性:Na2O2 + 2Na === 2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.Fe2O3 + 3H2 === 2Fe + 3H2O (制还原铁粉)Fe3O4 + 4H2 === 3Fe + 4H2O3、与水的作用:Na2O + H2O === 2NaOH2Na2O2 + 2H2O === 4NaOH + O2(此反应分两步:Na2O2 + 2H2O === 2NaOH + H2O2 ;2H2O2 === 2H2O + O2. H2O2的制备可利用类似的反应: BaO2 + H2SO4(稀) === BaSO4 + H2O2)MgO + H2O === Mg(OH)2 (缓慢反应)4、与酸性物质的作用:Na2O + SO3 === Na2SO4Na2O + CO2 === Na2CO3Na2O + 2HCl === 2NaCl + H2O2Na2O2 + 2CO2 === 2Na2CO3 + O2Na2O2 + H2SO4(冷、稀) === Na2SO4 + H2O2MgO + SO3 === MgSO4MgO + H2SO4 === MgSO4 + H2OAl2O3 + 3H2SO4 === Al2(SO4)3 + 3H2O(Al2O3是两性氧化物:Al2O3 + 2NaOH === 2NaAlO2 + H2O)FeO + 2HCl === FeCl2 + 3H2OFe2O3 + 6HCl === 2FeCl3 + 3H2OFe2O3 + 3H2S(g) === Fe2S3 + 3H2OFe3O4 + 8HCl === FeCl2 + 2FeCl3 + 4H2O六、含氧酸1、氧化性:4HClO3 + 3H2S === 3H2SO4 + 4HClHClO3 + HI === HIO3 + HCl3HClO + HI === HIO3 + 3HClHClO + H2SO3 === H2SO4 + HClHClO + H2O2 === HCl + H2O + O2(氧化性:HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强)2H2SO4(浓) + C === CO2 + 2SO2 + 2H2O2H2SO4(浓) + S === 3SO2 + 2H2OH2SO4 + Fe(Al) 室温下钝化6H2SO4(浓) + 2Fe === Fe2(SO4)3 + 3SO2 + 6H2O2H2SO4(浓) + Cu === CuSO4 + SO2 + 2H2OH2SO4(浓) + 2HBr === SO2 + Br2 + 2H2OH2SO4(浓) + 2HI === SO2 + I2 + 2H2OH2SO4(稀) + Fe === FeSO4 + H22H2SO3 + 2H2S === 3S + 2H2O4HNO3(浓) + C === CO2 + 4NO2 + 2H2O6HNO3(浓) + S === H2SO4 + 6NO2 + 2H2O5HNO3(浓) + P === H3PO4 + 5NO2 + H2O6HNO3 + Fe === Fe(NO3)3 + 3NO2 + 3H2O4HNO3 + Fe === Fe(NO3)3 + NO + 2H2O30HNO3 + 8Fe === 8Fe(NO3)3 + 3N2O + 15H2O36HNO3 + 10Fe === 10Fe(NO3)3 + 3N2 + 18H2O30HNO3 + 8Fe === 8Fe(NO3)3 + 3NH4NO3 + 9H2O2、还原性:H2SO3 + X2 + H2O === H2SO4 + 2HX(X表示Cl2、Br2、I2)2H2SO3 + O2 === 2H2SO4H2SO3 + H2O2 === H2SO4 + H2O5H2SO3 + 2KMnO4 === 2MnSO4 + K2SO4 + 2H2SO4 + 3H2O H2SO3 + 2FeCl3 + H2O === H2SO4 + 2FeCl2 + 2HCl3、酸性:H2SO4(浓) + CaF2 === CaSO4 + 2HFH2SO4(浓) + NaCl === NaHSO4 + HClH2SO4(浓) + 2NaCl === Na2SO4 + 2HClH2SO4(浓) + NaNO3 === NaHSO4 + HNO33H2SO4(浓) + Ca3(PO4)2 === 3CaSO4 + 2H3PO42H2SO4(浓) + Ca3(PO4)2 === 2CaSO4 + Ca(H2PO4)2 3HNO3 + Ag3PO4 === H3PO4 + 3AgNO32HNO3 + CaCO3 === Ca(NO3)2 + H2O + CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2) 等还原性气体)4H3PO4 + Ca3(PO4)2 === 3Ca(H2PO4)2(重钙)H3PO4(浓) + NaBr === NaH2PO4 + HBrH3PO4(浓) + NaI === NaH2PO4 + HI4,不稳定性:2HClO === 2HCl + O24HNO3 === 4NO2 + O2 + 2H2OH2SO3 === H2O + SO2H2CO3 === H2O + CO24SiO4 === H2SiO3 + H2O七、碱低价态的还原性:4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3与酸性物质的作用:2NaOH + SO2(少量) === Na2SO3 + H2ONaOH + SO2(足量) === NaHSO32NaOH + SiO2 === NaSiO3 + H2O2NaOH + Al2O3 === 2NaAlO2 + H2O2NaOH + Cl2 === NaCl + NaClO + H2ONaOH + HCl === NaCl + H2ONaOH + H2S(足量) === NaHS + H2O2NaOH + H2S(少量) === Na2S + 2H2O3NaOH + AlCl3 === Al(OH)3 + 3NaClNaOH + Al(OH)3 === NaAlO2 + 2H2ONaOH + NH4Cl === NaCl + NH3 + H2OMg(OH)2 + 2NH4Cl === MgCl2 + 2NH3.H2OAl(OH)3 + NH4Cl 不溶解3、不稳定性:Mg(OH)2 === MgO + H2O2Al(OH)3 === Al2O3 + 3H2O2Fe(OH)3 === Fe2O3 + 3H2OCu(OH)2 === CuO + H2O八、盐1、氧化性:2FeCl3 + Fe === 3FeCl22FeCl3 + Cu === 2FeCl2 + CuCl2(用于雕刻铜线路版)2FeCl3 + Zn === 2FeCl2 + ZnCl2FeCl3 + Ag === FeCl2 + AgCFe2(SO4)3 + 2Ag === FeSO4 + Ag2SO4(较难反应)Fe(NO3)3 + Ag 不反应2FeCl3 + H2S === 2FeCl2 + 2HCl + S2FeCl3 + 2KI === 2FeCl2 + 2KCl + I2FeCl2 + Mg === Fe + MgCl22、还原性:2FeCl2 + Cl2 === 2FeCl33Na2S + 8HNO3(稀) === 6NaNO3 + 2NO + 3S + 4H2O3Na2SO3 + 2HNO3(稀) === 3Na2SO4 + 2NO + H2O2Na2SO3 + O2 === 2Na2SO43、与碱性物质的作用:MgCl2 + 2NH3.H2O === Mg(OH)2 + NH4ClAlCl3 + 3NH3.H2O === Al(OH)3 + 3NH4ClFeCl3 + 3NH3.H2O === Fe(OH)3 + 3NH4Cl4、与酸性物质的作用:Na3PO4 + HCl === Na2HPO4 + NaClNa2HPO4 + HCl === NaH2PO4 + NaClNaH2PO4 + HCl === H3PO4 + NaClNa2CO3 + HCl === NaHCO3 + NaClNaHCO3 + HCl === NaCl + H2O + CO23Na2CO3 + 2AlCl3 + 3H2O === 2Al(OH)3 + 3CO2 + 6NaCl 3Na2CO3 + 2FeCl3 + 3H2O === 2Fe(OH)3 + 3CO2 + 6NaCl 3NaHCO3 + AlCl3 === Al(OH)3 + 3CO23NaHCO3 + FeCl3 === Fe(OH)3 + 3CO23Na2S + Al2(SO4)3 + 6H2O === 2Al(OH)3 + 3H2S3NaAlO2 + AlCl3 + 6H2O === 4Al(OH)35、不稳定性:Na2S2O3 + H2SO4 === Na2SO4 + S + SO2 + H2ONH4Cl === NH3 + HClNH4HCO3 === NH3 + H2O + CO22KNO3 === 2KNO2 + O22Cu(NO3)3 === 2CuO + 4NO2 + O22KMnO4 === K2MnO4 + MnO2 + O22KClO3 === 2KCl + 3O22NaHCO3 === Na2CO3 + H2O + CO2Ca(HCO3)2 === CaCO3 + H2O + CO2CaCO3 === CaO + CO2MgCO3 === MgO + CO2 .............................................。
鲁科版化学必修1和2——方程式汇总

必修1 有关Na元素的化学方程式:2Na + 2H2O == 2NaOH + H2↑2Na + 2HCl == 2NaCl + H2↑4Na + O2 == 2Na2O(白色)2Na + O2Na2O2(淡黄色)2Na + Cl22NaCl2Na + S Na2S2Na2O2 + 2H2O == 4NaOH + O2↑2Na2O2 + 2CO2 == 2Na2CO3 + O2 Na2O + H2O == 2NaOH Na2O + CO2 ==Na2CO3有关Cl元素和Fe元素的方程式:2Fe + 3Cl22FeCl3H2 + Cl22HClCu + Cl2CuCl2Cl2 + H2O HCl +HClOCl2 + 2NaOH == NaCl + NaClO + H2O (尾气的吸收原理)2Cl2 + 2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O (工业上制取漂白粉的原理)Ca(ClO)2 + CO2 +H2O == CaCO3 + 2HClO (漂白粉的漂白原理)2HClO 2HCl +O2↑ (漂白粉失效原理)Fe + H2SO4 == FeSO4 + H2↑2FeCl2 + Cl2 == 2FeCl32FeCl3 +Fe == 3FeCl22FeCl3 + Cu == CuCl2 + 2FeCl24Fe(OH)4+O2+2H2O 错误!未找到引用源。
4Fe(OH)4 (白色沉淀→灰绿色→红褐色沉淀)有关C元素的方程式:Na2CO3 + 2HCl == 2NaCl + CO2↑+H2O NaHCO3 + HCl == NaCl + CO2↑+H2O NaHCO3 + NaOH == Na2CO3 + H2OCaCl2 + Na2CO3 == CaCO3↓+ 2NaCl2NaHCO3Na2CO3 + CO2↑+ H2O Ca(HCO3)2CaCO3↓+ CO2↑+ H2OCa(OH)2 + CO2 == CaCO3↓+ H2O CaCO3 + CO2 + H2O ==Ca(HCO3)22NaOH + CO2 == Na2CO3 + H2O Na2CO3 + CO2 + H2O == 2NaHCO32C + O2(不足) 2CO C + O2(充足) CO2CO2+C 2CO Fe2O3+ 3CO 2Fe + 3CO2 (工业上炼铁原理)有关N元素的方程式:N2 + O22NON2 + 3H22NH3 (工业上合成氨原理)2 NO + O2 ==2NO2(红棕色)3NO2 + H2O == 2HNO3 + NO4NO + 3O2 + 2H2O == 4HNO3 4NO2 + O2 + 2H2O == 4HNO3NH3 + H2O NH3·H2O NH3·H2O NH4+ + OH- (氨水显碱性的原因)NH3·H2O NH3↑+ H2ONH3 + HCl == NH4Cl (白烟)NH3 + HNO3 == NH4NO3 (白烟)2NH3 + H2SO4 == (NH4)2SO44NH3 + 5O2 4NO + 6H2ONH4Cl NH3↑+ HCl↑高温催化剂放电NH4HCO3NH3↑+ H2O + CO2↑NH4Cl + NaOH NaCl + NH3↑+ H2ONH4+ + OH- NH3↑+ H2O (检验NH4+:加碱,加热,用湿润红色石蕊试纸)Ca(OH)2 + 2NH4Cl CaCl2 +2NH3↑+ 2H2O (实验室制备NH3原理)4HNO34NO2↑+ O2↑+ 2H2O (HNO3不稳定的方程式)C U+4HNO3(浓)==Cu(NO3)2 + 2NO2↑+ 2H2O 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2OC +4HNO3 (浓) CO2↑+ 4NO2↑+ 2H2O有关S元素的方程式:S + O2SO2S + H2H2S2Cu + S Cu2SFe + S FeS Hg + S == HgSSO2 + H2O H2SO3H2SO3SO2↑+ H2OSO3 + H2O == H2SO42H2SO3 + O2 == 2H2SO4SO2 + 2NaOH == Na2SO3 + H2O (向NaOH溶液中通少量SO2)Na2SO3 + SO2 + H2O == 2NaHSO3 (向NaOH溶液中通SO2至过量)SO2 + Ca(OH)2 ==CaSO3↓+ H2O (向C a(O H)2溶液中通少量SO2)CaSO3 + SO2 + H2O == Ca(HSO3)2 (向C a(O H)2溶液中通SO2至过量)SO2 + 2H2S == 3S↓+ 2H2OC + 2H2SO4(浓) CO2↑+ 2SO2↑+ 2H2OCu +2H2SO4(浓) C U SO4 + SO2↑+ 2H2OH2S+Cl2错误!未找到引用源。
高一化学必修一(鲁科版)方程式大全

高一化学必修一(鲁科版)方程式钠及其化合物的相关反应:1、钠在空气中燃烧:2Na + O 2 == Na 2O 2钠与氧气在常温下反应:4Na + O 2 == 2Na 2O2、Na 与H 2O 反应:2Na +2H 2O == 2NaOH +H 2↑3、Na 2O 2与H 2O 反应: 2Na 2O 2+2H 2O == 4NaOH +O 2↑4、Na 2O 2与CO 2反应: 2Na 2O 2+2CO 2 == 2Na 2CO 3+O 2氯气的相关反应: 1、实验室制Cl 2 : 4HCl (浓)+MnO 2 == Cl 2↑+MnCl 2+2H 2O2、氯气与金属铁反应:2Fe + 3Cl 2 == 2FeCl 33、氯气与金属铜反应:Cu + Cl 2 == CuCl 24、钠与氯气反应:2Na + Cl 2 == 2NaCl5、氯气与氢气反应:Cl 2 + H 2 == 2HCl6、氯气与水反应: Cl 2+H 2O == HCl +HClO7、氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH == NaCl + NaClO + H 2O8、次氯酸光照分解:2HClO == 2HCl + O 2↑9、工业制漂白粉: 2Cl 2+2Ca(OH )2 == CaCl 2+Ca (ClO )2+2H 2O10、漂白粉漂白原理: Ca (ClO )2+H 2O + CO 2 == 2HClO +CaCO 3↓11、漂白粉长期置露在空气中:Ca (ClO)2 + H 2O + CO 2 == CaCO 3↓ + 2HClO 2HClO == 2HCl +O 2↑离子检验1、硫酸根离子的检验: Ba 2++ SO 4 2- == BaSO 4↓2、碳酸根离子的检验: Ca 2+ + CO 32— == CaCO 3↓3、银离子的检验: Cl — + Ag + == AgCl ↓ 铁的相关方程式1、铁和稀盐酸Fe +2HCl == FeCl 2+H 2↑铁和稀硫酸Fe +H 2SO 4 == FeSO 4+H 2↑2、铁置换金属铜Fe +CuCl 2 == FeCl 2+Cu铁置换金属银Fe +2AgNO 3 == Fe (NO 3)2+2Ag3、铁和非金属反应:3Fe +2O 2 == Fe 3O 4 Fe +S == FeS4、氧化铁与盐酸反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O氧化亚铁与稀盐酸:FeO +2HCl == FeCl 2+H 2O磁性氧化铁和稀盐酸:Fe 3O 4+8HCl == FeCl 2+2FeCl 3+4H 2O5、氯化亚铁中通入氯气:2FeCl 2 + Cl 2 == 2FeCl 3点燃 光照△ △点燃 点燃 光照 点燃 点燃 加热6、三氯化铁溶液与铁粉反应:2FeCl 3 + Fe == 3FeCl 27、雕刻铜线路板2FeCl 3+Cu == 2FeCl 2+CuCl 28、氯化铁与氢氧化钠溶液反应:FeCl 3 + 3NaOH == Fe (OH )3↓+ 3NaCl9、硫酸亚铁与氢氧化钠溶液反应:FeSO 4 + 2NaOH == Fe (OH )2↓+Na 2SO 410、铁的氢氧化物和盐酸反应:Fe (OH)3+3HCl == FeCl 3+3H 2O 、 Fe (OH)2+2HCl == FeCl 2+2H 2O11、氢氧化亚铁被氧化成氢氧化铁:4Fe (OH )2+2H 2O +O 2 == 4Fe (OH)3 12、氢氧化铁加热分解:2Fe (OH )3 == Fe 2O 3 + 3H 2O↑13、氢氧化铁胶体的制备 FeCl 3+3H 2O == Fe(OH)3(胶体)+3HCl碳及其化合物的相关方程式:1、炭点燃:C +O 2(足量) == CO2、2C +O 2(少量) == 2CO2、CO 2和水反应:CO 2+H 2O == H 2CO 33、碳酸钠与盐酸反应: Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑4、碳酸氢钠与盐酸反应: NaHCO 3 + HCl == NaCl + H 2O + CO 2↑5、碳酸氢钠与氢氧化钠反应: NaHCO 3 + NaOH == Na 2CO 3+ H 2O6、碳酸氢钠与氢氧化钙:2NaHCO 3 (过量)+ Ca (OH )2 == CaCO 3↓+ Na 2CO 3+ 2H 2ONaHCO 3 (少量)+ Ca (OH)2 == CaCO 3↓+ NaOH + H 2O7、碳酸氢钠受热分解: 2NaHCO 3 == Na 2CO 3+CO 2↑+H 2O8、氯化钙与碳酸钠溶液反应:CaCl 2 + Na 2CO 3 == CaCO 3↓+ 2NaCl9、 Na 2CO 3中通入过量CO 2: Na 2CO 3+CO 2+H 2O == 2NaHCO 310、 足量NaOH 与CO 2反应: 2NaOH +CO 2 == Na 2CO 3+H 2O11、 NaOH 与过量CO 2反应: NaOH +CO 2 == NaHCO 312、溶洞形成:CaCO 3+H 2O +CO 2 == Ca (HCO 3)2、Ca (HCO 3)2 == CaCO 3↓+H 2O +CO 2↑13、制取水煤气:C +H 2O == CO +H 2氮的相关反应(N 2、NO 、NO 2、NH 3、HNO 3、铵盐)1、氮气与氧气在放电下反应:N 2 + O 2 == 2NO2、氮气与氢气合成氨:N 2 + 3H 2 2NH 33一氧化氮与氧气反应:2NO + O 2 == 2NO 24、二氧化氮与水反应:3NO 2 + H 2O == 2HNO 3 + NO5、氨气与水反应:NH 3+ H 2ONH 3•H 2O 6、氨水受热分解:NH 3•H 2O == NH 3↑ + H 2O7、氨气与氯化氢反应:NH 3 + HCl == NH 4Cl△ △ 放电 高温高压 催化剂 △ △ △ 点燃 点燃 高温8、氨的催化氧化:4NH 3+5O 24NO +6H 2O 6、氯化铵受热分解:NH 4Cl == NH 3↑ + HCl↑7、碳酸氢铵受热分解:NH 4HCO 3 == NH 3↑ + H 2O↑ + CO 2↑8、铵盐溶液与碱溶液反应:NH 4+ + OH — == NH 3↑+ H 2O9、氨气的实验室制取:2NH 4Cl + Ca(OH ) 2 == CaCl 2 + 2H 2O + 2NH 3↑10、硝酸见光分解:4HNO 3 == 4NO 2↑+O 2↑+H 2O11、浓硝酸与碳反应:C + 4HNO 3(浓) == CO 2 ↑+ 2H 2O + 4NO 2↑12、浓硝酸与铜反应:Cu + 4HNO 3(浓) == Cu(NO 3) 2 + 2H 2O + 2NO 2↑13、稀硝酸与铜反应:3Cu + 8HNO 3 (稀) == Cu (NO 3) 2 + 4H 2O + 2NO↑ 硫1、铁和硫反应:Fe +S == FeS2、硫和氧气反应:S +O 2 == SO 23、二氧化硫与水反应:SO 2 + H 2O == H 2SO 34、浓硫酸与铜反应:Cu + 2 H 2SO 4 (浓) == CuSO 4 + 2H 2O + SO 2↑5、浓硫酸与木炭反应:C + 2 H 2SO 4 (浓) == CO 2 ↑+ 2SO 2↑ + 2H 2O6、二氧化硫与氧气在催化剂的作用下反应:2SO 2 + O 2 2SO 37、三氧化硫与水反应:SO 3 + H 2O == H 2SO 48、亚硫酸变为硫酸:2H 2SO 3+O 2 == 2H 2SO 49、二氧化硫与氧化钙:SO 2 + CaO == CaSO 310、二氧化硫与氢氧化钠:SO 2 + 2NaOH == Na 2SO 3 + H 2O11、二氧化硫与氢氧化钙:SO 2 + Ca (OH ) 2 == CaSO 3↓ + H 2O12、二氧化硫与硫化氢:SO 2 + 2H 2S == 3S ↓ + 2H 2O 13、H 2S 长期放置变浑浊或H 2S 不完全燃烧: 2H 2S +O 2 == 2H 2O +2S↓ 14、H 2S 充分燃烧: 2H 2S +3O 2 == 2H 2O +2SO 215、H 2S 与SO 2反应:2H 2S +SO 2 == 3S↓+2H 2O16、SO 2通入氯水中褪色: SO 2+Cl 2+H 2O == 2HCl +H 2SO 4 海水中的元素 1、2Mg +CO2 == 2MgO +C2、Mg 2++2OH — == Mg (OH) 2↓3、Cl 2+2Br — == Br 2+2Cl -4、Cl 2+2I — == I 2+2Cl —5、Br 2+2I - == I 2+2Br -硅 1、Si + O 2 == SiO 22、Si + 2NaOH + H 2O == Na 2SiO 3 + 2H 2↑3、Si + 2Cl 2 == SiCl 44、SiO 2 + 2C == Si + 2CO↑5、SiO 2 + CaO == CaSiO 36、SiO 2 + 2NaOH == Na 2SiO 3 + H 2O△ 高温 点燃 高温催化剂 △ △ △ △ 催化剂 △ △或见光 △ △ 点燃 点燃 高温 高温 高温 高温7、SiO 2 + 4HF == SiF 4↑+2H 2O 8、SiO 2 + Na 2CO 3 == Na 2SiO 3 + CO 2↑ 9、SiO 2 + CaCO 3 == CaSiO 3 + CO 2↑10、Na 2SiO 3 + 2HCl + H 2O == H 4SiO 4↓+2NaCl 、H 4SiO 4 == H 2SiO 3 + H 2O 、H 2SiO 3 == SiO 2 + H 2O11、Na 2SiO 3 + CO 2 + H 2O == H 2SiO 3 ↓+ Na 2CO 3铝1、铝与氧气反应:4Al +3O 2 == 2Al 2O 32、铝热反应:2Al +Fe 2O 3 == Al 2O 3+2Fe3、铝与盐酸:2Al +6HCl == 2AlCl 3+3H 2 ↑4、铝与硫酸:2Al +3H 2SO 4 == Al 2(SO 4)3+3H 2↑5、铝与氢氧化钠:2Al +2NaOH +H 2O == 2NaAlO 2+3H 2↑6、氢氧化铝加热分解:2Al(OH)3 == Al 2O 3+H 2O7、硫酸铝与氨水:Al 2(SO 4)3 + 6NH 3·H 2O =2Al (OH)3↓+3(NH 4)2SO 48、氧化铝与盐酸:Al 2O 3+6HCl == 2AlCl 3+3H 2O9、氧化铝与氢氧化钠:Al 2O 3+2NaOH == 2NaAlO 2+H 2O10、氯化铝与氢氧化钠:AlCl 3+3NaOH == Al(OH)3↓+3NaCl11、氢氧化铝与氢氧化钠:Al(OH)3+NaOH == NaAlO 2+2H 2O12、氯化铝与氢氧化钠:AlCl 3+4NaOH == NaAlO 2+2H 2O13、偏铝酸钠与盐酸:NaAlO 2+HCl +H 2O == Al (OH)3↓+NaCl14、氢氧化钠与盐酸:Al (OH )3+3HCl == AlCl 3+3H 2O15、偏铝酸钠与盐酸:NaAlO 2+4HCl == AlCl 3+2H 2O16、氯化铝与氨水:AlCl 3+3NH 3·H 2O == Al(OH )3↓+3NH 4Cl 铜 1、2Cu +O 2 == 2CuO 2、2Cu +S == Cu 2S3、2Cu +O 2+H 2O +CO 2 == Cu 2(OH )2CO 34、4CuO == 2Cu 2O +O 2↑5、CuSO 4·5H 2O == CuSO 4+5H 2O ↑高温 高温 △ 高温 加热 加热 加热 高温。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
鲁科版化学化学方程式汇总请同学们先认真掌握化学反应方程式,属于离子反应(*)的再改写成离子反应方程式。
*1、硫酸根离子的检验: BaCl 2 + Na 2SO 4 = BaSO 4↓+ 2NaCl*2、碳酸根离子的检验: CaCl 2 + Na 2CO 3 = CaCO 3↓ + 2NaCl*3、铁片与硫酸铜溶液反应: Fe + CuSO 4 = FeSO 4 + Cu*4、氯化钙与碳酸钠溶液反应:CaCl 2 + Na 2CO 3 = CaCO 3↓+ 2NaCl5、钠在空气中燃烧:2Na + O 2 Na 2O 2 钠与氧气反应:4Na + O 2 = 2Na 2O*6、过氧化钠与水反应:2Na 2O 2+ 2H 2O = 4NaOH + O 2↑7、过氧化钠与二氧化碳反应:2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2*8、钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑9、氯气与金属铁反应:2Fe + 3Cl 2 2FeCl 310、氯气与金属铜反应:Cu + Cl 2CuCl 211、氯气与金属钠反应:2Na + Cl22NaCl12、氯气与氢气反应:H2 + Cl22HCl*13、氯气与水反应:Cl2 + H2O = HCl + HClO14、次氯酸光照分解:2HClO 2HCl +O2↑*15、氯气与氢氧化钠溶液反应:Cl2+ 2NaOH = NaCl + NaClO + H2O*16、氯气与消石灰反应:2Cl2+ 2Ca(OH)2= CaCl2+ Ca(ClO)2+ 2H2O*17、盐酸与硝酸银溶液反应:HCl + AgNO3= AgCl↓ + HNO318、漂白粉长期置露在空气中:Ca(ClO)2+ H2O + CO2= CaCO3↓ + 2HClO*19、碳酸钠与盐酸反应: Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑*20、碳酸氢钠与盐酸反应: NaHCO3+ HCl = NaCl + H2O + CO2↑*21、碳酸氢钠与氢氧化钠反应: NaHCO3+ NaOH = Na2CO3+ H2O22、碳酸氢钠受热分解:2NaHCO3Na2CO3+ H2O+ CO2↑23.炽热的木炭与二氧化碳反应:CO2+C 2CO24、木炭还原氧化铜: 2CuO + C 2Cu + CO2↑25、氮气与氧气在放电下反应:N2+ O22NO26、一氧化氮与氧气反应:2NO + O2= 2NO227、二氧化氮与水反应:3NO2+ H2O = 2HNO3+ NO28、合成氨:N2+3H22NH329、氨气易溶于水:NH3+H2O≒NH3·H2O*30、氨气与酸反应:NH3+HCl=NH4Cl31、氨的催化氧化:4NH3+5O24NO+6H2O32、氯化铵受热分解:NH4Cl NH3↑ + HCl↑33、碳酸氢氨受热分解:NH4HCO3NH3↑ +H2O↑ + CO2↑*34、硝酸铵与氢氧化钠反应:NH4NO3+ NaOHNH3↑ + NaNO3+ H2O35、氨气的实验室制取:2NH4Cl(固)+ Ca(OH)2(固)CaCl2+ 2H2O + 2NH3↑*36、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2+ 2H2O + 2NO2↑*37、稀硝酸与铜反应:3 Cu + 8HNO3(稀) =3Cu(NO3)2+ 4H2O + 2NO↑38、浓硝酸与木炭反应:C + 4HNO3(浓) CO2↑+ 4NO2↑ + 2H2O39、硫与金属铁反应:Fe + S FeS40、二氧化硫与氧气在催化剂的作用下反应:2SO 2 + O 22SO 341、二氧化硫与水反应:SO 2 + H 2O = H 2SO 342、三氧化硫与水反应:SO 3 + H 2O = H 2SO 443、亚硫酸氧化成硫酸:2H 2SO 3+O 2=2H 2SO 444、SO 2 + CaO = CaSO 3 *SO 2 + 2NaOH = Na 2SO 3 + H 2O*45、SO 2 + Ca(OH)2 = CaSO 3↓ + H 2O*46、SO 2 + Cl 2 + 2H 2O = 2HCl + H 2SO 447、二氧化硫与硫化氢反应:SO 2 + 2H 2S =3S +2H 2O*48、浓硫酸与铜反应:Cu + 2H 2SO 4(浓)CuSO 4+ 2H 2O + SO 2↑49、浓硫酸与木炭反应:C + 2H 2SO 4(浓)CO 2↑+ 2SO 2↑ + 2H 2O*50、电解饱和食盐水制氢氧化钠:2NaCl+2H2O2NaOH+H2↑+Cl2↑51、镁与二氧化碳反应:2Mg+CO22MgO+C52、硅与F2的反应:Si + 2F2= SiF453、硅与2NaOH 的反应:Si + 2NaOH + H2O = Na2SiO3+2H2↑54、硅单质的实验室制法:粗硅的制取:SiO2+ 2CSi + 2CO55、粗硅转变为纯硅:Si(粗)+ 2Cl2SiCl4SiCl4 + 2H2Si(纯)+ 4HCl56、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4+ 2H2O57、硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑58、二氧化硅与氧化钙高温反应:SiO2 + CaO =CaSiO3*59、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3+ H2O*60、硅酸钠溶液中通入二氧化碳: Na2SiO3+ CO2+ H2O = Na2CO3+ H2SiO3↓*61、硅酸钠与盐酸反应:Na2SiO3+ 2HCl = 2NaCl + H2SiO3↓62、铝热反应:2Al+Fe2O3Al2O3+2Fe*63、铝与氢氧化钠溶液反应:2Al + 2NaOH + 6H2O = 2Na[Al(OH)4]+ 3H2↑*64、氧化铝与盐酸反应:Al2O3+ 6HCl = 2AlCl3+ 3H2O*65、氧化铝与氢氧化钠溶液反应:Al2O3+ 2NaOH + 3H2O = 2Na[Al(OH)4]*66、实验室制取氢氧化铝:Al2(SO4)3+ 6NH3?H2O = 2Al(OH)3↓ + 3(NH4)2SO4*67、氢氧化铝与盐酸反应:Al(OH)3+ 3HCl = AlCl3+ 3H2O*68、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+ NaOH = Na[Al(OH)4]69、氢氧化铝加热分解:2Al(OH)3 Al2O3+ 3H2O*70、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2*71、氯化亚铁中通入氯气:2FeCl2 + Cl2= 2FeCl3*72、氧化铁与盐酸反应:Fe2O3+ 6HCl = 2FeCl3+ 3H2O*73、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl*74、硫酸亚铁与氢氧化钠溶液反应: FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO475、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+ 2H2O + O2= 4Fe(OH)3*76、实验室中制氯气:MnO2+HCl(浓)MnCl2+Cl2↑ + 2H2O77、铜在潮湿的空气中被锈蚀:2Cu+ O2+ H2O + CO2=Cu2(OH)2CO378、铜与非金属的反应:2Cu+ O22CuO 2Cu+S Cu2S79、氧化铜高温分解:4CuO 2 Cu2O+ O2↑80、电解熔融的氯化钠:2NaCl2Na+Cl2↑81、铅蓄电池的电池反应:Pb+PbO2+2H2SO4=2Pb SO4+2H2O*82、氢氧燃料电池的两极反应(碱性电解质):负极 2 H2+4OH—→4 H2O+4e—正极 O2+2H2O+4e—→4 OH—*83、乙酸、一水合氨的电离:CH3COOH CH3COO—+H+NH3?H2O NH4++ OH—*84、乙酸钠、氯化铵、碳酸钠的水解:*85、硫化亚铁向硫化汞转化:FeS(S)+Hg2+(aq)=HgS(S)+Fe2+(aq)*86、通往二氧化碳使碳酸钙溶解:CaCO3+CO2+2H2O=Ca2++2HCO3—*87、碳酸氢钙加热分解:Ca2++2HCO3—= CaCO3↓+CO2+2H2O。
