全自动血液细胞分析仪产品技术要求mairui、
全自动血细胞分析仪-产品技术要求-性能指标
《测量、控制和实验室用电气设备的安全要求 第2-101 部分:体外诊断(IVD)
医用设备的专用要求》中适用的条款要求。
≤8.0﹪
LYM﹪≥15.0﹪, WBC≥4.0×109/L
中间细胞百分率(MID﹪)
≤10.0﹪
MID﹪≥5.0﹪, WBC≥4.0×109/L
粒细胞百分率(GRAN﹪)
≤8.0﹪
GRAN﹪≥30.0﹪, WBC≥4.0×109/L
2.5 携带污染率
携带污染率应符合表 4 的要求。
表 4 携带污染率要求
电
─ ─ 2.2 a.c.220V
额定工
实验
作高温 1 4 时 通 30℃
─ 2.2 2.2 ─ √ 通电
试验
电
实验 运行试
4 - 时 通 30℃ 验
电
─ ─ 2.2 ─ √ 通电
高温贮 4
存试验
实验 ─ 后 通 55℃
电
─ ─ 2.2 a.c.220V
额定工
实 验 温度 30℃
作湿热 4 ─ 时 通 相 对 湿 度 ─ ─ 2.2 a.c.220V
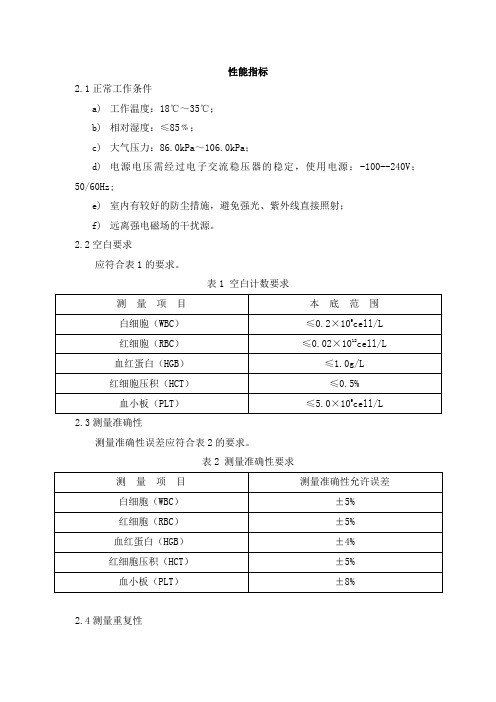
2.1 正常工作条件
性能指标
a) 工作温度:18℃~35℃;
b) 相对湿度:≤85﹪;
c) 大气压力:86.0kPa~106.0kPa;
d) 电源电压需经过电子交流稳压器的稳定,使用电源:~100--240V;
50/60Hz;
e) 室内有较好的防尘措施,避免强光、紫外线直接照射;
f) 远离强电磁场的干扰源。
表 2 测量准确性要求
测量项目
测量准确性允许误差
白细胞(WBC)
±5%
红细胞(RBC)
±5%
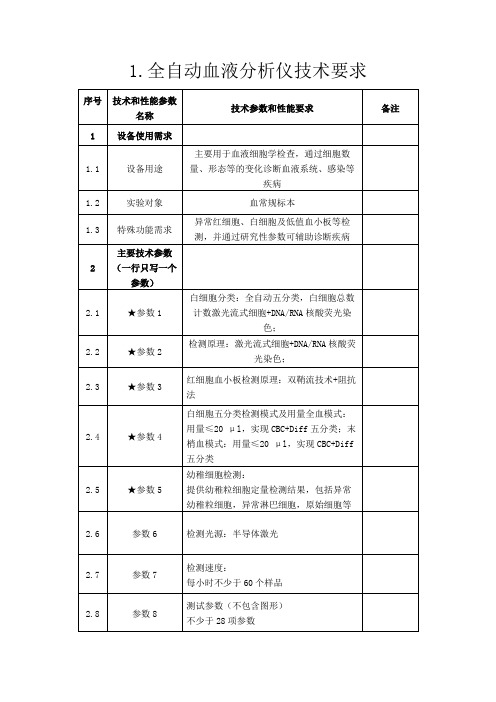
全自动五分类血液细胞分析仪技术参数要求

全自动五分类血液细胞分析仪技术参数要求:1.检测原理:多角度激光散射结合细胞化学染色技术,独立嗜碱性粒细胞检测通道;2.*检测项目≥35项;3.分析模式:CBC,CBC+DIFF;4.测量模式:全血、预稀释全血、末梢全血;5.*标本用量:全血模式:CBC≤12ul,CBC+DIFF≤15ul;预稀释全血≤20ul;6.检测速度:≥60样本/小时;7.*检测线性范围:WBC:0.00×109/L~400.00×109/LRBC:0.00×1012/L~8.00×1012/LHGB:0 g/L~250g/LPLT:0×109/L~5000×109/L8.*重复性:WBC≤2.0%RBC≤1.5%HGB≤1.5%MCV≤1.0%PLT≤4.0%9.*质控品、校准品:有仪器厂家原厂生产并通过省级SFDA注册的校准品、质控物,保证仪器检测结果准确性,并提供注册证复印件;10.*溯源性:投标时需提供五分类血细胞原厂生产校准品的国际溯源性检测报告复印件;11.*配套试剂:有仪器厂家原厂生产并通过SFDA注册/备案的配套试剂,并提供注册证或备案凭证复印件;12.*试剂种类:仅需两种溶血剂和一种稀释液和一种清洗液,降低使用成本;13.显示类型:10寸以上彩色液晶显示屏,同屏显示全部参数,便于基层操作人员使用;14.数据管理:4个USB接口,支持连接U盘、打印机、鼠标、键盘等;15.质控方式:L-J质控和X-B浮动均值法质控;16.工作环境:温度:10-30℃,湿度:20%-85%,气压:70kPa-106kPa;17.中文软件与细胞分析仪同一品牌(或同一厂家),并提供证明材料。
18.*生产厂家具有血液分析标准化实验室(非检测中心),并且获得CNAS(中国合格评定国家认可委员会)颁发的标准化实验室认可证书,确保血液分析系统的溯源有效性和检测质量;19*质评报告:投标设备系列产品参加安徽省临床检验中心室间调查,PT评价合格,并提供医院安徽省临床检验中心室间调查报告复印件;20.售后:生产厂家在安徽省境内设有常驻办事处和维修点,并提供证明材料;21.*售后服务人员:提供5名以上厂家售后服务工程师的本地社保证明(包括:社保卡正反面复印件及在合肥社保局查询截图),真实有效;22.投标系列产品通过FDA认证。
全自动血液分析仪技术要求
3.全自动干式生化分析仪技术要求
序号
技术和性能参数名称
技术参数和性能要求
备注
1
设备使用需求
无
1.1
设备用途
设备用于分析肝功、肾功等生化项目,为病人及临床提供快速准确的结果。
1.2
实验对象
血清、血浆、尿液、脑脊液
1.3
特殊功能需求
全自动干式生化分析仪,无需上下水及管路,无需废液处理,符合国家绿色环保要求。
2.8
参数8
待机样本编程能力不小于5000个样本
2.9
参数9
样本位:≥40个样本位,可适配多种尺寸原始采样管或样本杯
2.10
参数10
试剂库:≥60个冷藏位置,最大量≥3600个测试干片。
2.11
参数11
样本管理:凝固检测,气泡检测,液面感应,短缺样本检测。
2.12
参数12
操作界面:触摸屏监视器,在机用户指南
终身免费软件升级
4.10
维修支持
配件供应时间≥10年
4.4
耗材及零配件
提供耗材及主要零配件目录(含报价)
4.5
维修资料
提供详细操作手册、维修保养手册等
4.6
维修工具
提供维修专用工具1套
4.7
预防性维修
/定期维护保养
保修期内提供定期维护保养服务
4.8
维修密码支持
开放
4.9
升级
终身免费软件升级
4.10
使用培训
支持
4.11
工程师培训
2.5
★参数5
幼稚细胞检测:
提供幼稚粒细胞定量检测结果,包括异常幼稚粒细胞,异常淋巴细胞,原始细胞等
2.6
全自动血细胞分析仪产品技术要求libangmeisaier

2.1安全2.1.1 分析仪的安全应符合GB 4793.1-2007、GB 4793.9-2013、YY 0648-2008 的要求。
2.1.2 分析仪的电磁兼容要求应符合GB/T 18268.1-2010、GB/T 18268.26-2010 的要求.2.2性能要求2.2.1空白计数用配套稀释液作为样本计数,分析仪测量值应符合表 2 的规定。
表 2 空白计数要求2.2.2携带污染率WBC<1.0%;RBC<1.0%;HGB<1.0%;PLT <2.0%。
2.2.3线性分析仪的线性范围和线性误差应符合表3 的要求。
表 3 分析仪线性要求2.2.4重复性分析仪的重复性应符合表4 的要求。
表 4 分析仪重复性要求2.2.5分析仪可比性偏差要求:WBC 不超过±3%,RBC 不超过±2%,HGB 不超过±2%,PLT 不超过±5%,HCT/MCV 不超过±3%。
2.3分析仪基本功能和外观分析仪应具有下列基本功能:a)应提供中文报告;b)具有异常报警功能;c)具有与实验室信息系统进行通信的功能;d)具有打印功能;外观应符合下列要求:a)分析仪外壳应整齐美观,表面整洁,色泽均匀,无伤斑、裂纹等缺陷。
b)分析仪面板应无涂覆层脱落、锈蚀、面板上文字和标志应清晰、准确、牢固。
c)分析仪的塑料件应无起泡、开裂、变形以及灌注物溢出现象。
d)主机上电,无断路、短路和烧焦等现象,控制和调节机构应灵活可靠,紧固部位应无松动。
2.4环境试验要求分析仪的环境试验要求应符合GB/T 14710-2009 中气候环境试验I 组和机械环境试验Ⅱ组的要求。
分析仪的运输试验、电源适应能力应符合GB/T 14710-2009 中第4 章、第5 章的规定。
试验时间、恢复时间及检测项目按表5 的要求执行。
表 5 环境试验要求。
全自动血液细胞分析仪产品技术要求mairui1

2性能指标2.1空白计数分析仪的空白计数结果应符合表1、表 2 的规定。
表1 血液模式空白计数要求表2 体液模式空白计数要求2.2线性血液模式及体液模式线性范围和线性误差应分别符合表3、表4规定。
表 3 血液模式线性要求表 4 体液模式线性要求2.3仪器可比性偏差要求:WBC 不超过±3% ,RBC 不超过±2% ,HGB 不超过±2% ,PL T 不超过±5% ,HCT/MCV 不超过±2% 。
2.4白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞和未成熟粒细胞测试结果应在按照附录B 试验方法所得结果的允许范围之内(99%可信区间)。
2.5重复性血液模式及体液模式重复性应分别满足符合表5、表6的要求。
表 5 血液模式重复性要求以上*号参数注:RET#、RET%、LFR、MFR、HFR、IRF 仅BC-6600、BC-6700、BC-6800、BC-6900、BC-6200、BC-6000Plus、BC-6100Plus、BC-6600Plus、BC-6700Plus、BC-6800Plus 适用;IMG%、IMG#仅BC-6700、BC-BC-6900、BC-6000、BC-6100、BC-6200、BC-6000Plus、BC-6100Plus、BC-6600Plus、BC-6700Plus、BC-6800Plus 适用;IPF 仅BC-6700、BC-6900、BC-6200、BC-6000Plus、BC-6100Plus、BC-6600Plus、BC-6700Plus、BC-6800Plus 适用;RHE 仅BC-6200、BC-6000Plus、BC-6100Plus、BC-6600Plus、BC-6700Plus、BC-6800Plus 适用。
表 6 体液模式重复性指标要求2.6携带污染率高浓度样本对低浓度样本的携带污染程度,血液及体液检测重复性应分别满足符合表7、表8 的要求。
全自动五分类血液细胞分析仪技术参数和招标要求

全自动五分类血液细胞分析仪技术参数和招标规定一、技术参数1、检测原理:多角度激光散射结合细胞化学染色技术,独立嗜碱性粒细胞检测通道。
2、检测速度:≥60个样本/小时,可24小时持续开机(需提供有关资料或彩页证明并上传至电子投标文献);3、标本用量:全血/末梢全血≤15ul;预稀释全血≤20ul(需提供有关资料或彩页证明并上传至电子投标文献);4、操作界面:10寸以上彩色液晶显示屏,同屏显示所有参数,便于人机对话(需提供有关资料或彩页证明并上传至电子投标文献)。
5、检测项目≥35项;6、检测线性范围:WBC:0.00~400.00×109/LRBC:0.00~8.00×1012/LHGB:0~250g/LPLT:0~5000×109/L,7、反复性:WBC≤2.0%,RBC≤1.5%,HGB≤1.5%,MCV≤1.0%,PLT≤4.0%;8、WBC检测通道:白细胞DIFF(分类)通道和BASO(嗜碱性粒细胞)检测通道。
9、防抵死加样针,加样针底部侧方开孔,防止样本量过少时,加样针抵达试管底部,导致吸样量不准带来旳错误成果。
10、软件:具有与仪器配套旳原厂中文数据管理软件11、稀释器:内置稀释器,无需手工添加稀释液。
12、报警功能:具有未成熟细胞、异型/异常淋巴细胞旳报警提醒信息,有助于发现初期白血病。
13、工作环境:温度10℃~30℃;电源:100~240VAC±10%14、配套试剂:仅需两种溶血剂和一种稀释液和一种清洗液,减少使用成本(需提供有关资料或彩页证明并上传至电子投标文献)。
15、溯源性规定:血球分析仪生产厂家需同步生产配套旳血球试剂及校准品、质控品,校准品具有溯源性。
(需提供血球试剂、质控品、校准品注册证或立案凭证以及溯源性证书复印件并上传至电子投标文献)。
16、血球分析仪生产厂家俱有原则化参照试验室旳CNAS(中国合格评估国家承认委员会)试验室承认证书,以保证生产厂家对血球仪具有检测和校准服务旳能力。
血细胞分析仪用校准物(光学法) 产品技术要求mairui

2.性能指标
2.1外观
a)校准物应为一种足够均匀的类血液物质,不得有凝块。
b)校准物的外包装应完整、标签标识清晰。
2.2装量
每瓶校准物装量应不少于 3mL。
2.3均匀性
2.3.1瓶内均匀性
校准物瓶内均匀性应满足表 1 的要求。
表 1 校准物瓶内均匀性的要求(CV)
2.3.2瓶间均匀性
校准物瓶间均匀性应满足表 2 的要求。
表 2 校准物瓶间均匀性的要求(CV)
2.4溯源性
2.4.1靶值表
每批校准物均应提供本批校准物的靶值表。
2.4.2赋值程序
提供赋值程序文件及至少一个批次的赋值记录。
2.4.3校准物的互换性(计量溯源校准的确认)
提供校准物互换性的技术文件。
2.4.4赋值准确性
使用校准物标定的仪器测定定值血,结果偏倚应满足表3的要求。
表 3 定值血测定允许偏倚范围
2.5生物安全性
校准物的乙型肝炎表面抗原(HBsAg)、艾滋病I型/II型(HIV-1/HIV-2)抗体、丙型肝炎(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
全自动血细胞分析仪操作要求、仪器性能评估、运行环境、正确校准、试剂质量的要求、质量控制和测定结果审核

全自动血细胞分析仪操作素质要求、仪器性能评估、运行环境、正确校准、试剂质量的要求、质量控制和测定结果审核全自动血球分析仪血常规测定中非常普及,大大地提高血细胞分析的效率,但由于仪器种类繁多,性能差异较大,而且各种仪器的工作原理也不完全相同,完成一个项目测定要受到仪器、试剂、校准品、操作程序以及操作人员等因素影响,如何避免不同仪器之间测定结果的差异,提高测定结果准确性,全面做好血液分析仪的质量控制是一项非常重要的工作。
操作人员素质要求人是第一要素,是实验仪器操作者,必须经过专门的技术培训。
了解仪器各部件结构,熟悉仪器的性能、工作原理、参数设置、日常的维护以及试剂应用。
具有能解释和处理仪器各种报警信息,对仪器一般故障排除的能力。
血液分析仪性能进行评估新仪器在安装调试之后用于临床测定之前,首先要对新仪器各项性能指标进行初步评估。
按照有关规定对仪器的各项性能指标进行评估,包括仪器的线性范围、精密度、准确度、抗干扰性、白细胞分类以及携带污染率等。
有条件的应与其他性能稳定、运行良好、结果具有可溯源性的仪器进行比对,对新仪器的各项性能指标实际情况有全面了解。
运行环境全自动血球分析仪的正常运行必须依靠一个良好的运行环境。
其中包括一个有稳定电流、电压和接地保护的电源系统,放置仪器的实验台要稳固、防阳光直射,实验室防震、防尘,防潮、通风条件好,室内温度应在15℃~25℃,相对湿度应<80%,仪器安放在远离电磁干扰源、热源的位置,使其有一个相对独立的运行环境。
任何环境因素的变化都可能影响到仪器的稳定性,从而影响测定结果的精密度和准确度,因此,要经常观察并做好相应的记录,及时纠正。
全自动血球分析仪正确校准全自动血球分析仪的校准直接影响到检测结果的正确性,可以采取相应校准方式:1、应选用仪器商提供的配套血细胞校准品进行校准,这是最理想和最实用的方法,但这种原装校准品价格比较昂贵且有效期短,不易普及;2、用新鲜的全血标本进行校准,即用新鲜血液标本在其他已确定用配套校准品校准好且性能稳定的全自动血球分析仪上进行测定,测定多次取均值,将测定的结果视为该标本的标准值,来校准需要校准的仪器,这样也会得到比较满意的结果,也可以用这种方式来校准同一实验室内不同全自动血球分析仪,确保本实验室不同全自动血球分析仪测定结果的一致性。
全自动血液细胞分析仪产品技术要求mairui
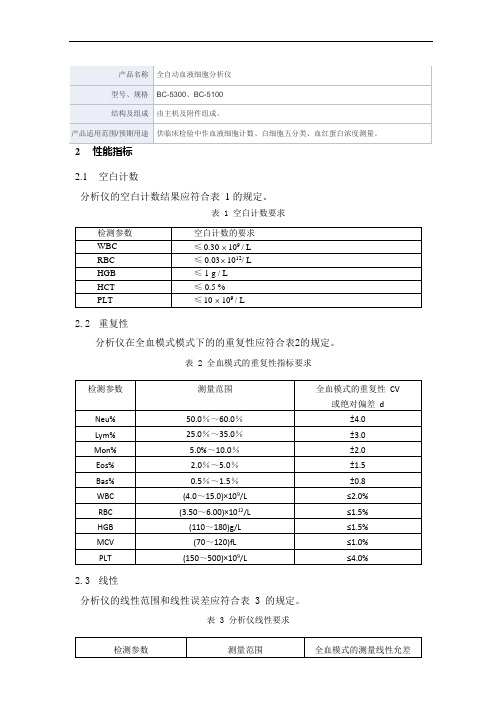
2性能指标2.1空白计数分析仪的空白计数结果应符合表 1 的规定。
表 1 空白计数要求2.2重复性分析仪在全血模式模式下的的重复性应符合表2的规定。
表 2 全血模式的重复性指标要求2.3线性分析仪的线性范围和线性误差应符合表 3 的规定。
表 3 分析仪线性要求2.4携带污染率高浓度样本对低浓度样本的携带污染程度,应满足表4的要求。
表 4 携带污染率2.5仪器可比性偏差要求:WBC 不超过±5%,RBC 不超过±2%,HGB 不超过±2%,PLT 不超过±8%,HCT 或MCV 不超过±3%。
2.6白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞测试结果应在按照附录 B 试验方法所得结果的允许范围之内(99%可信区间)。
2.7分析仪基本功能2.7.1开关机和登录注销功能分析仪应具有开关机、登录、注销的功能。
2.7.2分析功能分析仪可对样本进行分析,并输出检测结果、直方图、散点图。
2.7.3用户管理功能分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
2.7.4样本和病人信息管理功能分析仪至少应提供样本和病人信息的录入、编辑、浏览、删除功能。
2.7.5检测结果数据管理功能分析仪至少应提供检测结果的存储、回顾、查询、审核、打印、备份和导出的功能。
2.7.6质控管理功能分析仪应至少提供四种质控方法。
2.7.7校准管理功能分析仪应至少提供两种校准方式。
2.7.8调试和状态查询功能分析仪应提供调试和系统状态查询的功能。
2.7.9自动维护功能分析仪可根据使用情况,提供定时和定量自动维护的功能以及休眠功能。
2.7.10手动维护功能分析仪应至少提供更换试剂、清洗液路、排空液路等维护功能。
2.7.11自检功能分析仪应提供简单的仪器自动检测功能,以及试剂检测功能。
2.7.12设置功能用户应可对分析仪的相关可设置内容按照需要进行调整。
全自动血液细胞分析仪产品技术要求2

1性能指标1.1空白计数分析仪的空白计数结果应符合表1 的规定。
表 1 空白计数要求1.2线性分析仪的线性范围和线性误差应符合表2 的规定。
表 2 分析仪线性要求1.3仪器可比性偏差要求WBC 不超过±5%,RBC 不超过±2%,HGB 不超过±2%,PLT 不超过±8%, HCT 或MCV 不超过±3%。
1.4重复性分析仪在全血模式模式下的的重复性应符合表3。
表 3 分析仪重复性要求(全血模式)1.5携带污染率高浓度样本对低浓度样本的携带污染程度,应满足表4的要求。
表 4 携带污染率要求1.6白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞测试结果应在按附录B 试验方法所得结果的允许范围之内(99%可信区间)。
1.7分析仪基本功能1.7.1开关机和登录注销功能分析仪应具有开关机、登录、注销的功能。
1.7.2分析功能分析仪具有测量模式(2 种)和血样模式(3 种)对样本进行分析,并能输出检测结果(25 项)、直方图(4 个)、散点图(1 个),以上基本检测参数描述见附录A。
1.7.3用户管理功能分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
1.7.4样本和病人信息管理功能分析仪至少应能提供样本和病人信息的录入、编辑、保存、浏览、删除的功能。
1.7.5检测结果数据管理功能分析仪至少应能提供检测结果的复检提示、存储、回顾、查询、审核、打印、备份和导出的功能。
1.7.6质控管理功能分析仪应至少能提供四种质控方法。
1.7.7校准管理功能分析仪应至少能提供两种校准方式。
1.7.8调试和状态查询功能分析仪应能提供调试和系统状态查询的功能。
1.7.9自动维护功能分析仪应能根据使用情况,提供定时和定量自动维护的功能以及休眠功能。
1.7.10手动维护功能分析仪应能至少提供更换试剂、保养液路的维护功能。
1.7.11自检功能分析仪应能提供简单的仪器自动检测功能,及试剂检测功能。
全自动血液细胞分析仪产品技术要求mairui4

2性能指标2.1空白计数分析仪的空白计数结果应符合表1、表2的规定。
表 1 血液模式空白计数要求注:FR-CRP包含CRP、hs-CRP表2体液模式空白计数要求2.2线性血液模式及体液模式线性范围和线性误差应分别符合表3、表4规定。
表3血液模式线性要求注:FR-CRP包含CRP、hs-CRP表4体液模式线性要求2.3准确度分析仪准确度相对偏差满足表5要求。
表5准确度要求2.4白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞和未成熟粒细胞测试结果应在按照附录B试验方法所得结果的允许范围之内(99%可信区间)。
注:当参考方法检测结果为0,而分析仪检测结果≤1.0%时,检测结论为合格。
2.5精密度血液模式及体液模式精密度应分别满足符合表6、表7的要求。
表6血液模式精密度要求注:FR-CRP包含CRP、hs-CRP表7 体液模式精密度指标要求2.6携带污染率高浓度样本对低浓度样本的携带污染程度,血液及体液检测精密度应分别满足符合表8、表9的要求。
表8血液模式携带污染率要求注:FR-CRP包含CRP、hs-CRP表9体液模式携带污染率要求2.7相关性与对照仪器的相关性应满足表10的要求。
表10相关性要求注:FR-CRP包含CRP、hs-CRP2.8体液检测准确性表11相关性要求2.9分析仪基本功能2.9.1开关机和登录注销功能分析仪应具有开关机、登录、注销的功能。
2.9.2分析功能分析仪可对样本进行分析,并输出检测结果。
2.9.3用户管理功能分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
2.9.4样本和病人信息管理功能分析仪至少应提供样本和病人信息的录入、编辑、浏览、删除功能。
2.9.5检测结果数据管理功能分析仪至少应提供检测结果的存储、回顾、查询、打印和导出的功能。
2.9.6质控管理功能分析仪至少提供两种质控方法。
2.9.7校准管理功能分析仪应至少提供两种校准方式。
血细胞分析仪用质控物产品技术要求mairui

2.性能指标
2.1外观
A)质控物应为一种均匀的物质,不得有凝块。
B)质控物的外包装应完整、标签标识清晰。
2.2装量
质控物的装量应不少于标示量。
2.3均匀性
2.3.1瓶内均匀性
质控物瓶内均匀性应满足表2要求。
不低于适用的血细胞分析仪检测脑脊液、浆液和滑液等体液样本声称的重复性要求。
表 2 质控物瓶内均匀性
2.3.2瓶间均匀性
质控物瓶间均匀性应符合表3要求。
表 3 BC-BF 质控物瓶间均匀性
2.4质控物的定值及范围
2.4.1参考值
每批质控物均应提供本批产品的参考值和参考范围表。
2.4.2赋值程序
提供赋值程序文件及至少一个批次的赋值记录。
2.4.3赋值准确性
应符合表4的要求。
表 4 测定允许变化范围
2.5生物安全性
质控物的乙型肝炎表面抗原(HBsAg)、艾滋病I型/II型(HIV-1/HIV-2)抗体、丙型肝炎(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
血细胞分析仪用质控物(阻抗法) 产品技术要求mairui

2.性能指标2.1外观a)质控物应为一种均匀的类血液物质,不得有凝块。
b)质控物的外包装应完整、标签标识清晰。
2.2装量质控物装量应不小于 3mL。
2.3均匀性2.3.1瓶内均匀性质控物瓶内均匀性应符合表 2 要求。
表 2 BC-3D 质控物瓶内均匀性(CV/%/SD)注:Lymph%,Mid%,Gran%的瓶内均匀性用SD 表示,其余参数的瓶内均匀性用CV 表示。
2.3.2瓶间均匀性质控物瓶间均匀性应符合表 3 要求。
表 3 BC-3D 质控物瓶间均匀性(CV)2.4质控物的定值及范围2.4.1参考值每批质控物均应提供本批产品的参考值和参考范围表。
2.4.2赋值程序制造商需要提供参考值的赋值方法;确定参考范围的文件;并提供赋值程序文件及至少一个批次的赋值记录。
赋值程序详见附录A。
2.4.3赋值准确性在用校准物校准后的血细胞分析仪检测系统上测试定值质控物,应符合表4的要求。
表 4 BC-3D 质控物赋值测定允许变化范围注:* P-LCC 仅适用于BC-30s、BC-31s、BC-30、BC-31、BC-3600、BC-3300、BC-3600CT、BC-3300CT;P-LCR 仅适用于BC-30s、BC-31s、BC-10、BC-11、BC-20、BC-21、BC-30、BC-31、BC-3600、BC-3300、BC- 3600CT、BC-3300CT。
2.5生物安全性质控物的乙型肝炎表面抗原(HBsAg)、艾滋病 I 型/II 型(HIV-1/HIV-2)抗体、丙型肝炎(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
全自动血液分析仪技术参数

全自动血液分析仪技术参数一、产品名称:全自动血液分析仪二、数量:一套三、产品用途:用于在临床实验室中对血液样品进行血细胞计数、分类等检查及相关测量,可对白细胞进行五分类分析,满足临床检查需求。
四、技术要求1、检测原理:流式细胞技术、半导体激光、先进核酸荧光染色法、双鞘流电阻抗法;白细胞计数采用DNA/RNA染色技术,可有效识别血凝块,有效排除难溶红细胞,细胞碎片,巨大血小板,血小板聚集对白细胞计数的干扰,结果更加准确。
2、使用先进的RNA染色技术,对血小板聚集进行有效监测,结果更加可靠。
3、全自动细胞计数和分类≥60个标本/小时,检测参数≥28项(包括研究参数),并且除了可以提供病人报告的数字结果、直方图和散点图外,还可提供异常结果的报警提示以及定量检测幼稚粒细胞,检测灵敏度≤1%;4、提供专业的流程管理软件,内置国际权威机构推荐和经过中国权威机构评价的复检规则,可根据科室的情况进行评估和调整,可满足国内各等级评审对复检的要求。
5、三种微量血模式:静脉全血模式用血量≤20ul,末梢全血模式用血量≤20ul,末梢血预稀释模式用血量≤20ul,三种微量血模式全都可以实现完整五分类,并可满足各种采血量的要求。
6、白细胞分析仅需一个检测通道,即可提供白细胞总计数及五分类的全部结果,不需分开两个通道进行检测,节省试剂。
7、红细胞和血小板在特定的检测通道中采用独特的双鞘流阻抗技术,保证颗粒单个单向通过检测通道,避免颗粒重叠通过和颗粒回旋带来的检测干扰,可有效避免堵孔;并采用浮动界标技术防止血小板、红、白细胞之间的相互干扰,血小板检测更准确。
8、要求所投标产品获得国际医疗审核权威机构美国FAD的认证,产品质量更加有保障。
9、可提供配套的,获FDA认证的试剂、质控品、校准品。
10、具有实时在线网络质控功能,室内质控室间化,反馈时间≤10分钟,为用户的检测结果提供质量保障。
11、全血模式线性,WBC:0.00-400.00×103/µL;RBC: 0.00-8.00×106/µL; HGB: 0.0-250 g/L;PLT:0-5000×103/µL。
全自动五分类血细胞分析仪产品技术要求深圳市希莱恒医用电子

±0.8(绝对偏差)
参数 WBC RBC HGB PLT HCT
表 5 分析仪线性要求
线性范围
线性误差
1.0×109/L~10.0×109/L 10.1×109/L~99.9×109/L 0.30×1012/L~1.00×1012/L 1.01×1012/L~7.00×1012/L
20g/L~70g/L 71g/L~200g/L 20×109/L~100×109/L 101×109/L~999×109/L
试验
通电
试验时
运行试验 4h
—
30℃
—
— 2.2.1
—
√
通电
额定工作
试验时
1h
—
30℃
—
2.2.1 —
—
√
高温试验
通电
高温贮存
试验后
4h
4h
55℃
—
— 2.2.1
220
试验
通电
30℃
额定工作
试验时
4h
—
80±3%R
—
— 2.2.1
220
湿热试验
通电
H
40℃
湿热贮存
试验后
48h 24h
93±3%R
—
— 2.2.1
HCT
≤0.5
1.2.3 精密度
精密度应符合表 4 要求。
参数
WBC RBC HGB PLT MCV NEU% LYM% MON% EOS%
表 4 精密度要求
测量范围
精密度(CV/绝对偏差 d)
3.5×109/L~9.5×109/L
≤2.0%
3.8×1012/L~5.8×1012/L
C—反应蛋白(CRP)质控品产品技术要求mairui
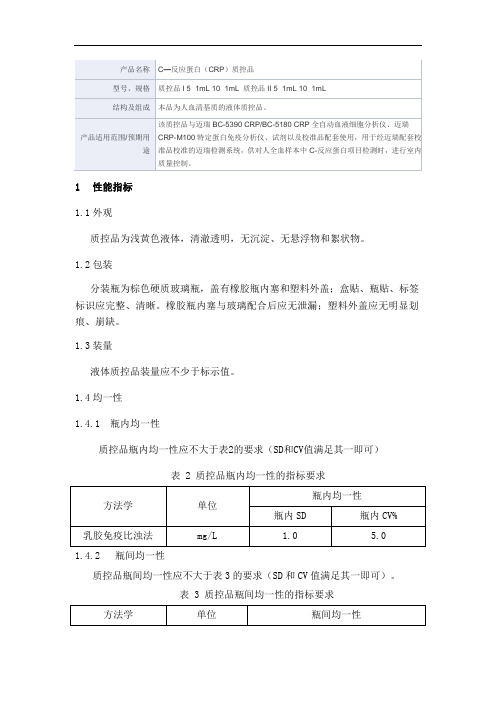
1性能指标
1.1外观
质控品为浅黄色液体,清澈透明,无沉淀、无悬浮物和絮状物。
1.2包装
分装瓶为棕色硬质玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
1.3装量
液体质控品装量应不少于标示值。
1.4均一性
1.4.1瓶内均一性
质控品瓶内均一性应不大于表2的要求(SD和CV值满足其一即可)
表 2 质控品瓶内均一性的指标要求
1.4.2瓶间均一性
质控品瓶间均一性应不大于表3的要求(SD和CV值满足其一即可)。
表 3 质控品瓶间均一性的指标要求
1.5参考值及参考范围
每批质控品均应提供本批产品的参考值和参考范围表。
经迈瑞校准品校准的血液细胞分析仪及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
1.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对质控品中HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
全自动生化分析仪产品技术要求mairui

2.性能指标2.1主要性能指标2.1.1杂散光BS-200E、BS-220E:吸光度应不小于4.6。
BS-360E、BS-360S、BS-370E:吸光度应不小于4.9。
2.1.2吸光度线性范围BS-200E、BS-220E:相对偏倚在±5%范围内的最大吸光度应不小于3.3。
BS-360E、BS-360S、BS-370E:相对偏倚在±5%范围内的最大吸光度应不小于3.5。
2.1.3吸光度准确度应满足表1的要求。
表 1 吸光度准确度2.1.4吸光度的稳定性吸光度变化应不大于0.01。
2.1.5吸光度的重复性用变异系数(CV值)表示,应不大于1%。
2.1.6反应杯温度准确度与波动度恒温室的温度应在37±0.3℃内,温度波动范围应不大于±0.1℃。
2.1.7样品携带污染率BS-200E、BS-220E:样品携带污染率应不大于0.1%。
BS-360E、BS-360S、BS-370E:样品携带污染率应不大于0.05%。
2.1.8加样准确度与重复性加样准确度与重复性应满足表2的要求。
表 2 加样准确度和重复性2.1.9电解质分析模块携带污染率电解质分析模块的携带污染率应满足表 3 的要求。
2.1.10电解质分析模块稳定性电解质分析模块的稳定性应满足表 3 的要求。
2.1.11电解质分析模块准确度电解质分析模块准确度应满足表 3 的要求。
2.1.12电解质分析模块精密度电解质分析模块的精密度应满足表 3 的要求。
2.1.13电解质分析模块线性电解质分析模块的线性应满足表 3 的要求。
表 3 电解质分析模块性能要求2.1.14临床项目的批内精密度变异系数(CV)应满足表4的要求。
表 4 临床项目批内精密度要求2.2功能2.2.1样本管理应具有常规/急诊样本申请,测试结果查询、编辑、审核、打印、双向 LIS 传输、手工结果编辑与查看功能。
2.2.2定标管理应具有定标/试剂空白申请,定标参数查询和打印,定标曲线观察和打印,定标参数重新计算,试剂空白结果观察和打印功能。
全自动血细胞分析仪产品技术要求帝迈生物
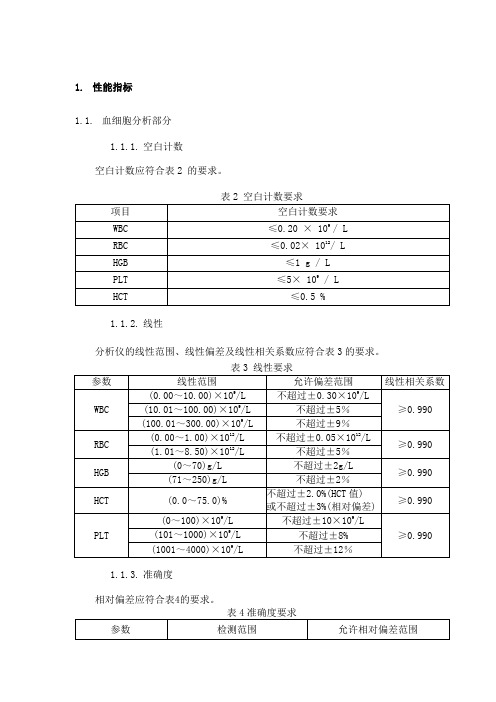
1.性能指标1.1.血细胞分析部分1.1.1.空白计数空白计数应符合表2 的要求。
1.1.2.线性分析仪的线性范围、线性偏差及线性相关系数应符合表3的要求。
1.1.3.准确度相对偏差应符合表4的要求。
1.1.4.精密度分析仪的精密度应满足表5的要求。
1.2.特定蛋白部分1.2.1.准确度准确度以测试平均值与标示值的偏差(B)表示,应不超过±5%。
1.2.2.精密度精密度以变异系数CV表示,应不大于4%。
1.2.3.线性线性以回归的相关系数(r)表示,应不小于0.950。
1.2.4.温度准确度与波动度反应池中的反应液温度值准确度不超过±0.5℃,波动度不大于1℃。
1.2.5.仪器稳定性开机处于稳定工作状态后第4个小时、第8个小时的测试结果与处于稳定工作状态初始时的测试结果的相对偏倚不超过±10%。
2.2.6 加样准确度与重复性对仪器的样品为50ul的一个加样量进行检测,加样准确度误差不超过±5%,变异系数不超过2%。
对仪器的试剂为300ul的一个加样量进行检测,加样准确度误差不超过±5%,变异系数不超过2%。
1.3.分析仪的基本功能分析仪应具有以下基本功能:1.3.1.校准方式:分析仪应至少提供3种校准方式。
1.3.2.质控方法:分析仪应至少能提供2种质控方法。
1.3.3.分析功能:分析仪可对样本进行分析,并输出检测结果、直方图。
1.3.4.进样方式:手动进样。
1.3.5.信息提示功能:分析仪应具有故障提示、操作提示、仪器状态提示、结果异常报警功能。
1.3.6.故障和清除功能:分析仪应具有故障检测和报警功能,并提供一键消除故障的功能。
1.3.7.开关机和登录注销功能:分析仪应具有开关机、登录、注销的功能。
1.3.8.维护功能:1.3.8.1.分析仪具备定时休眠功能;1.3.8.2.分析仪应至少提供整机初始化,电机自检,压力自检,状态监测维护功能;1.3.9.安全性:测试过程全封闭,具有良好的生物安全性;液、电能够有效隔离,具有良好的电安全性。
全自动血液细胞分析仪产品技术要求深圳市美思康电子

全自动血液细胞分析仪1 性能指标1.1 外观要求1.1.1 文字和标志清晰可见;表面应色泽均匀、无磕碰、无划痕等缺陷; 1.1.2 紧固件连接应牢固可靠,不得有松动。
1.2 基本功能要求1.2.1应提供中文报告;1.2.2应具有异常报警功能;1.2.3具有与实验室信息系统进行通信的功能。
1.3 空白计数WBC≤0.5×10 9/L;RBC≤0.05×10 12/L;HGB≤ 2g/L;PLT≤10×10 9 /L 。
1.4 线性表1 分析仪线性要求参数 线性范围 线性误差1.0×10 9/L-10.0×10 9/L 不超过±0.5×10 9/LWBC10.1×10 9/L-99.9×10 9/L 不超过±5%0.30×10 12/L-1.00×10 12/L 不超过±0.05×10 12/LRBC1.01×10 12/L-7.00×10 12/L 不超过±5%20g/L-70g/L 不超过±2g/L HGB71g/L-240g/L 不超过±3%20×10 9/L-100×10 9/L 不超过±10×10 9/L PLT101×10 9/L-999×10 9/L 不超过±10%1.5 仪器可比性偏差要求:WBC不超过±5%,RBC不超过±2.5%,HGB2.5%,PLT不超过±8%,HCT/MCV不超过±3%。
1.6 重复性分析仪的重复性应符合表2的要求表2全自动分析仪重复性要求参数 检测范围 精密度WBC 4.0×10 9/L-10.0×10 9/L ≤4.0%RBC 3.50×10 12/L-5.50×10 12/L ≤2.0%HGB 110g/L-160g/L ≤2.0%PLT 100×10 9/L-300×10 9/L ≤8.0%HCT/ MCV35%-50%85fL-100fL≤3.0%≤3.0%1.7 携带污染率WBC≤3.5%;RBC≤2.0%;HGB≤2.0%;PLT≤5.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2性能指标
2.1空白计数
分析仪的空白计数结果应符合表1 的规定。
表 1 空白计数要求
2.2线性
线性范围和线性误差应符合表 2 的要求。
表 2 线性要求
2.3仪器可比性
偏差要求WBC 不超过±5%,RBC 不超过±2%,HGB 不超过±2%,PLT 不超过±8%, HCT 或MCV 不超过±3%。
2.4白细胞分类准确性试验
分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞测试结果应在按照附录B 试验方法所得结果的允许范围之内(99%可信区间)。
2.5重复性
重复性应满足符合表3的要求。
表 3 重复性要求
2.6携带污染率
高浓度样本对低浓度样本的携带污染程度,应满足符合表4的要求。
表 4 携带污染率要求
2.7仪器相关性
仪器测定FR-CRP 结果,与其他厂家对照仪器结果相关性应满足:r≥0.975。
2.8分析仪基本功能
2.8.1开关机和登录注销功能
分析仪应具有开关机、登录、注销的功能。
2.8.2分析功能
分析仪应能对样本进行分析,并能输出检测结果、直方图、散点图。
2.8.3用户管理功能
分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
2.8.4样本和病人信息管理功能
分析仪至少应能提供样本和病人信息的录入、编辑、保存、浏览、删除的功能。
2.8.5检测结果数据管理功能
分析仪至少应能提供检测结果的复检提示、存储、回顾、查询、审核、打印、备份和导出的功能。
2.8.6质控管理功能
分析仪应至少能提供四种质控方法。
2.8.7校准管理功能
分析仪应至少能提供两种校准方式。
2.8.8调试和状态查询功能
分析仪应能提供调试和系统状态查询的功能。
2.8.9自动维护功能
分析仪应能根据使用情况,提供定时和定量自动维护的功能及休眠功能。
2.8.10手动维护功能
分析仪应能至少提供更换试剂、保养液路的维护功能。
2.8.11自检功能
分析仪应能提供简单的仪器自动检测功能,及试剂检测功能。
2.8.12设置功能
用户应可对分析仪的相关可设置内容按需要进行调整。
2.8.13信息提示功能
分析仪应具有故障提示、操作提示、仪器状态提示、异常报警功能。
2.8.14故障报警和清除功能
分析仪应具有故障检测和报警功能,并能提供一键消除故障的功能。
2.8.15通信功能
分析仪应能提供数据传输接口,具有与实验室信息系统进行通信的功能。
2.8.16数据打印功能
分析仪应能提供数据打印的功能,并能提供中文报告。
2.8.17数据输入功能
分析仪应能支持键盘、条码扫描仪输入或U盘导入信息的功能。
2.8.18日志功能
分析仪应具有日志记录的功能,记录用户操作和故障信息,日志内容应能导出。
2.8.19界面导航功能
分析仪应能提供常用操作的界面导航功能,以便用户方便快捷的切换界面。
2.9外观与结构
2.9.1文字和标志应清晰、准确、牢固;表面应色泽均匀、无磕碰、无划痕、锋棱及毛刺;
2.9.2紧固件连接应牢固可靠,不得有松动;控制件操作应灵活可靠。
2.10安全要求
应符合GB 4793.1-2007《测量、控制和实验室用电气设备的安全要求第一部分:通用要求》、GB 4793.9-2013《测量、控制和实验室用电气设备的安全要求第9部分:实验室用分析和其他目的自动和半自动设备的特殊要求》和YY 0648-2008《测量、控制和实验室用电气设备的安全要求第2-101部分:体外诊断医用设备的专用要求》的要求。
2.11环境试验要求
2.11.1气候环境试验应符合GB/T 14710-2009 中
3.3 气候环境试验I 组(正常工作条件按表
5,
储运条件按表6)的规定。
2.11.2机械环境试验应符合GB/T 14710-2009 中
3.3 机械环境试验I 组的规定,其中碰撞
试
验的试验条件参考II 组的规定。
2.11.3运输试验应符合GB/T14710-2009 中第4 章的规定。
2.11.4分析仪对电源的适应能力试验应符合GB/T 14710-2009 中5.1 的规定。
2.11.5外置电脑应符合GB4943 的规定。
