高中阶段常见元素的化合价
【全新版】常见元素的化合价记忆口诀4
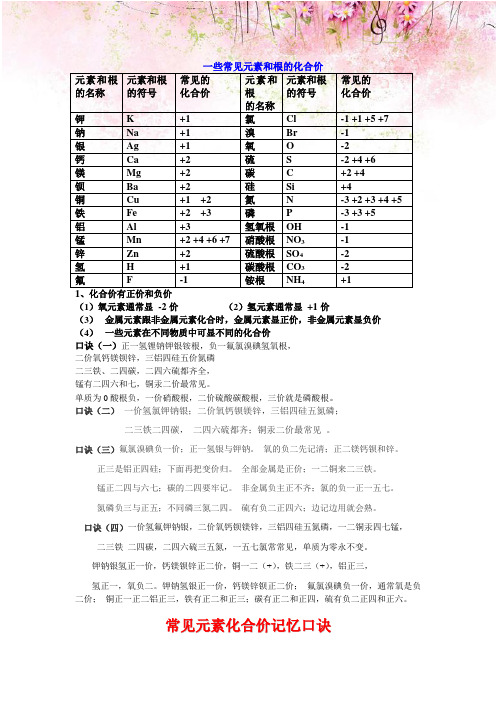
一些常见元素和根的化合价元素和根的名称元素和根的符号常见的化合价元素和根的名称元素和根的符号常见的化合价钾K +1 氯Cl -1 +1 +5 +7钠Na +1 溴Br -1银Ag +1 氧O -2钙Ca +2 硫S -2 +4 +6镁Mg +2 碳 C +2 +4钡Ba +2 硅Si +4铜Cu +1 +2 氮N -3 +2 +3 +4 +5铁Fe +2 +3 磷P -3 +3 +5铝Al +3 氢氧根OH -1锰Mn +2 +4 +6 +7 硝酸根NO3-1锌Zn +2 硫酸根SO4-2氢H +1 碳酸根CO3-2氟 F -1 铵根NH4+11、化合价有正价和负价(1)氧元素通常显-2价(2)氢元素通常显+1价(3)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价(4)一些元素在不同物质中可显不同的化合价口诀(一)正一氢锂钠钾银铵根,负一氟氯溴碘氢氧根,二价氧钙镁钡锌,三铝四硅五价氮磷二三铁、二四碳,二四六硫都齐全,锰有二四六和七,铜汞二价最常见。
单质为0酸根负,一价硝酸根,二价硫酸碳酸根,三价就是磷酸根。
口诀(二)一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;铜汞二价最常见。
口诀(三)氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
口诀(四)一价氢氟钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷,一二铜汞四七锰,二三铁二四碳,二四六硫三五氮,一五七氯常常见,单质为零永不变。
钾钠银氢正一价,钙镁钡锌正二价,铜一二(+),铁二三(+),铝正三,氢正一,氧负二。
钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧是负二价;铜正一正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正六。
化合价表格

在化学中,化合价是一个元素在化合物中的氧化态,通常用罗马数字表示。
化合价是原子之间互相连接的方式,决定了分子的形状和性质。
化合价的概念不仅在无机化学中有广泛应用,也在有机化学中有着重要的应用。
一价表示只有一个原子结合到其他原子或离子中,如氢(H)和氯(Cl)结合成氯化氢(HCl),其中氢原子呈一价。
二价表示有两个原子结合到其他原子或离子中,如氧(O)和两个氢(H)结合成水(H₂O),其中氧原子呈二价。
同样,三价表示有三个原子结合到其他原子或离子中,如铝(Al)和三个氯(Cl)结合成三氯化铝(AlCl₃)。
除了这些基本的化合价,还有更复杂的化合物,其中原子可以呈负价或正价。
负价表示原子获得电子,而正价表示原子失去电子。
例如,在硫酸(H₂SO₄)中,硫(S)呈正六价,因为它失去了六个电子;而在亚硫酸(H₂SO₃)中,硫(S)呈正四价,因为它失去了四个电子。
测它们在化学反应中的行为,以及它们如何与其他元素相互作用。
因此,化合价表格是化学教育中的重要工具,帮助我们理解和预测化合物和化学反应的性质。
ca的化合价

ca的化合价Ca化学元素是钙。
钙是一种金属元素,在化学元素周期表中位于第4周期、第IIA族,常温下呈银白色晶体,有光泽。
不溶于苯,微溶于醇,溶于酸、液氨。
钙的化学性质活泼,在空气中表面上能形成一层氧化物或氮化物薄膜,可减缓进一步腐蚀。
钙元素常见化合价为+2价它处于元素周期表的第四周期第二主族a在化合物中,只有一个化合价就是+2价。
钙是一种金属元素,原子序数为20,符号Ca,在元素周期表中位于第4周期、第IIA族。
钙单质常温下为银白色固体,化学性质活泼,因此在自然界多以离子状态或化合物形式存在。
口诀表,一价氢氯钾钠银,二价氧钙钡镁锌。
三铝四硅五价磷,二三铁,二四碳,铜汞正二最常见,单质元素价为零,正价、负价要分明。
化合价是初中化学接触的一个概念,最开始大概只能理解为一种规则;随着后续化学学习的深入,高中学过氧化还原、元素周期律之后,对化合价的理解才能进一步加深。
大概解释一下,化合价其实是原子得失电子的一种宏观表现,失电子表现为正价,得电子表现为负价。
(个人觉得其实氧化数的概念更有用,题主有兴趣可以去了解一下)(其实高中学氧化还原的时候所谓的化合价,可能已经和氧化数混为一谈了)元素的化合价与化合物中其它元素的种类数量和结合方式有关。
化合价可以很复杂,不一定都是整数,可以出现分数。
中学一般认为氢+1,氧-2,其它元素化合价可以根据这两个来计算。
扩展资料:金属元素锂Li 钠Na 钾K 铷Rb 铯Cs:+1铍Be 镁Mg 钙Ca 锶Sr 钡Ba:+2铝Al:+3锡Sn:+2 +4铅Pb:+2 +4(二氧化铅)钛Ti:+4铬Cr:+2 +3 +6(铬酸根、重铬酸根)锰Mn:+2(锰离子) +4(二氧化锰) +6(锰酸根) +7(高锰酸根)铁Fe:+2(亚铁) +3 (四氧化三铁+8/3,也可以认为是2个+3、1个+2)铜Cu:+1(亚铜) +2锌Zn:+2银Ag:+1汞Hg:+1 +2非金属元素稀有气体中学阶段一般不会接触化合态氢H:-1(金属氢化物) +1氟F:-1(只要和其它元素化合就是-1,包括氧)氯Cl:-1(氯离子) +1(次氯酸根) +3(亚氯酸根) +4(二氧化氯) +5(氯酸根) +7(高氯酸根)溴Br 碘I:-1(X离子) +1(次X酸根) +3(亚X酸根) +5(X酸根) +7(高X酸根)氧O:-2 -1(过氧根、过氧化氢)硫S:-2(硫离子) +2(硫代硫酸根) +4(二氧化硫、亚硫酸根) +6(三氧化硫、硫酸根)氮N:-3(氨、铵根) -2(联氨N2H4) +1(氧化亚氮N2O) +2(一氧化氮) +3(亚硝酸根) +4(二氧化氮、四氧化二氮) +5(硝酸根)磷P:-3(膦) +3(三氯化磷) +5(五氧化二磷、磷酸根)碳C:-4(甲烷) +2(一氧化碳) +3(草酸) +4(二氧化碳、碳酸根) (有机物就看着办吧,自己算)硅Si:+4硼B:+3(硼酸)。
常见元素的化合价口诀表

常见元素的化合价口诀表
一、引言
化学学习中,化合价是至关重要的概念。
为了帮助大家更好地掌握常见元素的化合价,本文将介绍一份常见的化合价口诀表。
这份口诀表包括了金属元素、非金属元素以及常见酸碱盐的化合价,希望能够为广大化学爱好者提供便利。
二、常见元素的化合价口诀表介绍
1.金属元素化合价口诀
金属元素化合价口诀主要包括了一至三价的金属元素。
例如:
钾钙镁铝锌,一价氯氢氧;
二价铁钙铜,三价铝硅磷。
2.非金属元素化合价口诀
非金属元素化合价口诀涵盖了一至五价的非金属元素。
例如:
一价氢氟氯,二价氧硫氮;
三价氯磷硫,四价硅氧氮;
五价磷氯硫,硼钠镁钙钾。
3.常见酸碱盐化合价口诀
常见酸碱盐化合价口诀包括了酸、碱、盐类化合物的化合价。
例如:
酸有一价氢,二价硫酸根;
碱有氢氧根,一价碳酸根;
盐类化合价,根据酸碱定。
三、化合价口诀表的应用
1.快速查询元素化合价
掌握了化合价口诀表,同学们可以迅速查询到元素的化合价,方便进行化学计算。
2.辅助计算化学方程式
化合价口诀表还可以帮助同学们在书写化学方程式时,准确地判断反应物和生成物的化学式,提高方程式的正确性。
3.提高化学学习效率
通过熟悉化合价口诀表,同学们可以更好地理解化学原理,提高学习效率。
四、总结
本文介绍了常见元素的化合价口诀表,包括金属元素、非金属元素以及常见酸碱盐的化合价。
掌握这份口诀表,对于化学学习具有重要的指导意义。
铁离子化合价

铁离子化合价铁在不同的反应中,常表现出不同的化合价,铁分别与盐酸、稀硫酸、硫酸铜溶液等物质反应时,生成+2价铁的化合物(铁与氯气等物质反应时,生成+ 3价的铁的化合物)。
铁与氧化性强的物质一般生成3价铁,即Fe3+. 如:Cl2, Br2, HNO3, 浓H2SO4等.铁与氧化性弱的物质一般生成2价铁,即Fe2+. 如:S, I2, H+等.一般铁发生置换反应时,呈现+2价.化合价是元素的一种重要性质,许多元素虽有多种化合价,但它们在同种化合物中一般只显一种化合价。
铁元素通常有+2价和+3价铁是变价金属,活动性在氢前面,所以他在常温条件下即可和盐酸反应,生成正二价铁离子。
铁有正三价,正二价,零价。
一般相邻价态转化最容易,也就是说零价的铁转化成正二价的反应比转化成正三价的反应更容易发生。
但是如果遇到的非常强氧化性的物质(如硝酸),则他可以直接被氧化成正三价与无氧化性酸(HCl,H2SO4),+2价氧化性酸(HNO3),+3价与弱氧化剂(硫,铜离子等),+2价。
强氧化剂(Cl2等),+3价铁二价为亚铁离子,一般呈浅绿色,有较强的还原性,能与许多氧化剂反应,如氯气,氧气等。
因此亚铁离子溶液最好现配现用,储存时向其中加入一些铁粉。
而铁三价为铁离子,金属阳离子,离子符号Fe。
是铁失去3个电子后形成的离子,是铁的最稳定离子,有中等强度的氧化性。
同时也是一种重要的工业用剂。
两者为不同的铁离子,两者本质区别就是:价态不一样。
在初中阶段:置换反应中,铁生成+2价。
在复分解反应中,铁的化合价不变。
在高中阶段:跟强氧化剂反应,生成+3价;跟弱氧化剂反应,生成+2价。
化合价

2+
HgS
HgCl2。
需要十分熟悉。较不常见的有 Al4C3,C 爲-4 价,水解生成 Al(OH)3 和 CH4。 镓分族不必了解。
ⅣA C Si Ge Sn Pb
C:[-4 ,+4] ,常见的 CO 碳爲+2 价, CO2
+1 −1+ 3 −3
2− − H2CO3 碳爲+4 价,氰根 CN-碳 CO3 HCO3
+1 −1−1 +1+ 3 −3
Cu3P。
CrCl 3,+6 价如 CrO 4 Cr2O 7 。
2−
2−
Mn: +2 价+4 价+6 价+7 价, +2 价如 MnSO4, +4 价如 MnO2, +6 价如 K2MnO4, +7 价如 KMnO4。 其他的 Hg:+1 价+2 价,+1 价如 Hg 2 (双聚) ,+2 价如 HgO Au:+3 价,+3 价如 Au2Cl6(双聚) AuCl 4 。
ⅤA N P As Sb Bi
N:[-3,+5]所有整数化合价均有且均较常见,
NH 3 + N 2H 4 NH 4 , -2 价 ,-1 价 NH2OH,+1 价 N2O, 如-3 价 + − N H ( 肼合氫離子 ) NH ( 氨基離子 ) 2 5 2 氮化物(如Mg N ) 3 2
硒分族不必了解。
ⅦA F Cl Br I At
F:化合态只有-1 价,无正价。 卤素互化物通式 XX n ,n∈{1,3,5,7} ,其中 X 显正价,爲+n 价,X’显负价,爲-1 价。
高中阶段常见元素的化合价(word版)

高中阶段常见元素的化合价(word 版)中学阶段常见元素化合价表注:本表不列出稀有气体、金属的 0 价及非常见价态等。
元素常见化合价 【主要离子】例子 该化合价的性质 元素及单质的其他性质氢 H+1(主要) 【H +】 在大多数化合物中,如 HCl 、 H 2 O 、NaHCO 3 、NH 3 等●有三种同位素:1H 、2H(或 D)、3H(或 T)●单质有 还原性●可燃●密度最小的气体●无色无味-1 【H -】在活泼金属氢化物中及其衍生 物,如 NaH 、KH 、CaH 2 、KBH 4 等有强还原性,可以 和水反应放出 H 2锂 Li +1 【Li +】锂化合物如 LiCl 、LiOH 、Li 2 O 等焰色为深红色 ●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素 6Li 用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成 Li 2 O●强还 原剂钠 Na +1 【Na +】钠化合物如 NaCl 、Na 2 O 2 等焰色为黄色●银白色的活泼金属,可以和水反应,保存在煤 油中●熔点比水低,密度、硬度小●和醇、酸反应 放出氢气●在空气中燃烧生成 Na 2 O 2 ●强还原剂钾 K+1 【K +】钾化合物如 KCl 、KNO 3 等 焰色为紫色(混有 Na +时会为黄色,透 过蓝色钴玻璃才能 看到紫色)●银白色活泼金属,可以和水反应,比钠更剧烈, 保存在煤油中●熔点比水低、密度、硬度小●强还 原剂●在空气中燃烧生成 K 2O 2 和 KO 2●钾钠合金 用作核反应堆的冷却剂镁 Mg +2 【Mg 2+】镁化合物如 MgCl 2 、MgSO 4 等 ●银白色活泼金属,和沸水略有反应●在空气中燃 烧生成 MgO ,也有 Mg 3 N 2 生成●能在 CO 2 等大多 数气体中燃烧●和酸剧烈反应●强还原剂●军事上 用作照明弹钙 Ca+2 【Ca 2+】钙化合物如 CaCl 2 、CaSO 4 、 CaO 等焰色为砖红色 ●银白色活泼金属,和水反应●密度比水大●在空 气中缓慢氧化或燃烧生成 CaO●强还原剂硼 B+3 【BO 33-】大多数硼化合物如 H 3 BO 3 、 B 2 O 3 等铝 Al +3 【Al 3+】 【AlO 2 -】(偏铝 酸根)大多数铝化合物如 Al 2 O 3 、 NaAlO 2 等●银白色活泼金属,在空气中生成致密的氧化膜 阻止进一步氧化●两性金属,可以和强酸、强碱 反应●在浓硫酸、浓硝酸中钝化●高温下有强还原 性,铝热反应的原料碳 C +2 CO 等 有还原性 ●有多种同素异形体,如金刚石、石墨、C 60 等● 高温下有还原性,可以还原金属氧化物、CO 2 等● +4 【CO 32-】 【HCO 3 -】等CO 2 、CS 2 等可以在纯氧中燃烧发出耀眼白光●同位素 14C 用 于考古其他 金属碳化物中碳显负价(如 CaC 2 等);有机物一般不讨论 碳的化合价负价的碳化合物有 还原性硅 Si +4【SiO 3 2-】硅酸盐如 Na 2 SiO 3 、硅酸、SiF 4 、 氟硅酸盐等高中阶段常见元素的化合价(word版)●半导体材料●用作电脑芯片●可以和碱反应放出氢气+3 SiHCl3-4【Si4-】某些硅化物如Mg2 Si、Ca2 Si等和水反应放出自燃性的硅烷氮N +5【NO3 -】硝酸及硝酸盐( 如KNO3 ) 、N2 O5 等硝酸根离子酸化后具有强氧化性●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时和O2 反应产生NO●和H2 高温高压在有催化剂的条件下化合成NH3 ●游离态氮转化+4 NO2 、N2 O4 等易歧化为化合态氮的过程叫做固氮●用作冷却、防腐、+3【NO2 -】亚硝酸及亚硝酸盐( 如NaNO2 )、N2 O3 等亚硝酸跟离子有致癌性保护气体+2 NO 等+1 N2 O 等-3【NH4 +】【N3-】氨气、铵盐(如NH4 C l)、氮化物(如Na3 N、Mg3 N2 等)NH3 溶于酸;铵盐和碱反应生成NH3 ;活泼金属氮化物和水反应放出NH3 ,生成碱其他【N3 -】叠氮化物(如NaN3 等)磷P +5(主要)磷酸及其盐(如H3 P O4 、HPO3 、无显著氧化性●有红磷、白磷(P4 )、黑磷等多种同素异形体●易【PO4 3-】【HPO4 2-】【H2 PO4 -】等K3 P O4 、NaH2 P O4 等)、P4 O10 、PCl5 、POCl3 等燃,在空气中燃烧生成P4 O10 ●白磷易自燃,剧毒,可溶于CS2 ●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●和氧化剂混合易爆+3 【PO3 3-】等H3 P O3 、PCl3 等+1 次磷酸(H3 P O2 )及其盐有强还原性氧O -2氧化物如SO2 、CuO、I2 O5 等;最常见的价态●无色无味的气体,供给呼吸,助燃●最常见的同【O2-】【OH-】【……】-1【O22-】氢氧化物如KOH 等;大多数含氧酸及其盐如HClO4 、BaSO4等;……过氧化物如H2 O2 、Na2 O2 等和水反应放出氧气素异形体是臭氧(O3 ),有鱼腥臭味和很强的氧化性(常温下能将银、硫化铅等物质氧化),易被催化分解,受热易分解●在氧气中高压放电能产生臭氧●液氧为淡蓝色液体,固态为淡蓝色雪花状固体●绝大多数元素都存在氧的化合物●接近100%的纯氧能使人的呼吸停止其他【O2 -】【O3 -】等硫S +6 【SO4 2-】【S2 O82-】【S2 O72-】等超氧化物(如KO2 )、臭氧化物(如CsO3 )、HOF(此处0 价)等SO3 、H2 SO4 、硫酸盐、过硫酸盐、焦硫酸盐、SF6 等强氧化性;超氧化物、臭氧化物和水反应放出氧气●黄色固体,可燃,在空气中燃烧产生淡蓝色火焰,在纯氧中则为蓝紫色火焰●熔点低●和碱金属反应爆炸,研磨即可反应●能和一些不活泼金属如Cu、Hg 反应●溶于二硫化碳或碱金属硫化物溶+4 【SO3 2-】等SO2 、亚硫酸盐等+2 SCl2 等液中●硫的分子式为S8 ●硫有多种同分异构体●硫、碳、硝酸钾用一定的工艺混合可以制成黑火-2【S2-】硫化物(如K2S、H2S、Cu2 S、HgS 等)、硫取代氧的化合物等活泼金属硫化物和药酸反应产生H2 S;某些金属的硫化物则很稳定;还原性氟 F -1 氟化物(如CaF2 、HF、NH4 F、可溶性氟化物有●极毒的淡黄绿色气体,有芥末气味,化学性质【F-】【HF2-】【SiF6 2-】等NH4 HF2 、KHF2 、UF6 、XeF6等)、氟代含氧酸盐、含氟有机物等毒,直接接触可引起严重灼伤极其活泼●无正价●只有少数元素不能和氟直接化合●用于制造含氟高分子材料、制造农药、制造人造血液、分离铀的同位素氯Cl +7 【ClO4 -】高氯酸、高氯酸盐、Cl2 O7 等强氧化剂●剧毒的黄绿色气体,有刺激性气味,化学性质十分活泼●化合价多、氧化物不稳定●有漂白性●+5 【ClO3 -】氯酸、氯酸盐等强氧化剂+4 ClO2 等+3 【ClO2 -】亚氯酸、亚氯酸盐等易液化●可溶于水●用于有机合成,是重要的化工原料+2 ClO·+1 【ClO-】次氯酸、次氯酸盐、Cl2 O等强氧化剂-1 【Cl-】等氯化物等溴Br +7、+5、+4、+3、见“氯Cl”(溴、碘+1 价有BrX、溴酸盐有强氧化性●有毒的深红棕色重质液体,易挥发,有刺激性+1、-1 IX 等) 气味,化学性质活泼●溶于水、乙醇、四氯化碳、苯等●用于消毒碘I +7、+5、+3、+1、见“氯Cl”(次碘酸及其盐常温碘化物有较强的还●深紫色固体,有毒,易升华,有刺激性气味●受-1其他【I3 -】等不存在)碘溶于碘化物溶液中产生:I2 +I-=I3 -原性使淀粉变蓝;有较强的还原性热升华●用于消毒●溶于水、碘化物溶液、乙醇、四氯化碳、苯等铬Cr +6【CrO42-】CrO3 、CrO5 、铬酸盐(BaCrO4 、铬酸跟在酸性条件●银白色金属,十分坚硬●有丰富的价态,化合物【Cr2 O72-】(此价态常见)K2 C rO4 、Na2 C rO4 等)、重(chóng)铬酸盐(K2 C r2 O7 、(NH4 )2 C r2 O7 等)下转化为重铬酸根,碱性条件下逆转换。
用口诀法记忆化学元素化合价

元素化合价记忆口诀1.用口诀法记忆化学元素化合价(1)常规价的:一价氢氯钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷。
(2)变价的:铜一二,铁二三,二(负二)四六硫二四碳,二四六七锰全占。
(3)负价的:负一氟氯和溴碘,负二氧硫负三氮。
2.化合价口诀:钾钠氢银正一价,钙镁锌钡正二价,氟氯溴碘负一价,通常氧是负二价,铜正一二铝正三,铁有正二和正三,碳有正二和正四,硫有负二正四六。
3.常见元素化合价口诀,及原子团化合价K Na Ag H +1价Ca Zn Ba Mg Hg +2价Cu有+1,+2价Fe有+2,+3价记住Al是+3价F和Cl -1价O和S是-2价OH根,根-1价根,根-2价根+1价第1楼一价氢氯钾钠银,二价氧镁钙钡锌,亚铁正二,铝,铁三铜汞二价最常见前正价,后负价,化合物中无余价单质书写为零价硝酸根,氢氧根负一价碳酸根,硫酸根负二价铵根则为正一价第2楼K Na Ag H +1价F Cl Br I —1价Ca Mg Ba Zn +2价通常O S —2价二、三Fe 二、四C三Al、四Si、五价P单质通通显零价初中阶段掌握这么多再加上原子团的化合价就足够了第3楼记口诀其实是最不聪明的办法难道做题的时候背诵一遍口诀先把常见的化合价记下然后结合做题的过程巩固然后在做题过程中遇到其他的新的化合价再去记忆这样记下来的应用起来灵活性很高而死记硬背的应用就没那么顺手了。
第4楼来弄个全的给你氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
常见根价口诀:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
高中化学化合价变价

高中化学化合价变价篇一:高中化学常考变价元素及其变价高中必考化合价1.分析下列常见物质的化合价非金属H NaH CaH2Li2NH 其他+1CH4N2H4O Na2O2H2O2KO2 其他-2As2O3 CH3CH2OH CrO42- S2O42-N NH3NH4+N2H4 N2N2ONONaNO2NO2HNO3 NH4NO3S H2S FeS Cu2S FeS2 S H2S NaS2O3 SO2 H2SO4P Cu3PPH3 P2O3PCl3 PCl5 P2O5 H3PO4Cl HClO4 HClOClO2 Cl-Br HBrO3Br2 Br-I H I O3 I 2I -金属Fe FeS FeOFeS2Fe2O3 Fe3O4Li FePO4FeO42-Cu CuI Cu2SCu3PMn KMnO4K2MnO4 MnO2 Mn2+Cr Cr3+ Cr2O72-CrO42-2.氧化还原反应原则1 总升高= 总降低2 一般向临近价态转化(就近原则)3 低价阳离子,高价酸根4 酸根形式不变价态不变5前后价态一致肯定不变N2O5篇二:化合价与化学式化合价及其变化化合价与化学式一、知识梳理1、化合价的定义知识衔接点拨:这部分内容在初中教材中介绍的不够深入,虽然也可能进行过大量训练,但是由于初中知识的局限性,大多数同学对化合价的概念没有掌握,以至于在进入高中后的学习过程中感到与化合价的变化密切相关的氧化还原理论非常艰涩难懂,甚至在整个高中化学的学习过程中都分不清关于氧化还原反应的相关概念,更不用说弄清它们之间的关系了。
因此,要想从根本上解决这个问题,首先应把常见元素的符号及常见化合价记准背熟,再次应下大力气弄清1-18号元素的核外电子排布和原子结构示意图,按照结构决定性质、性质反映结构的观点,用元素周期律揭示常见元素的主要化合价的递变规律,最后用元素周期表中元素所处的位臵印证元素的性质与原子结构之间的关系,就能真正的领会掌握元素的“位(位臵)、构(原子结构)、性(元素性质)”三者之间的关系,从而更深刻地理解并掌握元素化合价的定义,最终为氧化还原理论的深入学习打下坚实的基础,做好知识的充分准备。
化合价计算公式及过程

化合价计算公式及过程化合价用来表示物质中特定结构的原子的带电特性,具体表现为得失电子或共享电子对的偏差。
需要注意一点的是,只有电子式、结构式(可以是结构简式)中的每一个元素符号才能对应一个唯一的化合价。
比如,丙烷需要写成 \text{ch}_3\text{ch}_2\text{ch}_3 ,中间的碳的化合价是 -2 价而两边的碳的化合价是 -3 价。
计算化合价有两种,一种是计算一种元素可能具有的所有化合价,另一种是计算特定化学物质中具有特定结构的元素的化合价。
1、计算一个元素可能具备的化合价:这要充分学习《普通高中课程标准实验教科书化学选修3 物质结构与性质》才能有初步了解,而大学才有可能详细开设关于物质具体结构的课程,这样就能对原子得失电子,共用电子对偏移和化学键有一个非常清楚的了解,从而能够推算出一个元素可能具备的所有化合价。
也正因为如此,中学阶段,特别是初中的时候,许多化学老师都会给学生制定一个“常见元素化合价”的背诵口诀,以便学生能够根据化合价书写化学式。
答主初中时的老师教的版本是:一价钾、钠、氯、银、氢、二价镁、钙、钡、锌、三价铝、四氧化三铁、四碳和二硫化物都有记录,二价铜和汞最常见。
对于这个版本,回答者觉得不太好。
因为这个版本只能死记硬背,而且不太容易表现元素的化合价和元素周期律的关系。
另外,要求记住非金属元素中碳和硫的正化合价,增加了记忆的复杂性。
于是答主根据元素周期表,创立了一个新的版本:一价锂钠钾氟丸,二价铍镁钙锶钡氧硫化物,三价铝,四氧化三铁,银二价铜汞锌。
对于这个版本,答主不敢说“十分完美”,但答主自己觉得有以下几个优点:•第一个一二三化合价,说明主族中元素的化合价和元素周期律有一定的关系,为学生以后学习元素周期表和元素周期律做铺垫。
而且因为这种关系,只要看元素周期表就更容易记住。
•常见的子族元素放在一起,虽然有些生硬,但是字数少,记忆成本比较低。
•去掉没有记忆意义的非金属正价,减轻记忆负担。
常见化学元素化合价

常见化学元素化合价化学元素的化合价是指元素与其他元素结合时所表现出的电荷数。
化学元素的化合价不仅是化学中的重要概念,也是化学反应和化学式计算的基础。
在化学元素的命名和化合物的构建过程中,了解常见化学元素的化合价是非常重要的。
本文将介绍一些常见化学元素的化合价及相关知识。
1. 氢(H):氢的化合价通常为+1,但在金属化合物中,其化合价可以为-1。
2. 氧(O):氧的化合价通常为-2,但在过氧化物中,其化合价可以为-1。
同时,氧还可以表现出不同的氧化态,如+1、+2和+3等。
3. 氮(N):氮的化合价通常为-3,但在某些化合物中,其化合价可以为+3或+5。
4. 碳(C):碳的化合价通常为+4,在某些有机化合物中,其化合价可以为+2或-4。
5. 硫(S):硫的化合价通常为-2,但在硫化物中,其化合价可以为-1、+2、+4或+6。
6. 氯(Cl):氯的化合价通常为-1,但在氯化物中,其化合价可以为-1、+1、+3、+5或+7。
7. 铁(Fe):铁的化合价通常为+2或+3,但在一些特殊的化合物中,其化合价可以为+0或+6。
8. 锌(Zn):锌的化合价通常为+2。
除了以上所列举的常见化学元素,其他元素的化合价也存在多样性和变化性。
由于篇幅关系,本文无法一一列举。
在实际应用中,化学家们通过实验和观察总结出了大量元素的化合价规律和特点。
掌握了常见化学元素的化合价,我们可以更好地理解元素间的化学反应和化合物的构建过程。
化合价的概念帮助我们预测元素的离子价,从而推断出不同元素结合形成的化合物的化学式。
同时,对于化学方程式的平衡和离子反应的计算,了解化合价也能起到重要的指导作用。
总之,化合价是化学中不可或缺的概念,它能帮助我们理解元素的性质和化合物的构成。
通过掌握常见化学元素的化合价,我们可以更好地应用化学知识于实际应用中,为科学研究和工程技术提供有力支持。
(字数:408)。
高一上册化学知识点总结

高一上册化学知识点总结【导语】高一新生要根据自己的条件,以及高中阶段学科知识交叉多、综合性强,以及考核的知识和思维触点广的特点,找寻一套行之有效的学习方法。
作者为各位同学整理了《高一上册化学知识点总结》,期望对您的学习有所帮助!1.高一上册化学知识点总结元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排挤,使原子半径有增大的偏向2、元素的化合价与最外层电子数的关系:正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
同周期:左→右,核电荷数——→逐渐增多,最外层电子数——→逐渐增多原子半径——→逐渐减小,得电子能力——→逐渐增强,失电子能力——→逐渐减弱氧化性——→逐渐增强,还原性——→逐渐减弱,气态氢化物稳固性——→逐渐增强价氧化物对应水化物酸性——→逐渐增强,碱性——→逐渐减弱2.高一上册化学知识点总结一、无机非金属材料的主角——硅1、构成有机物的最不可缺少的元素是碳,硅是构成岩石和矿物的基本元素。
2、SiO2是由Si和O按1:2的比例所组成的立体网状结构的晶体,是光纤的基本原料。
3、凡是立体网状结构的晶体(如金刚石、晶体硅、SiC、SiO2等)都具有熔点高、硬度大的物理性质,且一样溶剂中都不溶解。
4、SiO2和强碱、氢氟酸都能反应。
前者说明碱溶液不能盛在玻璃塞试剂瓶中;后者说明雕刻玻璃的原因。
5、硅酸是用水玻璃加盐酸得到的凝胶,离子方程式为SiO32-+2H+=H2SiO3。
凝胶加热后的多孔状物质叫硅胶,能做干燥剂和催化剂载体。
化学常见元素化合价

化学常见元素化合价化学中的元素化合价是指元素在化合物中能够形成的化合物最稳定的化合物的电荷状态。
元素的化合价取决于其原子的电子结构和价电子数。
化合价可以帮助我们理解元素在化学反应中的行为和性质,从而为化学反应的设计和应用提供指导。
以下是一些化学常见元素的化合价的讨论:1.碱金属元素(1A族):碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素的化合价通常为+1,因为它们在化合物中丢失一个电子形成阳离子。
2.碱土金属元素(2A族):碱土金属元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素的化合价通常为+2,因为它们在化合物中丢失两个电子形成阳离子。
3.铝族元素(3A族):铝族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铊(Tl)。
这些元素的化合价通常是多样化的。
硼的化合价是+3,其余元素的化合价为+3或+14.碳族元素(4A族):碳族元素包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
这些元素的化合价通常为+4,因为它们通常会共享四个电子形成共价键。
5.氮族元素(5A族):氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
这些元素的化合价通常为-3,因为它们通常会接受三个电子形成阴离子。
6.氧族元素(6A族):氧族元素包括氧(O)、硫(S)、硒(Se)、碲(Te)和钋(Po)。
这些元素的化合价通常为-2,因为它们能够接受两个电子形成阴离子。
7.卤素元素(7A族):卤素元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素的化合价通常为-1,因为它们能够接受一个电子形成阴离子。
8.高反应性金属元素(B族和7B族):包括硼(B)、铝(Al)、氮(N)、磷(P)、硫(S)等元素。
这些元素的化合价通常比较复杂,取决于不同的反应条件和配位环境。
需要注意的是,元素的化合价并不是固定不变的,它可以在不同化合物中发生变化。
高中阶段常见元素的化合价之欧阳道创编

欧阳道创编2021.03.06
中学阶段常见元素化合价表
创作:欧阳道注:本表不列出稀有毛体.全属的0价及非常见价态
等。
说朗:
1.柱表示化合扬的价态时,除了用“需"、“亚"、“次" 等字来
表示,还可以用带有括号的罗马数字表示,如“氣化亚铁''可以表示为“氣化铁(II)",读作“氣化铁二''或“氣化二价铁
",但因为二价铁有专用的“亚铁'‘来表示,因此通帝读作并写作“氣化亚铁"。
2.本表仅适用于准备克界和基础好并且感兴趣的同学,有少量内
彖会和教科书上所示的不同,考试时以教科书和考纲为准。
化合价表_精品文档

化合价表高考化学蒙题技巧例题1、在一定体积的密闭容器中充入 3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g)=4X(g)+nY(g)反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是A、2B、3 C 、4 D、5思维:我们知道87.5%比1小,所以左边系数相加必须大于右边系数相加,满足条件只有A.例题2、已知二氯苯的同分异构体有3种,则四氯苯的同分异构体有A、2种B、3种C、4种D、5种思维:苯环有6个取代位置,四氯苯相当于二氯苯,也是3个例题3、38.4g铜跟适量的浓HNO3反应,铜全部作用后,共收集到气体22.4L(标况),反应消耗的HNO3的物质的量可能是A、1.0molB、1.6molC、2.2molD、2.4mol思维:因为气体有可能是NO和NO2,正常的解法是,列出两个反应式,然后列方程组计算。
其实不必,我们完全可以假定全部生成的是NO计算出消耗量,假定全部是NO2,计算出消耗量,答案就在两个数值之间。
选C.或者直接列总方程式计算,也快捷的多。
高考化学选择题怎么蒙重点是基本概念和基本理论,无机化学,有机化学这三大版块,这三大板块是整个高中化学的主干知识。
第一轮复习在紧扣课本复习的同时注意概念的理解记忆并不是机械式的死记硬背,尽量把晦涩的概念转化为自己易懂的语言,不但这样方便理解,而且记得会更牢。
这个阶段的练习也很重要,但是切记不要题海战术,适当的练习即可,但是练习之后对于错题要及时总结无机化学,无论是反应方程式还是各种化学现象,都要结合元素周期表最外电子层分布规律来学习。
主要记背各反应、实验中所产生的特殊气体、颜色沉淀等物理现象。
有机部分,注重官能团的特征,能够参与反应的类型。
注意碳链结构的组合方式、命名规则。
掌握这两部分,学生即可自行推导反应公式,从本质上理解化学。
化学选择题蒙题技巧1、任何化学反应先从元素周期表角度考虑化学的反应原理都是最外电子层是否“饱和”的问题,物态的化合价基本符合元素周期表分布规律,只有少数多化合价的,要抄下牢记。
高一化学知识点-元素周期表

高一化学知识点:元素周期表高一化学知识点:元素周期表一、元素周期表原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、周期序数=电子层数;主族序数=最外层电子数3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数二二质子数+中子数:A==Z+N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
七大方法助你告别化学“差生”一.尽快去找化学老师,让他告诉你以前学过的关键知识点,在短期内掌握,目的是能够大致跟上现在的教学进度,以听懂老师讲授的新知识。
要想进步,必须弄清楚导致化学成绩差的根本原因是什么?是常用的几个公式、概念没记住,还是很重要的几个基本解题方法不能熟练应用,或者是以前的一些重点知识没有理解透彻等等。
常见元素的化合价记忆口诀4

一些常见元素和根的化合价元素和根元素和根常见的元素和元素和根常见的的名称的符号化合价根的符号化合价的名称钾K+1氯Cl-1+1+5+7钠Na+1溴Br-1银Ag+1氧O-2钙Ca+2硫S-2+4+6镁Mg+2碳C+2+4钡Ba+2硅Si+4铜Cu+1+2氮N-3+2+3+4+5铁Fe+2+3磷P-3+3+5铝Al+3氢氧根OH-1锰Mn+2+4+6+7硝酸根NO3-1锌Zn+2硫酸根SO4-2氢H+1碳酸根CO3-2氟F-1铵根NH4+11、化合价有正价和负价(1)氧元素通常显-2价(2)氢元素通常显+1价(3)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价(4)一些元素在不同物质中可显不同的化合价口诀(一)正一氢锂钠钾银铵根,负一氟氯溴碘氢氧根,二价氧钙镁钡锌,三铝四硅五价氮磷二三铁、二四碳,二四六硫都齐全,锰有二四六和七,铜汞二价最常见。
单质为0酸根负,一价硝酸根,二价硫酸碳酸根,三价就是磷酸根。
口诀(二)一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;铜汞二价最常见。
口诀(三)氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
口诀(四)一价氢氟钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷,一二铜汞四七锰,二三铁二四碳,二四六硫三五氮,一五七氯常常见,单质为零永不变。
钾钠银氢正一价,钙镁钡锌正二价,铜一二(+),铁二三(+),铝正三,氢正一,氧负二。
钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧是负二价;铜正一正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正六。
常见元素化合价记忆口诀氢钾钠银+1价,氟氯溴碘-1价,钙镁钡锌+2价,通常氧硫-2价,金属铝铁+3价,氮磷最低-3价,还有其他可变价。
S4N4中元素化合价及结构式的推定与思考

试题 中反 应 前 后 元 素 化 合 价 变 化 情 况 的判 定 是 争议 的焦 点. 其实 , 方 程式 配 平方 法 的不 同 , 并 不 影 响
的化 合 价 是 如何 确 定 的呢 ?考 虑 到 反 应 时有 s元 素 从 +2价 降为 0价 , 因此 必有 元 素的化 合 价升 高. 由 于
产 物 中 NH C I 不 含 化 合 价 升 高 的元 素 , 故 化 合 价 升
高 的元 素必 在 S N 中 . 又 因 为 N 一 般 显 一 3价 , 所 以
配平 的结 果 . 例如 , 本 试 题 方 程 式 的 配 平 还 可 用 0价
配 平法 , 即假 设 在 S N 中 S与 N 的化 合 价均 为 0价 , 配平 的结 果 仍 相 同. 但是 , 元 素 化 合 价 变 化 的 实 际 情
与众 多学 生及 教 师的强 烈 争议 , 现将 争 议 的情 况 和 由
此 引发 的思考 展现 如下 . 1 试 题 的 内 容
S C 1 和 NH。 在 1 6 0℃作 用 下 得 到 S N 、 NH C l 和 s . 该 反应 过程 中 . 氧化剂 和还 原剂 的物 质 的量之 比
联合 考试 理 科 综 合 能 力 测 试 ” 试卷 中一道有关 s N
( 四氮化 四硫 ) 中元 素 化 合 价 的 判 定 问 题 引 起 了 笔 者
学 阶段 是合 理 的 , 学 生 也 完 全 能 够 理 解 和 接 受. 实 际
上, 这 种推 断 能力 的培 养也 正 是 学 校化 学 教 育 所 要追 求 的根本 目标 之一 1 2 种 可能 的 结 构 式 , 哪 个 是 正 确 的 呢 ?这 个 问题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注:本表不列出稀有气体、金属的0价及非常见价态等。
元素
常见化合价
【主要离子】
例子
该化合价的性质
元素及单质的其他性质
氢H
+1(主要)
【H+】
在大多数化合物中,如HCl、H2O、NaHCO3、NH3等
●有三种同位素:1H、2H(或D)、3H(或T)●单质有还原性●可燃●密度最小的气体●无色无味
叠氮化物(如NaN3等)
磷P
+5(主要)
【PO43-】
【HPO42-】
【H2PO4-】等
磷酸及其盐(如H3PO4、HPO3、K3PO4、NaH2PO4等)、P4O10、PCl5、POCl3等
无显著氧化性
●有红磷、白磷(P4)、黑磷等多种同素异形体●易燃,在空气中燃烧生成P4O10●白磷易自燃,剧毒,可溶于CS2●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●和氧化剂混合易爆
剧毒;强氧化性
镓Ga
铟In
+3
【Ga3+、In3+】
大多数镓、铟化合物中
●镓的熔点低于体温
碳C
+2
CO等
有还原性
●有多种同素异形体,如金刚石、石墨、C60等●高温下有还原性,可以还原金属氧化物、CO2等●可以在纯氧中燃烧发出耀眼白光●同位素14C用于考古
+4
【CO32-】
【HCO3-】等
CO2、CS2等
+4
NO2、N2O4等
易歧化
+3
【NO2-】
亚硝酸及亚硝酸盐(如NaNO2)、N2O3等
亚硝酸跟离子有致癌性
+2
NO等
+1
N2O等
-3
【NH4+】
【N3-】
氨气、铵盐(如NH4Cl)、氮化物(如Na3N、Mg3N2等)
NH3溶于酸;铵盐和碱反应生成NH3;活泼金属氮化物和水反应放出NH3,生成碱
其他【N3-】
锶Sr
钡Ba
+2
【Sr2+】
【Ba2+】
锶、钡化合物如SrCl2、BaSO4等
锶的焰色为深红色,钡的焰色为黄绿色;Ba2+有毒
●银白色活泼金属,可以和水反应●密度比水大●强还原剂●可以在空气中燃烧
硼B
+3
【BO33-】
大多数硼化合物如H3BO3、B2O3等
铝Al
+3
【Al3+】
【AlO2-】(偏铝酸根)
-1
【H-】
在活泼金属氢化物中及其衍生物,如NaH、KH、CaH2、KBH4等
有强还原性,可以和水反应放出H2
锂Li
+1
【Li+】
锂化合物如LiCl、LiOH、Li2O等
焰色为深红色
●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素6Li用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成Li2O●强还原剂
钠Na
+1
【Na+】
钠化合物如NaCl、Na2O2等
焰色为黄色
●银白色的活泼金属,可以和水反应,保存在煤油中●熔点比水低,密度、硬度小●和醇、酸反应放出氢气●在空气中燃烧生成Na2O2●强还原剂
钾K
+1
【K+】
钾化合物如KCl、KNO3等
焰色为紫色(混有Na+时会为黄色,透过蓝色钴玻璃才能看到紫色)
有强氧化性
●铅和酸反应生成二价铅化合物,四价铅则难达到●质软的金属●有毒●熔点较低,常用来制合金●可以防护放射线●在空气中生成致密的碱式碳酸铅氧化膜
+2(主要)
【Pb2+】
二价铅化合物如PbO、PbCl2等
氮N
+5
【NO3-】
硝酸及硝酸盐(如KNO3)、N2O5等
硝酸根离子酸化后具有强氧化性
●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时和O2反应产生NO●和H2高温高压在有催化剂的条件下化合成NH3●游离态氮转化为化合态氮的过程叫做固氮●用作冷却、防腐、保护气体
镁Mg
+2
【Mg2+】
镁化合物如MgCl2、MgSO4等
●银白色活泼金属,和沸水Байду номын сангаас有反应●在空气中燃烧生成MgO,也有Mg3N2生成●能在CO2等大多数气体中燃烧●和酸剧烈反应●强还原剂●军事上用作照明弹
钙Ca
+2
【Ca2+】
钙化合物如CaCl2、CaSO4、CaO等
焰色为砖红色
●银白色活泼金属,和水反应●密度比水大●在空气中缓慢氧化或燃烧生成CaO●强还原剂
+3【PO33-】等
H3PO3、PCl3等
+1
次磷酸(H3PO2)及其盐
有强还原性
-3
【P3-】
磷化物(如K3P等)
砷As
+5【AsO43-】等
砷酸及其盐、As2O5
●有灰色类金属砷(灰砷)、黄砷、黑砷等多种同素异形体●可燃●大多数含砷化合物有剧毒●用作半导体
+3【AsO33-】等
亚砷酸及其盐、As2O3
●银白色活泼金属,可以和水反应,比钠更剧烈,保存在煤油中●熔点比水低、密度、硬度小●强还原剂●在空气中燃烧生成K2O2和KO2●钾钠合金用作核反应堆的冷却剂
铷Rb
铯Cs
+1
【Rb+】
【Cs+】
铷、铯化合物如RbCl、CsCl等
铷的焰色为浅紫色,铯的焰色为天蓝色
●铷是银白色金属,铯是略带金黄色光泽的金属,熔点低,和水极其猛烈地反应●铯可以在空气中自燃●强还原剂
其他
金属碳化物中碳显负价(如CaC2等);有机物一般不讨论碳的化合价
负价的碳化合物有还原性
硅Si
+4
【SiO32-】
硅酸盐如Na2SiO3、硅酸、SiF4、氟硅酸盐等
●半导体材料●用作电脑芯片●可以和碱反应放出氢气
+3
SiHCl3
-4
【Si4-】
某些硅化物如Mg2Si、Ca2Si等
和水反应放出自燃性的硅烷
-3
砷化物(如AsH3、K3As等)
活泼金属砷化物和水反应产生H3As
其他
As4S4等
锑Sb
+5【SbO3-】
【SbF6-】等
SbF5、HSbF6、SbCl5、锑酸盐等
SbF5或锑和氟构成的阴离子有极强的酸性
●熔点低,有多种同素异形体,但只有灰锑最稳定●用作合金、半导体●有毒
锗Ge
+4
GeO2等
●半导体材料
锡Sn
+4
【Sn4+】
四价锡化合物如SnO2、SnCl4等
可溶于过量强碱
●熔点较低,常用来制备合金,如青铜(传统的青铜是铜锡合金)、焊锡等
+2
【Sn2+】
亚锡化合物如SnCl2、SnSO4等
有还原性;溶于过量强碱
铅Pb
+4
【Pb4+】
四价铅化合物如Pb(CH3COO)4、PbO2等;Pb3O4含有+2和+4价的铅。
大多数铝化合物如Al2O3、NaAlO2等
●银白色活泼金属,在空气中生成致密的氧化膜阻止进一步氧化●两性金属,可以和强酸、强碱反应●在浓硫酸、浓硝酸中钝化●高温下有强还原性,铝热反应的原料
铊Tl
+1【Tl+】
亚铊化合物如TlCl等
剧毒
●较软的银白色金属,和酸反应生成亚铊化合物●剧毒
+3【Tl3+】
三价铊化合物如Tl2O3等
