高考化学氯及其化合物综合练习题含详细答案
高考化学氯及其化合物的综合热点考点难点含详细答案

高考化学氯及其化合物的综合热点考点难点含详细答案一、高中化学氯及其化合物1.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
(1)NaClO中Cl的化合价为____,有较强的___(填氧化、还原)性。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO42-,此反应的离子方程式为____。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为____。
【答案】+1 氧化 2ClO3-+SO2=2ClO2+SO42- 2:5【解析】【分析】(1)根据化合物中正负化合价的代数和为0;根据次氯酸盐中Cl的化合价分析判断;(2)①KClO3与SO2在强酸性溶液中反应生成ClO2、硫酸根离子;②根据得失电子守恒计算。
【详解】(1)NaClO中Na为+1价,O为-2价,化合物中总化合价为0,则Cl为+1价;次氯酸盐中+1价的氯元素易得到电子,具有较强氧化性,故答案为:+1;氧化;(2)①KClO3与SO2在强酸性溶液中反应可制得ClO2,根据氧化还原反应的规律,同时应生成硫酸钾,反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-,故答案为:2ClO3-+SO2=2ClO2+SO42-;②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,反应中ClO2为氧化剂,Cl 元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2∶5,故答案为:2∶5。
【点睛】本题的易错点为(2)②,要注意氧化还原反应的计算的一般方法的应用,解答本小题,也可以书写出反应的方程式再分析计算。
2.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸化的硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。
2020-2021备战高考化学 氯及其化合物综合试题及答案

2020-2021备战高考化学氯及其化合物综合试题及答案一、高中化学氯及其化合物1.Cl2通人70℃的NaOH水溶液中,发生氧化—还原反应,反应完成后,测得溶液中NaClO与NaClO3的物质的量之比为4∶1,则:(1)配平溶液中所发生反应的化学方程式:____Cl2+______NaOH=____NaCl+____NaClO3+_____NaClO+____ ____(2)反应中的氧化产物为_________________。
(3)已知生成0.1mol NaClO,反应中转移的电子总数是__________ mol,若溶液的体积正好为100mL,则溶液中NaCl的物质的量浓度为________ mol/L。
【答案】7149147 NaClO 3 NaClO 0.225 2.25【解析】【分析】【详解】(1)据题设条件,先定NaClO、NaClO3的化学计量数为4、1,再利用化合价升降法:升高总数为4×1+1×5=9,降低总数为1,配平得7Cl2+14NaOH=9NaCl+NaClO3+4NaClO+7H2O;(2)分析反应得氧化剂、还原剂均为Cl2,Cl元素被氧化生成NaClO3与NaClO,氧化产物为NaClO3与NaClO;(3)由反应知每转移9mol电子,生成4molNaClO,则生成0.1molNaClO,反应中转移的电子总数是0.225mol,同时生成NaCl为0.225mol,若溶液的体积正好为0.1L,则溶液中NaCl 的物质的量浓度为2.25mol·L-1。
2.氯及其化合物在工农业生产和人类生活中有着重要的作用。
回答下列问题:(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。
2020-2021高考化学压轴题专题复习—氯及其化合物的综合含答案

2020-2021高考化学压轴题专题复习—氯及其化合物的综合含答案一、 高中化学氯及其化合物1.Cl 2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.完成下列填空:(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO 的杀菌能力比ClO ﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).(4)在氯水中,下列关系正确的是__(选填编号).a c (HClO )+c (ClO ﹣)=c (H +)﹣c (OH ﹣)b c (H +)=c (ClO ﹣)+c (Cl ﹣)+c (OH ﹣)c c (HClO )<c (Cl ﹣)d c (Cl ﹣)<c (OH ﹣)(5)ClO 2是一种更高效、安全的消毒剂,工业上可用ClO 2与水中的MnCl 2在常温下反应,生成MnO 2和盐酸,以除去水中Mn 2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO 2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.【答案】3s 23p 5 自旋方向 Cl ﹣、O 2﹣、H ﹣ Cl 2(aq )+H 2O 垐?噲?HClO+H ++Cl ﹣、HClO 垐?噲?H ++ClO ﹣、Cl 2(g )垐?噲?Cl 2(aq ) 夏季温度高,HClO 易分解,杀菌效果比在冬季差 bc 2ClO 2+5MnCl 2+6H 2O=5MnO 2+12HCl 错 MnO 2和浓盐酸加热的条件下才能反应【解析】【分析】【详解】(1)氯是17号元素,其最外层电子的电子排布式为253s 3p ,若用轨道表示式来描述,则可以描述其电子的自旋方向;(2)+H 相当于光秃秃的质子,2-O 填满了前两层电子,而-Cl 填满了前三层电子,半径由大到小为-2-+Cl >O >H ;(3)首先氯气存在溶解—挥发平衡,即22Cl (g)Cl (aq)ƒ,其次氯气还能和水发生可逆反应,即22Cl +H O HCl+HClO ƒ,而HClO 是一个弱酸,存在电离平衡+-HClO H +ClO ƒ; 夏季和冬季最大的区别在温度,我们知道HClO 受热易分解,因此杀菌效果变差;(4)a.溶液中存在质子守恒---+c(OH )+c(Cl )+c(ClO )=c(H ),若要a 项成立除非-c(HClO)=c(Cl ),但是二者不可能相等,a 项错误;b.该项即溶液中存在的质子守恒,b 项正确;c.氯气和水反应得到等量的HCl 和HClO ,HCl 是强酸可以完全电离,因此溶液中-Cl 的量等于生成的HCl 的量,而HClO 是弱电解质部分电离,因此剩余的HClO 的浓度将小于-Cl 的浓度,c 项正确;d.氯水呈酸性,因此溶液中的-c(OH )极低(室温下-7<10mol/L ),因此不可能出现--c(OH )>c(Cl )的情况,d 项错误;答案选bc ;(5)2ClO 作氧化剂,2+Mn 作还原剂,二者发生氧化还原反应22222ClO +5MnCl +6H O=5MnO +12HCl ,该反应得到的盐酸较稀,且没有加热,因此不太可能被2MnO 继续氧化变成氯气,反应在这一步就停止了。
2019_2020学年高中化学2.2氯及其化合物综合训练含解析新人教版必修第一册

综合训练1.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟B.钠在氯气中燃烧,生成白色的烟C.氯气能与水反应生成次氯酸和盐酸,久置,氯水最终会变为稀盐酸D.氯气在常温下能与铁反应,故不能用铁罐存放液氯答案 D解析常温下氯气与铁不反应,故工业上用铁罐存在液氯。
2.用氯气消毒的自来水配制下列溶液时,会使配得的溶液变质的是( )①NaOH②AgNO3③Na2CO3④NaBr⑤FeCl2A.只有②④B.只有④⑤C.只有②④⑤ D.全部答案 D解析用氯气消毒的自来水中有Cl2和HCl等,会使配制的溶液变质。
①Cl2+2NaOH===NaCl+NaClO+H2O,②Cl-+Ag+===AgCl↓,③Na2CO3+2HCl===2NaCl+H2O+CO2↑,④2NaBr+Cl2===2NaCl+Br2,⑤2FeCl2+Cl2===2FeCl3。
3.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )①氯气②液氯③新制氯水④氯气的四氯化碳溶液⑤盐酸⑥盐酸与少量漂白粉的混合溶液A.①②④ B.①②⑤C.③⑥ D.②④⑤答案 C解析能使干燥的蓝色石蕊试纸先变红后褪色,要求该物质具有酸性和漂白性。
酸性要有H+,漂白性要有HClO。
①②④中只有Cl2;⑤中盐酸只有酸性无漂白性;③中新制氯水中含有Cl2、HCl和HClO;⑥中发生反应:Ca(ClO)2+2HCl===CaCl2+2HClO,且与少量漂白粉反应盐酸过量。
4.将紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢褪去,其原因是( )①氯气有漂白性②氯气与NaOH溶液反应③氯气的水溶液呈酸性④次氯酸有漂白性⑤氯化钠有漂白性A.①④ B.②③④ C.①②③ D.①⑤答案 B解析Cl2与NaOH溶液反应生成NaCl和NaClO,当Cl2过量时,Cl2与水反应生成HCl 和HClO,溶液呈酸性,因此使石蕊试液变红色,而HClO有漂白性,又使溶液褪色。
氯及其化合物练习及答案

氯及其化合物1.下列说法正确的是()①Cl2的性质活泼,与H2混合后立即发生爆炸②实验室制取Cl2时,为了防止环境污染,多余的Cl2可以用Ca(OH)2溶液吸收③若Cl2发生泄漏,应立即向上风地区转移④检验HCl气体中是否混有Cl2,方法是将气体通入AgNO3溶液中⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中A.①②③B.②③④C.③D.③⑤2.下列说法正确的是()A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可B.欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存D.实验室用MnO2和稀HCl加热法制取Cl2时,若有14.6gHCl参加反应,则可制得3.55g Cl23.下列关于氯气的叙述正确的是()A.钠在氯气中燃烧产生白色烟雾B.通常状况下,干燥的氯气能和Fe反应C.纯净的氢气可以在氯气中安静地燃烧,发出黄色火焰D.向田鼠洞里通入氯气杀灭田鼠,利用了氯气有毒和密度较大的性质4.当有大量Cl2逸散到周围空间,你认为以下措施合理的是()①迅速拨打求救电话;②迅速撤离至地势较高处;③迅速撤离至下风口;④用浸有一定浓度NaOH溶液的口罩或毛巾捂住口鼻;⑤用浸有一定浓度Na2CO3溶液的口罩或毛巾捂住口鼻;⑥尽可能切断泄漏源(如堵住泄漏口,将其浸入碱液池等)A.①②④⑥B.①②⑤⑥C.①③⑤⑥D.①②④⑤⑥5.用氯气消毒的自来水配制下列溶液时,会使配得的溶液变质的是()①NaOH②AgNO3③Na2CO3④NaBr⑤FeCl2A.只有②④B.只有④⑤C.只有②④⑤D.全部6.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是()①氯气②液氯③新制的氯水④氯气的酒精溶液⑤盐酸⑥盐酸酸化的漂白粉溶液A.①②③B.①②③⑥C.③⑥D.②③⑥7.下列反应过程中不会产生气体的是A.B.C.D.8.新制氯水分别与下列四种物质发生反应,其中能证明新制氯水具有酸性的是()A.FeCl2B.AgNO3C.KI D.Na2CO39.饱和氯水久置后,溶液中的各种粒子:①Cl2②CIO-③CI-④HClO⑤H+减小的是()A.①②④B.①②③C.①④D.②④10.如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是A.浓硫酸B.饱和NaCl溶液C.浓NaOH溶液D.浓KI溶液11.(1)氯水呈颜色;(2)氯水与硝酸银溶液反应,直接与银离子反应的微粒;(3)氯水使蓝色的石蕊试纸(填现象),其主要是因为其中含有等微粒;(4)新制的氯水保存在;(5)微热新制的氯水,看到的现象是;(6)在某NaOH溶液中加入几滴酚酞,溶液显红色,向其中逐滴滴加新制饱和氯水,当滴到最后一滴,红色突然褪去。
2020-2021备战高考化学 氯及其化合物 综合题附答案

2020-2021备战高考化学氯及其化合物综合题附答案一、高中化学氯及其化合物1.肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO+ 2NH3 = N2H4 + NaCl+ H2O制取。
某化学兴趣小组尝试在实验室制取N2H4,设计了如下实验:(1)制备NaClO溶液,装置如图所示。
(已知:3Cl2 + 6NaOH Δ5NaCl+ NaClO3 + 3H2O)①仪器A的名称是________________。
②连接好装置,装药品之前,必须进行的一项操作是_________。
③圆底烧瓶内发生反应的化学方程式为_______________;当生成71g氯气时,被氧化的HCl为_________mol。
试管内发生反应的离子方程式为_________。
④饱和食盐水的作用是_____________,冰水的作用是____________。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。
制取氨气的化学方程式为_______。
(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质。
写出该反应的化学方程式______________。
【答案】分液漏斗检查装置的气密性 MnO2 + 4HCl(浓)ΔMnCl2 + Cl2↑+ 2H2O 2 Cl2 +2OH-= Cl-+ ClO-+ H2O 除去Cl2中的HCl气体防止溶液温度过高发生副反应 2NH4Cl+Ca(OH)2ΔCaCl2 + 2NH3↑+ 2H2O 2N2H4 + N2O4点燃3N2 + 4H2O【解析】【分析】(1) ①根据仪器的构造判断;②检查装置的气密性,以防止漏气;③该装置是用来制备氯气的,MnO2 与浓盐酸反应生成MnCl2 、 Cl2和H2O;试管内氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;④饱和食盐水的作用是除去Cl2中的HCl气体,冰水的作用是防止溶液温度过高发生副反应;(2) 实验室利用加热氯化铵和氢氧化钙混合固体制取氨气;(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质氮气和水蒸气。
2020-2021高考化学综合题专练∶氯及其化合物含答案解析

2020-2021高考化学综合题专练∶氯及其化合物含答案解析一、高中化学氯及其化合物1.高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O①还原产物为_____。
②被氧化的元素是_____③氧化剂与还原剂的物质的量之比为_____④每生成 2.24 L(标况下)SO2,转移电子数目是_____(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。
写出该离子反应方程式_____(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
【答案】Mn2+ Cu、S 8:5 0.8N A 6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O 0.2【解析】【分析】(1)结合氧化还原反应的知识分析即可;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素失去的电子,据此分析。
【详解】(1)在8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O中Mn元素从+7价降为+2价,发生还原反应,而Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,发生氧化反应;①由分析知,还原产物为Mn2+;②被氧化的元素是Cu2S中Cu、S两元素;③氧化剂为KMnO4,还原剂为Cu2S,两者的物质的量之比为8:5;④Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,则1molCu2S完全被氧化,转移8mol电子;2.24 L(标况下)SO2的物质的量为2.24?L22.4?L/mol=0.1mol,反应中转移电子的物质的量为0.8mol,电子数目是0.8N A;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合守恒法得发生反应的离子方程式为6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,m(O2)=15.8g-15.0g=0.8g ,n(O 2)=0.8g 32g /mol =0.025mol ; 在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn 元素获得电子等于O 元素、Cl 元素获得的电子,则设氯气的物质的量为xmol ,n(KMnO 4)=15.8g 158g /mol=0.1mol ,电子转移守恒可得:0.1mol(7-2)=4n(O 2)+2(Cl 2),即0.1×(7-2)=4×0.025+2x ,解得:x=0.2mol 。
高考化学 氯及其化合物综合试题附详细答案
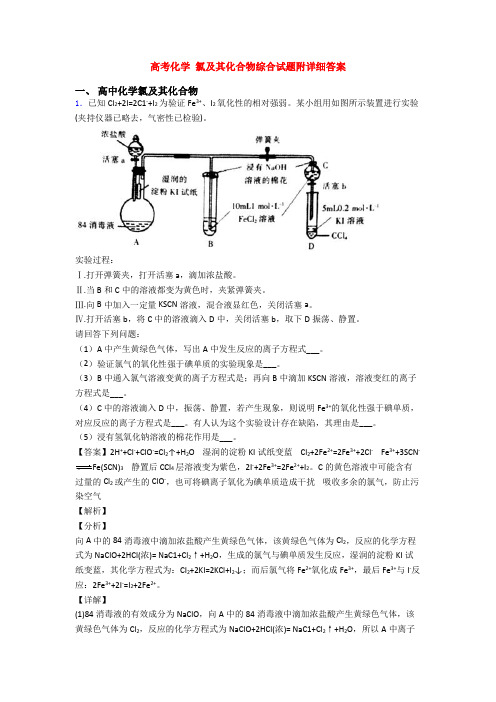
高考化学氯及其化合物综合试题附详细答案一、高中化学氯及其化合物1.已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。
某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。
有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
【答案】2H++Cl-+ClO-=Cl2↑+H2O 湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。
C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰吸收多余的氯气,防止污染空气【解析】【分析】向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,生成的氯气与碘单质发生反应,湿润的淀粉KI试纸变蓝,其化学方程式为:CI2+2KI=2KCl+I2↓;而后氯气将Fe2+氧化成Fe3+,最后Fe3+与I-反应:2Fe3++2I-=I2+2Fe2+。
【详解】(1)84消毒液的有效成分为NaClO,向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,所以A中离子方程式为:2H++Cl-+ClO-=Cl2↑+H2O;(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI试纸变蓝,发生反应的化学方程式为:CI2+2KI=2KCl+I2↓;(3)B中的溶液变为黄色,B中反应为Cl2将Fe2+氧化成Fe3+,B中发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;再向B中滴加KSCN溶液,溶液变红的离子方程式是:Fe³⁺ + 3SCN⁻ =Fe(SCN)₃ (血红色);(4)将C中溶液滴入D中,关闭活塞b,取下D振荡,若产生现象:静置后CCl4层溶液变为紫色,则说明Fe3+的氧化性强于碘单质,反应的离子方程式为2Fe3++2I-=I2+2Fe2+;但C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰,此为实验设计存在缺陷,要验证Fe3+的氧化性强于I2必须排除Cl2的干扰;(5)由于Cl2有毒会污染大气,浸有NaOH溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
高考化学氯及其化合物综合题汇编含详细答案.docx

B与水______________________________。
C与澄清石灰水________________________。
点燃
【答案】H22
2
22
2
2
2
2
Cl CO HCl
H + Cl
2HCl H O+ Cl = HCl + HClO CO + Ca(OH) =
3
+2NH Cl
CaCl +H O+2NH↑ ①②
4NH
加热
4NO+6H O NH Cl①②④⑥
取E少许于试管,加入浓
NaOH溶
3
+5O催化剂
2
2
4
液,加热,生成无色有刺激性气味的气体,用湿润的红色石蕊试纸检验,试纸变为蓝色,
证明E中有NH4+
【解析】
【分析】
为黄绿色气体,应为Cl2,D极易溶于水,形成的溶液可使酚酞变红,应为NH3,A、B、
+
-
Mn
2+
↑+2HO 3Fe +
2 2
22
2
2
Cl
2H O
2H O+O
MnO +4H +2Cl
+Cl
高温
4H2O(g)
Fe3O4+4H2
4FeCl2+4Na2O2+ 6H2O = 4Fe(OH)3↓+8NaCl + O2↑
6NA
【解析】
【分析】
丙为黄绿色单质气体,所以丙为
高中化学人教版()必修第一册 第二章第二节 氯及其化合物 练习(含解析)

高中化学人教版(2019)必修第一册第二章第二节氯及其化合物一、单选题1.自来水可用氯气进行消毒,如在实验室用自来水配制下列物质的溶液,不会产生明显的药品变质问题的是()A. AgNO3B. NaOHC. Na2CO3D. FeCl32.下列关于氯水的叙述中正确的是()A. 新制氯水中只含有Cl2和H2O两种分子B. 新制氯水可以使蓝色石蕊试纸先变红后褪色C. 氯气、液氯和氯水是同一种物质D. 氯水放置数天后pH变大3.氯气是一种很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )A. 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟B. 氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸C. 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸D. 通常状况下,干燥的氯气能和Fe反应4.实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。
下列说法中错误的是()A. 装置C的作用是除去氯气中的杂质HClB. 装置F中的现象为有白色沉淀产生C. 实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯D. 该实验中体现了浓盐酸的还原性和酸性5.用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是()A. 漂白粉与氧气反应了B. 有色布条与氧气反应了C. 漂白粉跟空气中的CO2反应生成了较多量的HClOD. 漂白粉溶液蒸发掉部分水,其浓度增大6.下列说法错误的是()①钠、氢气都能在氯气中燃烧生成白色烟雾②铜丝在氯气中燃烧,生成蓝绿色的氯化铜③液氯就是氯气的水溶液,它能使干燥的有色布条褪色④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水A. ①B. ①和②C. ①和④D. ①②③④7.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。
全国高考化学氯及其化合物的综合高考真题汇总及答案解析

全国高考化学氯及其化合物的综合高考真题汇总及答案解析一、 高中化学氯及其化合物1.Cl 2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.完成下列填空:(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO 的杀菌能力比ClO ﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).(4)在氯水中,下列关系正确的是__(选填编号).a c (HClO )+c (ClO ﹣)=c (H +)﹣c (OH ﹣)b c (H +)=c (ClO ﹣)+c (Cl ﹣)+c (OH ﹣)c c (HClO )<c (Cl ﹣)d c (Cl ﹣)<c (OH ﹣)(5)ClO 2是一种更高效、安全的消毒剂,工业上可用ClO 2与水中的MnCl 2在常温下反应,生成MnO 2和盐酸,以除去水中Mn 2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO 2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.【答案】3s 23p 5 自旋方向 Cl ﹣、O 2﹣、H ﹣ Cl 2(aq )+H 2O 垐?噲?HClO+H ++Cl ﹣、HClO 垐?噲?H ++ClO ﹣、Cl 2(g )垐?噲?Cl 2(aq ) 夏季温度高,HClO 易分解,杀菌效果比在冬季差 bc 2ClO 2+5MnCl 2+6H 2O=5MnO 2+12HCl 错 MnO 2和浓盐酸加热的条件下才能反应【解析】【分析】【详解】(1)氯是17号元素,其最外层电子的电子排布式为253s 3p ,若用轨道表示式来描述,则可以描述其电子的自旋方向;(2)+H 相当于光秃秃的质子,2-O 填满了前两层电子,而-Cl 填满了前三层电子,半径由大到小为-2-+Cl >O >H ;(3)首先氯气存在溶解—挥发平衡,即22Cl (g)Cl (aq)ƒ,其次氯气还能和水发生可逆反应,即22Cl +H O HCl+HClO ƒ,而HClO 是一个弱酸,存在电离平衡+-HClO H +ClO ƒ; 夏季和冬季最大的区别在温度,我们知道HClO 受热易分解,因此杀菌效果变差;(4)a.溶液中存在质子守恒---+c(OH )+c(Cl )+c(ClO )=c(H ),若要a 项成立除非-c(HClO)=c(Cl ),但是二者不可能相等,a 项错误;b.该项即溶液中存在的质子守恒,b 项正确;c.氯气和水反应得到等量的HCl 和HClO ,HCl 是强酸可以完全电离,因此溶液中-Cl 的量等于生成的HCl 的量,而HClO 是弱电解质部分电离,因此剩余的HClO 的浓度将小于-Cl 的浓度,c 项正确;d.氯水呈酸性,因此溶液中的-c(OH )极低(室温下-7<10mol/L ),因此不可能出现--c(OH )>c(Cl )的情况,d 项错误;答案选bc ;(5)2ClO 作氧化剂,2+Mn 作还原剂,二者发生氧化还原反应22222ClO +5MnCl +6H O=5MnO +12HCl ,该反应得到的盐酸较稀,且没有加热,因此不太可能被2MnO 继续氧化变成氯气,反应在这一步就停止了。
全国高考化学氯及其化合物的综合高考真题汇总含答案

全国高考化学氯及其化合物的综合高考真题汇总含答案一、高中化学氯及其化合物1.肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO+ 2NH3 = N2H4 + NaCl+ H2O制取。
某化学兴趣小组尝试在实验室制取N2H4,设计了如下实验:(1)制备NaClO溶液,装置如图所示。
(已知:3Cl2 + 6NaOH Δ5NaCl+ NaClO3 + 3H2O)①仪器A的名称是________________。
②连接好装置,装药品之前,必须进行的一项操作是_________。
③圆底烧瓶内发生反应的化学方程式为_______________;当生成71g氯气时,被氧化的HCl为_________mol。
试管内发生反应的离子方程式为_________。
④饱和食盐水的作用是_____________,冰水的作用是____________。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。
制取氨气的化学方程式为_______。
(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质。
写出该反应的化学方程式______________。
【答案】分液漏斗检查装置的气密性 MnO2 + 4HCl(浓)ΔMnCl2 + Cl2↑+ 2H2O 2 Cl2 +2OH-= Cl-+ ClO-+ H2O 除去Cl2中的HCl气体防止溶液温度过高发生副反应 2NH4Cl+Ca(OH)2ΔCaCl2 + 2NH3↑+ 2H2O 2N2H4 + N2O4点燃3N2 + 4H2O【解析】【分析】(1) ①根据仪器的构造判断;②检查装置的气密性,以防止漏气;③该装置是用来制备氯气的,MnO2 与浓盐酸反应生成MnCl2 、 Cl2和H2O;试管内氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;④饱和食盐水的作用是除去Cl2中的HCl气体,冰水的作用是防止溶液温度过高发生副反应;(2) 实验室利用加热氯化铵和氢氧化钙混合固体制取氨气;(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质氮气和水蒸气。
全国高考化学氯及其化合物的综合高考真题分类汇总及答案解析

全国高考化学氯及其化合物的综合高考真题分类汇总及答案解析一、高中化学氯及其化合物1.已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。
某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。
有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
【答案】2H++Cl-+ClO-=Cl2↑+H2O 湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。
C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰吸收多余的氯气,防止污染空气【解析】【分析】向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,生成的氯气与碘单质发生反应,湿润的淀粉KI试纸变蓝,其化学方程式为:CI2+2KI=2KCl+I2↓;而后氯气将Fe2+氧化成Fe3+,最后Fe3+与I-反应:2Fe3++2I-=I2+2Fe2+。
【详解】(1)84消毒液的有效成分为NaClO,向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,所以A中离子方程式为:2H ++Cl -+ClO -=Cl 2↑+H 2O ;(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI 试纸变蓝,发生反应的化学方程式为:CI 2+2KI=2KCl+I 2↓;(3)B 中的溶液变为黄色,B 中反应为Cl 2将Fe 2+氧化成Fe 3+,B 中发生反应的离子方程式为Cl 2+2Fe 2+=2Cl -+2Fe 3+;再向B 中滴加KSCN 溶液,溶液变红的离子方程式是: Fe³⁺ + 3SCN⁻ =Fe(SCN)₃ (血红色);(4)将C 中溶液滴入D 中,关闭活塞b ,取下D 振荡,若产生现象:静置后CCl 4层溶液变为紫色,则说明Fe 3+的氧化性强于碘单质,反应的离子方程式为2Fe 3++2I -=I 2+2Fe 2+;但C 的黄色溶液中可能含有过量的Cl 2或产生的ClO -,也可将碘离子氧化为碘单质造成干扰,此为实验设计存在缺陷,要验证Fe 3+的氧化性强于I 2必须排除Cl 2的干扰;(5)由于Cl 2有毒会污染大气,浸有NaOH 溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl 2+2NaOH=NaCl+NaClO+H 2O 。
高考化学《氯、溴、碘及其化合物》真题练习含答案

高考化学《氯、溴、碘及其化合物》真题练习含答案1.[2022·广东卷]实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。
下列装置(“→”表示气流方向)不能达到实验目的的是()答案:D解析:A项,除杂装置,先除去HCl,后除去水蒸气,正确;B项,集气装置,氯气密度比空气大,进气管长,出气管短,正确;C项,探究干燥的红布条和湿润的红布条与氯气的反应,正确;D项,尾气吸收应用碱液,错误。
2.[2023·辽宁卷]某小组进行实验,向10 mL蒸馏水中加入0.4 g I2,充分振荡,溶液呈浅棕色,再加入0.2 g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。
已知I-3(aq)答案:D解析:向10 mL蒸馏水中加入0.4 g I2,充分振荡,溶液呈浅棕色,说明I2的浓度较小,因为I2在水中溶解度较小,A项正确;已知I-3(aq)为棕色,加入0.2 g锌粒后,Zn与I2反应生成ZnI2,生成的I-与I2发生反应I-+I2⇌I-3,生成I-3使溶液颜色加深,B项正确;I2在水中存在溶解平衡I2(s)⇌I2(aq),Zn与I2反应生成的I-与I2(aq)反应生成I-3,I2(aq)浓度减小,上述溶解平衡向右移动,紫黑色晶体消失,C项正确;最终溶液褪色是Zn与有色物质发生了化合反应,不是置换反应,D项错误;答案选D。
3.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO答案:D解析:新制氯水中含有Cl2,所以呈浅黄绿色,A项正确;生成氯化银沉淀,说明氯水中含有Cl-,B项正确;加入NaHCO3粉末,有气泡生成,说明氯水中含有H+,C项正确;Cl2也可将Fe2+氧化为Fe3+,故该现象不能说明氯水中含有HClO,D项错误。
全国高考化学氯及其化合物的综合高考真题汇总附详细答案

全国高考化学氯及其化合物的综合高考真题汇总附详细答案一、 高中化学氯及其化合物1.Cl 2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.完成下列填空:(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO 的杀菌能力比ClO ﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).(4)在氯水中,下列关系正确的是__(选填编号).a c (HClO )+c (ClO ﹣)=c (H +)﹣c (OH ﹣)b c (H +)=c (ClO ﹣)+c (Cl ﹣)+c (OH ﹣)c c (HClO )<c (Cl ﹣)d c (Cl ﹣)<c (OH ﹣)(5)ClO 2是一种更高效、安全的消毒剂,工业上可用ClO 2与水中的MnCl 2在常温下反应,生成MnO 2和盐酸,以除去水中Mn 2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO 2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.【答案】3s 23p 5 自旋方向 Cl ﹣、O 2﹣、H ﹣ Cl 2(aq )+H 2O 垐?噲?HClO+H ++Cl ﹣、HClO 垐?噲?H ++ClO ﹣、Cl 2(g )垐?噲?Cl 2(aq ) 夏季温度高,HClO 易分解,杀菌效果比在冬季差 bc 2ClO 2+5MnCl 2+6H 2O=5MnO 2+12HCl 错 MnO 2和浓盐酸加热的条件下才能反应【解析】【分析】【详解】(1)氯是17号元素,其最外层电子的电子排布式为253s 3p ,若用轨道表示式来描述,则可以描述其电子的自旋方向;(2)+H 相当于光秃秃的质子,2-O 填满了前两层电子,而-Cl 填满了前三层电子,半径由大到小为-2-+Cl >O >H ;(3)首先氯气存在溶解—挥发平衡,即22Cl (g)Cl (aq)ƒ,其次氯气还能和水发生可逆反应,即22Cl +H O HCl+HClO ƒ,而HClO 是一个弱酸,存在电离平衡+-HClO H +ClO ƒ; 夏季和冬季最大的区别在温度,我们知道HClO 受热易分解,因此杀菌效果变差;(4)a.溶液中存在质子守恒---+c(OH )+c(Cl )+c(ClO )=c(H ),若要a 项成立除非-c(HClO)=c(Cl ),但是二者不可能相等,a 项错误;b.该项即溶液中存在的质子守恒,b 项正确;c.氯气和水反应得到等量的HCl 和HClO ,HCl 是强酸可以完全电离,因此溶液中-Cl 的量等于生成的HCl 的量,而HClO 是弱电解质部分电离,因此剩余的HClO 的浓度将小于-Cl 的浓度,c 项正确;d.氯水呈酸性,因此溶液中的-c(OH )极低(室温下-7<10mol/L ),因此不可能出现--c(OH )>c(Cl )的情况,d 项错误;答案选bc ;(5)2ClO 作氧化剂,2+Mn 作还原剂,二者发生氧化还原反应22222ClO +5MnCl +6H O=5MnO +12HCl ,该反应得到的盐酸较稀,且没有加热,因此不太可能被2MnO 继续氧化变成氯气,反应在这一步就停止了。
全国高考化学氯及其化合物的综合高考真题汇总含答案解析

全国高考化学氯及其化合物的综合高考真题汇总含答案解析一、 高中化学氯及其化合物1.(1)单质钠是一种______色的金属,密度比水______(大/小),钠在自然界中以______(化合/游离)态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______(化学式),其生成物与水反应的化学方程式:______。
(2)氯气是一种______色的气体,密度比空气______,______溶于水,并可以和水发生反应,写出其反应的化学方程式:______,实验室中用______ 溶液(化学式)吸收多余的氯气。
铁丝在氯气中燃烧的化学方程式:______。
漂白粉是______和______(化学式)的混合物,是利用氯气与氢氧化钙反应制成的,写出其反应的方程式:______。
(3)现有物质:①氧化镁②硫酸铜 ③碳酸钙 ④金属钠 ⑤氯气 ⑥氢气 ⑦硫酸 ⑧氯水⑨二氧化硫 ⑩氧化钠⑪二氧化硅⑫次氯酸⑬漂白粉按下列标准进行归类(填序号)混合物______ 酸______ 盐______单质______ 碱性氧化物______ 酸性氧化物______。
【答案】银白 小 化合 222Na 2H O 2NaOH H +=+↑ 淡黄 22Na O 22222Na O 2H O 4NaOH O +=+↑ 黄绿 大 易 22Cl H O HCl HClO ++ƒ NaOH232Fe 3Cl 2FeCl -+点燃2CaCl 2Ca(ClO)222222Cl 2Ca(OH)CaCl Ca(ClO)2H O +=++ ⑧⑬ ⑦⑫ ②③ ④⑤⑥ ①⑩ ⑨⑪【解析】【分析】()1钠观察切开面,新切开的金属钠断面呈银白色色;密度比水小,钠是很活泼的金属,在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气;金属钠在空气中燃烧生成淡黄色的过氧化钠,过氧化钠可以和水之间发生反应生成氢氧化钠和氧气;()2在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水;氯气和水反应生成盐酸和次氯酸,实验室用氢氧化钠吸收吸收多余的氯气,铁丝在氯气中燃烧生成氯化铁,氯气与氢氧化钙反应生成漂白粉,漂白粉的主要成分是次氯酸钙、氯化钙; ()3物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐。
高考化学氯及其化合物综合题附详细答案

高考化学氯及其化合物综合题附详细答案一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol=0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
备战高考化学专题题库∶氯及其化合物的综合题附答案

备战高考化学专题题库∶氯及其化合物的综合题附答案一、高中化学氯及其化合物1.现有一包固体粉末,此中可能含有以下五种物质:CaCO3、K2CO3、 Na2SO4、 NaCl、CuSO4。
现进行以下实验:①溶于水得无色溶液,溶液中无积淀出现;②向溶液中加入BaCl2溶液生成白色积淀,再加盐酸时积淀消逝。
依据上述实验现象推测:(1)必定不存在的物质是 ___________;(2)写出加入盐酸时积淀消逝的离子反响方程式___________ ;(3)可能存在的物质是___________;(4)用化学反响的现象来查验可能存在的物质所用试剂为:__________ ;若不使用化学试剂还可用 _________来查验该物质的存在。
【答案】 CaCO32443+= Ba2++ CO22稀硝酸、硝酸、 Na SO 、 CuSO BaCO+ 2H↑+H O NaCl银溶液焰色反响【分析】【剖析】①原固体中 CaCO3不溶于水, CuSO4溶于水后为蓝色溶液,固体粉末溶于水得无色溶液,溶液中无积淀出现说明必定不含这两种物质;②碳酸钡积淀溶于盐酸,硫酸钡积淀不溶于盐酸,向溶液中加入BaCl2溶液生成白色积淀,再加盐酸时积淀消逝说明固体粉末中必定含有碳酸根离子,必定不含有硫酸根离子,则固体粉末中必定不存在的物质是CaCO3、Na2SO4、 CuSO4,必定有 K2CO3,因为没有波及与NaCl 有关的实验,固体粉末中可能含有NaCl。
【详解】(1)由剖析可知,固体粉末中必定不存在CaCO3、 Na2 SO4、CuSO4,故答案为:CaCO3、Na SO、 CuSO ;244(2)向溶液中加入BaCl2232溶液反响生成3溶液, K CO溶液与 BaCl BaCO 白色积淀,再加盐酸, BaCO3白色积淀与盐酸反响生成氯化钡、二氧化碳和水,反响的离子方程式为3BaCO ++=Ba2++ CO223+= Ba2++ CO222H↑+ H O,故答案为:BaCO + 2H↑+H O;(3)由剖析可知,固体粉末中可能含有NaCl,故答案为: NaCl;(4)氯化钠的存在与否,能够经过查验氯离子或钠离子来确立,氯离子的查验能够用硝酸酸化的硝酸银来查验,钠离子的查验能够用焰色反响来查验,故答案为:稀硝酸、硝酸银溶液;焰色反响。
2022届高三化学一复习专题演练--氯气及化合物的性质综合练习 有答案

2022届高三化学一复习专题演练--氯气及化合物的性质综合练习一、单选题(共16题)1.下列关于实验室制取Cl2的说法正确的是()A. 将混有HCl的Cl2通过盛有饱和NaHCO3溶液的洗气瓶除去杂质B. 实验室制取Cl2,浓盐酸体现酸性和氧化性C. 实验室用如图装置除去Cl2中的少量HClD. 实验室制备Cl2,可用排饱和食盐水集气法收集2.实验室用下图所示装置来制取少量氯气,下列说法正确的是()A. A容器中加入的是稀盐酸B. C瓶的作用是来收集氯气C. F瓶中加入NaOH溶液吸收多余的氯气D. 用该装置制取氯气前无需检查装置的气密性3.实验室用软锰矿(MnO2)与浓盐酸加热制氯气,下列说法正确的是()A. 盛浓盐酸的分液漏斗可用长颈漏斗代替B. 可用一张白纸放到集气瓶后,观察氯气是否收集满C. 用饱和食盐水吸收尾气D. 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验4.下列实验操作正确的是()A. 给容量瓶中加水时,借助于玻璃棒,给滴定管中装液时,借助于漏斗B. 蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯的外焰加热;水浴加热可以不用温度计C. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较D. 用梨形分液漏斗做萃取实验时,检漏该分液漏斗上口的方法与检漏容量瓶一样,检漏下方活塞的方法与检漏滴定管一样。
5.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是()选项陈述Ⅰ陈述Ⅱ判断A.可用pH试纸测氯水pH氯水有酸性Ⅰ对,Ⅱ对,无B.将Na2O2加入酚酞溶液中,最终溶液变为红色Na2O2与水反应生成氢氧化钠Ⅰ对,Ⅱ错,无C.金属钠保存在煤油中,以隔绝空气常温下,金属钠在空气中会生成过氧化钠Ⅰ对,Ⅱ对,有D.氯气可以使湿润的淀粉−碘化钾试纸变蓝Cl2与KI溶液反应生成I2Ⅰ对,Ⅱ对,有A. AB. BC. CD. D6.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。
高考化学氯及其化合物的综合题试题及详细答案

高考化学氯及其化合物的综合题试题及详细答案一、高中化学氯及其化合物1.Cl2通人70℃的NaOH水溶液中,发生氧化—还原反应,反应完成后,测得溶液中NaClO与NaClO3的物质的量之比为4∶1,则:(1)配平溶液中所发生反应的化学方程式:____Cl2+______NaOH=____NaCl+____NaClO3+_____NaClO+____ ____(2)反应中的氧化产物为_________________。
(3)已知生成0.1mol NaClO,反应中转移的电子总数是__________ mol,若溶液的体积正好为100mL,则溶液中NaCl的物质的量浓度为________ mol/L。
【答案】7149147 NaClO 3 NaClO 0.225 2.25【解析】【分析】【详解】(1)据题设条件,先定NaClO、NaClO3的化学计量数为4、1,再利用化合价升降法:升高总数为4×1+1×5=9,降低总数为1,配平得7Cl2+14NaOH=9NaCl+NaClO3+4NaClO+7H2O;(2)分析反应得氧化剂、还原剂均为Cl2,Cl元素被氧化生成NaClO3与NaClO,氧化产物为NaClO3与NaClO;(3)由反应知每转移9mol电子,生成4molNaClO,则生成0.1molNaClO,反应中转移的电子总数是0.225mol,同时生成NaCl为0.225mol,若溶液的体积正好为0.1L,则溶液中NaCl 的物质的量浓度为2.25mol·L-1。
2.氯气是一种具有重要用途的气体,在工业上大量用于制造盐酸、有机溶剂和杀菌消毒剂等。
甲同学在实验室进行氯气性质的研究Cl与①钠、②铜、③氢气、④水反应的实验。
(1)甲同学依次进行了2上述反应中属于氧化还原反应的是___________(填序号)。
(2)写出铁丝在氯气中燃烧的化学方程式:________。
(3)氯气溶于水得到的溶液称为氯水,新制的氯水呈_________色,新制的氯水中含有的物质为(水除外)________(填化学式)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学氯及其化合物综合练习题含详细答案一、高中化学氯及其化合物1.高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O①还原产物为_____。
②被氧化的元素是_____③氧化剂与还原剂的物质的量之比为_____④每生成 2.24 L(标况下)SO2,转移电子数目是_____(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。
写出该离子反应方程式_____(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
【答案】Mn2+ Cu、S 8:5 0.8N A 6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O 0.2【解析】【分析】(1)结合氧化还原反应的知识分析即可;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素失去的电子,据此分析。
【详解】(1)在8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O中Mn元素从+7价降为+2价,发生还原反应,而Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,发生氧化反应;①由分析知,还原产物为Mn2+;②被氧化的元素是Cu2S中Cu、S两元素;③氧化剂为KMnO4,还原剂为Cu2S,两者的物质的量之比为8:5;④Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,则1molCu2S完全被氧化,转移8mol电子;2.24 L(标况下)SO2的物质的量为2.24?L22.4?L/mol=0.1mol,反应中转移电子的物质的量为0.8mol,电子数目是0.8N A;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合守恒法得发生反应的离子方程式为6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,m(O2)=15.8g-15.0g=0.8g ,n(O 2)=0.8g 32g /mol=0.025mol ; 在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn 元素获得电子等于O 元素、Cl 元素获得的电子,则设氯气的物质的量为xmol ,n(KMnO 4)=15.8g 158g /mol=0.1mol ,电子转移守恒可得:0.1mol(7-2)=4n(O 2)+2(Cl 2),即0.1×(7-2)=4×0.025+2x ,解得:x=0.2mol 。
2.氯气是一种具有重要用途的气体,在工业上大量用于制造盐酸、有机溶剂和杀菌消毒剂等。
甲同学在实验室进行氯气性质的研究(1)甲同学依次进行了2Cl 与①钠、②铜、③氢气、④水反应的实验。
上述反应中属于氧化还原反应的是___________(填序号)。
(2)写出铁丝在氯气中燃烧的化学方程式:________。
(3)氯气溶于水得到的溶液称为氯水,新制的氯水呈_________色,新制的氯水中含有的物质为(水除外)________(填化学式)。
(4)甲同学探究氯气能否与水发生反应①B 中纸条褪色,结合化学方程式解释原因:________。
②装置A 的作用是___________。
③烧杯中发生反应的化学方程式为_________。
【答案】①②③④ 232Fe 3Cl 2FeCl 点燃+ 黄绿 2Cl HClO HCl 、、 Cl 2 + H 2O ⇌ HCl + HClO ,生成的次氯酸有漂白性 对照实验,证明氯气自身没有漂白性,说明B 中起漂白作用的是其他物质,从而证明氯气与水发生了反应22Cl 2NaOH=NaClO NaCl H O +++【解析】【分析】(1)氯气具有强氧化性,可与金属、非金属单质发生化合反应,与水反应生成HClO 和HCl ;(2)铁在氯气中燃烧生成氯化铁;(3)氯气溶于水后和水反应生成盐酸和次氯酸,该反应为可逆反应:Cl 2 + H 2O ⇌ HCl+ HClO ;(4)①氯气和水发生反应生成的HClO 具有漂白性;②氯气不具有漂白性,干燥红纸不褪色,可作对照实验;③烧杯中应盛放氢氧化钠溶液,用于吸收氯气,避免污染环境。
【详解】(1)氯气具有强氧化性,可与金属、非金属单质发生化合反应,与水反应生成HClO 和HCl ,则①②③④都为氧化还原反应,故答案为:①②③④;(2)铁在氯气中燃烧生成氯化铁,反应的化学方程式为232Fe 3Cl 2FeCl 点燃+,故答案为:232Fe 3Cl 2FeCl 点燃+;(3)氯气溶于水后和水反应生成盐酸和次氯酸,该反应为可逆反应:Cl 2 + H 2O ⇌ HCl+ HClO ,则新制的氯水中含有的物质为(水除外)2Cl HClO HCl 、、,新制氯水中由于含有氯气,所以溶液呈黄绿色,故答案为:黄绿;2Cl HClO HCl 、、;(4)①氯气和水发生反应Cl 2 + H 2O ⇌ HCl+ HClO ,生成HClO ,由于HClO 具有漂白性,可使红纸条褪色,故答案为:Cl 2 + H 2O ⇌ HCl+ HClO ,生成的次氯酸有漂白性;②氯气不具有漂白性,干燥红纸不褪色,作对照实验,证明氯气自身没有漂白性,说明B 中起漂白作用的是其他物质,从而证明氯气与水发生了反应,故答案为:对照实验,证明氯气自身没有漂白性,说明B 中起漂白作用的是其他物质,从而证明氯气与水发生了反应;③烧杯中应盛放氢氧化钠溶液,用于吸收氯气,避免污染环境,发生反应的化学方程式为22Cl 2NaOH=NaClO NaCl H O +++,故答案为:22Cl 2NaOH=NaClO NaCl H O +++。
【点睛】氯气溶于水后和水反应生成盐酸和次氯酸,该反应为可逆反应:Cl 2 + H 2O ⇌ H + + Cl - + HClO ,新制氯水中存在氯气、盐酸、次氯酸,因此新制氯水就具有了氯气、盐酸、次氯酸的性质,溶液具有强氧化性且显酸性,这是学生们的易错点。
3.(1)单质钠是一种______色的金属,密度比水______(大/小),钠在自然界中以______(化合/游离)态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______(化学式),其生成物与水反应的化学方程式:______。
(2)氯气是一种______色的气体,密度比空气______,______溶于水,并可以和水发生反应,写出其反应的化学方程式:______,实验室中用______ 溶液(化学式)吸收多余的氯气。
铁丝在氯气中燃烧的化学方程式:______。
漂白粉是______和______(化学式)的混合物,是利用氯气与氢氧化钙反应制成的,写出其反应的方程式:______。
(3)现有物质:①氧化镁②硫酸铜 ③碳酸钙 ④金属钠 ⑤氯气 ⑥氢气 ⑦硫酸 ⑧氯水⑨二氧化硫 ⑩氧化钠⑪二氧化硅⑫次氯酸⑬漂白粉按下列标准进行归类(填序号)混合物______ 酸______ 盐______单质______ 碱性氧化物______ 酸性氧化物______。
【答案】银白 小 化合 222Na 2H O 2NaOH H +=+↑ 淡黄 22Na O22222Na O 2H O 4NaOH O +=+↑ 黄绿 大 易 22Cl H O HCl HClO ++ƒ NaOH232Fe 3Cl 2FeCl -+点燃2CaCl 2Ca(ClO)222222Cl 2Ca(OH)CaCl Ca(ClO)2H O +=++ ⑧⑬ ⑦⑫ ②③ ④⑤⑥ ①⑩ ⑨⑪【解析】【分析】()1钠观察切开面,新切开的金属钠断面呈银白色色;密度比水小,钠是很活泼的金属,在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气;金属钠在空气中燃烧生成淡黄色的过氧化钠,过氧化钠可以和水之间发生反应生成氢氧化钠和氧气;()2在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水;氯气和水反应生成盐酸和次氯酸,实验室用氢氧化钠吸收吸收多余的氯气,铁丝在氯气中燃烧生成氯化铁,氯气与氢氧化钙反应生成漂白粉,漂白粉的主要成分是次氯酸钙、氯化钙; ()3物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐。
混合物是指由多种物质组成的物质;酸是指电离时产生的阳离子全部是氢离子的化合物;盐是指由金属离子和酸根离子组成的化合物;单质是只含有一种元素的纯净物;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,碱性氧化物是指能和酸反应生成盐和水的氧化物,酸性氧化物是指能和碱反应生成盐和水的氧化物。
【详解】()1钠观察切开面,新切开的金属钠断面呈银白色色;钠与水反应浮在水面上,钠的密度比水小,钠是很活泼的金属,在常温下就能与氧气反应,钠在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气,反应的化学方程式:222Na 2H O 2NaOH H +=+↑,金属钠在空气中燃烧生成淡黄色的过氧化钠,2222Na O Na O -+V ,过氧化钠可以和水之间发生反应生成氢氧化钠和氧气,方程式为:22222Na O 2H O 4NaOH O +=+↑;()2在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,1体积水中能溶解2体积的氯气;氯气和水反应生成盐酸和次氯酸,22Cl H O HCl HClO ++ƒ,实验室用氢氧化钠吸收吸收多余的氯气,生成氯化钠和次氯酸钠,离子反应为22Cl 2OH Cl ClO H O ---+=++,铁丝在氯气中燃烧生成氯化铁232Fe 3Cl 2FeCl -+点燃,氯气与石灰乳反应生成氯化钙和次氯酸钙,反应的方程式为222222Cl 2Ca(OH)CaCl Ca(ClO)2H O +=++,漂白粉的主要成分是次氯酸钙()2(Ca ClO)、氯化钙()2CaCl ;漂白粉溶于水后,受空气中的2CO 作用,即产生有漂白、杀菌作用的次氯酸,同时生成碳酸钙沉淀,反应的化学方程式为:2223Ca(ClO)CO H O CaCO 2HClO ++=↓+;()3①氧化镁为碱性氧化物; ②硫酸铜由硫酸根离子和铜离子构成的盐; ③碳酸钙由碳酸根离子和钙离子构成的盐; ④金属钠 属于单质;⑤氯气属于单质; ⑥氢气属于单质;⑦硫酸属于二元强酸; ⑧氯水属于氯气和水的混合物; ⑨二氧化硫为酸性氧化物; ⑩氧化钠为碱性氧化物;⑪二氧化硅为酸性氧化物;⑫次氯酸为一元弱酸;⑬漂白粉主要成分是次氯酸钙()2(Ca ClO)、氯化钙()2CaCl ,属于混合物;则:混合物为⑧⑬,酸为 ⑦⑫,盐为②③,单质为④⑤⑥,碱性氧化物为①⑩, 酸性氧化物为⑨⑪。
