专题06 溶解度曲线(考点详解)
《溶解度曲线》课件

溶解度曲线的作用
判断物质在水中的溶解度 确定物质的溶解度范围 预测物质在水中的溶解度变化趋势 指导工业生产中物质的溶解和结晶过程
溶解度曲线的绘制方法
准备实验材 料:包括待 测溶液、溶 剂、温度计 等
设定温度范 围:根据实 验需要设定 温度范围, 如0-100℃
绘制曲线: 将待测溶液 在不同温度 下的溶解度 数据绘制在 坐标轴上, 形成溶解度 曲线
葡萄糖的溶解度曲线是表示葡萄糖 在不同温度下的溶解度
曲线的拐点:在特定温度下,葡萄 糖的溶解度达到最大值
添加标题
添加标题
添加标题
添加标题
曲线的形状:随着温度的升高,葡 萄糖的溶解度逐渐增大
曲线的应用:在制药、食品等行业 中,葡萄糖的溶解度曲线用于指导 生产过程和优化产品质量
硫酸钙的溶解度曲线
硫酸钙的溶解 度曲线是表示 硫酸钙在不同 温度下的溶解
优化结晶工艺:通过溶解度曲线优化结晶工艺,提高结晶效率和产品质量
结晶过程中的问题解决:通过溶解度曲线分析结晶过程中的问题,如结晶速度慢、结晶 质量差等,并提出解决方案
物质含量的测定
溶解度曲线:表示物质在不同温度下的溶解度 应用:通过溶解度曲线确定物质的溶解度 测定方法:通过实验测定物质的溶解度 应用实例:测定溶液中某物质的含量
化学反应速率的影响
温度:温度升高,化学反应速率加快 浓度:反应物浓度增加,化学反应速率加快 催化剂:加入催化剂,化学反应速率加快 压强:增加压强,气体反应物的化学反应速率加快
结晶过程中的应用
确定结晶条件:通过溶解度曲线确定合适的结晶温度和浓度
控制结晶过程:通过溶解度曲线控制结晶速度,避免结晶过程中的杂质影响
实验注意事项:实验过程中要注意控制温度,避免温度过高或过低 影响实验结果
初三化学小专题复习课--溶解度曲线(共18张PPT)

这是一种什么图像,可以 从中获得哪些信息
这是固体A的溶解度曲线
A
可以获得以下信息:
1、A这种物质,随着温度的上升溶解 度明显上升
2、溶解度曲线上的每一点都达到饱和 状态
3、可以获得某一温度下的溶解度
t (℃)
4、可以采用冷却热饱和溶液的方法得 到较纯净的A
……
S(克/100水)
KNO3
图像中a表示的意义 23℃时,硝酸钾的 溶解度为36克/100水
是M、N),充分搅拌。将混合物
b 的温度升高到t2℃,试判断MN两
物质的溶液是否t3℃, 是判断判断M、N两物质的溶液 是否饱和? M、N的溶质质量分
t3 t (℃) 数是否相等?
练习2 在家庭中自制汽水时需要在饮料中加入白糖、 果(汁1)、加小入苏柠打檬(酸Na的H目CO的3是)_、与__凉小_苏_开_打_水_反_,_应_还产__需生__加二_氧_入_化_柠_碳_檬_气_酸体__。; (2)饮用时,将瓶盖打开,会有大量气泡冒出,
。 现 将 具 体 理由阐 述如下 : 一 、 教 育 理 念的统 一:
我 们 的 教 育 理念是 :培养孩 子多方 面的兴 趣,发 现孩子 的内在 潜能,鼓 励孩子 大胆尝 试 ,并 协 助 孩 子实;现 理想 。我们 认为在 这方面 与贵园 的教育 理念是 一致的 。 二 、 对 贵 园 的喜爱 :
溶解度及溶质质量分数
饱和溶液与不饱和溶液
1、饱和溶液:在一定的温度下,在一定量的溶剂 里,不能再溶解某种物质的溶液叫做这种溶质的 饱和溶液。
2、不饱和溶液:在一定的温度下,在一定量的 溶剂里,还能继续溶解某种物质的溶液叫做这种 溶质的不饱和溶液。
饱和溶液与不饱和溶液的转化
溶解度曲线

考点三溶解度曲线知识梳理1、溶解度曲线(1)概念:用纵坐标表示,横坐标表示,得到物质的随变化的曲线。
(2)意义表示物质随的变化情况。
陡升型:大多数固体物质的溶解度随温度的升高而明显,如、等。
缓升型;少数固体物质的溶解度受温度变化的影响,如。
下降型:极少数固体物质的溶解度随温度的升高而,如。
(3)从溶解度曲线上可以获得的信息黏贴7见本子2.结晶(1)概念:溶液中的以的形式从溶液中析出的过程,叫做结晶。
(2)结晶的方法从硝酸钾的饱和溶液中得到硝酸钾晶体,可以采用的办法。
从海水中提取食盐,可以采用的办法。
易错警示1、溶质从溶液中以晶体的形式析出,这一过程叫做结晶。
结晶有两种方法,蒸发溶剂法和降温法(冷却热饱和溶液法)。
(1)若物质的溶解度受温度变化的影响不大,则可采用蒸发溶剂的方法。
例如从海水中提取食盐。
(2)若物质的溶解度受温度变化的影响较大,则用降温法(冷却热饱和溶液法)。
例如从硝酸钾的饱和溶液中得到硝酸钾晶体。
2、黏贴8见本子典例精讲例1:(2012·十堰)在初中化学里,我们学习了溶液的有关知识.下列图甲为X、Y、Z三种固体物质的溶解度曲线.图乙中,小烧杯的b是水,广口瓶中的溶液是X、Y、Z溶液的一种.(1)30℃时,将20g的X放入50g的水中充分溶解,所得溶液的质量是g.(2)在不改变溶液中溶质和溶剂的质量的前提下,把Y的不饱和溶液变为饱和溶液的方法是.(3)把70℃的X、Z的饱和溶液分别降温到40℃,此时X溶液的质量分数(填“>”、“<”或“=”)Z溶液的质量分数.(4)图乙中,若a是生石灰,试验时发现溶液中有固体析出,则广口瓶中溶液的溶质是(填“X”、“Y”或“Z”)分数的计算式×100%,所以此时(2012乌鲁木齐)如图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是()例2:针对训练1.(2012·贵港)右图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是【 】A .t 2℃时,甲、乙两种溶液的溶质质量分数相等B .甲、乙、丙三种物质的不饱和溶液降温都会转化成饱和溶液C .t 3℃时,分别将甲、乙、丙三种物质的饱和溶液降温到t 1℃,析出晶体最多的是甲D .若物质甲中含有少量的物质乙时,可用冷却结晶法获得较纯的物质甲2(2012·无锡)右图是甲、乙两种物质的溶解度曲线,下列叙述正确的是 A .20℃时,甲的溶解度大于乙的溶解度 B .40℃时,甲、乙两种物质的溶解度相等C.采用降温的方法可以将乙的不饱和溶液转化为饱和溶液D. 60℃时,在100g水中加入lO0g 甲,充分溶解后溶液质量为200g3(2012·襄阳)如图是甲、乙两种固体物质的溶解度曲线图,请用“甲”或“乙”填空:4(2012广西)右图是A 、B 、C 三种物质的溶解度曲线: (1)如果C 物质为气体,其溶解度随温度的(2) t℃时三种物质的溶解度由大到小的顺序(3)把物质A的不饱和溶液变成饱和溶液的方法是:5.(2012·岳阳)右图是熟石灰的溶解度曲线图,请依据图示信息回答有关问题:(1)熟石灰的溶解度随着温度升高而(填“增大”或“降低”)。
初中化学溶解度曲线考点,中考必考题型.doc

初中化学溶解度曲线考点,中考必考题型下划线内容为高频考点一、饱和溶液和不饱和溶液1. 饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解的溶液,叫做这种溶质的不饱和溶液。
2.浓溶液、稀溶液和饱和溶液不饱和溶液的关系(1)不同种溶质,在一定温度下,浓溶液不一定是饱和溶液。
(2)同种溶质,在相同温度下,饱和溶液一定比不饱和溶液浓。
(3)同种溶质,在相同温度下,等量饱和溶液一定比不饱和溶液含溶质多。
3.饱和溶液和不饱和溶液的相互转化:二、溶解度和溶解性1.固体的溶解度:表示在一定温度下,某固态物质在100g 溶剂里达到饱和状态时所溶解的质量。
(如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度)需要注意的四要素:一定温度、100g溶剂、饱和状态、单位为克。
2.“在20℃时,氯化钠的溶解度为36.0g。
”这句话表达的含义:①在20℃时,36.0g氯化钠在100g水中溶解达到饱和状态。
(或②在20℃时,100g水中最多溶解36.0g氯化钠。
)由此可知:20℃氯化钠的饱和溶液中溶质、溶剂、溶液的质量比为:36g:100g:136g=9:25:343.气体溶解度是指该气体的压强为101kpa和一定温度时,在1体积水里溶解达饱和状态时的气体体积。
如:“在0℃时,氮气的溶解度为0.024”这句话的含义是:氮气的压强为101kpa和温度为0℃时,在1体积水里最多能溶解0.024体积的氮气。
4.①影响固体物质溶解度的因素:温度、溶质的性质、溶剂的性质。
②影响固体物质溶解速率的因素:温度、是否搅拌、颗粒大小。
③影响气体物质溶解度的外在因素:温度和压强注意:气体溶解度一般随压强增大而增大,随压强减小而减小。
气体溶解度一般随温度升高而减小,随温度降低而增大。
5.溶解度和溶解性的关系三、溶解度曲线意义及应用1.溶解度曲线:①溶解度曲线的横坐标表示温度,纵坐标表示溶解度②通过溶解度曲线,可以判断固体物质的溶解度受温度影响的变化情况;可以比较不同物质在同一温度时溶解度的大小;也可以查出同一种物质在不同温度时的溶解度。
初三化学溶解度曲线知识点

初三化学溶解度曲线知识点天高鸟飞,海阔鱼跃;考试这舞台,秀出你特殊的杰出;一宿好的睡眠,精神能百倍;一颗淡定的平常心,冷静应对,努力备考,考入理想院校!下面是作者给大家带来的初三化学溶解度曲线知识点,欢迎大家浏览参考,我们一起来看看吧!初三化学溶解度曲线知识点一、溶解度曲线图上的点1、溶解度曲线上的点:表示在该点所示温度下某物质的溶解度。
如A点表示当温度为t2时,物质R的溶解度为ag。
2、两条曲线的交点:表示在该点所示温度下,两种物质的溶解度相同。
如B点表示当温度为t1时,物质R和N的溶解度相等,都为bg。
二、溶解度曲线图上的线每一条曲线都表示这种物质的溶解度随温度变化而变化的总趋势,主要有:1、陡升型:绝大多数固体物质的溶解度随温度的升高而增大,曲线峻峭。
如曲线R,代表物质有KNO3、NH4NO3等。
2、缓升型:少数固体物质的溶解度受温度的影响较小。
如曲线M,代表物质有NaCl。
3、降落型:极少数固体物质的溶解度随温度的升高而减小。
如曲线N,代表物质有Ca(OH)2。
三、溶解度曲线图上的面1、在溶解度曲线上方平面上的任何点:表示在该点所示温度下形成了含有部分固体溶质的饱和溶液,即依照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是饱和溶液,且还有未溶解完的溶质存在。
如C点。
2、在溶解度曲线下方平面上的任何点:表示在该点所示温度下形成了不饱和溶液,即依照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是不饱和溶液。
如D点。
四、溶解度曲线图的综合运用1、溶解度曲线上的每一点都代表着对应温度下该物质的溶解度,所以利用溶解度曲线可以查找出某种物质在不同温度时的溶解度。
2、根据溶解度曲线的走向,可以判定或比较各物质的溶解度随温度变化的趋势。
3、可以比较在同一温度下不同物质的溶解度大小。
如在t3时,R、M、N三种物质的溶解度由小到大的顺序为N M R。
初三化学,溶解度曲线解题技能溶解度曲线题型可从点、线、面和交点四个方面进行解答:1.溶解度曲线上的点:溶解度曲线上的每一个点都是表示的是某温度下某种物质的溶解度。
九年级下册化学课件:溶解度曲线

THANKS FOR WATCHING
感谢您的观看
九年级下册化学课件溶解度曲线
目录
• 溶解度曲线基本概念 • 各类物质溶解度曲线特点 • 溶解度曲线应用举例 • 实验操作与技巧指导 • 生活中溶解度现象解读 • 总结回顾与拓展延伸
01 溶解度曲线基本概念
溶解度定义及表示方法
溶解度定义
在一定温度下,某固态物质在 100g溶剂里达到饱和状态时所溶 解的质量,叫做这种物质在这种 溶剂里的溶解度。
绘制物质溶解度曲线图
01
02
03
04
选择合适的坐标轴
以温度为横坐标,溶解度为纵 坐标,选择合适的坐标轴范围
和刻度。
绘制数据点
将实验测得的各温度下的溶解 度数据在坐标轴上标出。
连接数据点
用平滑的曲线连接各数据点, 得到物质的溶解度曲线图。
添加图例和标签
在图上添加图例、标题、坐标 轴标签等必要信息。
实验注意事项和误差分析
变化规律
根据溶解度曲线,可以总结出物质溶解度的变化规律。例如,对于溶解度随温 度升高而增大的物质,可以通过升温来提高其溶解度;反之,则可以通过降温 来降低其溶解度。
02 各类物质溶解度曲线特点
无机盐类溶解度曲线
大部分无机盐的溶解度随着温 度的升高而增大,如硝酸钾、 硫酸钠等。
少数无机盐的溶解度随着温度 的升高而减小,如氢氧化钙、 硫酸钡等。
合物分离的方法等。
拓展延伸:其他相关概念介绍
饱和溶液与不饱和溶 液
在一定温度下,一定量的溶剂里不能 再溶解某种溶质的溶液叫做这种溶质 的饱和溶液,还能继续溶解该种溶质 的溶液叫做该种溶质的不饱和溶液。
溶解度曲线及其应用

溶解度曲线知识归纳一、点的意义1.溶解度曲线上的点表示物质在该点所示湿度下的溶解度,溶液所处的状态是饱和溶液。
2.溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
3.溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
4.两条溶解度曲线的交点,表示在该点所示的湿度下,两种物质的溶解度相等。
二、变化规律1.绝大部分固体物质的溶解度随湿度升高而增大,曲线为"陡升型,如硝酸钾。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型,如氯化钠。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型,如氢氧化钙。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型,如氧气。
三、应用1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的水准,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。
溶解度曲线及其应用1.溶解度曲线上每一点表示该物质在不同温度下的不同的溶解度。
2.溶解度曲线上的任意一点表示在该温度下某物质的溶解度是多少克。
3.不同物质溶解度曲线的交点处,表示不同物质在相对应的同一温度下的溶解度相同。
4.溶解度曲线上方的一点,表示在指定温度下,溶液中的溶质质量已超过该物质的溶解度,溶液是过饱和的;溶解度曲线下方的一点,表示在指定温度下,溶液中溶质质量还没有达到溶解度的量,溶液是不饱和的。
5.溶解度曲线的特征是:(1)绝大部分固体物质的溶解度曲线左低右高,溶解度随温度的升高而增加;(2)少数固体物质的溶解度曲线较平缓,溶解度受温度的影响小,如食盐;(3)极少数固体物质的溶解度曲线是左高右低,溶解度随温度的升高而降低,如熟石灰。
高中化学复习-溶解度曲线

0.01g 1g
10g
溶 200
解
二.溶解度的表示方法:
/
度 190
g 180
170
.
(1)列表法:
160 150
温
度
/
0
10 20
30
40
50 60 70 80
℃
溶
解 度
13.3
20.9
31.6 45.8 63.9 85.5
110 138 168
/g
140
130
90 100
120
110
202 246100
KNO3 热 饱 和溶液
降温
结晶
过滤
(蒸发浓缩)
降温结晶法提纯硝酸钾 (又叫冷却热饱和溶ຫໍສະໝຸດ 法)滤纸上: KNO3固体
滤液中: 大 部 分 NaCl 少量KNO3
思考:1.冬天捞碱,夏天晒盐的原理 纯碱的溶解度随温度变化影响较大,冬天温 度降低,纯碱的溶解度随温度减小而析出; 夏天,水分蒸发快,溶剂量减少,氯化钠溶 解度受温度影响小而析出
某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶 质,为回收金属Cu并得到 ZnCI2固体,化学小组的 同学们设计并进行了如下实验:
(1) 加入过量的A的目的是 将废液中的Cu完全置换出;来操
作①名称是 过滤 , 所需要的仪
器 (2)
烧滤杯渣、B中漏含斗有、的玻物璃质棒是、:铁Z架n和台Cu
10
0
固体溶解度曲线
硝酸钾
1.降温结晶
(又叫冷却热饱和溶液法
)适 用 于 溶 解 度 受 温度影响较大的 物质.如:KNO3
2.蒸发结晶
氯化钠
适用于溶解度受 温度影响较小的 物质如:NaCl
中考化学的知识点溶解度曲线

中考化学的知识点溶解度曲线
中考化学的知识点溶解度曲线
关于化学中溶解度曲线的知识,希望同学们都能很好的掌握下面的内容。
溶解度曲线:
物质的溶解度随温度变化的曲线。
大部分固体的.溶解度随温度升高而增大,但NaCl的溶解度受温度影响很小,
熟石灰的溶解度随温度高而减小。
气体的溶解度随温度降低、压强的增大而增大。
上面对溶解度曲线的讲解知识,同学们都能很好的掌握了吧,希望同学们做好充分的准备迎接考试工作。
化学会考知识点总结:实验室制取气体的思路
同学们对实验室制取气体的思路知识还熟悉吧,下面我们一起来学习哦。
溶解度曲线
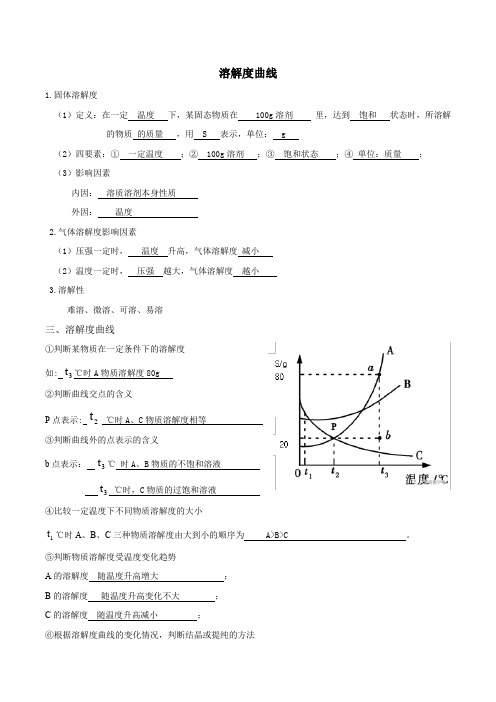
溶解度曲线1.固体溶解度(1)定义:在一定温度下,某固态物质在 100g溶剂里,达到饱和状态时,所溶解的物质的质量,用 S 表示,单位: g(2)四要素:①一定温度;② 100g溶剂;③饱和状态;④单位:质量;(3)影响因素内因:溶质溶剂本身性质外因:温度2.气体溶解度影响因素(1)压强一定时,温度升高,气体溶解度减小(2)温度一定时,压强越大,气体溶解度越小3.溶解性难溶、微溶、可溶、易溶三、溶解度曲线①判断某物质在一定条件下的溶解度t℃时A物质溶解度80g如: 3②判断曲线交点的含义t℃时A、C物质溶解度相等P点表示: 2P③判断曲线外的点表示的含义b点表示:3t℃时A、B物质的不饱和溶液t℃时,C物质的过饱和溶液3④比较一定温度下不同物质溶解度的大小t℃时A、B、C三种物质溶解度由大到小的顺序为 A>B>C 。
1⑤判断物质溶解度受温度变化趋势A的溶解度随温度升高增大;B的溶解度随温度升高变化不大;C的溶解度随温度升高减小;⑥根据溶解度曲线的变化情况,判断结晶或提纯的方法从A 的饱和溶液中获取A 晶体可用 冷却热饱和溶液 的方法; A : 陡升形 冷却热饱和溶液B : 缓升形 蒸发溶剂C : 缓降形 蒸发溶剂⑦根据溶解度曲线判断温度变化时溶液,溶质及溶质质量分数变化 3t ℃时A.B.C 的饱和溶液,降到 2t ℃会析出晶体的有A.B ,无晶体析出的有C ,所得溶液中溶质的质量分数由小到大依次是 B>A>C 。
⑧饱和溶液恒温蒸发溶剂,仍为饱和溶液,溶质质量分数不变。
溶解度曲线解题 ppt课件

分
析
图
种
像
类
要 二看点
起点:是否为原点 交点:在该温度下两物质溶解度相等 拐点:状态或质量变化
做
终点:是否形成平台(过量问题)
到
四
位置: 线的上方、下方、线内
看
三看走势: 上升、下降、不变
越缓受温度影响越小 四看缓陡:
越陡受温度影响越大
溶解度曲线解题
溶解度曲线的应用(两条曲线)
1、曲线交点Байду номын сангаас示两物质在对应温度下的溶解度相等
知 识
2、比较两种物质溶解度受温度影响的大小
点 3、判断两种物质溶解度的大小关系
归 4、饱和溶液与不饱和溶液的转化
纳 5、温度变化时饱和溶液中各个量的变化
6、结晶的方法
解题方法小结:
一看坐标(横、纵坐标的含义)
初三化学溶解度曲线知识点(完整)

溶解t/t 2 t 1 O m m 溶解度曲线知识点一、正确理解溶解度曲线的含义溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
下面,我们从溶解度曲线的特点入手,对溶解度作进一步的理解。
(一)点1.曲线上的点:表示对应温度下该物质的溶解度。
如:下图中a 表示A 物质在t 1℃时溶解度为m 1g 。
2.曲线上方的点:表示在对应温度下该物质的饱和溶液中存在不能继续溶解的溶质。
如:图中b 表示在t 1℃时,A 的饱和溶液中有(m 2-m 1)g 未溶解的溶质。
3.曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如:图中C表示在t1℃时,A的不饱和溶液中,还需要加入(m1-m3)g A物质才达到饱和。
4.曲线交点:表示在对应温度下不同物质的溶解度相同。
如图中d表示在t2℃,A、B两物质的溶解度都为m4g。
(二)线t/如图中A物质的溶解度随温度升高而明显增大,A曲线为“陡升型”。
如KNO3等大多数固体物质。
图中B物质的溶解度随温度变化不大,B曲线为“缓升型”,如NaCl等少数固体物质。
图中C物质的溶解度随温度升高而减小,C曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、掌握溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2.可以比较在同一温度下不同物质溶解度的相对大小。
3.根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。
某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4.从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
最新人教版化学中考专项复习溶解度曲线(共26张PPT)教育课件

人
的
一
生
说
白
了
,
也
就
是
三
万
余
天
,
贫
穷
与
富
贵
,
都
是
一
种
生
活
境
遇
。
懂
得
爱
自
己
的
人
,
对
生
活
从
来
就
没
有
过
高
的
奢
望
,
只
是
对
生
存
的
现
状
欣
然
接
受
。
漠
漠
红
尘
,
芸
芸
众
生
皆
是
客
,
时
光
深
处
,
流
年
似
水
,
转
瞬
间
,
光
阴
就
会
老
去
,
留
在
心
头
的
,
只
是
弥
留
在
时
光
深
处
的
无
边
落
寞
。
轻
拥
沧
桑
,
淡
看
流
年
,
掬
一
捧
岁
月
,
握
一
份
懂
得
,
红
尘
纷
扰
,
我
自
未溶解。
溶解度曲线应用——5.曲线上和曲线上下部区域点的意义及移动
中考复习--- 溶解度及溶解度曲线(共20张PPT)【完美版】

中考复习--- 溶解度及溶解度曲线(共20张PPT)【完 美版】
【例题1】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是( C )
A. t1℃时,甲、乙的溶液中所含溶质质量相等 B. t2℃时,将50 g甲加入50 g水中,可得到100 g溶液 C.甲中含有少量乙时,可用降温结晶法提纯甲 D. t1℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数甲>乙
中考复习--- 溶解度及溶解度曲线(共20张PPT)【完 美版】
中考复习--- 溶解度及溶解度曲线(共20张PPT)【完 美版】
3.溶解度曲线 (1)含义。①曲线上的点,表示对应温度下该物质的溶解度。 ②曲线的走向表示该物质的溶解度随温度变化的趋势。曲线平缓,说明该物质的溶解度受温
度变化影响较小;曲线越陡,说明该物质的溶解度受温度变化影响越大。 ③交点表示该温度下,两物质的溶解度相等;还可表示该温度下,两物质饱和溶液的溶质质量
(3)溶液不一定无色,常见的有色溶液有:蓝色的CuCl2、CuSO4溶液;浅绿色的FeCl2、FeSO4 溶液;黄色的FeCl3、Fe2(SO4)3溶液;紫红色的高锰酸钾溶液等。
(4)不同物质去污原理不同,如洗涤剂去油污是乳化作用,汽油去油污是溶解作用。 (5)溶液一定属于混合物,而水、乙醇属于纯净物,因此均一、稳定的液体不一定是溶液。
中考复习--- 溶解度及溶解度曲线(共20张PPT)【完 美版】
中考复习--- 溶解度及溶解度曲线(共20张PPT)【完 美版】
【例题4】(双选)时,将等质量的分别加入到各盛有水的两个烧杯中,充分搅拌后恢复到,现 象如图1、2所示。下列说法正确的是( BD )
A. 甲中加入的固体是 KNO3 B. 甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液 C. 将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D. 若将甲、乙的温度从升高到,两溶液中的溶质质量分数相等
溶解度曲线(答案)

溶解度曲线1、点的意义:①曲线以上的点:表示过饱和溶液;②曲线以下的点:表示不饱和溶液;③曲线上的点:表示恰好饱和;④两条曲线的交点:表示对应温度下两物质的溶解度相等.2、线的意义:曲线表示出了物质的溶解度受温度影响的情况。
①大多数物质的溶解度随温度的升高而增大,(陡升型)如:硝酸钾。
②少数物质的溶解度受温度的影响很小,(缓升型)如:氯化钠。
③极少数物质的溶解度随温度的升高而减小,(下降型)如:氢氧化钙。
3、应用:①利用溶解度曲线可以查出某物质在某温度下的溶解度。
②利用曲线可以比较某物质在不同温度下的溶解度大小。
③利用曲线可以比较同一温度下不同物质的溶解度的大小。
④利用曲线可以知道如何改变温度完成饱和、不饱和溶液之间的转化⑤利用曲线可以知道如何从溶液中得到晶体。
【陡升型-----降温(冷却热饱和溶液);缓升型----蒸发溶剂;下降型------升温】⑥利用曲线可以将混合物达到初步分离:硝酸钾中混有少量的氯化钠,如何提纯硝酸钾?练习1、(2006河北)右图是三种固体物质溶解度曲线。
下列说法中正确的是()A.甲乙都属于易溶物质B.固体物质的溶解度都随着温度的升高而增大C.在30℃时,乙的溶解度大于甲的溶解度D.升高温度,可以使丙的饱和溶液变成不饱和溶液2、下图是甲、乙、丙、丁四种物质的溶解度曲线,温度为t℃时,将等质量甲、乙、丙、丁四种物质分别加到100g水中,充分搅拌后只得到一种饱和溶液,该饱和溶液中的溶质是()A.甲B.乙C.丙D.丁3、右下图为甲、乙两种固体物质在水中的溶解度曲线。
下列说法错误的是()A.甲物质的溶解度随温度的升高而增大B.在t1℃时,甲、乙两物质的溶解度相等C.在t2℃时,N点表示甲物质的不饱和溶液D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g4、右图是X、Y两种固态物质的溶解度曲线,下列判断正确的是()A.t1时,X物质和Y物质的溶解度相等B.X物质和Y物质的溶解度均随温度的升高而增大C.将Y物质的饱和溶液从t2降到t1有晶体析出D.t2时,X溶液的溶质质量分数比Y溶液的溶质质量分数大0 t t温度/℃M N甲乙25125、根据图8所示的溶解度曲线,判断下列说法中不正确...的是( ) A.t 1℃时,甲物质的溶解度小于乙物质的溶解度B.t 2℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量相等C.将t 3℃的甲乙两物质的饱和溶液降温到t 2℃时都会析出晶体D.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲6、木糖醇是一种理想的蔗糖替代品,它的溶解度曲线如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题06 溶解度曲线一、判断某物质在某温度下的溶解度或比较某温度下各物质溶解度的大小;二、计算某溶质的质量分数或比较不同物质的溶质质量分数大小;三、温度变化时,溶解度或溶质质量分数的变化和比较;四、比较等质量的不同溶质配成饱和溶液所需溶剂质量(或等质量的溶剂配成饱和溶液所需不同溶质质量)大小;五、饱和溶液与不饱和溶液的转化方法;六、物质的净化方法等本考点主要以文字叙述结合两条线或三条线的坐标曲线图在选择题或填空题中考查。
归纳1 溶解度1.固体物质的溶解度(1)固体的溶解度表示在下,某固态物质在溶剂里达到时所溶解的。
四要素:a.一定温度下;b.100 g溶剂里;c.达到饱和;d.溶解的质量。
(2)影响固体溶解度的因素内因:a.的性质,b.的性质;外因:c.温度。
2.气体溶解度(1)气体溶解度,表示该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
(2)影响气体溶解度的因素内因:a.的性质;b.的性质;外因:c.压强;d.温度。
(3)气体溶解度与温度、压强的关系①压强越大,溶解度;②温度越高,溶解度。
(4)会用气体溶解度的影响因素解释简单实际问题:①喝汽水易打嗝是因为:。
②打开汽水瓶盖会冒出大量气泡是因为:。
④水沸腾前就会出现气泡是因为:。
归纳2 溶解度曲线1.溶解度曲线应用:(注:A、B、C代表物质依次为——硝酸钾、氯化钠、熟石灰或气体)⑴会比较S大小:0℃时溶解度大小顺序为,t2℃时三种物质溶解度大小顺序为。
⑵会查S并进行简单推算、判断:①t2℃50g水中最多能溶解A物质。
②t2℃一瓶饱和A溶液的浓度为。
③t2℃把25gA物质放入100g 水中,所得溶液质量为,浓度为,所得溶液是否饱和:;降温至t1℃,所得溶液质量为,此时溶液是否饱和:。
⑶会判断饱和溶液浓度随温度变化情况:①t2℃三物质的饱和溶液降温至t1℃,A溶液浓度将,B溶液浓度将,C溶液浓度将。
②t1℃三物质的饱和溶液升温至t2℃,A溶液浓度将,B溶液浓度将,C溶液浓度将。
③t1℃三物质的饱和溶液(杯内有剩余晶体),升温至t2℃,A溶液浓度将,B溶液浓度将,C溶液浓度将。
A溶液中能看到的现象是,C溶液中能看到的现象是。
④t1℃的三种物质饱和溶液,升温时浓度变小的是,降温时浓度变小的是。
⑤t2℃时三个物质饱和溶液的浓度大小顺序为,降温至t1℃时溶液浓度的大小顺序为(可画水平线判断:A溶解度虽下降但并没有低于C在t2℃的“高度”)。
⑷M点含义是:(注意:纵坐标若给出数值需指出)。
⑸会观察溶解度曲线图选择合适的结晶方法:从溶液中析出A 常用 结晶法,从溶液中析出B 常用 结晶法,欲除去A 中少量B 常用 结晶法,欲除去B 中少量的A 常用的方法是 。
⑹会判断饱和与不饱和转化方法:欲使C 的溶液达到饱和方法有 、 、 ;欲使A 溶液达到饱和方法有 、 、 。
⑺在指定的温度下(即不许改变温度)考查饱和溶液与不饱和溶液的转化方法:t 2℃时,使A 、B 、C 不饱和溶液变为饱和溶液的方法依次是 、 、 ,或 ;t 2℃时,使A 、B 、C 的饱和溶液变为不饱和溶液的方法均为 。
2.溶解度曲线的含义: ①曲线上的点表示对应温度下的溶解度。
②两曲线的交点表示该点所对温度下,两物质溶解度相等。
③曲线下方的点表示的溶液为不饱和溶液,曲线上方的点表示的溶液 为饱和溶液且有未溶晶体,曲线中的点表示的溶液为恰好饱和;如a 点表示A 物质的饱和溶液且A 固体有剩余,b 点表示A 物质的恰好饱和的溶液,c 点表示A 物质的不饱和溶液。
④曲线图中点的移动:曲线上方的点移动到曲线下方,说明溶液由饱和变为不饱和;曲线下方的点移动到曲线中,说明溶液由不饱和变为饱和;曲线中的点沿曲线向下移动,则有晶体析出。
如,a 溶液变为c 溶液的操作是:将a 溶液降温至t 1℃,结晶、过滤出晶体后再升温至t 2℃即可。
【典例精讲】1.(2020安徽省卷)20℃时,NaCl 的溶解度为36g 。
配制此温度下20g 质量分数为5%的NaCl 溶液,下列说法正确的是( ) A .配制该溶液需要5g NaCl B .该溶液为饱和溶液C .将该溶液长时间敞口放置,最终有晶体析出D .配溶液时,量取所需体积水倒入烧杯,有少量水洒出,则所配溶液浓度小于5% 2.(2020江西中省卷)甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )t 1t a b c温度SA BCA.乙的饱和溶液升温后溶质的质量分数会变大B.仅用降温至0℃的方法可将a点的甲溶液转化为饱和溶液C.t2℃时等质量的甲、乙饱和溶液中溶剂质量:甲<乙D.除去甲中混有的少量乙宜采用的结晶方法是_____3.(2020山东聊城)a、b是常见的两种固体物质,根据图表的信息回答下列问题:物质b的溶解度表(1)60℃时,物质a的溶解度是______g。
(2)20℃时,将20g物质b加入到50g水中,充分溶解后得到溶液的质量为________g。
(3)将50℃时a、b两物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数大小关系为a______b (填“>”、“=”或者“<”)。
(4)下列说法正确的组合是_______(填字母序号)。
①所有物质的溶解度都随温度的升高面增大②30℃时,物质的溶解度a小于b③物质b中含有少量a时,可以采用降温结晶的方法提纯b④40℃时,分别将物质a、b的饱和溶液降温至10℃,析出物质的质量b大于aA ①④B ①③C ②③D ②④4.(2020河南省卷)甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是()A.甲的溶解度大于乙的溶解度B.t1°C时,甲乙饱和溶液中溶质的质量分数相等C.t2°C时,60g 甲的饱和溶液稀释到20%需加水10gD.将t1°C时相等质量的甲、乙的饱和溶液升温到t2°C,溶液中溶质的质量甲大于乙5.(2020北京市)不同温度下KNO3的溶解度如下表所示。
下列说法正确的是()A.20℃时,100gKNO3饱和溶液中溶质质量为31.6gB.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%C.30℃时,将50gKNO3放入100g水中得到150g溶液D.40℃时,100g水最多溶解63.9gKNO36.(2020福建省卷)NaCl和KNO3在不同温度时的溶解度如下表。
下列说法错误的是()A.20℃时,100gH2O最多能溶解36.0gNaClB.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%C.可用冷却海水的方法获取大量食盐D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液7.(2020天津市)溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是___________(填序号)。
A.硝酸钾B.植物油C.面粉(2)下列有关溶液的说法中,正确的是_________(填序号)。
A.凡是均一的、稳定的液体一定是溶液B.溶液是均一、稳定的混合物C.溶液一定是无色的,且溶剂一定是水的(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度___________(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为___________(填最简比)。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是_______(填序号)。
A.甲>乙>丙B.甲=乙<丙C.甲=乙>丙(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为__________g。
若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为_______g。
8.(2020湖北武汉)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:(1)A、B两点对应的溶液中溶质的质量分数较大的是____________(填字母编号)。
(2)0℃时,物质X的溶解度是____________。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是____________(填字母编号)。
(4)下列说法正确的是_____________(填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大9.(2020广东省卷)如图是KNO3的溶解度曲线,下列说法正确的是()A.溶液从b点降温到a点,有晶体析出B.60℃时,b、c点对应的都是饱和溶液C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液D.60℃时,向50g水中加入60gKNO3,形成不饱和溶液10.(2020江苏常州)甲、乙试管中各盛有10.0g水,向其中一支中加入3.0gKNO3固体,另一支中加入3.0gNaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是()A.甲中加入的固体是KNO3B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量11.(2020广东广州)硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是()12.(2020陕西省卷)如下图所示,室温下将120gNaOH固体加入100g水中搅拌后固体全部溶解,放置一段时间恢复至室温后,析出11g固体。
(忽略实验过程中水的损失)。
(1)丙中溶液为______(填“饱和”或“不饱和”)溶液。
(2)乙中溶液的质量为______。
(3)室温时NaOH的溶解度是_______。
(4)上述实验说明NaOH的溶解度曲线与右上图中的______(填“a”或“b”)相似。
13.(2020黑龙江哈尔滨)如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是()A.t2℃时,甲的溶解度为70B.乙中含有少量的甲,可用蒸发溶剂的方法提纯乙C.t2℃时,甲、乙两种物质的溶液分别降温到t1℃,析出晶体的质量甲一定大于乙D.t2℃时,甲的溶液降温到t1℃,一定能得到甲的饱和溶液14.(2020山东潍坊)甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是()A.甲的溶解度大于乙的溶解度B.t2℃时,甲、乙的饱和溶液中溶质的质量分数相等C.t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液D.将t2℃时等质量的甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大15. (2020江苏无锡)如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是()A.t1℃时,KNO3的溶解度与NH4Cl的溶解度相等B.t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%C.t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出D.t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数[名师点拨]溶解度曲线能定量地表示出溶解度变化的规律,根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小;根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
