注射用盐酸表柔比星说明书--艾达生
盐酸多柔比星脂质体注射液 质量标准

盐酸多柔比星脂质体注射液质量标准盐酸多柔比星脂质体注射液,是一种用于治疗癌症的药物。
其主要成分是盐酸多柔比星,以及一种称为脂质体的药物传递系统。
在本文中,我们将详细介绍盐酸多柔比星脂质体注射液的质量标准。
1.外观:盐酸多柔比星脂质体注射液应该是无颗粒、无悬浮物和无杂质的透明液体。
其中,脂质体应该是均匀分散在溶液中,并且具有均一的颗粒大小和形状。
2. pH值:盐酸多柔比星脂质体注射液的pH值应该在4.0-7.0之间。
pH值的范围对于药物的稳定性和生物利用度非常重要,过高或过低的pH值可能会影响药物的疗效。
3.盐酸多柔比星含量:盐酸多柔比星脂质体注射液的盐酸多柔比星含量应符合国家药典或企业自行制定的规定。
这是确保该药物在治疗癌症方面提供有效结果的重要指标。
4.脂质体粒径:盐酸多柔比星脂质体注射液中的脂质体应具有一定的粒径范围。
这是由于脂质体的大小会影响其在体内的分布和吸收情况。
通常来说,脂质体粒径应在100-200纳米之间。
5.无菌性:盐酸多柔比星脂质体注射液必须符合无菌性的要求。
这意味着在制造和包装过程中,要严格控制微生物的污染。
如果存在细菌、霉菌或其他致病微生物的污染,可能对患者的健康产生严重影响。
6.稳定性:盐酸多柔比星脂质体注射液在储存和运输过程中应该具有良好的稳定性。
药物的稳定性包括其在不同温度、光照和湿度条件下的物化特性和有效性。
针对盐酸多柔比星脂质体注射液,一般要求其在室温下储存,并且在有效期内保持其活性。
7.溶解度:盐酸多柔比星脂质体注射液的溶解性是十分重要的。
治疗的有效性与药物的溶解度密切相关。
因此,盐酸多柔比星脂质体注射液的溶解性应符合一定的标准,以确保在用药过程中能够得到良好的溶解。
综上所述,盐酸多柔比星脂质体注射液的质量标准涉及到外观、pH值、盐酸多柔比星含量、脂质体粒径、无菌性、稳定性以及溶解度等方面。
只有在这些方面都能达到标准,药物才能发挥其治疗癌症的作用。
不过需要注意的是,具体的质量标准可能因国家药典、公司标准或医疗监管要求而有所不同。
表柔比星注射液

盐酸表柔比星注射液目录编辑本段产品介绍【批准文号】国药准字H20041211【中文名称】盐酸表柔比星注射液【产品英文名称】Epirubicin Hydrochloride for Injection 【生产企业】浙江海正药业股份有限公司【功效主治】用于治疗白血症恶性淋巴瘤多发性骨髓瘤乳腺癌肺癌软组织肉瘤胃癌结肠直肠癌卵巢癌等【化学成分】盐酸表柔比星编辑本段药理作用4位置上的羟基由顺位变为反位为一细胞周期非特异性药物其主要作用部位是细胞核本品的作用机制与其能与DNA结合有关体外培养的细胞加入本品可迅速透入胞内进入细胞核与DNA结合从而抑制核酸的合成和有丝分裂已证实表柔比星具有广谱的抗实验性肿瘤的作用对拓扑异构酶也有抑制作用疗效与阿霉素相等或略高而毒性尤其是心脏毒性低于阿霉素【药物相互作用】1表柔比星可与其他抗肿瘤药物合用但表柔比星用量应减低联合用药时不得在同一注射器内使用2表柔比星不可与肝素混合注射因为二者化学性质不配伍在一定浓度时会发生沉淀反应编辑本段不良反应1与阿霉素相似但程度较低尤其是心脏毒性和骨髓换制毒性;2其他不良反应有:脱发60~90%的病例可发生一般可逆男性有胡须生长受抑;黏膜炎用药的第5~10天出现能常发生在舌侧及舌下粘膜;胃肠功能紊乱如恶心呕吐腹泻;曾有报道偶有发热寒颤荨麻疹色素沉着关节疼痛【禁忌症】1禁用于因用化疗或放疗而造成明显骨髓抑制的病人2已用过大剂量蒽环类药物(如阿霉素或柔红霉素)的病人3近期或既往有心脏受损病史的病人【产品规格】5ml:10mg【用法用量】表柔比星单独用药时成人剂量为按体表面积一次60~90mg/m2联合化疗时每次50~60mg/m2静脉注射根据病人血象可间隔21天重复使用【贮藏方法】遮光,密封保存。
编辑本段注意事项1关于心脏毒性(1)可导致心肌损伤,心力衰竭。
动物实验和短期人体实验表明,表柔比星的心脏霉性比异构体阿霉素小。
比较研究表明,表柔比星和阿霉素引起相同程度心功能减退的蓄积剂量之比为2:1。
201103外观相似药品(外包装似)

2种外观相似的药品
注射用美罗培南 (海正美特) 500mg/西林
注射用盐酸表柔比星 (艾达生) 10mg/西林
2种外观相似的滴眼液
氟米龙滴眼液 (艾氟龙) 5mg 5mL/瓶
醋酸泼尼松龙滴眼液 (百力特) 50mg 5mL/瓶
2种外观相似的注射剂
鲑鱼降钙素 (密盖息) 50IU 1mL/安瓿
奥曲肽 (善宁) 0.1MG 1mL/安瓿
4种外观 相似的 中成药
通用名 加味香连丸 茴香橘核丸 木香顺气丸 越鞠保和丸 规格 6g×12袋/盒 6g×12袋/盒 6g ×12袋/盒 6g×12袋/盒
2种外观相似 自制制剂的包装改进
通用名 规格 硫酸镁溶液 40mL/瓶 水合氯醛溶液 30mL/瓶
药房和病房均出现过 由此混淆引发的用药 差错
2种外观相似的注射剂
通用名
注射用法莫替丁(冻干) 注射用糜蛋白酶
规格
4000单位/瓶 20mg/瓶
用药途径
IV or 肌注 肌注or眼科注入后房
2种外观相似的外用药
商品名 必伏 邦力
通用名 联苯苄唑凝胶 曲安奈德益康唑乳膏
规格 10g:0.1g/支 15g:0.15g/盒
2种外观相似的注射液
规格 80mg×7粒/盒 10mg×14片/盒
3种外观相似的品种
商品名 开博通 蒙诺 格华止
通用名 卡托普利片 福辛普利钠片 二甲双胍片
规格 12.5mg ×20片/盒 10mg×14片/盒 500mg×20片/盒
3种外观相 似的品种
商品名 安拿芬尼 力奥来素 扶他林
通用名 规格 氯米帕明片 25mg×30片/盒 巴氯酚片 10mg×30片/盒 双氯芬酸钠肠溶片 25mg×30片/盒
盐酸表柔比星功能介绍
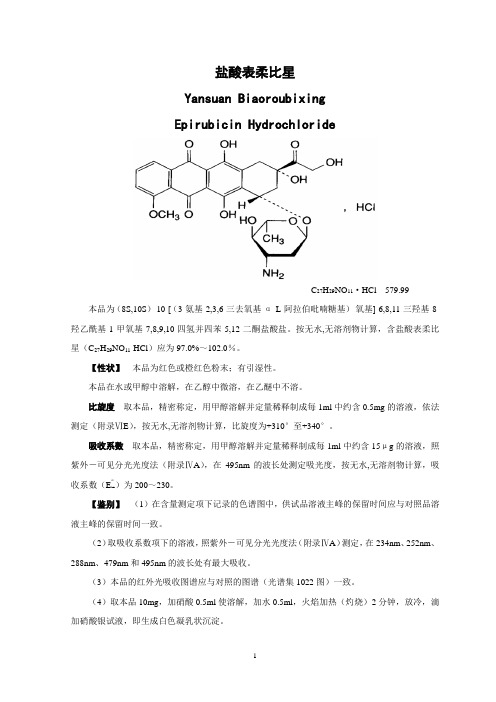
盐酸表柔比星Yansuan BiaoroubixingEpirubicin HydrochlorideC27H29NO11·HCl 579.99 本品为(8S,10S)-10-[(3-氨基-2,3,6-三去氧基-α-L-阿拉伯吡喃糖基)-氧基]-6,8,11-三羟基-8-羟乙酰基-1-甲氧基-7,8,9,10-四氢并四苯-5,12-二酮盐酸盐。
按无水,无溶剂物计算,含盐酸表柔比星(C27H29NO11·HCl)应为97.0%~102.0%。
【性状】本品为红色或橙红色粉末;有引湿性。
本品在水或甲醇中溶解,在乙醇中微溶,在乙醚中不溶。
比旋度取本品,精密称定,用甲醇溶解并定量稀释制成每1ml中约含0.5mg的溶液,依法测定(附录ⅥE),按无水,无溶剂物计算,比旋度为+310°至+340°。
吸收系数取本品,精密称定,用甲醇溶解并定量稀释制成每1ml中约含15μg的溶液,照紫外-可见分光光度法(附录ⅣA),在495nm的波长处测定吸光度,按无水,无溶剂物计算,吸收系数(E1%1cm)为200~230。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取吸收系数项下的溶液,照紫外-可见分光光度法(附录ⅣA)测定,在234nm、252nm、288nm、479nm和495nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1022图)一致。
(4)取本品10mg,加硝酸0.5ml使溶解,加水0.5ml,火焰加热(灼烧)2分钟,放冷,滴加硝酸银试液,即生成白色凝乳状沉淀。
【检查】酸度取本品,加水制成每1ml中含5mg的溶液,依法测定(附录VI H),pH 值应为4.0~5.5。
溶液的澄清度取本品5份,各10mg,分别加水5ml溶解后,溶液应澄清;如显浑浊,与1号浊度标准液(附录ⅨB)比较,均不得更浓。
阿克拉霉素(注射用)

注射用盐酸阿柔比星说明书【药品名称】通用名:注射用盐酸阿柔比星商品名:英文名:Ac1arubicin Hydrochlorid for Injection汉语拼音:Zhusheyong Yansuan A roubixing本品主要成分为阿柔比星,化学名为(1R,2R,4S)-2-乙基-1,2,3,4,6,11-六氢-2,5,7-三羟基-6,11-二氢-4-[[2,3,6-三脱氧-4-O-[2,6-二脱氧-4- O-[(2R,6S)-四氢-6-甲基-5-氧-2H-吡喃-2-基]-α-L-来苏-已吡喃糖基]-3-(二甲氨基)-α- L-来苏-已吡喃糖基]氧]-1-并四苯羧酸甲酯。
其结构式:分子式:C42H58NO15 ·HCL分子量:848.34【性状】本品为黄色或淡橙黄色冷冻疏松块状物。
【药理毒理】阿柔比星是一种新蒽环类抗肿瘤抗生素,对各种移植性动物肿瘤如L310、P388、Ehlrich 腹水癌、Lewis 肺癌、S100肉瘤、B16黑色素瘤和CDF8及C3H乳癌等均有较强的抗瘤活性。
本品能抑制癌细胞的生物大分子合成,特别对RNA合成的抑制作用强。
本品对实验动物有一定的心脏毒性和骨髓抑制作用,但作用是可逆的。
本品有生殖毒性。
【药代动力学】本品静脉注射后,能很快分布到全身组织中,以肺浓度为最高,其次为脾、胸腺、小肠、心脏;在肝、肾中以配基类代谢物为主;瘤组织中也有一定分布。
虽然本品在注射后,血药浓度迅速降低,但能较久地维持在一定浓度。
原型药和糖苷类代谢物在胆汁中排泄较多,在尿粪中排泄较少;配基类代谢物主要由尿、粪排泄。
【适应症】急性白血病、恶性淋巳瘤,也可试用于其他实体恶性肿瘤。
【用法用量】临用前,加氯化钠注射液或5%葡萄糖注射液溶解,静脉注射或滴注。
白血病与淋巴瘤:15~20mg/日,连用7~10日,间隔2~3周后可重复。
实体瘤:30~40mg/次,一周2次,连时4~8周。
本品也可与其他抗癌药物联合应用。
表阿霉素(表柔比星)

表阿霉素(表柔比星)
【适用症】: 适应症与阿霉素相同,主要用于乳腺癌、恶性淋巴瘤、
卵巢癌、消化道癌、肺癌、白血病、头颈部癌、软组织肉瘤、膀胱癌、肾癌及恶性黑色素瘤等。
【注意事项】: 与阿霉素相同,骨髓抑制略轻,心脏毒性较低。
引起
心脏毒性的平均剂量为每平方米体表面积935mg,而阿霉素为每
平方米体表面积468mg。
70%的病人出现脱发。
【用法与用量】: 静注:成人单一用药每平方米体表面积75~90
mg,3周给药1次。
也可给予每平方米体表面积40~50mg,
连续2日,亦3周后重复。
对于既往作过放、化疗,骨髓贮备降低,
年老病人、肝功能异常及同时进行纵隔、心包放疗的病人需减量。
在
联合化疗中也应相应减量,一般可给每平方米体表面积50~75mg,3周1次。
表阿霉素口服无效,不能肌注或鞘内给药。
静注时最
好在输液后由侧管中冲入,避免药物外渗或漏至皮下引起严重的组织
损伤及坏死。
药物溶解后可在室温下保存24小时,但应避免阳光直
接照射。
在冰箱中(4~10℃)可保存48小时。
【包装】: 针剂表阿霉素:每支10mg、50mg。
【贮藏】: 室
温下避光保存。
粉针剂用注射用水初溶的必要性及其稳定性浅析

粉针剂用注射用水初溶的必要性及其稳定性浅析肖莉娜张建中(复旦大学附属中山医院静脉用药调配中心上海 200032)摘要目的:提高我院粉针剂药物用注射用水初溶后的稳定性。
方法:对我院2020年所有针剂品种进行回顾并统计,其中对粉针剂用注射用水初溶及初溶后的药物稳定性进行分析。
结果:发现在粉针剂药物说明书中要求使用注射用水进行初溶的药物品种有53个,占总品种的13%,其目的包括增加粉针剂药物的溶解度、避免输液pH对粉针剂药物溶解造成不稳定结果、避免盐析现象、避免美拉德反应、防止产生同离子效应、防止输液中可能产生不溶性微粒、防止溶血现象的发生。
结论:粉针剂药物溶解是制备加药输液稳定性的一个重要步骤,正确使用注射用水对其进行初溶是药学人员必须掌握的专业技能。
关键词粉针剂注射用水初溶稳定性中图分类号:R926; R952 文献标志码:C 文章编号:1006-1533(2022)07-0078-04引用本文肖莉娜, 张建中. 粉针剂用注射用水初溶的必要性及其稳定性浅析[J]. 上海医药, 2022, 43(7): 78-81.Necessity and stability of initial dissolution of water for injection for powder injectionXIAO Li’na, ZHANG Jianzhong(Pharmacy Intravenous Admixture Service, Zhongshan Hospital, Fudan University, Shanghai 200032, China)ABSTRACT Objective: To improve the stability of water for injection for powder injection in our hospital. Methods: All varieties of drug injections in our hospital in 2020 were reviewed and statistically analyzed, in which the initial dissolution of water for injection for powder and the drug stability after initial dissolution were analyzed. Results: It was found that there were 53 drug varieties that require the use of water for injection for initial dissolution in the powder injection drug instructions, accounting for 13% of the total varieties, the purpose of which was to increase the solubility of the powder for injection, avoid the salting-out phenomenon, the Maillard reaction and the unstable results caused by the pH value of the infusion solution, and prevent the generation of the same ion effect and the insoluble particles in the infusion solution and the occurrence of hemolysis.Conclusion: Drug dissolution of powder injection is an important step in the stability of drug infusion preparation. Proper use of water for injection for initial dissolution is a professional skill that pharmaceutical personnel must master.KEy wORDS powder injection; water for injection; initial dissolution; stability输液加药包括药物溶解(粉针剂药物)与药物稀释入输液两个工作环节,粉针剂药物初溶解正确与否对于最终加药输液的稳定性至关重要。
注射用盐酸表柔比星说明书

注射用盐酸表柔比星说明书注射用盐酸表柔比星说明书一、商品名称注射用盐酸表柔比星二、药品分类处方药三、药品成分每1毫升含盐酸表柔比星2毫克四、适应症此药适用于治疗以下感染疾病:1. 呼吸道感染,如急性喉炎、急性支气管炎等。
2. 皮肤和软组织感染,如表浅性脓肿、痈、蜂窝织炎等。
3. 泌尿道感染,如肾盂肾炎、尿道炎等。
4. 消化道感染,如胃肠炎、胆囊炎等。
5. 骨骼系统感染,如骨髓炎,化脓性关节炎等。
五、用法用量该药应由医生按病情和患者体重等因素决定用药剂量和疗程,不宜自行调整。
1. 成人和12岁以上儿童:每次0.25毫克/千克,一日2次给药。
2. 特殊人群:(1)肝功能不全患者:应减小剂量或增加给药间隔时间。
(2)肾功能不全患者:根据肾功能状况,调整用药剂量和给药间隔时间,严重肾功能不全应禁用。
(3)老年患者:应注意肾功能变化,酌情调整剂量和给药间隔时间。
(4)儿童患者:剂量应按体重计算,给予成人剂量的半数。
六、注意事项1. 禁忌症:对本药过敏、严重肝功能不全和婴儿期患嗜血细胞减少症等禁用。
2. 孕妇和哺乳期妇女应慎用。
3. 本药物可能出现过敏、肝损伤、肾损伤、血液系统不良等不良反应,如出现不适应立即停药并就医。
4. 在药物使用期间应避免饮酒、吸烟等影响药效的行为。
5. 长期应用本药可能导致细菌耐药性增加,应尽可能遵医嘱使用。
七、药物相互作用1. 与苯扎氯铵合用可增加中枢神经系统毒性。
2. 与卡马西平合用可增强前者的抗高血压作用。
3. 与华法林、保泰松等药物合用可增加出血风险。
八、贮藏方法本药品需存放于干燥,阴凉和避光的环境内,离达到最佳效果的安瓿打开时间不超过24小时。
避免冷藏,不得使用色素变化、浑浊、有颗粒物的溶液。
九、过期时间该药品保质期为2年。
十、包装规格每瓶装2毫升,每盒12瓶。
注射用盐酸表柔比星说明书--法玛新

注射用盐酸表柔比星说明书【药品名称】通用名称: 注射用盐酸表柔比星(速溶)商品名称:法玛新®英文名称: Epirubicin Hydrochloride for Injection (Rapid Dissolution)汉语拼音: Zhusheyong Yansuan Biaoroubixing(Surong)【成份】化学名称:(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐化学结构式:分子式:C27H29NO11⋅ HCl分子量:579.98CAS No.:56390-09-1辅料名称:乳糖、对羟基苯甲酸甲酯【性状】本品为鲜红色或橙红色的疏松块状物,有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】10mg【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg/m2,当表柔比星用来辅助治疗腋下淋巴阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg/m2,在每疗程的第1天给药,3-4周一次。
静脉注射给药。
根据患者血象可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。
海正药业

花钱买鱼——让海正“站起来”。
1986年,买断上海医药工业研究院的阿霉素 实验室成果,并实现产业化,使海正迈出了具 有历史意义的一步
借池养鱼——让海正“富起来”
阿佛菌素是海正与上海市农药研究所合作的成 果,成为公司历史上第一只单品种利润超亿元 的产品
放水养鱼——让海正“大起来”。
他汀类药物就是组合了国内多家科研单位各自 在菌种选育、发酵、提取等专业领域的优势, 目前生产规模和技术水平居世界第二
筑池养鱼——真正“强起来”
1999年,海正成立了浙江省医药行业首家研发中心; 2000年,经国家经贸委批准,海正建立“国家级企业技术研究中心”; 2001年,经人事部批准设立了“博士后科研工作站”。 目前,海正拥有六大研发部门和四大研发中心,拥有50多个单元实验 室,研发领域涵盖化学合成、微生物发酵、生物技术、天然植物提取 及制剂开发等多个方面,产品治疗领域涉及抗肿瘤、心血管系统、 抗感染、抗寄生虫、内分泌调节、免疫抑制、抗抑郁等。 公司从国内“产、学、研”合作走向国际合作, 联合发达国家的著名院校,建立国际化的研发体系, 开展化学合成及创新药物、基因工程药物的自主研发和自主创新
主要业务
1、原料药业务:主要是特色原料药的生产和 出口销售。 2、制剂业务:主要是抗肿瘤(包含白血病治 疗药物)、抗感染、心血管、免疫抑制剂、内 分泌调节剂、骨科用药等制剂产品的生产销售。 3、第三方药品分销业务
产品简介
抗肿瘤类 抗感染类 心血管类 免疫抑制剂 其他
克拉屈滨注射液 (艾博定 )
通络生骨胶囊(肌肉骨骼系统)
【药理作用】临床前动物试验 表明,本品可改善兔激素性股骨 头坏死模型内的血液供应,促进 死骨吸收与新骨形成;提高醋酸 法及热板法试验小鼠痛阈。
注射用盐酸吡柔比星说明书

注射用盐酸吡柔比星说明书【药品名称】通用名:注射用盐酸吡柔比星英文名:Pirarubicin Hydrochloride For Injection汉语拼音:Zhusheyong Yansuan Biroubixing【成份】本品主要成分及其化学名称为:(8S,10S)-[[3-氨基-2,3,6-三去氧-4-O-(2-四氢吡喃基)-α-L-阿拉伯吡喃糖基]氧]-7,8,9,10-四氢-6,8,11-三羟基-8-羟乙酰基-1-甲氧基-5,12-萘二酮盐酸盐其结构式为:分子式:C32H37NO12·HCl分子量:664.10CAS No.:72496-41-4【性状】本品为橙红色冻干疏松块状物或粉末。
【适应症】对恶性淋巴瘤和急性白血病有较好疗效,对乳腺癌、头颈部癌、胃癌、泌尿系统恶性肿瘤、及卵巢癌、子宫内膜癌、子宫颈癌等有效。
单用THP的有效率分别为20%~70%。
与多种化疗药物如Ara-C、CTX、6-MP、MTX、5-FU、DDP等联合应用抗癌作用增加。
【规格】(1) 10mg(2) 20mg【用法用量】将本品加入5%葡萄糖注射液或注射用水10ml溶解。
可静脉、动脉、膀胱内注射。
静注:一般按体表面积一次25~40mg/m2;动脉给药:如头颈部癌按体表面积一次7~20 mg/m2,一日1次,共用5~7日,亦可每次14~25 mg/m2,每周一次;膀胱内给药:按体表面积一次15~30 mg/m2,稀释为500~1000μg/ml浓度,注入膀胱腔内保留1~2h,每周3次为一疗程,可用2~3疗程。
【不良反应】1. 骨髓抑制为剂量限制性毒性,主要为粒细胞减少,平均最低值在14天,第21 天恢复,贫血及血小板减少少见;2. 心脏毒性低于ADM,急性心脏毒性主要为可逆性心电图变化,如心律失常或非特异性ST-T异常,慢性心脏毒性呈剂量累积性;3. 胃肠道反应:恶心、呕吐、食欲不振、口腔粘膜炎,有时出现腹泻;4. 其它:肝肾功能异常、脱发、皮肤色素沉着等,偶有皮疹。
注射用盐酸表柔比星说明书--艾达生

注射用盐酸表柔比星说明书【药品名称】 尔:注射用盐酸表柔比星 尔:艾达生尔:Epirubicin Hydrochloride for Injection f : Zhusheyong Yansuan Biaoroubixing 份】化学需称:本品的主要成份为盐酸表柔比星,化学名为(75: 9S ) -9-疑乙酰基-4-甲氧基-7, & 9, 10-四氢-6, 7, 9, 11-四疑基-7-。
(2, 3, 6-三去氧-3-氨基--L-阿拉伯毗喃糖基) -5, 12-蔡二酮盐酸盐。
化学结构式:分子式:C ::H 虫OiHCl分子量:579. 98CAS No. : 56390-09-1辅料:乳糖 【性状】本品为鲜红色或橙红色的疏松块状物;有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、 结肠直肠癌、卵巢癌、多发性卅髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿逍切除术后的复发。
【规格】lOmg 【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表而积一次60〜120mg /斥,当表柔比星 用来辅助治疗腋下淋巴结阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100〜120站,‘京 静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血 象可间隔21天重复使用。
优化剂量叙高剂疑可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面 积一次最高可达135mg/m %在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药, 3-4周一次。
联合化疗时,推荐起始剂量按体表而积最高可达120mg ,/ni :,在每疗程的第1天 给药,3-4周一次。
静脉注射给药。
根据患者血彖可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时 常变换体位,以保证膀胱粘膜能最大而积地接触药物。
注射用盐酸表柔比星说明书--艾达生

注射用盐酸表柔比星说明书【药品名称】通用名称:注射用盐酸表柔比星 商品名称:艾达生英文名称:Epirubicin Hydrochloride for Injection 汉语拼音:Zhusheyong Yansuan Biaoroubixing 【成 份】化学名称:本品的主要成份为盐酸表柔比星,化学名为(7S ∶9S )-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O -(2,3,6-三去氧-3-氨基--L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐。
化学结构式:分子式:C 27H 29NO 11·HCl 分子量:579.98 CAS No.:56390-09-1 辅 料:乳糖 【性状】本品为鲜红色或橙红色的疏松块状物;有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】10mg 【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg /m 2,当表柔比星用来辅助治疗腋下淋巴结阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m 2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量*:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m 2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg /m 2,在每疗程的第1天给药,3-4周一次。
静脉注射给药。
根据患者血象可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。
盐酸多柔比星脂质体说明书

盐酸多柔比星脂质体说明书
【药品名称】盐酸多柔比星脂质体注射液
【成分】盐酸多柔比星。
【性状】本品为无色透明液体。
【适应症】用于治疗化学疗法失败的转移性乳腺癌。
【规格型号】200mg/10mL
【用法用量】成人按体表面积每次1.8mg/m2,每周一次静脉滴注,治疗周期为21天。
治疗前应评估患者心功能和血液学指标。
【注意事项】
1、使用前应先阅读说明书,按照规定用量和方法使用。
2、严格按照医嘱使用本品,不得随意更改用量和方法。
3、本品仅限医院使用。
4、静脉滴注速度应控制在1mg/min以内。
5、使用本品过程中,应密切监测患者的生命体征和心电图,如出现心电图异常或心功能不全等不适症状应立即停止使用。
6、本品不宜在孕妇和哺乳期妇女中使用。
7、儿童患者应慎重使用。
8、使用本品过程中,如出现过敏及其他严重不良反应,应立即停止使用。
【贮藏方法】遮光,密闭,储存于2℃~8℃,避免冻结。
【包装】200mg/10mL
【有效期】24个月
【执行标准】YB20180050
【生产企业】xxxxxxx公司。
多柔比星说明书

注射用盐酸多柔比星[药典]【英文名称】Doxorubicin Hydrochloride for Injection[药典]【成份】本品主要成份为盐酸多柔比星。
其化学名称为:10-[(3-氨基-2、3、6-三去氧-a-L-来苏已吡喃基)-氧]-7,8,9,10-四氢-6,8,11-三羟基-8-(羟乙酰基)-1-甲氧基-5,12-萘二酮的盐酸盐。
其结构式为:分子式:C27H29NO11·HCl分子量:579.99辅料为乳糖。
主要成份相关链接:盐酸多柔比星D《妊娠期用药分类注释》【经乳汁分泌】C ontraindicated【性状】本品为橙红色的疏松块状物或粉末。
【适应症】用于急性白血病(淋巴细胞性和粒细胞性)、恶性淋巴瘤、乳腺癌、肺癌(小细胞和非小细胞肺癌)、卵巢癌、骨及软组织肉瘤、肾母细胞瘤、神经母细胞瘤、膀胱癌、甲状腺癌、前列腺癌、头颈部鳞癌、睾丸癌、胃癌、肝癌等。
【规格】10mg【用法用量】静脉冲入、静脉滴注和动脉注射。
临用前加氯化钠注射液溶解,浓度一般为2mg/ml。
1、成人常用量单药为50-60mg/m2,每3~4周1次,或一日20mg/m2,连用3日,停用2~3周后重复。
联合用药40mg/m2,每3周1次或25mg/m2,每周1次,连用2周,3周重复。
总剂量按体表面积不宜超过400mg/m2。
分次用药的心肌毒性,骨髓抑制和胃肠道反应(包括口腔溃疡)较每3周用药一次为轻。
2.联合化疗①ABVD(多柔比星、博来霉素、长春碱和达卡巴嗪),主要用于霍奇金淋巴瘤;②CAF(环磷酰胺、多柔比星、氟尿嘧啶),主要用于乳腺癌;③CAOP(环磷酰胺、多柔比星、长春新碱和泼尼松),主要用于非霍奇金淋巴瘤;④FAM(氟尿嘧啶,多柔比星和丝裂霉素),主要用于胃癌;⑤AC(多柔比星和阿糖胞苷),主要用于成人急性髓细胞性白血病;⑥AOP(多柔比星、长春新碱和泼尼松),主要用于淋巴母细胞型急性白血病的诱导缓解;⑦ACP(多柔比星、环磷酰胺和顺铂),主要用于卵巢癌和肺癌以及头颈部癌、膀胱癌等;⑧COAD(环磷酰胺、长春新碱、多柔比星和达卡巴嗪),主要用于软组织肉瘤和成骨肉瘤;⑨CAO(环磷酰胺、多柔比星、长春新碱),主要用于小细胞肺癌。
肝细胞肝癌临时医嘱

0.9%氯化钠注射液 100ml
注射用泮托拉唑钠(泮立苏)40mg
0.9%氯化钠注射液 100ml
注射用还原型谷胱甘肽(双益健) 1.8g
5%葡萄糖注射液250ml
门冬氨酸鸟氨酸注射液 10g
10%葡萄糖注射液250ml
异甘草酸镁注射液(天晴甘美)150mg
肝素钠注射液 2ml
盐酸异丙嗪注射液 50mg
盐酸甲氧氯普胺注射液 10mg
硝酸甘油注射液 5mg
盐酸阿托品注射液 1mg/1ml
盐酸托烷司琼注射液(欣贝) 5mg
碘佛醇注射液 67.8g/50ml
碘化油注射液 30ml
注射用奥沙利铂 150mg
注射用盐酸表柔比星(艾达生) 60mg
头孢替安皮试(-)
0.9%氯化钠注射液 100ml
注射用盐酸头孢替安(罗欣乐)1g
7.18
注射用盐酸头孢替安(罗欣乐)1g
0.9%氯化钠注射液 100ml
注射用盐酸头孢替安(罗欣乐)1g
0.9%氯化钠注射液 100ml
地塞米松磷酸钠注射液
乳果糖口服溶液(杜密克)
0.9%氯化钠注射液 100ml
7.19
免疫室(住院)降钙素原/
开塞露 40ml 塞肛
0.9%氯化钠注射液 100ml
人血白蛋白
吲哚美辛栓50mg 塞肛
吲哚美辛栓50mg 塞肛
0.9%氯化钠注射液 100ml
人血白蛋白 20g
7.2
生化室/胆碱酯酶/病房肝肾糖脂/血生化
血凝室/门诊血凝四项
心电图/心电图
分子生物学实验室/乙肝肝炎DNA测定
表柔比星输注标准流程

表柔比星输注标准流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!表柔比星输注标准操作流程详解表柔比星,又名多柔比星,是一种常用的抗肿瘤药物,主要用于治疗多种类型的恶性肿瘤。
盐酸多柔比星脂质体-详细说明书与重点

盐酸多柔比星脂质体英文名称:Doxorubicin Hydrochloride Liposome Injection【成份】活性成份为盐酸多柔比星,是从一种波塞链霉菌表灰变种培养液中提取得到的蒽环类细胞毒性抗生素。
【性状】●一种脂质体制剂,系将盐酸多柔比星包封于聚乙二醇化(PEG化)的,表面结合有甲氧基聚乙二醇(MPEG)的脂质体中,可以保护脂质体免受单核巨噬细胞系统(MPS)识别,从而延长其在血液循环中的时间。
●为无菌、半透明红色混悬液,每瓶10ml,含盐酸多柔比星2mg/ml,是用于单剂量静脉滴注的浓缩液。
【适应症】可用于低CD4(<200CD4淋巴细胞/mm3)及有广泛皮肤粘膜内脏疾病的与艾滋病相关的卡波氏肉瘤(AIDS-KS)病人。
可用作全身化疗药物,或者用作治疗病情有进展的AIDS-KS病人的二线化疗药物,也可用于不能耐受下列两种以上药物联合化疗的病人:长春新碱、博莱霉素和多柔比星(或其他蒽环类抗生素)。
脂质体多柔比星在国外还被批准用于乳腺癌、卵巢癌和多发性骨髓瘤等恶性肿瘤。
【用法用量】应为每2-3周静脉内给药20mg/m2,给药间隔不宜少于10天,因为不能排除药物蓄积和毒性增强的可能。
病人应持续治疗2-3个月以产生疗效。
为保持一定的疗效,在需要时继续给药。
用250毫升5%葡萄糖注射液稀释,静脉滴注30分钟以上。
禁止大剂量注射或给用未经稀释的药液。
建议滴注管与5%葡萄糖滴注管相连接以进一步稀释并限度地减少血栓形成和外渗危险。
禁用于肌肉和皮下注射。
肝功能不全病人:对少数肝功能不全病人(胆红素值达4mg/dl)给予20mg/m2,血浆清除率和清除半衰期未见变化。
然而在取得进一步的经验之前,根据以往盐酸多柔比星的使用经验,对于肝功能不全的病人的给药量要减少。
建议当胆红素高于以下数值时考虑减少用量:血清胆红素1.2-3.0mg/dl,用常用量的;大于3mg/dl时用常用量的。
肾功能不全病人:由于多柔比星由肝脏代谢和经胆汁排泄,故使用时剂量不需作调整。
艾诺宁(注射用盐酸伊达比星)

艾诺宁(注射用盐酸伊达比星)【药品名称】商品名称:艾诺宁通用名称:注射用盐酸伊达比星英文名称:Idarubicin Hydrochloride for Injection【成份】化学名称:本品主要成份为盐酸伊达比星,其化学名为4-去甲氧基柔红霉素盐酸盐。
化学结构式:分子式:C26H27NO9.HCl分子量:533.97辅料:乳糖【适应症】成人急性非淋巴细胞性白血病的诱导缓解,复发,难治病人的诱导缓解。
成人和儿童急性淋巴细胞性白血病的二线治疗,还可用于综合化疗方案。
【用法用量】急性非淋巴细胞性白血病成人12mg/m2/日,疗程为3日,与阿糖胞苷联合使用;另一用法是单独或联合用药:8mg/m2/日,静脉注射,疗程为5日。
急性淋巴细胞性白血病成人12mg/m2/日,疗程3日。
儿童10mg/m2/日,疗程3日。
静脉注射。
在推荐剂量的基础上,用药2个疗程后的量可达到60-80mg/m2。
虽然没有最高限量,但对癌症病人来说,避免发生心脏性的平均剂量为93 mg/m2。
【不良反应】严惩骨髓抑制和心脏毒性,致死性的感染。
可逆性脱发,胃肠道反应如恶心、呕吐、粘膜炎,尤其是口腔粘膜炎,出现于治疗后3-10日,食道炎、腹泻,发热,寒战,皮疹。
有酶和胆红素增高。
使用本药1-2天后尿液呈现红色。
【禁忌】禁用于肝肾功能严重损伤的病人以及感染未得到控制病人。
【注意事项】严惩肝肾功能不全,感染未得到控制,曾接受药物或放射治疗引起骨髓抑制,心脏病患者。
妊娠及哺乳妇女。
老年人、高尿酸摁症患者及全身性感染病人慎用。
治疗过程中或药几周内,可能发生心毒性反应,即潜在性、致肌病,表现为持续性的QRS低电压,收缩新时期延长(PEP/LVET),左心室射血分数减低。
出现这些反应时可用洋地黄、利尿剂、制钠盐及臣床休息等措施。
治疗过程中应注意监测心脏功能。
纵隔心包区有过治疗,用过潜在性心脏毒性药物。
伴有其它疾病(如贫血、骨髓抑制、感染、心肌炎)者。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用盐酸表柔比星说明书【药品名称】通用名称:注射用盐酸表柔比星商品名称:艾达生英文名称:Epirubicin Hydrochloride for Injection汉语拼音:Zhusheyong Yansuan Biaoroubixing【成 份】化学名称:本品的主要成份为盐酸表柔比星,化学名为(7S ∶9S )-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O -(2,3,6-三去氧-3-氨基- -L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐。
化学结构式:分子式:C 27H 29NO 11·HCl分子量:579.98CAS No.:56390-09-1辅 料:乳糖【性状】本品为鲜红色或橙红色的疏松块状物;有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】10mg【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg /m 2,当表柔比星用来辅助治疗腋下淋巴结阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m 2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量*:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m 2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg /m 2,在每疗程的第1天给药,3-4周一次。
静脉注射给药。
根据患者血象可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。
为了避免药物被尿液不适当的稀释,应告知患者灌注前12小时不要饮用任何液体。
医生应指导患者在治疗结束时排空尿液。
2浅表性膀胱癌,表柔比星50mg溶于25至50ml注射用水中,每周一次,灌注8次。
对于有局部毒性(化学性膀胱炎)的病例,可将每次剂量减少至30mg,患者也可接受50mg每周一次共4次、然后每月一次共11次的同剂量药物膀胱灌注。
医生可根据患者病情调整给药次数。
*本品高剂量下中国患者使用数据有限,须在有经验的抗肿瘤医生指导下使用。
【不良反应】1.与多柔比星相似,但程度较低,尤其是心脏毒性和骨髓抑制毒性;2.其他不良反应有:脱发,60~90%的病例可发生,一般可逆,男性有胡须生长受抑;黏膜炎,用药的第5~10天出现,通常发生在舌侧及舌下粘膜;胃肠功能紊乱,如恶心、呕吐、腹泻;曾有报道偶有发热、寒颤、荨麻疹、色素沉着、关节疼痛。
【禁忌】1.禁用于因用化疗或放疗而造成明显骨髓抑制的患者。
2.已用过大剂量蒽环类药物(如多柔比星或柔红霉素)的患者禁用。
3.近期或既往有心脏受损病史的患者禁用。
4.禁用于血尿患者膀胱内灌注。
【注意事项】1.关于心脏毒性(1)可导致心肌损伤,心力衰竭。
动物实验和短期人体实验表明,表柔比星的心脏毒性比它的同分异构体多柔比星小。
比较性研究表明,表柔比星和多柔比星引起相同程度心功能减退的蓄积剂量之比为2∶1。
在表柔比星治疗期间仍应严密监测心功能,以减少发生心力衰竭的危险(这种心力衰竭甚至可以在终止治疗几周后发生,并可能对相应的药物治疗无效);(2)对目前或既往接受纵隔、心包区合并放疗的患者,表柔比星心脏毒性的潜在危险可能增加;(3)在确定表柔比星最大蓄积剂量时,与任何具有潜在心脏毒性药物联合用药时应慎重;(4)在每个疗程前后都应进行心电图检查。
蒽环类,尤其是多柔比星所引起的心肌病,在心电图上表现为QRS波群持续性低电压、收缩间期的延长超过正常范围(PEP/LVET),以及射血分数减低。
对接受表柔比星治疗的患者,心电监护是非常重要的,可以通过无创伤性的技术如心电图、超声心动图来评估心脏功能。
如有必要,可通过放射性核素血管造影术测量射血分数。
(5)当表柔比星总累积剂量超过900mg/m2时进展性充血性心力衰竭(CHF)的发生率明显增高,超过该累积剂量的使用需要非常小心。
当表柔比星总累积剂量超过900mg/m2时有引起原发性心肌病的风险,超过该累积剂量的使用需要非常小心。
发生心脏毒性的风险因素包括活动的或者非活动性的心血管疾病、目前或既往接受过纵膈/心脏周围区域的放射治疗,之前用过其他蒽环类药物或者蒽二酮药物、同时使用其他抑制心肌收缩功能的药物或者具有心脏毒性的药物(例如曲妥珠单抗)。
除非患者的心功能得到严密的检测,否则蒽环类药物包括表柔比星不能与其他具有心脏毒性的药物同时使用。
患者在停止使用其他具有心脏毒性的药物(特别是具有长半衰期的药物例如曲妥珠单抗)之后接受蒽环类药物可能也会增加发生心脏毒性的风险。
曲妥珠单抗的半衰期约为28.5天并且在血循环中可以持续至24周。
因此,如果可能,医师应该在停用曲妥珠单抗之后的24周内避免使用以蒽环类药物为基础的治疗。
如果在该时间之前需要使用蒽环类抗生素,须仔细监测心功能。
2.关于肝肾功能影响(1)由于表柔比星经肝脏系统排泄,故肝功能不全者应减量,以免蓄积中毒。
中度肝功能受损者(胆红素1.4~3mg/100ml或BSP滞留量9~15%),药量应减少50%。
重度肝功能受损者(胆红素大于3mg/100ml或BSP滞留量大于15%)药量应减少75%;(2)中度肾功能受损患者无需减少剂量,因为仅少量的药物经肾脏排出。
表柔比星和其它细胞毒药物一样,因肿瘤细胞的迅速崩解而引起高尿酸血症。
应检查血尿酸水平,通过药物控制此现象的发生;另外,在用药1~2天内可出现尿液红染。
3.关于骨髓抑制可引起白细胞及血小板减少,应定期进行血液学监测。
4.关于给药说明(1)静脉给药,用注射用水稀释,使其终浓度不超过2mg/ml。
(2)建议先注入生理盐水检查输液管通畅性及注射针头确实在静脉之后,再经此通畅的输液管给药。
以此减少药物外溢的危险,并确保给药后静脉用盐水冲洗;(3)表柔比星注射时溢出静脉会造成组织的严重损伤甚至坏死。
小静脉注射或反复注射同一血管会造成静脉硬化。
建议以中心静脉输注较好;(4)不可肌肉注射和鞘内注射。
5.继发性白血病有报道使用蒽环类药物(包括表柔比星)的患者出现了继发性白血病,可伴或不伴白血病前期症状。
下列情况下出现继发性白血病更为常见:当与作用机制为破坏DNA结构的抗癌药合用时;或患者既往多次使用细胞毒药物治疗;或蒽环类治疗剂量有所提升时。
此类白血病的潜伏期一般为1~3年。
6.对生殖系统的影响表柔比星能破坏精子染色体,正在接受表柔比星治疗的男性患者应采取有效的避孕方法。
表柔比星可能引起绝经前妇女闭经或绝经期提前。
7.免疫抑制效应/增加对感染易感性对于接受化疗药物包括表柔比星而导致免疫妥协的患者接种活疫苗或者减毒活疫苗可能会产生严重甚至致命的感染。
正在接受表柔比星的患者应该避免接种活疫苗。
可以接种死疫苗或者灭活疫苗,但是对这些疫苗的免疫应答可能会降低。
【孕妇及哺乳期妇女用药】尚无定论性资料说明表柔比星对人的生育力是否有不利影响,以及对胎儿是否有致畸作用或其它有害影响。
但有实验资料提示表柔比星与大多数抗肿瘤药物和免疫抑制剂类似,在特定试验条件下,在动物身上表现出致突变性和致癌性。
可以降低胎儿的成活率。
因此在妊娠期间不主张使用本品,哺乳期妇女禁用。
【儿童用药】儿童用药无特殊要求。
【老年用药】老年患者伴心功能减退者宜慎用或减量。
【药物相互作用】1.表柔比星可与其他抗肿瘤药物合用,但表柔比星用量应减低。
联合用药时,不得在同一注射器内使用。
2.表柔比星不可与肝素混合注射,因为二者化学性质不配伍,在一定浓度时会发生沉淀反应。
3.表柔比星主要在肝脏代谢,伴随治疗中任何能引肝功能改变的药物将会影响表柔比星的代谢、药动、疗效和/或毒性。
4、在表柔比星给药前使用紫杉醇类药物会引起表柔比星药物原形及代谢物血药浓度升高,其中代谢物既没有活性也没有毒性。
当紫杉醇或多西紫杉醇类药物和表柔比星联合用药时,先给表柔比星则对其药代动力学没有影响。
【药物过量】本品总限量为按体表面积550~800mg/m2。
9411名使用表柔比星治疗的患者,其中大部分为实体瘤晚期患者,当累积剂量达到550mg/m2时临床上出现明显充血性心力衰竭的患者约为0.9%;当累积剂量达到700mg/m2时临床上出现充血性心力衰竭的患者约为1.6%;当累积剂量达到900mg/m2时临床上出现明显充血性心力衰竭的患者约为3.3%。
使用表柔比星辅助治疗乳腺癌,临床试验中最大累积剂量为720mg/m2。
【临床试验】以上主要来自国外临床研究资料。
早期乳腺癌患者的辅助治疗两项随机、开放、多中心临床研究评估了表柔比星100~120mg/m2联合环磷酰胺与氟脲嘧啶,辅助治疗腋下淋巴阳性不伴远处转移的乳腺癌患者(Ⅱ或Ⅲ期)。
MA-5研究对表柔比星每个疗程120mg/m2联合环磷酰胺与氟脲嘧啶(CEF-120)方案进行了评估,该研究将伴有1个或以上淋巴结转移的绝经前和围绝经期女性患者随机分为含有表柔比星的CEF-120组或CMF 组。
GFEA-05研究则评估了表柔比星每个疗程100mg/m2联合氟脲嘧啶与环磷酰胺(FEC-100)方案,将绝经前和绝经后女性患者随机分为FEC-100组或较低剂量的FEC-50组。
GFEA-05研究入组患者要求伴有4个或以上淋巴结阳性,或,如果阳性淋巴结为1-3个,则要求患者雌激素和孕酮受体为阴性,而且肿瘤组织学为3级或2级。
这两项研究共入选1281名妇女,肿瘤组织学4级的患者均未入选。
表1列出各治疗方案,试验的主要终点指标为无复发生存时间(包括发生局部或区域复发、远处转移或疾病相关性死亡的时间)。
最后一次随访时记录是否发生对侧乳腺癌、患第二种原发性肿瘤或非乳腺癌导致的死亡。
表1. 早期乳腺癌患者Ⅲ期临床研究治疗方案治疗组药物用法MA-51CEF-120(共6个周期)2环磷酰胺75 mg/m2PO,d 1-14,q 28天716例356例表柔比星60 mg/m2IV,d 1&8,q 28天氟脲嘧啶500 mg/m2IV,d 1&8,q 28天CMF(共6个周期)环磷酰胺100 mg/m2 PO,d 1-14,q 28天360例甲氨喋呤40 mg/m2IV,d 1&8,q 28天氟脲嘧啶600 mg/m2IV,d 1&8,q 28天GFEA-053FEC-100(共6个周期)氟脲嘧啶500 mg/m2IV,d 1,q 21天565例276例表柔比星100 mg/m2IV,d 1,q 21天环磷酰胺500 mg/m2IV,d 1,q 21天FEC-50(共6个周期)氟脲嘧啶500 mg/m2IV,d 1,q 21天289例表柔比星50 mg/m2IV,d 1,q 21天环磷酰胺500 mg/m2IV,d 1,21天不论受体状态如何,两组绝经后妇女均接受三苯氧胺每天30 mg共三年1.对于乳腺肿瘤切除术的患者,在化疗完成后继续给予放疗。
