电化学合成碘仿
碘仿的制备

碘仿的制备一目的:1 了解电化学方法在有机合成中的应用。
2 初步掌握电化学合成的基本原理和基本操作。
二原理碘仿可以由乙醇或丙酮与碘的碱溶液作用而制得,也可用电解法制备。
本实验以石墨碳棒做电极,直接在丙酮—碘化钾溶液中进行电解反应,十分方便的制取碘仿。
阴极2H2O + 2e →2OH-+ H2阳极2I- - 2e → I2I2 + 2OH-→IO- + I- + H2OCH3COCH3 + 3IO- →CH3COO- + CHI3 + 2OH-总反应式:3I- + CH3COCH3 + 3 H2O = CH3COO- + CHI3 + 2OH- + H2副反应: 3IO- = IO3-+2I-碘仿为创面良好的消毒剂和除臭剂,作用缓和而持久。
可吸收创面渗出物,保持创面干燥,促使肉芽组织生长,加速创面愈合,适用于化脓性感染。
可用于根管感染、拔牙后感染、手术后感染、上颌窦感染、砷性牙周坏死和砷性根尖周炎的治疗。
什么是碘仿反应??卤仿反应是有机化合物与次卤酸盐的作用产生卤仿的反应叫卤仿反应,分两步进行(1)醛(酮)的α-甲基的完全卤代作用(碱催化):反应式如下CH3-CH(R)O+3NaOX--->CX3-C(R)HO+3NaOH三卤代醛(酮)的碳链碱性裂解作用,反应式如下CX3-C(R)HO+NaOH---->CHX3+(r)HCOONa.凡具有CH3CO-连于H或C上的结构的化合物或能被次卤酸盐氧化为这种结构的化合物都能起卤仿反应。
碘仿为难溶于水的黄色固体,具有特殊臭味,容易嗅出,作为鉴定比氯仿和溴仿好并且反应非常灵敏,所以在有机分析上用碘仿反应测定新化合物的结构和鉴定未知物的重要手法。
碘能把醇氧化成乙醛而发生碘仿反映影响碘仿反应发生的2个关键性因素为:一是羰基α- H的反应活性;二是空间位阻的影响.有机化学中关于碘仿反应的叙述为:把含有CH3CO -结构的醛,酮在碱性溶液中与卤素作用生成三卤甲烷的反应,称卤仿反应;当卤素是碘时,产生的碘仿在水中溶解度小而沉淀出黄色结晶,称为碘仿反应因此常利用碘仿反应来鉴定具有CH3CO -结构的醛,酮.醛酮与卤素在酸或碱催化下反应,阿尔发位H可被卤素取代,一般反应难以停留在一卤代阶段,易生成多卤代产物。
电化学合成碘仿装置的改进及反应条件的探索

Th mp o e n ft e d vc n s n h szn e i r v me to e ie o y t e ii g h id fr b lcr c e sr t o n h o oo m y ee to h mity meh d a d t e e p oi g o e cin c n i o s x lrn fra to o d t n i
新装置能够满足半微量有 机化学实验的要求 ,碘仿 的产率可达到 5.% 。该装置具 有实用性和推广价值 。 49
关键词 :装置 ;碘仿 ;电化学 ;合 成 中图分类号 :O 2 61 文献标识码 : A 文章编 号 : 0 24 5 (0 7 0 — 0 9 0 10 - 6 2 0 )3 04 — 3 9
目前 ,电化 学 方法 在有 机合 成上 的应 用 已引起 人 们 的广泛 注 意 ,日益 为化 学 、化工 界所 重视 。
合成洁净技术 的重要组成部分 。电化学合成法与常 规合成法相 比有以下特点 : ( )可 自 1 动控制 电化学过程 中的两大参数电
碘仿 (oo r i f m)是一种重要 的消毒剂 ,它 的 do 合成在 以往 的教材中一般作为性质实验 ,由乙醇与 碘的水溶液在碱 性条件下加 热反应制得 。由于 此实验中有大量碘蒸气生成 ,具有刺激性气味,强
L ig jn U h — i ,LU Hu — i WA G H i Z U X a— i,S N P n IYn —u ,S N S u qn I a y, N u , HO i xa U e g o
(0e ei y n h il nnen, in g o aUirt L oi aa 1 09 Ci ) c1g oC ms d e c g e i L on Nr l n ei , in g ln 2, h a 1 ef h t a C m aE i rg a i m v s r y a n D i 6 1 n
碘仿反应的反应机理(3篇)

第1篇一、反应概述碘仿反应是指卤代烷与碘反应生成碘代烷和碘仿的过程。
反应式如下:R-X + I2 → R-I + CHI3其中,R代表烷基或芳基,X代表卤素(Cl、Br、I)。
碘仿反应可分为两个阶段:自由基链式反应和离子型反应。
二、自由基链式反应机理1. 引发阶段在引发剂(如过氧化物、光照、热等)的作用下,碘分子(I2)发生均裂,生成两个碘自由基(·I)。
I2 → 2·I2. 传递阶段碘自由基(·I)攻击卤代烷分子中的卤素原子(X),使其发生均裂,生成烷基自由基(·R)和卤素自由基(·X)。
R-X + ·I → ·R + ·X3. 终止阶段烷基自由基(·R)和卤素自由基(·X)在终止剂(如H2、O2、N2等)的作用下发生反应,生成碘代烷和碘仿。
·R + ·X → R-X + CHI3整个自由基链式反应机理可表示如下:I2 → 2·IR-X + ·I → ·R + ·X·R + ·X → R-X + CHI3三、离子型反应机理1. 碘化反应在碱性条件下,卤代烷与碘化钠(NaI)反应生成碘代烷和碘仿。
R-X + NaI → R-I + NaX + CHI3反应机理如下:R-X + NaI → R-·I + NaXR-·I + NaX → R-I + Na·INa·I + NaI → 2NaI2. 碘化-去卤化反应在酸性条件下,卤代烷与碘化氢(HI)反应生成碘代烷和碘仿。
R-X + HI → R-I + HX + CHI3反应机理如下:R-X + HI → R-·I + HXR-·I + HX → R-I + H·IH·I + HI → 2HI四、影响碘仿反应的因素1. 反应温度碘仿反应通常在室温或稍微加热的条件下进行。
《物理化学综合实验》碘仿的间接有机电合成实验

《物理化学综合实验》碘仿的间接有机电合成实验一、实验目的1、通过碘仿的间接电合成试验对电化学与有机化学的交叉学科——有机电化学有所了解。
2、掌握有机电合成的基本操作。
3、熟悉电合成电流转化率的计算方法。
二、实验原理有机电合成分为两类,一是有机物在电极上得失电子直接生成目的产物;另一类是电极上的电解产物与有机物发生化学反应生成目的产物。
,前者称为直接电合成,本实验是利用阳极上生成的I2,间接电氧化丙酮,恒电流合成碘仿。
某些含氧基有机物(如羰基,羟基)可以在卤离子存在的情况下,由阳极间接电合成CHX3,这种电合成反应成为哈洛霍路姆反应。
例如:RCOCH3 + 6X- + H2O −→−-e6RCOOH + CHX3 + 3HXCH3CH2OH + 10X- + H2O −−-e10 CHX3 + CO2 + 7HX−→三、仪器、药品仪器:250毫升直口三口瓶,1号电池的石墨电极,U形管,稳压电源,毫安表(0~1500),梨形分液漏斗,滑线变阻器,水浴锅。
烧杯,试管。
药品:0.4mol/L 碘化钾,无水氯化钙,0.2 mol/L 硫酸,无水乙醇,0.2%硝酸银,1:1氨水,5%硝酸。
四、操作步骤1.电合成在一干净的烧杯中加入150毫升0.4 mol/L KI溶液,于通风厨中用1:1氨水调节pH值,使pH=12,再加入35毫升丙酮,搅拌均匀。
按图1装好试验设备,阳极和阴极材料均为石墨,使用前用0.2 mol/L H2SO4清洗,将以上准备好的电解液倒入直口三颈瓶中,调节电极高度,使其浸入溶液约为2cm,密封直口三颈瓶,外接液封.短路AB两端,使滑线电阻滑动头位于中间位置,打开稳压电源,使I=100mA,即表观电流密度大约为2.5 A/dm2。
反应过程中要保持电流强度为100mA,若电流发生漂移,应随时调节。
通电后,注意观察阳极上和阴极上的反应现象及颜色变化.每隔10分钟轻轻摇晃一次直口三颈瓶(此时应断开电源),静止后注意瓶底的电合成产物的颜色及形态,通电1.5 h。
实验九 电化学合成碘仿知识交流

实验九电化学合成碘仿实验九、电化学合成碘仿实验目的1.了解电化学方法在有机合成中的应用。
2.初步掌握电化学合成碘仿的基本原理和基本操作。
实验原理卤仿反应是有机化合物与次卤酸盐作用产生卤仿的反应叫卤仿反应,分两步进行(1)醛酮的α-甲基的完全卤代作用(碱催化):反应式如下CH3-CH(R)O+3NaOX→CX3-C(R)HO+3NaOH(2)三卤代醛(酮)的碳链碱性裂解作用,反应式如下CX3-C(R)HO+NaOH→CHX3+(R)HCOONa.能起卤仿反应的化合物:1 具有CH3CO-连于H或C上的结构的化合物2 具有CH3CHOH-R 结构的化合物(能被次卤酸盐氧化为CH3CO-)3 烯醇(发生分子重排)4 其他能被次卤酸盐氧化为这种结构的化合物碘仿反应某些化合物(如α-羟基乙酸)与次碘酸钠反应生成易于辨认的碘仿的反应。
碘仿为黄色六角形结晶,熔点120 ℃,在沸点升华;遇高温分解而析出碘;不溶于水,能溶于醇、醚、醋酸、氯仿等有机溶剂;有特殊气味,容易嗅出,作为鉴定比氯仿和溴仿好,并且反应非常灵敏,所以在有机分析上用碘仿反应测定新化合物的结构和鉴定未知物的重要手法。
可用以鉴定具有乙酰基(CH3CO)或其他可被氧化成该基团的化合物,如乙醛、丙酮、乙醇、异丙醇、乳酸、醌类或间二羟酚类等。
外科用作消毒剂。
电化学合成碘仿在电化学反应中,物质的分子或离子与电极间发生电子的转移,在电极表面生成新的分子或活性中间体,再进一步反应生成产物。
在碘化钾-丙酮水溶液中进行电解,在阳极碘离子失去电子被氧化生成碘,碘在碱性溶液中变成次碘酸根离子,再与丙酮(或者乙醇)作用生成碘仿,反应如下:2H2O +2e →2OH-+H22I--2e→I2I2 +2OH-→IO- +I- +H2OCH3COCH3 +3IO- →CH3COO- +CHI3 +2OH-能起卤仿反应的化合物:具有CH3CO-连于H或C上的结构的化合物;具有CH3CHOH-R 结构的化合物(能被次卤酸盐氧化为CH3CO-);烯醇(发生分子重排);其他能被次卤酸盐氧化为这种结构的化合物。
有机化学实验实验十五 碘仿的制备

三、物理常数
比重 名 称 分子量 颜色形态 20 结构式或分子式 (d 4 ) 熔点 (℃) 沸点 (℃) 折光率 20 (n D ) 1.3611 1.3588 溶 解 度 水 乙醇 乙醚 ∞ ∞ ∞ ∞ ∞ ∞
CH3CH2OH CH3COCH3
46.07 无色液体 0.7893 -117.3 78.5 58.08 无色液体 0.7899 -95.35 56.2
2 H + 2e
+
H2
阳极:
_ _ 2I 2e _ I2 + 2OH
_ _ + IO I + H2O
I2
CH3COCH3 + 3 IO
_
CHI3
_ _ + CH3COO + 2 OH
副反应:
_ 3 IO IO3
_
+ 2I
_
由于电解液是水溶液,水可作为阴极的质子源,本反应 中间体或产物都不会被阴极还原,所以两极之间不需要隔 膜,这样电解槽就简单多了。
CHI3 KI
393.73 黄色晶体 4.008
123 681
218 1330
不溶 溶热 溶 溶
166.01 白色粒状
四、实验装置
0-12V
电磁搅拌器
五、注意事项
1、两极间不能短路;
2、安培表不能反接,通电时不能移动,以防损坏。
六、成功关键
1.为了减少电流通过介质的损失,两电极应尽可能的靠近。
2.电极表面积越大,反应速度越快,要保证电极浸入反应液
的面积。 3.纯净的碘仿为黄色晶体,但用石墨作电极时,析出的晶体 呈灰绿色,是因为混有石墨,需要精制。
七、课后习题
玻碳电极上碘仿电解合成的机理

较 不 同 电极 材 料 上 I 体 系 的 电 化 学 行 为 , 获 得 高 纯 一 为
度 的有 机 产 物 而 选 择 电极 材 料 提 供依 据 。
1 实验 部 分 1 1 仪 器 与 试 剂 .
CI 6 H 一60型 电 化 学 工 作 站 ( 国 C I 司 ) 金 电 美 H公 , 极 或 玻 碳 电极 为 工 作 电 极 , 丝 电 极 为 辅 助 电 极 , 铂 A 舷 c 电极 为 参 比 电极 。 l 碘 化 钾 , 水 碳 酸 钠 , 酮 。 以 上 试 剂 均 为 分 析 无 丙 纯 , 液均采用二次蒸馏水配制。 溶 12 实 验 方 法 .
摘 要 : 文 采 用 循 环 伏 安 法 研 究 了 在 N O 溶 液 介 质 中 K 在 金 电极 和玻 碳 电极 上 的 电 化 本 aC 3 I 学 行 为 。 在 02 .V~12 .V电 位 范 围 内玻 碳 电 极 上 仅 发 生 I 被 氧 化 为 I 的 反 应 , 在 金 电 极 一 而 上 除 了 I 被 氧 化 为 I外 , 发 生 生 成 ]f 的氧 化 反 应 。 同时 通 过 不 同 电 位 扫 描 速 度 下 的 一 2 还 o 循 环 伏 安 行 为 分 析 发 现 电极 过程 为 传 质 控 制 步 骤 。
电极 , 验 了改 变 电 位 扫 描 速 度 对 第 一 对 氧 化 还 原 峰 试
的影 响 。结 果 表 明 , 述 体 系 对 应 的 第 一 对 氧 化 还 原 上 峰 的 峰 电位 变 化 不 大 , 其 峰 电 流 随 扫 描 速 度 的 增 加 但 而增大 , 而且 峰 电流 与 扫 描 速 度 平 方 根 即 i ~v 成 良 。 好 的 线 性 关 系 , 明 在 玻 碳 电极 上 碘 的 电 化 学 形 成 过 表
电解法制碘仿思考题

电解法制碘仿思考题
利用电解法制取碘(Electrolytic Preparation of Iodine)是一
种常见的化学实验,用来制造碘的化学反应。
它的基本原理是,通过电流对碳酸钠溶液中的氯离子进行电解,产生氯原子,然后氯原子与碳酸钠溶液中的碳酸根结合,形成碘和碳酸根。
电解法制取碘的具体实验步骤为:
1.首先,将一定的碳酸钠溶液倒入实验室中,放置在一个
实验玻璃板上;
2.然后,在实验板中放入一个碳钾电极,把另一个碳钠电
极放在另外一个实验玻璃板中,将两个电极连接到电源上;
3.最后,通过开关控制电源的输出,使实验玻璃板上的碳
钾电极产生电流,从而对碳酸钠溶液中的氯离子进行电解,产生氯原子,并与碳酸根结合,从而形成碘和碳酸根。
电解法制取碘的实验结果是,当实验完成后,实验板上的碳酸钠溶液发生变化,碘沉淀在实验板上,而碳酸根则溶于溶液中。
通过电解法制取碘的实验,可以让学生了解到电解的基本原理,以及电解制取碘的具体过程。
此外,它还能帮助学生研究并掌握电解的实验技术,以及如何操作实验仪器和设备,从而更好地理解化学反应原理。
电解法制取碘是一种有效的方法,能够帮助学生更好地理解化学原理,从而掌握和应用化学知识。
它是一种简单易行的实验,实验结果可靠,适合大多数化学实验室使用。
电解法和传统法制碘仿实验报告

综合化学实验报告实验名称:电解法和传统化学法合成碘仿实验专业姓名学号实验日期年月日——年月日一、实验目的1.熟悉电化学方法在有机合成中的应用2.掌握电化学合成碘仿的基本原理3.掌握电流效率等概念以及电化学合成的基本操作及影响因素4.熟悉化学法合成碘仿的原理和操作,并与电解法进行比较,对比讨论两者的优缺点二﹑实验原理1.电解法:主反应:副反应:其中副反应每生成1mol IO3-会消耗6mol电子。
因此,在制备碘仿实验中,实际通过的电量要大于理论计算的数值。
反应式所需的电量与实际通过的电量之比称为电流效率。
2.化学法:NaI+NaClO→NaIO+NaClCH3COCH3+3NaIO→CH3COCI3+3NaOHCH3COCI3+NaOH→CHI3+CH3COONa三﹑实验仪器与药品1.仪器:电磁搅拌器、直流电源、电解池、自制电极(1对Ni电极和1对Cu电极)、水浴锅、布式漏斗、pH试纸、数字熔点仪2.药品:碘化钠(A.R.)、次氯酸钠(A.R.)、丙酮(A.R.)、乙醇(95%)四﹑实验步骤1.化学法制备碘仿如图搭好装置,在搅拌条件下向三颈烧瓶中依此加入50mL水,7.7gNaI和1mL丙酮。
在滴液漏斗中加入50mL5%的NaClO溶液。
通过滴液漏斗逐滴向三颈烧瓶中滴加NaClO溶液,控制温度在25℃以下。
滴加完之后,继续搅拌30分钟,停止反应。
抽滤。
于35~40 ℃烘箱中进行干燥,得粗产品。
用大约40mL95%乙醇加热溶解所得粗产品。
溶解采用右图所用装置。
溶解完全后趁热抽滤,所得母液在冰水浴中结晶,待结晶完全后抽滤,干燥,称量,并用数字熔点仪测重结晶后的产品熔点。
2.电解法制备碘仿在一定温度下,向电解池中加入100mL水。
搅拌下加入7.7g碘化钠,待固体溶解后,再加入1mL丙酮,混合均匀后测pH并记录。
安装好电极,在某一电流下开始电解,记下起始时间。
1min后再测pH值并记录,实验中分别记录1,3,5,···,10min 反应(5min后每隔5min记录一次)时体系pH值和电流。
碘仿的制备

。
物理性质:碘仿又称为黄碘
1.是有特殊刺激气味的黄色粉末或晶体。 1.是有特殊刺激气味的黄色粉末或晶体。 是有特殊刺激气味的黄色粉末或晶体 2.熔点123℃。沸点218℃ 高温分解形成碘。 熔点123℃ 218℃。 2.熔点123℃。沸点218℃。高温分解形成碘。 3.相对密度4.008。 相对密度4.008 3.相对密度4.008。 4.难溶于水 可溶于氯仿、二硫化碳、热乙醇、乙醚等, 难溶于水, 4.难溶于水,可溶于氯仿、二硫化碳、热乙醇、乙醚等,并能 与苯和丙酮混溶。 与苯和丙酮混溶。
1.将旧的1号电池的石墨棒拆出来做电极,其直径为6mm, 1.将旧的1号电池的石墨棒拆出来做电极,其直径为6mm, 将旧的 6mm 浸入溶液的长度约40mm 40mm。 浸入溶液的长度约40mm。用一块带四个孔的有机玻璃盖在 烧杯上,将石墨插入孔中(不要碰到杯底, 烧杯上,将石墨插入孔中(不要碰到杯底,以便用电磁搅 也可以简单地将石墨棒用透明胶带固定在烧杯壁上, 拌)。也可以简单地将石墨棒用透明胶带固定在烧杯壁上, 这样便于人工搅拌。 这样便于人工搅拌。 2.用石墨电极时,得到的粗制碘仿颜色发灰绿, 2.用石墨电极时,得到的粗制碘仿颜色发灰绿,如果改 用石墨电极时 用铂或镀二氧化铅的石墨为阳极,得到的碘仍为亮黄色。 用铂或镀二氧化铅的石墨为阳极,得到的碘仍为亮黄色。 3.用一个电流不小于1A的可以调整电压的0 12V整流电 3.用一个电流不小于1A的可以调整电压的0~12V整流电 用一个电流不小于1A的可以调整电压的 源。 4.通过的电量为 通过的电量为1 30×60C=1800C, 4.通过的电量为1×30×60C=1800C,这在理论上能生 1800/(6×96500)mol=0.0031mol碘仿 碘仿。 成1800/(6×96500)mol=0.0031mol碘仿。 5.此溶液中还剩下大部分碘化钾和丙酮, 5.此溶液中还剩下大部分碘化钾和丙酮,可用来再做此 此溶液中还剩下大部分碘化钾和丙酮 实验。 实验。
BB合实验-电解法和化学法合成碘仿实验-revised
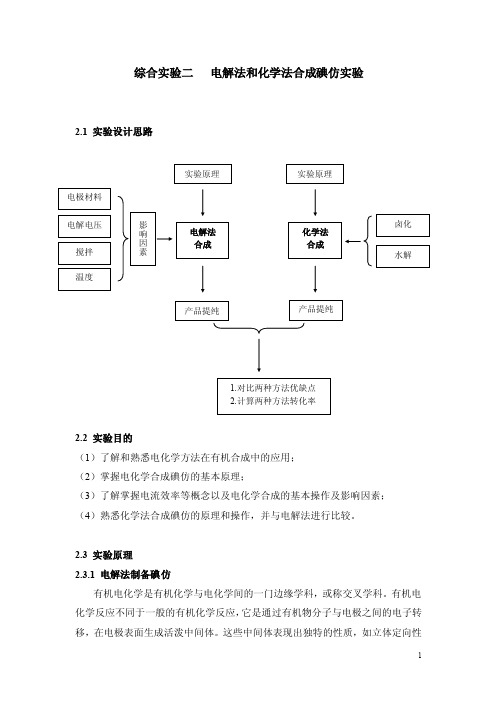
综合实验二 电解法和化学法合成碘仿实验2.1 实验设计思路2.2 实验目的(1)了解和熟悉电化学方法在有机合成中的应用;(2)掌握电化学合成碘仿的基本原理;(3)了解掌握电流效率等概念以及电化学合成的基本操作及影响因素;(4)熟悉化学法合成碘仿的原理和操作,并与电解法进行比较。
2.3 实验原理2.3.1 电解法制备碘仿有机电化学是有机化学与电化学间的一门边缘学科,或称交叉学科。
有机电化学反应不同于一般的有机化学反应,它是通过有机物分子与电极之间的电子转移,在电极表面生成活泼中间体。
这些中间体表现出独特的性质,如立体定向性和分布特殊性。
因此与一般的有机反应相比,通常具有更高产率或得到一般方法无法获得的结构。
化学反应的本质是反应物外层电子的运动,从这一意义上说,所有的反应都有可能通过电化学方法来进行。
人们在长期的实践中已经在电解池内完成了加成、取代、裂解、消除、环合、偶合以及氧化和还原等各种反应,极性反应和自由基反应的概念在电化学中也是适用的。
但某些有机反应不能用电化学方法完成,因为它们要求的电极电势超越了介质电化学势的范围,所以无法在实验上实现。
电解法制碘仿是在碘化钠水溶液中,碘离子在阳极被氧化而成碘,生成的碘在碱性介质中变成次碘酸根离子,再与溶液中的丙酮或乙醇作用成碘仿,即: 222I e I →--O H I IO OH I 222++→+------++→+OH COO CH CHI IO COCH CH 233333 or----++++→+OH HCO I O H CHI IO OH CH CH 22532323副反应:---+→I IO IO 233在副反应中,每生成1mol -3IO 会消耗6mol 电子。
因此,在制备碘仿的实验中,实际通过的电量要大于前面计算的数值。
这里要提出电流效率的概念,即反应式需要的电量与实际通过的电量的比值称为电流效率。
2.3.2 化学法合成碘仿化学法合成碘仿是采用丙酮经卤化、水解的方法制得。
电化学合成碘仿实验报告

电化学合成碘仿实验报告1.引言1.1 概述概述电化学合成是指利用电化学原理和技术进行化学合成的过程,通过控制电流和电压对化学反应进行调控,实现特定产物的合成。
在电化学合成过程中,碘仿是一种常用的试剂,它具有较高的电还原性和电化学活性,可在电极表面发生电化学反应,从而完成对目标产物的合成。
本文将围绕电化学合成碘仿的实验展开,首先介绍实验所需的材料和实验步骤。
然后,对实验结果进行总结,分析实验数据并得出结论。
最后,探讨实验的意义和展望,展示电化学合成碘仿在化学合成领域中的应用前景。
通过本文的阅读,读者将了解到电化学合成碘仿的原理和操作方法,掌握实验的步骤和注意事项。
同时,还能够了解到电化学合成碘仿的优势和局限性,以及未来可能的改进方向和研究方向。
本文旨在为相关领域的研究者和实验人员提供参考和指导,促进电化学合成碘仿的应用和发展。
文章结构部分的内容可以按照以下方式进行编写:1.2 文章结构本实验报告将按照以下结构进行展开:引言部分将概述电化学合成碘仿的背景和意义,并明确本实验的目的。
正文部分将包括实验所用的材料及其性质介绍,以及实验的详细步骤和操作方法。
结论部分将对实验结果进行总结,分析实验数据得出的结论,并探讨实验的意义和展望。
通过清晰明了的文章结构,读者将能够系统地了解电化学合成碘仿的实验过程和结果,并深入理解该实验的意义和未来发展的方向。
1.3 目的本实验的主要目的是通过电化学合成的方法制备出碘仿。
具体目的包括:1. 掌握电化学合成碘仿的基本原理和方法。
电化学合成是利用电流引发氧化还原反应的方法,通过在电解槽中施加电流,使得电解液中的物质发生氧化还原反应,从而得到所需的产物。
本实验通过电化学合成方法制备碘仿,旨在让实验者了解并熟悉电化学合成的基本原理和操作方法。
2. 熟悉电化学合成碘仿的实验步骤。
实验步骤是实验中必不可少的部分,掌握正确的实验步骤能够保证实验的可靠性和准确性。
本实验的目的之一就是让实验者熟悉电化学合成碘仿的实验步骤,包括准备实验材料、搭建电解槽、控制电流强度和时间等。
碘仿合成实验报告总结(3篇)

第1篇一、实验目的和要求本次实验旨在通过碘仿的合成反应,了解和掌握卤仿反应的基本原理和操作步骤,加深对有机化学反应过程的理解。
实验要求学生能够熟练操作实验仪器,准确控制实验条件,并观察、记录实验现象,从而得出实验结果。
二、实验仪器设备1. 烧杯:250ml2. 玻璃棒:1根3. 酒精灯:1个4. 冷水浴:1套5. 分液漏斗:1个6. 烧瓶:100ml7. 滴定管:10ml8. 容量瓶:50ml9. 酚酞指示剂:适量10. 氢氧化钠溶液:0.1mol/L三、实验设计及调试(一)实验内容1. 在250ml烧杯中加入适量的碘和氢氧化钠溶液,搅拌溶解;2. 将乙醛溶液缓慢滴加至烧杯中,观察溶液颜色的变化;3. 当溶液颜色变为黄色时,继续搅拌反应;4. 将反应液倒入分液漏斗中,静置分层;5. 收集有机层,用无水硫酸钠干燥;6. 将干燥后的有机层倒入烧瓶中,加入适量的氢氧化钠溶液,加热回流;7. 待反应完成后,冷却反应液,加入酚酞指示剂,用0.1mol/L的氢氧化钠溶液滴定至溶液颜色由无色变为微红色;8. 计算碘仿的产率。
(二)实验电路本实验为常规有机合成实验,无需特殊电路。
(三)实验设计及调试步骤1. 分析实验内容和实验电路,确定实验设计思路;2. 列出实验所需的特殊标志位、堆栈sp、内部ram、工作寄存器等资源的分配列表;3. 画出程序设计流程图,包括主程序和各子程序流程图;4. 根据步骤2、3的内容,写出实验程序;5. 调试程序,观察实验现象,记录实验数据。
四、实验调试过程中所遇到的问题、解决问题的思路和方法1. 在实验过程中,发现反应液颜色变化不明显,可能原因是碘和氢氧化钠溶液未充分混合;解决方法:加大搅拌速度,确保反应液充分混合。
2. 在分液过程中,有机层和水层分离不明显,可能原因是乙醛溶液加入过快;解决方法:减慢乙醛溶液的加入速度,使有机层和水层充分分离。
3. 在滴定过程中,发现溶液颜色变化不明显,可能原因是氢氧化钠溶液浓度过高;解决方法:降低氢氧化钠溶液的浓度,使滴定反应更加明显。
碘仿的制备实验报告

碘仿的制备实验报告篇一:电解法和传统法制碘仿实验报告综合化学实验报告实验名称:电解法和传统化学法合成碘仿实验专业姓名学号实验日期年月日——年月日一、实验目的1.熟悉电化学方法在有机合成中的应用2.掌握电化学合成碘仿的基本原理3.掌握电流效率等概念以及电化学合成的基本操作及影响因素4.熟悉化学法合成碘仿的原理和操作,并与电解法进行比较,对比讨论两者的优缺点二﹑实验原理1.电解法:主反应:副反应:其中副反应每生成1mol IO3-会消耗6mol电子。
因此,在制备碘仿实验中,实际通过的电量要大于理论计算的数值。
反应式所需的电量与实际通过的电量之比称为电流效率。
2.化学法:NaI+NaClO→NaIO+NaClCH3COCH3+3NaIO→CH3COCI3+3NaOH CH3COCI3+NaOH→CHI3+CH3COONa三﹑实验仪器与药品1.仪器:电磁搅拌器、直流电源、电解池、自制电极(1对Ni电极和1对Cu电极)、水浴锅、布式漏斗、pH试纸、数字熔点仪2.药品:碘化钠(A.R.)、次氯酸钠(A.R.)、丙酮(A.R.)、乙醇(95%)四﹑实验步骤1.化学法制备碘仿如图搭好装置,在搅拌条件下向三颈烧瓶中依此加入50mL水,7.7gNaI和1mL丙酮。
在滴液漏斗中加入50mL5%的NaClO溶液。
通过滴液漏斗逐滴向三颈烧瓶中滴加NaClO溶液,控制温度在25℃以下。
滴加完之后,继续搅拌30分钟,停止反应。
抽滤。
于35~40℃烘箱中进行干燥,得粗产品。
用大约40mL95%乙醇加热溶解所得粗产品。
溶解采用右图所用装置。
溶解完全后趁热抽滤,所得母液在冰水浴中结晶,待结晶完全后抽滤,干燥,称量,并用数字熔点仪测重结晶后的产品熔点。
2.电解法制备碘仿在一定温度下,向电解池中加入100mL水。
搅拌下加入7.7g 碘化钠,待固体溶解后,再加入1mL丙酮,混合均匀后测pH并记录。
安装好电极,在某一电流下开始电解,记下起始时间。
电化学合成碘仿思考题

电化学合成碘仿思考题
电化学合成碘仿思考题
一、假设你需要在某实验过程中合成1g的碘,请描述一下,应当怎么做?
假设你需要在某实验过程中合成1g的碘,你可以先将1克的KIO3溶液以100ml的容量加入在实验器皿中,然后加入稀硫酸溶液到KIO3溶液中,使其pH值下降到6以下,接着用电极将KIO3溶液电解,电解时间根据实验需要进行调节,然后将电解出来的碘以滴定的方式进行测试,测量完毕后再加入滴定剂,当颜色呈现橙黄色时即表明恰好配制了1g的碘溶液。
二、请给出电化学反应合成碘存在的不足?
1. 合成碘的步骤较为复杂,操作步骤较多,操作过程需要花费较长的时间,精确度也不够高;
2. 合成碘的工艺工序要求较高,由于参与合成的反应物活性强,易受环境影响,合成的碘活性性和稳定性较低;
3. 合成碘的成本比现有的另一种以碘矿石为原料生产碘更高,生产周期也比较长,基本上不太适合大规模生产。
- 1 -。
碘仿的制备实验报告

碘仿的制备实验报告
1. 实验目的
本实验的目的是学习和掌握化学品的制备方法,通过制备碘仿,加深对化学反应原理
的理解,以及了解碘仿的性质和用途。
2. 实验原理
碘仿的制备原理是将碘和氢氧化钠反应生成碘化钠和水,然后将碘化钠与甲醇反应生
成碘仿和甲醇钠。
具体反应式如下:
I2 + 2NaOH → NaI + H2O
NaI + CH3OH → CH3I + NaOH
3. 实验步骤
3.1 材料准备
所需化学品:碘、氢氧化钠、甲醇
所需器材:烧杯、筛子、移液管、酒精灯、试管
3.2.1 制备碘化钠溶液
将10 g氢氧化钠溶于50 mL去离子水中,加入适量碘化钠,搅拌混合,过滤去掉杂质,得到碘化钠溶液。
将20 mL甲醇倒入试管中,加入少量碘化钠溶液和碘,用酒精灯进行加热,并使用移
液管不断旋转,直到溶液变色,停止加热。
将制得的碘仿放入烧杯中,用筛子过滤去掉杂质,得到纯化后的碘仿。
4. 实验结果与分析
制得的碘仿为棕黄色液体,具有独特的气味。
经过纯化后,溶液中不再有杂质。
碘仿易挥发,易燃,应避免接触火源和静电,同时应按照规定储存。
5. 实验总结。
有机电合成制备碘仿

实验二十九碘仿的制备(有机电化学反应)一、实验目的1、通过碘仿的制备,了解有机电解合成的基本原理,认识电化学方法在有机合成的应用。
2、初步掌握电化学合成的基本方法二、实验原理用碘化钾与丙酮水溶液进行电解来合成碘仿的原理是电解液中的碘负离子在阳极失去电子被氧化为碘,而在阴极氢质子获得电子被还原成H2,于是碘在碱性介质中生成次碘酸根负离子,后者与丙酮反应生成碘仿(棕黄色)阴极:2H+ + 2e−H2阳极:2I− - 2e−I2I2 + 2OH−IO− + I− + H2OCH3OCH3 + 3IO−CH3COO− + CHI3 + 2OH−副反应:3IO−IO3 + 2I−由以上反应式可以看出,每生成1mol CHI3需要6mol I−,也就是说需要6mol电子参与反应,而摩尔电子电荷量96500 C/mol,因此在电解池中需要通过6 mol(电子) 96500 C/mol的电荷量才能产生1mol CHI3。
但由于副反应,按反应式计算需要的电荷量总是小于实际消耗的电荷量,两者的比值为电流效率。
三、需要药品碘化钾:6g(0.036mol)丙酮0.8g或1mL(0.014mol)乙醇四、实验步骤将1个150mL烧杯作为电解槽,其上盖一块钻有距离为3mm的2个孔(d=8mm)的有机玻璃板,2支石墨棒[1]作为电极分别插入2个孔中(不能碰烧杯底部,以便于电磁搅拌),1支为阳极,另一支为阴极[2],并接到一个可以调压(0-12 V)的2A直流稳压电源上[3],在烧杯中加120mL蒸馏水[4]和6g碘化钾,固体溶解后加1mL丙酮。
将烧杯放在恒温搅拌器上搅拌。
接通电源,将电流调整1A[5],并尽量保持电流恒定。
这时,烧杯中立即有棕黄色中立即有棕黄色物质出现,并不断地析出固体碘仿。
电解液温度维持在2030℃,电解液pH 逐渐增大至810。
电解1h后,切断电流,停止搅拌。
将电解液用布氏漏斗抽滤,滤液倒入另一烧杯中保存备用[6]。
碘仿电解合成的机理研究

碘仿电解合成的机理研究
近年来,由于全球范围内能源、资源和环境的矛盾日益突出,碘仿电解合成技术应运而生,其拥有减少能源消耗、降低原料成本、提高竞争力、改善工业环境等特点,受到了越来越多行业的青睐。
碘仿电解合成机理,是指在电解催化过程中,CO2通过与乙二醇反应生成碳水酯,再经由水解和降解的共同作用,将碳水酯转化为各种构筑单元所组成的有机产物,从而获得合成氨和其他有机物。
碘仿电解合成反应操作温度低,受到长期温和条件加成,促使反应速率加快,能源消耗降低。
此外,其也利用了乙二醇、乙醇、有机醇等低碳廉价原料,可以进一步降低原料成本,大幅提升竞争力。
了解了碘仿电解合成机理,可以进一步引入节能减排、清洁化技术,使反应体系的环境影响降至最低。
此外,采用碘仿电解合成技术,不仅可以改善工业环境,还有助于实现低碳经济发展,从而更好地保护生态系统,持续可持续的发展经济。
可见,碘仿电解合成技术是当今行业发展及应对环境挑战中一种重要技术手段,有助于减少能源消耗、降低原料成本、改善工业环境等,对促进行业发展及应对环境挑战颇具积极意义。
因此,相关行业应加强对本技术的研究,把握技术发展趋势,拓宽应用领域,从而发挥更大作用,改善集体利益,和谐社会发展环境。
电化学法制备碘仿的研究

电化学法制备碘仿的研究
薛文华
【期刊名称】《广州化工》
【年(卷),期】2003(31)1
【摘要】研究碘仿的电化学制法.重点探讨电极材料、电流密度、电解液温度、pH 值等因素对碘仿合成的电流效率和产率的影响.碘仿电化学合成的最佳条件为:以石墨为阳极,铅作阴极,电流密度为7.0mA/cm2,pH=11,电解液配方是在15mL乙醇中加入8 g碘化钾,浴温30℃.电流效率达80.3%,产率72.3%.
【总页数】3页(P48-50)
【作者】薛文华
【作者单位】福建福清卫校,350300
【正文语种】中文
【中图分类】TQ22
【相关文献】
1.熔盐电化学法制备纳米硅材料研究进展 [J], 周忠仁
2.熔盐电化学法制备纳米硅材料研究进展 [J], 周忠仁
3.电化学法制备石墨烯的研究进展 [J], 高亚辉;尹国杰;张少文;王璐;孟巧静;李欣栋
4.电化学法制备高Alb含量铝系混凝剂的表征及混凝效能研究 [J], 戴常超;郭嘉钰;刘峻峰;黄琳琳;张杰;冯玉杰
5.电化学法制备BaMoO_4和SrMoO_4薄膜的生长特性比较研究(II):个性研究[J], 杨祖念;肖定全;余萍;安红娜;金晓玲;陈连平;王辉
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意事项
1.电极浸入电解液的高度约为40 ,析出的晶体呈灰绿色,是因为混有石墨,需要精制。
阳极:2I--2e→I2
I2+2OH-→IO-+I-+H2O
CH3COCH3+3IO-→CH3COO-+CHI3+2OH-
三、仪器与药品
仪器:烧杯,直流电源,石墨棒
药品:碘化钾(6g)、丙酮(1 ml)、蒸馏水
四、实验步骤
用一个150 ml烧杯作为电解槽,用2根直径为6 mm旧的1号电池的石墨棒做电极,把它们垂直地固定在硬纸板或有机玻璃上。向烧杯中加如100 ml蒸馏水、6gKI,溶解后加入1ml丙酮,将烧杯放置在电磁搅拌器上慢慢搅拌,接通电源(10V),这时在电解槽阳极会有晶体(碘仿)析出。电解30 min,切断电源,停止反应。
电化学合成碘仿
在电化学反应中,物质的分子或离子与电极间发生电子的转移,在电极表面生成新的分子或活性中间体,再进一步反应生成产物。在碘化钾-丙酮水溶液中进行电解,在阳极碘离子失去电子被氧化生成碘,碘在碱性溶液中变成次碘酸根离子,再与丙酮(或者乙醇)作用生成碘仿,反应如下:
阴极:2H2O +2e →2OH-+H2
实验九、电化学合成碘仿
一、实验目的
1.了解电化学方法在有机合成中的应用。
2.初步掌握电化学合成碘仿的基本原理和基本操作。
二、实验原理
卤仿反应
有机化合物与次卤酸盐作用产生卤仿的反应叫卤仿反应,分两步进行
(1)醛酮的α-甲基的完全卤代作用(碱催化):反应式如下
CH3-CH(R)O+3NaOX→CX3-C(R)HO+3NaOH
(2)三卤代醛(酮)的碳链碱性裂解作用,反应式如下
CX3-C(R)HO+NaOH→CHX3+(R)HCOONa.
能起卤仿反应的化合物:
1具有 结构的化合物
2具有 结构的化合物
当上述反应中的X为I时称为碘仿反应。碘仿为黄色六角形结晶,熔点120℃,遇高温分解而析出碘;不溶于水,能溶于醇、醚、醋酸、氯仿等有机溶剂;有特殊气味,容易嗅出,作为鉴定比氯仿和溴仿好,并且反应非常灵敏,所以在有机分析上碘仿反应是测定新化合物的结构和鉴定未知物的重要手法。可用以鉴定具有乙酰基(CH3CO)或其他可被氧化成该基团的化合物,如乙醛、丙酮、乙醇、异丙醇、乳酸、醌类或间二羟酚类等。外科用作消毒剂。
