乙酰谷酰胺内控质量标准
乙酰谷酰胺注射剂说明书修订要求

附件
乙酰谷酰胺注射剂说明书修订要求
(包括乙酰谷酰胺注射液、注射用乙酰谷酰胺、乙酰谷酰胺氯化钠注射液、乙酰谷酰胺葡萄糖注射液)
一、【不良反应】项应包含且不限于以下内容
上市后监测中发现本品报告有以下不良反应/不良事件(发生率未知):
全身性反应:寒战、畏寒、发热、乏力等;
皮肤及皮下组织:潮红、皮疹、瘙痒、红斑、多汗等;
消化系统:恶心、呕吐、腹部不适、腹痛、腹泻、腹胀、转氨酶升高等;
神经系统和精神类反应:头晕、头痛、头部不适、震颤、抽动、感觉减退、烦躁、焦虑、失眠等;
心血管系统:胸部不适、胸痛、心悸、发劣、血压升高、血压降低、低血压等;
呼吸系统:呼吸困难、呼吸急促、窒息感等;
免疫系统:过敏反应、过敏样反应、过敏性休克等;
其他:静脉炎、注射部位反应(疼痛、硬结、肿胀)等。
二、【禁忌】项应包含且不限于以下内容
对本品及所含成份过敏者禁用。
(注:如原批准说明书的安全性内容较本修订建议内容更全面或更严格的,应保留原批准内容。
说明书其他内容如与上述修订要求不一致的,应当一并进行修订。
)。
谷氨酰胺执行标准

谷氨酰胺执行标准
谷氨酰胺(Glutamine)是一种非必需氨基酸,它在人体中具
有重要的生物功能。
谷氨酰胺的执行标准可以参考以下几个方面:
1. 食品级谷氨酰胺:食品级谷氨酰胺通常应符合相关食品安全标准,如所在国家或地区的食品安全法规以及食品添加剂的规定。
具体的执行标准可以根据不同国家或地区的法规来确定。
2. 药品级谷氨酰胺:药品级谷氨酰胺通常需要符合药典标准,如美国药典(USP)、欧洲药典(EP)或中国药典(CP)等。
这些标准会对谷氨酰胺的纯度、溶解度、PH值、微生物限度
等进行规定。
此外,药品级谷氨酰胺还需要符合药品质量管理体系的要求,如GMP(Good Manufacturing Practice)等。
3. 饮料或保健品级谷氨酰胺:对于以谷氨酰胺为主要活性成分的饮料或保健品,需要根据相关的国家或地区的规定来确定执行标准。
这些规定可能包括产品的含量、添加剂的使用限制、成分的声明等方面的要求。
总之,谷氨酰胺的执行标准会根据谷氨酰胺所用的领域以及所在国家或地区的相关法规和标准来确定。
说明书质量标准1

上海朝晖药业有限公司
1、物料名称:说明书
物料代码:见附表
供应商:上海科虹彩印有限公司、上海浦东自立彩印厂、徐州太平洋印务有限公司
标准依据:企业内控
2、取样方法:SOP-04-852
3、检验方法:SOP-03-159
4、检验项目与限度:
材质纸质(具体见附表)
外观印刷文字清晰、准确无误;印刷区域应居中,位移偏
差见附表。
裁切刀口刀口光洁,无毛刺,边缘不得歪斜。
纸质符合要求,纸质厚度均一;纸张版面平整,不得
有褶皱。
清洁度表面应干净无异物。
尺寸偏差应不得过±3mm。
检查尺寸见附表。
5、包装:用坚固的橡皮带进行捆扎。
6、贮藏:清洁、通风、干燥、距地面的高度不得低于150mm。
7、用途:外包材。
检查项目、抽样依据及取样量
附表说明书物料代码及规格表
上海朝晖药业有限公司
8、修改历史:
上海朝晖药业有限公司。
乙酰谷酰胺注射液中有关物质的研究

乙酰谷酰胺注射液中有关物质的研究摘要目的:建立HPLC法测定乙酰谷酰胺注射液中的有关物质。
方法:HPLC检测采用Sepax HP-C18柱、以0.1%的高氯酸水溶液-甲醇(99∶1)为流动相、检测波长为210 nm、柱温25 ℃。
结果: 6个有关物质能较好地分离,专属性、线性、定量限、检测限、校正因子、系统精密度、溶液稳定性、重复性均符合2010年版中国药典要求,结论:该方法可将乙酰谷酰胺注射液中的乙酰谷酰胺与6个有关物质完全分离。
关键词乙酰谷酰胺注射液 HPLC 有关物质中图分类号:R977.9; R927.11 文献标识码:A 文章编号:1006-1533(2016)09-0071-05Study on the relevant substance in aceglutamide injection WANG Yan1*,QIAN Weigang1,LI Changwei1,XU Jinghua1,SUN Dongyan1,ZHOU Huana2,WANG Xuemin2**(1. Shanghai Zhaohui Pharmaceutical Co. LTD.,Shanghai 201908, China;2. Nanjing Zeheng Pharmaceutical Technology Development Co. LTD., Nanjing 210046, China)ABSTRACT Objective:To establish an HPLC method for determination of relevant substances in aceglutamide injection. Methods: HPLC was performed on a Sepax HP-C18 column with amobile phase of 0.1% perchloric acid and methanol(99:1) at detection wavelength of 210 nm and column temperature of 25 ℃. Results: Six relevant substances were well separated. The specificity, linearity, limit of quantitation and detection,correction factor, system precision, solution stability and repeatability were conformed to the requirements of 2010 version of Chinese Pharmacopoeia. Conclusion: Aceglutamide can be completely separated with 6 relevant substances in aceglutamide injection by this method.KEY WORDS aceglutamide injection; HPLC; relevant substance 乙酰谷酰胺为脑功能改善药,具有改善神经细胞代谢、维持神经应激机能及降低血氨的作用[1]。
乙酰谷酰胺说明书

乙酰谷酰胺说明书一、药品名称通用名称:乙酰谷酰胺英文名称:Aceglutamide汉语拼音:Yixian Gu'anxian二、成分本品主要成分是乙酰谷酰胺。
三、性状本品为白色结晶性粉末。
四、适应症用于脑外伤性昏迷、神经外科手术引起的昏迷、肝昏迷及偏瘫、高位截瘫、小儿麻痹后遗症、神经性头痛和腰痛等。
五、规格以具体药品规格为准。
六、用法用量1、肌内注射:一次 100 ~ 500mg,一日 1 ~ 2 次。
儿童剂量酌减。
2、静脉滴注:每次 100 ~ 600mg,用 5%或 10%葡萄糖溶液 250ml 稀释后缓慢滴注。
具体的用法用量应根据患者的病情、年龄、体重等因素,在医生的指导下进行调整。
七、不良反应1、可能会出现血压下降的情况。
2、极少数患者使用后可能会出现恶心、呕吐、头晕等不适症状。
如果出现不良反应,应及时告知医生,医生会根据具体情况采取相应的措施。
八、禁忌对本品过敏者禁用。
九、注意事项1、当药品的性状发生改变时,禁止使用。
2、用药过程中应密切观察患者的病情变化,如出现异常应及时处理。
3、肝肾功能不全者应在医生的指导下谨慎使用。
4、儿童、孕妇及哺乳期妇女使用本品应在医生的严格指导下进行。
十、药物相互作用1、本品与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
2、与抗胆碱药合用时,可能会减弱其作用。
十一、药理作用乙酰谷酰胺通过改善神经细胞代谢,维持神经应激能力及降低血氨的作用,从而改善脑功能。
十二、药代动力学本品在体内分布广泛,能透过血脑屏障。
在肝脏代谢,大部分以原形经肾脏排泄。
十三、贮藏遮光,密闭保存。
十四、包装以实际药品包装为准。
十五、有效期以药品包装上标注的有效期为准。
十六、执行标准以具体的执行标准为准。
十七、批准文号以实际的批准文号为准。
高效液相色谱法测定注射用乙酰谷酰胺的含量

高效液相色谱法测定注射用乙酰谷酰胺的含量
廖彩霞;田伟强;应小飞
【期刊名称】《中国药业》
【年(卷),期】2006(015)012
【摘要】目的建立注射用乙酰谷酰胺含量测定的高效液相色谱法.方法色谱柱为
C18柱(150 mm×4.6 mm,5 μm),以0.2%磷酸溶液(用三乙胺调节pH值为3.5)-甲醇(95:5)为流动相,检测波长为210 nm.结果乙酰谷酰胺进样量线性范围是
0.41~6.0μg,r=0.9998,平均回收率为98.74%,RSD为0.80%.结论该方法精密可靠,可作注射用乙酰谷酰胺的质量控制方法.
【总页数】1页(P22-22)
【作者】廖彩霞;田伟强;应小飞
【作者单位】浙江省丽水市中心医院,浙江,丽水,323000;浙江省丽水市中心医院,浙江,丽水,323000;浙江省丽水市中心医院,浙江,丽水,323000
【正文语种】中文
【中图分类】R927.2;R971+.7
【相关文献】
1.高效液相色谱法测定注射用亚胺培南/西司他丁钠含量及含量均匀度 [J],
2.用高效液相色谱-蒸发光散射检测法测定注射剂中乙酰谷酰胺的含量 [J], 王波;沈梅
3.高效液相色谱法测定注射用灰树花倍他葡聚糖的含量及含量均匀度 [J], 杨海;赵峡;于广利;徐泽平
4.HPLC法测定注射用乙酰谷酰胺的含量 [J], 纪标;王东凯;薛梅妍;徐飒;
5.RP-HPLC法测定注射用乙酰谷酰胺的含量 [J], 罗邻涛;张丽娜;钟慧琼;吴雪钗因版权原因,仅展示原文概要,查看原文内容请购买。
谷氨酰胺 质量标准

谷氨酰胺质量标准谷氨酰胺,又称氨基乙酰甲酸,是一种重要的氨基酸衍生物,具有多种生物学功能。
在医药、保健品、食品添加剂等领域都有广泛的应用。
由于其重要性,谷氨酰胺的质量标准显得尤为重要。
本文将对谷氨酰胺的质量标准进行详细介绍。
一、外观与性状。
谷氨酰胺为白色结晶性粉末,无臭,味微苦。
在常温下易溶于水,微溶于乙醇,不溶于乙醚。
这些性状是谷氨酰胺的主要特征,也是其质量标准的重要指标之一。
二、纯度。
谷氨酰胺的纯度是其质量标准中最为重要的指标之一。
通常来说,谷氨酰胺的纯度需在98%以上,高纯度的谷氨酰胺在医药和保健品领域有着更广泛的应用前景。
因此,对于谷氨酰胺的生产和质量控制,纯度的保证是至关重要的。
三、重金属残留。
重金属残留是衡量谷氨酰胺质量的重要指标之一。
过多的重金属残留会对人体健康造成危害,因此谷氨酰胺产品中重金属残留的含量需严格控制在国家标准规定的范围内。
四、水分含量。
水分含量是影响谷氨酰胺稳定性的重要因素之一。
过高或过低的水分含量都会影响谷氨酰胺的质量和稳定性,因此在生产过程中需要严格控制水分含量,以确保产品质量。
五、微生物指标。
谷氨酰胺作为一种生物活性物质,其微生物指标也是质量标准中不可忽视的部分。
微生物污染会对谷氨酰胺的质量造成严重影响,因此在生产过程中需要进行严格的微生物检测,确保产品符合相关标准要求。
六、其他指标。
除了以上几项主要指标外,谷氨酰胺的质量标准还包括了其他一些重要指标,如酸度、氨基酸含量、杂质含量等。
这些指标都对谷氨酰胺的质量和应用性能有着重要影响,需要在生产和检验过程中进行严格把控。
总结。
谷氨酰胺作为一种重要的生物活性物质,在医药、保健品、食品等领域有着广泛的应用前景。
而其质量标准的制定和执行,则是保障其安全有效应用的重要基础。
只有严格按照相关标准要求,确保产品质量稳定可靠,才能更好地发挥谷氨酰胺的应用效果,为人类健康和生活质量的提升做出贡献。
乙酰乙酰胺 标准

乙酰乙酰胺标准
乙酰乙酰胺标准通常是指关于乙酰乙酰胺(化学物质)的特定或合规性标准。
标准是为了在某个特定领域内设定一致的规则、参数或指导方针,确保各方的合规性。
对于乙酰乙酰胺而言,可能包括化学纯度、颜色、溶解度、水分、稳定性等方面的规定或标准。
示例:
1.乙酰乙酰胺的纯度标准应不低于99.5%。
2.乙酰乙酰胺的颜色标准应接近无色或微黄色。
3.乙酰乙酰胺的溶解度标准应符合相关规定,如在不同溶剂中的溶解度。
4.乙酰乙酰胺的水分标准应低于0.5%。
5.乙酰乙酰胺的稳定性标准应确保在正常存储条件下不易变质。
总结:乙酰乙酰胺标准是指关于乙酰乙酰胺的特定或合规性标准,包括纯度、颜色、溶解度、水分和稳定性等方面的规定或标准。
这些标准是为了确保乙酰乙酰胺的质量和合规性,为相关行业或应用提供可靠的参考依据。
《中国药典》2015年版乙酰谷酰胺注射液含量测定系统适用性的修订建议

《中国药典》2015年版乙酰谷酰胺注射液含量测定系统适用性的修订建议徐桂连;邵纯君;贺建华;鹿麟【期刊名称】《中国药品标准》【年(卷),期】2016(017)003【摘要】乙酰谷酰胺用于治疗脑外伤昏迷,神经外科手术引起的昏迷、肝昏迷及偏瘫、高位截瘫、小儿麻痹后遗症、神经性头痛和腰痛[1]。
乙酰谷酰胺注射液现收载于《中国药典》2015年版二部,其标准〔含量测定〕系统适用性要求乙酰谷酰胺峰与谷氨酰胺峰分离度应大于7.0[2],但在实际检验中发现,使用多品牌的常规十八烷基键合硅胶柱,且调整流动相比例及其pH,分离度均不能满足要求。
为此,经过试验研究,我们对该标准提出了修订建议,以供今后完善该标准作参考,使标准更加严谨及符合实际检验情况。
【总页数】3页(P169-170,207)【作者】徐桂连;邵纯君;贺建华;鹿麟【作者单位】大连市药品检验所,大连116021;大连市药品检验所,大连116021;大连市药品检验所,大连116021;大连市药品检验所,大连116021【正文语种】中文【中图分类】R921.2【相关文献】1.对《中国药典》2010年版第二增补本中乙酰胺注射液含量测定的修订建议 [J], 吕海鸿;刘乃强2.关于《中国药典》2005年版二部阿昔洛韦含量测定项下系统适用性试验溶液配制的商榷 [J], 杨兴明;黄慧芬3.对《中国药典》2005年版槐花总黄酮含量测定的修订建议 [J], 郭亚健4.中国药典2015年版醋酸地塞米松片红外鉴别修订建议 [J], 解瑞辉;杨坤;郭社民5.对《中国药典》2020年版硫酸阿托品注射液含量测定的修订建议 [J], 邹纯才;万艳娟;鄢海燕因版权原因,仅展示原文概要,查看原文内容请购买。
乙酰半胱氨酸内控质量标准
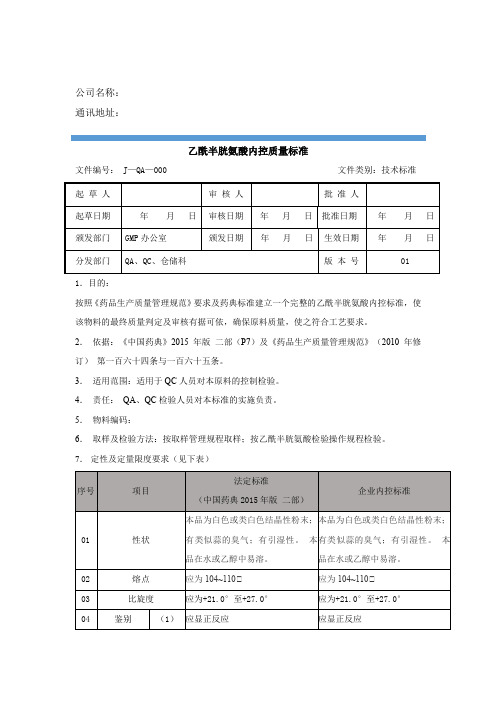
公司名称:
通讯地址:
乙酰半胱氨酸内控质量标准
文件编号: J—QA—000 文件类别:技术标准
1.目的:
按照《药品生产质量管理规范》要求及药典标准建立一个完整的乙酰半胱氨酸内控标准,使该物料的最终质量判定及审核有据可依,确保原料质量,使之符合工艺要求。
2.依据:《中国药典》2015年版二部(P7)及《药品生产质量管理规范》(2010年修订)第一百六十四条与一百六十五条。
3.适用范围:适用于QC人员对本原料的控制检验。
4.责任:QA、QC检验人员对本标准的实施负责。
5.物料编码:
6.取样及检验方法:按取样管理规程取样;按乙酰半胱氨酸检验操作规程检验。
7.定性及定量限度要求(见下表)
8.贮藏条件:密封,在凉暗处保存
9.储存期:12个月复验周期:6个月10.类别:祛痰药
11.用途:用于含乙酰半胱氨酸颗粒的配制。
12.经批准的供应商:×××××××××有限公司
附赠质量标准。
谷氨酰胺执行标准

谷氨酰胺执行标准谷氨酰胺是一种重要的氨基酸,具有多种生理功能,如维持肠道功能、促进肌肉合成、增强免疫力等。
在医疗、食品、化妆品等领域得到广泛应用。
为了规范谷氨酰胺的生产和使用,制定了一系列执行标准。
本文将就谷氨酰胺的执行标准进行详细介绍。
一、谷氨酰胺的执行标准概述谷氨酰胺的执行标准主要包括国家标准和行业标准。
目前,我国谷氨酰胺的执行标准是由国家粮食局发布的《谷氨酰胺》,该标准规定了谷氨酰胺的各项技术指标、试验方法、包装标识等要求。
此外,在医疗、食品等领域也有相关的行业标准对谷氨酰胺的使用进行规范。
二、谷氨酰胺的执行标准内容1.技术指标谷氨酰胺的执行标准中规定了各项技术指标,包括纯度、含量、水分、灰分等。
其中,纯度和含量是最重要的指标,纯度指的是谷氨酰胺中其他杂质的含量,含量则是指每100克样品中谷氨酰胺的含量。
根据执行标准,谷氨酰胺的纯度应不低于98%,含量应不低于95%。
1.试验方法谷氨酰胺的执行标准中规定了各项试验方法,包括化学分析法、仪器分析法等。
其中,化学分析法是最常用的方法,通过滴定等方法测定谷氨酰胺的含量和纯度。
仪器分析法则包括色谱法、质谱法等高精度分析方法,可用于测定谷氨酰胺的微量杂质和其他成分。
1.包装标识谷氨酰胺的执行标准中规定了包装标识的要求,包括产品名称、净含量、生产日期、保质期、生产厂家等信息。
此外,还要求在包装上标注产品的技术指标和试验方法等信息,以便消费者了解产品的质量和安全情况。
1.其他要求除了上述要求外,谷氨酰胺的执行标准还规定了其他方面的要求,如生产过程中的质量控制、产品的安全性和有效性评价等。
这些要求旨在保证产品的质量和安全,保障消费者的健康和安全。
三、谷氨酰胺执行标准的实施与监督为了保障谷氨酰胺执行标准的实施和监督,相关部门需要采取一系列措施。
首先,政府和行业协会应加强标准的制定和修订工作,不断完善标准体系。
其次,生产厂家应加强内部质量控制和管理,确保产品符合标准要求。
乙酰谷酰胺说明书

乙酰谷酰胺说明书关于《乙酰谷酰胺说明书》,是我们特意为大家整理的,希望对大家有所帮助。
乙酰谷酰胺是一种用于改进神经元细胞新陈代谢的药品,一般针对这些昏迷的患者,可能会需要应用到这类药品,也有高血压和脑动脉硬化的患者,也是有可能会需要应用到这类药品。
这类药品的临床医学运用相对而言還是较为普遍,自然大家之前沒有应用过这类药品,最好是可以先去了解一下乙酰谷酰胺使用说明。
1特性CAS:2490-97-3EINECS:219-647-7化学式:C7H12N2O4相对分子质量:188.18特性:乳白色结晶体。
溶于强电解质,能溶解酒精和乙酸丁酯。
溶点:溶点195-199℃密度:1.146g/cm32使用量肌肉注射或静脉滴注,100mg~600mg/日,静脉滴注时能用5%~10%葡萄糖溶液250Ml稀释液后迟缓滴注。
使用方法对神经性头痛、腰痛选用穴道注射。
留意点留意服药后有可能造成血压降低。
3临床医学运用关键融入关键适用范围本产品关键用以推动神经外科术后昏迷患者清醒(如脑肿瘤、颅脑外伤、脑血管病等)。
脑外伤.肝性脑病,偏瘫、高位截瘫、中枢神经瘤、神经性头痛、腰痛的医治。
智商减低、记忆能力阻碍、小儿麻痹症并发症,血防846等药品造成的精神疾病并发症各种各样原因(如一氧化碳中毒了、亚急性乙醇及药物中毒、亚急性化脓性脑膜炎、病毒性脑炎、肝性脑病、肺性脑病、电击伤后等)引发的昏迷、记忆力与直觉思维。
老年人记忆力下降及心脑血管病后的记忆力下降。
老年脑作用衰落的輔助医治。
漫性精神病.老年精神疾病综合征,精神忧郁症等。
在精神科临床医学,常以本产品与其他药品搭配静脉滴注,以改进细胞分化及健康状况。
时兴乙脑流行性感冒乙型脑炎参考文献报导“病毒唑协同乙酰谷酰胺医治乙脑的功效开展了观查,病案分2组,2组在性別、年纪、临床类型、刚开始医治病日等基本同样,具备对比性2组均选用减温、化痰、镇定、脱水、降颅压、输液.防止感染等综合性医治。
医治组到综合性医治的基本上再加病毒唑注射液,按每日15mg/kg,和乙酰谷酰胺,按每日0.02g/kg,两药另外添加10%葡萄糖液中静脉滴注,用至第10病日,服药均值時间为5.7天。
2020版药典对乙酰氨基酚内控质量标准
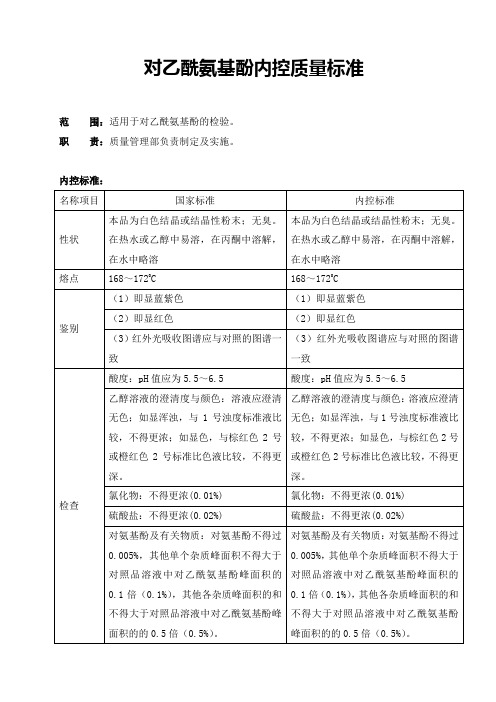
炽灼残渣:不得过0.1%
干燥失重:减失重量不得过0.5%
干燥失重:减失重量不得过0.5%
重金属:含重金属不得过百万分之十
重金属:含重金属不得过百万分之十
微生物限度:需氧菌总数103cfu/g、霉菌和酵母菌数102cfu/g。
微生物限度:需氧菌总数≤800cfu/g、霉菌和酵母菌数≤80 cfu /g。
对氨基酚及有关物质:对氨基酚不得过0.005%,其他单个杂质峰面积不得大于对照品溶液中对乙酰氨基酚峰面积的0.1倍(0.1%),其他各杂质峰面积的和不得大于对照品溶液中对乙酰氨基酚峰面积的的0.5倍(0.5%)。
对氯苯乙酰胺:含对氯苯乙酰胺不得过0.005%
对氯苯乙酰胺:含对氯苯乙酰胺不得过0.005%
168~1720C
鉴别
(1)即显蓝紫色
(1)即显蓝紫色
(2)即显红色
(2)即显红色
(3)红外光吸收图谱应与对照的图谱一致
(3)红外光吸收图谱应与对照的图谱一致
检查
酸度:pH值应为5.5~6.5
酸度:pH值应为5.5~ห้องสมุดไป่ตู้.5
乙醇溶液的澄清度与颜色:溶液应澄清无色;如显浑浊,与1号浊度标准液比较,不得更浓;如显色,与棕红色2号或橙红色2号标准比色液比较,不得更深。
含量测定
按干燥品计算,含C8H9NO2应为98.0~102.0%
按干燥品计算,含C8H9NO2应为98.0~102.0%
四、贮存条件和注意事项:密封保存。
五、有效期:根据厂家有效期
乙醇溶液的澄清度与颜色:溶液应澄清无色;如显浑浊,与1号浊度标准液比较,不得更浓;如显色,与棕红色2号或橙红色2号标准比色液比较,不得更深。
注射用乙酰谷酰胺

注射用乙酰谷酰胺【制剂与规格】注射用乙酰谷酰胺:0.3g【药理及适应症】本品为白色或类白色冻干块状物或粉末。
用于脑外伤性昏迷、神经外科手术等引起的昏迷、肝昏迷及偏瘫、高位截瘫、小儿麻痹后遗症、神经性头痛和腰痛等。
【用法用量】静脉滴注。
每次100~600mg,用5%或10%葡萄糖溶液250ml 或0.9%氯化钠溶液稀释后缓慢滴注。
儿童剂量酌减或遵医嘱。
肌肉注射。
一日100~600mg;儿童剂量酌减或遵医嘱。
用适量无菌注射用水稀释后使用。
【不良反应】尚未见有关不良反应的报道【注意事项】1.静滴时可能引起血压下降,使用时应注意。
2.当药品的性状发生改变时禁止使用。
【药物相互作用】尚不明确。
11注射用脑蛋白水解物【制剂与规格】注射用脑蛋白水解物:60mg 【药理及适应症】本品系健康猪脑组织经酶水解制得的无菌冻干制剂。
内含16种游离氨基酸,并含有少量肽。
本品为白色或淡黄色冻干块状物或粉末,易溶于水。
用于颅脑外伤、脑血管病后遗症伴有记忆减退及注意力集中障碍的症状改善。
【用法用量】用注射用水溶解后,静脉滴注,每一疗程最好连续注射,参考病人年龄、病情以决定疗程长短及剂量。
一般使用60mg,稀释于250ml生理盐水中缓慢滴注,每日一次。
约60~120分钟滴完,可连续使用10~14天为一疗程,或遵医嘱。
【不良反应】本品一般耐受性良好。
体内及体外实验、毒理实验均显示无任何潜在的致畸、致敏或致癌作用。
偶可引起过敏反应(如寒颤、发热、皮肤潮红、全身瘙痒、皮疹等),过敏性休克样反应,呕吐、腹泻,且多与病人体质有关。
大剂量使用和注射过快时,少数病例会引起发热、注射部位疼痛红肿。
迄今尚未发现用药后持久的不良反应或危及生命的病例。
【注意事项】·`【注意事项】过敏体质患者慎用。
一旦出现过敏反应,应立即停药,并及时治疗。
使用本品期间,如出现任何不良事件和/或不良反应,请咨询医生同时使用其他药品,请告知医生。
请放置于儿童不能够触及的地方。
简明氨基酸质量标准-CP2010

293 异亮氨酸
323 苏氨酸
L-2-氨基-4(4-(甲 L-2-氨基-3-羟基丙 L-2-氨基-3(β-吲 L-2-氨基-3-甲基-戊 L-2-氨基-4-羟基丁
硫基)丁酸
酸
哚)丙酸
酸
酸
C5H11NO2S 149.21
C3H7NO3 105.09
C11H12N2O2 204.23
C6H13NO2 131.17
25EU/g
氨基酸类药 密封保存 片剂
12EU/g
50EU/g
20EU/g
12EU/g
氨基酸类药 遮光,密封保存
氨基酸类药
氨基酸类药
遮光,密封,在凉处 保存
遮光,密封保存
氨基酸类药 密封保存
361 谷氨酸
434 苯丙氨酸
507 组氨酸
605 亮氨酸
半胱氨酸
L-2-氨基戊二酸
C5H9NO4 147.13
几乎无臭
无臭 味微甜而后苦
在水中易溶,在乙醇 中溶解,在乙醚或正 丁醇中不溶
在水中极微溶,在无 水乙醇、甲醇或丙酮 中不溶,在稀盐酸或 稀硝酸中溶解
在水中易溶,在乙醇 中几乎不溶,在稀盐 酸中易溶
在水中易溶,在乙醇 中几乎不溶
在水中易溶,在乙醇 中几乎不溶
-84.5°~ -86.0° -11.3°~ -12.1° +26.9°~ +27.9° +8.5°~ +10.0° +26.6°~ +28.8°
氨基酸类药 遮光,密封保存 片剂
886 脯氨酸
1069 酪氨酸
1104 精氨酸
1134 醋酸赖氨酸
1137 缬氨酸
(L)-吡咯烷-2-羧酸
乙酰谷酰胺注射液中细菌内毒素的检查

乙酰谷酰胺注射液中细菌内毒素的检查
刘丽杰;蒋艳红;吴晓莉
【期刊名称】《中国医药技术经济与管理》
【年(卷),期】2008(002)002
【摘要】目的建立乙酰谷酰胺注射液的细菌内毒素的检查方法.方法依据细菌内毒素检查法(中国药典2005年版附录ⅪE),对乙酰谷酰胺注射液的细菌内毒素进行试验.结果用标示灵敏度为0.25Eu/ml和0.5EU/ml的鲎试剂检测三批乙酰谷酰胺注射液的细菌内毒素量均小于0.5EU/ml.结论用细菌内毒素法检查乙酰谷酰胺注射液的热原,无干扰,灵敏度符合规定,方法可行.
【总页数】3页(P71-73)
【作者】刘丽杰;蒋艳红;吴晓莉
【作者单位】河北以岭医药研究院,河北石家庄,050035;石家庄市华新制药厂,河北石家庄,050091;河北以岭医药研究院,河北石家庄,050035
【正文语种】中文
【中图分类】R9
【相关文献】
1.曲克芦丁注射液中细菌内毒素检查方法的研究 [J], 罗婷;林玲
2.长春西汀注射液中细菌内毒素检查方法的建立 [J], 胡佳
3.羟乙基淀粉40氯化钠注射液中细菌内毒素的检查方法 [J], 王瑶;刘洋;胡晨;孟长虹;史清水
4.丙泊酚中/长链脂肪乳注射液细菌内毒素检查法的干扰试验 [J], 丁丽燕
5.鲎试验测定乙酰谷酰胺氯化钠注射液中的细菌内毒素 [J], 肖贵南;李瑾翡;吴招娣因版权原因,仅展示原文概要,查看原文内容请购买。
乙酰谷酰胺注射液Acetylglutamide-详细说明书与重点

乙酰谷酰胺注射液Acetylglutamide【适应症】本品主要用于:1、促进神经外科手术后昏迷病人苏醒(脑肿瘤、颅脑外伤)。
2、脑卒中、脑外伤、肝昏迷、偏瘫、高位截瘫、脑神经瘤、神经性头痛、腰痛的治疗。
3、老年智力减退、记忆力障碍,小儿麻痹后遗症,血防846等药物引起的神经精神障碍后遗症。
4、各种原因(如一氧化碳中毒、药物、急性酒精中毒、急性化脓性脑膜炎、病毒性脑炎、电击伤后等)所致的昏迷、记忆与思维障碍。
【规格】5ml:0.25g;2ml:0.1g,每盒10支,每件100盒【用法用量】肌注或静滴成人:每日0.1-0.6g。
滴注时用5%或10%葡萄糖注射液250ml稀释后缓慢滴注。
小儿用量酌减或遵医嘱。
【不良反应】副作用极小,静注时有可能引起血压下降。
【注意事项】若用于治疗瘫痪、小儿麻痹后遗症、腰痛,采用穴位注射。
【药理毒理】1、本品为脑功能、神经功能改善药,具有改善神经细胞代谢、维持神经应激机能及降低血氨的作用。
在体内分布广泛,能透过血脑屏障,以脑、肝、肾浓度较高,在肾小管细胞内经谷氨酰分解,分解出氨而变成乙酰谷氨酸,氨从肾小管分泌排出,乙酰谷氨酸被吸收,参与体内代谢。
2、乙酰谷酰胺在脑细胞中可产生谷氨酸、γ-氨基丁酸(GABA)。
GABA与GABAA受体结合,抑制突触后神经元兴奋,与GABAB受体结合,抑制兴奋性氨基酸(EAA)的释放,从而对抗EAA的兴奋毒性,保护神经元;GABA可提高葡萄糖磷酸酯化酶的活性,促进葡萄糖代谢;GABA可以促进乙酰胆碱的合成,改善脑功能。
谷氨酸作用于NMDA受体,与神经元的可塑性关系密切,对神经系统的发育和突触形成,对提高学习、记忆能力有重要作用。
谷氨酸参与蛋白质和糖类代谢,对细胞修复有重要作用。
3、谷氨酸与乙酰CoA生成的N-乙酰谷氨酸是氨甲酰磷酸合成酶I的别构激活剂,还可生成鸟氨酸,促进鸟氨酸循环,生成尿素,从而降低血氨。
肾脏回收的乙酰谷胺酸可以用来降低血氨。
乙酰谷酰胺熔点规定存在的问题及修订建议

乙酰谷酰胺熔点规定存在的问题及修订建议
王艳红;李冰
【期刊名称】《中国药品标准》
【年(卷),期】2014(015)001
【摘要】乙酰谷酰胺为谷氨酰胺的乙酰化合物,具有改善神经细胞代谢,维持神经应激能力及降低血氨等作用。
乙酰谷酰胺为《中国药典》2010年版二部新增品种,熔点规定为194~198℃[1];国外药典[2-5]未收载,文献帕[6]报道,乙酰谷酰胺在乙醇中结晶的熔点为197℃。
我们对某制药有限公司生产的原料进行检验,熔点测定时发现熔融同时分解;应用热重/差示扫描量热(TGA/DSC)分析方法进一步试验,证明乙酰谷酰胺熔融同时分解。
【总页数】3页(P15-17)
【作者】王艳红;李冰
【作者单位】山东药品食品职业学院,威海,264210;山东省食品药品检验所,济南,250101
【正文语种】中文
【中图分类】R921.2
【相关文献】
1.《中国药典》2015年版乙酰谷酰胺注射液含量测定系统适用性的修订建议 [J], 徐桂连;邵纯君;贺建华;鹿麟
2.现行中医执业类别及范围有关规定存在的问题及修订建议 [J], 余鹏程;陈涛
3.我国适航规定轻型水陆两栖飞机部分的修订建议 [J], 董一巍; 吕玥萱; 殷春平
4.两法衔接视角下的法释[2000]33号解释第7条——兼评《道路交通安全法(修订建议稿)》的规定 [J], 徐澍
5.两法衔接视角下的法释〔2000〕33号解释第7条
——兼评《道路交通安全法(修订建议稿)》的规定 [J], 徐澍
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
公司名称:
通讯地址:
乙酰谷酰胺内控质量标准
文件编号: J—QA—000 文件类别:技术标准
1.目的:
按照《药品生产质量管理规范》要求及药典标准建立一个完整的乙酰谷酰胺内控标准,使该物料的最终质量判定及审核有据可依,确保原料质量,使之符合工艺要求。
2.依据:《中国药典》2015年版二部(P8)及《药品生产质量管理规范》(2010年修订)第一百六十四条与一百六十五条。
3.适用范围:适用于QC人员对本原料的控制检验。
4.责任:QA、QC检验人员对本标准的实施负责。
5.物料编码:
6.取样及检验方法:按取样管理规程取样;按乙酰谷酰胺检验操作规程检验。
7.定性及定量限度要求(见下表)
8.贮藏条件:遮光,密封保存
9.储存期:12个月复验周期:6个月10.类别:精神振奋药
11.用途:用于乙酰谷酰胺注射液的配制。
12.经批准的供应商:×××××××××有限公司
附件
乙酰谷酰胺
Yixianguxian'an
Aceglutamide
C7H12N2O4 188.18
本品为N2-乙酰-L-谷氨酰胺。
按干燥品计算,含C7H12N2O4不得少于98.0%。
【性状】本品为白色结晶性粉末;无臭。
本品在水中溶解,在乙醇中微溶。
熔点本品的熔点(通则0612)为194~198℃。
比旋度取本品,精密称定,加水溶解并定量稀释制成每1ml中含20mg的溶液,依法测定(通则0621),比旋度为-11.5°至-13.5°。
【鉴别】(1)取本品0.1g,加稀盐酸5ml,加热煮沸30分钟,并不断补充水分,放冷,用氢氧化钠试液调节pH值约为6,取2ml,加茚三酮约2mg,加热,应显蓝紫色。
另取本品50mg,加水2ml及茚三酮约2mg,加热,不显蓝紫色。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集539图)一致。
【检查】溶液的透光度取本品0.50g,加水20ml溶解后,照紫外-可见分光光度法(通则0401),在430nm的波长处测定透光率,不得低于95.0%。
氯化物取本品0.40g,依法检查(通则0801),与标准氯化钠溶液8.0ml 制成的对照液比较,不得更浓(0.02%)。
硫化物取本品1.25g,依法检查(通则0803),应符合规定(0.0004%)。
有关物质取本品,加流动相溶解并稀释制成每1ml中约含1mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
照含量测定项下的色谱条件,精密量取供试品溶液和对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液的主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(2.0%)。
干燥失重取本品,在105℃干燥至恒重,减失重量不得过1.0%(通则0831)。
炽灼残渣不得过0.1%(通则0841)。
重金属取本品1.0g,加水23ml,必要时加热使溶解,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,依法检查(通则0821第一法),含重金属不得过百万分之十。
【含量测定】照高效液相色谱法(通则0512)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.05mol/L的磷酸二氢钾溶液(用10%磷酸溶液调节pH值至3.0)-甲醇(95:5)为流动相;检测波长为210nm。
取乙酰谷酰胺对照品和谷氨酰胺对照品各适量,置同一量瓶中,加流动相溶解并稀释制成每1ml中各约含0.1mg的溶液,混匀,取20μl注入液相色谱仪。
乙酰谷酰胺峰与谷氨酰胺峰的分离度应大于7.0,理论板数按乙酰谷酰胺峰计算不低于2000。
测定法精密称取本品适量,加流动相溶解并定量稀释制成每1ml中约含0.1mg的溶液,精密量取20μl注入液相色谱仪,记录色谱图;另取乙酰谷酰胺对照品适量,精密称定,同法测定。
按外标法以峰面积计算,即得。
【类别】精神振奋药。
【贮藏】遮光,密封保存。
【制剂】乙酰谷酰胺注射液。
