脂肪乳氨基酸葡萄糖注射液无菌保证与细菌内毒素质量风险评估报告
注射剂无菌安全存在的问题及对策思考

Oct.2009,Vol.6No.10药品审评注射剂无菌安全存在的问题及对策思考霍秀敏(国家食品药品监督管理局药品审评中心,北京100038)作者简介:霍秀敏,女,主任药师。
从事药品技术审评工作。
E-mail :huoxm@“欣弗”事件使得无菌制剂的无菌保障问题成为公众关注的焦点,保证无菌制剂达到无菌要求,确保人民用药安全,是药品生产企业和药品监管部门需要认真思考的问题。
本文针对药品研发中存在的一些问题,结合无菌制剂无菌保证的要求,从如下几个方面谈谈个人的认识,供业内人士参考。
1注射剂剂型选择的合理性众所周知,剂型的选择主要考虑药物的理化性质、稳定性和生物学特性,以及临床治疗的需要和临床用药的顺应性,此外,还要考虑制剂工业化生产的可行性和生产成本等。
注射剂包括大容量注射剂、粉针剂和小容量注射剂,开发成注射剂不但要遵循上述原则,同时还要考虑制剂的无菌保证水平。
换句话说就是,应优先选择无菌保证水平高的剂型。
如果某主药可以制成无菌保证水平高的剂型,而选择无菌保证水平低的剂型,则应视为剂型选择不合理。
如果主药在水溶液中稳定性较好,同时又可以耐受最终灭菌工艺,则适于开发成小容量注射剂或大容量注射剂;其采用的灭菌方式的无菌保证值应在6以上(微生物残存概率<10-6)。
如果主药的稳定性不够好,则应尽量优化处方工艺,以改善制剂的耐热性,使之能够耐受最终灭菌工艺;如确实无法耐受,则应考虑选择其他剂型,而非大容量注射剂。
对于有充分的依据证明不适宜采用终端灭菌工艺(F 0≥8)且临床必需注射给药的品种,可考虑选择采用无菌生产工艺的剂型。
通常无菌生产工艺仅限于粉针剂或部分小容量注射剂。
如果改变上市产品的剂型(粉针剂、小容量注射剂、大容量注射剂互换),不但应证明变更后的剂型在安全、有效和质量可控性方面更具优势,而且其无菌保证水平也不能降低。
2无菌检查方法的局限性微生物的生长受温度、pH 、培养基、检品特性及实验操【摘要】本文从剂型选择的合理性、无菌检查方法的局限性、不同灭菌方式的无菌保证水平、无菌安全的保证要素等方面,对国内注射剂无菌安全存在的问题进行了分析,同时根据无菌制剂无菌保证的要求,提出了在现有条件下提高注射剂无菌保证水平的可行对策,以完善产品的质量保证体系,保证药品的质量、疗效和用药安全。
肿瘤专科医院脂肪乳氨基酸(17)葡萄糖(11%)注射液临床使用分析

肿瘤患者营养不良发生率高,营养不良不仅影响肿瘤治 疗的临床决策,还会增加并发症发生率和病死率,降低患者的 生活质量,影响患者的临床结局〔1〕。肿瘤患者肠外营养应用 合理性一直是 临 床 药 学 工 作 的 难 点。脂 肪 乳 氨 基 酸 (17)葡 萄糖(11%)注射液为肠外营养复方制剂,适用于不能或功能 不全或被禁忌经口 /肠道摄取营养的成人患者。本文尝试从 脂肪乳氨基酸(17)葡萄糖(11%)注射液的使用情况入手,从 适应症,用法用量及配伍用药等方面等对肿瘤患者肠外营养 应用合理性进行分析。现将结果报道如下。 1 资料与方法 11 资 料 来 源 脂 肪 乳 氨 基 酸 (17)葡 萄 糖 (11%)注 射 液
工作,规范合理用药,提高药学服务水平。
关键词:脂肪乳氨基酸(17)葡萄糖(11%)注射液;肠外营养;肿瘤患者;药学服务
中图分类号:R9694 文献标识码:B 文章编号:10063765(2019)1002046012603
FatEmulsion,AminoAcids(17)andGlu cose(11%)InjectioninTumorSpecializedHospital
ABSTRACT:OBJECTIVE Medicalrecordswiththeuseoffatemulsion,aminoacids(17)andglucose(11%) injectionwerecollected,andtoprovidereferenceforclinicalrationaldruguse,theuseoffatemulsion,aminoacids (17)andglucose(11%)injectionincancerspecialisthospitalswereanalyzedandcommentedMETHODS Nin tyfivecasesoffatemulsion,aminoacids(17)andglucose(11%)injectionswerecollectedandtherationalityof theapplicationwasexaminedintermsoftotalenergy,indications,andcompatibilityRESULTS Therationalrateof drugusewas642%,theindicationwassuitablefor768%,thetotalenergywasreasonablyaccountedfor863%, thenutritionratioandcompatibilityarebasicallyreasonableCONCLUSION Clinicalpharmacistsshouldstrength enrelevantmonitoringworkonparenteralnutrition,standardizerationaldruguseandimprovethelevelofpharmaceu ticalcare KEYWORDS:Fatemulsion,aminoacids(17)andglucose(11%)injection;Parenteralnutrition;Tumorpatient;Pharmaceutical
针剂生产过程内毒素控制方法总结

1.洗瓶和洗塞
洗瓶通常采用粗洗一精洗工艺。粗洗常用毛刷刷洗或超声波清洗,以去除瓶内外壁的各种污染物。精洗多采用多道注射用水喷射淋洗,以彻底去除污染物。
应对精洗后的输液瓶进行可见异物检查。
丁基胶塞使用前应由洗塞机进行清洗,必要时加入一定量的甲基硅油进行硅化。硅化的目的是防止胶塞粘连,并有利于胶塞在自动压塞机轨道上的运动。但硅化后的胶塞可能向药液释放微量硅
①轧盖机和灌装机应分置于两个房间。
②轧盖间对灌装间为相对负压;或者轧盖机安装在有足够排风的装置内,该装置对其外围环境为相对负压。
可采用其他防止微粒污染风险的措施,但应通过验证证明其有效性。
通常铝盖生产的最后清洗和包装应在d级区进行,铝盖的卫生洁净是有保证的。考虑到多次清洗会增加对铝盖表面涂层的伤害,而且铝盖在使用过程本身会产生大量微粒污染,大输液生产企业在使用前对铝盖进行清洗的意义不大。建议通过对供应商的控制保证铝盖的洁净程度而不对铝盖进行再次清洗。
采用纯化水为直接接触产品的介质。在灭菌腔室中加入一定量的纯化水,通过循环泵经喷嘴均匀喷洒在产品上。纯化水通过由工业蒸汽加热的热交换器达到灭菌需要的温度。在冷却阶段该纯化水又通过低温水冷却的热交换器降温,并使产品降温。
③过热水浴
与过热水喷淋相同的加热一冷却原理。区别在于产品完全浸没在水中。
国际上普遍要求具有防止灭菌后产品二次污染微生物的措施,主要方法有:
轧盖工序应监控铝盖的扭力矩。
在完成轧盖进行灭菌前,应根据需要取样监测产品灭菌前微生物污染及污染菌的耐热性。
(五)灭菌
灭菌区应限制无关人员进入。
产品应在规定时间内进行灭菌。
产品灭菌主要有蒸汽灭菌和过热水喷淋或过热水浴三种。
①蒸汽灭菌
采用清洁蒸汽(工业蒸汽经过滤除去铁锈等异物)为加热介质。冷却介质为经消毒处理的水。②过热水喷淋
新版注射液风险评估报告【精选】

XXXX注射液风险评估报告文件编号:REP.04.1102.0012012年12月报告批准QA主管:年月日QC主管:年月日制剂车间主任:年月日生产部经理:年月日工程部经理:年月日质量总监:年月日质量受权人:年月日副总经理:年月日1基本内容1.1目的对XXXX注射液生产过程的所有工序进行风险评估分析,确认各生产工序的相关潜在风险及应采取的控制措施,以最大限度地降低各种风险,确保将影响产品质量的各种风险控制在可接受的范围内。
1.2范围本报告适用于XXXX注射液所有生产工序及所涉及的关键设施设备的风险评估。
生产工序包括:安瓿清洗、药液配制、灌封、灭菌、灯检、包装等;主要工艺设备包括:配料罐、洗瓶机、灌装机、灭菌器、灯捡台、包装设备等;关键设施包括:纯化水系统、注射用水系统、纯蒸汽系统、压缩空气系统、空调系统等。
1.3职责以下部门/人员作为风险评估小组成员,参与完成风险评估工作并批准风险评估报告。
2程序与结果2.1风险管理流程风险管理流程如下:1、风险识别:系统地运用信息来辨别危险因素,这些信息可能包括历史数据、理论分析、意见等。
确定事件并启动质量风险管理,收集背景信息并确定质量风险管理项目小组人员及资源配置。
2、风险分析:在项目策划和设计开发时,对项目进行风险分析,风险分析的评估和结果应记录在风险管理文档中。
3、风险控制:根据风险可接收准则,判断每个危害的风险,是否达到可接受水平,在风险评价中可以使用风险评价表,对需要降低的风险或消除的风险,应进行风险控制。
风险控制措施及其实施、验证、评价、分析结果须记录在风险管理文档中。
4、风险降低:确定风险降低的方法。
当风险超过可接受的水平时,风险管理将致力于减少或避免风险。
包括采取行动来降低风险的严重性或风险发生的可能性。
5、风险接受:确定可接受的风险的最低限度。
对于一些类型的伤害,甚至最好的质量风险控制措施也未必能全部消除风险,在这些情况下,可以认为已应用了恰当的质量风险管理策略,并将质量风险降低到了可接受(参数范围、标准)的水平。
注射剂质量风险管理

注射剂质量风险管理1无菌保证风险与质量风险控制点无菌保证的风险主要来自于以下,即:●产品灭菌前微生物污染水平●灭菌工艺的可靠性●容器密封完整性●无菌保证管理体系(1)产品灭菌前微生物污染水平产品灭菌前通常都存在一定程度的微生物污染。
微生物污染主要受以下因素影响:①原材料和包装材料中的微生物——风险在于其可能进入产品。
质量风险控制方法:●制定原辅料采购标准,规定微生物限度。
通常应不超过100CFU/g,并不得检出致病菌。
●进行供应商的确认时应重点关注供应商的生产过程对微生物污染、细菌内毒素污染、产品混淆和交叉污染风险的控制措施。
●对供应商及其供应的原料进行年度质量回顾分析,以评估其质量状况。
对有质量不良趋势的供应商应采取针对性的措施,如增加现场检查的频率,更严格的抽样方案。
●严格管理仓储条件,确保原料储存过程中质量受控。
如干燥、防虫、防鼠等。
包装材料如玻璃瓶应定点采购,其包装应能防止昆虫进入,储存过程防止受潮长霉。
②生产环境注射剂的生产从原料称量开始直至完成密封,都分别在相应的洁净区进行。
生产过程各步骤都可能存在药物直接暴露于环境的环节,存在来自于生产环境中的微生物污染的风险。
为控制上述风险,采用A、B、C、D四个等级的洁净区标准,分别对应注射剂的各生产工序。
如能证明在动态下生产区的洁净度能符合上述标准,则来自环境的微生物污染风险是较低的。
质量风险控制方法:●洁净区应配置设计良好并经过验证、定期再验证且良好维护的空调净化系统。
洁净区新风和人员数量的关系,应至少达到GB50457-2008《医药工业洁净厂房设计规范》规定的标准。
●空调净化系统应保证持续稳定地运行。
●空调净化系统停机超出规定时间后,应重新进行洁净区的验证。
●精心设计、实施动态环境监控方案,保证监控数据能反映洁净区的实际情况。
●对环境监控结果进行环境质量统计分析。
●根据环境质量统计结果制定、修订环境监控警戒标准和纠偏标准,确保能及时发现、纠正环境恶化的趋势。
两厂家市售脂肪乳注射液的质量评价

,)): 年 99 月 9) 日 ,)): 年 9) 月 9+ 日 ,)): 年 99 月 9, 日 ,)): 年 99 月 , 日 ,)): 年 99 月 8 日 ,)): 年 99 月 7 日 ,)): 年 : 月 ,)): 年 . 月 ,)): 年 9) 月 ,)): 年 7 月 ,)): 年 9) 月 ,))+ 年 9 月
"4(#D , 游 离 脂 肪 酸 为 "4$& E "4(& ))JI ! @ , 甘 油 分 别 为 &&4"( E &&4&" )H ! )I 和 #$4#$ E #$4GF )H ! )I , 甘 油 三 酯 含 量 为
标 示 量 的 ’’4#D E #""4%D , 磷 脂 含 量 为 标 示 量 的 ’(4(GD E #""4"CD , 溶 血 磷 脂 为 "4&F’ E "4GFF )H ! )I , 过 氧 化 值 为
!"#$%#&’()*&#+ ,-#+(#)*./ .0 12. !$.3(&)4 .0 5#) ,%(+4*./ 6/7’&)*./
N*+ O-. !P @+ O- ! Q1+P R3-J K+.P :1. S*+ ! ,J.H
LO*0-TU)*.U JV S3-T)-2WP S=N5 6JX0+U-IP 5?N: -., S=N5P K*+Y+.H #""(C"P 53+.-M
谱纯、分析纯或化学纯。
脂肪乳注射液质量标准

脂肪乳注射液质量标准
1.原料药质量
脂肪乳注射液的原料药应来自合法且质量可靠的供应商,应提供原料药的详细质量标准,包括但不限于纯度、杂质含量、稳定性等。
在选择供应商时,应优先考虑具有良好信誉和稳定质量的制药公司。
2.外观
脂肪乳注射液的外观应为无色或浅黄色的澄明液体,无沉淀物、杂质和絮状物。
不得有气泡、混浊、变色、细菌污染等情况。
3.装量
脂肪乳注射液的装量应符合标示量要求,允差应在±5%范围内。
装量的测定方法应按照中国药典的相关规定进行。
4.粒度与粒子大小
脂肪乳注射液中的粒子大小和粒度分布应符合一定的要求,以保证注射液的稳定性和药效。
应采用适当的方法对粒子大小和粒度分布进行检测和评估,如激光粒度仪法等。
5.渗透压
脂肪乳注射液的渗透压应与血浆渗透压相似,以避免对血管和身体造成不良影响。
渗透压的测定方法应按照中国药典的相关规定进行。
6.酸碱度
脂肪乳注射液的酸碱度应控制在一定范围内,以保证注射液的稳定性和安全性。
应采用适当的酸碱度测定方法对注射液的酸碱度进行检测和控制。
7.无菌
脂肪乳注射液应无菌,不得含有任何微生物和细菌内毒素。
应采用适当的无菌检测方法对注射液进行无菌检测,如培养法、鲎试验法等。
8.细菌内毒素
脂肪乳注射液中不得含有任何细菌内毒素,应采用适当的细菌内毒素检测方法对注射液进行检测和控制。
细菌内毒素的检测方法应按照中国药典的相关规定进行。
凝胶法测定10%中长链脂肪乳注射液(C8-24Ve)和30%脂肪乳注射液(C14-24)中细菌内毒素

凝胶法测定10%中/长链脂肪乳注射液(C 8-24Ve )和30%脂肪乳注射液(C 14-24)中细菌内毒素Determination of Bacterial Endotoxin in 10%Medium/Long Chain Fat EmulsionInjection (C 8-24Ve )and 30%Fat Emulsion Injection (C 14-24)by Gel Method曾博雅ZENG Boya摘要目的:采用凝胶法测定10%中/长链脂肪乳注射液(C 8-24Ve )和30%脂肪乳注射液(C 14-24)中的细菌内毒素。
方法:根据《中国药典2015年版四部》1143细菌内毒素检查法,先调节供试品pH 值,再进行干扰试验,确定10%中/长链脂肪乳注射液8倍稀释液无干扰作用,30%脂肪乳注射液原液无干扰作用。
结果:在调节pH 值至中性后,10%中/长链脂肪乳注射液8倍稀释液对细菌内毒素试验无干扰,30%脂肪乳注射液原液对细菌内毒素试验无干扰。
结论:凝胶法可用于10%中/长链脂肪乳注射液(C 8-24Ve )和30%脂肪乳注射液(C 14-24)中的细菌内毒素检查。
关键词中/长链脂肪乳注射液;脂肪乳注射液;细菌内毒素检查法;凝胶法中图分类号:R927文献标识码:ADOI :10.19694/ki.issn2095-2457.2020.02.058AbstractObjective:To adopt gel method for the determination of bacterial endotoxin in 10%Medium/Long Chain Fat Emulsion Injection (C 8-24Ve)and 30%Fat Emulsion Injection (C 14-24).Methods:According to the “bacterial endotoxin test method ”of 1143in Four Part of Chinese Pharmacopoeia 2015edition,the PH of the sample was adjusted first,and then the interference test was carried out.It was determined that the dilution of 10%medium/long chain fat emulsion injection 8times had no interference effect,and the original solution of 30%fat emulsion injection had no interference effect.Results:After adjusting the PH to neutral,the 8times dilution solution of 10%medium/long chain fat emulsion injection did not interfere with the bacterial endotoxin test,and the original solution of 30%fat emulsion injection did not interfere with the bacterial endotoxin test.Conclusions:the gel method can be used for bacterial endotoxin test in 10%Medium/Long Chain Fat Emulsion Injection (C 8-24Ve)and 30%Fat Emulsion Injection (C 14-24).Key WordsMedium/long chain fat emulsion injection;Fat emulsion injection;Bacterial endotoxin test;Gel method曾博雅宝鸡市食品药品检验检测中心微生物室(宝鸡721013)近年来,10%中/长链脂肪乳注射液作为肠外营养药,用于口服或肠内营养不能或不够时补充能量和必需脂肪酸。
脂肪乳氨基酸(17)葡萄糖(11%)注射液(1440 ml)致药物性肝损害1例

脂肪乳氨基酸(17)葡萄糖(11%)注射液(1440 ml)致药物性肝
损害1例
关丽叶;李晓明;史英钦
【期刊名称】《临床合理用药杂志》
【年(卷),期】2018(11)34
【摘要】脂肪乳氨基酸(17)葡萄糖(11%)注射液(1440ml),是一种即用型预混式多腔袋标准化肠外营养配方,广泛应用于不能或功能不全或被禁忌经口/肠道摄取营养的成人患者。
【总页数】2页(P116-117)
【作者】关丽叶;李晓明;史英钦
【作者单位】河北省人民医院药学部
【正文语种】中文
【中图分类】R575
【相关文献】
1.卒中患者长期给予脂肪乳氨基酸(17)葡萄糖(11%)注射液致韦尼克脑病
2.脂肪乳氨基酸(17)葡萄糖(11%)注射液对消化系统肿瘤切除术后血糖水平及并发症的影响
3.脂肪乳氨基酸(17)葡萄糖(11%)注射液氨基酸注射液中犬尿氨酸含量测定
4.脂肪乳氨基酸(17)葡萄糖(11%)注射液氨基酸注射液中吲哚-3-甲醛的测定
5.精氨酸谷氨酸注射液与脂肪乳氨基酸(17)葡萄糖(11%)注射液的配伍稳定性考察
因版权原因,仅展示原文概要,查看原文内容请购买。
葡萄糖细菌内毒素检查方法验证报告 模版

葡萄糖细菌内毒素检查方法验证报告文件编码:D01-5301 版本号:01目录一、目的 (1)二、适用范围 (1)三、内容 (1)四、附件 (14)五、变更历史 (14)一、 目的建立葡萄糖细菌内毒素检查方法,即按照《葡萄糖细菌内毒素检查方法验证方案》D01-5301进行验证,在本实验条件下的适用性,所采用的检验方法能够始终如一地获得符合客观实际的数据或结果,确保检验结果的准确性。
二、 适用范围适用于本公司所生产的葡萄糖细菌内毒素检查方法的验证。
三、 内容 1. 概述按照《2015年分析仪器、实验设备确认总计划》进度安排,验证小组按《葡萄糖细菌内毒素检查方法验证方案》D01-5301中既定检查项目,对葡萄糖细菌内毒素检查方法进行了检查、测试,且所有测试结果已收集齐全,现特此起草《葡萄糖细菌内毒素检查方法验证报告》,分析、总结各项验证情况,对葡萄糖细菌内毒素检查方法做出客观评价,提出合理化使用建议,以确保该检验方法的检验结果准确可靠。
2. 验证组织3. 验证实施时间:2015.10.124. 验证内容根据公司《验证管理规程》C05-0001的有关规定,对葡萄糖细菌内毒素检查方法进行验证。
验证内容包涵鲎试剂灵敏度复核试验、干扰试验以及凝胶限度试验,以部 门部门职责责任人 职 务工作划分 备注 质量部 方案起草、组织实施、过程监控、书写报告方案、报告起草,验证实施及操作结果的复核进行验证操作过程监控 验证委员会方案、报告审核、批准、验证合格证发放方案、报告审核方案、报告批准;验证合格证发放确认所建立的葡萄糖细菌内毒素检查方法可行性、准确性。
5.验证依据5.1.验证的法规依据《药品生产质量管理规范(2010年修订)》《药品GMP指南·质量控制实验室与物料系统》《中华人民共和国药典》2015年版四部6.验证前完成工作检查6.1.文件资料的检查确认项目认可标准确认方法确认结果是否符合是否验证方案已起草,并经过审核、批准对验证方案进行检查验证方案已完成起草,并按照规定结果验证委员会成员审核,验证委员会组长批准。
综合技能实训14 5萄糖注射液的细菌内毒素检查教案资料

1.确定检品的L值
L=K/M
式中,L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U(活性单位)表示;K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5EU/(kg·h),放射性药品注射剂K=2.5EU/(kg· h),鞘内用注射剂K=0.2EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,以ml/(kg·h)、mg/(kg·h)或U/(kg·h)表示,人均体重按60kg计算,人体表面积按1.62m2计算。注射时间若不足1小时,按1小时计算。供试品每平方米体表面积剂量乘以0.027即可转换为每千克体重剂量(M)。
三、学生分组完成操作,进行加样。
四、学生在老师指导下完成保温工作。
五、随机抽一名学生演示上述操作,由来自学们充当评委,指出操作不当之处。
六、根据中国药典,对检验结果进行判断。
七、老师组织组间评比,评比内容包括方案设计的合理性、操作的规范性、报告方法及检验结果的准确性等,由同学代表和老师共同综合上述各项打分。
S
供试品阳性对照
阳性对照
阴性对照
0.1ml水+0.1ml SMVD
0.1ml SMVD+0.1ml E2λ
0.1ml水+0.1ml E2λ
0.2ml水
(4)封闭管口,摇匀,放入37℃±1℃恒温水浴保温60分钟±2分钟,取出观察结果,记录结果。
将试管缓慢翻转180°,若管内凝胶显示坚实不变形为阳性,记录为“+”;若无凝胶出现,或虽有凝胶但不能保持完整,从管壁滑脱,均判定为阴性,记录为“-”。
4.结果判断若阴性对照溶液的平行管均为阴性,供试品阳性对照溶液的平行管均为阳性,阳性对照溶液的平行管均为阳性,试验有效。若检品S的两个平行管均为阴性,判定供试品符合规定;若检品S的两个平行管均为阳性,判定供试品不符合规定;若检品S的两个平行管中的一管为阳性,另一管为阴性,需进行复试。
最终灭菌产品的质量风险评估案例

A. 无菌保证风险与质量风险控制点 无菌保证的风险主要来自于以下,即: ● 产品灭菌前微生物污染水平 ● 灭菌工艺的可靠性 ● 容器密封完整性 ● 无菌保证管理体系 (1) 产品灭菌前微生物污染水平 产品灭菌前通常都存在一定程度的微生物污染。微生物污染主要受以下因素影响: ① 原材料和包装材料中的微生物——风险在于其可能进入产品。 质量风险控制方法: ● 制定原辅料采购标准,规定微生物限度。通常应不超过 100CFU/g,并不得检出致病菌。 ● 进行供应商的确认时应重点关注供应商的生产过程对微生物污染、细菌内毒素污染、产 品混淆和交叉污染风险的控制措施。 ● 对供应商及其供应的原料进行年度质量回顾分析,以评估其质量状况。对有质量不良趋 势的供应商应采取针对性的措施,如增加现场检查的频率,更严格的抽样方案。 ● 严格管理仓储条件,确保原料储存过程中质量受控。如干燥、防虫、防鼠等。包装材料 如玻璃瓶应定点采购,其包装应能防止昆虫进入,储存过程防止受潮长霉。 ② 生产环境 注射剂的生产从原料称量开始直至完成密封,都分别在相应的卫生洁净区中进行。生产过程 各步骤都可能存在药物直接暴露于环境的环节,存在来自于生产环境中的微生物污染的风 险。为控制上述风险,应采用 A 、B 、C、D 四个等级的洁净区标准,分别对应注射剂的各 生产工序。如能证明在动态下生产区的洁净度能符合上述标准,则来自环境的微生物污染风 险是较低的。 质量风险控制方法: ● 洁净区应配置设计良好并经过验证、定期再验证且良好维护的空调净化系统。洁净区新 风和人员数量的关系,应至少达到 GB 50457—2008《医药工业洁净厂房设计规范》规定的 标准。 ● 空调净化系统应保证持续稳定地运行。 ● 空调净化系统停机超出规定时间后,应重新进行洁净区的验证。 ● 精心设计、实施动态环境监控方案,保证监控数据能反映洁净区的实际情况。 ● 对环境监控结果进行环境质量统计分析。 ● 根据环境质量统计结果制定、修订环境监控警戒标准和纠偏标准,确保能及时发现、纠 正环境恶化的趋势。 ● 养成良好的个人卫生习惯和意识,即环境监控取样时段与非取样时段的行为一致。 ● 制定 SOP 明确规定发生诸如停电、空调净化系统故障、环境超标等偏差应对措施。 ③ 生产设备 注射剂通常采用固定的设备,安装了生产及在线清洗、消毒等多种工艺管道。因此设备存在 残留物或微生物的可能,对产品有潜在风险。 质量风险控制方法: ● 设备在线清洁和在线灭菌的方法应足够详细,应包含所有影响清洁效果的参数,如水温、 清洁剂浓度、流速、时间、阀门的开闭次序和时间、蒸汽温度、压力等的书面规定,以的变更管理程序,确保微生物专业人员参加该程序,即所有的变更均需经微生 物专业人员审核,专业人员应对变更是否增加微生物风险进行分析、判断;对变更进行的验 证结果进行审核并提出专业意见。 B .细菌内毒素风险与控制 细菌内毒素污染来自于以下两个方面。 ● 物料(原辅料、包装材料)本身携带的细菌内毒素。 ● 产品中能产生细菌内毒素的活微生物,在灭菌前繁殖代谢产生。 因此,细菌内毒素的风险控制主要针对这两方面。 (1) 物料的细菌内毒素污染 控制物料携带的细菌内毒素可采取以下措施。 ● 根据原辅料在成品中的含量合理制定原料和辅料细菌内毒素限度。 ● 原辅料的生产工艺中应有降低、控制微生物污染和细菌内毒素污染的措施。 ● 在成品生产中合理使用活性炭,一方面达到降低细菌内毒素的目的,另一方面尽量控制 活性炭产生的风险。 ● 可通过清洗及清洗验证消除包装材料携带内毒素的风险。注射剂的玻璃瓶、胶塞的清洗 效果验证应包括细菌内毒素项目。 (2) 产品中微生物代谢产生的细菌内毒素 这类风险因素的控制关键在于控制产品灭菌前微生物污染水平以及各工艺步骤的时限。 应注意虽然终端过滤器能截流药液中的绝大部分微生物,但对降低药液中已有细菌内毒素无 效,因此控制配制工序的微生物污染和配制工序时间相对重要。 C. 微粒污染风险与控制 注射剂中的微粒来源非常广泛,可能的因素包括但不限于: ● 原辅料和包装材料。 ● 生产环境。 ● 人员。 ● 生产设备。 ● 药液稳定性。 ● 包装材料的兼容性等。 除因药液稳定性和包装材料兼容性导致的微粒污染外,其余风险因素的控制与药品中微生物 污染的控制方法基本重叠,可参照控制药液灭菌前微生物污染水平的措施。 药液稳定性、药液与包装材料的兼容性应在产品设计、研发阶段研究解决。 原材料和包装材料的质量标准与供应商的变更应进行相关的稳定性试验和兼容性试验。 2.2.2 非最终灭菌产品的风险评估案例 非最终灭菌产品同样考察无菌工艺过程中的微生物、内毒素和微粒状态,由于无法对半成品 进行灭菌处理,并且该类工艺在过程中有更多的暴露带来的污染风险,因此在此类工艺中应 更关注无菌工艺失败的风险。下面以冻干产品的生产工艺风险评估来说明非最终产品工艺的 风险评估和控制。 A. 目的 对某公司冻干生产工艺风险评估,该公司对于冻干生产工艺进行定期回顾和风险评估。 B. 范围 涵盖某公司冻干制剂从物料准备至灯检生产的全过程,用于对产品质量的风险评估。 C. 方法
脂肪乳注射液细菌内毒素检查法的可行性研究
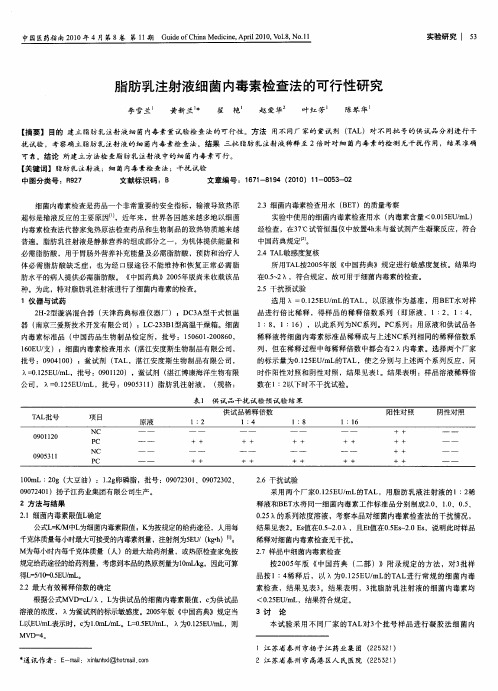
015 U m . E / L,批号 :0 0 10 2 9 12 ),鲎试剂 ( 湛江博康 海洋生物有 限
时作 阳性 对照 和 阴性 对照 ,结果 见表 1 。结果 表 明 :样 品溶液稀 释倍 数在1 2 : 以下 时不干扰试 验 。
0 0 2 0 )扬子江药 业集 团有限公司生产 。 974 1 2方 法与 结果
2 . 6干扰试验 采用两 个厂 家015 U mL A . E / 的T L,用 脂肪 乳液 注射液 的 1: 稀 2 2
释液和B T E 水将 同一 细菌 内毒素工 作标准 品分别制 成2 、1 、O5 . . .、 0 0
中国医 指南21年4 药 00 月第8 第1期 G i Ci M d i ,p 卷 1 u e f h a ein A do n ce
,0 ! : v ! ! :
实 验研 究 l 5 3
脂肪 乳注射液细菌 内毒素检 查法 的可行性研 究
李 雪 兰 黄 新 兰 翟 艳 赵 爱 华。 叶 红 芳 陈琴 华
肪水平 的病 人提供必需 脂肪酸 。 《 中国药典 》2 0 年版 尚未收 载该 品 05
2 A 敏感度复 核 .TL 4 所用T L 0 5 A 按20 年版 《 中国药 典》规 定进行敏 感度复 核。结果均
在0  ̄ ,符合规定 ,故 可用于细菌 内毒素的检查 。 .2 5
种。为此 ,特对脂肪乳 注射液进行 了细菌 内毒素的检查 。 1仪 器与 试药 2 一型漩涡 混合器 ( H2 天津 药典标准 仪器厂 );D 3 型 干式恒 温 CA 器 ( 南京三爱斯技术开 发有限公司 ) ; C2 3 1 L 一3B 型高温干燥箱 。细菌 内毒素标 准 品 ( 中国药 品生物 制 品检 定所 ,批号 :100 —0 80 561 06 , 2 10 U支 );细菌内毒素检查 用水 ( 6E / 湛江安 度斯生物制 品有限公 司 ,
注射剂风险评估报告1
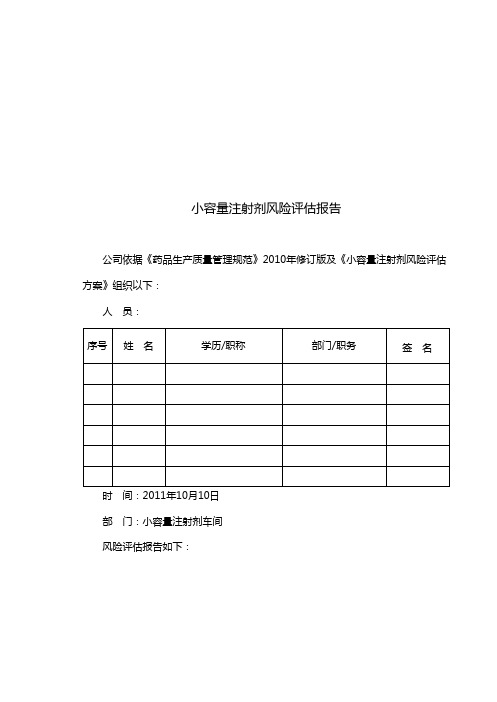
小容量注射剂风险评估报告公司依据《药品生产质量管理规范》2010年修订版及《小容量注射剂风险评估方案》组织以下:人员:序号姓名学历/职称部门/职务签名时间:2011年10月10日部门:小容量注射剂车间风险评估报告如下:风险分析:(人流与物流)编号步骤子步骤风险影响S原因P控制措施D 起始RPN风险水平验证活动1人流进入车间未经批准的人员进入车间未进行正确更衣厂房使用不当产品污染来自于外部环境的活粒子及非活性粒子污染厂房3进入控制设计不当不符合SOP缺乏培训2人工控制记录设计上只有经过更衣室才能进入车间SOP 到位培训到位2 12 中检查车间的进入控制及人流检查车间的进入控制及人流SOP(卫生及更衣)以及培训情况2物流进入车间非预期物料进入车间物料未经清洁进入车间物料进入车间的程序不当物料包装的污染导致厂房与产品污染4进入控制设计不当不符合 SOP缺乏培训3物料进入控制SOP 到位2 24 高检查物料进入车间的控制检查SOP(卫生及更衣)以及培训到位,1.人流、物流进入车间都存在污染的高风险,通过对操作人员的培训和控制(比如采用监控的方式),风险已经降至可接受水平。
工艺设备循环设施编号步骤子步骤风险影响S原因P控制措施D 起始RPN风险水平验证活动3 纯化水用于安瓿的预清洗纯化水质量不当有颗粒和化学残留 3设施污染 1周期性取样在线监测(电导率、酸碱度) 3 9 中仪表校准检查纯化水的质量4注射用水安瓿的最后清洗注射用水质量不当存在颗粒化学污染微生物污染4 设施污染 1周期性取样在线监测(电导率、温度) 2 8 中仪表校准检查注射用水质量5 用于配料和配料罐、过滤器、灌装机的清洗6 压缩空气用于过滤器完整性测试、配料罐压空药液压缩空气质量不当存在颗粒微生物污染4 设施污染使用点过滤器损坏1周期性取样按规程对过滤器进行完整性测试3 12 高检查压缩空气质量执行及记录过滤器完整性测试的规程到位7 纯蒸汽用于配料罐、、灌装机、的消毒压力温度不够目标消毒不成功 3操作不当1规程规定操作 3 9 中---第 2 页共 13 页2.工艺设备循环系统的纯化水、注射用水、压缩空气和纯蒸汽存在中风险和高风险,通过采用校验仪表、完善操作规程、对过滤器进行完整性检查,风险已经降至可接受水平,但生产过程中须加强水质监控,如:微生物和细菌内毒素监测。
新版注射液风险评估报告

XXXX注射液风险评估报告文件编号:REP.04.1102.0012012年12月报告批准QA主管:年月日QC主管:年月日制剂车间主任:年月日生产部经理:年月日工程部经理:年月日质量总监:年月日质量受权人:年月日副总经理:年月日1基本内容1.1目的对XXXX注射液生产过程的所有工序进行风险评估分析,确认各生产工序的相关潜在风险及应采取的控制措施,以最大限度地降低各种风险,确保将影响产品质量的各种风险控制在可接受的范围内。
1.2范围本报告适用于XXXX注射液所有生产工序及所涉及的关键设施设备的风险评估。
生产工序包括:安瓿清洗、药液配制、灌封、灭菌、灯检、包装等;主要工艺设备包括:配料罐、洗瓶机、灌装机、灭菌器、灯捡台、包装设备等;关键设施包括:纯化水系统、注射用水系统、纯蒸汽系统、压缩空气系统、空调系统等。
1.3职责以下部门/人员作为风险评估小组成员,参与完成风险评估工作并批准风险评估报告。
2程序与结果2.1风险管理流程风险管理流程如下:1、风险识别:系统地运用信息来辨别危险因素,这些信息可能包括历史数据、理论分析、意见等。
确定事件并启动质量风险管理,收集背景信息并确定质量风险管理项目小组人员及资源配置。
2、风险分析:在项目策划和设计开发时,对项目进行风险分析,风险分析的评估和结果应记录在风险管理文档中。
3、风险控制:根据风险可接收准则,判断每个危害的风险,是否达到可接受水平,在风险评价中可以使用风险评价表,对需要降低的风险或消除的风险,应进行风险控制。
风险控制措施及其实施、验证、评价、分析结果须记录在风险管理文档中。
4、风险降低:确定风险降低的方法。
当风险超过可接受的水平时,风险管理将致力于减少或避免风险。
包括采取行动来降低风险的严重性或风险发生的可能性。
5、风险接受:确定可接受的风险的最低限度。
对于一些类型的伤害,甚至最好的质量风险控制措施也未必能全部消除风险,在这些情况下,可以认为已应用了恰当的质量风险管理策略,并将质量风险降低到了可接受(参数范围、标准)的水平。
脂肪乳氨基酸葡萄糖注射液说明书卡文
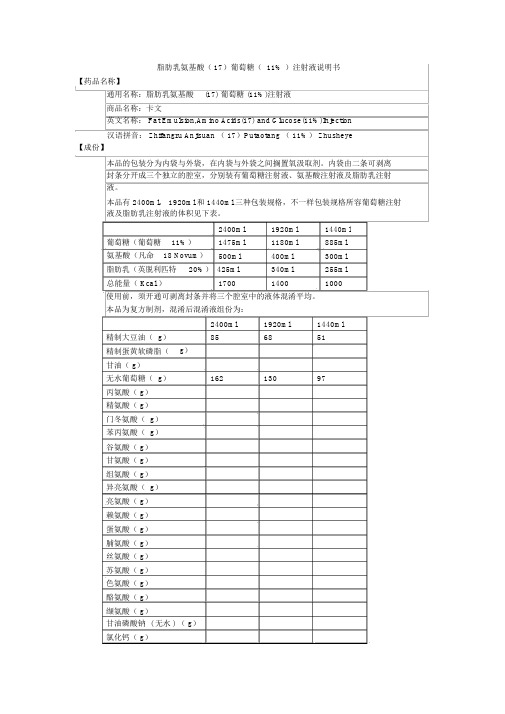
脂肪乳氨基酸( 17)葡萄糖( 11% )注射液说明书【药品名称】通用名称:脂肪乳氨基酸(17) 葡萄糖 (11%)注射液商品名称:卡文英文名称: Fat Emulsion,Amino Acids(17) and Glucose(11%)Injection汉语拼音: Zhifangru Anjisuan ( 17)Putaotang ( 11%) Zhusheye【成份】本品的包装分为内袋与外袋,在内袋与外袋之间搁置氧汲取剂。
内袋由二条可剥离封条分开成三个独立的腔室,分别装有葡萄糖注射液、氨基酸注射液及脂肪乳注射液。
本品有 2400ml, 1920ml 和 1440ml 三种包装规格,不一样包装规格所容葡萄糖注射液及脂肪乳注射液的体积见下表。
2400ml 1920ml 1440ml 葡萄糖(葡萄糖11%)1475ml 1180ml 885ml氨基酸(凡命18 Novum)500ml 400ml 300ml脂肪乳(英脱利匹特20%) 425ml 340ml 255ml总能量( Kcal )1700 1400 1000使用前,须开通可剥离封条并将三个腔室中的液体混淆平均。
本品为复方制剂,混淆后混淆液组份为:2400ml 1920ml 1440ml精制大豆油( g)85 68 51精制蛋黄软磷脂(g)甘油( g)无水葡萄糖( g)162 130 97丙氨酸( g)精氨酸( g)门冬氨酸( g)苯丙氨酸( g)谷氨酸( g)甘氨酸( g)组氨酸( g)异亮氨酸( g)亮氨酸( g)赖氨酸( g)蛋氨酸( g)脯氨酸( g)丝氨酸( g)苏氨酸( g)色氨酸( g)酪氨酸( g)缬氨酸( g)甘油磷酸钠 ( 无水 ) ( g)氯化钙( g)氯化钾( g)硫酸镁( g)醋酸钠( g)折合:氨基酸( g)57 45 34氮( g)脂肪( g)85 68 51碳水化合物葡萄糖 ( 无水 ) ( g)162 130 97电解质 :钠 (mmol) 53 43 32钾 (mmol) 40 32 24镁 (mmol)钙 (mmol)磷 (mmol) 18 14 11硫酸盐 (mmol)氯 (mmol) 78 62 47醋酸盐 (mmol) 65 52 39能量总能量 (kcal) 约1700 1400 1000非蛋白热卡 (kcal) 约1500 1200 900重量浸透压约 830mosm/kg H2O容积浸透压约 750mosm/LpH 值约本品辅料为精制蛋黄软磷脂、甘油(无水)和注射用水,用适当冰醋酸调理氨基酸注射液 pH,适当氢氧化钠调理脂肪乳注射液pH。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【最新资料,WORD文档,可编辑修改】1.简介脂肪乳氨基酸(17)葡萄糖(11%)注射液,商品名卡文,系由费森尤斯卡比集团公司研制,自2004年起由XX公司进口销售。
经费卡董事会批准XX公司接受费卡公司就该产品的技术转移,在XX公司无锡生产基地建造生产线,产品供应中国市场并出口至亚太地区市场。
项目分为生产线建设和产品注册两个相互影响的部分。
由于国内药品生产注册申请受理前要求必须具备实际的生产线并经验证生产出注册报批样品,在等待审批过程中必然存在生产设备投资的闲置问题。
由于生产设施中自动化制袋/灌装/装外袋的设备投资很大,为求得产品注册进展,项目费用、生产能力和市场需求的最优平衡,决定分两个阶段建设生产设施:第一阶段,2008年实现投资较低的进口成品空袋、半自动灌装,每小时灌装200袋的生产能力,以达到年产100万袋的产能,产品可满足国内市场需求。
但其中配制、灭菌、灯检、装箱等设备和公用工程应能为第二阶段每小时900袋的生产能力配套。
第二阶段,2010年投资一套全自动的制袋/灌装/装外袋的设备,以取代第一阶段的半自动设备,产品除满足国内市场外,还可供应亚太地区。
根据上述项目建设策略,因灌装速度的限制,会存在配制批量、灭菌能力超过第一阶段的灌装能力的问题。
主要表现为:如以1440ml规格的产品计算,脂肪乳注射液最大配制批量2000升生产,灌装时间会达到40小时;以最小批量1000升生产,则需要的灌装时间为20小时。
1920ml规格的产品灌装时间分别低于上述数据。
通常,营养类输液产品灭菌前存放时间超过12小时,应考虑灭菌前微生物繁殖导致的产品无菌保证和细菌内毒素质量的风险,并采取有针对性的措施控制风险。
而就产品的理化质量而言,只要产品灌装前和灌装后具有同样的氮气保护,相对于产品2年以上的稳定性保证,几十小时的灌装时间不会造成特殊的风险。
本文以产品的无菌保证和细菌内毒素质量风险控制为目标,通过分析药液长时间灌装导致微生物繁殖的各种风险因素,说明项目在设备与工艺设计、质量控制策略等方面采用的全面的风险控制策略与方案,并结合相应的验证和试验结果,以评估产品的实际风险控制水平。
2.风险评估2.1风险因素分析本项目的最大潜在风险因素在于药液自配制完成至开始灭菌最长可能有48小时的时间。
作为营养性输液产品,药液中存在的微生物可能以产品为底物大量繁殖,造成灭菌前微生物无法控制进而超出灭菌工艺的能力,威胁产品无菌保证水平;同时也可能使革兰氏阴性菌的代谢物细菌内毒素超出安全水平。
产品中细菌繁殖的总量取决于药液温度、微生物的种类、时间以及药液的特性,如pH、可供微生物利用的成分等。
在本项目中,药液等待灭菌的时间是最应关注的因素。
此外,微生物的数量还与灭菌微生物初始污染量、污染种类以及药液的温度和性质有关;细菌内毒素数量与污染菌的种类和数量相关。
此外,细菌内毒素主要来自于原料中已有的内毒素和药液中微生物大量繁殖的代谢产物。
由于原料中的内毒素能均匀分布溶解在药液中,通过抽样检查可以准确掌握整批产品来自原料的内毒素情况。
而来自药液灭菌前微生物繁殖的内毒素,在各产品包装中可能不均匀,必须通过控制微生物的繁殖来间接控制该来源的内毒素。
总体上,控制药液中灭菌前的微生物总量,就能控制相应的细菌内毒素风险。
以下分析着重讨论微生物的风险因素控制。
2.1.1 微生物的初始污染导致微生物初始污染的原因有以下多种方面:⑴原料中的微生物,通过产品配制进入药液,⑵配制过程中来自环境和人员操作的微生物,⑶设备中残存的微生物⑷包装材料中的微生物2.1.2 污染的种类从控制的角度,微生物污染的种类是不可控的,但对污染菌的鉴别有助于对产品质量的评价。
2.1.3时间整个灭菌前的时间分为配制时间、灌装时间和灌装后待灭菌时间。
由于配制在高温下进行,一般生长态微生物能被杀死,而芽孢态微生物在此高温条件下不死亡也不会繁殖,因此配制过程的时间可以不予考虑。
需要考虑的是配制完成药液冷却到室温后开始转移进入储罐直至灭菌开始的时间。
本产品最大灌装时间系生产1440ml规格产品时,配制2000升的脂肪乳注射剂,其灌装时间达到40小时,加上药液转移入储存罐、灌装后等待灭菌的时间,生产方法规定总共不超过48小时。
在设计验证方案时,以48小时为挑战时间。
2.1.4产品特性分析三个单元产品分别为氨基酸溶液、脂肪乳液和葡萄糖溶液,其理化性质各异,各有敏感的微生物。
从公司掌握的微生物经验,葡萄糖、氨基酸液的pH较低,一般微生物不宜在其中繁殖。
脂肪乳比较适宜微生物的生长。
2.1.5温度适宜的温度是微生物繁殖的重要条件。
三个产品均在高温下配制,其中葡萄糖和氨基酸注射液冷却到室温储存,而脂肪乳特别冷却到2-10℃储存。
低温能抑制微生物生长。
2.2风险控制策略与方案风险控制策略与方案应针对风险因素。
2.2.1设备与工艺设计生产设备与工艺设计的总体目标是尽可能降低药液被微生物污染的风险。
整个配制灌装系统都设计为计算机程序控制的全封闭系统,能经自动在线灭菌程序(SIP)对包括药液过滤器内的整个系统灭菌,灭菌完成后充入经0.22微米过滤的氮气正压保护,理论上只要维持正压,即能保证设备内表面的无菌状态。
配制好的氨基酸溶液和葡萄糖溶液,可经0.22微米的除菌过滤器滤除由原料带入药液的微生物,得到无菌溶液,并在灌装罐中在室温下无菌储存。
脂肪乳液(Intralipid 20%)的灌装罐带有冷却加套和温度测定控制系统,保证脂肪乳液储存在2-10℃。
该设计基于费卡公司(前身为Kabi Pharmacia公司)多年的生产实践。
该公司的生产常规为将匀化后的乳液冷却至2-10℃并在该条件下储存,可达40小时。
在此基础上,我公司预测延长至48小时是可行的。
因此,从设计可以保障药液在等待灌装的期间污染微生物或微生物爆发性繁殖的风险很小。
2.2.2微生物的初始污染⑴原料中的微生物①对每种主要原辅料均制定了内控微生物限度和细菌内毒素限度标准,以减少进入药液的微生物总量和细菌内毒素量。
以最大批量2000升脂肪乳液,2400升氨基酸液,7000升葡萄糖液的工艺配方组合计算,最差情况下配制完成后氨基酸液中的微生物初始污染水平为12×106cfu,相当于葡萄糖液中为15×106cfu。
两种溶液均经过Pall公司的20英寸0.22微米除菌过滤器,其有效过滤面积为16800cm2,以对细菌截留效率107/cm2计,该型过滤器的截留细菌能力远远超过药液中的带菌量,理论上能获得无菌的氨基酸溶液和葡萄糖溶液。
因脂肪乳液无法通过0.22微米过滤器,故对配制脂肪乳的水、甘油溶液分别通过0.22微米除菌过滤,大豆油通过0.45微米过滤,氢氧化钠配制成1M的溶液后投料(一般微生物在强碱液中无法生存)。
0.45微米过滤器常虽然不作为药液除菌过滤器使用,但其孔径小于绝大多数微生物的尺寸,广泛用于无菌检查和微生物限度检查中,实际上对微生物也有相当好的截留作用。
因此由原料带入脂肪乳中初始污染微生物主要来自卵磷脂,不超过2.6×106cfu。
②配制温度较高,其中氨基酸配制温度起始为约80℃,葡萄糖溶液起始约80℃,脂肪乳约70℃,一般生长态的微生物可以被杀死。
工艺验证报告836-PQ-R1总结了对三批验证生产中配制灌中微生物初始污染量的数据:该验证数据说明配制过程能杀死大部分生长态的微生物,药液在过滤前的污染水平已经很低,原料的微生物限度标准足够严格。
生产方法中规定各药液灭菌前污染菌浓度纠偏限度为100cfu/100ml,与公司多年生产的其他输液类产品相同。
⑵配制过程中来自环境和人员操作的微生物尽管采用了密闭性良好的配制灌装系统,能有效防止环境微生物的侵入,但加强环境和人员微生物的控制有助于进一步降低产品污染风险。
配制间和灌装间的生产环境为符合欧盟标准的C级,药液暴露的灌装环境局部为A级。
空调净化系统系符合欧盟规范的计算机自控的恒风量系统,主要房间风量经初始调整验证确定后,24小时恒定风量连续运行,从而保证各房间换气次数及相邻房间之间气流方向的恒定。
风险最大的房间为灌装间,设计送风量10600m3/h,75%循环风,按每人每小时40m3新风量的洁净室设计规范,理论上可容纳60人同时工作。
房间风量设计和实测结果见下表:SOP10-120规定了空调净化系统高效过滤器、风量和层流系统风速的再验证,应每半年进行一次PAO(曾经为DOP)试验以及风速测定。
该洁净环境2009年4月经过静态验证,并于5月起转人动态监控。
按SOP5-319的要求,最终灭菌产品C级及以上区域有生产时每周监控一次,连续无生产时每月进行一次静态监测。
从空调净化系统和洁净环境验证及监控数据看,空调系统和洁净环境均能符合设计要求。
⑶设备中残存的微生物设备中残存微生物通过CIP出去,由SIP达到无菌保证。
在设备内充氮气并维持正压以保证维持已建立的微生物洁净状态。
其中,因长期储存药液,药液储罐至灌装机及其所属管道经CIP后必须经SIP,伴以最终充氮气保护,以达到并维持无菌状态;而配制系统则通过进行CIP达到微生物限度要求,并通过充氮气维持正压的措施保证微生物洁净标准。
同时,配制系统也能进行SIP并通过了验证。
验证报告836-PQ-R1总结了配制、灌装系统SIP的验证结果。
验证方法:通过经验对整个系统判断选取可能的冷点位置50个为测量点。
将50根热电偶放置在测量点设备的外表面并用隔热材料包裹。
运行SIP程序三次,记录F0值三组。
所有150个F0值数据都大于17分钟。
由于达到了过度杀灭的标准,决定不必进行微生物挑战试验。
清洁验证报告838-ClV-R1总结了三个验证批经CIP后的清洁验证数据,其中微生物清洁验证归纳如下:验证证明系统经CIP能使微生物水平符合验证合格标准。
设备残存微生物的风险受控⑷内包装材料中的微生物内包装袋由爱尔兰工厂定点生产。
在注册进口包装袋的过程中,对其生产、质量控制、储存、发运、接收、检验、储存、工厂使用等环节的质量可控进行了详细评估。
公司制定了包装袋质量控制标准,微生物限度为100cfu/袋,远低于灭菌前产品微生物限度;细菌内毒素标准为50EU/袋,远低于每袋产品允许的细菌内毒素总量。
上述控制使来自于包装材料的微生物和细菌内毒素降低到最小程度。
另外,由包装袋进入药液的微生物至灭菌的时间通常不超过8个小时(一般为5小时),微生物繁殖的风险较小。
SOP3-934规定了材料转移、使用过程的防止污染措施。
由包装材料向产品引入微生物的风险可以接受。
2.2.3污染的种类污染的种类无法预先控制。
通过对超过微生物限度标准的污染菌进行鉴别,有助于预测细菌内毒素的质量情况并指导污染原因的调查。
公司已有10多年使用API系统鉴别微生物种的经验,能为微生物污染原因调查提供技术支持。
