20190704 仿制口服片剂功能性刻痕设计和研究的一般要求(征求意见稿)
《口服固体制剂仿制药质量一致性评价工作》背景介绍与技术要求(上海药检所 谢沐风)-武汉药交会-文档资料

(4) 试验前应首先进行原料药在各pH值溶出介质中的稳定性
考察,以确保试验数据的准确测定。在日本橙皮书中,就罗 列了该药物在各种溶出介质中的稳定性数据。
企业如何剖析原研品的多条特征溶出曲线
<测定时间点>
普通制剂与肠溶制剂可为5、10、15、30、45、60、90、 120分钟,此后每隔1小时直至6小时止;缓控释制剂可为15、
(建议加入表面活性剂,按照以0.01%(w/v)
为起点、按照1、Biblioteka 、5级别逐步增加,不建 议采用1.0%以上浓度,无论溶出度结果如何, 依然进行比较)
体外溶出曲线比较的具体操作
< 原研制剂15分钟溶出量达85%以上时 > ★ 无需采用f1和f2因子比较。
★ 仿制制剂在15分钟内平均溶出率也达85%以上。
<装置与转速> <阐述故有错误理念> ★ 片剂:桨板法/50转起始。 ★ 胶囊剂:转篮法/50转或桨板法/50转(加沉降 蓝)。
<溶出介质体积>
※ 不建议采用小杯法,一律采用900ml或1000ml。 ※ 如样品浓度过低,可采用加大进样量至 50~500μl。
企业如何剖析原研品的多条特征溶出曲线
<试验参数的放宽> (1) 批间样品波动较大;(建议加大转速) (2) 多条溶出曲线最终溶出量均未达85%以上。
谢沐风
上海市食品药品检验所 xiemufengsina
请大家将手机调至“振动”
档!(包括闹钟、叫醒、工作 安排、约会等) 谢谢您的配合!
实施方案 详见国家药监局网站2019年2月16日公布的《 国 家食品药品监督管理局关于开展仿制药质量一致性 评价工作的通知》。 ★ 开展剂型的顺序 1. 口服固体制剂 → 注射剂 → 其他小众化剂型 2. 新版基药目录中的速释制剂 → 临床常用的速释 制剂 → 缓控释制剂等逐一进行
仿制药审评策略及案例——口服固体制剂

多种介质中对比研究的意义,一定要多种介质中 溶出/释放曲线都一致吗?
溶出度/释放度研究与评价
• 多种介质中溶出度/释放度对比研究 例1.某药物片剂
主药在水中极微溶解 原研药溶出度测定方法:桨法,50rpm,ph6.8 缓冲液, hplc检测,30min溶出不低于80%
溶出度/释放度研究与评价
提纲
• 口服固体制剂体内过程特点 • 口服固体制剂的研发 • 仿制口服固体制剂审评策略 • 溶出度/释放度研究与评价 • BE试验与评价
口服固体制剂的体内过程
崩解 崩 解 时 限
溶出/释放 溶释 出放 度度
吸收 生生 物物 利等 用效 度性
体循环
仿制口服制剂的研发
处方前工作
处方工艺
制剂基本特性
溶出度/释放度
主药在水中易溶 原研药溶出度测定方法:桨法,50rpm,ph1.0盐酸溶液,
hplc检测,30min溶出不低于75% 原研样品实测结果:15min溶出88%,20min基本全部溶出 对比研究:水、ph1.0、ph4.5中,原研药及仿制品均快速溶
出(15min溶出85%以上),但仿制药更快,5min即可溶 出90%。
溶出度/释放度研究与评价
• 多种介质中溶出度/释放度对比研究 ——进一步调研分析:
主药为弱酸性药物,在ph1.0盐酸中溶解度低。 原研产品对主药进行了微粉化处理。 修改工艺,对主药进行微粉化处理后,样品在 四种介质中溶出曲线均与原研药一致。 BE试验结果:生物等效
溶出度/释放度研究与评价
• 多种介质中溶出度/释放度对比研究 例2.某药物片剂
仿制口服固体制剂审评策略
• CMC审评—处方工艺评价—BE批样品的制备
国家药监局药审中心关于发布《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)》的通告

国家药监局药审中心关于发布《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)》的通
告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2020.10.21
•【文号】国家药品监督管理局通告2020年第35号
•【施行日期】2020.10.21
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局通告
2020年第35号
国家药监局药审中心关于发布
《化学仿制药口服片剂功能性刻痕设计和研究技术指导
原则(试行)》的通告
为推进化学仿制药口服固体制剂的研究与开发,在国家药品监督管理局的部署下,药审中心组织制定了《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审核同意,现予发布,自发布之日起施行。
特此通告。
国家药品监督管理局药品审评中心
2020年10月21日
附件:化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)。
咀嚼片(化学药品)质量属性研究技术指导原则(征求意见)
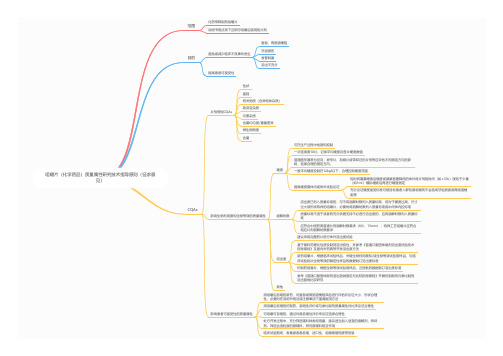
咀嚼片(化学药品)质量属性研究技术指导原则(征求意见)范围化药常释制剂咀嚼片说明书用法项下注明可咀嚼后服用的片剂目的避免或减少临床不良事件发生窒息、胃肠道梗阻牙齿损伤食管刺激溶出不充分CQAs提高患者可接受性片剂常规CQAs性状鉴别有关物质(含异构体杂质)致突变杂质元素杂质含量均匀度/重量差异微生物限度含量影响生物利用度和生物等效的质量属性硬度崩解时限溶出度其他影响患者可接受性的质量属性须咀嚼后吞咽的新药,对窒息或胃肠道梗阻风险进行评估并论证大小、形状合理性,必要时在说明书用法或注意事项下强调服用方法须咀嚼后吞咽的仿制药,吞咽性评价或与参比制剂质量属性对比来论证合理性可咀嚼可吞咽的,通过对易吞咽性评价来论证选择合理性处方开发过程中,充分筛选辅料种类和用量,建议适当加入适宜的崩解剂,矫味剂,筛选合适粒度的原辅料,研究原辅料相互作用临床试验期间,收集患者易吞咽、适口性、咀嚼难易程度等信息可在生产过程中检测和控制一次连续测10片,记录平均硬度及各片硬度数值普通圆形通常为径向;异形片、刻痕片或带印记的片剂等应评估不同测定方向的影响,选择合理的测定方向。
一般平均硬度控制在12kgf以下,合理控制硬度范围提高硬度需体内或体外试验论证短时间暴露唾液后硬度或崩解显著降低的体外将片剂短时间(如≤30s)浸泡于少量(如1ml)模拟唾液后再进行硬度测定充分论证硬度接受标准可被目标患者人群轻易咀嚼而不会造成牙齿损害或胃肠道梗阻等溶出度已列入质量标准的,可不将崩解时限列入质量标准,但对于硬度过高、尺寸过大或形状特异的咀嚼片,必要时将崩解时限列入质量标准或中间体内控标准质量标准不适于或者有充分依据支持不必进行溶出度的,应将崩解时限列入质量标准应符合中国药典普通片剂崩解时限要求(6片,15min);特殊工艺咀嚼片应符合相应片剂崩解时限要求建议采用完整药片进行体外溶出度试验基于原料药理化性质及制剂溶出特性,并参考《普通口服固体制剂溶出度试验技术指导原则》及国内外药典等开发溶出度方法新药咀嚼片,根据临床试验样品、关键生物利用度和/或生物等效试验用样品、与临床试验批次生物等效的稳定性样品的数据制订溶出度标准仿制药咀嚼片,根据生物等效试验用样品、注册批的数据制订溶出度标准参考《普通口服固体制剂溶出曲线测定与比较指导原则》开展仿制制剂与参比制剂溶出曲线比较研究。
2.化学药品仿制药口服固体制剂一致性评价申报资料要求(征求意见稿)

附件2化药仿制药口服固体制剂一致性评价申报资料要求(征求意见稿)第一部分:研究资料信息汇总表(研究综述部分)一、目录1.1 品种概述,简述原研产品情况)1. 1.2批准及上市情况1. 1.3临床信息及不良反应1. 1.4最终确定的处方、工艺及标准情况1. 1.5生物药剂学分类1.2 剂型与产品组成(CDE格式为1.3 产品再评价研究(参照CDE资料“产品开发”)1.3.2 制剂的再研发(相对处方、工艺有改变的品种),详述具体内容),详述具体内容)1.4 生产(参照CDE资料,删去与注射剂相关的叙述)1.4.6 临床试验/BE试验样品的生产情况1.5 原辅料的控制1.6 包装材料(基本同,考虑容器主要指注射剂,暂不在题目中强调)1.6.1 包装材料类型1.6.2 选择依据1.7 质量控制(基本同CDE资料1.7.1 质量标准1.7.2 分析方法1.7.3 分析方法的验证1.7.4 批检验报告1.8 对照品1.9 稳定性(参照CDE资料“1.10 参比制剂1.11 体外评价,例如杂质分析、晶型等)1.12 体内评价用于生物等效性试验的样品处方及生产规模不同规格产品的生物等效性试验情况生物等效性试验设计与实施试验受试者方案偏离安全性评估试验结果生物样本分析测定分析方法验证质量保证1.12.2 临床有效性1.13 综合评价1.14 参考文献1.15附件二、信息汇总表正文及撰写要求1.1 品种概述1.1.1 历史沿革说明同品种原研产品上市背景信息,包括品种治疗领域、国内外上市情况、立题的合理性分析。
提供包括原研药或国际公认的同种药物以及被仿制药的质量概况或文献资料来论证本品剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
1.1. 2 批准及上市情况介绍产品INN名、通用名、商品名等名称批准以及上市后变更情况。
说明再评价品种具体的已上市信息。
包括剂型,规格,批准时间(批准文号)、执行标准、标准号、有效期等内容。
已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿).doc

已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿).doc附件:已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)一、申请人应全面了解已上市注射剂的国内外上市背景、安全性和有效性数据、上市后不良反应监测情况,评价和确认其临床价值。
二、已上市注射剂属于具有完整和充分的安全性、有效性数据的,或被FDA橙皮书收载的,按本技术要求选择参比制剂,参照本技术要求和国内外相关技术指导原则开展一致性评价研究工作。
申报资料格式和内容参照CTD格式要求进行整理。
三、已上市注射剂不具有完整和充分的安全性、有效性数据的,开展药品再评价。
药品上市许可持有人根据注射剂药品科学进步情况、批准上市时的研究情况、上市后持续研究情况等进行综合分析,对其安全性、有效性和质量可控性进行再评价工作,具体办法另行发布。
四、参比制剂的选择作为参比制剂的原研产品应具有完整和充分的安全性、有效性数据作为上市依据,符合以上要求的,建议企业按以下顺序选择参比制剂:(一)首选国内上市的原研药品;如原研药品国内未上市,应选择欧美日已上市的原研药品(对于多个国家/地区的,建议依次选择在美国、欧盟和日本已批准上市的)。
如果原研药品在国外上市的处方不一致,申请人按照现有技术要求进行评估,选择更合理的原研药品。
(二)在原研企业停止生产的情况下,可选择美国橙皮书标识为RS的药品。
(三)对参比制剂选择有疑义的(专利问题除外),可与总局一致性评价办公室讨论确定。
五、处方工艺技术要求(一)处方注射剂仿制药中的辅料种类和用量通常应与参比制剂相同。
辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%-105%。
如附带专用溶剂,应与参比制剂的专用溶剂处方一致。
申请人可以提交与参比制剂抑菌剂、缓冲剂(含常规的pH调节剂)或抗氧剂不同的处方,但需标注不同之处,阐述选择的理由,并研究证明上述不同不影响所申请产品的安全性和有效性。
辅料的浓度或用量需符合FDA IID数据库限度要求,或提供充分依据。
化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求正式发布稿2020版

附件3化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求特殊注射剂是指与普通注射剂相比,特殊注射剂的质量及其活性成分的体内行为受处方和工艺的影响较大,可能进一步影响制剂在体内的安全性和有效性,例如脂质体、静脉乳、微球、混悬型注射剂、油溶液、胶束等。
特殊注射剂化学仿制药原则上应符合《化学药品注射剂仿制药质量和疗效一致性评价技术要求》的要求,本文件系在此基础上的补充,旨在提出特殊注射剂仿制药研发的整体思路和一般原则,为特殊注射剂仿制药的研发提供技术指导。
一、总体考虑对于特殊注射剂,由于制剂特性的复杂性,应基于制剂特性和产品特征,采取逐步递进的对比研究策略,通常首先开展受试制剂与参比制剂药学及非临床的比较研究,然后进行人体生物等效性研究,必要时开展进一步的临床研究。
若药学研究和/或非临床研究结果提示受试制剂与参比制剂不一致,申请人应考虑对受试制剂处方工艺进一步优化后重新开展研究。
二、药学研究根据《化学药品注射剂仿制药质量和疗效一致性评价技术要求》,特殊注射剂一致性评价在按照上述技术要求开展研究的同时,还需根据特殊注射剂的特点,参照FDA、EMA 发布的特殊制剂相关技术要求,科学设计试验。
建议关注以下问题:(一)处方工艺处方原则上应与参比制剂一致,建议对辅料的型号及可能影响注射剂体内行为的辅料的CQA进行研究。
特殊注射剂的生产工艺可能影响药物体内行为,需深入研究;对于采用无菌工艺生产的特殊注射剂,需特别注意各生产步骤的无菌保证措施和验证。
注册批和商业批的生产工艺及批量原则上应保持一致。
注册批样品批量参照发布的《化学仿制药注册批生产规模的一般性要求(试行)》执行。
(二)质量研究考察的关键质量属性可能包括但不限于以下内容:理化性质(如性状,黏度,渗透压摩尔浓度,pH值/酸碱度等),Zeta电位,粒子形态,粒径及分布(如D10,D50,D90等),体外溶出/释放行为,游离和结合药物,药物晶型和结晶形态。
可分割刻痕片设计和体外评价的基本考虑

可分割刻痕片设计和体外评价的基本考虑作者:石靖(CDE)来源:中国医药工业可分割的刻痕片是指带有一道或多道刻痕,以便于进行剂量分割的片剂。
在实际应用中,分割片剂存在片剂破碎、分剂量不准确等风险,因此国外的一些监管机构对刻痕片分割后部分的关键质量控制提出了一些技术要求。
本文在总结上述技术要求的基础上,针对可分割刻痕片的设计和体外质量研究提出了建议,希望为后续类似产品的研发提供一定的参考。
刻痕片( scored tablets) 一般是指带有一道刻痕( 一字型)、两道刻痕( 十字型) 或多道刻痕的片剂。
生产片剂时压制刻痕的作用一方面是在片剂上做一定的标示,如特定的生产商或特定的规格等。
另一方面的重要功能是为了便于分割片剂,这种带有功能性刻痕(functional score) 的片剂也是本文重点讨论的可分割的刻痕片。
可分割的刻痕片设计的主要目的在于:有时老年、儿童和一些特殊患者吞服固体片剂比较困难,通过将整片掰成多片可解决这方面的问题;对于一些特殊的药物,生产线无法满足最小剂量的片剂要求,可通过刻痕片放大剂量解决;从经济方面讲,刻痕片由于其剂量调整更加灵活,可以一定程度上节省药物的治疗花费。
根据文献的统计数据,分割片剂已经成为临床上调节剂量普遍使用的一种方法。
中国住院药房中使用率达到25.8%[1] ;在德国,约有49%的初级保健患者将片剂进行分割[2] ;在英国,一项针对养老院的调查显示,超过80%的护理服务中存在捣碎药片或打开胶囊的做法[3] ;另一项在澳大利亚进行的研究表明,养老院使用的药物中有34%在服药前改变了原本的剂量[4]。
常见的适应证领域均可能涉及带有刻痕的片剂,并且分割方式多种多样,包括手掰法,剪刀、刀片和切药器分割等。
在片剂上压制刻痕,可以较大程度地增加分割片剂的便利性,但研究同时也显示刻痕片的形状、大小、厚薄、曲率以及刻痕线的形状、深度均可影响刻痕片分剂量的准确性[5]。
实际使用中,刻痕片主要存在的问题包括:刻痕片不易分割,分割时由于出现粉末或碎片导致药量损失[6]、分割导致剂量不均匀等[7—8]。
已上市化学仿制药注射剂一致性评价与衡量技术地要求征求意见稿子

附件:已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)一、申请人应全面了解已上市注射剂的国内外上市背景、安全性和有效性数据、上市后不良反应监测情况,评价和确认其临床价值。
二、已上市注射剂属于具有完整和充分的安全性、有效性数据的,或被FDA橙皮书收载的,按本技术要求选择参比制剂,参照本技术要求和国内外相关技术指导原则开展一致性评价研究工作。
申报资料格式和内容参照CTD格式要求进行整理。
三、已上市注射剂不具有完整和充分的安全性、有效性数据的,开展药品再评价。
药品上市许可持有人根据注射剂药品科学进步情况、批准上市时的研究情况、上市后持续研究情况等进行综合分析,对其安全性、有效性和质量可控性进行再评价工作,具体办法另行发布。
四、参比制剂的选择作为参比制剂的原研产品应具有完整和充分的安全性、有效性数据作为上市依据,符合以上要求的,建议企业按以下顺序选择参比制剂:(一)首选国内上市的原研药品;如原研药品国内未上市,应选择欧美日已上市的原研药品(对于多个国家/地区的,建议依次选择在美国、欧盟和日本已批准上市的)。
如果原研药品在国外上市的处方不一致,申请人按照现有技术要求进行评估,选择更合理的原研药品。
(二)在原研企业停止生产的情况下,可选择美国橙皮书标识为RS的药品。
(三)对参比制剂选择有疑义的(专利问题除外),可与总局一致性评价办公室讨论确定。
五、处方工艺技术要求(一)处方注射剂仿制药中的辅料种类和用量通常应与参比制剂相同。
辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%-105%。
如附带专用溶剂,应与参比制剂的专用溶剂处方一致。
申请人可以提交与参比制剂抑菌剂、缓冲剂(含常规的pH调节剂)或抗氧剂不同的处方,但需标注不同之处,阐述选择的理由,并研究证明上述不同不影响所申请产品的安全性和有效性。
辅料的浓度或用量需符合FDA IID数据库限度要求,或提供充分依据。
过量投料(overage):建议参考ICH Q8相关要求。
口服固体处方工艺变更技术要求及案例分析

口服固体处方工艺变更技术要求及案例分析
第19页
工艺验证
—工艺验证基本要素:
批号、批量、生产设备、工艺条件和关键工艺步
骤、关键工艺参数及工艺参数可接收范围、中间体控 制、各项检测抽样方法及计划、检测方法、验证结果 。
口服固体处方工艺变更技术要求及案例分析
第10页
案例分析:XXXX片
变更理由:改变工艺,提升生产效率 变更事项:由主药与辅料熔融分散后制粒,改为主药
直接粉碎后湿法混合制粒。 变更评定
难溶性药品,存在多晶型问题(其中B晶型为有效 晶型)。
因为主成份在熔融状态和直接粉碎状态下,其晶 型可能会发生改变,进而对产品临床效果造成影响, 属于重大变更。 变更研究:应建立有针对性方法,证实变更前后制剂 中原料晶型没有发生改变。
口服固体处方工艺变更技术要求及案例分析
第31页
高溶解性,低通透性原料药
—药品渗透过程是吸收主药限速步骤 —首选标准中溶出度检验条件
低溶解性原料药
—药品溶出过程会影响体内吸收
—溶出比较试验要求不一样pH介质进行溶出比较,如 水、0.1M盐酸溶液、pH4.5-7.5缓冲液
普通不使用含有机溶剂介质,有充分依据,介质中可 加适量表面活性剂
口服固体处方工艺变更技术要求及案例分析
第33页
BE评定
—普通来说,Ⅲ类变更可能影响到体内效果发挥,应 该进行BE研究
—详细情况应结合变更类型、原料药性质、既往研究 基础、原研品信息、国内外相关资料进行评定
—申请免去生物等效性试验,可考虑进行临床验证
葡萄糖酸钙片等14个口服制剂药学研究技术要求

葡萄糖酸钙片药学研究技术要求一、品种概述葡萄糖酸钙为补钙剂,参与骨骼的形成与骨折后骨组织的再建以及肌肉收缩、神经传递、凝血机制并降低毛细血管的渗透性等。
本品的适应症:用于预防和辅助治疗钙缺乏,如骨质疏松、手足搐搦症、佝偻病以及儿童、妊娠和哺乳期妇女、绝经期妇女、老年人钙的补充;用法用量:口服。
一次1-4片(以钙计:45毫克-180毫克),一日3次。
FDA、EMA、HMA、PMDA药物批准数据库均未查询到葡萄糖酸钙片产品信息。
目前国内有119个葡萄糖酸钙片批准文号,规格为5mg、10mg,按OTC 药物管理。
ChP2020、USP43、EP10.2、BP2020均收载了葡萄糖酸钙原料药,ChP2020、USP43、BP2020均收载了葡萄糖酸钙片剂。
二、药学要求1、原辅料葡萄糖酸钙的内控标准应不低于中国药典2020年版二部标准,同时需结合其制备工艺路线、结构及国外药典(EP10.2/BP2020)完善杂质(包括有机杂质、潜在致突变杂质、残留溶剂等)研究和控制,制定合理的控制限度。
其他:氯化物、有机杂质和硼酸、镁盐和碱金属盐、含量需参照EP10.2/BP2020进行严格控制,硫酸盐需参照USP43进行严格控制。
2、处方结合剂型的特点,选择适宜的辅料进行处方筛选和优化,辅料用量应在常规用量范围内(如FDA非活性成分数据库)。
3、生产工艺应对生产工艺及工艺参数进行详细研究,确定影响产品质量的关键工艺步骤和关键工艺参数,并建立有效的过程控制。
4、质量研究(1)质量属性本品质量属性应包括但不限于性状、鉴别、有关物质、溶出度、微生物限度、含量等。
(2)质量控制国内外药典收载的葡萄糖酸钙片标准对比如下:拟定的质量标准控制项目和限度要求原则上应不低于上述国内外药典标准要求,并关注以下研究内容:①有关物质:需结合本品所用原料药的杂质概况、制剂处方工艺、降解途径研究结果和相关文献资料对制剂中可能存在的降解杂质进行全面分析和研究,根据质量研究和稳定性考察结果,制定合理的杂质控制限度,并订入质量标准。
奥卡西平刻痕片仿制药与原研药溶出行为及相关指标的一致性评价研究

奥卡西平刻痕片仿制药与原研药溶出行为及相关指标的一致性评价研究作者:吕蓓蓓杨海源程华魏文芝张敏娟来源:《中国药房》2020年第12期中图分类号 R917 文献标志码 A 文章编号 1001-0408(2020)12-1463-08DOI 10.6039/j.issn.1001-0408.2020.12.11摘要目的:评价奥卡西平刻痕片仿制药与原研药溶出行为的一致性,并比较两者的外观、半片制剂的脆碎度及分割质量损失以及不同企业原料药的晶型、晶体形貌。
方法:采用高效液相色谱法测定含量;采用桨法(设置转速60 r/min,温度37.0 ℃)测定仿制药与原研药在4种不同溶出介质[含0.6%十二烷基硫酸钠的盐酸溶液(pH=1.2)、含0.6%十二烷基硫酸钠的醋酸盐缓冲溶液(pH=4.5)、含0.6%十二烷基硫酸钠的磷酸盐缓冲溶液(pH=6.8)、含0.6%十二烷基硫酸钠的水溶液]中的累积溶出度,采用相似因子法评价两者溶出曲线的相似性,并评价半片与整片制剂的批内均一性;采用脆碎度检测仪及电子天平测定半片制剂的脆碎度及分割质量损失;采用X射线衍射仪及扫描电子显微镜观察不同企业原料药的晶型和晶体形貌。
结果:奥卡西平检测质量浓度的线性范围为33.42~401.09 μg/mL(r=0.999 9);定量限为0.10μg/mL,检测限为0.04 μg/mL;精密度、稳定性、重复性、耐用性试验的RSD均小于2%;回收率为99.80%~101.63%(RSD为0.37%~0.91%,n=3)。
仿制药A、B和原研药在4种不同溶出介质中90 min时的平均累积溶出度分别为92%、87%、90%[含0.6%十二烷基硫酸钠的盐酸溶液(pH=1.2)];94%、94%、90%[含0.6%十二烷基硫酸钠的醋酸盐缓冲溶液(pH=4.5)];95%、95%、91%[含0.6%十二烷基硫酸钠的磷酸盐缓冲溶液(pH=6.8)];97%、98%、95%(含0.6%十二烷基硫酸钠的水溶液)。
仿制制剂的处方工艺研究

仿制制剂的处方工艺研究处方名称:仿制制剂的工艺研究引言:仿制制剂是指根据原研制剂的成分及配方进行仿制的药物制剂,具有与原研制剂相同的药效和质量标准。
为了确保仿制制剂的质量、安全和疗效与原研制剂相一致,需要进行相关工艺研究。
本文将对仿制制剂的工艺研究进行探讨,以提供参考。
一、药物成分分析与选择:1. 率先对原研制剂进行药物成分分析,确定其组分及配比。
2. 根据药品工艺的要求和原研制剂的成分,选择相适宜的药物原料进行合理的比例配比。
二、工艺流程研究:1. 设计仿制制剂的工艺流程,确保原研制剂的制剂步骤得到合理保留。
2. 研究原研制剂工艺中的每个环节,确定操作的温度、时间和方法。
3. 在工艺流程中添加合适的辅料,以提高仿制制剂的稳定性、延长保存期限。
三、制剂工艺优化:1. 在仿制制剂的制剂过程中,根据实际生产情况进行工艺参数的调整与优化,以提高产量和质量。
2. 对仿制制剂进行工艺验证和工艺评价,确保其疗效、质量和安全性符合规定标准。
四、质量控制与分析:1. 建立仿制制剂的质量控制标准,包括物理性质、化学性质和生物性质等方面。
2. 对仿制制剂进行质量分析,确定合理的质量控制方法和检测指标。
结论:通过对仿制制剂的工艺研究,我们可以确保仿制制剂与原研制剂在成分、工艺和质量方面的一致性。
在仿制制剂的工艺研究中,要注重实验室与工厂生产的结合,不断优化工艺流程,提高仿制制剂的稳定性和疗效。
同时,要加强质量控制和分析,确保仿制制剂的质量和安全性符合要求,为患者提供高质量的药物治疗服务。
五、工艺研究中的关键问题与解决方案:1. 药物成分分析与选择阶段可能面临的问题:在进行药物成分分析时,可能会遇到某些成分含量甚少或难以检测到的情况。
为解决这一问题,可以考虑采用更敏感的分析方法或通过了解相关文献和专家咨询等方式进行补充研究,确保成分的准确性和全面性。
2. 工艺流程研究中可能面临的问题:在设计仿制制剂的工艺流程时,需要确保原研制剂的制剂步骤得到合理保留。
化学药品仿制药口服固体制剂质量和疗效一致性 评价申报资料要求(试行)

化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)一、申报资料项目(一)概要1.历史沿革2.批准及上市情况3.自评估报告4.临床信息及不良反应5.最终确定的处方组成及生产工艺情况6.生物药剂学分类(二)药学研究资料7.(2.3.P,注:括号内为CTD格式的编号,以下同)制剂药学研究信息汇总表8.(3.2.P)制剂药学申报资料8.1.(3.2.P.1)剂型与产品组成8.2.(3.2.P.2)产品再评价研究8.2.1.(3.2.P.2.1)处方组成8.2.2.(3.2.P.2.2)制剂再研发(适用于处方、工艺有改变的品种)8.2.2.1.(3.2.P.2.2.1)处方再研发8.2.2.2.(3.2.P.2.2.2)工艺再研发8.3.(3.2.P.3)生产信息8.3.1.(3.2.P.3.1)生产商8.3.2.(3.2.P.3.2)批处方8.3.3.(3.2.P.3.3)生产工艺和工艺控制8.3.4.(3.2.P.3.4)关键工艺步骤和中间体的控制8.3.5.(3.2.P.3.5)工艺验证和评价(适用于工艺有改变的品种)8.3.6.(3.2.P.3.6)临床试验/生物等效性(BE)样品的生产情况8.4.(3.2.P.4)原辅料的控制8.5.(3.2.P.5)制剂的质量控制8.5.1.(3.2.P.5.1)质量标准8.5.2.(3.2.P.5.2)分析方法8.5.3.(3.2.P.5.3)分析方法的验证8.5.4.(3.2.P.5.4)批检验报告8.5.5.(3.2.P.5.5)杂质谱分析8.5.6.(3.2.P.5.6)质量标准制定依据8.6.(3.2.P.6)对照品8.7.(3.2.P.7)包装材料8.8.(3.2.P.8)稳定性8.8.1.(3.2.P.8.1)稳定性总结8.8.2.(3.2.P.8.2)后续稳定性承诺和稳定性方案(适用于处方、工艺有改变的品种)8.8.3.(3.2.P.8.3)稳定性数据(三)体外评价9.参比制剂9.1.参比制剂的选择9.2.基本信息9.3.质量考察9.4.溶出曲线考察9.5.溶出曲线稳定性考察(适用于理化性质不稳定品种)10.质量一致性评价10.1.国内外质量标准收载情况比较10.2.关键质量属性研究10.3.参比制剂与被评价制剂的检验结果11.溶出曲线相似性评价11.1.建立体外溶出试验方法11.2.批内与批间差异考察11.3.溶出曲线相似性比较结果(四)体内评价12.(2.5. P)制剂临床试验信息汇总表13.制剂临床试验申报资料13.1.(5.2)临床试验项目汇总表13.2.(5.3)生物等效性试验报告13.2.1.(5.3.1.2.1)空腹生物等效性试验报告13.2.2.(5.3.1.2.2)餐后生物等效性试验报告13.2.3.(5.3.1.4)方法学验证及生物样品分析报告13.3.(5.3.5.4)其他临床试验报告14.参考文献及相关实验数据研究资料二、申报资料项目说明工艺如有变化,应以文字或列表方式说明变更前、后生产工艺主要变化(包括对于仅涉及工艺变化、未涉及处方变化的品种,也应列出制剂处方,并核实与已批准的处方的一致性。
20190704 仿制口服片剂功能性刻痕设计和研究的一般要求(征求意见稿)

仿制口服片剂功能性刻痕设计和研究的一般要求带有功能性刻痕的片剂(可分割的刻痕片)是指带有一道或多道刻痕,以便于进行剂量分割的片剂。
研究显示刻痕线的存在与否及其形状、深度,刻痕片的形状、大小、厚薄、曲率均可能影响片剂分剂量的准确性,进而影响患者临床使用时的安全性和便利性。
为了完善仿制药注册申请的技术标准,我中心参考各国监管机构相关的技术要求并结合中国药典及国内仿制药研发与生产现状,制定技术要求如下:一、仿制口服片剂功能性刻痕的设计根据《化学药品注册分类改革工作方案的公告》对于仿制药的定义:即具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量的原料药及其制剂。
相同的刻痕特征可以保证患者使用仿制片剂时能够采用与原研药品(参比制剂)相同的方式进行片剂的分割,因此为了充分的保证临床使用中的可替换性,仿制片剂的功能性刻痕应该与参比制剂保持一致。
如参比制剂未带功能性刻痕设计,仿制片剂不建议设计刻痕。
1.1对于已申报的仿制片剂,说明书中如明确描述需进行分剂量使用的情况,比如有“可掰开服用”或“半片”的描述,如申报产品未参照参比制剂设计功能性刻痕,应增加刻痕并进行相关的研究,符合要求方能获得批准。
如说明书中未明确,可在药品批准上市后进一步完善相关的研究。
1.2本技术要求发布之后申报的品种,仿制片剂的功能性刻痕应该与参比制剂保持一致。
1.3按照一致性评价申报的品种,研究要求同上述仿制片剂。
二、刻痕片的体外研究2.1基本要求分割方式的选择:必须进行手工分割方式的考察,同时采用一种机械的分割方式进行考察,如切片器、刀等,以保证不同原理的分割条件下产品均能够符合要求。
研究用样品:产品开发过程中的各阶段的代表性样品均应进行研究。
多规格的产品对于带有功能性刻痕的各个规格均应进行研究。
总体质量:分割后的部分的质量应能符合整片的质量标准。
2.2速释片剂的考察要求2.2.1重量差异或含量均匀度:根据《中国药典》2015年版四部的要求,若片剂分割后部分的理论剂量小于25mg或主药含量占比小于25%,应进行含量均匀度的检查。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
仿制口服片剂功能性刻痕设计和研究的一般要求带有功能性刻痕的片剂(可分割的刻痕片)是指带有一道或多道刻痕,以便于进行剂量分割的片剂。
研究显示刻痕线的存在与否及其形状、深度,刻痕片的形状、大小、厚薄、曲率均可能影响片剂分剂量的准确性,进而影响患者临床使用时的安全性和便利性。
为了完善仿制药注册申请的技术标准,我中心参考各国监管机构相关的技术要求并结合中国药典及国内仿制药研发与生产现状,制定技术要求如下:
一、仿制口服片剂功能性刻痕的设计
根据《化学药品注册分类改革工作方案的公告》对于仿制药的定义:即具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量的原料药及其制剂。
相同的刻痕特征可以保证患者使用仿制片剂时能够采用与原研药品(参比制剂)相同的方式进行片剂的分割,因此为了充分的保证临床使用中的可替换性,仿制片剂的功能性刻痕应该与参比制剂保持一致。
如参比制剂未带功能性刻痕设计,仿制片剂不建议设计刻痕。
1.1对于已申报的仿制片剂,说明书中如明确描述需进行分剂量使用的情况,比如有“可掰开服用”或“半片”的描述,如申报产品未参照参比制剂设计功能性刻痕,应增加刻痕并进行相关的研究,符合要求方能获得批准。
如说明书中未明确,可在药品批准上市后进一步完善相关的研究。
1.2本技术要求发布之后申报的品种,仿制片剂的功能性刻痕应
该与参比制剂保持一致。
1.3按照一致性评价申报的品种,研究要求同上述仿制片剂。
二、刻痕片的体外研究
2.1基本要求
分割方式的选择:必须进行手工分割方式的考察,同时采用一种机械的分割方式进行考察,如切片器、刀等,以保证不同原理的分割条件下产品均能够符合要求。
研究用样品:产品开发过程中的各阶段的代表性样品均应进行研究。
多规格的产品对于带有功能性刻痕的各个规格均应进行研究。
总体质量:分割后的部分的质量应能符合整片的质量标准。
2.2速释片剂的考察要求
2.2.1重量差异或含量均匀度:根据《中国药典》2015年版四部的要求,若片剂分割后部分的理论剂量小于25mg或主药含量占比小于25%,应进行含量均匀度的检查。
其他情况则可通过分割后部分的片重差异考察单位剂量均匀性。
上述检测时应注意,测试时取每个片子中一个分割部分进行测试,其他部分不用。
2.2.2分割重量损失:取15整片,在整片片剂拟定硬度范围的上限和下限处分别检测,分割后部分(二分片共30个半片,三分片共45个三分片)与15整片相比,重量损失应控制在
3.0%以内,掰片过程中的药片碎屑不应参与计算重量损失。
2.2.3脆碎度:分割后的部分在整片片剂拟定硬度范围的上限和下限处分别进行脆碎度检查,结果应符合《中国药典》2015年版四部
脆碎度检查的要求。
2.2.4 溶出度:分割后的部分应进行溶出测试,溶出结果应符合成品放行质量标准,测试样品量应不少于12个分割后的单位。
2.3 缓控释片剂
2.3.1使用骨架缓释技术的片剂
除应满足上述速释制剂的相关要求外,还应在整片片剂拟定硬度范围的上限和下限处分别取分割后部分与整片检测溶出曲线,比较相似因子(f2),应符合要求。
2.3.2使用包衣后压片技术的片剂(即微丸压片的产品)
除满足上述速释制剂的相关要求外,还应检测分割后部分的溶出曲线,与压片前的微丸、压片后的整片比较相似因子(f2),应符合要求。
一般而言,溶出曲线测定应在质量标准规定的介质中进行,测试样品量应不少于12个分割后的单位。
2.4 稳定性研究
推荐考察分割后部分在25℃±2℃/60%RH±5%RH条件下90天的稳定性。
也可根据产品的贮藏条件、包装形式、临床使用情况,参考《化学药物(原料药和制剂)稳定性研究技术指导原则》,拟定合理的稳定性考察条件和时限,必要时在说明书中加以规定。
2.5 变更研究
带有功能性刻痕的片剂如进行处方工艺的变更,由于处方工艺的
变更可能影响刻痕的可分割性,在进行变更研究时应同时参考上述要求,比较变更前后刻痕片的分割能力,作为评价变更前后产品质量差异的一部分重要数据。
增加或删除刻痕的变更,首先需结合参比制剂的刻痕特征确认增加或删除刻痕的合理性以及必要性。
由于增加和删除刻痕可能涉及处方和工艺的变更,应该根据《已上市化学药品生产工艺变更研究技术指导原则》等技术要求,进行变更程度的评估,并进行相应的研究。
对于增加刻痕的情况,同时需要进行刻痕片的分割能力考察。
如果处方和工艺变更评估后归类为“重大变更”,则需考虑进行生物等效性试验。
主要参考资料
[1] FDA Tablet Scoring: Nomenclature, Labeling, and Data for Evaluation.
[2] FDA MAPP 5223.2 Scoring Configuration of Generic Drug Products.
[3] FDA ANDA Submissions: Refuse-to-Receive Standards.
[4] EP Subdivision of tablets.
[5] WHO Pharmaceutical development of multisource (generic) pharmaceutical products - point to consider.。
