脂质体转染的实验原理与操作步骤
脂质体介导转染方法

脂质介导的短暂表达
实验材料
哺乳动物细胞
试剂、试剂
质粒DNA完全培养基氯化铯DMEM
盒
仪器、耗材
培养皿培养箱聚苯乙烯管
实验步骤
1. 按5×105细胞/孔的量在六孔板中接种指数期生长的细胞,在37℃ 5%CO2培养箱中
培养过夜,直至细胞80%汇片。
(如果用100 mm 培养皿代替六孔扳,则培养细胞至80%
汇片,将所有数量扩大8倍)
2. 在聚苯乙烯管中配制DNA/脂质体复合物如下:稀释质粒DNA至1 ml DMEM-SF中,
在旋涡混合器上振荡1 s 然后加入脂质体悬液、再次旋起混匀。
在室温下温育5~ 10 min,
使DNA与阳离子脂质体结合。
3. 吸去DMEM-SF培养液,用1 ml 的完全DMEM-SF洗1次,吸去DMEM-SF。
对毎
个35 mm 孔中,直接在细胞上加1 ml DNA/脂质体复合物。
在37℃培养箱中温育3~5 h。
4. 往每孔细抱中加入1 ml 的DMEM-20完全培养液,在37℃培养箱中继续温育24~48
h。
5. 吸去完全DMEM/DNA/脂质体复合物,毎孔加入2 ml 新的DMEM-10完全培养液,
继续搵育24~48 h。
6. 收集细胞:用细胞刮于刮下细胞,或胰蛋白酶消化或冻融裂解细胞。
进行适当的表
达分析。
脂质体进行稳定表达。
脂质体转染mrna细胞原理

脂质体转染mrna细胞原理
脂质体转染mRNA细胞的原理是利用脂质体作为载体,将目的mRNA包裹在其内部,然后通过与细胞膜融合让mRNA进入细胞质,最终达到将目的mRNA表达出来的目的。
脂质体是由磷脂和胆固醇等组成的微小囊泡结构,与细胞膜结构相似。
其内部的疏水层可以容纳水溶性的物质,包括mRNA分子。
脂质体转染mRNA的步骤如下:
1. 准备目的mRNA:目的mRNA是指需要转染到细胞内进行表达的mRNA,可以是外源的mRNA,也可以是经过In vitro 转录合成的人工合成mRNA。
这些mRNA一般会在实验室中事先准备好。
2. 制备脂质体:将脂质体粉末或液体悬浮液溶解在适当的缓冲液中,形成脂质体溶液。
脂质体通过磷脂的双层结构来包裹mRNA,形成稳定的脂质体-mRNA复合物。
3. 混合脂质体与mRNA:将目的mRNA与脂质体溶液混合,并进行充分的混合和搅拌。
这样就可以使mRNA和脂质体发生相互作用,形成脂质体-mRNA复合物。
4. 转染细胞:将脂质体-mRNA复合物加入到需要转染的细胞培养液中,使其与细胞接触。
脂质体复合物会与细胞膜融合,从而使脂质体内的mRNA进入细胞质。
5. mRAN转录和表达:在细胞质中,脂质体释放的mRNA会
被细胞的核糖体识别,进而进行mRNA转录和翻译,最终使
该mRNA编码的蛋白质在细胞内得到表达。
脂质体作为转染载体具有一定的优势,如制备简单、生物相容性好等。
但是,脂质体转染也存在一些问题,如转染效率较低、引起细胞毒性等。
因此,在实际应用中需对转染条件进行优化,以提高转染效率和减少毒性。
脂质体转染实验原理与操作步骤总(精)

脂质体转染的实验原理与操作步骤大全日期:2012-06-25 来源:互联网作者:青岚点击:3644次摘要:细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等, 理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等, 本文主要介绍细胞转染常用的方法 -脂质体转染的原理和操作步骤等。
找产品,上生物帮 >> >>细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等, 理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法 -脂质体转染的原理和操作步骤等。
脂质体 (lipofectin regeant, LR 试剂是阳离子脂质体 N-[1-2, 3-Dioleyoxy , Propyl]-n, n , n-Trimethylammonium Chloride(DOTMA和 Dioleoyl photidye-thanolamine(DOPE的混合物 [1:1(w/w]。
它适用于把 DNA 转染入悬浮或贴壁培养细胞中 ,是目前条件下最方便的转染方法之一。
转染率高,优于磷酸钙法,比它高5~100倍,能把 DNA 和 RNA 转染到各种细胞。
用 LR 进行转染时, 首先需优化转染条件, 应找出该批 LR 对转染某一特定细胞适合的用量、作用时间等,对每批 LR 都要做:第一,先要固定一个 DNA 的量和DNA/LR混合物与细胞相互作用的时间, DNA 可从1~5μg和孵育时间 6小时开始,按这两个参数绘出相应 LR 需用量的曲线,再选用 LR 和 DNA 两者最佳的剂量,确定出转染时间 (2~24小时。
因 LR 对细胞有一定的毒性,转染时间以不超过 24小时为宜。
细胞种类:COS-7、 BHK 、 NIH3T3、 Hela 和 Jurkat 等任何一种细胞均可作为受体细胞。
脂质体转染原理及操作步骤

脂质体转染原理及操作步骤脂质体转染是一种常用的基因传递技术,用于将外源的核酸(例如DNA、RNA)转入细胞内。
脂质体是由人工合成的类似于细胞膜的双层脂质膜组成,具有较好的生物相容性和可降解性,因此可以用来包裹并传递外源核酸进入目标细胞内。
本文将详细介绍脂质体转染的原理和操作步骤。
脂质体由两个疏水性脂质尾部和一个亲水性脂质头部组成,形成类似生物细胞膜的双层结构。
这种双层结构使得脂质体可以包裹水溶性的外源核酸,并形成脂质体-核酸复合物。
当复合物与细胞膜接触时,由于脂质体的类似性,这些复合物可以与细胞膜融合,并释放外源核酸进入细胞。
然而,简单地将脂质体-核酸复合物添加到细胞培养基中并不能有效地将外源核酸转入细胞内。
为了提高转染效率,常常需要使用电穿孔或钙磷共沉淀等方法,以增加细胞膜的通透性。
操作步骤:1.准备工作:-完整的脂质体转染试剂盒。
-DNA或RNA溶液。
-靶细胞。
-无菌操作条件下的实验室。
2.重组脂质体的合成:-按照试剂盒说明将脂质体复合物合成。
-使用无菌的工具和试剂。
3.核酸引物的制备:-将外源DNA或RNA与引物混合,使其形成核酸复合物。
4.细胞处理:-将培养皿中的细胞进行冲洗,去除培养基。
-将适量的细胞培养基添加到培养皿中,以保证细胞的正常生长。
5.导入核酸:-将所制备的核酸复合物滴加到细胞培养基中。
-将细胞培养皿置于无菌环境中,以便细胞吸收和利用核酸。
6.细胞培养:-按照细胞类型和所使用的培养基,将细胞置于恰当的培养条件下,并进行培养。
-根据需求添加所需要的生长因子和抗生素。
7.观察和分析:-在一定的培养时间后,观察细胞是否发生了显著的变化。
- 使用适当的实验方法(如PCR、Western blot等)检测外源基因的表达。
-观察并记录实验结果。
以上是脂质体转染的原理和操作步骤。
脂质体转染是目前常用的基因传递技术之一,可以用于研究基因功能、疾病治疗等领域。
随着技术的不断发展,转染效率和特异性将逐渐提高,为研究和治疗带来更多的机会和挑战。
脂质体转染操作步骤

脂质体转染操作步骤进行实验之前,请先规划好实验,一般细胞转染需要24h-72h,所以要充分了解细胞生长速度,计算所需脂质体和DNA的储备量,并确认准备好所需试剂:Opti-MEM无血清培养基,Lipofectamine转染试剂,以及DNA,这个一定要确认好。
1、细胞铺板(1)一般会选择复苏细胞传代3-4次(汇合率达到90%之前对细胞进行传代,不要长到100%),从解冻过程中恢复过来可以稳定生长的细胞进行细胞转染,传代次数高(>30-40)时,细胞的生长速度和形态会改变。
(2)如果提总蛋白,一般选择六孔板进行转染,因为转染的细胞提取蛋白的总量能达到200ug,一般够做并且需要的DNA和Lipofectamine又相对比较少。
(3)传代条件取决于所用的细胞系。
对于快速生长的细胞,倍增时间为16小时(如HEK293)。
对于生长缓慢的细胞,倍增时间为36小时(如原代细胞)。
(4)转染当天,将细胞铺板。
如果在转染前一天或更早时间铺板,转染效率可能下降,如果是简单细胞系的转染,可以直接在前一天晚上铺板,第二天来转染。
转染时,细胞密度会影响转染效率,细胞密度保持在汇合率为70-90%(这个前提是转染24h,如果转染48h则需要汇合率为50-70%),细胞的铺板和转染也可同时进行。
2、细胞转染吸去培养皿中的培养基,用PBS或者无血清培养基清洗一次。
更换无血清培养基。
准备转染制备液,用灭菌后的EP管制备。
以六孔板为例,A液:用200μl Opti-MEM稀释4μg质粒;B液:用200μl Opti-MEM稀释10μl lipo2000,分别将A液、B液轻轻混匀,静置5min,吸取B液加入至A液中,轻轻混匀,室温静置20min。
加入转染试剂到每个孔的培养基中,6h后,更换成完全培养基,继续培养到24-48小时(不同的质粒和脂质体最佳搭配比例不同,转染前,应该摸一个最佳配比。
质粒:脂质体=1:1,1:1.5,1:2,1:2.5,1:3,1:3.5的梯度比例来检测最佳转染比例,一般质粒有带荧光,可以通过观察每组荧光强弱来判断转染效率)。
贴壁细胞的脂质体转染

一、实验材料1、宿主细胞CHO(贴壁细胞)2、脂质体LIPOFECTAMINE 2000(invitrogen公司)3、6孔细胞培养版4、无血清培养基OPTI-MEM(GIBICO)5、转染级质粒二、实验步骤invitrogen的LIPOFECTAMINE 2000说明书上列举了24孔、12孔、6孔……板的实验体系,因为需要转染的细胞量大,所以一直采用的是6孔版做的转染。
以下是以6孔板为例说明一下我的体系和方法吧!1、转染前一天,以合适的细胞密度接种到6孔培养板上。
(我的接种密度是3~4*105/ml.)转染时,细胞要达到90~95%的融合。
2、溶液1:240ul 无血清培养基 + 10 ul lipofectamine 2000 per well (总体积250 ul)(温育5min)3、溶液2:X ul 无血清培养基 + 4 ug 质粒 per well(总体积250 ul)4、将溶液1与溶液2混合,室温下置20min。
5、与此同时,将6孔板中的细胞用无血清培养基冲洗细胞两遍后,加入2ml 无血清培养基。
6、将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀。
在37℃,5%的CO2中保温5~6小时。
7、6小时后,更换含有血清的全培养基,在37℃,5%的CO2中48~72h检测转染水平。
8、如果做稳定转染,换全培养基培养后24h,即可以1:10或更高的稀释比例(根据细胞的生长情况)接种到新的培养基。
三、个人经验:我觉得贴壁细胞的脂质体转染还是很容易的,有了经验之后,现在做转染得心应手,转染前后细胞的形态几乎不发生变化,几乎没有细胞死亡。
转染率很高。
以下是个人经验,与大家分享。
1.细胞的状态。
这点非常重要,不要急于求成,一定要让细胞处于最佳的生长状态再做。
有文献说传代不要超过17代。
我总是在细胞复苏后的3代左右做,那时细胞状态最好,不要用传了很多代的细胞去做,细胞的形态都会发生变化了。
2.细胞的融合度。
脂质体转染原理及操作步骤

脂质体转染原理及操作步骤
脂质体转染是一种常用的基因传递方法,通过将目标基因以及负载该基因的脂质体添加到细胞培养物中,使其与细胞膜融合,并将基因导入到细胞内。
脂质体转染的操作步骤如下:
1. 提取脂质体:首先,从脱脂牛奶或其它来源中提取脂质体。
可以通过超声处理、离心等方法将脂质体分离出来。
2. 混合目标基因与脂质体:将目标基因与脂质体混合,目标基因可以是质粒DNA、RNA等。
将基因加入脂质体溶液中,进
行充分混合。
3. 孵育:将脂质体-基因混合物在室温下孵育一段时间,通常
为15-30分钟。
这一步主要是让脂质体与基因充分结合。
4. 加入细胞:将孵育好的脂质体-基因混合物加入需要转染的
细胞培养物中。
细胞种类可以是哺乳动物细胞、脊椎动物细胞、细菌等。
5. 孵育细胞:将细胞培养物保持在适宜的培养条件下,孵育一定时间,让细胞充分吸收脂质体-基因复合物。
6. 收获转染细胞:经过一定时间的孵育后,可从培养物中收获转染细胞。
可以根据实验需要进行后续分析。
需要注意的是,脂质体转染的效率与脂质体组分、浓度、孵育时间、细胞类型等因素密切相关,需要进行参数优化才能达到较高的转染效果。
脂质体转染的实验原理与操作步骤大全

脂质体转染的实验原理与操作步骤大全细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。
脂质体(lipofectin regeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy,Propyl]-n, n,n-Trimethylammonium Chloride(DOTMA)和Dioleoylphotidye-thanolamine(DOPE)的混合物[1:1(w/w)]。
它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。
转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。
用LR进行转染时,首先需优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做:第一,先要固定一个DNA的量和DNA/LR混合物与细胞相互作用的时间,DNA可从1~5μg和孵育时间6小时开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间(2~24小时)。
因LR对细胞有一定的毒性,转染时间以不超过24小时为宜。
细胞种类:COS-7、BHK、NIH3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。
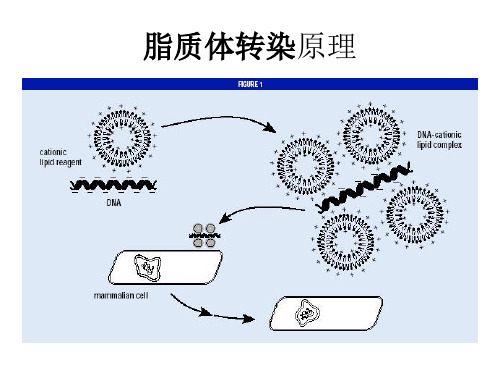
一、脂质体(liposome)转染方法原理脂质体(liposome)转染方法原理:脂质体((Iiposome)作为体内和体外输送载体的工具,已经研究的十分广泛,用合成的阳离子脂类包裹DNA,同样可以通过融合而进人细胞。
使用脂质体将DNA带人不同类型的真核细胞,与其它方法相比,有较高的效率和较好的重复性。
中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。
带正电的阳离子脂质体,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。
阳离子脂质体转染操作方法

阳离子脂质体转染操作方法
阳离子脂质体转染是一种常用的基因传递实验技术,可以将核酸载体有效地转染至细胞内。
下面是阳离子脂质体转染的基本操作方法:
1. 细胞培养:选择适合的细胞培养基及条件,将要转染的细胞在培养皿中培养至指定的生长状态,通常是80%~90%的细胞密度。
2. 制备DNA-脂质体复合物:将目标DNA与阳离子脂质体以适当比例混合,制备成DNA-脂质体复合物。
复合物的制备条件可以根据实际情况进行优化,一般来说,将DNA与脂质体按照质量比1:3~1:5混合,在无菌条件下保持15~30分钟使其充分结合。
3. 转染:将DNA-脂质体复合物均匀滴加至细胞培养皿中,注意避免产生气泡,插入培养皿中心。
轻轻摇晃培养皿使其均匀分布,然后将培养皿放回密闭的培养箱中,继续培养。
4. 代谢酶抑制:在培养细胞转染后的前24小时内,添加代谢酶抑制剂(如10 μg/mL的氨基葡萄糖苷或10 mM的2-脱氧-D-葡萄糖)来提高转染效率。
5. 培养:根据需要的实验设计,继续培养细胞,通常在转染后24~72小时进行下一步的实验。
需要注意的是,每个细胞系对阳离子脂质体的适应性不同,因此在实际操作中需要进行不同的试验优化。
同时,与脂质体浓度、DNA浓度、转染时间等因素也需要进行优化。
脂质体转染原理

脂质体转染原理
脂质体转染是一种常用的基因传递工具,可以将外源DNA有效地引导进入目标细胞。
其原理基于脂质体的特殊结构和细胞膜的特性。
脂质体是由疏水性和亲水性分子组成的结构,可以形成类似细胞膜的双层结构。
在细胞培养条件下,脂质体会与目标DNA 结合,形成脂质体/DNA复合物。
当脂质体/DNA复合物与目标细胞接触时,由于脂质体与细胞膜的亲和性,复合物可以通过与细胞膜融合的方式进入细胞。
一旦脂质体/DNA复合物进入细胞,复合物会被内吞作用包裹成内吞体,内吞体随后与溶酶体融合形成溶酶体内嘌呤体。
在溶酶体内,复合物会被酸性环境和溶酶体内含的酶分解,释放出DNA分子。
最后,释放出的DNA会进入到细胞核中,并与细胞核中的染色体相结合,启动目标基因的表达。
脂质体转染的原理可以归纳为三个步骤:脂质体与DNA结合形成复合物,复合物与细胞膜融合进入细胞,复合物在细胞内释放DNA并进入细胞核。
这个过程提供了一种可靠的手段,用于将外源DNA引导进入目标细胞,实现基因传递和表达。
细胞的脂质体转染法和电穿孔法

细胞的脂质体转染法和电穿孔转染法(一)脂质体转染一、实验试剂及器材Lipofectamine® 3000 Transfection Reagent,质粒DNA(0.5-5 μg/μL储液),Opti-MEM®减血清培养基,培养板,酒精灯,离心机,微量移液器,离心管等。
二、实验步骤1. 接种细胞至70-90%汇合度时转染;2. 使用Opti-MEM®减血清培养基稀释Lipofectamine® 3000试剂(2管),充分混匀(6孔板Opti-MEM®培养基为125 μL× 2,Lipofectamine® 3000为3.75和7.5 μL);3. 在每管已稀释的Lipofectamine® 3000试剂中加入稀释的DNA(用P3000TM试剂稀释)(1:1比例);4. 室温孵育5分钟;5. 加入DNA-脂质体复合物至细胞中;6. 37°C(PK-15在39°C下培养)孵育细胞2–4天,然后分析转染细胞。
三、注意事项1. 在无血清培养基(如Opti-MEM®减血清培养基)中制备DNA-Lipofectamine® 3000脂质体复合物,直接将其加入含细胞培养基的细胞中(在血清/抗生素存在或不存在时均可);2. 转染后无需去除转染复合物或者更换/添加培养基;3. Lipofectamine® 3000试剂用量各有不同,测试推荐的两种浓度的Lipofectamine® 3000试剂,以确定最佳用量,开始新的转染;4. Lipofectamine® 3000试剂应放在4℃储存(切勿冷冻)。
附上Lipofectamine 3000 REagent Protocol:(二)电穿孔转染法一、实验试剂及器材BTX ECM2001®2001细胞电融合仪,细胞,胰蛋白酶,电转液,DMEM,培养板,离心机等。
细胞转染

1、转染前一天,3.0×105-8.0×105 个/ml细胞接种于 35mm底部含有盖玻片的培养皿培养,加入1mlRPMI 1640 含血清,使其在24小时内使细胞汇合达到40-70%(汇合过 分,转染后不利筛选细胞); 2、转染液制备:在1.5mlEP管中制备以下两液:A液:用无 血清培养基稀释4μg DNA,终量250μL;B液:用250μL无 血清培养基稀释10μl脂质体试剂,轻轻混匀,室温放置5 分钟(注意:无血清中不含双抗,因为抗生素会在穿透的 细胞中积累毒素); 3、混合A、B液,轻轻混匀,室温放置30分钟,以便形成 DNA / 脂质体复合物;
【实验用品】
1、仪器和用品:37℃、5%CO2的加湿培养箱、35mm的 细胞培养皿、 载玻片、盖玻片、弯头镊子。 2、材料:呈指数生长的真核细胞HO-8910PM(贴壁细胞)。 3、试剂 1)RPMI 1640含血清培养基 2)质粒载体DNA带GFP(绿色荧光蛋白)基因。 3)转染试剂:阳离子试剂脂质体2000。 4)RPMI 1640无血清培养基不含青霉素、链霉素。
4.转染准备:用2mL无血清培养液漂洗两次细胞,再加 入1mL无血清培养液(注意:转染时切勿加血清,血清对 转染效率有很大影响); 5.将500μl DNA / 脂质体 复合物加到含有细胞和培养基的 培养皿中,来回轻柔摇晃细胞培养板,37℃温箱温育6~ 24小时,吸除无血清转染液,换入正常培养液继续培养; 6.转染24h后,取出盖玻片盖在载玻片上,使用荧光显微 镜观察计数表达绿色荧光蛋白的细胞,在明场中观察计数 同一视野中的总细胞数,计算转染效率。 转染细胞率=荧光蛋白表达细胞数/总细胞数×100%
实验八
脂质体介导转染实验
分子生物学实验课:8脂质体转染
ß-半乳糖苷酶(ß-gal)表达比较
转染试
LIPOFECTAMINE2000
剂家族
•提供对大多数细胞最高的转染活性
•在含血清时的效果无可匹敌
•对常用于蛋白表达的细胞系非常适合
•建议使用96孔板进行高通量应用
LIPOFECTAMINE PLUS
•对于多数贴壁细胞的转染效率较高
•使用方便,不需要对DNA和阳离子脂质体试剂的量进行优化
LIPOFECTIN •对内皮细胞的转染效率较高 •用于寡聚核苷酸的转染效果已证实
293FECTIN •专门针对293细胞的转染 •对293细胞的转染表现出最佳效果
图1. 使用LIPOFECTAMINE 2000获得高转染效率 细胞在含有血清的生长培养基中铺板,第2天使用LIPOFECTAMINE 2000在24孔板中 转染(BE(2)C细胞不使用血清)pCMV·SPORT-βgal。加入复合物后24小时使用X-gal 对细胞染色。根据LIPOFECTAMINE 2000剂量-反应曲线确定最佳点。
脂质体转染步骤
• 1.培养好的细胞接种24孔细胞孔板,37ቤተ መጻሕፍቲ ባይዱ的CO2培养箱培养,待细胞 密度为80~90%,约24h。
• 2. 待转染质粒与脂质体混合物制备: • A液:转染质粒0.8ug稀释至无血清F12培养基中50ul,混匀,室温放置
5min; • B液:脂质体2ul稀释至50ul无血清F12培养基中,混匀,室温放置5min; • A、B液混匀,室温放置30min,该混合液在30min~6h内稳定。 • 3. 取出细胞孔板,弃培养液,用hanks液洗涤2次,待用。 • 4. 到时间后,将混合物导入细胞中,加入0.4ml无血清DMEM培养基,
lipo2000转染方法

lipo2000转染方法Lipo2000转染方法引言:Lipo2000是一种常用的转染试剂,广泛应用于生物医学研究领域。
本文将介绍Lipo2000转染方法的原理、步骤以及其在实验中的应用。
一、原理:Lipo2000转染试剂是一种基于脂质体的转染方法。
其原理是通过脂质体与目标DNA或RNA结合形成复合物,然后将复合物转染至靶细胞中。
脂质体的疏水性结构使其能够与负电荷的核酸结合,从而实现核酸的传递。
二、步骤:1. 准备工作:a. 将Lipo2000转染试剂取出并放置于室温下回温。
b. 根据实验需要,准备好需要转染的靶细胞。
c. 根据转染试剂和靶细胞的要求,选择合适的培养基和培养条件。
2. 转染复合物的制备:a. 将所需的DNA或RNA与Lipo2000转染试剂按照一定的比例混合,轻轻摇晃使其均匀混合。
b. 将混合液静置一段时间,使其形成稳定的脂质体-核酸复合物。
3. 细胞转染:a. 将转染复合物滴加到准备好的细胞培养基中,轻轻摇晃培养皿使其均匀分布。
b. 将培养皿放回培养箱中,按照细胞的培养要求进行后续处理。
4. 细胞培养:a. 根据实验需要,选择合适的培养基和培养条件进行细胞培养。
b. 根据实验设计,进行所需的时间点采样或进一步处理。
三、应用:Lipo2000转染方法在生物医学研究中有着广泛的应用。
以下列举几个常见的应用领域:1. 基因功能研究:通过转染特定基因的siRNA或miRNA,可以实现对基因的特定抑制,从而研究其功能。
2. 蛋白表达调控:通过转染携带特定启动子的DNA或RNA,可以实现对目标蛋白的表达调控。
3. 细胞信号通路研究:通过转染特定信号通路相关基因的DNA或RNA,可以研究该信号通路的调控机制及其在疾病发生发展中的作用。
4. 肿瘤药物筛选:通过转染肿瘤细胞系,可以评估特定药物对肿瘤细胞的抑制效果,为药物筛选提供参考依据。
5. 病毒感染研究:通过转染携带特定病毒基因的DNA或RNA,可以模拟病毒感染过程,研究病毒的传播机制和致病机理。
细胞转染实验

第二次细胞传代 1) 在转染后 24 小时,观察实验结果并记录绿色荧光蛋白表达情况。 2) 再次进行细胞传代,按照免疫染色合适的密度 0.8X105 个细胞/35mm 培养
皿将细胞重新粉入培养皿中。 3) 在正常条件下培养 24 小时后按照染色要求条件固定。
转染条件优化可以参考 TransFast 的使用说明书。
细胞转染 1)转染试剂的准备
A. 将 400ul 去核酸酶水加入管中,震荡 10 秒钟溶解脂状物。 B.震荡后将试剂放在-20 摄氏度保存,使用前还需震荡,。
2) 选择合适的混合比例(1:1-1:2/脂质体体积:DNA 质量)来转染细胞。 在一个转染管中加入合适体积的无血清培养基。加入合适质量的 MyoD 或者 EGFP 的 DNA,震荡后在加入合适体积的转染试剂,再次震荡。 5) 将混合液在室温放置 10—15 分钟。 6) 吸去培养板中的培养基,用 PBS 或者无血清培养基清洗一次。 7) 加入混合液,将细胞放回培养箱中培养一个小时。 8) 到时后,根据细胞种类决定是否移除混合液,之后加入完全培养基继续培养 24-48 小时。
上图是本次实验采用的脂质体中阳离子组分的结构的示意图。 本次实验采用的脂质体是 promega 公司的 TransFast 脂质体试剂,它是一种阳离 子脂质体和中性脂质体的混合物,是对于本次实验中采用的 293T 细胞优化的转 染试剂。
3. 实验材料与器材 1)材料 293T 细胞 MyoD 表达质粒和 EGFP 表达质粒 DMEM 培养基 链霉素/青霉素(双抗) FCS(小牛血清) PBS(磷酸盐缓冲溶液) 胰酶/EDTA 消化液 转染试剂(TransFast) 2)器材 20ul/200ul/1ml 微量移液器和 Tip 头 酒精灯 废液缸 血球计数板 涡旋振荡器 提示转染之前的试剂配制要充分混匀 恒温水浴箱 台式离心机 35mm 培养皿 转染管 15ml 离心管 观察用倒置显微镜 荧光显微镜和 CCD
细胞转染实验报告

一、实验目的本实验旨在通过细胞转染技术将外源基因导入哺乳动物细胞中,研究外源基因在细胞中的表达情况,为进一步研究基因功能奠定基础。
二、实验原理细胞转染是指将外源DNA、RNA或蛋白质等生物大分子导入细胞内,使其在细胞内稳定存在并表达的过程。
常用的细胞转染方法有脂质体介导转染、电穿孔转染、病毒载体转染等。
本实验采用脂质体介导转染方法,利用脂质体将外源DNA包裹并导入细胞内。
三、实验材料1. 细胞:HEK293细胞2. 外源DNA:目的基因片段3. 脂质体:转染试剂4. 细胞培养试剂:DMEM高糖培养基、胎牛血清、胰蛋白酶、双抗5. 仪器:细胞培养箱、倒置显微镜、离心机、PCR仪、凝胶成像系统四、实验步骤1. 细胞培养:将HEK293细胞接种于6孔板,培养于DMEM高糖培养基中,置于37℃、5%CO2的细胞培养箱中培养至细胞密度达到80%。
2. DNA提取:采用DNA提取试剂盒提取目的基因片段,进行PCR扩增,得到目的基因。
3. 脂质体转染:按照脂质体说明书进行操作,将目的基因片段与脂质体混合,室温孵育20分钟。
4. 转染:将脂质体-DNA混合物加入培养好的细胞中,轻柔摇匀,使脂质体均匀分布。
37℃、5%CO2培养箱中培养6小时。
5. 洗涤:用无血清培养基洗涤细胞2次,去除未转染的脂质体。
6. 继续培养:更换新鲜培养基,继续培养细胞24小时。
7. 实验验证:7.1 RT-PCR检测:提取细胞总RNA,进行RT-PCR扩增,检测目的基因在细胞中的表达情况。
7.2 Western Blot检测:提取细胞总蛋白,进行SDS-PAGE电泳,转膜,加入一抗和二抗,检测目的蛋白在细胞中的表达情况。
五、实验结果1. RT-PCR检测结果:目的基因在细胞中成功表达,与阴性对照组相比,实验组目的基因表达量明显升高。
2. Western Blot检测结果:目的蛋白在细胞中成功表达,与阴性对照组相比,实验组目的蛋白表达量明显升高。
脂质体转染实验步骤和细胞转染技术总述

脂质体转染实验步骤和细胞转染技术总述
一、脂质体转染实验步骤
1)细胞处理:细胞培养,细胞脱落,细胞悬液浓缩;
2)添加脂质体:将DNA与相应脂质体混合,可以将DNA结合到脂质体上;
3)细胞接种:将脂质体/DNA混合物接种到细胞悬液中,使DNA能够被细胞吞噬;
4)转染放置:将接种混合物保持在室温静置一定的时间,从而使DNA能够被细胞吞噬;
5)细胞活化:在静置期间,DNA会被细胞内吞噬,当添加激活剂和营养培养基时,细胞会活化;
6)细胞培养:在细胞活化后,细胞会被培养,并进行观察,以评估DNA转染的效果;
7)细胞收集:在培养过程中,可以通过浓缩细胞悬液,将转染后的细胞收集起来,以便进行其他分析。
细胞转染是将外源DNA片段转染到细胞中,从而改变其基因表达的技术。
目前常用的细胞转染技术有电转染、磁珠转染、质粒转染、脂质体转染等。
1)电转染
电染是一种最常用的染技术,即通过将DNA片段置于细胞悬液中,然后用微电流刺激,使DNA片段直接进入细胞。
脂质体转染_实验报告

一、实验目的本实验旨在通过脂质体转染技术将目的基因导入细胞内,研究脂质体转染方法对基因表达的影响,为后续基因功能研究提供技术支持。
二、实验材料1. 细胞:人胚肾细胞HEK2932. 载体:pGL3-Basic(含有报告基因)3. 脂质体:Lipofectamine 30004. 细胞培养试剂:DMEM培养基、胎牛血清、青霉素-链霉素溶液5. 实验仪器:超净工作台、CO2培养箱、酶标仪、显微镜、PCR仪等三、实验方法1. 细胞培养:将HEK293细胞接种于6孔板,待细胞汇合至80%时进行实验。
2. 脂质体-DNA复合物制备:将pGL3-Basic质粒DNA和Lipofectamine 3000试剂按照说明书比例混合,室温孵育20分钟。
3. 细胞转染:将脂质体-DNA复合物加入细胞培养孔中,轻轻混匀,37℃、5%CO2培养箱中孵育6小时。
4. 洗涤:弃去转染液,用PBS缓冲液洗涤细胞两次。
5. 优化培养条件:将细胞分为实验组和对照组,实验组加入脂质体-DNA复合物,对照组加入等量无DNA的脂质体。
6. 重组蛋白表达检测:收集细胞,提取总蛋白,进行Western blot检测目的蛋白表达水平。
7. 报告基因表达检测:收集细胞,提取总RNA,进行实时荧光定量PCR检测报告基因表达水平。
四、实验结果1. Western blot结果:实验组细胞中目的蛋白表达水平明显高于对照组(P<0.05),表明脂质体转染成功。
2. 实时荧光定量PCR结果:实验组细胞中报告基因表达水平明显高于对照组(P<0.05),表明脂质体转染对基因表达有显著促进作用。
五、实验讨论1. 脂质体转染技术在基因研究中的应用:脂质体转染技术具有操作简便、转染效率高、安全性好等优点,是基因研究中最常用的转染方法之一。
2. 本实验中,脂质体转染成功地将目的基因导入细胞内,并显著提高了报告基因的表达水平。
这表明脂质体转染技术在本实验中具有良好的效果。
脂质体转染原理

脂质体转染原理
脂质体转染是一种常用的基因转染方法,通过将外源基因载体包裹在脂质体内,使其能够穿过细胞膜并进入细胞内,从而实现基因的转染和表达。
脂质体转染原理主要包括脂质体的结构特点、转染机制和影响因素等内容。
首先,脂质体是由磷脂双分子层和蛋白质组成的囊泡结构,其外层为亲水性头部,内层为疏水性尾部。
这种特殊的结构使得脂质体能够与细胞膜融合,释放内部载体进入细胞质。
其次,脂质体转染的机制主要包括吸附、内化、溶酶体逃逸和核内释放等步骤。
当脂质体与细胞表面结合后,通过内化形成内体,随后内体融合成溶酶体,脂质体内的载体得以逃逸进入细胞质,最终进入细胞核并释放出目的基因。
最后,影响脂质体转染效率的因素包括细胞类型、脂质体与基因载体的比例、转染时间和温度等。
不同的细胞类型对脂质体转染的敏感性不同,而适当的脂质体与基因载体比例、转染条件的优化则能够提高转染效率。
总的来说,脂质体转染原理是通过脂质体与细胞膜的融合,将内部携带的基因
载体释放到细胞质中,最终实现基因转染和表达。
了解脂质体转染的原理和影响因素,对于基因转染实验的设计和结果解读具有重要的指导意义。
因此,在进行脂质体转染实验时,需要充分考虑脂质体的特点和转染机制,合理设计实验方案,以提高转染效率,为后续的基因功能研究奠定基础。
希望本文能够帮助读者更好地理解脂质体转染的原理和应用,为科研工作者提
供一定的参考价值。
脂质体转染操作步骤

脂质体转染操作步骤
(一)准备材料
1.质粒:一般是由受体细胞胞浆抽提的质粒,其中含有DNA操纵因子、胞质蛋白等;
2.抗体:主要由混合物或单一蛋白质组成,用于鉴定质粒抗原性以及
抑制免疫反应;
3.细胞培养液:一般为包含细胞培养基和生长因子的混合物;
4.转染试剂:也称转染缓冲液,主要由多种物质,如阿拉伯胞浆清酯、卡夫培糖、酚红、多数体核酸等组成,用于载体细胞的传感和质粒的迁移。
(二)脂质体转染操作
1.取出细胞培养液,将受体细胞倒入培养管中,用浓度为0.25%(体
积比)的牛血清添加至8-10%,以细胞膜生长抗性抑制剂(如抗生素或吲
哚美辛)等抑制细胞膜的分裂,加以培养;
2.将培养液中的受体细胞的数量控制在2×105/ml以上,用酚酞红法
检测,检测结果达到要求后,把受体细胞从培养管中放入6 ml的离心管中,进行6000 g的离心;
3.将离心液放入新的容器中,把细胞抽出,再加入细胞稀释缓冲液
(以PBS或缓冲液为主,加入百维素或多数体核酸)至1×106/ml,离心5000 g;
4.将离心液抽出,用转染试剂缓冲液把细胞洗涤,再分别加入DNase I, 抗体和质粒,放入摇床中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脂质体转染的实验原理与操作步骤大全
日期:2012-06-25 来源:互联网作者:青岚点击:4751次
摘要:
细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀
法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。
找产品,上生物帮
>> >>
细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。
脂质体(lipofectin regeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy,Propyl]-n, n,n-Trimethylammonium Chloride(DOTMA)和Dioleoyl
photidye-thanolamine(DOPE)的混合物[1:1(w/w)]。
它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。
转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。
用LR进行转染时,首先需优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做:第一,先要固定一个DNA的量和DNA/LR 混合物与细胞相互作用的时间,DNA可从1~5μg和孵育时间6小时开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间(2~24小时)。
因LR对细胞有一定的毒性,转染时间以不超过24小时为宜。
细胞种类:COS-7、BHK、NIH3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。
一、脂质体(liposome)转染方法原理
脂质体(liposome)转染方法原理:脂质体((Iiposome)作为体内和体外输送载体的工具,已经研究的十分广泛,用合成的阳离子脂类包裹DNA,同样可以通过融合而进人细胞。
使用脂质体将DNA带人不同类型的真核细胞,与其它方法相比,有较高的效率和较好的重复性。
中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。
带正电的阳离子脂质体,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。
二、脂质体转染操作步骤
1、操作步骤[方法一]:
(1)细胞培养:取6孔培养板(或用35mm培养皿),向每孔中加入2mL含1~2×105个细胞培养液,37℃CO2培养至40%~60%汇合时(汇合过分,转染后不利筛选细胞)。
(2) 转染液制备:在聚苯乙稀管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1-10μg DNA,终量100μL,B液:用不含血清培养基稀释2-50μgLR,终量100μL,轻轻混合A、B液,室温中置10-15分钟,稍后会出现微浊现象,但并不妨碍转染(如出现沉淀可能因LR或DNA浓度过高所致,应酌情减量)。
(3)转染准备:用2mL不含血清培养液漂洗两次,再加入1mL不含血清培养液。
(4)转染:把A/B复合物缓缓加入培养液中,摇匀,37℃温箱置6~24小时,吸除无血清转染液,换入正常培养液继续培养。
(5)其余处理如观察、筛选、检测等与其它转染法相同。
注意:转染时切勿加血清,血清对转染效率有很大影响。
2、快速脂质体转染法操作步骤如下[方法二]:
(1)以5×105细胞/孔接种6孔板(或35mm培养皿)培养24小时,使其达到50~60%板底面积。
(2)在试管中配制DNA/脂质体复合物方法如下:
①在1mL无血清DMEM中稀释PSV2-neo质粒DNA或供体DNA。
②旋转1秒钟,再加入脂质体悬液,旋转。
③室温下放置5~10分钟,使DNA结合在脂质体上。
(3)弃去细胞中的旧液,用1mL无血清DMEM洗细胞一次后弃去,向每孔中直接加入1mL DNA/脂质体复合物,37℃培养3~5小时。
(4)再于每孔中加入20%FCS的DMEM,继续培养14~24小时,
(5)吸出DMEM/DNA/脂质体混合物加入新鲜10%FCS的DMEM,2mL/孔,再培养24~48小时。
(6)用细胞刮或消化法收集细胞,以备分析鉴定。
3、稳定的脂质体转染方法如下:
(1)接种细胞同前,细胞长至50%板底面积可用于转染。
(2)DNA/脂质体复合物制备转染细胞同前(2)、(3)步骤。
(3)在每孔中加入1mL、20%FCS的DMEM,37℃培养48小时。
(4)吸出DMEM,用G418选择培养液稀释细胞,使细胞生长一定时间,筛选转染克隆,方法参照细胞克隆筛选法进行。
三、个人经验:
本人用的是Invitrogen公司的Lipofectamine2000在24孔板转染单层贴壁细胞。
(别的方法可以参考生产商提供的protocol)
1、转染前1天将0.5~2×105细胞接种于24孔培养板,并加入500ul不含抗生素的完全培养基,以保证转染时细胞汇合达90~95%。
2、准备复合物
(1) 将0.8ug DNA稀释于50ul无血清无抗生素的培养液中轻轻浑匀。
(2) 将2ul Lipofectamine2000稀释于50ul无血清无抗生素的培养液中,轻轻浑匀,室温孵育5分。
注意:必须在25分内进行。
(3) 5分后将它们混合,并轻轻浑匀,室温孵育20分。
3、吸去培养板的培养基,用PBS或无血清培养基(最好)清洗细胞2次。
4、将复合物(总体积100ul)加入培养孔,前后摇动培养板使其分布均匀。
5、将细胞放入培养箱孵育4~6h后,可以更换含血清培养液去除复合物(也可不用)。
6、24~48h后可以观察转入基因表达情况。
7、稳定转染:换含血清培养基24h后将细胞以1:10(或更高比例)传代,1天后更换筛选培养基筛选。
8、优化:要保证细胞汇合率达90~95%(比较高);DNA/ Lipofectamine2000比率1:0.5~1:5,一般细胞1:2~3.
脂质体转染法的主要优点是可用将DNA转染至悬浮或者铁壁细胞培养、转染效率相对较高、对基因片段大小的限制较小等,但是
阳离子脂质体对细胞的毒性相对较高,为了防止其毒性,要摸索好如下实验条件:脂质体与质粒的比例、细胞转染时间等。
