硫化氢的实验室制法优秀课件
21硫化氢

五、硫的氢化物
无色
H2S
1、硫化氢的物理性质: 有臭鸡蛋气味的气体 标准状况下硫化氢的密度 =34g/22.4L = 1.52 g/L 可溶于水(1 2.6) 可溶于水(1︰2.6) 剧毒 (头痛、头晕、恶心、昏迷、死亡)
注 意
制取和使用硫化氢时必须在密闭或 通风橱中进行
2、硫化氢的化学性质: 弱酸 弱电解质
(完全燃烧) 完全燃烧)
点燃
2H2S+3O2
2H2O+2SO2↑ 火焰浅蓝色
有关燃烧的讨论 2H2S+O2 2H2S+3O2
n(H2S) n(H2S)
点燃 点燃
2H2O+2S↓ 2S↓ 2H2O+2SO2↑
≥ n(O2)
2 1 2 3
氧化产物是 S 氧化产物是 SO2
≤ n(O2)
2 3
<
n(H2S) n(O2)
2e
H2S+2FeCl3→2FeCl2+S↓+2HCl S↓+
8e
浅绿色
淡黄色
H2S+8HNO3(浓)→H2SO4+8NO2↑+4H2O 红棕色气体 6e 3H2S+2HNO3(稀)→3S↓+2NO↑+4H2O 3S↓+2NO↑ 无色遇空气转化为红棕色
2e
H2S+H2SO4(浓)→S↓+SO2↑+2H2O S↓+ 刺激性气味
二氧化硫是污染大气的主要有害物质之一
(2)化学性质: ① SO2称为亚硫酐, 具有酸性氧化物(酸酐) 具有酸性氧化物(酸酐)的通性
SO2 + H2O → H2SO3 H2SO3 → SO2 + H2O
正反应
SO2 + H2O
逆反应
H2SO3
在同一条件下, 正反应和逆反应同时进 行的反应叫可逆反应。
硫化氢的实验室制法及原理

硫化氢的实验室制法及原理
硫化氢(H2S)是一种有毒、有臭味的气体,常被用作工业原料和化学试剂。
在实验室中,常用的制法有以下几种:
1、硫酸与钠反应制法:将硫酸和钠混合在一起,加热至80-90°C,即可生成硫化氢气体。
具体反应方程式为:
H2SO4 + Na → NaHSO4 + H2
NaHSO4 + Na → Na2SO4 + H2
2、硫酸与铜反应制法:将硫酸和铜混合在一起,加热至80-90°C,即可生成硫化氢气体。
具体反应方程式为:
Cu + H2SO4 → CuSO4 + H2
3、硫酸与铁反应制法:将硫酸和铁混合在一起,加热至80-90°C,即可生成硫化氢气体。
具体反应方程式为:
Fe + H2SO4 → FeSO4 + H2
这三种制法的原理均为还原反应,即在反应过程中硫酸的硫原子被还原为硫化氢分子。
注意:制备硫化氢时要格外小心,因为它是有毒的。
使用时应注意安全措施,并且使用时应穿戴防毒面具。
人教版高中化学必修1课件 硫化氢

硫化氢 2.硫化氢的可燃性 (1)完全燃烧时:发出淡蓝色火焰. 2H2S+3O2===2SO2+2H2O (2)不完全燃烧时:有淡黄色粉末出现. 2H2S+O2===2S+2H2O
硫化氢
H2S燃烧的总方程式
XH2S+YO2====1.5(X-Y)S↓+(Y-0.5X)SO2+XH2O
硫化氢
练习:24毫升的硫化氢在30毫升氧气中燃烧,在同 D 温同压下,得到的二氧化硫的体积为( )毫升 A、24 B、30 C、20 D、18
解析:根据燃烧的通式:将X=24ml Y=30ml代入 得生成的二氧化硫的体积为Y-0.5X =30- 12 =18ml
硫化氢 分析硫化氢中硫元素的化合价,并从氧化还 原反应的角度推它具有什么性? 3.强还原性
H2S+Cl2===2HCl+S↓ (使氯水褪色并出现浑浊) H2S+X2===2HX+S↓(X2—常指Cl2、Br2、I2)
名称 状态 组成 硫化氢 气态 纯净物 氢硫酸 液态 混合物
粒子
化学性质
H2S 分子
还原性
H2S、H2O、H+、HS、S2-、OH-(少量)
酸性、氧化性、还原 性
硫化氢
六、硫化氢的特殊性 • 酸在发生复分解反应时,通常遵守强酸制弱 酸的规则,但氢硫酸有时却“反其道而行” :若将硫化氢气体通入硫酸铜溶液中,可观 察:产生黑色沉淀,静置后,上层为无色。 H2S+CuSO4==CuS↓+H2SO4
1.硫化氢的毒性 • 硫化氢经粘膜吸收快,皮肤吸收甚慢。人吸入 70至150毫克/米硫化氢1至2小时出现呼吸道 及眼刺激症状,2至5分钟后嗅觉疲劳闻不到臭 味。吸入760毫克/立方米吸入1000毫克/立 方米数秒钟后很快出现急性中毒,呼吸加快后 呼吸麻痹而死亡。 • 硫化氢对粘膜的局部刺激作用系由接触湿润粘 膜后分解形成的硫化钠以及本身的酸性所引起 。对机体的全身作用为阻断细胞内呼吸导致全 身性缺氧。由于中枢神经对缺氧最敏感,因而 首先受到损害。
硫化氢采做样方法PPT课件

测定。记录采样时的温度和大气压 力。
(五)分析步骤 1.绘制标准曲线 (1)用标准溶液绘制标准曲线 按下表制备标准 色列管,先加吸收液,后加标准液,立即倒 转混匀。
各管立即加1ml混合显色液,加盖倒转一次, 缓缓混合均匀,放置30min。加1滴磷酸氢二 钠溶液,摇匀,以排除Fe3+的颜色。用 20mm比色皿,以水作参比,在波长665nm 处,测定各管吸光度。以硫化氢含量(μg)为 横坐标,吸光度为纵坐标,绘制标准曲线,
2.样品测定 采样后,用水补充到采样前的吸收液的体积。 由于样品溶液不稳定,应在6h内,按用标准 溶液绘制标准曲线的操作步骤显色,测定吸 光度。 在每批样品测定的同时,用10ml未采样的吸 收液,按相同的操作步骤作试剂空白测定。
如果样品溶液吸光度超过标准曲线的范围, 则可取部分样品溶液用吸收液稀释后再分析, 计算浓度时,要乘以样品溶液的稀释倍数。
准确量取25.00ml 0.1000mol/L碘酸钾标准溶液,于250ml碘量瓶中,加 入75ml新煮沸冷却的水,再加3g碘化钾和10ml冰乙酸。摇匀后,暗处放 置3min,用0.1mol/L硫代硫酸钠标准溶液滴定析出的碘,至淡黄色。再 加1ml5g/L淀粉溶液,呈蓝色,再继续滴定至蓝色刚刚褪去,即为终点。 记录所用硫代硫酸钠溶液体积。重复做两次滴定,所用硫代硫酸钠溶液 体积误差不超过0.05ml。硫代硫酸钠标准溶液的浓度用下式计算: 式中M——硫代硫酸钠标准溶液的浓度,mol/L; V——滴定所用硫代硫酸钠溶液的体积,ml。
2024版硫化氢课件完整版

鉴别诊断
主要与一氧化碳中毒、氰化物中毒、单纯窒息性气体中毒等疾病进行鉴别。一氧化碳中毒常有碳氧血红蛋 白增高的实验室检查结果;氰化物中毒常有口苦、杏仁味等特征性表现;单纯窒息性气体中毒常无明显的 眼和上呼吸道刺激症状。
2024/1/28
18
治疗原则与方法探讨
2024/1/28
治疗原则
立即将患者移离中毒现场,脱去污染衣物,注意保暖和安静。对轻度中毒者主要采取对 症治疗,中度中毒者给予吸氧、抗感染等治疗措施,重度中毒者需积极防治并发症和后
2024/1/28
亚甲基蓝法
利用亚甲基蓝与硫化氢的 还原反应,生成无色的硫 化物,通过比色法或电位 滴定法确定硫化氢浓度。
碘量法
在酸性条件下,硫化氢与 碘反应生成硫和氢碘酸, 通过滴定法确定硫化氢浓 度。
9
检测原理及仪器介绍
原理
基于硫化氢与特定试剂的化学反应, 通过测量反应产物的量或颜色变化来 确定硫化氢浓度。
输标02入题
相对密度1.19,比空气重,易积聚在通风不良的城市 污水管道、窨井、化粪池、污水池、纸浆池以及其他 各类发酵池和蔬菜腌制池等低洼处。
01
03
燃烧时呈蓝色火焰并产生有毒的二氧化硫气体。
04
2024/1/28
溶于水、乙醇,溶于水后生成氢硫酸。
4
硫化氢的来源与产生
工业生产中,含硫有机物经厌氧菌作用可产生硫化氢,如制革、味精、造纸等工业 废水处理过程中。
2024/1/28
11
03
防护措施与应急救援
2024/1/28
12
个人防护措施及装备选择
呼吸防护
选用合适的防毒面具或正压式空 气呼吸器,确保呼吸道不受硫化
常见气体的实验室制法PPT课件
气体 C2H4 Cl2 NH3 NO
a 乙醇 浓盐酸 饱和NH4Cl溶液 稀HNO3
b 浓H2SO4
MnO2 消石灰
铜屑
c NaOH溶液 NaOH溶液
H2O H2O
d 浓H2SO4 浓H2SO4 固体NaOH
P2O5
(1)上述方法中可以得到干燥、纯净的气
体是
NO 。
(2)指出不能用上述方法制取的气体,并
CaC2 + 2H2O → Ca(OH)2 + CH≡CH↑
气体制备流程图
发生 装置
净化 装置
干燥 装置
收集 装置
吸收 装置
及反 反应 应物 条状 件态
的气 性体 质及
杂 质
选气 择体 干的 燥性 剂质
及气 密体 度水溶 性ຫໍສະໝຸດ 选气 择体 吸的 收毒 剂性
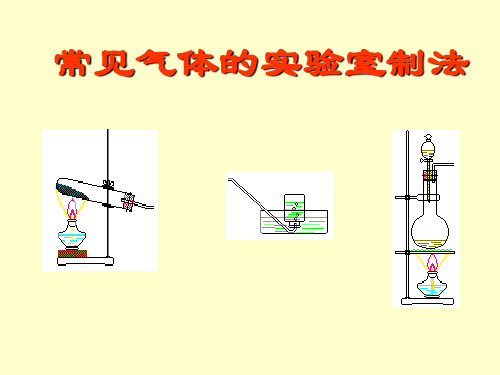
二、气体发生装置:
1、固、固加热:即:固+固→气
P2O5可以干燥除氨气以外的其它气体。
四、气体的收集
收集方法 排水法 向上排气法 向下排气法
装置示意图
气体性质 实例
难溶或微溶 于水的气体
密度大于空 密度小于空 气的气体 气的气体
H2、CH4、NO O2、N2、C2H2
CO2、Cl2、HCl
H2、NH3、CH4
五、尾气的吸收
1、依据气体的性质选取适当的吸收试剂 2、防倒吸
常见气体的实验室制法
一、常见气体的制备原理:
H2: Zn + H2SO4(稀) = ZnSO4 + H2↑
O2:
M n O 2
2 K C lO 3
2 K C l + 3 O 2
或: 2 K M n O 4 K 2 M n O 4 + M n O 2 + O 2
高中化学必修一:4.1.4硫化氢性质及应用 课件

二、结 构
1、硫化氢是极性键构成的极性分 子;
2、水溶液呈酸性;
3、H2S中的S是的最底价态的S.
三、化 学 性 质
1.还 原 性 2.不 稳 定 性 3.可 燃 性
1、还 原 性
2 H2S + SO2 ===== 3 S+2 H2O
H2S +X2==== S↓+2HX (X=Cl.Br.I) 氧化性: Cl >Br> I >S △ H2S+H2SO4(浓)=== S↓+ SO2↑+2H2O H2S +8HNO3 (浓) ==== H2SO4 +8NO2↑ +4H2O 3H2S +2HNO3 (稀) ===== 3S +2NO↑ +4H2O H2S 不能用H2SO4(浓)或HNO3制取或干燥
一、硫化氢的物理性质
二、硫化氢的结构 三、硫化氢的化学性质 四、氢硫酸 五、 硫化氢的实验室制法
一、物理性质
1、色.态.味:无色、臭鸡蛋气味、巨毒、气体
2、溶解性: 一体积水能溶解2.6体积的硫化氢
(溶解性:CO2<Cl2<H2S<SO2<HCl<NH3) 3、密 度: 比空气大,标况下的密度为1.52g/L
五、实验室制法
原 理: 装 置: 净 化: 收 集: 检 验: 尾 气:
FeS(固) + 2HCl(液) == FeCl2 +H2S↑
制H2 、CO2 的装置相同,亦可用启普发生器. 饱和NaHS溶液,无水CaCl2 向上排空气法 Pb(Ac)2 试纸或CuSO4 溶液 NaOH 溶液
H2S)/n( O2 )<2时
点燃
aH2S + bO2 ==== (2b-a)/2 S O2 +(3a-2b)/2 S + aH2O
硫化氢的实验室制法

排水法( 因为氧 气不易 溶于水) 向上排气法(因为 氧气 的密度比空 气略大)
排水法(因为氢气难 溶于水)
向下排气法(因为氢 气的密度比空气小)
带火星的木条伸 检验方法 入集气瓶,木条
复燃,为氧气
点燃气体能燃烧, 生成物只有水,为 氢气
氧
氢
气
气
的
ቤተ መጻሕፍቲ ባይዱ
的
发
发
生
生
装
装
置
置
讨论:选择实验室制取气体装置的
思路与方法。
可供选药品:1 大理石, 2 锌粒,
A
3 MnO 2 , 4 浓H2SO4 , 5 稀H2SO4
6 FeS, 7 双氧水,8稀HCl,9浓HCl
B
可制备的气 A中盛放的 B中盛放的
体
药品
药品
O2
7
3
CO2
8
1
H2S
8或5
6
排水法 向上排气法 向下排气法
2、收集方法: 向上排气法( H2S的密度比空气大)
不能用排水法( H2S能溶于水)
收集仪器: 1、集气瓶 2、玻璃片
实验室制取硫化氢的装置 :
3、检验方法:
使湿润的醋 酸铅(PbAc2)试 H2S 纸变黑。
思考:
1。如何验证集气瓶内的气体已满?
2。尾气如何吸收?
Cl2的制备、提纯、吸收 Cl2中混有HCl和H2O(g)
三、实验室制取硫化氢气体的装置
1、发生装置(制取氢气的装置相似 )
发生仪器: 1、长颈漏斗
(或分液漏斗) 2、锥形瓶 3、双孔橡皮塞 4、导气管
2、在选择收集装置时应以什么为依据? 主要应以物理 (1)气体的密度与空气比较 性质两个方面:(2)气体在水中的溶解性
硫化氢课件

天然气净化
天然气中含有一定量的 硫化氢,需要经过净化 处理才能达到使用标准。
化肥生产
在合成氨和尿素的生产 过程中,会产生大量的
硫化氢废气。
污水处理
污水处理厂的厌氧处理 环节会产生硫化氢,对 环境和人体健康造成威
胁。
控制技术与方法探讨
源头控制
通过改进生产工艺、使用 低硫原料等方法,从源头 上减少硫化氢的产生。
许可证规定的要求进行排放。
行业标准要求及实施指南
1 2
《大气污染物综合排放标准》 规定了硫化氢等大气污染物的排放限值、监测方 法和实施要求。
《恶臭污染物排放标准》 针对硫化氢等恶臭污染物的排放,规定了相应的 排放限值和控制措施。
3
《工业企业设计卫生标准》 对工业企业产生硫化氢等有害因素的作业场所, 提出了卫生要求和防护措施。
硫化氢的危害及影响
对眼和呼吸道粘膜产生强烈的刺激作 用。
硫化氢具有“臭蛋样”气味,但极高 浓度很快引起嗅觉疲劳而不觉其味。
低浓度接触仅有呼吸道及眼的局部刺 激作用,高浓度时全身作用较明显, 表现为中枢神经系统症状和窒息症状。
02
硫化氢检测方法与原理
常用硫化氢检测方法
01
02
03
比色法
通过硫化氢与特定试剂反 应生成有色物质,比较颜 色深浅确定硫化氢浓度。
时便有硫磺味。
溶于水和乙醇,水溶液为氢硫 酸。
分子式为H2S,分子量为 34.08,相对密度为1.19。
熔点为-85.5℃,沸点为60.4℃,自燃点为260℃。
硫化氢的来源与产生
工业生产中,含硫有机物经厌 氧细菌分解可产生硫化氢。
石油炼制、合成氨生产、煤气 制造等工业中都有硫化氢产生。
硫化氢的制取实验

硫化氢的制取实验
硫化亚铁稀酸逢,启普器中气体生。
橱中操作上排气,氧化性酸概不用。
解释:
1、硫化亚铁稀酸逢,启普器中气体生:"稀酸"在此指稀盐酸或稀硫酸。
这句的意思是说,在实验室中常用硫化亚铁(FeS)跟稀盐酸(HCI)或稀硫酸(H2SO4),在启普发生器中发生反应来制取硫化氢(H2S)[联想:"关闭活塞查密性"]。
2、橱中操作上排气:"橱中操作"的意思是说,该实验的操作过程必须在通风橱中进行[联想:因为H2S有剧毒,空气中如果含有微量的H2S,就会使人感到头痛、头晕恶心,吸入较多的H2S,会使人昏迷、甚至死亡。
]。
3、氧化性酸概不用:"氧化性酸"在此指浓硫酸(H2SO4)和硝酸(HNO3)。
这句的意思是说一概不用氧化性酸根硫化亚铁反应来制取硫化氢,因为硫化亚铁是强还原剂,易被氧化性酸氧化(H2S+ H2SO4浓=S↓+SO2↑+2H2O,H2S+ 8HNO3浓= H2SO4+8NO2+4H2O,3H2S+2HNO3=3S↓+ 2NO↑+4H2O)。
硫化氢实验室制法方程式

硫化氢实验室制法及方程式
实验室制取硫化氢的原理及方程式:
硫化氢
①制取原理——强酸与强碱的复分解反应
②制取方程式——FeS+2HCl=== FeCl2+H2S↑
③装置——启普发生器
④检验——能使湿润的醋酸铅试纸变黑
⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O ⑸二氧化硫
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——先通入品红试液,褪色,后加热又恢复原红色;
⑤除杂质——通入浓H2SO4(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O。
化学初三上鲁教版-用蜡烛制硫化氢

化学初三上鲁教版-用蜡烛制硫化氢
石蜡是固态石蜡烃的混合物,凡士林是液态和固态石蜡烃的混合物,它
们差不多上由碳和氢组成的。
把硫黄与石蜡(或凡士林)放在一起加热,就会产生硫化氢气体。
硫黄、石蜡和凡士林差不多上专门容易得到的,因此用这种方法制硫化氢是专门简便的。
取一支试管,配上一个带尖嘴玻璃管的橡皮塞,在试管中加入1 克硫黄
粉和1 克石蜡(可将小段蜡烛切碎),把试管放在酒精灯火焰上加热,即产
生硫化氢气体。
在玻璃管的尖嘴处把硫化氢气体点燃,它的火焰是蓝色的。
假如用一张
湿的蓝色石蕊试纸放在火焰上方(不接触火焰),蓝色试纸就会变红,说明
硫化氢气体燃烧后,产生的气体具有酸性。
假如将一支试管放在硫化氢的火焰上(试管的外壁与火焰接触),不久,
你就会看到试管的外壁上显现了一层黄色的固体。
上面两个实验中发生了什么反应呢?我们明白,当硫化氢气体在空气中
燃烧时,假如空气是充足的(第一种情形),就产生二氧化硫和水:
2H2S+3O2=2SO2↑+2H2O
二氧化硫溶于水生成亚硫酸,能使蓝色的石蕊试纸变红。
假如空气不足时(第二种情形),它只能把硫化氢氧化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室制备气体的要素
1。药品: 2。反应原理: 3。发生装置: 4。除杂装置: 5。收集装置: 6。尾气吸收装置:
实验室制取硫化氢的方法:
一、药品: 硫化亚铁和稀硫酸(或稀盐 酸)
二、反应原理:
FeS+H2SO4==FeSO4+H2S
FeS+2HCl==FeCl2+H2S
Cl2的制备、提纯、吸收 Cl2中混有HCl和H2O(g)
三、实验室制取硫化氢气体的装置
1、发生装置(制取氢气的装置相似 )
发生仪器: 1、长颈漏斗
(或分液漏斗) 2、锥形瓶 3、双孔橡皮塞 4、导气管
2、在选择收集装置时应以什么为依据? 主要应以物理 (1)气体的密度与空气比较 性质两个方面:(2)气体在水中的溶解性
氧 气 ( O2 ) 氢 气 ( H2 ) 药品 氯酸钾或高锰酸钾 锌和稀硫酸
反应 原理
2KClO3 =M=n=O= 22KCl + 3O2 2KMnO4 == K2MnO4+MnO2+O2
Zn+H2SO4 =ZnSO4 +H2
装 置
发生装置 收集装置
氧 气 ( O2 )
氢 气( H2 )
收集方法
排水法( 因为氧 气不易 溶于水) 向上排气法(因为 氧气 的密度比空 气略大)
排水法(因为氢气难 溶于水)
向下排气法(因为氢 气的密度比空气小)
带火星的木条伸 检验方法 入集气瓶,木条
复燃,为氧气
点燃气体能燃烧, 生成物只有水,为 氢气
氧
氢
气
气
的
的
发
发
生
生
装
装
置
置
讨论:选择实验室制取气体装置的
思路与方法。
可供选药品:1 大理石, 2 锌粒,
A
3 MnO 2 , 4 浓H2SO4 , 5 稀H2SO4
6 FeS, 7 双氧水,8稀HCl,9浓HCl
B
可制备的气 A中盛放的 B中盛放的
体
药品
药品
O2
7
3
CO2
8
1
H2S
8或5
6
小结:
1。固体+固体 加热 气体
2。固体+液体
气体
Байду номын сангаас
3。固体+液体 加热
气体
1、下列制取硫化氢的装置有哪些错误?
A.长颈漏斗下端管口没有插 到液面以下。 B.导气管插到液面以下。 C.用向下排气法收集。 D.导管没有插到接近集气瓶 底部。
思考:
右图是实验室制气体装置,用于发生和收集气
体(洗气,干燥,尾气回收装置已略去)
1、制取氧气时能否用制取氢气的
装置?反之是否可行?
2、在选择发生装置时要考虑哪些 因素?
从两个方面考虑: (1)反应的条件。 (2)药品的状态。
氧 气 的 发 生 装 置
此装置使用于什么样的反应
氢 气 的 发 生 装 置
此装置使用于什么样的反应
适用于反应物是固 体且需加热
适用于反应物有两种 (固体+液体)且不 需加热
排水法 向上排气法 向下排气法
2、收集方法: 向上排气法( H2S的密度比空气大)
不能用排水法( H2S能溶于水)
收集仪器: 1、集气瓶 2、玻璃片
实验室制取硫化氢的装置 :
3、检验方法:
使湿润的醋 酸铅(PbAc2)试 H2S 纸变黑。
思考:
1。如何验证集气瓶内的气体已满?
2。尾气如何吸收?
