高二化学氢氧化铝性质和合金PPT优秀课件
合集下载
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】

沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
2、氢氧化铝
优点:
本品为复方制剂,
Al(OH)3碱性 每粒含氢氧化铝 不强,不会对 140毫克
胃壁产生强烈
的刺激或腐蚀
推测
作用。
Al(OH)3+3H+ = Al3++3H2O
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
实验步骤
实验现象
方案一:在试管里加入 约1mL 硫酸铝溶液,用胶 头滴管逐滴滴加氨水至 过量
生成白色胶状沉淀,氨 水过量时,沉淀不溶解
方案二:在试管里加入 约1mL 硫酸铝溶液,用 胶头滴管逐滴滴加NaOH 溶液至过量
先出现白色胶状沉淀, 后沉淀逐渐溶解
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
氢氧化铝与稀盐酸的反应 Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3+3H+ = Al3++3H2O
氢氧化铝与氢氧化钠溶液的反应 Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
实验结论:
1、实验室制备Al(OH)3 铝盐溶液和氨水反应
Al2(SO4)3+ 6NH3·H2O= 2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3·H2O= Al(OH)3↓+3NH4+
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
2、氢氧化铝
优点:
本品为复方制剂,
Al(OH)3碱性 每粒含氢氧化铝 不强,不会对 140毫克
胃壁产生强烈
的刺激或腐蚀
推测
作用。
Al(OH)3+3H+ = Al3++3H2O
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
实验步骤
实验现象
方案一:在试管里加入 约1mL 硫酸铝溶液,用胶 头滴管逐滴滴加氨水至 过量
生成白色胶状沉淀,氨 水过量时,沉淀不溶解
方案二:在试管里加入 约1mL 硫酸铝溶液,用 胶头滴管逐滴滴加NaOH 溶液至过量
先出现白色胶状沉淀, 后沉淀逐渐溶解
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
氢氧化铝与稀盐酸的反应 Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3+3H+ = Al3++3H2O
氢氧化铝与氢氧化钠溶液的反应 Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O
沪科版高中化学拓展课程 6. 氢氧化铝【优秀课件】
实验结论:
1、实验室制备Al(OH)3 铝盐溶液和氨水反应
Al2(SO4)3+ 6NH3·H2O= 2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3·H2O= Al(OH)3↓+3NH4+
沪科版化学高二上册-8.2.2 氢氧化铝 课件 ppt
课程导入
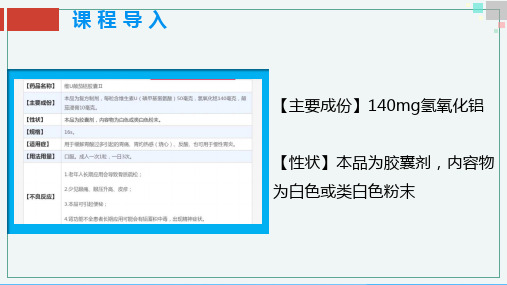
【主要成份】140mg氢氧化铝
【性状】本品为胶囊剂,内容物 为白色或类白色粉末
第二节 几种重要的金属化合物 第四课时 氢氧化铝
学习目标
学习目标: 1、掌握氢氧化铝的主要性质 及应用; 2、通过实验探究掌握氢氧化 铝的制备方法; 3、提高观察实验现象,分析 实验结论的能力。
学习重点:氢氧化铝的化学性质及制备 学习难点:氢氧化铝制备方法的探究
2Al + 3H 2 SO4 = Al 2(SO4) 3 + 3H 2↑;
.
Al 2(SO4) 3 + 3NH3 ·H2O = Al(OH)3 ↓ + 3(NH4) 2SO4 ;
(2)你认为甲的实验方案应该如何改进?将加稀硫酸改为通入CO2;写出改进
后的实验方案涉及到的反应方程式: 2Al + 2NaOH + 2H2O= 2NaAlO2 + 3H 2↑.
自主学习
1.氢氧化铝的物理性质: Al(OH)3是几乎不溶于水的 白色胶状物质 ,但能凝聚水中的悬浮物,
并能吸附 悬浮物 和 色素 。氢氧化铝胶体可用作净水剂、色素吸附剂等。 2.氢氧化铝的化学性质: (1)不稳定性:加热时,氢氧化铝分解为_A__l2_O__3 __和__H__2O__。 化学方程式为: _2_A_l_(_O_H_)_3_=∆_=_A_l_2O__3+__3_H_2_O_____ (2)氢氧化铝和盐酸反应的离子方程式 :_A_l_(O__H__)3_+__3_H_+__=__A_l_3_+_+_3_H__2_O_ (3)氢氧化铝和氢氧化溶液反应的离子方程式:
AlO2-+ CO2 + 2H2O=Al(OH)3 ↓ + HCO3 -
【主要成份】140mg氢氧化铝
【性状】本品为胶囊剂,内容物 为白色或类白色粉末
第二节 几种重要的金属化合物 第四课时 氢氧化铝
学习目标
学习目标: 1、掌握氢氧化铝的主要性质 及应用; 2、通过实验探究掌握氢氧化 铝的制备方法; 3、提高观察实验现象,分析 实验结论的能力。
学习重点:氢氧化铝的化学性质及制备 学习难点:氢氧化铝制备方法的探究
2Al + 3H 2 SO4 = Al 2(SO4) 3 + 3H 2↑;
.
Al 2(SO4) 3 + 3NH3 ·H2O = Al(OH)3 ↓ + 3(NH4) 2SO4 ;
(2)你认为甲的实验方案应该如何改进?将加稀硫酸改为通入CO2;写出改进
后的实验方案涉及到的反应方程式: 2Al + 2NaOH + 2H2O= 2NaAlO2 + 3H 2↑.
自主学习
1.氢氧化铝的物理性质: Al(OH)3是几乎不溶于水的 白色胶状物质 ,但能凝聚水中的悬浮物,
并能吸附 悬浮物 和 色素 。氢氧化铝胶体可用作净水剂、色素吸附剂等。 2.氢氧化铝的化学性质: (1)不稳定性:加热时,氢氧化铝分解为_A__l2_O__3 __和__H__2O__。 化学方程式为: _2_A_l_(_O_H_)_3_=∆_=_A_l_2O__3+__3_H_2_O_____ (2)氢氧化铝和盐酸反应的离子方程式 :_A_l_(O__H__)3_+__3_H_+__=__A_l_3_+_+_3_H__2_O_ (3)氢氧化铝和氢氧化溶液反应的离子方程式:
AlO2-+ CO2 + 2H2O=Al(OH)3 ↓ + HCO3 -
氢氧化铝的性质ppt课件

是不能把氢氧化铝溶解的。(比醋酸弱的)
5
探索:请用铝盐制备Al(OH)3
Al3+
NH3·H2O (aq) NaOH(aq)
Al(OH)3
最佳方法一:
铝盐和氨水反应制备氢氧化铝。 AlCl3+3NH3.H2O ==Al(OH)3↓+3NH4Cl Al3++3NH3.H2O ==Al(OH)3↓+3NH4+
n
2.5
2
1.5
1
0
1 1.5 2
n〔 Ba(OH)2 〕
16
【提高二】将100 mL a mol/L的NaOH溶液滴加到100mL
bmol/L的AlCl3溶液中,试推导a与b的关系,并计算能得到 Al(OH)3的物质的量。
17
n(沉淀)
01 2
3 4 5 6 n(OH-)
13
【应用一】将0.5mol/L AlCl3溶液100mL,跟某未 知浓度的NaOH溶液50mL相混合,得到1.56g沉 淀,则烧碱溶液的浓度是多少?
n〔Al(OH)3〕
0.05
0.02 0 0.05 0.10 0.15 0.20
n(OH-)
14
【应用二】将AlCl3溶液和NaOH溶液等体积混合, 得到的沉淀物中含铝元素的质量与溶液中所含铝
10
NaOH
Al3++3OH-=Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O
n〔Al(OH)3〕
A
Al2(SO4)3
NH3·H2O
01 2 3
n〔Al(OH)3〕
B n(OH-)
4
A
Al2(SO4)3 01 2 3 4
5
探索:请用铝盐制备Al(OH)3
Al3+
NH3·H2O (aq) NaOH(aq)
Al(OH)3
最佳方法一:
铝盐和氨水反应制备氢氧化铝。 AlCl3+3NH3.H2O ==Al(OH)3↓+3NH4Cl Al3++3NH3.H2O ==Al(OH)3↓+3NH4+
n
2.5
2
1.5
1
0
1 1.5 2
n〔 Ba(OH)2 〕
16
【提高二】将100 mL a mol/L的NaOH溶液滴加到100mL
bmol/L的AlCl3溶液中,试推导a与b的关系,并计算能得到 Al(OH)3的物质的量。
17
n(沉淀)
01 2
3 4 5 6 n(OH-)
13
【应用一】将0.5mol/L AlCl3溶液100mL,跟某未 知浓度的NaOH溶液50mL相混合,得到1.56g沉 淀,则烧碱溶液的浓度是多少?
n〔Al(OH)3〕
0.05
0.02 0 0.05 0.10 0.15 0.20
n(OH-)
14
【应用二】将AlCl3溶液和NaOH溶液等体积混合, 得到的沉淀物中含铝元素的质量与溶液中所含铝
10
NaOH
Al3++3OH-=Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O
n〔Al(OH)3〕
A
Al2(SO4)3
NH3·H2O
01 2 3
n〔Al(OH)3〕
B n(OH-)
4
A
Al2(SO4)3 01 2 3 4
高二化学铝的重要化合物(PPT)3-3

根肥大快,低温条件下成形、成色能力强;皮、肉、芯三红,颜色深,着色快,根形整齐,根皮光滑,收尾好,形状好看。 [] 宝冠 进口品种,根形整齐, 一般长~cm粗cm左右,尾部 宝冠 宝冠 收尖好,红心,红肉,红皮,中心轴细小,适于生产加工胡萝卜汁和胡萝卜粒原料,抗旱,耐暑,宜于夏季播种,属 高产增收型品种,播后天左右根重可达~g,播后天起可以开始上市,每亩(m)产成品可达kg。 [] 红芯六号 杂交种,地上部分长势强而不旺,叶色浓绿生 育期~天,抗抽薹性极强,适合中国大部分地区春季露地播种或南方地区小拱棚越冬栽培;肉质根光滑整齐,柱形;皮、肉、心浓鲜红色,心柱细,口感好; 肉质根长cm,粗约cm,单根重约g,m产量约kg;胡萝卜素含量为新黑田五寸的~倍,总胡萝卜素~mg/kg,其中β-胡萝卜素含量~mg/kg,是适合鲜食与加 工的理想品种。 [] 春红二号 生育期天左右,为早熟品种;根形为整齐的柱形,外表光滑 春红二号 春红二号 ,皮、肉、心均为鲜红色根长8cm,直径~cm, 是适合春夏栽培的早熟耐热品种,m产量~kg左右,适合中国
二、氢氧化铝 Al(OH)3
物理性质:
氢氧化铝是白色胶状物质,几乎不 溶于水,有强的吸附性,可以吸附 水中的悬浮物和各种色素。
定后,注意水肥管理,产量才能提高;生育中期应注意水肥调控,要施缓肥,以保持根形的发育;此品种发芽后~8天长势茂盛,吸肥量剧增,第二时期肥料 应注意其延迟性,要后期起作用。 [] 改良新黑田五寸 生长势强,早期生育好,耐暑性、抗病性较强;肥大好,根部缩尾好,根形优秀;根色深红,根皮光 滑;夏季播种,秋、冬收; 微商货源 ; 获的丰产品种。 [] 超级红芯 属抽薹晚、收尾早、三红率高的超级品种。生长势强,耐暑性、 抗病性强;根部收尾好,长圆柱形,根长8~cm,单根重~g;着色好、肥大快商品率高,生育期天左右,亩产kg左右。 [] 汉城六寸 生长速度快,根皮及芯 部呈鲜红色;生长势强,不易抽 改良新黑田五寸、汉城六寸、超级红芯 改良新黑田五寸、汉城六寸、超级红芯(张) 薹,根形均匀一致,商品性好;生育期 约天,根型长圆筒型,根长8~cm,单根重g左右,根径.~.cm;抗病性强,高产品种,亩产kg以上。 [] 法国阿雅 属早熟性突出,根型好,心部颜色佳的早 熟品种。改良黑田五寸系列,大型高产品种;播种后天采收,根长~cm,肩宽.~cm;根形好,收尾渐细,根皮橘红色;耐热性好,抗萎缩病及叶斑病。 [] 红映二号 引自日本的早熟杂交一代胡萝卜优种,播种后天即可收获。抗抽薹能力特强,适于早春覆膜播种。叶丛挺立,适于密植,产量高。生长强健,肉质
《氢氧化铝的性质》课件

• 用长期焙烧的硫铝 矾岩或泡菜渣等反
• 应需要较长时间的反 应,和高温及高压 条件
酸分解法
• 用氢氧化铵、硫酸、 还原剂等反应制备 氢氧化铝
• 工艺简单,成本较 低,产率高
氢氧化铝的安全注意事项
1 易吸入粉尘
操作时应穿戴防护用品,如ຫໍສະໝຸດ 罩、手套等。2 不宜与强酸接触
避免与强酸接触,以免放出有毒的氯气。
3
配位反应
和一些配体络合或交换,如与氟化物生成水解不容易的氟铝酸盐。
氢氧化铝的应用领域
• 用于制备铝盐,担载剂等化学品 • 作防火材料,防腐涂料等 • 医药及化妆品原料 • 制备铝热剂,多孔陶瓷等高科技材料
氢氧化铝的制备方法
氧化法
• 用铝粉或铝源与碱 性氢氧化物反应
• 需要较高温度和高压
碱分解法
探索氢氧化铝的性质
氢氧化铝是一种重要化学品,具有许多独特的性质和广泛的应用。
氢氧化铝的定义及组成
定义
氢氧化铝是一种化学品,化学式为Al(OH)3,分子量为78.0。
组成
氢氧化铝由氢氧化铝晶体和吸附水分子构成。
性质
热稳定性好,可溶于碱性介质,难溶于酸性溶液和水,具有一定的凝固性。
氢氧化铝的物理性质
晶体结构
氢氧化铝呈六方晶系结构, 居于空间群P63/mmc。
粒子特性
氢氧化铝呈球形、簇状或棒 状颗粒,粒径范围广。
物理状态
氢氧化铝常见物理状态为白 色粉末状。
氢氧化铝的化学性质
1
酸碱反应
可与强酸反应生成相应的盐, 如 AlCl3 等。
2
氧化还原反应
可与一些 金属离子进行 氧化还原反应,生 成相应的氧化 铝。
3 易因水解而变质
• 应需要较长时间的反 应,和高温及高压 条件
酸分解法
• 用氢氧化铵、硫酸、 还原剂等反应制备 氢氧化铝
• 工艺简单,成本较 低,产率高
氢氧化铝的安全注意事项
1 易吸入粉尘
操作时应穿戴防护用品,如ຫໍສະໝຸດ 罩、手套等。2 不宜与强酸接触
避免与强酸接触,以免放出有毒的氯气。
3
配位反应
和一些配体络合或交换,如与氟化物生成水解不容易的氟铝酸盐。
氢氧化铝的应用领域
• 用于制备铝盐,担载剂等化学品 • 作防火材料,防腐涂料等 • 医药及化妆品原料 • 制备铝热剂,多孔陶瓷等高科技材料
氢氧化铝的制备方法
氧化法
• 用铝粉或铝源与碱 性氢氧化物反应
• 需要较高温度和高压
碱分解法
探索氢氧化铝的性质
氢氧化铝是一种重要化学品,具有许多独特的性质和广泛的应用。
氢氧化铝的定义及组成
定义
氢氧化铝是一种化学品,化学式为Al(OH)3,分子量为78.0。
组成
氢氧化铝由氢氧化铝晶体和吸附水分子构成。
性质
热稳定性好,可溶于碱性介质,难溶于酸性溶液和水,具有一定的凝固性。
氢氧化铝的物理性质
晶体结构
氢氧化铝呈六方晶系结构, 居于空间群P63/mmc。
粒子特性
氢氧化铝呈球形、簇状或棒 状颗粒,粒径范围广。
物理状态
氢氧化铝常见物理状态为白 色粉末状。
氢氧化铝的化学性质
1
酸碱反应
可与强酸反应生成相应的盐, 如 AlCl3 等。
2
氧化还原反应
可与一些 金属离子进行 氧化还原反应,生 成相应的氧化 铝。
3 易因水解而变质
氢氧化铝 (1)ppt课件

3、不稳定性:加热会分解为氧化铝和水
感觉,易吐酸水, Al(OH)3碱性不强,不至于对胃 壁产生强烈的刺激或腐蚀作用,但却可以与酸反 应,使胃酸浓度降低,起到中和过多胃酸的作 用。, 此时最好用含氢氧化铝的胃药(如胃舒平)离子 方程式: Al(OH)3+ OH¯= 2AlO2+2H2O
作为净水剂
• 2008年10月1日《南国日报》江西洪水过后,村 民的生活用水受到严重影响。为了让光和村村民 喝上干净水,9月30日,南宁市卫生监督所将明 矾、万消灵片等净水消毒用品。
(1)往装有约5mLAl2(SO4)3溶液试管逐滴NaOH溶 液。
• 现象:先生成白色胶状沉淀,后沉淀溶解
Al2(SO4)3 + 3NaOH ===Al(OH)3 ↓+ 3Na2SO4 Al(OH)3+ NaOH = NaAlO2+2H2O
偏铝酸钠
Al(OH)3+OH¯= AlO2 +2H2O
结论:
明矾能够净水是由于生成了氢氧化铝胶体,氢氧化铝 胶体具有很强的吸附能力所以明矾可以起净化作用
小结:
• 物理性质:白色胶状物质,几乎不溶于水,具有吸附作用
化学性质:1、与强碱反应 Al(OH)3+ NaOH = NaAlO2+2H2O 2、与酸反应 Al(OH)3+3HCl = AlCl3+3 H2O 两性氢氧化物
• 上述两个方案都能获得氢氧化铝白色沉淀,但用 氢氧化钠溶液要控制用量,一有疏忽,可能得不 到沉淀,而氢氧化铝不溶于过量氨水,所以在实 验室里最好用铝盐溶液和氨水反应来制备氢氧化 铝。
Al(OH)3 与酸反应?
• 向Al(OH)3沉淀中加入HCl溶 液。
化学课件《氢氧化铝的性质和制备》优秀ppt(说课) 人教课标版

91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
三、制备 Al3++3NH3.H2O=Al(OH)3+NH4+
YOUR SITE HERE
氢氧L化O铝GO
YOUR SITE HERE
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
最佳方案!
方法:向少量AlCl3溶液中逐滴滴加氨水
满
实验现象:
足
有白色絮状沉淀生成 条
解 释:
件
一
Al3++3NH3·H2O=Al(OH)3 +3NH4+
YOUR SITE HERE
知识延伸——氢氧化铝的应用
广州越秀区东濠涌整治前后
整治前
整治后
YOUR SITE HERE
静置
氢氧化铝净水
10
20
min
min
10
20
min
min
加Al(OH)3
后静置
YOUR SITE HERE
氢氧化铝净水原理
Al(OH)3
三、制备 Al3++3NH3.H2O=Al(OH)3+NH4+
YOUR SITE HERE
氢氧L化O铝GO
YOUR SITE HERE
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
最佳方案!
方法:向少量AlCl3溶液中逐滴滴加氨水
满
实验现象:
足
有白色絮状沉淀生成 条
解 释:
件
一
Al3++3NH3·H2O=Al(OH)3 +3NH4+
YOUR SITE HERE
知识延伸——氢氧化铝的应用
广州越秀区东濠涌整治前后
整治前
整治后
YOUR SITE HERE
静置
氢氧化铝净水
10
20
min
min
10
20
min
min
加Al(OH)3
后静置
YOUR SITE HERE
氢氧化铝净水原理
Al(OH)3
课件-4.2.2氧化铝和氢氧化铝

四羟基合铝酸根离子
结论:氢氧化铝是两性氢氧化物
两性氢氧化物——既与强酸反应生成 盐和水,又与强碱反应生成盐和水的 氢氧化物。
受热易分解:
△
2Al(OH)3== Al2O3+3H2O
3、氢氧化铝的化学性质
a.两性氢氧化物: Al(OH)3+3H+== Al3++ 3H2O
Al(OH)3+OH == [Al(OH)4]
铝盐:
AlCI3+3 3;3 OH == Al(OH)3↓
-
Al(OH)3+NaOH==Na[Al(OH)4]
Al(OH)3+OH == [Al(OH)4] Al3++4 OH ==[Al(OH)4]-
观察与思考 氢氧化铝与酸、碱溶液的反应
在一支试管中放入1/4试管容积的0.5mol.L-1的 Al2(SO4)3溶液,滴加氨水直到不再产生沉淀为止。 将沉淀分为两份:一份滴加盐酸,另一份滴加 NaOH溶液,观察发生的现象。
实验记录
实验内容 硫酸铝与 氨水反应 氢氧化铝 与盐酸反 应 氢氧化铝 与氢氧化 钠反应 实验现象 产生白 色沉淀 白色沉 淀溶解 结论 Al2(SO4)3+6NH3· 2O== H
2Al(OH)3↓ +3(NH4)2SO4
Al(OH)3+3HCI== AlCI3+ 3H2O
白色沉 淀溶解
Al(OH)3+NaOH==Na[Al(OH)4]
一、氢氧化铝 Al(OH)3
2、制备:
实验1、Al2(SO4)3溶液滴加氨水 Al2(SO4)3+6NH3· 2O==2Al(OH)3↓ H
+3(NH4)2SO4 Al3++3NH3· 2O==Al(OH)3 ↓ +3NH4+ H
结论:氢氧化铝是两性氢氧化物
两性氢氧化物——既与强酸反应生成 盐和水,又与强碱反应生成盐和水的 氢氧化物。
受热易分解:
△
2Al(OH)3== Al2O3+3H2O
3、氢氧化铝的化学性质
a.两性氢氧化物: Al(OH)3+3H+== Al3++ 3H2O
Al(OH)3+OH == [Al(OH)4]
铝盐:
AlCI3+3 3;3 OH == Al(OH)3↓
-
Al(OH)3+NaOH==Na[Al(OH)4]
Al(OH)3+OH == [Al(OH)4] Al3++4 OH ==[Al(OH)4]-
观察与思考 氢氧化铝与酸、碱溶液的反应
在一支试管中放入1/4试管容积的0.5mol.L-1的 Al2(SO4)3溶液,滴加氨水直到不再产生沉淀为止。 将沉淀分为两份:一份滴加盐酸,另一份滴加 NaOH溶液,观察发生的现象。
实验记录
实验内容 硫酸铝与 氨水反应 氢氧化铝 与盐酸反 应 氢氧化铝 与氢氧化 钠反应 实验现象 产生白 色沉淀 白色沉 淀溶解 结论 Al2(SO4)3+6NH3· 2O== H
2Al(OH)3↓ +3(NH4)2SO4
Al(OH)3+3HCI== AlCI3+ 3H2O
白色沉 淀溶解
Al(OH)3+NaOH==Na[Al(OH)4]
一、氢氧化铝 Al(OH)3
2、制备:
实验1、Al2(SO4)3溶液滴加氨水 Al2(SO4)3+6NH3· 2O==2Al(OH)3↓ H
+3(NH4)2SO4 Al3++3NH3· 2O==Al(OH)3 ↓ +3NH4+ H
化学人教版(2019)必修第一册3.2.1铝、氧化铝、氢氧化铝(共15张ppt)

小结:“铝三角”
OH-(足量强碱)
Al3+OH-(少量H)+、(强NH酸3·)H2O、AlOA2-l等(OH)3H+(少O量H)-、(强CO碱2、) Al3+等AlO2-
H+(足量强酸)
此转化过程全部是非氧化还原反应,转化试剂都是酸,碱、盐等。
当堂训练
1、下列关于铝和氧化铝的说法正确的是( B )
硬度很大,是一种较好的耐火材料。
2、化学性质
Al2O3是两性氧化物,与强酸或强碱反lCl3 + 3H2O Al2O3 + 2NaOH = 2NaAlO2 + H2O
[练习2]下列关于铝和氧化铝的说法不正确的是( A )
A.铝是地壳中含量最多的元素 B.铝在自然界中通常以化合态形式存在 C.金属铝在空气中有良好的抗腐蚀性 D.氧化铝是一种高硬度、高熔沸点的化合物,红宝石、
[练习3]下列有关Al与NaOH溶液反应的说法中,正确的是( D )
A.Al是还原剂,H2O和NaOH都是氧化剂 B.NaOH是氧化剂,其还原产物是H2 C.水是氧化剂,铝被还原 D.1 mol 铝参加反应,则被还原的H2O的物质的量为3 mol
解析:Al与NaOH溶液反应,可认为是分两步进行。 ① 2Al + 6H2O = 2Al(OH)3 + 3H2 ↑ ② 2Al(OH)3+2NaOH = 2NaAlO2+4H2O
一、铝的性质
1、物理性质
地壳中含量最多的金属元素,银白色固体,具有良好 的导电性、导热性和延展性。
2、化学性质 (1)与O2反应:4Al + 3O2 点燃 2Al2O3
现象:点燃铝箔,剧烈燃烧,放出大量热,发出耀眼的光,没有液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液500ml,反应完全后,再向其中滴入NaOH溶液,
生成的沉淀量和滴入的NaOH的量的关系如图:
(1)写出相 应的方程式 (2) Mg的含量 (3)a,b,c 的值
6.8g 2.9g
a bc
三、合金
定义:由两种或两种以上的金属(或金属和非金属) 熔合而成的有金属特性的物质。
特点:①合金的性质不是各成分金属性质的总和。
②合金的熔点、密度一般比各成分的金属低。
③合金的硬度一般比各成分的金属大。
④合金的化学性质也和各成分金属不同。最早
的合金是___青___铜_____,最常见、用量最大的合金是 _____钢________。
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
列实验方法得到Al(OH)3的量最多的是 :
H+
OH-
a、Al——→ Al3+ ——→T·M·
OH-
H+
b、Al——→AlO2- ——→T·M·
H+
c、Al——→Al3+
OH-
→T·M·
Al——→AlO2-
有关氢氧化铝的计算问题:
例1:向100mL 1mol/L AlCl3 溶液中加入____mol NaOH , 生成沉淀3.9 g。
Al3++NH3·H2O → AlO2-+CO2 → Al(OH)3+OH- →
➢ 有关系数比例关系:
有关Al(OH)3的制备问题的讨论:
1、由AlCl3出发制Al(OH)3 用哪种试剂较好,由NaAlO2出发呢?
2、练习:现有1.65mol的H2SO4 , 3.3mol的NaOH及足量Al , 下
法一:一般方程式分析法。(既:量的讨论) 法二:图形分析法。
AlCl3中滴加NaOH NaAlO2中滴加HCl HCl中滴加NaAlO2 NaOH中滴加AlCl3
法三:方程式直接配平法。
有关Al3+、AlO2-图形分析实例:
例2:将一定量的Mg、Al投入100mL,一定的物质的量浓 度的HCl中,合金全部溶解。向所得溶液中滴加5mol/L的 NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如 图所示。求:
第一节 镁和铝
第三课时 氢氧化铝性质、 合金
• 复习回顾
• 氧化镁、氧化铝性质相比较有什么不同之处?
• 氢氧化铝、氢氧化镁的性质相比较有什么不同 之处?
(1)物理性质:白色胶状物质, 具有一定的吸附作用
(2) 化学性质—— “铝三角”
➢ 有关方程式:
Al3++OH- →
AlO2-+H+ → Al(OH)3+H+ →
(1)合金中Mg、Al的质量分别是多少? (2)原HCl的物质的量浓度?
(g)
例3:根据已知条件作图
19.4
➢向含等物质的量的MgCl2、AlCl3溶液中 11.6 滴加入NaOH溶液。
20
➢向明矾溶液中滴加Ba(OH)2溶液.
(mL)
160
例4:Al2O3和MgO的混合物mg滴入1mol/L的盐酸
生成的沉淀量和滴入的NaOH的量的关系如图:
(1)写出相 应的方程式 (2) Mg的含量 (3)a,b,c 的值
6.8g 2.9g
a bc
三、合金
定义:由两种或两种以上的金属(或金属和非金属) 熔合而成的有金属特性的物质。
特点:①合金的性质不是各成分金属性质的总和。
②合金的熔点、密度一般比各成分的金属低。
③合金的硬度一般比各成分的金属大。
④合金的化学性质也和各成分金属不同。最早
的合金是___青___铜_____,最常见、用量最大的合金是 _____钢________。
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
列实验方法得到Al(OH)3的量最多的是 :
H+
OH-
a、Al——→ Al3+ ——→T·M·
OH-
H+
b、Al——→AlO2- ——→T·M·
H+
c、Al——→Al3+
OH-
→T·M·
Al——→AlO2-
有关氢氧化铝的计算问题:
例1:向100mL 1mol/L AlCl3 溶液中加入____mol NaOH , 生成沉淀3.9 g。
Al3++NH3·H2O → AlO2-+CO2 → Al(OH)3+OH- →
➢ 有关系数比例关系:
有关Al(OH)3的制备问题的讨论:
1、由AlCl3出发制Al(OH)3 用哪种试剂较好,由NaAlO2出发呢?
2、练习:现有1.65mol的H2SO4 , 3.3mol的NaOH及足量Al , 下
法一:一般方程式分析法。(既:量的讨论) 法二:图形分析法。
AlCl3中滴加NaOH NaAlO2中滴加HCl HCl中滴加NaAlO2 NaOH中滴加AlCl3
法三:方程式直接配平法。
有关Al3+、AlO2-图形分析实例:
例2:将一定量的Mg、Al投入100mL,一定的物质的量浓 度的HCl中,合金全部溶解。向所得溶液中滴加5mol/L的 NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如 图所示。求:
第一节 镁和铝
第三课时 氢氧化铝性质、 合金
• 复习回顾
• 氧化镁、氧化铝性质相比较有什么不同之处?
• 氢氧化铝、氢氧化镁的性质相比较有什么不同 之处?
(1)物理性质:白色胶状物质, 具有一定的吸附作用
(2) 化学性质—— “铝三角”
➢ 有关方程式:
Al3++OH- →
AlO2-+H+ → Al(OH)3+H+ →
(1)合金中Mg、Al的质量分别是多少? (2)原HCl的物质的量浓度?
(g)
例3:根据已知条件作图
19.4
➢向含等物质的量的MgCl2、AlCl3溶液中 11.6 滴加入NaOH溶液。
20
➢向明矾溶液中滴加Ba(OH)2溶液.
(mL)
160
例4:Al2O3和MgO的混合物mg滴入1mol/L的盐酸
