热休克蛋白70与心肌保护
热休克蛋白70与心肌细胞的凋亡

或 表达 量 很 少 , 在热 应 激或 其 他 应激 作 用 下 迅 速 但
增 加 表 达 , 于诱 导 型 HS 7 ; ) 激 同源 蛋 白 7 属 P02热 0 (et h c on t 7 ) 也称 为 H P 3 在 所有 细胞 h a so kc g a 0 , e S7 。 的胞浆 和胞 核 中均 有 所 表 达 .为结 构 型 HS 7 . P 0 与
实用临床医学 2 1 0 1年 第 1 2卷 第 1 2期
P a t a 咖 i l dcn ,0 1 V l 2 N 2 r ci l c C c iie 2 1 , o , o 1 a Me 1
・
1 3・ 2
热休克蛋 白 7 0与 心 肌 细 胞 的凋 亡
童金 英 综述 )朱 清 仙 审校 ) ( , ( ( 昌大 学 a 究 生院 医学部 2 0 南 . 研 0 8级 ; . 础 医学院 , 昌 3 0 0 ) b基 南 3 0 6
H P 0具 有 高度 的序 列 同源 性 (5 和相 似 的生物 S7 9 %)
化 学 特 性 ; ) 萄 糖 调 节 蛋 白 7 (lcs euae 3葡 8 gu oerg lt d poe 7 , R 7 ) 存 在 于 内质 网胞 内 ; ) R 7 , rti 8G P 8 , n 4 G P 5 位 于线 粒体 内。
白质 , 也称 热 应激 蛋 白。H P家 族被 分 为 : P 1 、 S HS 10 H P O H P 0 H P 0和小 分子 HS , 中 H P 0 S9 、S7 、S6 P其 S 7 是 研 究较 多 的蛋 白质之 一 [。近 年来 国 内外 学 者一 直 2 ] 在 探 索 H P 0的特 性及 其 在 心 脏 疾 病 治 疗 中的 作 S7
热休克蛋白70与心肌保护研究现状

20 0 7年
右江 民族 医学 院学oo h e e e d rn ac lr d v lp n lrg ltrft e Ti g n uig v sua e e me t 2 o
po tr i hm. i h s J . o rmoe.Bo e Bo y.[ ] C mm,9 8 2 2 5 6 c p 19 , 5 : 4
一 一
热休克转 录因子 (et hc asr t nfc r HS F) Hs ha okt nci i t , T 和 s r po a o P 基 因上特异 DN A片段 即热休克素 (et hc l n,H E 的 ha okee t S ) s me 结合有关 。在非应 激状态下 , E以单 体形式 存在 于胞浆 中, HS 不与 HS E结合 。当生物体受到多种损伤性应 激原刺激时 , F HS 作为启动子与 HS E结合 , 启动 H P 0的转 录合成 。 ST 2 2 抗氧 化及炎 性损 伤作用 目前 认为 自由基的作 用 、 . 细胞 内钙超载及炎 性细胞 浸润在 缺 血再灌 注 侦 伤 中起 重要 作用 。 HS T P 0对损伤心肌保 护作用 与其 阻止再 灌注损 伤时氧 自由基 的释放和细胞 内钙 反常及抗 炎作用 有关 。心肌 缺血 时氧 自由 基产生增 加 , 导致细胞内钙离子 超载 , 可以损伤细 胞膜 、 坏 它 破 细胞 酶系统、 细胞核和核糖 体蛋 白, 血管通 透性增 加 , 子泵 使 离 衰竭 , 导致心 肌功 能 失常 。Hs P的抗 氧 化作 用分 为 如下 两 方 面: 一方面通过抑制产 生氧 自由基 的关 键酶 即氧化 酶 , 馈减 反
5 1 5 .
收稿 日期 :o 7 6 1 2 0 —0 —0
【江苏省自然科学基金】_心肌保护作用_期刊发文热词逐年推荐_20140815
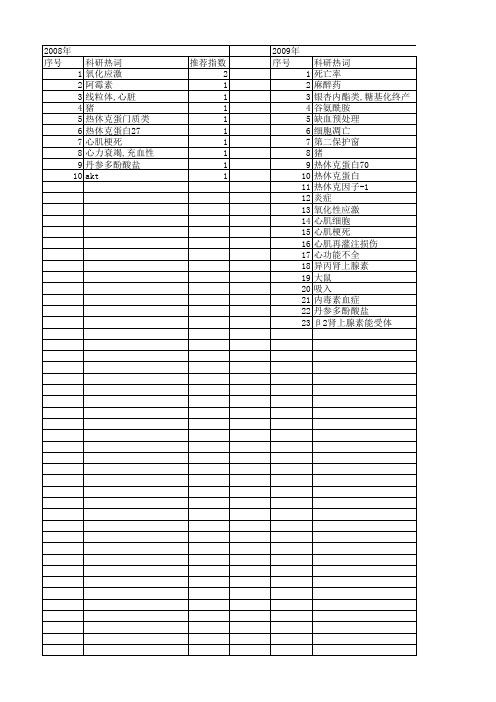
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31
科研热词 推荐指数 预处理 2 心肌再灌注损伤 2 心肌保护 2 异氟烷 2 麻醉药,吸入 1 过氧化氢酶 1 转基因鼠 1 谷胱甘肽还原酶 1 谷胱甘肽过氧化物酶 1 谷胱甘肽-s转移酶 1 蛋白激酶b(akt) 1 老年 1 缺血预处理 1 缺血/再灌注损伤 1 细胞凋亡 1 组织学 1 磷酸化抑制蛋白 1 热休克蛋白27 1 炎症 1 心肌 1 心功能不全 1 心力衰竭 1 异氟醚 1 基因转染 1 吸人麻醉药预处理 1 内源性抗氧化酶 1 内毒素血症 1 信号通路 1 β 2肾上腺素能受体 1 p38丝裂原活化蛋白激酶 1 p13k/akt信号通路 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19
2011年 科研热词 推荐指数 预处理 2 心肌缺血再灌注损伤 2 七氟烷 2 麻醉药 1 血清 1 自噬 1 缺氧/复氧 1 生脉注射液 1 气阴两虚 1 气相色谱-飞行时间质谱 1 核转录因子-к b 1 核转录因子-κ b 1 方证对应 1 心肌缺血 1 吸入 1 体外实验 1 代谢组学 1 中药复方 1 h9c2心肌细胞 1
推荐指数 1 1
2008年 序号 1 2 3 4 5 6 7 8 9 10
科研热词 氧化应激 阿霉素 线粒体,心脏 猪 热休克蛋门质类 热休克蛋白27 心肌梗死 心力衰竭,充血性 丹参多酚酸盐 akt
推荐指数 2 1 1 1 1 1 1 1 1 1
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
热休克蛋白70对心脏移植供心保护作用的实验研究

r e c i p i e n t r a t s a t i f v e t i m e p o i n t s a f t e r h e a t s t r e s s( O h , 2 4 h , 4 8 h , 9 6 h , 1 9 2 h ) .T h e l e v e l s o f H S P T 0 e x p r e s s i o n
R 2 4 h组受体 中的乳酸脱氢酶和肌 酸激 酶浓 度最低 , 供 心的炎症 损伤最 小。结论 : 热休 克预适 应可 能是
一
种临床 中切实 可行 的减 轻心肌缺血 缺氧损伤 的方 法。热休 克预适应. HS P 7 0 一 心肌保 护作用 之间存在
时 间一 剂量 一 疗 效的关联。
[ 关键词 ] 心脏移植 ; 热休克蛋 白 7 0 ; 热休 克预适应 ; 供心保护
F t s t r e s s a n d o n e w a s a c o n t r o l g r o u p .Do n o r h e a r t s we r e h e t e r o t o p i c a l l y t r a n s p l a n t e d i n t o
热休克蛋白70与心肌保护研究现状

热休克蛋白70与心肌保护研究现状(作者:___________单位: ___________邮编: ___________)【关键词】热休克蛋白质70 心肌缺血心肌再灌注损伤/治疗热休克蛋白(heat shock protein, HSP)是指细胞在应激原特别是环境高温诱导下所产生的,由热休克基因所编码合成的,序列高度保守的一组蛋白质。
近年来研究发现,以热、缺血缺氧为应激原或通过基因调控的方法诱导心肌细胞产生热休克蛋白,可使心肌具有抗热、抗缺血缺氧的保护作用。
热休克蛋白按其分子量不同分为多个家族,其中,热休克蛋白70(HSP70)备受重视,已成为新近较重视的内源性心肌保护途径之一,在对抗心肌缺血再灌注损伤中发挥着极为重要的作用。
综合近几年的研究热点,现就其特性及其在心肌保护方面的研究现状进行综述。
1 HSP的一般概况1962年Ritossa[1]首次从果蝇在热应激环境中诱导合成而命名,随后的研究发现,除高温外,缺血、低氧、重金属盐及大多数病理状态下都能诱导细胞产生热休克蛋白,因此又称应激蛋白,但习惯上仍沿用热休克蛋白这一名称。
根据分子量大小和同源程度可分为HSP110,HSP90,HSP70,HSP60及小分子量HSP等几个家族,每个家族又有多个成员。
HSP70是HSP家族中最保守、最主要、含量最丰富,也是近年来研究备受关注的一类。
HSP70家族(分子量:72~80)成员最多,共有21种蛋白质,是一组进化上高度保守的应激蛋白。
按表达情况可分为结构型HSP70和诱导型HSP70,生理情况下,正常细胞可表达结构型HSP70,应激情况下略有增加。
结构型HSP70又可分为两种,即葡萄糖调节蛋白78(glucose-regulated protein, GRP78),这种蛋白存在于内质网腔内;另一种是GRP75,主要存在于线粒体内。
诱导型HSP70即HSP72,仅出现于应激细胞,通常在正常细胞中并不表达或表达量甚少,但是在热应激或其它应激原的作用下则表达迅速增加[2]。
热休克蛋白70对供心一氧化氮及一氧化氮合酶表达的影响

热休克蛋白70对供心一氧化氮及一氧化氮合酶表达的影响(作者:___________单位: ___________邮编: ___________)【摘要】目的探讨热休克蛋白70 (HSP70) 对供心一氧化氮(NO)、一氧化氮合酶(NOS)的影响。
方法Wistar 大鼠18只,分为2组:对照组(C,n = 9),腹腔注射生理盐水0.5 ml,24 h后取离体心脏灌注康斯特保护液(HTK液),4℃保存3 h后建立Langendorff离体心脏灌注模型,灌注KH液2 h;实验组(E,n = 9)腹腔注射重酒石酸去甲肾上腺素(溶于生理盐水中)3.1μmol/kg(0.53mg/kg),腹腔注射24 h后取离体心脏,处理方法同C组。
测定心肌HSP70含量、NO、NOS的含量以及相关生化指标并做统计学处理比较。
结果HSP70含量E 组较C组明显增高(P0.01) ,NO、NOS的含量E组较C组明显增多(P0.01) ,生化指标E组明显优于C组。
结论心肌HSP70高表达对供心具有明显的保护效应,并且其促进心肌NO、NOS的表达,可能是HSP70发挥心肌保护作用的因素之一。
【关键词】热休克蛋白70;一氧化氮;一氧化氮合酶Abstract: OBJECTIVE To investigate the protection of heat shock protein 70 on donor heart and the effects on expression of myocardial cell nitric oxide (NO) and nitric oxide synthase (NOS) of isolated rat heart. METHODS 18 Wistar rats were randomly divided into 2 groups. Control group (C,n = 9) ,Normal saline 0.5ml was injected intraperitoneally and 24 hours later isolated hearts were stored in 4 ℃for 3 hours with Histidine-tryptophan-ketoglutarate (HTK) solutions, and then isolated hearts were perfused for 2 hours by Langendorff model. Experimental group (E,n = 9), Noradrenaline Bitartrate 3.1μmol/kg(0.53mg/kg) was injected intraperitoneally and 24 hours later isolated hearts were stored in 4 ℃for 3 hours with HTK,and then isolated hearts were perfused for 2 hours with Krebs-Henseleit (K-H) solutions by Langendorff model. Myocardial HSP70 content , the expression of NO,NOS and related biochemical indicators were detected. RESULTS HSP70 ,NO and NOS in E group are higher than those in C group and biochemical indicators in E group is better than that in C group . CONCLUSION This study demonstrated that the high expression of HSP70 has obvious protection on donor heart ,and it can markedly affect the expression of NO,NOS of isolated rat heart and it is perhaps one of important factors for myocardial protection.Key words:Heat shock protein 70;Nitric oxide;Nitric oxidesynthase热休克蛋白(heat shock protein,HSP)是一组所有的细胞能在应激情况下由热休克基因所编码合成的序列高度保守的伴随细胞蛋白, 并能对抗更为严重的应激损伤, 研究发现在高温、缺氧、再灌注、局部损伤或感染等多种有害因素[1]刺激均可产生热休克蛋白。
针灸与热休克蛋白60、热休克蛋白70和细胞凋亡关系研究进展

象 。 而针 刺 治 疗 脑 缺 血 性 疾 病 具 有 良好 的疗 效 , 来 越 多 的 越 研 究 表 明 , 刺 能 诱 导 HS 7 针 P 0的 表 达 是 治 疗 有 效 的 原 因 之
针 灸 通 常 以机 械 刺 激 、 刺 激 、 物 刺 激 、 热 药 电刺 激 、 刺 激 光
等 物 理 化 学 方 式 刺 激 人 体 相 关 腧 穴 , 到 激 发 经 络 之 气 、 调 达 协 阴 阳 、 节 人 体 功 能 的 目的 , 一 种 充 分 重 视 人 体 自身 潜 力 激 调 是
一
生 之前 预先 刺激 相关 腧 穴 , 人 体 一 个 适 宜 的 刺 激 , 使 人 体 给 并
H P对 心 肌 的保 护 作 用 才 被 注 意 。8 S O年 代 , ur C re等 的 研 i
究 表 明 , H P 0预 处 理 心 肌 , 减 少 心 肌 梗 死 的 面 积 和 心 用 S7 能 肌 超 微 结 构 的 损 伤 , 时 有 利 于 心 肌 细 胞 的 恢 复 。 Mab r 同 re 等 发 现 转 基 因 小 鼠对 HS 7 P 0的 过 度 表 达 提 高 了 心 肌 对 缺 血 性 损 伤 的 耐 受 力 , 不 伴 有 抗 氧 化 酶 活 性 的 改 变 , 明 且 说
。1 0 8 5‘
-
针 灸 与 热休 克 蛋 白 6 、 休 克 蛋 白 7 0热 0和 细 胞 凋 亡 关 系 研 究 进 展
彭 宏 , 金 标 , 亚 平 洪 林
( 南 中 医药大 学针 灸推拿 学院 , 南 长 沙 4 0 0 ) 湖 湖 10 7
[ 键 词 ] 热 休 克 蛋 白 6 热 休 克 蛋 白 7 细 胞 凋亡 ; 灸 关 0; 0; 针 [ 图 分 类 号 ] R 4 中 25 [ 献标识码 ] A 文 [ 章 编 号 】 10 文 0 8—84 (0 0 1 8 9 2 1 )4—10 0 8 5— 3
热休克蛋白70对幼鼠心肌缺血再灌注损伤保护作用的实验研究

0 6 0 C ia 5 0 0, h n
【 b rc】 O j t e onei tt a i rete fc a s c p tnT P nihma A s at t be i T v ta e ro o cv eeto h th k re (M )o s ei cv i sg e h c d p t i f s f e o o i c —
1 亚组、4h亚组 、6 h亚 组 、 8h亚组 , 亚 组 分 别 于 腹 腔 药 物 注射 l MP+I 组 腹 腔 注 射 T P 2h 2 3 4 各 T R M
(0 sk )S 10 m / g ,C组与 I R组腹腔注射等量 0 9 . %氯化钠溶液 ] 1 、4h3 、8h制作心肌 缺血再灌注 后 2h 2 、6h 4
h a t o t e e u e o ma e ic e a r p r so d la 2 ,2 h,3 h 8 f rt e p er ame t. A l e rs f a sw r s d t k s h mi - ef i n mo e t1 h 4 r e u 6 ,4 h a t h r t t n s e e l
T ep oet ee et f e t h c rti7 ntemyc rilsh mi rp ruini uyi h rtc v f c a okp oe 0o oa da c e a— e efs j r i i oh s n h i o n n mmau e tr
热休克蛋白70在心肌保护中的作用

热休 克蛋 白最初 是在 果蝇 (rsp i ) doohl 中发现 的 。9 2年 , a 16 遗传 学 家 Ri sa等 首次 发 现果 蝇 幼虫 唾 液腺 受 热休 克 的刺 ts o
激 可诱 导特 殊 的基 因激 活 。 17 9 4年 Tsi e 等 利用 S S凝 i e s sr D
Thef nc i n o e ts o k o e n 7 n m y c r a o e to u to fh a h c pr t i 0 i o a di lpr t ci n
WANG ai Y l,YU Do g i n me,GONG h li S ue
Ci) ha n
【 sr c]H a h c rti 0i agop o rtisit — ellrta icesdu d r h t so.nti at l w Ab ta t etsokpoen7 s ru f oe nr cl a t n rae n e esr sr i hs r c e p n a u h t e ie
aot i b s c t i ce ape0d i i ( C, ek nm oa i ce i r eui jr(I I adr- pp s, e s ie wt i h m r n i n g P )w ae yc da i hma e r s ni u M R ) n os a oad hs c t nI 0 r l s p f o n y , e
7 ) 肌 保 护 效 应 已 被 多 次 动 物 实 验 证 明 [ 2h 心 7 1 。
HS 7 P 0家 族 是 一 组最 保 守 、 主 要 的 蛋 白质 家 族 . 最 广泛
护 作用 。另 有研 究 发现 , S 7 H P 0可 以 阻止 热 应激 所致 的 细胞 色 素 C从 线 粒 体 的释 放 , 能 与 A a- 并 p f 1结 合 , 制 Apf 1 抑 a - 和 C sae 9的复 合体 的形 成 , 而抑 制 凋亡 ap s一 从 。
热休克蛋白70与细胞保护

员 , 括 应 激 诱 导 的 HS 7 ( 称 为 HS 7 包 P0 又 P 2或 HS 7 I , 构 P 0) 结 型 热休 克 蛋 白 HS 0 HS 3 , 粒 体 HS 7 ( H8 7 ) C7 ( P7 ) 线 P 5 mt P 5 和 位- f 一内质 网 的 Gr 7 ( P) 应 激 时 , 部 分 诱 导 型 HSP O位 p 8 Bi 。 大 7 于细 胞 核 内并 包 围核 仁 . 复 后 则 移 入 胞 浆 , 次 应 激 又 重 回 恢 再 拖 丰 :。 HS 7 的诱 导 可 能 是 由 于 在 应 激 情 况 下 未 折 叠 和 衰 P( ) 或 变 性 蛋 白 的 出现 , 其 它介 质 包 括 经 典 的 第 二 信使 如 细 咆 内 或 游 离钙 、 白 激 酶 或 DNA 的 改 变 也 与 HS 7 的 诱 导 有 关 蛋 P0 目前 认 为 HS T P 0具 有 多 种 功 能 , 一 种 非 特 异 性 细 胞 保 护 蛋 是 回. 此 备 受 关 注 。 因
维普资讯
国 外 医学 临 味 生 物 化学 与 检 验 学 分 册 2 0 0 2午 第 2 3卷 第 5期
28 7
综 述
热休 克蛋 白 7 细 胞 保 护 O与
HSP 70与心肌保护(一)

HSP 70与心肌保护(一)心脏移植为终末期心脏病的唯一有效的治疗方法,但心脏不同于机体其他组织器官,供心从切取到移植入受体体内缺血、缺氧时间较长,而且它在植入受体后要尽快恢复功能,立即承载起全身其他脏器的供血功能,保证生命。
因此,对供心的心肌保护极为重要。
目前,随着临床手术技术的提高,供心热缺血时间基本可控制于6~10min,如何延长供心冷缺血时间,加强心肌保护效果,减轻心肌缺血再灌注损伤,以便从容运输和手术,甚至建立器官库,资源共享,即成为当今心脏移植的研究热点,也是影响心脏移植广泛开展的瓶颈问题。
热休克蛋白家族(HSP70s)是目前备受关注的应激蛋白,它作为一种“分子伴侣”参与多种细胞的损伤修复,对心肌细胞同样具有保护作用。
提高心肌细胞HSP70含量的方法有两类:(1)诱导内源性HSP70的表达;(2)导入外源性HSP70基因。
近年来实施心肌保护方面的研究多注重于调动心脏内源性的保护机制,以提高心肌细胞自身耐受缺氧的能力。
本文就内源性HSP70与心肌保护的研究进展进行如下综述。
1HSP70概述1.1HSP70的分类及分布热休克蛋白(heatshockprotein,HSP)是一组高度保守的多肽,普遍存在于生物体内。
HSPs研究是从观察果蝇幼虫热应激反应开始的。
Ritossia等发现短期高热处理(大约高于正常体温5℃)可引起果蝇(drosoPhila)幼虫唾液腺细胞的染色体发生“膨松”式(puffing)改变,提示这一区域基因的转录被激活。
这种反应称为热应激反应,而在这种条件下合成的蛋白质即是HSPs。
广义的HSP包括三大类蛋白质:(1)结构性HSP(constitutiveHSP),是在生理状态下固定表达并存在于非应激的正常细胞的胞液和胞核,一般与应激反应无关。
(2)诱导性HSP(inducibleHSP),又称应激蛋白,为狭义的HSP,仅在受到有害因素作用后产生,为高度应激诱导合成,应激时位于胞核,细胞恢复时则移入胞浆,胞核正常条件下不表达或少见合成。
热休克蛋白70对供心一氧化氮及一氧化氮合酶表达的影响

( T ol o s a dte lt er eepr s r or b a gn ofm d1 xe m n l ru E, = H K)s u n , ni a h asw r ef e f 2hus yLne dr oe.E pr et op( n i t n h s e o d t ud o i ag 9 , oarnl eBt t t 3 I mo/g O 5 r / s a j t t ero e l ad2 or lt oa er ) N rde an i ra . t tk ( .3 gk )w 8i e e i mp i na yn hus a ri l e hat i are t a nc d n t l 4 e s t d s
增 高(P<0 0 ), O、 O . 1 N N S的含量 E组较 c组 明显增 多(P < . 1 生 化指标 E组 明显 优于 c组 。结论 0 0 ),
的 因素 之 一 。
心肌
H P 0高表达对供心具有 明显 的保护效应 , ST 并且其促 进心肌 N N S的表达 , 能是 H P 0发挥 心肌保 护作 用 O、 O 可 ST 关键词 : 热休克蛋 白 7 ; 0 一氧化氮 ; 一氧化氮合酶
Ab ta t sr c :OBJ T I EC VE T n et aetep oe t no ets o k poen7 n d n rh ata d te e et n e — oiv si t h rtc o fh a h c rti 0 o o o e r n h f cso x g i
鼠1 8只, 分为 2组 : 对照组 ( , Cl t l=9 , ) 腹腔 注射生理 盐水 0 5m ,4 h 取 离体 心脏 灌 注康斯 特保 护液 ( T . l2 后 HK
热休克蛋白对心肌缺血再灌注损伤的细胞保护作用

冠状动 脉粥样硬化性 心脏病 现称 为“ 血性 心脏病 ” 后一 缺 , 病 名较前者 更 为 准 确地 反 映 了这 类疾 病 的 发 病 机 理 , 论 是 无 “ 心肌梗 塞” 还是 “ , 心绞 痛” “ 、 缺血 心肌病 ” , 肌缺 血都 是最 等 心
重 要 最 基 本 的 病 理 环 节 。 如 “ 性 心 肌 梗 塞 ” Act M ycri 急 ( ue oa d l a
摘 要 心肌 缺血是 缺血性心 脏病的主要病 理改 变。对 于心肌 缺血 在 急性 心肌 梗 塞过程 中的发病 机 理 的研 究 已深入到 分子
水平。心肌缺 血后 的再 灌注在某些 情况下会 引起 损伤 ( 再灌 注损伤 ) 。本 篇主要 探讨 热休 克蛋 白对心肌 缺 血 一再灌 注损 伤 的细胞
o o a d a h mi n my c r ili e a—r p ru in. c s e e f so
K yw rs Me H ha hc rti } ) mycri h mi—rprui ;eu rt t n e od S et okpoe s n(即 ; oada i e a e e s n cl a poe i ls c f o lr l c o
l P与活化 的 H F结 合 , I S S 降低 其活性 形成 反馈 抑制 , 而使体 从 内 HS P的表达量 与所处的环境 相适应 , 整个 过程极 为精细 。在 心肌缺血 再灌 注损伤 中, 有哪些 因素会影 响 HS P的合 成及其
热休克蛋白在生物医学中的应用

热休克蛋白在生物医学中的应用热休克蛋白是一种广泛存在于不同生物体内的蛋白质,也称为分子伴侣。
它的主要作用是帮助其他蛋白质构成正确的三维结构,并使它们得以正确地折叠和工作。
除此之外,热休克蛋白还可以参与调控细胞凋亡、肿瘤、免疫反应等许多生物学过程。
近年来,研究发现,热休克蛋白在生物医学领域具有广泛的应用前景,被视为重要的生物医学研究热点之一。
1. 热休克蛋白在胆囊癌诊断和治疗中的应用胆囊癌是一种常见的恶性肿瘤,目前尚无明确有效的治疗手段。
研究发现,热休克蛋白在胆囊癌的诊断和治疗中有着重要的应用价值。
一项最新研究表明,热休克蛋白70(Hsp70)表达异常与胆囊癌的发生、发展密切相关。
热休克蛋白70在肿瘤细胞内发挥重要的生物学功能,参与了肿瘤细胞的增殖、转移、抗药等多个环节。
因此,可以利用热休克蛋白的特异性表达,开发出更加敏感的胆囊癌筛查和诊断方法,同时也可以研制出更有针对性的治疗方法。
2. 热休克蛋白在心肌梗死的预防和治疗中的应用心肌梗死是临床上常见的心血管疾病,给患者带来了极大的危害。
近年来的研究表明,热休克蛋白在预防和治疗心肌梗死中具有潜在的应用价值。
热休克蛋白可以通过增强心肌细胞的耐受性和抗氧化能力,保护心肌细胞免受缺氧、缺血、再灌注等多种因素的损伤,同时还能促进心肌细胞的自主修复能力,减轻心肌梗死产生的损害和副作用。
3. 热休克蛋白在自身免疫性疾病治疗中的应用自身免疫性疾病是一类由于免疫系统功能失调导致的疾病,如类风湿性关节炎、狼疮、干燥综合征等。
研究表明,热休克蛋白在自身免疫性疾病治疗中有着一定的应用前景。
热休克蛋白可以通过调节免疫系统的功能,增强受损组织和器官的自我修复功能,从而在改善和治疗自身免疫性疾病过程中发挥作用。
4. 热休克蛋白在细胞治疗中的应用细胞治疗是一种通过细胞移植或转移植入治疗人体疾病的方法。
研究发现,热休克蛋白在细胞治疗中有着广泛的应用前景。
热休克蛋白可以有效地提高细胞移植的成活率和免疫逃避性能,从而增强细胞治疗的效果和表现,为实现真正的个性化疾病治疗提供了有力的技术和方法基础。
热休克蛋白的功能

热休克蛋白的功能
热休克蛋白的主要功能包括维持细胞正常功能、降低分子干扰、分解受损细胞,能够提升机体对于外界环境的抵御能力和抵抗能力,帮助维持身体健康状态。
热休克蛋白就是细胞质的蛋白质,有HSP90、HSP110、HSP60、HSP70以及小分子热休克蛋白等五种不同的类型,临床上也可以作为筛查癌症的一种标志物,但相对使用较少。
1、维持细胞正常功能:热休克蛋白实际上是一种保护类型的蛋白质,如人体处于高温或者是恶性状态下,通常会自动合成大量的热休克蛋白来对人体产生保护作用。
可有助于细胞维持原有的正常功能以及活动,以免身体出现不适以及异常表现;
2、降低分子干扰:热休克蛋白能够和其他的蛋白质结合,发挥出对应的生理功能,比如热休克蛋白在护送蛋白分子的寻找结合物的过程当中,可降低外界分子对于体内蛋白分子的影响,以完成整个生理反应过程;
3、分解受损细胞:在机体受到刺激之后导致细胞受损,热休克蛋白就能够将相关细胞进行回收,作为蛋白质的合成材料重新结合成人体所需要的蛋白质。
热休克蛋白名词解释

热休克蛋白名词解释热休克蛋白是一类高度保守的蛋白,它能够适应环境的低温变化,从而为细胞提供必要的热抵抗和调节能力。
它们是生物体自身水平的保护因子,有助于细胞在低温或高温下维持正常的生理活动和结构。
热休克蛋白主要分为热休克蛋白70(Hsp70),热休克蛋白90(Hsp90),热休克蛋白27(Hsp27),热休克蛋白17(Hsp17),热休克蛋白23(Hsp23)。
此外,还有其他类型的热休克蛋白,比如热休克蛋白60(Hsp60),热休克蛋白14 (Hsp14)和热休克蛋白15(Hsp15)。
Hsp70是最常见的热休克蛋白,可以提供局部和全身性的保护作用。
它能够与特定的蛋白质结合,进而调节细胞水平的生物学过程。
Hsp70可以抑制细胞凋亡,促进细胞的恢复和再生,并帮助协调细胞的增殖和分化。
Hsp90的作用则更加复杂,它主要参与细胞膜上信号传导和蛋白质翻译的调节。
Hsp90可以结合和激活细胞膜上的受体,以促进细胞表面蛋白质的翻译,可以有效防止过度表达的蛋白质,调节细胞膜上的结构,参与内部细胞信号传导,并促进细胞内的基因表达和调控。
Hsp27和Hsp17的作用有所不同,Hsp27可以调节细胞的凋亡,保护细胞免受炎症因素的损害,以及促进细胞的修复和抵抗力。
Hsp17可以抵抗钠离子的突变,抵抗细胞凋亡,并维持细胞结构的稳定。
Hsp23是一种细胞凋亡调节蛋白,主要由一个ATP酶结构域和一个细胞膜蛋白结构域组成。
它可以调节细胞凋亡,保护细胞免受环境的损伤。
此外,Hsp23还可以调节细胞的信号传导,加速细胞的分化和再生,以及调节细胞的免疫反应。
热休克蛋白起着至关重要的作用,不仅是细胞维持正常活动和结构的重要保护因子,同时也可以抵御低温和高温环境,促进细胞的再生和抵抗力。
热休克蛋白是一类非常重要的蛋白质,它们可以有效调节细胞的生物学过程,为细胞提供关键的抗低温和高温环境的保护作用,从而促进细胞的健康发育,并协助细胞的正常活动和结构的维持。
热休克蛋白与未成熟心肌保护的研究进展

过短期高热处理,果蝇幼虫唾液腺细胞多丝染色体的“膨松”
(p幽ng)方式发生改变,显示这一区域基因转录被激活,称其
为热休克反应。 从热休克果蝇唾液腺细胞中分离出一组蛋白质即“热休克 蛋白”(heat
shock
protein,HsP),以后对HSP研究越来越深入,
从原核生物到真核生物,从植物、动物到人整个生物界,无论培 养细胞还是整个机体对热休克处理都有HsP合成表达。当细 胞处于高温(40一43℃)、严重缺氧、缺血、内毒素作用及紫外线 照射等应激刺激时,可以激活HsP的合成。它能够快速、短暂 调整应激过程中细胞存活机能,保护细胞抗损伤,并有助于细 胞恢复期正常结构和机能的重建。
HsPs据其分子量大小和功能一般分为3个家族:HsP90、 HSP70和小分子量家族p J。HSP8具有以下几个特点:(1)结构 上的高度保守性:例如果蝇和酵母菌Hsfr70有72%的同源性, 人类和酵母菌HSP90有60%的同源性。(2)非特异性:除热应 激外,其他理化及病理生理刺激如缺血、低氧、重金属盐类、炎 症等都可不同程度地诱导细胞内合成HsPs。(3)分子伴侣作 用(molecular chapemne):几种主要的ATP依赖的HSPs如 HSfr70、HSP60等家族与新生、未折叠或错折叠的蛋白质相结 合,加速正确肽链的折叠和重折叠,同时还促进某些变性蛋白 的降解和清除,恢复酶的活性。(4)交叉耐受性:即机体或细胞 经历一次短暂、轻度的热应激反应后,不仅对其后重度热应激 产生耐受性,使细胞的存活率增加,而且对其他重度损伤(如缺 血、低氧等)刺激产生耐受性。反之,细胞经历轻度缺血等刺激 后,对其后重度缺血损伤和热应激也具有耐受性。
542.2
【文献标识码】A
【文章编号】1002—7386(2010)12一1617一03
外源性热休克蛋白70基因对心肌细胞损伤的保护作用

摘要 目的 : 讨 热休 克 蛋 白 7 ( P 基 因转 染 对心 肌 细 胞 急 性 实验 性 缺 氧 / 探 0 HS ) 复氧 损 伤 的 保 护 作 用及 其 机 制 。方 法 : 行 大 进 鼠乳 鼠原 代 心 肌 细胞 培 养 , 随机 分 为 4组 , 照 组 、 氧/ 氧 ( R) 、 对 缺 复 A/ 组 热休 克 处 理 后 缺 氧 / 氧 ( / +HS 组 和 p D 复 A R ) C NA HS 质 粒 转 导 后缺 氧 / 氧 ( / p D A HS ) 。 用脂 质 体 包裹 p D P 粒 , 转 导入 心肌 细 胞 内。反 转 录一 P 复 A R C N P 组 C NA HS 7 , 质 并
srs .Tosu y tep oe t er l fHS 7 x rsini c t o ada R ij r ,t el o o — dae e eta se te s t d h rtci oeo P( p eso na u emy c r ilA/ nu y h i s meme itdg n r n fr v )e p
—
c u w_ L hn AN
HE M ig n
1 .De a t n f Ca d o a c l r S r e y,Fis Af iitd Ho p t l p rme t r iv su a u g r o r t f lae s ia
o n h n i e st n J a g o i c ,Na c a g 3 0 0 f Na c a g Un v r iy i i n xiPr v n e n h n 3 0 6,Ch n ia;2 .De a t n f Ph r — p rme to a ma
热休克蛋白70与心肌保护

21 0 0年月第 l 2卷第 3期
JN a hn ol dc nvri 00Ma ,2 3 o hC iaC a Meia U ie t 2 1 y 1 ( ) l sy
・3 37・
it eai rsueo fnaii ha m ai t[ ] r l nr rna pesr f uetn edt apt ns J .B cn a l s ln mu e J i
(0 0—0 0 收稿 ) 岳静玲 21 2— 4 (
编辑 )
热 休 克 蛋 白 7 心 肌 保 护 0与
刘 军 涛 张 宇
( 北 煤 炭 医学 院 附属 医 院心 血 管 外 科 华
[ 关键词 ] 热休 克蛋白7 心肌 保护 0 [ 中图分类号 ] R3 9 [ 2 文献标识码 ] A [ 文章编号 】 10 6 3 (0 0 0 3 7— 3 0 8— 6 3 2 1 ) 3— 3 0
o u e t n lph r c k n t s i a in s n e g i g c r n r re y ns fna i a ma o i ei n p t t c e u d r o n o o a y a tr
bp s sre [ ] ns eioy2 0 1 1 4 :6 yas ugr J .A et s lg ,04,0 ( ) 82 y h o [4 M ie a 2 ] es l nC,B n a o tm ehm uD,Bre , t 1 fcso g npama ar e a.Ef t f eo ls J e a
P am c 94,8 4 :6 hr a ,19 陈树强. 芬太尼在腹部手术不同年龄患者的药代 动力学研究 [ ] 中华麻 醉学杂志 ,0 12 ( ) l J. 2 0 ,1 1 :8 f7]徐凯智 , 2 岳静玲 , 胡小琴.国产芬太尼在法洛 四联 症患儿的药代动 力学研究 [ ] 中国新药杂 志,00,( )6 3 J. 2 0 9 9 :2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【关键词】hsp70;心肌缺血/再灌注损伤;心肌保护
热休克蛋白(heat shock proteins, hsps),也称应激蛋白,是生物体或离体培养细胞在应激状态下产生的一类内源性保护蛋白,根据同源程度及相对分子质量大小可分为hsp110、hsp90、hsp70、hsp60、小分子hsps等几个家族。
由于hsp70在正常细胞中水平较低,应激状态下可显著升高,目前成为hsps中最为关注、研究最深入的一个家族[1]。
近年研究发现,缺血/再灌注心肌中有hsp70的表达,通过多种机制产生心肌保护作用。
1概述
1.1 hsp70的分类、表达及分布hsp70家族主要包括hsp72、hsp73、grp78、grp75四个成员,按表达情况分为诱导型和结构型】1-2]。
hsp72为高度应激诱导,存在于胞浆中,胞核在正常条件下不表达或少见合成,为诱导型;hsp73固定表达并存在于胞浆和胞核中,为结构型;grp78、grp75为葡萄糖调节蛋白,分别固定存在于内质网和线粒体。
正常细胞可表达结构型hsp70,在应激下略增加,而诱导型hsp70仅出现于应激细胞,可以在各种应激状态下被诱导,如高热、缺氧、运动、缺血、氧化应激、心衰、射线、内毒素、某些药物等。
hsp70存在于细胞内,并在细胞内发挥作用。
应激时,大部分诱导型hsp70位于细胞核内并包围核仁,恢复后则移入胞浆,再次应激又重回胞核。
1.2应激状态下hsp70的表达机制及调节hsp70表达的原因估计与应激情况下未折叠或变
性蛋白质的出现,或者细胞内游离钙、蛋白激酶、dna等的改变有关。
热休克基因的表达是对变性蛋白的应答,其应答机制被认为与热休克转录因子(heat shock transcription factor, hsf)和热休克元件(heat shock element, hse)有关。
hsf是一种胞浆内的多肽,通常以单体形式存在,少数与hsp70结合;hse为位于hsp70基因启动子中特定的核苷酸序列。
应激情况下,变性蛋白失去正常的三维结构,暴露出内部的hsp70结合位点,hsp70与受损蛋白结合后释放出游离的hsf,游离hsf倾向于聚合成三聚体,向核内移位并与hse上游的起动序列相结合,起动hsp70转录合成。
应激状态下hsp70的表达与细胞的生理状态有关,随着机体衰老和细胞老化,hsp70 mrna 和hsp70的合成和功能均有所降低。
实验表明,青年鼠比老年鼠心肌细胞hsp70表达量明显增多,肥厚的心肌细胞比正常的心肌细胞hsp70表达量减少°hsp70合成还依赖于预存的hsp70 含量和应激反应的严重度,hsp70可作为一种负性调节物质调节hsp70的表达。
应激原刺激可使即早基因(immediately early genes,iegs)先于hsp70基因在细胞内表达,有研究推测 hsp70基因可能是iegs的靶基因之一。
xu等】3]提出,gtp结合蛋白ras和rac 可以显著抑制hsp70合成和hsf的活性。
1.3 hsp70的细胞保护作用hsp70的细胞保护作用是指机体细胞在受到各种应激,如高热、氧化等有害应激时,产生的hsp70可以增强细胞对损害的耐受程度,维持细胞的正常功能代谢,提高细胞生存率,是一种内源性的自我保护机制。
其可能机制为:①提高细胞对应激原的耐受性;②“分子伴侣”作用;③抗细胞凋亡的作用;④减轻过氧化及炎性损伤。
几乎全身所有的细胞都能表达hsp70,心脏的组织细胞在应激状态下亦可产生hsp70,而且产生的主要部位是在血管的内皮细胞,在应激时对心肌收缩功能和内皮功能具有保护作用,以抵抗各种应激原对心肌的损害,如高热、缺血及缺血/再灌注损伤等。
因此,调动心脏内源性的保护机制,以提高心肌细胞自身耐受缺氧的能力,是近年来人们实施心肌保护方面研究的主要着重点。
2hsp70与心肌缺血/再灌注损伤
1988年currie等用全身42°C高温维持15min造成大鼠热休克模型,24 h后心脏离体灌注,形成缺血/再灌注损伤,与对照组相比,热休克组心脏收缩功能显著恢复,肌酸激酶释放减少,过氧化氢酶增多,同时心肌hsp70增多。
后来大量实验证实,多种非致死性应激刺激能诱导心肌合成hsps,如缺血、压力或容量负荷、重金属盐、药物等。
心肌缺血是常见的应激反应,可以诱导心肌细胞表达hsp70。
实验证明短暂的心肌缺血预处理可以诱导hsp70的表达,而且反复多次短暂缺血诱导hsp70表达的量更多,hsp70合成的量与心脏保护的程度有关。
1996年junichiro等研究发现,缺血/再灌注可以诱导热休克转录因子-i(hsf-1)的明显激活,从而调节热休克蛋白基因的转录,促进hsps的合成,而且该研究也证实,在鼠心肌缺血/再灌注后,是再灌注而不是缺血诱导热休克反应。
心肌缺血/再灌注时hsp70产生的主要原因,可能为氧自由基的产生扰乱了蛋白质代谢,产生了分子作用的底物,激活hsf-1,诱导hsp70 mrna基因的表达和hsp70产生[4]。
3hsp70对缺血/再灌注心肌的保护作用
由热应激诱导的hsp70对随后发生的缺血/再灌注损伤具有保护作用,1996年mohamed等在研究热应激后离体鼠心肌缺血/再灌注时发现,心脏机械功能和内皮功能在心肌缺血后的恢复明显改善,如心输出量、左室舒张末期压力变化及冠状动脉血流量均明显增加。
通过hsp70 基因转染技术使心脏过度表达hsp70,也可以促进心肌缺血/再灌注后心脏功能的恢复[5-6]。
1995年marber等将大鼠诱导型hsp70基因插入小鼠基因后,导致小鼠hsp70 mrna超水平表达,与对照组(单纯热休克)相比,缺血/再灌注后心肌梗死面积减少40%,肌酸激酶释放减少50%,收缩功能恢复增加2倍。
非致死性应激和hsp70相互关联,它们通过细胞内在途径起保护作用;非致死性应激可造成细胞内蛋白变性,从而诱导合成hsp70,实现其保护作用[7]。
实验证明多种药物可以诱导hsp70表达,从而增加心脏的保护作用。
在体实验发现,去甲肾上腺素通过a 1-肾上腺素受体诱导鼠心肌c-fos和hsp70的表达,对缺血后心肌功能失调具有延迟性保护作用。
katori等[8]通过预先应用一氧化氮释放剂诱导hsp70表达而减轻鼠心脏移植模型中的心肌缺血/再灌注损伤;xu等[9]在鼠心缺血/再灌注前使用重组人促红细胞生成素预处理,诱导hsp70表达,缩小心肌梗死面积;mc guinness等[10]也在新西兰白兔缺血/再灌注模型中发现,预先应用3-3脂肪酸灌注,可以上调hsp70表达,降低心肌梗死面积;oxman等[11-12]应用乳酸杆菌和gga诱导hsp70过度表达而获得心肌保护作用;国内学者应用参麦注射液、川芎嗪、左旋尼卡汀等药物诱导hsp70表达,达到保护心肌的目的[13-14]。
4hsp70心肌保护作用的可能机制
心肌细胞遭受缺血/再灌注应激后,诱导hsp70表达,发挥“分子伴侣”作用,与新生、未折叠、错折叠或聚集的蛋白质相结合,使某些蛋白质解离,减少产生不溶性聚集物的危险性,并帮助需要折叠的蛋白正确折叠;维持某些肽链的伸展状态,以利于其跨膜转运,在线粒体、内质网等不同区域内发挥作用;同时还能促进某些变性蛋白的降解和清除;维持酶的动力学特征,以维护细胞的功能,抵抗缺血/再灌注损伤,促进心肌细胞功能恢复。
血管内皮细胞的功能是反映心肌状况的一项重要指标,缺血造成的血管内皮损伤将导致冠状血管阻力增加和心肌灌注不足,使再灌注时出现“无灌流现象”[15]。
实验证实热处理后hsp70 在心肌细胞和内皮细胞均有表达;如果将hsp70 cdna转染大鼠冠脉内皮细胞,再置于缺氧环境18h,恢复2h后,细胞内atp浓度较对照增加54%,乳酸脱氢酶漏出减少8%,内皮通透性降低59%。
因此,hsp70的内皮保护功能是其保护缺血心肌的重要保护机制。
心肌缺血/再灌注时氧自由基产生增加,它可以损伤细胞膜、破坏细胞酶系统、细胞核和核糖体蛋白,导致心肌功能失常[16]。
hsp70理论上能减少氧自由基释放,具有稳定细胞膜和溶酶体、防止蛋白质变性的作用。
su等发现,大鼠h9c2细胞经热休克处理后10〜60h细胞耐受低浓度h202损伤的能力增强,耐受较高浓度h202损伤的能力于热休克处理后20〜44h 出现增强o mn-sod是重要的抗氧化酶,可减轻氧自由基损伤,具有心肌保护作用。
研究表明[17],大鼠心脏转染hsp72基因后,可提高缺血/再灌注后心肌mn-sod活性,保护线粒体功能,抑制心肌细胞凋亡,缩小心肌梗死面积。
因此,hsp70除直接导致细胞抗氧自由基酶活性增加外,还可作为“分子伴侣”保护mn-sod等细胞内抗氧自由基酶免受损伤,从而达
到清除自由基的作用。
