2021年人教版必修2高中化学课件1-2元素周期律(共25张PPT)
合集下载
人教版化学必修二第一章第二节-元素周期律优秀课件PPT
ds区,它包括
族,Ⅰ处B于和周Ⅱ期B 表d区和p区之间。它们都
是 ,也属过金渡属元素。
f区元素最后1个电子填充在f轨道上,它包括镧系和锕系元素 (各有15种元素)。
小结
包括元素 s区 ⅠA、ⅡA族 p区 ⅢA~零族 d区 ⅢB~Ⅷ族 ds区 ⅠB、ⅡB族 f区 镧系和锕系
价电子排布 ns1、ns2 ns2np1~6
——依据外围电子的排布特征,看最后一个电子填充的轨道类型。
s区元素 最后1个电子填充在 ns 轨道上,价电子的构型是__n_s1___ 或 ns2 ,位于周期表的 左 侧,包括ⅠA 和 ⅡA族,它们都是 _活__泼__金__属,容易失去电子形成 +1 或 +2价离子。
p区元素最后1个电子填充在 轨道np上,价电子构型是 ,ns2np1~6 位于周期表 右侧,包 ⅢA~Ⅶ族A、元零素族。大部分为 元素非。金属
d区元它素们的价层电子构型是 (n-,1)最d1后~81n个s2电子基本都是填充
在 轨道上(n,-位1于)d长周期的中部。这些元素都是 ,常有可变
化金合属价,为过渡元素。它包括 族元素。 ⅢB~Ⅷ
ds区元价层电子构型是
(n-,1)即d1次0n外s1层~2d轨道是 的,最充外满
层素轨道上有1~2个电子。它们既不同于s区,也不同于d区,称为
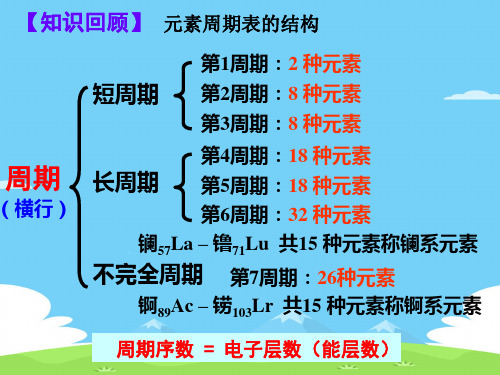
元素周期表结构:七主七副七周期 Ⅷ族0族镧锕系
1、某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素 的原子序数是( )
A、只有x+1 B、可能是x+8或x+18 C、可能是x+2 D、可能是x+1或x+11或x+25
2、推测核电荷数为87的元素R在周期表中第_____周期第 _______族,下列关于它的性质的说法中错误的是( ) A.在同族元素原子中它具有最大的原子半径 B.它的氢氧化物化学式为ROH,是一种极强的碱 C.R在空气中燃烧时,只生成化学式为R2O的氧化物 D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
高一化学人教版必修二课件:第一章 第二节 元素周期律(106张PPT)

2.原子结构示意图 (1)圆圈和圆圈内的符号及数字表示 原子核及核内质子数。 (2)弧线表示电子层。 (3)弧线上的数字表示该电子层上的 电子数,如
3.离子结构示意图 (1)当主族中的金属元素的原子失去 最外层所有电子变为离子时,电子层数 减少一层,形成与上一周期稀有气体元 素原子相同的电子层结构。如 Na:
解析:K 层、L 层、M 层上最多能容纳的 电子数分别为 2、8、18。K 层上可排 1 个电子, 也可排 2 个电子,所以 A 项有可能;当 M 层 上排有电子时,L 层已经排满电子,即排了 8 个电子,而 M 层最多可以排 18 个电子,所以 B 项不可能;符合“某离子 M 层上和 L 层上电子 数均为 K 层上电子数的 4 倍”的离子可以是 S2 -、Cl-、K+、Ca2+等,所以 C 项有可能;
1.钠、镁、铝金属性强弱比较
阅读下列资料内容,思考问题。
Na
Mg
Al
与冷水反应缓
与冷水
与酸反应,放
物质与
慢,与沸水反应
剧烈反
出氢气,但不
水(或与
迅速,放出氢气;
应,放出
如 Mg 反应剧
酸反应)
与酸反应剧烈,
氢气
烈
放出氢气
续表
Na
Mg
Al
最高价氧
化物对应
的水化物 NaOH 强 Mg(OH)2 Al(OH)3
[对点演练] 3.从原子序数 11 依次增加到 17, 下列所述递变关系错误的是( ) A.原子电子层数不变 B.原子半径逐渐增大 C.最高正价数值逐渐增大 D.从硅到氯负价从-4→-1
解析:从原子序数 11 依次增加到 17, 各原子的原子半径逐渐减小,B 选项错误。
答案:选 B
化学:1.2.2《元素周期律》PPT课件(新人教版-必修2)

新课标人教版课件系 列
《高中化学》
必修2
教学目标
• 知识与技能: • 1、掌握元素的金属性和非金属性随原子序数的增递而呈 现周期性变化的规律。2、通过实验操作,培养学生实验 技能。 • 过程与方法: • 1、自主学习,归纳比较元素周期律。2、自主探究,通过 实验探究,培养学生探究能力。 • 情感、态度与价值观: • 培养学生辩证唯物主义观点:量变到质变规律 • 教学重点:元素的金属性和非金属性随原子序数的递增而 呈现周期性变化的规律。 • 教学难点:探究能力的培养 • 教具准备:多媒体课件、实物投影仪等。
硅(Si)、磷(P)、硫(S)、氯(Cl)
非金属性的比较
性质
光照或 磷蒸气 单质与 氢气反 高温 与氢气 须加热 点燃爆 炸 应条件 能反应
含氧酸 H2SiO3 H3PO4 H2SO4 HClO4 的酸性 弱酸 中强酸 强酸 最强酸
结论:电子层数相同的原子,随着原子序数的增 加非金属性增强。
Si
P
第一章 物质结构 元素周期律
第二节《元素周期律》
第2课时 1.2.2《元素周期律》
科学探究
阅读P14并填表
实
验
放少许镁带 于试管中,加 2mL水,滴 入2滴酚酞试 液,观察现 象;过一会 加热至沸, 再观察现 象。
现象: 镁与冷水反应缓慢, 产生少量气泡,滴入酚酞 试液后不变色。 加热后镁与沸水反应 较剧烈,产生较多气泡,溶 液变为红色。 反应式:
呈 现 周 期 性 变 化
金属性减弱 非金属性增强
随着原子序数的递增,元素的性质呈 现周期性变化 ,这叫做元素周期律。
规律小结 原子半径和离子半径的比较方法:
1、当电子层数及核电荷数均不同时,电子层数越 多的,半径越大;如Na<K(层不同,层多,径大) 2、当电子层数相同时,核电荷数越大的,半径越 小;如Na>Mg;Na+>Mg2+(层相同,核多,径小) 3、阴离子半径大于对应的原子半径;如Cl<Cl-
《高中化学》
必修2
教学目标
• 知识与技能: • 1、掌握元素的金属性和非金属性随原子序数的增递而呈 现周期性变化的规律。2、通过实验操作,培养学生实验 技能。 • 过程与方法: • 1、自主学习,归纳比较元素周期律。2、自主探究,通过 实验探究,培养学生探究能力。 • 情感、态度与价值观: • 培养学生辩证唯物主义观点:量变到质变规律 • 教学重点:元素的金属性和非金属性随原子序数的递增而 呈现周期性变化的规律。 • 教学难点:探究能力的培养 • 教具准备:多媒体课件、实物投影仪等。
硅(Si)、磷(P)、硫(S)、氯(Cl)
非金属性的比较
性质
光照或 磷蒸气 单质与 氢气反 高温 与氢气 须加热 点燃爆 炸 应条件 能反应
含氧酸 H2SiO3 H3PO4 H2SO4 HClO4 的酸性 弱酸 中强酸 强酸 最强酸
结论:电子层数相同的原子,随着原子序数的增 加非金属性增强。
Si
P
第一章 物质结构 元素周期律
第二节《元素周期律》
第2课时 1.2.2《元素周期律》
科学探究
阅读P14并填表
实
验
放少许镁带 于试管中,加 2mL水,滴 入2滴酚酞试 液,观察现 象;过一会 加热至沸, 再观察现 象。
现象: 镁与冷水反应缓慢, 产生少量气泡,滴入酚酞 试液后不变色。 加热后镁与沸水反应 较剧烈,产生较多气泡,溶 液变为红色。 反应式:
呈 现 周 期 性 变 化
金属性减弱 非金属性增强
随着原子序数的递增,元素的性质呈 现周期性变化 ,这叫做元素周期律。
规律小结 原子半径和离子半径的比较方法:
1、当电子层数及核电荷数均不同时,电子层数越 多的,半径越大;如Na<K(层不同,层多,径大) 2、当电子层数相同时,核电荷数越大的,半径越 小;如Na>Mg;Na+>Mg2+(层相同,核多,径小) 3、阴离子半径大于对应的原子半径;如Cl<Cl-
人教版化学必修二1.2《元素周期律》经典课件(共39张PPT)

▪ (1)X、Y、Z的原子半径顺序为_X__>__Y_>_。Z
▪ (2)X、Y、Z的非金属性强弱顺序为_Z_>__Y__>_。X
▪ (3)气态氢化物的化学式分别_X_H_3_、__H_2_Y_、__H_Z,
▪ 它们稳定性强弱为__X_H_3_<__H_2_Y_<__H_Z_________。 ▪ (4)最高价氧化物对应水化物的酸性强弱为
2、科学预言新元素及预测它们的原子结构 和性质。 这在门捷列夫后得到证实。
1869年门捷列夫在编排出第一个元素周期表后, 预言了三种新元素及其有关的性质,这三种元素随后 比被发现,它们分别是1875年发现的镓(Ga)、1879 年发现的钪(Sc)、1886年发现的锗(Ge),而且 它们的相对原子质量和密度等有关性质都与门捷列 夫的预言惊人的相符。
(1)你能确定元素R 在周期表的位置 是第_三__周期、第_V_I_A_族吗?
(2)它是金属还是非金属?_非__金__属__。 (3)它的最高价是 +6 ,最低价是 -2 ,最 高价氧化物的化学式__R_O__3 ___,该氧化物对应 的水化物的化学式__H_2_R_O_4_。(以R来表示)
(4)该水化物呈碱性还是酸性? 酸性
元素的金属性的强弱: 先看同周期的 Na Mg Al (从左到右)
1、钠常温下与水剧烈反应,而镁只有在加热时才 能与水缓慢反应,而铝一般与水不反应。
金属性:Na > Mg > Al
2、碱性 NaOH > Mg(OH)2 > Al(OH)3 强碱 中强碱 弱碱
同一周期从左到右金属性逐渐减弱
同一周期从左到右,原子半径依次减小,原 子核对最外层电子的引力逐渐增强,失电子 能力依次减弱,所以金属性依次减弱
三、元素周期律和表的应用
▪ (2)X、Y、Z的非金属性强弱顺序为_Z_>__Y__>_。X
▪ (3)气态氢化物的化学式分别_X_H_3_、__H_2_Y_、__H_Z,
▪ 它们稳定性强弱为__X_H_3_<__H_2_Y_<__H_Z_________。 ▪ (4)最高价氧化物对应水化物的酸性强弱为
2、科学预言新元素及预测它们的原子结构 和性质。 这在门捷列夫后得到证实。
1869年门捷列夫在编排出第一个元素周期表后, 预言了三种新元素及其有关的性质,这三种元素随后 比被发现,它们分别是1875年发现的镓(Ga)、1879 年发现的钪(Sc)、1886年发现的锗(Ge),而且 它们的相对原子质量和密度等有关性质都与门捷列 夫的预言惊人的相符。
(1)你能确定元素R 在周期表的位置 是第_三__周期、第_V_I_A_族吗?
(2)它是金属还是非金属?_非__金__属__。 (3)它的最高价是 +6 ,最低价是 -2 ,最 高价氧化物的化学式__R_O__3 ___,该氧化物对应 的水化物的化学式__H_2_R_O_4_。(以R来表示)
(4)该水化物呈碱性还是酸性? 酸性
元素的金属性的强弱: 先看同周期的 Na Mg Al (从左到右)
1、钠常温下与水剧烈反应,而镁只有在加热时才 能与水缓慢反应,而铝一般与水不反应。
金属性:Na > Mg > Al
2、碱性 NaOH > Mg(OH)2 > Al(OH)3 强碱 中强碱 弱碱
同一周期从左到右金属性逐渐减弱
同一周期从左到右,原子半径依次减小,原 子核对最外层电子的引力逐渐增强,失电子 能力依次减弱,所以金属性依次减弱
三、元素周期律和表的应用
人教版高中化学必修2课件:1.2 元素周期律(共22张PPT)

一、元素周期律 5、元素周期律
⑴定义:元素的性质随着元素原子序数的递增而呈现 周期性变化的规律叫元素周期律。
⑵实质:核外电子排布的周期性变化。 即元素性质的周期性变化是元素原子的核外电子排布 的周期性变化的必然结果。
同周期元素,从左到右,原子序数 增大,电子层数 相同 ,
最外层电子数 增大 ,原子半径 减小 ,元素化合价特
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午3时0分 35秒下午3时0分15:00:3521.11.9
一、元素周期律 4、元素的金属性和非金属性的周期性变化
思考 如何判断元素的金属性和非金属性强弱? ⑴判断元素金属性强弱的方法:
①金属单质跟水(或酸)反应置换出氢的难易;
①____O__H_-__+_H__+ _=_H__2O___________; ②____A_l_(_O_H_)_3_+_3_H__+_=_A__l3_+ _+_3_H__2O__。
课堂练习
2、运用元素周期律分析下面的推断,其中错误的是( BD )
A、铍(Be)的氧化物对应的水化物可能具有两性 B、砹(At)为白色固体,HAt不稳定,AgAt感光性很强 C、硫酸锶(SrSO4)是难溶于水的白色固体 D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
NaOH
强碱
Mg(OH)2 Al(OH)3
中强碱 两性氢 氧化物
H2SiO3
弱酸
H3PO4 H2SO4 HClO4
中强 强酸 最强
酸
酸
元 素
金属性和非 金属性递变
金属性逐渐减弱,非金属性逐渐增强
人教版高中化学必修二第一章第二节元素周期律 课件(共41张PPT)

族 周期
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子半径逐渐减小
非金属性(氧化性)逐渐增强
1 原金
注意:非金属性最强的元素
2
子属 半性
B
3 4 5 6
径 逐 渐 增 大
)
还 原 性
逐 渐
(
Al Si Ge As Sb Te Po At
金7属性最强的增 大元素:
金属性逐渐增强
非 金 属 性 逐 渐 增 强
⑤非金属阴离子还原性 阴离子还原性越弱,则对应元素非金属性越强
二、元素周期律
2.金属性与非金属性的周期性 Na Mg Al Si
P S Cl
※结论:同周期元素从左到右:金属性逐渐减弱,
非金属性逐渐增强
电子层数:
相同
核电荷数:
逐渐增加
从元素原子结构判断元素
金属性与非金属性?
失电子能力:
金属性:
逐渐减弱
(2)与Ne电子层结构相同的离子: Na+ 、 Mg2+ 、Al3+ F- 、 O2- 、N3-
(3)你发现了电子层结构相同的离子的元素在 周期表中的位置关系吗?
▲电子层结构相同的离子:阴上,阳下 上一周期的非金属元素形成的阴离子 下一周期的金属元素形成的阳离子
补充习题:
1、某元素的原子核外有3个电子层,最外层有4个电子,
4、 ★某元素的核电荷数是电子层数的5倍,其质子数是
最外层电子数的3倍,该元素的原子结构示意图为
+15 2 8 5
★ ★ 5、今有结构示意图
试指出x的可能数值及相应微粒符号,并画出该 微粒的结构示意图
X值
9
10
11
12
人教版化学必修二 1.2 元素周期律PPT课件(第二课时) (共24张PPT)

1.根据非金属单质与H2化合生成氢化物的 难易或氢化物的稳定性程度。越容易与 H2化合,则生成的氢化物越稳定,非金属 性越强。 以第三周期元
素为例讨论! 2.根据非金属元素最高价氧化物对应的水 化物酸性强弱。酸性越强,则元素的非金 属性越强。
3. 根据对应阴离子还原性强弱判断。阴离 子还原性越弱,则元素非金属性越强。
5.R(电子层数少)<R(电子层数多)
O<Cl; P>F; O 2- <S 2-
6.利用以上规律进行传递推断 K + >Al 3+ ; S 2- >F K>S
随着原子序数的递增,元素原子的 电子层排布,化合价和原子半径都呈周 期性变化! 元素的金属性和非金属性是否也随 原子序数的变化呈现周期性变化呢?
练习
1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
BC
B、Na能与冷水反应,而Mg不能;
3.电子层结构相同的微粒“核大径小”
H - > Li + >Be 2+ ; N 3- >O 2- >F - >Na + >Mg 2+ >Al 3+
4. 同种元素的微粒:R(阳)<R(原)<R(阴); R(高价)<R(低价)
H + <H<H - ; Fe 3+ <Fe 2+ ; Na + <Na; F<F -
PH3
H2S HCl
磷蒸气,困难
加热反应 光照或点燃化合
非金属性:Si < P < S < Cl
素为例讨论! 2.根据非金属元素最高价氧化物对应的水 化物酸性强弱。酸性越强,则元素的非金 属性越强。
3. 根据对应阴离子还原性强弱判断。阴离 子还原性越弱,则元素非金属性越强。
5.R(电子层数少)<R(电子层数多)
O<Cl; P>F; O 2- <S 2-
6.利用以上规律进行传递推断 K + >Al 3+ ; S 2- >F K>S
随着原子序数的递增,元素原子的 电子层排布,化合价和原子半径都呈周 期性变化! 元素的金属性和非金属性是否也随 原子序数的变化呈现周期性变化呢?
练习
1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
BC
B、Na能与冷水反应,而Mg不能;
3.电子层结构相同的微粒“核大径小”
H - > Li + >Be 2+ ; N 3- >O 2- >F - >Na + >Mg 2+ >Al 3+
4. 同种元素的微粒:R(阳)<R(原)<R(阴); R(高价)<R(低价)
H + <H<H - ; Fe 3+ <Fe 2+ ; Na + <Na; F<F -
PH3
H2S HCl
磷蒸气,困难
加热反应 光照或点燃化合
非金属性:Si < P < S < Cl
1.2 元素周期律 人教版高中化学必修二课件(共40张PPT)

(3)不正确;
(4)正确
小结
一.原子核外电子的排布 1. 核外电子运动特征 分层排布,轨迹不确定,高速运动 2. 核外电子排布规律
二.原子核外电子的排布的表示方法
1.原子结构示意图
2.离子结构示意图
元素周期律 第二课时
科学探究
一.变化规律
1. 核外电子排布的周期性变化
以原子序数为 1~18 的元素为例,探究原子最外层电子数的变 化,图示如下:
原子序数递增,电子层数逐渐增多,半径逐渐增大
(2)同周期元素原子半径随原子序数增大而减 小的原因?
同周期,电子层数相同,原子序数递增,核电荷数增大, 原子核对最外层电子的吸引力增大,半径逐渐减小
(3)试比较Na+与F-的半径大小
Na+
F- 9
r(Na+)<r(F-)
粒子半径大小的比较方法
(1)同周期元素原子半径随原子序数的增大而减小 同主族元素原子和离子半径随原子序数的递增而
如F F-
(1)离子结构示意图中,阳离子核内质子数大于核外 电子数,阴离子核内质子数小于核外电子数,且差值为 离子所带电荷数。
(2)单个原子形成简单离子时,其最外层可形成 8 电 子稳定结构(K 层为最外层时可形成 2 电子稳定结构)。
1.下列结构示意图所代表的微粒属于阴离子的是 ( A )
练一练
-4→-1 。 金属元素无负价,既有正价又有负 价的一定是非金属元素
2. 原子半径的周期性变化(不考虑稀有气体)
规律:随着原子序数的递增,元素的原子半径呈现 由大到小 的周期性变化。同周期由左向右逐渐减小, 同主族由上到下逐渐增大。
2. 原子半径的周期性变化(不考虑稀有气体)
2021年人教版必修2高中化学课件:第一章 元素周期律和周期表(共48张PPT)

③核外电子数: 电子数增多,增加了相互排斥,使原子 半径有增大的倾向。
课堂练习二:
试比较 O2- 、F-、Na+ 、Mg2+ 、Al3+ 的半径大 小?
O2- > F- >Na+ > Mg2+ > Al3+
元素 Li Be B C N O F Ne
符号
最高和最 低化合价
+1
+2
+3
+4
+5
0
(常见)
2、递变规律:同周期元素的原子半径从左向右逐渐减小; 同主族元素的原子半径从上到下逐渐增大.
七
注意:
个
25 29
43 47
副
75 79
间隔为3
族
第
零
八
族
族
目标要求:
1、记住第一、二、三、四周期的元素(名称、符号和原子序数); 2、记住主族元素(名称、符号和原子序数); 3、记住稀有气体元素(名称、符号和原子序数); 4、会用罗马字符表示主族、副族和第八族; 5、知道元素的最高价、最低价及其等量关系;
-4 -3 -2 -1
元素 Na Mg Al Si
符号
负价
PS
Cl Ar
最高和最 低化合价
+1
+2
+3
+4
+5
+6
+7
0
(常见)
-4 -3 -2 -1
负价
图像
随着元素原子序数的递增,元素的化合价呈现周期性变化。
最高正价=最外层电子数 最高正价+︱最低负价︱=8
说明:19号以后的元素,上述三个方面的变化 规律虽比1到18号元素的要复杂些,但总 的变化趋势是相同的。
课堂练习二:
试比较 O2- 、F-、Na+ 、Mg2+ 、Al3+ 的半径大 小?
O2- > F- >Na+ > Mg2+ > Al3+
元素 Li Be B C N O F Ne
符号
最高和最 低化合价
+1
+2
+3
+4
+5
0
(常见)
2、递变规律:同周期元素的原子半径从左向右逐渐减小; 同主族元素的原子半径从上到下逐渐增大.
七
注意:
个
25 29
43 47
副
75 79
间隔为3
族
第
零
八
族
族
目标要求:
1、记住第一、二、三、四周期的元素(名称、符号和原子序数); 2、记住主族元素(名称、符号和原子序数); 3、记住稀有气体元素(名称、符号和原子序数); 4、会用罗马字符表示主族、副族和第八族; 5、知道元素的最高价、最低价及其等量关系;
-4 -3 -2 -1
元素 Na Mg Al Si
符号
负价
PS
Cl Ar
最高和最 低化合价
+1
+2
+3
+4
+5
+6
+7
0
(常见)
-4 -3 -2 -1
负价
图像
随着元素原子序数的递增,元素的化合价呈现周期性变化。
最高正价=最外层电子数 最高正价+︱最低负价︱=8
说明:19号以后的元素,上述三个方面的变化 规律虽比1到18号元素的要复杂些,但总 的变化趋势是相同的。
【最新】人教版高一化学必修二第一章第二节-元素周期律(公开课)(共24张PPT).ppt

渐增减增力力
减强弱强逐逐
弱
渐渐
减增
弱强
二、元素周期律
科学探究
探究目标
•1、1-18号元素随着核电荷数的递增,元素原子最 外层电子排布呈现出怎样的规律?
•2、1-18号元素(除稀有气体元素外)随着核电荷 数的递增,元素原子半径呈现出怎样的规律?
•3、1-18号元素(除稀有气体元素外)随着核电荷 数的递增,元素的主要化合价(最低和最高)呈现
元素周期律
元素的原子结构和主要化合价及原子半径 的变化规律
原子 电子 最外层 原子半径 最高或最低化 序数 层数 电子数 的变化 合价的变化
1~2 1 12 ——
+10
3~10 2 18 大→小
+1+5 -4-10
11~1 8
3
18
大→小
+1+7 -4-10
随着原子序数的递增,元素原子的电子层 结论 排布、原子半径和化合价都呈现周期性变化
元素金
元素 非金 属性 强弱 判断
1.单质与水(或酸)反应置换出氢的难易程度
2.最高价氧化物的水化物—氢氧化物碱性的强弱
3.单质与氧气反应的剧烈程度
4.金属间的置换反应
以第三周期元 素为例讨论!
1.与氢气生成气态氢化物的难易 2.氢化物的稳定性 3.最高价氧化物的水化物的酸性强弱
结
论
非金属性逐渐增强
金属性与非金属性的递变规律
根据实验,可得出第三周期元素金属性、非金属 性的递变规律:
Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强
原子序数 金属性
非金属性
3~9
逐渐减弱
逐渐增强
人教版高中化学必修二《元素周期律》课件

逐渐减小
11~17
逐渐减小
结论:随着原子序数的递增,元素
原子半径呈现 周期性 变化(稀有气
体元素除外)。
原子半径
随着原子序数的递增,元素原子最 外层电子排布和原子半径都呈周期性变 化!
根据核外电子排布能否判断出各元素的最高化合价及最 低化合价?
K
元素的主要化合价
元素的主要化合价随着原子序数的变化如何?
金属性逐渐增强
2、元素的化合价与位置、结构的关系 (1)最高正价数=主族序数=最外层电子数
(2)最低负价数=主族序数 - 8 =最外层电子数 - 8
剧烈反应
有气泡产生
产生大量气泡 但不如Mg剧烈
Na、Mg、Al的活动性强弱顺序是: Na>Mg>Al
非金属性
非金属原 子的氧化
性
非金属性:元素原子得到电子能力的强弱
S
得2个电子 S2-
8
如何判断非金属性强弱? 非金属性
1、单质与氢气生成气态 氢化物的难易程度及
氢化物的热稳定性 2、最高价氧化物的水化 物的酸性强弱 3、相互置换反应
2.各稀有气体元素中最外电子层最多能容纳的电子数是多少?次外电子层最多 能容纳的电子数是多少?
人教版高中化学必修二《元素周期律 》课件
人教版高中化学必修二《元素周期律 》课件
小结:原子核外电子排布规律
① 能量最低原理:先排K层,排满K层后再排L层,排 满L层再排M层。注意并不以此类推。 ②每个电子层最多只能容纳2n2个电子。 ③ 最外层最多容纳 8个电子(K为最外层为2个)
周期性变化
元素的金属性和非金属性是否也随 原子序数的变化呈现周期性变化呢?
金属性
金属原子 的还原性
人教版高中化学必修二第一章第二节元素周期律 课件(共25张PPT)

B 4.下列关于元素周期律的叙述正确的是( )
A.随元素原子序数的递增,原子最外层电子数总是从 1到8重复出现 B.元素的性质随着原子序数的递增而呈周期性变化 C.随元素原子序数的递增,元素的最高正价从+1到 +7,负价从 -7到-1重复出现 D.元素性质的周期性变化的根本原因是:原子半径的 周期性变化及元素主要化合价的周期性变化
加热后镁与沸水反应较剧烈,产生较
试管中,加入2-3 多气泡,溶液变为红色。
ml水,并滴入2滴
酚酞溶液。观察
现象。过一会儿, 用酒精灯给试管
反应式:Mg
+
2H2O
பைடு நூலகம்
△
=
Mg(OH)2
+
H2
加热至沸腾,并
移开酒精灯,再
观察现象。
钠(Na)、镁(Mg)、铝(Al)金属性比较
性质
钠(Na) 镁(Mg)
与水反应 与冷水水、反剧烈应:冷热N水a水>、、M缓迅g慢速
元素
14Si 15P 16S 17Cl
最高价 氧化物
SiO2 P2O5
SO3 Cl2O7
最高价氧化物的水化物
H2SiO3 H3PO4 H2SO4 HClO4
硅酸 磷酸 硫酸 高氯酸
极弱酸 中强酸 强酸
最强酸
非金属性:Si < P < S < Cl
第三周期元素性质的变化中可得出如下的结论:
Na Mg Al Si P S Cl
知识回
1顾、:1-18号元素(除稀有气体元素外)
元素的原子半径,随着原子序数的递 增,呈现出怎样的规律?
周期 元素原子半径的周期性变化
1 2 3
4 5 6 7
人教版高一化学必修2第一章 物质结构 元素周期律第二节 元素周期律(共15张PPT)

3、核外电子排布规则
① 每个电子层最多排布2n2个电子 ② 最外层最多排布8个电子 ③ 次外层最多排布18个电子
倒第三层不超过32个电子
作业:熟练排布前36号元素以及碱 金属、卤素、稀有气体
有哪些微粒具有10电子? Na+、Mg2+、Al3+ 、 O2-、F-、 OHCH4、NH3、H2O、HF、Ne
有哪些微粒具有18电子?
H3O+、NH4+
Ar 、H2S、HCl、F2、H2O2、CH3CH3 N2H4、CH3OH K+、Ca2+、S2-、Cl-
二、元素周期律 完成P14【科学探究】表1
1、原子结构与元素周期律
电子层数
依次递增
同主族元素随原子序数递增 (从上至下)
最外层电子数
相同
原子半径
递增
同周期的主族元素 随原子序数递增 (从左至右)
电子层数 最外层电子数
相同 依次递增
原子半径
递减
主族同,最外层电子数同; 周期同,电子层数同
若电子层结构相同的离子,谁的半径大?
电子层结构相同的离子 原子序数小的半径大!
练习 按照原子半径由小到大的顺序排序 A、 F、C、O、N、B B、 Mg、Al、Na、P、Si C、 Mg、Al、P、F、O D、 F-、O2- 、Na+、Al3+ 、Mg2+
酸性越强,非完成P15-16【科学探究】1-4
同主族元素从上至下 金属性增强,非金属性减弱
同周期的主族元素(随原子序数递增)从左至右 金属性减弱,非金属性增强
元素周期律:元素的性质随着原子序数的递增而呈周期性的变化
三、元素周期表和元素周期律的应用
1、推测原子的结构、化学性质或者位置
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
2
A. 同周期主族元素:
3
从左到右原子半径依次减小 (除稀有气体)
4
B. 同主族元素:
5
从上到下原子半径逐渐变大
主族 从上到下:电子层数依次增加----- 原子半径越来越大
(2)与10Ne原子电子层结构相同的离子:
7N3-、8O2-、9F-、11Na+、12Mg2+、13Al3+ (3)与18Ar原子电子层结构相同的离子:
15P3-、16S2-、17Cl-、19K+、20Ca2+
5.含有10个电子的常见粒子 [设计P16左下] 分子: 10Ne、HF、H2O、NH3、CH4、 阳离子: 11Na+、12Mg2+、13Al3+、NH4+、H3O+ 阴离子: 7N3-、8O2-、9F-、OH-、NH2-
3.核外电子的排布 [课本P13]
(1)原子核外电子的排布 在多电子原子中,电子的能量不同,能量较低的电子在离核较 近的区域运动,能量较高的电子在离核较远的区域运动,我们 把不同的区域简化为不连续的壳层,也称作电子层,电子在原 子核外分层运动,也称分层排布。
电子层(n): 1 2 3 4 5 6 7(能量逐渐升高)
核电 元素 元素
各电子层的电子数
荷数 名称 符号 K LMNOP
2 氦 He
10 氖 Ne
18 氩 Ar
36 氪 Kr
54 氙 Xe
86 氡 Rn
(4)稀有气体元素原子电子层排布
核电 元素 元素
各电子层的电子数
荷数 名称 符号 K LMNOP
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
4.与稀有气体原子核外电子排布相同的离子
[设计P15右]
阳离子:与上一周期稀有气体原子核外电子排布相同 阴离子:与同周期稀有气体原子核外电子排布相同
(1)与2He原子电子层结构相同的离子: 1H-、3Li+、4Be2+
B.元素的性质 ①原子核外电子排布 ②原子半径 ③元素主要化合价 ④元素的金属性和非金属性
......
(一)元素原子核外电子排布的周期性变化
1H 1
3Li 21
11Na 281
19K 2881
4Be 22
12Mg 282
20Ca 2882
5B 23
13Al 283
6C 24
14Si 284
7N 25
KL MN O P Q
(2)核外电子排布的规律 [学案P10左]
A. 能量最低原理 原子核外的电子总是尽先排布在能量最低的的电子层里, 然后再由里往外,依次排布在能量逐步升高的电子层里, 即排满了K层才排L层,排满了L层才排M层。
B. 各电子层排布规律 ①各电子层最多容纳的电子数目是2n2
②最外层电子数目不超过8个(K层为最外层时不超过2个)
(3)核电荷数为1—18的元素原子核外电子层排布
氢(H)
氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar)
注意:短周期元素原子结构的特殊性 [学案P10右]
(4)稀有气体元素原子电子层排布
③次外层电子数目不超过18个,
倒数第三层电子数目不超过32个
注意:1.以上几点是互相联系的,不能孤立地理解。
如:当M层不是最外层时,最多可以排布18个电子, 而当它是最外层时,则最多可以排布8个电子。
2.该规律只适用于主族元素原子核外电子的排布 3.主族元素原子内层电子数目分别是:2、8、18、32
2.核外电子受力分析
在含多个电子的原子中: (1)一方面每个电子和核之间因带异性电荷而有吸引力,
这个吸引力倾向于把电子尽可能拉得靠近核; (2)另一方面,电子与电子之间带同性电荷而相互排斥,
这个排斥力迫使电子彼此尽可能远离。
当吸引和排斥达成平衡时, 核外电子就分布在离核远近 不同的区域里运动,有不同 的能量。 离核近的电子能量低, 离核远的电子能量高。
6.含有18个电子的常见粒子 [设计P16左下] 分子: 18Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6 阳离子: 19K+、20Ca2+ 阴离子: 15P3-、16S2-、17Cl-、HS-
练习:
1、判断下列示意图是否正确?为什么?
A、 +19 2 8 X9
B、 +12 2 1X0
4、按核外电子排布规律,预测核电荷数 为118的元素的原子核外电子层排布是
(D )
A 2、8、18、32、58
B 2、8、18、32、50、8
C 2、8、18、32、50、18、8
D 2、8、18、32、32、18、8
二、元素周期律
A.周期性: 循环往复,自然界普遍存在该现象 如:时间——周期性,简单的重复 生物进化——周期性,螺旋上升
第二节 元素周期律
一、原子核外电子的排布 [阅读:课本P13]
1.核外电子运动的特点
(1)电子的质量极微小 (9.10910-31kg)
(2)电子绕核运动是在原子这 样极其微小的空间中进行
(原子的直径约10-10m) (3)电子绕核作高速运动 (运动的速度接近光速,
约为108m/s)
因此,电子绕核运动没有确定的轨道, 不能精确测定或计算电子在任一时刻 所在的位置,也不能描绘出其运动轨 迹,我们只能指出它在核外空间某处 出现机会的多少。这是核外电子运动的根本特征。完全不同于宏观世界物体, 如行星、炮弹、尘粒等的运动状况。
15P 285
8O 26
16S 286
9F 27
17Cl 287
2He 2
10Ne 28
18Ar 288
同周期:从左至右,电子层数相同,最外层电子数依次增加 同主族:从上至下,最外层电子数相同,电子层数依次增加
(二)元素原子半径的周期性变化
主族元素原子半径的递变规律
主族
周期 IA IIA IIIA IVA VA VIA VIIA
C、 +3 X1 2
D、
+54
2
8
18
2X0
X6
2、某元素的原子核外有3个电子层,最外层有5个电
子,该原子核内的质子数为( B )
A、14
B、15 C、16 D、17
3、某元素的原子核外有三个电子层,M层的电子数是L
层电子数的1/2,则该元素的原子是( B )
A、Li
B、Si C、Al D、K
练习:
