离子及离子结构示意图
元素2的最低价阴离子的离子结构示意图

元素2的最低价阴离子的离子结构示意图
阴离子是一种带有负电荷的离子,它们可以与其他离子或分子结合,形成化合物。
元素2的最低价阴离子是氯离子,它的离子结构示意图如下:
氯离子由一个氯原子和一个负电荷组成,氯原子由一个氯核和一个电子组成,氯核由17个质子和17个中子组成,电子分布在氯核的外围,形成一个八面体结构。
氯离子的负电荷是由一个多余的电子提供的,它们分布在氯核的外围,形成一个八面体结构。
氯离子是一种非常重要的离子,它可以与其他离子或分子结合,形成化合物。
氯离子可以与阳离子结合,形成盐类化合物,也可以与其他阴离子结合,形成氯化物类化合物。
氯离子还可以与有机物结合,形成有机氯化物类化合物。
氯离子在日常生活中也有着重要的作用,它可以用来消毒水,防止细菌的生长,从而保护人们的健康。
此外,氯离子还可以用来制造各种化学制品,如染料、润滑油等。
总之,氯离子是一种重要的离子,它可以与其他离子或分子结合,形成各种化合物,在日常生活中也有着重要的作用。
初中化学原子结构示意图和离子ppt课件
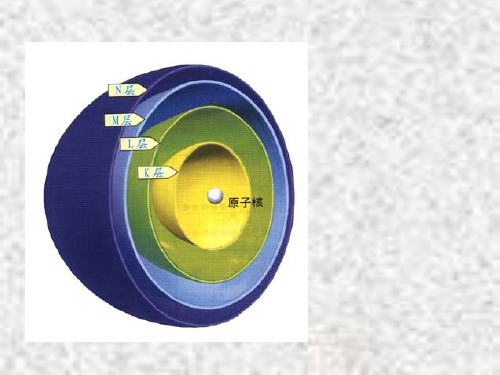
常见的离子
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
一、原子的构成
质子(+)
1、原子 原子核(+) 中子(不带电) (电中性) 核外电子( )
2、原子中:核电荷数=质子数=核外电子数 相对原子质量=质子数+中子数
原子结构示意图说明
原子核
原子核带正电
质子数
第3层 第2层 第1层
电子层
+ 16 2 8 6
电数
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
原子结构示意图说明
各元素原子最外电子数目的特点: 经营者提供商品或者服务有欺诈行为的,应当按照消费者的要求增加赔偿其受到的损失,增加赔偿的金额为消费者购买商品的价款或接受服务的费用
+11 2 8 1 失去1个电子
+11 2 8 带正电
钠原子(Na)
钠离子( Na+ )
+17 2 8 7
得到1个电子 +17 2 8 8
离子

个或2个(氦原子)或没有电子(四中子)的稳定结构。
这一过程称为电离。
电离过程所需或放出的能量称为电离能。
在化学反应中,金属元素原子失去最外层电子,非金属原子得到电子,从而使参加反应的原子或原子团带上电荷。
带电荷的原子叫做离子,带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。
阴、阳离子由于静电作用而形成不带电性的化合物。
与分子、原子一样,离子也是构成物质的基本粒子。
如氯化钠就是由氯离子和钠离子构成的。
中文名离子外文名ion发现人人类目录1基本概念▪分类▪属性▪结构示意2发现简史▪酸根▪金属离子▪非金属离子3符号4离子键5特征6常见离子▪阳离子▪阴离子▪常见颜色7离子方程式8离子液体的毒性9离子液体的毒性研究1基本概念在化学变化中,原子或原子团得失电子后形成的带电微粒称作离子。
带正电的称为阳离子,带负电的称为阴离子。
原子是由原子核和核外电子构成,原子核带正电荷,绕核运动的电子则带相反的负电荷。
原子的核电荷数与核外电子数相等,因此原子显电中性。
如果原子从外获得的能量超过某个壳层电子的结合能,那么这个电子就可脱离原子的束缚成为自由电子。
原子核外第一层不能超过2个电子,最外层最多只能排8个。
次外层不超过18个。
一般最外层电子数小于4的原子、或半径较大的原子,较易失去电子(一般为金属元素,如:钾K,钙Ca等)趋向达到相对稳定结构;而最外层电子数不少于4的原子(一般为非金属元素,如:硼B,碳C等)则较易获得电子趋向达到相对稳定结构。
当原子的最外层电子轨道达到饱和状态(第一周期元素2个电子、第二第三周期元素8个电子)时,性质最稳定,一般为稀有气体(氦除外,最外层有2个电子,性质也很稳定)。
为8个(如第一层是最外层,则为2个,若是氢离子,则没有外层电子)的稳定结构。
这一过程称为电离。
电离过程所需或放出的能量称为电离能。
在化学反应中,金属元素原子失去最外层电子,非金属原子得到电子,从而使参加反应的原子或原子团带上电荷。
离子

非金属元素: 原子最外层电子数等于或多于4
在化学反应中易得到电子形成阴离子
阴离子的书写: O2-、S2-、Cl-、I-
我会做
1、用化学符号表示:
12))钾铝离离子子— ———KA+——l 3—+; 3)硫离子——S—2- ; 4)2个钠离子——2N—a+
易失去最 外层电子
非金属元素
一般多于 或等于4个
不稳定结构
稀有气体 8个电子 元素 (He为2个)
稳定结构
易得到电子
一般不参加 化学反应
元素的种类由原子的 核电荷数(或质子数) 决定。 元素的化学性质主要决定于原子的 最外层电子数 。
1.当原子得失电子后, 还显电中性吗? 2.原子得失电子后,所得到 的微粒如何称呼?
1、以下碳原子的结构示意图正确的是( D )
A、
B、
C、
D、
2、某元素的原子结构示意图为
,该元素的核
电荷数为 13 个,核外有 3 个电子层,第二层上
有 8 个电子,最外电子层上有 3 个电子,该元素
为Байду номын сангаасAl 元素。
元素与最外层电子数的关系
元素种类 稀有气体
最外层电子数 元素的化学性质
8个(He为2个)
质子(+)
原子
原子核
(+)
中子(不带电)
核外电子(一)
核电荷数=质子数=电子数
离子
核外电子的排布(又叫分层运动) 1、电子能量的高低与离核远、近的关系:
一二 三 电子层
中考新热点之原子(离子)结构示意图

解析
相 对稳定 结构是 指最 外层 电子数 为 8
子
( 只有 一 个 电子 层 时 为 2 的结 构 。题 中原 子 核 外 最 )
外层 电子数为 2 没有达到 8电子的稳定结构 。 , 而该 原子的核外电子数= + + = 2 2 8 2 1 ;该原子 的最外层 电 子数为 2 小 于 4 为金属元素 ; , , 易失去 2个 电子 , 因 此 与 C 形成 的化合物为 X 1 1 C 。 答案 A。
例 2 (0 1肇 庆 市 )某 原 子 结 构 示 意 图 为 21 ・
@ ;, 该原子 核有— —个质 元素符号为 —, 子, — 该
一 /i
原子在形成化合物时容易得到
结构。
个电子 , 达到稳定
原子 ; c项中质子数为 1 , 1 电子数 为 1 , 阳离子。 0为
中考新 热点之 原子 ( 离子 ) 结 构 示 意 图
■ 赵 夕 兰 隋 家礼
有关原子( 离子) 构示 意网的考查是 近几 年化 结
学中考 的热 点之一 , 些试题 借助原 子( 这 离子) 结构
示 意 图 综 合 考 查 了 原 子 的 构 成 、 素 的 分 类 、 子 元 原
二、 子( 原 离子 ) 构 示 意 图 的应 用 结 1 金 属 元 素 、 金 属 元 素 的 判 断 . 非 例 3 (0 1 湛 江 市 ) 列 四种 粒 子 的 结 构 示 21・ 下 意 图 中 , 于 金 属元 素 原 子 的 是 ( 属 )
+ -・ 一 — 卜 +
。
o) @ 》
@> 》 >
⑩ 》 ①) 》 ①》 》 ) 》 》 ⑩
A. 都属 于阳离子 B. 都属于阴离子
前20个离子结构示意图
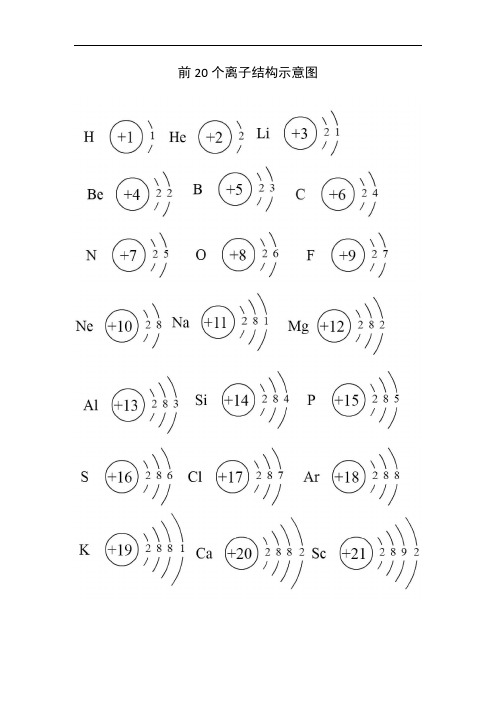
前20个离子结构示意图
离子结构示意图与原子结构示意图一样,人们可以用离子结构示意图来表示离子的核电荷数和电子层排布。
小圈和圈内的数字分别表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
当然,在书写离子结构的时候需要注意离子核外电子一般为8电子(或2电子)的稳定结构。
以Na+结构示意图为例,具体说明。
“Ο”,表示原子核,圈内“+”号,表示质子所带电荷的性质;圈内数字“11”,表示核内11个质子;圈外弧线,表示电子层,弧线所夹的数字为该层容纳的电子的数目。
磷原子有2条弧线,表示它共有3个电子层,失一个电子。
外部2、8,表示现在有10个电子还在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+11
2 8 Na+
Al
+13
283
易失3个电子
+13
2 8 Al3+
原子
失电子
带正电
阳离子
R
失n电子
Rn+
举例分析:
Cl
+17
287
易得1个电子
+17
2 8 8 Cl-
S
+16
286
易得2个电子
+16
2 8 8 S2-
原子
得电子 得n电子
带负电
阴离子 Rn-
R
原子中: 核电荷数 = 质子数
阳离子: 核电荷数 = 质子数 阴离子: 核电荷数 = 质子数
核外电子数 =
> 核外电子数
< 核外电子数
练习2、判断下列是原子结构图、离子结构图?
+16 2 8 6 +11 2 8 1
+17
2 8 8
S
+8 2 8
Na
+10 2 8
Cl+11 2 8
O2-
Ne
Na+
离子的形成
2-、SO 2-。 带电的原子或原子团,如 S 1、概念: 4 离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
原子
阳离子
阴离子
微粒结构
微粒电性
质子数=电子数
质子数>电子数 质子数<电子数
不显电性
用元素符号表示,如 H、Na、Cl
显正电性
先负电性
符号
用阳离子符号表示,用阴离子符号表示, 如Na+,Ca2+等,数 如S2-、Cl-,数字在前, 字在前,符号在后。符号在后。
失电子
得电子
联系
阳离子 离子
得电子
原子
失电子
PO43-磷酸根离子
2、离子的形成:
阳离子( + )
失电子
原子
得电子
阴离子( - )
3、离子的表示方法:
+11 2 8
离子结构图
+17
2 8 8
Na+
离子符号
Cl-
1.离子
• 阳离子-带正电荷的粒子 • 阴离子-带负电的粒子
2.离子符号的意义 表示,每个镁离子带2个单位的正电荷
2
Mg2+
表示2个镁离子
微粒种类
离子和原子的关系
离子及其形成
在 化学变化 中,电中性的原子经常
会 得到 或 失去 电子而成为 带电 的微 粒,这种微粒称为离子。
原子核外电子的排布(又叫分层运动)
1、电子能量的高低与离核远、近的关系:
电子层 一 二 K L 三 M 四 N 五 O 六 P 七 Q
离核远近 近
能量高低 低
远 高
原子结构示意图
1、画法:圆圈标核电,电子分弧线, 数字一条线 。
金属 元素
一般少于 4个 一般多于或 等于 4个
不稳定结构
易失去最外 层电子
ห้องสมุดไป่ตู้
非金属 元素
不稳定结构 易得到电子 稳定结构 一般不参加 化学反应
稀有气体 8个电子 元素 (He为2个)
元素的种类由原子的核电荷数(质子数)决定。 元素的化学性质主要决定于原子的 最外层电子数 。
+11 2 8 1
钠原子(Na) +17 2 8 7 氯原子(Cl )
2、表示意义: 以氧原子结构示意图为例 ⑴ 弧线表示电子层, ⑵ “2” 表示第一层上排有2个电子。
⑶“6” 表示第二层上排有6个电子。
⑷
+8
表示原子核内有8个质子 。
离子
核电 荷数
电子层
钠原子结构示意图
电子 数
⑴第一层最多容纳2个电子,第二层最多容纳8个电子。
(2)最外层不超过8个电子。 ⑶电子先排满能量较低的电子层,然后再排能量稍高的 电子层。
1-18号元素的原子结构示意图 稳定结构
氢(H) 氦(He)
锂(Li)
铍(Be)
硼(B) 碳(C)
氮(N)
氧(O)
氟(F)
氖(Ne )
钠(Na)
镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S)
氯(Cl) 氩(Ar)
3、元素分类、原子结构与元素化学性质的关系
元素分类 最外层电数 结构的稳性 化学性质
失去1个电子
+11 2 8
钠离子( Na+ ) 阳离子 得到1个电子 +17 2 8 8 氯离子( Cl ) 阴离子
-
离子
相对稳定结构:
只有一个电子层:最 外层为2个电子 多个电子层时:最外 层为8个电子
每一种原子在化学反应中,形成化合物 时:都要形成相对稳定结构
举例分析: Na
+11
281
易失1个电子
阴
离子是如何构成物质的呢?
钠原子Na 不稳定
+11 2 8 1
氯原子Cl
+17 2 8 7
不稳定
稳定
+11 2 8
+17 2 8 8
-
稳定
钠离子Na
+
氯离子Cl
相互作用
Na+ Cl-
NaCl
离子是构成物质的粒子么?
【知识拓展 】
像氯化钠这种由阴离子和阳离子相互作用 而形成的化合物,叫做离子化合物。 离子化合物:由阴离子和阳离子结合的化合物 (典型的金属和非金属结合的化合物)。
NaCl
MgCl2
KCl
离子——带电的原子或原子团。
阳离子:带正电荷的离子叫做阳离子。 如: H+ 、 NH4+ 、 Mg2+ 、Al3+、NH4+铵根离子 阴离子:带负电荷的离子叫做阴离子。 O2-、F-、S2-、Cl-、 OH-氢氧根离子、NO3-硝酸根离子、
CO32-碳酸根离子、SO42-硫酸根离子、
