离子及离子结构示意图
离子及离子结构示意图演示文稿

离子
相对稳定结构:
只有一个电子层:最 外层为2个电子
多个电子层时:最外 层为8个电子
每一种原子在化学反应中,形成化合物 时:都要形成相对稳定结构
举例分析: Na +11 2 8 1
易失1个电子
+11 2 8 Na+
Al +13 2 8 3
易失3个电子
+13 2 8 Al3+
原子 失电子 R 失n电子
核=外电子数 核>外电子数
核<外电子数
练习2、判断下列是原子结构图、离子结构图?
+16 2 8 6
S
+8 2 8
O2-
+11 2 8 1
Na
+10 2 8
Ne
+17 2 8 8
Cl-
+11 2 8
Na+
离子的形成
1、概念: 带电的原子或原子团,如S2-、SO42-。
离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
元素
(He为2个)
稳定结构
一般不参加 化学反应
元素的种类由原子的核电荷数(质子数)决定。 元素的化学性质主要决定于原子的最外层电。子数
+11 2 8 1 失去1个电子
+11 2 8
钠原子(Na)
钠离子( Na+ ) 阳离子
+17 2 8 7 得到1个电子 +17 2 8 8
氯原子(Cl )
氯离子( Cl- )阴离子
离子
核电 荷数
电子层
电子 数
钠原子结构示意图
⑴第一层最多容纳2个电子,第二层最多容纳8个电子。
九年级化学离子结构示意图

离子结构示意图
概念:
离子结构示意图是用来表示离子核电荷数和电子排布的图示.同种元素的原子和离子其质子数相同.离子的核外电子数和质子数不同,阳离子的质子数大于核电荷数,阴离子的质子数小于核外电子数.主族元素的离子最外层一般为8个电子(最外层是K层为2个电子)。
阴阳离子的结构示意图与原子结构示意图的的区别:
1、结构示意图中,圆圈里的数字=半弧上的数字之和,它就是原子结构示意图。
2、结构示意图中,圆圈里的数字>半弧上的数字之和,它就是阳离子结构示意图。
3、结构示意图中,圆圈里的数字<半弧上的数字之和,它就是阴离子结构示意图。
构成物质的微粒(分子、原子、离子)
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
初中化学原子结构示意图和离子ppt课件
常见的离子
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
一、原子的构成
质子(+)
1、原子 原子核(+) 中子(不带电) (电中性) 核外电子( )
2、原子中:核电荷数=质子数=核外电子数 相对原子质量=质子数+中子数
原子结构示意图说明
原子核
原子核带正电
质子数
第3层 第2层 第1层
电子层
+ 16 2 8 6
电数
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
原子结构示意图说明
各元素原子最外电子数目的特点: 经营者提供商品或者服务有欺诈行为的,应当按照消费者的要求增加赔偿其受到的损失,增加赔偿的金额为消费者购买商品的价款或接受服务的费用
+11 2 8 1 失去1个电子
+11 2 8 带正电
钠原子(Na)
钠离子( Na+ )
+17 2 8 7
得到1个电子 +17 2 8 8
九年级化学离子结构示意图怎么画

离子结构示意图
•概念:
离子结构示意图是用来表示离子核电荷数和电子排布的图示.同种元素的原子和离子其质子数相同.离子的核外电子数和质子数不同,阳离子的质子数大于核电荷数,阴离子的质子数小于核外电子数.主族元素的离子最外层一般为8个电子(最外层是K层为2个电子)。
•阴阳离子的结构示意图与原子结构示意图的的区别:
1、结构示意图中,圆圈里的数字=半弧上的数字之和,它就是原子结构示意图。
2、结构示意图中,圆圈里的数字>半弧上的数字之和,它就是阳离子结构示意
图。
3、结构示意图中,圆圈里的数字<半弧上的数字之和,它就是阴离子结构示意
图。
第1页共1页。
离子的形成要点

构成物质的微粒有:分子、原子和离子
物质与构成微粒之间的关系:
单质
素同 组种 成元 具 的有 一相 类同 原质 子子 数 结合
金刚石、 铁Fe等等
聚集
原 子
元素
不 组同 成种 元 素
结合 分解
分子
氧气 氢气 水等
化合物
离子
去得 电到 子或 失
结合NaCl 、 CFra bibliotekO 等什么意思?
下列微粒的性质与质子数、电子数、 中子数、电子层数、最外层电子数等有 关,请你用它们填空 质子数 元素种类_____________ ; 最外层电子数 ; 元素分类______________ 质子数、中子数; 相对原子质量_____________ 最外层电子数 ; 元素的化学性质___________ 核外电子总数和
阳离子中
核电荷数 > 核外电子数 带正电的原子
阴离子中
核电荷数 < 核外电子数 带负电的原子
氯化钠的形成过程 3 、离子化合物
失得 去到 电的 钠 子 1 原 个子
失 电 去 子 1 个
离子化合物
检查一下 我们的学习效果
检 查 一 下 学 习 效 果 吧
1.观察判断原子结构示意图、离子结构示意图
(二)、原子结构示意图
1、画法:圆圈标核电,电子分弧线, 数字一条线 。
2、表示意义: 以氧原子结构示意为例 ⑴ 弧线表示电子层,
⑵ “ 2 ” 表示第一层上排有两个电子。
⑶“6” 表示第二层上排有6个电子。
⑷ +8 表示原子核内有 8 个质子,并带 有八个正电荷。
(三)1-18号元素的原子结构示意图
(3)、离子结构示意图
离 子 结 构 示 意 图
初中化学原子结构示意图和离子ppt课件
原子结构示意图说明
各元素原子最外电子数目的特点:
元素
最外层电 原子结构 变化 化学
子数
趋势 性质
稀有气体
8
相对稳
元素
(He为2个) 定结构
金属元素
一 般﹤ 4
不稳定 结构
非金属元素 一般≥4, 不稳定
﹤8
结构
稳定
易失 电子 易得 电子
稳定 活泼 活泼
原子最外层决电定子了数元素的化学性质
+11 2 8 1 失去1个电子
得电子
原子
阴离子( - )
1、概念: 带电的原子或原子团,如S2-、SO42-。 离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
2、离子的表示方法: 离子结构示意图 +11 2 8
+17 2 8 8
离子符号
Na+
Cl-
在元素符号的右上角标出所带的电荷数,数值在前符号在 后,1可以省略不写。 如:Na+ Mg2+ Cl- O2-
2、原子中:核电荷数=质子数=核外电子数
相对原子质量=质子数+中子数
原子结构示意图
1氢 2氦 3锂 4铍 5硼 6碳 7氮8氧 9氟10氖 H He Li Be B C N O F Ne 1钠1 1镁2 13铝14硅15磷 1硫6 17氯18氩19钾2钙0 Na Mg Al Si P S Cl Ar K Ca
核外电子排布
• 电子在核外是怎么作高速运动的?电子多了会不会 出现“撞车”现象?会不会被原子核吸掉?会不会 飞到原子的外面来?
• 原子核的半径约为原子半径的十万分之一,电子在 核外作高速运动。
核外电子是分层排布的
• 第一电子层离核最近、能量最低,最多能容纳2 个电子。
初中化学原子结构示意图和离子 PPT课件 图文
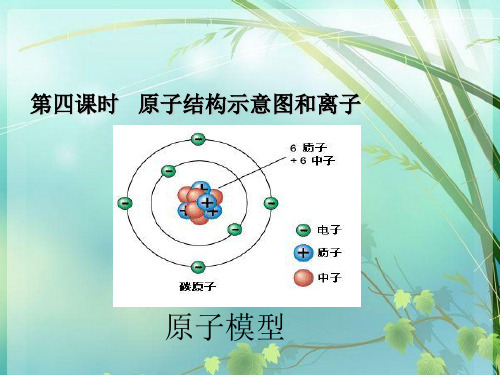
原子模型
核外电子排布
• 电子在核外是怎么作高速运动的?电子多了会不会 出现“撞车”现象?会不会被原子核吸掉?会不会 飞到原子的外面来?
• 原子核的半径约为原子半径的十万分之一,电子在 核外作高速运动。
核外电子是分层排布的
• 第一电子层离核最近、能量最低,最多能容纳2 个电子。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
谢谢! 学妹给我打电话,说她又换工作了,这次是销售。电话里,她絮絮叨叨说着一年多来工作上的不如意,她说工作一点都不开心,找不到半点成就感。 末了,她问我:学姐,为什么想 找一份 自己热 爱的工 作这么 难呢? 我问她上一份工作干了多久,她 说不到 三个月 ,做的 还是行 政助理 的工作 ,工作 内容枯 燥乏味 不说, 还特别 容易得 罪人, 实在不 是自己 的理想 型。 我又问了她前几份工作辞职的原 因,结 果都是 大同小 异,不 是因为 工作乏 味,就 是同事 不好相 处,再 者就是 薪水太 低,发 展前景 堪忧。 粗略估计,这姑娘毕业不到一年 ,工作 却已经 换了四 五份, 还跨了 三个行 业。 但即使如此频繁的跳槽,她也仍 然没有 找不到 自己满 意的工 作。 2 我问她,心目中理想型的工作是 什么样 子的。 她说, 姐,你 知道苏 明玉吗 ?就是 《都挺 好》电 视剧里 的女老 大,我 就喜欢 她样子 的工作 ,有挑 战有成 就感, 有钱有 权,生 活自由 ,如果 给我那 样的工 作,我 会投入 我全部 的热情 。 听她说完
前20个离子结构示意图
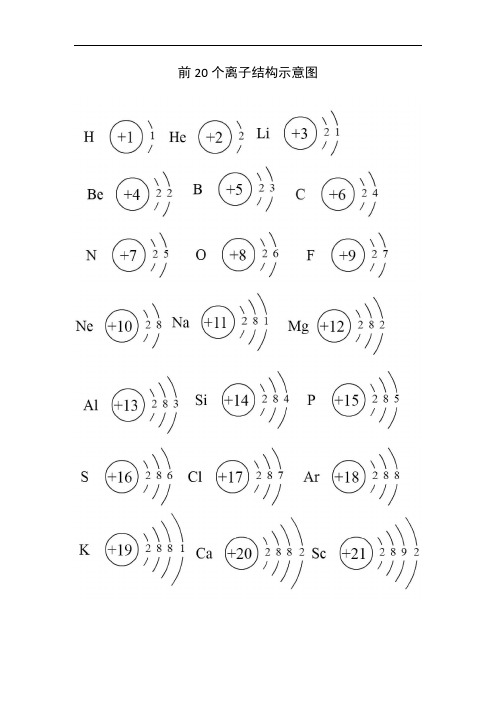
前20个离子结构示意图
离子结构示意图与原子结构示意图一样,人们可以用离子结构示意图来表示离子的核电荷数和电子层排布。
小圈和圈内的数字分别表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
当然,在书写离子结构的时候需要注意离子核外电子一般为8电子(或2电子)的稳定结构。
以Na+结构示意图为例,具体说明。
“Ο”,表示原子核,圈内“+”号,表示质子所带电荷的性质;圈内数字“11”,表示核内11个质子;圈外弧线,表示电子层,弧线所夹的数字为该层容纳的电子的数目。
磷原子有2条弧线,表示它共有3个电子层,失一个电子。
外部2、8,表示现在有10个电子还在。
初中化学原子结构示意图和离子

核外电子是 分层排布的
第一电子层离核最近、能量最低,最 多能容纳2个电子。
第一层排满后,电子排在第二层,第 二层上最多可容纳8个电子。
第三层上最多可容纳18个电子
……
最外层上最多可容纳8个电子(第一 层作为最外层时,最多2个)。
原子结构示意图说明
原子核
原子核带正电
质子数
第3 第2 层 第1 层 层
原子结构示意图
1氢 2氦 3锂 4铍 5硼
H He Li Be B Ne 1钠1 1镁2 1铝3 1硅4 1磷5
碳6 氮7 氧8 氟9 氖10 CNOF
硫16 1氯7 1氩8 1钾9 钙20
Na Mg Al Si P S Cl Ar K Ca
原子结构示意图说明
各元素原子最外电子数目的特点:
元素
1、概念: 带电的原子或原子团,如S2-、SO42-。 离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
2、离子的表示方法: 离子结构示意图 +112 8
+1 2 8 8 7
离子符号
Na+
Cl-
在元素符号的右上角标出所带的电荷数,数值在前符号在 后,1可以省略不写。 如:Na+ Mg2+ Cl- O2-
+16 2 8
电子层
6
电子数
学体属金决化 反性原属于学 应质子原原性 )稳容子子质 。定易容的活
(得易最泼 一电失外或 般子电层稳 不,子电定 参稀,子主 与有非数要 化气金。取
个 ) 。
He 2
个 的 是 稀 有 气 体 ( 为
金 属 原 子 , 最 外 层 电 子 数 为
4
子 数 为 多 于 个 的 一 般 是 非
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子——带电的原子或原子团。
阳离子:带正电荷的离子叫做阳离子。
如: H+ 、 NH4+ 、 Mg2+ 、Al3+、NH4+铵根离子
阴离子:带负电荷的离子叫做阴离子。
O2-、F-、S2-、Cl-、 OH-氢氧根离子、NO3-硝酸根离子、 CO32-碳酸根离子、SO42-硫酸根离子、 PO43-磷酸根离子
离子及其形成
在 化学变化 中,电中性的原子经常 会 得到 或 失去 电子而成为 带电 的微 粒,这种微粒称为离子。
原子核外电子的排布(又叫分层运动)
1、电子能量的高低与离核远、近的关系:
电子层 一 二 三 KL M
离核远近 近
四 五 六七
NOPQ
远
能量高低 低
高
原子结构示意图
1、画法:圆圈标核电,电子分弧线, 数字一条线 。
1-18号元素的原子结构示意图
稳定结构
氢(H)
氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar)
3、元素分类、原子结构与元素化学性质的关系
元素分类
最外层电数
结构的稳性
Na+
离子的形成
1、概念:带电的原子或原子团,如S2-、SO42-。
离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
2、离子的形成:
阳离子( + )
失电子
得电子
原子
阴离子( - )
3、离子的表示方法:
+11 2 8
离子结构图
+17 2 8 8
Na+
离子符号
Cl-
1.离子
• 阳离子-带正电荷的粒子 • 阴离子-带负电的粒子
易失1个电子
+11 2 8 Na+
Al +13 2 8 3
易失3个电子
+13 2 8 Al3+
原子 失电子 R 失n电子
阳离子 Rn+
带正电
举例分析: Cl +17 2 8 7 易得1个电子 +17 2 8 8 Cl-
S
+16 2 8 6
易得2个电子
+16 2 8 8 S2-
原子 得电子 阴离子
带负电
2、表示意义: 以氧原子结构示意图为例 ⑴ 弧线表示电子层, ⑵ “2” 表示第一层上排有2个电子。 ⑶“6” 表示第二层上排有6个电子。 ⑷ +8 表示原子核内有8个质子 。
离子
核电 荷数
电子层
电子 数
钠原子结构示意图
⑴第一层最多容纳2个电子,第二层最多容纳8个电子。
(2)最外层不超过8个电子。 ⑶电子先排满能量较低的电子层,然后再排能量稍高的 电子层。
化学性质
金属 元素
一般少于 4个
易失去最外 不稳定结构
层电子
非金属 元素
一般多于或 等于 4个
不稳定结构 易得到电子
稀有气体 8个电子
元素
(He为2个)
稳定结构
一般不参加 化学反应
元素的种类由原子的核电荷数(质子数)决定。 元素的化学性质主要决定于原子的最外层电。子数
+11 2 8 1 失去1个电子
2.离子符号的意义
2 Mg2+
表示,每个镁离子带2个单位的正电荷
表示2个镁离子
离子和原子的关系
微粒种类
原子
微粒结构 质子数=电子数
微粒电性 不显电性
阳离子
阴离子
质子数>电子数 质子数<电子数
显正电性 先负电性
符号
用元素符号表示,如 H、Na、Cl
用阳离子符号表示,用阴离子符号表示, 如Na+,Ca2+等,数 如S2-、Cl-,数字在前, 字在前,符号在后。符号在后。
R 得n电子 Rn-
原子中: 核电荷数 = 质子数 阳离子: 核电荷数 = 质子数 阴离子: 核电荷数 = 质子数
核=外电子数 核>外电子数
核<外电子数
练习2、判断下列是原子结构图、离子结构图?
+16 2 8 6
S
+8 2 8
O2-
+11 2 8 1
Na
+10 2 8
Ne
+17 2 8 8
Cl-
+11 2 8
失电子
得电子
联系 阳离子 得电子 原子 失电子
阴
离子
离子是如பைடு நூலகம்构成物质的呢?
钠原子Na
氯原子Cl
不稳定 +11 2 8 1
+17 2 8 7 不稳定
稳定
+11 2 8
钠离子Na+
+17 2 8 8 稳定 氯离子Cl-
相互作用
Na+ Cl-
NaCl
离子是构成物质的粒子么?
【知识拓展 】
像氯化钠这种由阴离子和阳离子相互作用 而形成的化合物,叫做离子化合物。 离子化合物:由阴离子和阳离子结合的化合物 (典型的金属和非金属结合的化合物)。
+11 2 8
钠原子(Na)
钠离子( Na+ ) 阳离子
+17 2 8 7 得到1个电子 +17 2 8 8
氯原子(Cl )
氯离子( Cl- )阴离子
离子
相对稳定结构:
只有一个电子层:最 外层为2个电子
多个电子层时:最外 层为8个电子
每一种原子在化学反应中,形成化合物 时:都要形成相对稳定结构
举例分析: Na +11 2 8 1
