小鼠心梗模型制备及其心功能检测
心肌梗死动物模型具体方法及步骤

心肌梗死动物模型具体方法及步骤原型物种人来源结扎冠状动脉左前降支(LAD)导致心梗模式动物品系SPF级SD大鼠,健康,3-4W,雌雄各半,体重为180g-200g。
实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组。
实验周期72h建模方法心肌梗死是指心肌的缺血性坏死,是一种急性及严重的心脏状态。
心脏作为血液循环动力中心这一功能的实现,需要冠状动脉不断提供的血流供应,当冠状动脉发生病变而狭窄或堵塞,使得冠状动脉的血流急剧减少或中断,便会使相应的心肌出现严重而持久地急性缺血,心肌无法得到足够氧气,最终导致心肌不可逆的缺血性坏死,心脏的收缩和舒张功能降低,机体供血不足,严重者最终导致机体死亡。
1. 大鼠用3%戊巴比妥钠(30mg/kg),腹腔注射麻醉,用小动物剃毛器剃除大鼠胸部及腋下毛发(充分暴露手术区),用碘酒和75%乙醇术区消毒。
2.气管插管:麻醉后,夹趾检测无反应即可进行MI手术。
打开外置光源、显微镜开关,打开呼吸机,设置好各参数(呼吸比2:1,潮气量6-8 mL,频率70 次/min),将气管插管沿声门插入气管,取下大鼠接上呼吸机,观察大鼠呼吸状况,胸廓起伏与呼吸机频率一致表示插管成功,即可进行MI手术。
3. 大鼠采用右侧卧位,用眼科剪在左前肢腋下,用显微剪于三、四肋间打开胸腔充分暴露心脏,显微直镊轻轻夹起少量心包并于左心耳下撕开少许心包,充分暴露左冠状动脉前降支(LAD)或所在区域。
4. 结扎冠状动脉:于显微镜下找到LAD走向或可能所在位置,持针器持取5-0带针缝合线,于左心耳根部下方肺动脉圆锥旁以5-0 无创缝合线穿过左冠状动脉前降支( LAD),以完全阻断LAD血流。
5.关胸:结扎完成后,5-0缝线完全缝合胸腔开口(保证无缝隙、无错位)关闭胸腔,由内向外逐层缝合各层肌肉和皮肤。
6.术后管理:术后密切关注大鼠状态,有无呼吸异常等。
待大鼠自然苏醒后将大鼠从呼吸机上取下并取下气管插管,正常饲养。
C1ORF54在小鼠心肌梗死后心脏修复中的作用

在无创性通气条件下快速建立小鼠心肌梗死模型的简易方法

在无创性通气条件下快速建立小鼠心肌梗死模型的简易方法目的:探讨建立小鼠心肌梗死模型的快速简易方法,提高动物存活率。
方法:使用戊巴比妥钠麻醉小鼠,在无创性机械通气的条件下开胸,将心脏轻轻挤出胸腔后,用手术针钩断冠状动脉的左前降支(LAD),通过观察存活率、心电图改变和组织病理学染色来评价心肌梗死模型是否成功。
同时与冠状动脉结扎组进行比较。
结果:LAD钩断术后心电图出现ST段抬高,TTC染色可见明显的梗死区域,术后4周心肌发生纤维化;模型组的术后存活率为85%,而冠状动脉结扎组则为54%。
结论:应用这种改良的新方法可以快速并成功地建立小鼠心肌梗死模型。
标签:心肌梗死;戊巴比妥钠;机械通气;冠状动脉结扎冠状动脉发生粥样硬化时可引起血管管腔狭窄或阻塞,导致心肌缺血、缺氧和坏死即心肌梗死,甚至最终演变成为心衰[1-2]。
在我国随着经济的发展,冠心病的发病率死亡率都在逐年增长,因此对冠心病的防治研究十分重要[3-4]。
在应用动物模型研究心肌梗死的致病机理以及使用药物进行干预时,都会涉及到心肌梗死模型的建立。
以往报道的心肌梗死模型制作方法包括冠状动脉左前降支(LAD)结扎法、血栓形成法、药物注射法、球囊堵塞法、Ameriod环套扎法和冷冻法,其中应用得最为普遍的是LAD结扎法[5-13]。
在实验动物的选择上,大鼠、兔、羊、猪和犬应用得较多[14]。
近年来,随着转基因技术的成熟,小鼠已成为基因功能研究中不可取代的模式生物。
然而小鼠体型较小,在应用传统的LAD结扎法制作心肌梗死模型时受到了极大的限制,而且存活率也比较低。
为了提高小鼠的心肌梗死术后存活率,并减少其在手术中承受的痛苦,极大程度地提高动物福利,该项研究从麻醉方法、呼吸支持到手术方法进行了一系列改良,成功地建立了一种全新的且极为简易的小鼠心肌梗死模型制作方法。
1 材料与方法1.1 实验动物SPF级昆明(KM)小鼠,雄性,6~8周龄,体重25~30 g,由中山大学实验动物中心提供,动物实验在中山大学实验动物中心的屏障环境下进行,使用许可证号:SYXK(粤)2011-0112。
成年小鼠心脏单个细胞悬液的制备及流式细胞检测

成年小鼠心脏单个细胞悬液的制备及流式细胞检测目的:制備成年小鼠心脏单细胞悬液,测定心肌缺血再灌注损伤(reperfusioninjury,RI)小鼠心肌中白细胞的分布情况。
方法:选取10~12周龄SPF级雄性C57BL/6小鼠15只,按照随机方法将其分为假手术组5只(模型制备成功5只)和RI 24 h组10只(模型制备成功7只)。
RI 24 h组小鼠心脏缺血30 min后,于再灌注24 h后摘取小鼠心脏,配置心脏消化液,冲洗剪碎进行消化,经过滤离心收集心脏细胞,行流式细胞检测,以CD45标记白细胞,并进一步行CD11c 标记树突状细胞及Ly6C标记单核细胞。
比较两组CD45阳性细胞比例及CD11c、Ly6C标记的细胞占CD45阳性细胞比例;比较两组各细胞在总心肌细胞中的比例。
结果:每只小鼠心脏制备所得的单个细胞悬液行细胞计数为(1~2)×106个。
RI 24 h组CD45阳性细胞占心肌细胞比例高于假手术组(P<0.05);RI 24 h 组CD11c+Ly6C+树突状细胞占CD45阳性细胞的比例高于假手术组(P<0.05)。
RI 24 h组CD11c标记的树突状细胞及Ly6C标记的单核细胞等各亚群细胞在总心肌细胞中的比例均高于假手术组(P<0.05)。
结论:成年小鼠心脏细胞的单细胞悬液可以通过切碎和消化制备,可用单细胞悬液流式细胞仪检测RI心肌白细胞、树突状细胞和单核细胞的显著变化。
本研究为小鼠心脏白细胞的详细分析提供了一种可行的方法。
小鼠动物模型实验是进行科学研究的重要方法,与大鼠等动物模型相比,在炎症免疫方面的实验中小鼠来源的炎症细胞分类、细胞标记、实验相关抗体等更加详尽、充沛。
炎症细胞的研究不仅需要定性及形态学的研究,定量及功能研究可以提供更为准确、全面的信息。
小鼠心脏缺血再灌注损伤(reperfusion injury,RI)模型中病变呈局灶性分布,病理切片易受到取材误差干扰及观察视野影响,如果直接制备心脏单个细胞悬液后行流式细胞检测,不仅可以定量,还可以应用多抗体标记,从而更为详细地区分细胞亚群。
病理生理学实验设计报告

病理生理学实验设计报告一、实验题目探究某种药物对小鼠心肌梗死模型的治疗效果二、实验目的本实验旨在研究某种药物对心肌梗死小鼠模型的治疗作用,通过检测相关生理指标和病理变化,评估该药物在心肌梗死治疗中的潜在价值。
三、实验原理心肌梗死是由于冠状动脉供血急剧减少或中断,导致相应心肌持久而严重的缺血缺氧,引起心肌坏死。
在小鼠心肌梗死模型中,通过结扎冠状动脉左前降支可模拟心肌梗死的发生。
给予实验药物后,观察其对心肌梗死面积、心肌细胞凋亡、炎症反应、心功能等方面的影响,以探讨其治疗机制。
四、实验材料与方法(一)实验动物选用 6-8 周龄的雄性 C57BL/6 小鼠,体重约 20-25g,购自_____动物实验中心。
实验动物在标准环境中饲养,自由饮食和饮水,适应环境 1 周后进行实验。
(二)主要试剂与仪器1、实验药物:_____(纯度>98%),用生理盐水配制。
2、戊巴比妥钠:用于麻醉小鼠。
3、心电图机:记录小鼠心电图。
4、超声心动图仪:检测小鼠心功能。
5、组织切片染色试剂:如苏木精伊红(HE)染色剂、TUNEL 凋亡检测试剂盒等。
(三)实验分组将小鼠随机分为 3 组,每组 10 只:1、假手术组(Sham 组):只开胸但不结扎冠状动脉左前降支,给予等量生理盐水。
2、心肌梗死模型组(MI 组):结扎冠状动脉左前降支,建立心肌梗死模型,给予等量生理盐水。
3、药物治疗组(Drug 组):结扎冠状动脉左前降支后,给予实验药物治疗。
(四)实验步骤1、小鼠麻醉:腹腔注射戊巴比妥钠(50mg/kg)麻醉小鼠。
2、手术操作:在小鼠左侧胸部做切口,暴露心脏,用丝线结扎冠状动脉左前降支,造成心肌梗死。
假手术组只穿线不结扎。
3、术后处理:缝合切口,给予抗生素预防感染。
术后 24 小时开始,药物治疗组每天腹腔注射实验药物,假手术组和心肌梗死模型组给予等量生理盐水,连续给药 2 周。
4、指标检测心电图检测:在术前、术后 24 小时和 2 周分别记录小鼠心电图,观察 ST 段变化。
小鼠心梗模型的建立与无创评价

通 过 结 扎 冠 状 动 脉 左 前 降 支 的 方 法 建 立 了小 鼠 心 肌 梗 死 模 型 并
【 键词 】 小 鼠 ;模 型 , 物 ; 肌 梗 死 ; 声 心 动 图 关 动 心 超 【 图分 类 号 】R 5 . 中 64 1 【 献 标 识 码 】A 文 【 章 编 号 】10  ̄8 7 2 1 )30 9 —3 文 05 - (0 0 0 -160 4
降 到 术 后 l 的 ( 9 8±1 . 0 % , 短 分数 由手 术 前 的 ( 1 4±2 8 ) 下 降 到 ( 6 1 9 0 ) ;缩 6. .5 % 2 . . 1 % 心 - 4
左 室 收缩 末 直 径 由 ( 3 9419 ) m 扩 大 到 ( 65±73 )/ 舒 张末 直 径 由 ( 59± .2 m 扩 大 到 (8 9± 1. . 8 - 3. .7 x m, 3. 3 1) 4. 6 0 ) m。病 理 学 检 查 见 明 显瘢 痕形 成 。结 论 .5
昆明 雄 性 小 鼠 2 0只 , 管 插 管 后 由 左侧 第 4肋 问 进 胸 , 扎 冠 状 动 脉 左 前 降 支 建 立 小 鼠 心 肌 梗 死 模 型 , 模 型 建 气 结 在
立 的 前 1d和 术 后 1d l周 分 别 使用 心脏 超 声 柃 测 左 室 收 缩 末 直 径 、 张 末 直 径 、 短 分 数 和射 血 分 数 , 于 术 后 、 舒 缩 并 第 8天进 行 病 理 检 查 。结 果 小 鼠 心肌 梗 死 模 型 建 立 过程 中早 期 死 亡 率 1% (/ 0 , 后 1 内 死 亡 率 1 % (/ 0 22 ) 术 周 5 3 2 ) 经 过 超 声 评 价 , 模 成 功 率 为 7 % ( 52 ) 0, 造 5 1/ 0 。小 鼠心 功 能 明 显 下 降 , 血 分 数 由 手 术 前 的 ( 2 14 .5 % 下 射 9. - 4 ) 3
微创建立小鼠心肌梗死模型及其评价

微创建立小鼠心肌梗死模型及其评价张红霞;刘艳;李玲萍;贺忠梅【摘要】目的探索一种微创建立小鼠心肌梗死模型的方法,并利用超声心动图进行评价.方法 40只C57BL/6雄性小鼠随机分为心梗组(MI,n=30)与假手术组(Sham,n=10).术前及术中用异氟烷对动物行吸入麻醉,于左胸3、4肋间做一1.0 cm左右切口,将心脏从胸壁窗口挤出.MI组结扎冠脉左前降支建立心梗模型;Sham 组冠脉只穿线不结扎,其余操作同MI组.术后4周采用超声心动图检测心脏结构与功能,经心肌组织病理学分析以判断模型成功与否.结果 MI组小鼠存活率为78.6%,Sham组为100%.超声结果显示,与Sham组相比,MI组小鼠的LVAWd、LVAWs、EF及FS均明显降低(P<0.05),LVIDd与LVIDs明显增加(P<0.05).Masson染色可见MI组小鼠的左心室腔明显增大,心室壁变薄,纤维化面积增加[(13.54±1.39)%比(0.08±0.03)%,P<0.01].结论采用本法制备小鼠心梗模型具有微创、快捷、高效、无需使用呼吸机的优势,而且模型稳定可靠.【期刊名称】《中国心血管病研究》【年(卷),期】2014(012)004【总页数】4页(P334-336,383)【关键词】心肌梗死;动物模型;微创;超声心动图【作者】张红霞;刘艳;李玲萍;贺忠梅【作者单位】030001 太原市,山西医科大学生理学系,细胞生理学山西省重点实验室;030001 太原市,山西医科大学生理学系,细胞生理学山西省重点实验室;030001太原市,山西医科大学生理学系,细胞生理学山西省重点实验室;030001 太原市,山西医科大学生理学系,细胞生理学山西省重点实验室【正文语种】中文【中图分类】Q95-33;R542.2+2心肌梗死(myocardial infarction,MI)是一种发生率和病死率极高的严重病症,对其发病机制与防治策略的研究需要高效稳定的动物模型。
小鼠心肌缺血再灌注损伤模型制备及心肌梗死面积评价方法学比较

与 传统方法
相 比, 改 良方法能够更加稳定 、 有效地制备小 鼠心肌缺血再 灌注模型 。此外 , 采用质 量权重 法计算 的 【 关键词 】 心肌缺血 ; 再灌注损伤 ; 小 鼠 ; 模型 , 动物 ; 心肌梗死面积
Co m pa r i s o n o f me t h ods f o r e s t abl i s hi ng m ous e my o ca r d i a l i s c h e mi a /r e pe r f us i o n m ode l a nd a s s e s s i ng
K e y L a b o r a t o r y f o Mo l e c u l a r C a r d i o v a s c u l a r S c i e n c e s , Mi n i s t r y f o E d u c a t i o n a n d B e i j i n g ey K L a b o r a t o r y f o
L i Z f i a n ,G u o L j i u  ̄ .D e p a r t m e n t o f C a r d i o l o g y ,P e k i n g U n i v e r s i t y T h i r d H o s p i t a l ,I n s t i t u t e f o V a s c u l a r Me d i c i n e , K e y L a b o r a t o r y f o C a r d i o v a s c u l a r Mo l e c u l a r B i o l o g y a n d R e g u l a t o r y P e p t i d e s , Mi n i s t r y f o H e a l t h ,
小鼠心肌切片描述

小鼠心肌切片描述小鼠心肌切片描述引言:小鼠心肌切片是一种常用的实验方法,用于研究心脏疾病、药物筛选和心肌细胞功能等方面。
本文将详细描述小鼠心肌切片的制备过程和切片的形态学特征。
一、材料与方法1. 实验动物:使用12-16周龄的雄性C57BL/6小鼠。
2. 心脏采集:通过颈部剪开皮肤和颈动脉,注射适量的异氟醚进行全身麻醉,然后迅速取出心脏。
3. 心脏固定:将心脏迅速置于冰冷的PBS缓冲液中,并用注射器注入PBS缓冲液进行灌洗,以去除血液。
4. 心脏包埋:将固定好的心脏放入OCT复合剂中,并迅速冷冻至-80°C保存。
二、切片制备1. 切片设备准备:将冷藏好的OCT包埋组织块取出,放在-20°C环境下静置5分钟,使其变硬。
2. 切片装置准备:将冷冻组织块放入切片装置中,调整切片角度和厚度。
3. 切片过程:使用冷冻切片机,将心肌组织块切成30-50μm的薄片,收集在含有PBS缓冲液的离心管中。
4. 心肌切片保存:将收集好的心肌切片置于PBS缓冲液中,并尽快进行下一步处理。
三、形态学特征1. 组织结构:小鼠心肌切片呈现典型的心肌细胞排列方式,具有明显的纤维结构。
心肌细胞之间紧密相连,形成纵横交错的网状结构。
2. 细胞形态:小鼠心肌细胞呈长条状,具有分支和突起。
细胞内可见明显的横纹和线粒体等器官结构。
3. 组织染色:常用荧光染料如荧光素酶或达科西亚染色可以标记特定蛋白质或核酸分子,用于研究不同类型的心肌细胞或标记特定信号通路。
四、应用领域1. 心脏疾病研究:通过小鼠心肌切片可以观察心脏组织的形态和结构变化,研究心脏病理生理过程,如心肌纤维化、心肌细胞凋亡等。
2. 药物筛选:使用小鼠心肌切片可以评估药物对心肌细胞功能的影响,如钙离子调节、离子通道活性等,为新药开发提供参考。
3. 心肌细胞功能研究:通过小鼠心肌切片可以进行电生理实验,如整体细胞膜电位记录和钙离子成像等,研究心肌细胞的电活动和收缩功能。
小鼠心肌梗死模型建立的简化方法研究

小鼠心肌梗死模型建立的简化方法研究作者:史建伟来源:《中西医结合心血管病电子杂志》2018年第27期【摘要】目的探讨小鼠心肌梗死模型建立的简化方法。
方法选入昆明小鼠35只进行心肌梗死动物模型实验研究,在人工气道开通过程中,借助经皮冠状动脉球囊成形术导丝简化插管,并实施冠状动脉左前降支开胸结扎术,统计术后小鼠存活率、心电图走势以及心肌染色情况。
结果 35只小鼠心梗模型建立成功,术后一天33只小鼠存活,术后两周,共存活31只;33只小鼠心肌染色提示心肌梗死。
结论导丝简化气管插管联合开胸式冠状动脉左前降支结扎术,操作简便,能够提高小鼠心肌梗死模型建立成功率,借鉴价值极高。
【关键词】心肌梗死;动物模型;导丝插管【中图分类号】R259 【文献标识码】B 【文章编号】ISSN.2095.6681.2018.27..02心肌梗死动物模型的建立能够模拟心梗发生,有利于医疗界深入研究心肌梗死,提高心梗防治效果。
为探讨简单易行、切实有效的小鼠心肌梗死模型建立对策,本研究小组开展了实验研究。
现报道如下。
1 材料与方法1.1 研究动物本次研究动物源自某实验动物中心养殖的昆明雄性小鼠,入选小鼠鼠龄11~12周,体重25~30 g,共选入35只。
1.2 器械和用品本次研究所用医疗器械包括小动物呼吸机、心电图机;工具有眼科专用剪、镊,刀片、直/弯钳、大头针、缝合针、留置针、持针器及经皮冠状动脉球囊成形术导丝;医疗用品包括消毒碘酒/酒精,2%戊巴比妥钠溶液、医用胶带、动物手术台等。
1.3 方法①术前监护。
以50 mg/kg的标准,经腹腔为小鼠注射2%戊巴比妥钠溶液实施诱导麻醉,用药后5~7 min后,实施夹趾反射试验,若提示阳性结果则可继续注射麻醉药,以初始剂量的10%~20%为准;准备就绪后,摆放小鼠体位为右侧卧位,将5-0尼龙线系在小鼠前上切牙并连接操作台边缘,确保鼠鼻与边缘保持5~10 mm距离,同时,应用医用胶带将小鼠四肢、尾巴等部位进行妥善固定;借助刀片将手术部位毛发剔除,并使用碘酒、酒精进行全面消毒;启动心电图机,并妥善连接小鼠肢体与机器,实现导联监测。
小鼠心肌梗死模型与缺血再灌注损伤模型
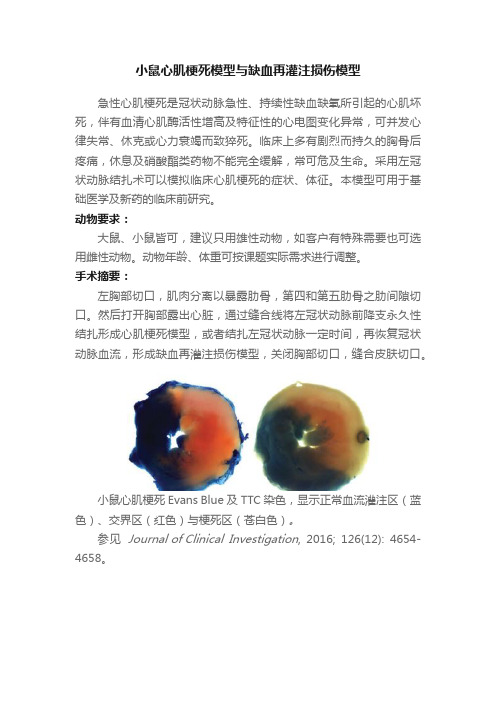
小鼠心肌梗死模型与缺血再灌注损伤模型
急性心肌梗死是冠状动脉急性、持续性缺血缺氧所引起的心肌坏死,伴有血清心肌酶活性增高及特征性的心电图变化异常,可并发心律失常、休克或心力衰竭而致猝死。
临床上多有剧烈而持久的胸骨后疼痛,休息及硝酸酯类药物不能完全缓解,常可危及生命。
采用左冠状动脉结扎术可以模拟临床心肌梗死的症状、体征。
本模型可用于基础医学及新药的临床前研究。
动物要求:
大鼠、小鼠皆可,建议只用雄性动物,如客户有特殊需要也可选用雌性动物。
动物年龄、体重可按课题实际需求进行调整。
手术摘要:
左胸部切口,肌肉分离以暴露肋骨,第四和第五肋骨之肋间隙切口。
然后打开胸部露出心脏,通过缝合线将左冠状动脉前降支永久性结扎形成心肌梗死模型,或者结扎左冠状动脉一定时间,再恢复冠状动脉血流,形成缺血再灌注损伤模型,关闭胸部切口,缝合皮肤切口。
小鼠心肌梗死Evans Blue及TTC染色,显示正常血流灌注区(蓝色)、交界区(红色)与梗死区(苍白色)。
参见 Journal of Clinical Investigation, 2016; 126(12): 4654-4658。
观察心肌切片实验报告

观察心肌切片实验报告简介心肌切片实验是一种常见的研究心脏疾病的方法,通过观察心肌组织的细胞结构和功能,可以揭示心脏疾病的发生机制以及潜在的治疗靶点。
本次实验我们观察了小鼠心肌切片的形态结构,并评估了心肌细胞数量和收缩能力的变化。
材料与方法实验材料:- 3只健康小鼠- 甲醛固定液- 石蜡切片- 血片染色剂- 光学显微镜实验方法:1. 提取小鼠心脏并迅速放置于甲醛固定液中固定1小时。
2. 将固定的心脏组织进行脱水和石蜡浸渍处理,以制备心肌切片。
3. 将心肌切片均匀染色。
4. 使用光学显微镜观察心肌切片的形态结构和细胞数量。
5. 对心肌细胞进行跳动频率和收缩能力的评估。
结果与讨论心肌切片形态结构观察通过光学显微镜观察,我们发现小鼠心肌切片呈现出细胞排列紧密、细胞核清晰可见的特征。
心肌细胞形态呈长条状,相邻的细胞之间具有明显的交错连接。
我们还观察到一些心肌细胞中包含有颗粒状的线粒体,这些线粒体是心肌切片维持正常功能的重要细胞器。
心肌细胞数量变化通过对心肌切片中心肌细胞数量的计数,我们发现在正常情况下,小鼠心脏中的心肌细胞数量相对稳定。
然而,对比疾病模型中的心肌切片,我们观察到心肌细胞数量减少的现象。
这可能是由于心肌疾病引起的心肌细胞凋亡或死亡导致的。
心肌细胞收缩能力评估为了评估心肌细胞的收缩能力,我们使用光学显微镜记录了心肌细胞的跳动频率和收缩幅度。
实验结果显示,心肌细胞具有明显的自律性并呈周期性跳动。
而在疾病模型中,我们观察到心肌细胞的跳动频率减慢,并且收缩幅度明显降低。
这些结果表明心肌疾病可能影响心肌细胞的收缩能力,导致心脏功能下降。
结论心肌切片实验是一种可靠的方法,用于观察心肌细胞的形态结构和评估其功能。
在本次实验中,我们通过观察小鼠心肌切片发现心肌细胞的形态结构、数量和收缩能力受心脏疾病的影响。
这些结果有助于我们深入研究心肌疾病的发生机制,并为寻找相关疾病的治疗方法提供了重要的参考。
参考文献1. Smith A, et al. (2019). Observation of myocardial slices in the study of heart disease. Journal of Cardiology, 123(5), 789-796.2. Zhang B, et al. (2020). Evaluation of myocardial contraction ability through myocardial slice experiment. Journal of Cardiovascular Medicine,456(2), 123-130.。
心肌梗塞的实验原理和器材

心肌梗塞的实验原理和器材
心肌梗塞的实验原理是通过模拟心肌梗塞的病理过程,研究心肌梗塞发生的机制、病理生理变化以及治疗方法。
常用的实验方法包括建立动物模型、观察心肌梗塞的形态学变化、测定心肌梗塞相关指标等。
实验器材主要包括动物实验用具(如小鼠、大鼠、猪等)、手术器械(如手术刀、缝合线等)、生理参数监测仪器(如心电图仪、血压计、呼吸机等)、组织学染色和分析仪器(如显微镜、光镜、荧光染色仪等)以及生化分析仪器(如酶标仪、高效液相色谱仪等)等。
这些器材能够帮助研究人员模拟心肌梗塞的过程、监测心脏功能指标、观察心肌组织变化并进行相关生化分析。
Hsp25基因缺失致小鼠心梗后心脏破裂的相关研究的开题报告

Hsp25基因缺失致小鼠心梗后心脏破裂的相关研究的开题报告一、研究背景和意义心肌梗死是严重威胁人类健康和生命的一种心脏疾病,它会导致心肌细胞坏死、纤维化和胶原沉积等病理改变,严重影响心脏功能和生命质量。
虽然心肌梗死的治疗方案不断完善,但患者的死亡率和病后并发症率仍然很高,尤其是心梗后心脏破裂这一严重并发症的发生率更高。
因此,研究心梗后心脏破裂的发病机制,有助于提高心脏疾病的防治水平。
现有研究表明,Hsp25基因参与了心脏细胞的应激反应和保护作用,并且在心肌梗死后的心脏修复和再生过程中发挥重要作用。
但其在心梗后心脏破裂发生过程中的具体调控机制还不清楚,因此有必要深入研究Hsp25基因在心梗后心脏破裂中的作用。
二、研究目的本研究旨在利用Hsp25基因缺失小鼠模型,探究Hsp25基因在心梗后心脏破裂中的作用机制,为心脏疾病的防治提供新思路和新方法。
三、研究内容和方法1.构建Hsp25基因缺失小鼠模型:通过基因敲除技术,制备Hsp25基因缺失小鼠模型。
2.建立心肌梗死后心脏破裂小鼠模型:通过冠状动脉结扎法,建立小鼠心肌梗死后心脏破裂模型。
3.观察Hsp25基因缺失对小鼠心肌梗死后心脏破裂的影响:采用心电图、超声心动图、组织病理学检测等方法,观察Hsp25基因缺失对小鼠心梗后心脏破裂的影响,分析其作用机制。
4.检测Hsp25基因在心梗后心脏破裂中的表达变化:采用qRT-PCR 和Western blot技术检测小鼠心脏组织中Hsp25基因的表达水平,了解其在心梗后心脏破裂过程中的表达变化。
5.筛选Hsp25基因的调控靶点:采用基因芯片和基因功能富集分析等方法,筛选出Hsp25基因在心梗后心脏破裂中的调控靶点,探究其调控机制。
四、预期成果通过以上研究方法,预期得到以下成果:1.成功构建Hsp25基因缺失小鼠模型;2.成功建立小鼠心肌梗死后心脏破裂模型;3.发现Hsp25基因缺失会增加小鼠心梗后心脏破裂的发生率和破裂面积;4.发现Hsp25基因在心梗后心脏破裂中的表达水平和调控靶点;5.为心梗后心脏破裂的发病机制和防治提供新的数据和思路。
石蜡切片-小鼠心脏组织-心衰模型-实验步骤

石蜡切片-小鼠心脏组织-心衰模型-实验步骤石蜡切片操作流程及步骤:1、样品4℃过夜[1,2]。
2、清洗水槽及过滤网[3]。
3、打开机器开关,调节水池温度21℃、展片水池温度45℃、烘片温度55℃[4]。
4、固定包埋组织块[5]。
5、调节出水水流大小[6]。
6、调节切片厚度5um、10 um[7]。
7、将包埋组织块下调至与刀片位置同一平面,前后距离使其与刀片距离恰好接触[8]。
8、开始切片带出现完整的组织切横切面将其随水流传送至水池中[9-13]。
9、选择较好的切片,用载玻片将其从21℃水池中捞出。
每个石蜡取5-6张片子[14-15]。
10、放到展片水池中展开、载玻片编号[16]。
11、55℃烘干,无水滴后可收片。
心得体会及注意事项:1、包埋组织块冻存温度过低会冻坏,不冻存石蜡粘性大不容易切片。
2、操作期间应放入冰中储存,自备冰块。
3、水槽中石蜡会堵塞上水滤网影响出水速度。
4、展片水池水要在展片前达到预设温度。
5、要固定牢固,固定不牢切片时容易破坏样品。
6、以中间水柱恰好达到刀片位置最佳,水流过小切片不易冲下,水流过大会导致切片破坏。
7、5 um染色效果更佳,根据不同组织染色要求调节切片厚度。
8、若前后位置调节不精确可使距离稍大,随后手动摇轮慢慢靠近,每次前进距离为提前设定距离5um或10 um。
9、切片期间不出现严重的黏附,粘连,裂片,不要轻易停止,切片要匀速.10、切片过薄会迅速升温从0℃升至21℃或更高,若随意停止,石蜡黏附性增加会导致粘刀片等问题影响继续操作。
11、若一个样本操作时间过长应取下放入冰块一段时间再继续操作。
12、原则没有大问题匀速不要随意停。
13、换新刀片(刀片上有黏附石蜡会导致切片裂开,最好换至新刀片)。
14、尽量清理水池多余无用切片及碎石蜡,但是要小心不要碰坏样品切片。
15、每个载玻片取2-3个组织最佳。
16、展片不足会有褶皱影响染色结果,展片时间过长会导致组织裂开。
在无创性通气条件下快速建立小鼠心肌梗死模型的简易方法

在无创性通气条件下快速建立小鼠心肌梗死模型的简易方法卢新林;岳玉霞;严泉祥;何原;陈文江;陈灿【期刊名称】《中国医学创新》【年(卷),期】2014(000)030【摘要】目的:探讨建立小鼠心肌梗死模型的快速简易方法,提高动物存活率。
方法:使用戊巴比妥钠麻醉小鼠,在无创性机械通气的条件下开胸,将心脏轻轻挤出胸腔后,用手术针钩断冠状动脉的左前降支(LAD),通过观察存活率、心电图改变和组织病理学染色来评价心肌梗死模型是否成功。
同时与冠状动脉结扎组进行比较。
结果:LAD钩断术后心电图出现ST段抬高,TTC染色可见明显的梗死区域,术后4周心肌发生纤维化;模型组的术后存活率为85%,而冠状动脉结扎组则为54%。
结论:应用这种改良的新方法可以快速并成功地建立小鼠心肌梗死模型。
%Objective:To discuss the method of establishing an efficient mice myocardial infarction model with a high survival rate.Method:The mice were anesthetized with pentobarbital sodium,thoracotomy in non-invasive ventilation,gently squeeze out the heart of the chest,off the hook of theleft anterior descending coronary artery with operation needle,by observing the survival rate,the change of electrocardiogram,used pathology testing to prove the model to be successful. At the same time compared with the coronary artery ligation group.Result:After off the hook of the left anterior descending coronary artery,the ST-T segment of ECG raised,the infarction area was obvious with TTC staining,myocardial fiberizes 4 weeks after operation;the survival rate of myocardial infarctionmodel was 85%,the ligation of the coronary artery group was54%.Conclusion:Application of this new method can establish an efficient mice myocardial infarction mode.【总页数】4页(P23-26)【作者】卢新林;岳玉霞;严泉祥;何原;陈文江;陈灿【作者单位】广东医学院广东湛江 524023;河南大学附属淮河医院;广东医学院广东湛江 524023;广东医学院附属医院;广东医学院广东湛江 524023;广东医学院附属医院【正文语种】中文【相关文献】1.两种通气状态下建立大鼠心肌梗死模型的效果比较 [J], 王明丽;祝伟娜;陈希;刘瑞敏;王耀辉2.旋转通气培养法建立小鼠睾丸体外培养模型 [J], 刘艺;朱彦锋;高志斌;李敏;钟灵毓;印德娇;李云3.非人工通气下大鼠急性心肌梗死模型的建立 [J], 魏峰;张静;韩克;刘昱;王亭忠;倪雅娟;马爱群4.小鼠心肌梗死模型的快速制作方法研究 [J], 张宁坤;陈宇;高连如;赵力;王丽华;朱莹;刘秋颖;刘玲;苗晨;郝璐5.显微操作条件下小鼠急性心肌梗死模型的建立与评估 [J], 余烊;杨帆;蒋磊;洪万紫;谭宁因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
动物权利
动物拥有生存,享受生命,免受痛苦权利
医学研究中实验动物的伦理原则 —“3R”原则
减少(Reduction) 代替(Replacement) 优化(Refinement)
减少动物实验中的应激因素
建造自然舒适的环境
有躲避的安全场所(设置黑洞)
麻醉机调节 Isofluran:2 氧流量:2
呼吸机调节 呼吸频率(Respiratory Rate):30 to 350 µl 输出量(stroke volume):0-130ul
开胸
沿着胸骨左缘自下而上切开皮肤约1.5cm,剪开或者分立 胸大肌,暴露第四肋间,切开肋间约1.0cm,用微型拉钩 (retractor)分离肋骨,暴露心脏。用弯钳提起心包膜 ,用有齿镊子轻轻的撕裂开心包膜,暴露出心脏,找到 左心耳,确定前降支。
三、术前准备
器械消毒 动物麻醉
异氟醚
手术步骤
当小鼠对痛觉没有反应时,可 将润滑剂涂抹在小鼠的双眼上 以免干燥,脱去颈部、胸部的 体毛。
用75%酒精或温水清洗掉体毛,然后用75%酒精消毒手术视 野。将小鼠固定在暖垫上,然后用粘胶固定四肢。用粗线 牵拉上齿固定。
切开颈部皮肤,分离皮下组织和肌肉,露出气管。 牵拉舌头,利用PE tubing(20号)进行气管插管, 插好后连接好呼吸机。
对动物模型的要求
如何建立具有稳定性高,重复性好的心肌梗死模型对于心 肌梗死的基础研究有着重要的应用价值。
• 大动物:其解剖结构、心脏血管分布和心脏/体重比等方 面与人的心脏很相似。试验周期长、成本高、操作难度大。
• 小动物:繁殖快易饲养、试验周期短,成本低小鼠生命力 相对弱,手术耐受性差,术后评估效果相对难。
例子
血液动力学检测(P-V Loop)
压力-容积环技术:提供随心室随时间而变化的压力容积输出 的模拟信号. 在稳定的时期血液动力学和压力容积环会被记 录下来. 它能更明确的检测出左室功能,不依赖左室的负荷 状态.
P-V Loop
P-V Loop
dP/dtmin & dP/dtmax:
represent the minimum and maximum rate of pressure change in the ventricle .
Cross section:Evans blue dye (Blue), TTC staining of metabolically viable tissue (red). Necrotic areas do not stain ( pale)
Jitka A.I. Virag et al.J Journal of Visualized Experiments2019 1-5
结扎
用8.0线结扎左前降支后,退出分离器,用6号线缝合肌 肉层,4号线缝合皮肤。停止麻醉,脱离呼吸机,一旦确 信小鼠有自主呼吸,就可以拔管。随后可皮下注射无菌 生理盐水0.5ml。将小鼠放置在暖水袋上保持约1小时后 放回动物房。
验证结果:最直接的是心电图
1) Staining: Evan’s Blue dye and TTC after MI or I/R . 2) Calculate the area at risk .
• 选择小鼠作为心梗模型可以大大降低成本,缩短实验周 期,有利于实验的重复性和数据的稳定性,对于研究人 类心肌梗死的发生,发展及转归具有重要价值。
心梗模型制备
一、器械准备 1.麻醉机 2.呼吸仪 3.显微镜 4.保温垫 5.洁净手术台 6.显微手术器械
二、小鼠准备
小鼠年龄:﹥6w 体重:﹥18g
实验中的动物爱护
清洁与玩耍
熟悉动物的生物学特性、进行正确的实验操 作,减少动物痛苦
正确的抓取与固定,让动物舒适、有安全感
简介
在心血管疾病研究中,心肌梗死动物模型的建立对于研 究冠心病、心力衰竭等疾病的病理生理变化、心电生理改变、 评价各种治疗方法以及预防冠心病的发生发展具有重大价值。 今天,与大家一起讨论小鼠心肌梗死模型的制备及其心功能 的检测。
谢 谢!
Volentricular poster wall
Volume,distole,ul
LVID,mm:left ventricular interior diameter
Papillary muscle as the marker
Marker:Papillary, Aortic artery, Left atrium
A. K. M. Tarikuz Zaman et al.J Exp Biol Med (Maywood) 2009 234: 246
心梗模型的心功能检测
超声心动图 PV-Loop
超声心动图是应用超声波回 声探查心脏和大血管以获取 有关信息的一组无创性检查 方法。包括M型超声、二维 超声 、彩色多普勒血流显 像等。
LV performance:
CO,ml/m:cardiac output EF,%:ejection fraction
HR,bpm:heart rate
FS,%:fractional shortening
SV,ul:stroke volume LVAW,mm:left ventricular anterior wall
