荧光原位杂交仪实验报告
荧光原位杂交技术

硕士学位论文荧光原位杂交技术及其在环境领域内的应用Fluorescence in situ hybridization technology and its application in thefield of environment作者姓名:**学科、专业:环境科学与工程学号:********指导教师:***完成日期:2014/3/26XX理工大学Dalian University of Technology摘要荧光原位杂交(FISH)是现代分子生物学及基因工程中广泛应用的新技术,本文概述了FISH实验原理、实验流程以及技术问题等。
总结了一些实验关键步骤的操作要点和注意事项,并对荧光原位杂交技术在环境微生物监测方面的应用做了综述。
利用FISH 技术在环境样品上直接原位杂交,不仅可以测定不可培养微生物的形态特征及丰度,而且可原位分析它们的空间及数量分布。
并且展望了FISH技术的未来。
关键词:荧光原位杂交技术;探针;环境微生物;监测AbstractFluorescence in situ hybridization (FISH)isa new technologywhich is widely used in modern molecular biology and genetic engineering. This article summarizes the experimental principle, process and technical issues of FISH.Also we summarize some operation points and matters needed attention of key steps, and review application of FISH in environmental microbe monitoring. Using FISH technology directly in the environmental samples, can not only measure the morphology and abundance of uncultured microorganisms, but alsoanalyse their spatial distribution and quantity in situ. And look forward to the futureof FISH.Key Words:Fluorescence in situ hybridization technology; Probe; Environmental microbes; monitoring目录摘要IAbstractII1 荧光原位杂交技术简介41.1 FISH发展历史41.2 FISH原理51.3 FISH基本过程61.3.1 探针制备61.3.2 探针的标记71.3.3杂交前处理71.3.4 杂交81.3.5荧光检测与结果分析91.4 FISH技术特点101.5 常见的技术问题及解决措施101.5.1 FISH检测的假阳性101.5.2 FISH检测的假阴性112 FISH技术在环境领域的应用112.1 对硝化细菌的监测112.2 对除磷细菌的监测122.3 FISH技术在丝状微生物研究中的应用122.4 对厌氧颗粒污泥中微生物的监测132.5 对自然环境中微生物多样性的监测133 未来展望14参考文献151荧光原位杂交技术简介荧光原位杂交(fluorescence in situ hybridization,FISH)是在20世纪80年代末在放射性原位杂交技术的基础上发展起来的一种非放射性分子细胞遗传技术,以荧光标记取代同位素标记而形成的一种新的原位杂交方法,探针首先与某种介导分子结合,杂交后再通过免疫细胞化学过程连接上荧光染料。
微生物荧光原位杂交实验技术

微生物荧光原位杂交实验技术背景微生物荧光原位杂交实验技术是在原位杂交技术的基础上发展而来的。
原位杂交技术最早应用于染色体分析,后来逐渐应用于微生物检测领域。
随着荧光标记技术的不断发展,人们开始利用荧光标记探针进行原位杂交,从而提高了检测的灵敏度和特异性。
原理微生物荧光原位杂交实验技术的原理是利用特定的荧光标记探针与细胞中的微生物进行杂交,从而将微生物定性和定量地检测出来。
该技术的基本原理是碱基互补配对原则,即探针的序列与待测微生物的序列互补,从而形成稳定的杂交双链。
利用荧光检测仪器检测荧光信号,从而实现对微生物的定量和定位分析。
实验方法样品的制备:将待测样品进行处理,使微生物细胞分离并保持活性。
探针的制备:将特定的DNA或RNA片段进行标记,形成荧光探针。
杂交反应:将样品和探针在一定条件下进行杂交反应,形成杂交双链。
洗涤和干燥:去除未结合的探针和杂质,保持杂交信号的特异性。
荧光检测:利用荧光检测仪器检测样品的荧光信号,并对数据进行处理和分析。
实验结果通过微生物荧光原位杂交实验技术,我们可以得到样品的定性和定量数据。
实验的成功率较高,特异性较强,能够清晰地检测出目标微生物的存在和数量。
该技术的灵敏度较高,可以检测出低拷贝数的微生物基因,为研究提供了有力的工具。
实验讨论微生物荧光原位杂交实验技术具有许多优势,如高特异性、高灵敏度和能够保持细胞结构的完整性等。
然而,该技术也存在一些不足之处,如探针制备过程较为繁琐、杂交反应条件要求较高以及荧光检测仪器价格昂贵等。
荧光探针的稳定性也可能影响实验结果的可靠性。
因此,在应用该技术时需要注意这些因素,并选择合适的探针和实验条件,以保证实验结果的准确性和可靠性。
结论微生物荧光原位杂交实验技术在研究领域具有广泛的应用前景。
除了在微生物检测方面的应用,该技术还可以应用于其他领域,如基因表达分析、细胞凋亡研究等。
虽然该技术存在一些不足之处,但随着技术的不断发展和优化,相信未来会有更多的应用前景等待着我们去探索和发现。
原位杂交实验总结

定价协议书甲方(供应商):_____________________乙方(采购方):_____________________鉴于甲方是专业的产品供应商,乙方有采购该产品的需求,双方本着平等自愿、诚实信用的原则,就产品定价事宜达成如下协议:1. 产品信息:甲方同意向乙方提供以下产品,具体产品信息如下:产品名称:________________型号/规格:________________单位:________________质量标准:________________2. 定价机制:双方同意按照以下方式确定产品价格:a. 固定价格:双方约定在合同有效期内,产品价格为固定价格,不随市场波动而变化。
b. 浮动价格:若双方同意,产品价格可以根据市场行情进行调整,具体调整机制如下:i. 价格调整周期:________________ii. 价格调整依据:________________iii. 价格调整通知:甲方应至少提前____天书面通知乙方价格调整事宜。
3. 价格条款:产品价格包括以下费用:a. 生产成本b. 运输费用c. 税费d. 其他双方约定的费用4. 付款方式:乙方应在收到甲方发票后____天内,按照约定的价格条款支付货款。
5. 价格保密:双方应对本协议中的价格信息保密,未经对方书面同意,不得向第三方透露。
6. 协议期限:本定价协议书自____年____月____日起至____年____月____日止有效。
7. 违约责任:如一方违反本协议约定,应向守约方支付违约金,违约金的数额为违约方应支付或应收款项的____%。
8. 争议解决:双方因履行本协议所发生的任何争议,应首先通过友好协商解决;协商不成的,提交甲方所在地人民法院诉讼解决。
9. 其他约定:________________甲方代表(签字):_____________________乙方代表(签字):_____________________签订日期:____年____月____日签订地点:_______________________________(注:本协议书模板仅供参考,具体条款应根据实际情况由双方协商确定。
植物显微技术实验报告
实验一利用流动细胞仪测定植物DNA含量一、实验目的1、了解流动细胞仪的基本构造、原理与应用。
2、熟悉流动细胞仪的基本操作。
3、学会流动细胞仪样品制备及结果处理。
二、实验原理单个细胞、细胞群或其他生物微粒经过特异的荧光染料染色(DAPI或PI或免疫荧光标记)之后,在气体压力下,通过样品管引入到喷嘴内形成样品流,样品流经过激光束(488、405等)照射,样品流中的细胞吸收光能后发射出荧光,然后经相应的检测器检测,检测结果以直方图、二维散点图或三维立体图的形式显示出来。
根据荧光强度与胞内生物大分子含量的比例关系,对细胞进行定量分析。
三、实验步骤1、从野外取新鲜幼嫩的叶片(或竹笋)。
2、将新鲜的叶片(或竹笋)切取1平方厘米大小,放进干净玻璃培养皿中。
3、加入500μL PARTEC公司流式细胞仪自带的cystain UV precise P Nuclei Extraction Buffer 滴于样品上。
4、用双面刀片将样品剁碎,核提取2-3分钟。
5、然后再加入2mL 仪器自带的cystain UV precise P stain Buffer进行细胞核染色4分钟。
6、利用移液枪吸取染色后的样品,经公司自带的滤膜过滤到5mL的测量管中,进行测量。
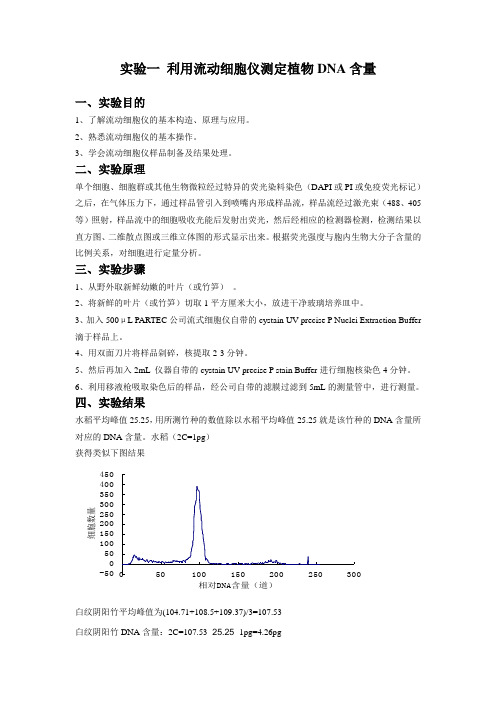
四、实验结果水稻平均峰值25.25,用所测竹种的数值除以水稻平均峰值25.25就是该竹种的DNA含量所对应的DNA含量。
水稻(2C=1pg)获得类似下图结果白纹阴阳竹平均峰值为(104.71+108.5+109.37)/3=107.53白纹阴阳竹DNA含量:2C=107.53÷25.25×1pg=4.26pg实验二石蜡切片技术一、实验目的在有关植物胚胎发育和组织器官的形态建成研究的过程中,都需要应用到石蜡切片技术。
在植物杂交育种、作物病虫害防治、药用植物的培育和鉴别,以及林木材性鉴别等方面的研究和教学工作中,由于各作物器官的性质差异以及研究目的的不同,就需要用不同的制片方法。
原位杂交实验

荧光原位杂交(FISH)的实验步骤FISH(Fluorescence In-Situ Hybridization)技术问世于20世纪70年代后期,是在原来的同位素原位杂交技术基础上发展起来的。
其基本原理是,按照两个核酸的碱基序列互补原则,用特殊修饰的核苷酸分子标记DNA探针,然后将标记的探针直接原位杂交到染色体或DNA 纤维切片上,再与荧光素分子偶联的单克隆抗体和探针分子特异性结合,经荧光检测系统和图形分析技术对染色体或DNA纤维上的DNA序列定位、定性和相对定量。
试验方法如下:1)玻片处理(a)玻片清洗:热肥皂水刷洗,1%盐酸浸泡24h,再在0.1%焦炭酸二乙酯(DEPC)中浸泡24h。
(b)硅化处理:玻片和盖玻片1%(质量分数)盐酸煮沸10min,烘干,锡纸包好4℃保存备用。
(c)明胶涂片制备:将烘干的玻片放入明胶中10min,然后60℃烘干过夜备用。
(d)试剂瓶、塑料器皿及组织匀浆器的处理试剂瓶、组织匀浆器先清洗干净,用1 mL/LDEPC (Diethyl Pyrocarbonate)水溶液浸泡处理(37℃、2h,室温过夜),高压消毒去除DEPC,然后250℃烘干4h以上或200℃过夜。
称量试剂勺也要干烤。
塑料器皿最好用灭菌的一次性塑料用品,使用前进行高压消毒,为保证质量,凡使用的枪头、试管等均经0. 5mL/L DEPC水溶液处理3h以上,然后再高压灭菌,烘干。
若为进口已处理的无RNase和DNase的枪头、试管可不必处理直接使用。
(e)各种溶液的配制:凡是水溶性液体均用1mL/L DEPC水配制。
2)样品制备及其所涉及的试剂包括:(a)缓冲溶液1×PBS缓冲溶液:NaCl 8g,Na2HPO4 2.9g,KCl 0.2g,KH2PO4 0.2g,溶入1000mL超纯水;3×PBS缓冲溶液:NaCl 24g,Na2HPO4 8.7g,KCl 0.6g,KH2PO4 0.6g,溶入1000mL超纯水;通常配制成10×PBS的储备液,3×PBS和1×PBS可用DEPC水稀释获得。
荧光原位杂交技术检测BCR-ABL融合基因阳性的病例分析

荧光原位杂交技术检测BCR-ABL融合基因阳性的病例分析荧光原位杂交技术(FISH)是一种能够检测基因染色体异常的分子遗传学技术,广泛应用于血液学、肿瘤学等多个领域中。
本文以一名患有慢性髓细胞白血病(CML)的患者为例,阐述荧光原位杂交技术检测BCR-ABL融合基因阳性的过程及结果。
患者,男性,65岁。
因口渴、口干、腰疼等症状就诊于本院。
经常规检查发现白细胞计数为40×10^9/L,骨髓形态学示慢性期CML。
接下来,为了确定患者CML的分子遗传学变异情况,选择了荧光原位杂交技术检测BCR-ABL融合基因。
实验流程如下:首先,从患者血样中提取细胞,并通过离心等处理步骤,制备出细胞悬液。
接着,使用一系列合成的荧光探针,与细胞DNA序列发生特异性结合。
該荧光探针包含Fusion Green(FG)和Fusion Orange(FO)荧光染料,分别用于标记BCR基因和ABL基因。
如果细胞存在BCR-ABL融合基因,那么BCR基因和ABL基因就能形成连接,使荧光探针结合并显示出光信号。
如果细胞没有BCR-ABL融合基因,则FO和FG的信号不会同时出现。
实验结果显示,患者细胞核内同时能够检测到FO和FG信号,且两种信号位置重合,说明患者BCR基因和ABL基因融合。
进一步分析结果,患者的融合基因区域是t(9;22)(q34;q11.2),合成了BCR-ABL融合基因。
依据患者荧光原位杂交技术检测结果,制定了治疗方案,包括干细胞移植和靶向治疗等。
通过定期监测患者血象和病理学表现等指标,发现患者的CML得到了有效控制。
总之,荧光原位杂交技术可以高度特异地检测基因染色体异常,是CML等恶性肿瘤分子遗传学诊断和疗效监测的重要技术手段。
在临床检查中,可以辅助医生诊断和制定个性化的治疗方案,从而提高患者的生存质量和治疗效果。
ISHprotocol荧光原位杂交技术实验方案

地高辛标记寡核苷酸,荧光标记二抗,ISH,冰冻切片操作过程:1、多甲固定:应尽量在半个小时内完成。
(固定时间以24-36小时为宜,避免RNA降解或固定过度。
)2、切片:为获得高杂交信号,冰冻切片应切成10um-20um。
(选用16um)(切好的片子可以保存在-70度中)但是要注意,保存在-70度中的切片,拿出来以后,立即在4%的多甲中重新固定,避免在重新固定前切片恢复室温。
(重新固定10-15min)3、用0.1MPB洗切片3*5min4、切片放入100%乙醇5min,空气中干燥。
杂交液:(20ml)藏于-20度20*SSC 4ml硫酸葡聚糖 4g去离子甲酰胺 10ml将他们溶解后,加入以下物质:Poly A(10mg/ml) 0.5 mlSsDNA(10mg/ml) 0.5 mltRNA (10mg/ml) 0.5 mlDTT (1M) 2ml50*Denhardts 0.2ml上述溶液可以配置后长期贮藏与-20度中,用前预热到37度。
杂交溶液:将地高辛加入杂交液中,探针的浓度需要摸索(一般是100ng-1000ng/ml,一般是以200ng/ml为起点来摸索条件),所加的杂交液的体积看切片的大小来决定,对于2cm*2cm的组织,一般是加50ul,但是对于嗅球,可能30-40ul足够。
加好杂交液以后,用盖玻片盖上切片(注意中间不要留有任何的气泡),为防止杂交液从盖玻片中流走,注意使切片保持水平,并且注意切片不能干燥,(干燥的话杂交会有一个很高的背景)在湿盒中37度杂交18小时,这个杂交时间可以延长到40小时来提高杂交的信号,但是前提是不能让切片干燥。
杂交后处理;制备0.5*SSC和1*SSC(从20*来稀释)并且保证这两种SSC在使用的时候的温度是55度。
注意配置0.5*SSC和1*SSC中含有10mM的DTT(将1.2g的DTT加入到800ml的SSC中)杂交后,用小镊子将盖玻片轻轻移走,然后倒掉杂交液,将切片放入洗液中,在振摇水浴中按照下面的要求来洗片:快洗: 1*SSC(10mMDTT)室温2*15min:1*SSC(10mMDTT)55度2*15min 0.5*SSC(10mMDTT) 55度1*10min 0.5*SSC(10mMDTT)室温将切片一直放在最后一步的溶液中一直到下一步操作。
荧光原位杂交检测报告

荧光原位杂交检测报告
一、检测目的
本次检测旨在探究目标基因在细胞核内的位置以及其存在的数量,以确保基因研究可靠性及准确性。
二、检测方法
采用荧光原位杂交技术(FISH)进行检测。
首先,获取样本组织切片并制备。
然后,利用荧光信号染色体常规核型分析技术,将采集的细胞进行体外细胞培养,用血白进行标本制备,完成荧光原位杂交,最后在荧光显微镜下观察目标基因信号。
三、检测结果
本次检测结果显示:目标基因存在于细胞核的特定区域且数量适当,未出现缺失或多余现象。
具体细节如下:
1. 细胞核内目标基因存在的数量为正常情况下的1个;
2. 目标基因位于常染色体的20号染色体的长臂上;
3. 目标基因信号强度适中,无杂乱信号干扰;
4. 目标基因存在于所有观察到的核中,未出现缺失现象。
四、检测结论
本次荧光原位杂交检测结果显示目标基因存在于样本组织细胞核内且数量适当,位置确定,验证了该基因在实验研究中的可靠性和准确性。
鉴于本次检测结果,应确保实验人员、化学品、仪器设备、试卡等相关实验材料的检测标准及操作规范,提高实验质量及结果准确率。
五、附注
1. 此次检测的基因为【填写基因名称】;
2. 本次检测结果仅供参考,如需获取更多相关信息或进一步检测,请再次联系本实验室。
揭秘基因密码——荧光原位杂交分子病理报告解读

视界照耀科技| 11MEDICAL HEALTH医学健康生命是一部由基因编写的复杂交响曲,而荧光原位杂交技术(fluorescence in situ hybridization ,FISH )是揭示这部交响曲内在奥秘的重要工具之一。
FISH 是一种生物分子分析技术,用于研究细胞和组织中的染色体结构、基因定位和基因表达。
该技术通过使用荧光标记的DNA 或RNA 探针与目标DNA 或RNA 序列杂交,然后通过荧光显微镜观察杂交信号的位置和数量。
FISH 技术让人们能够在细胞和组织层面上观察基因、染色体的情况,了解患者病变部位的分子生物学特征,从而为个体化医疗提供支持。
但对于许多患者而言,他们并不了解FISH ,甚至对为何进行FISH 检测存在疑惑。
本文将从科普角度解读FISH 分子病理报告,以及FISH 走入临床工作的意义。
1 FISH 的前世今生FISH 从实验室走进临床工作,已经历了50余年的历史。
1969年,科研工作者利用放射性标记DNA 或28S RNA 发明了FISH 。
尽管当时原位杂交技术已经具有较高的特异性和灵敏度,但鉴于放射性同位素自身特性的局限,如安全性、空间分辨率低、不稳定性等问题,这项技术仅限于实验室研究方面的应用。
1986年,有科研工作者开始利用异硫氰酸盐荧光素来标记探针,并在荧光显微镜下进行观察分析,建立了荧光原位杂交技术。
1989年,Delong 首次使用荧光标记寡核苷酸探针检测单个微生物细胞。
20世纪90年代,FISH 技术已具有敏感度高、信号强、背景低、快速等优点,这使得FISH 技术逐渐商业化,并出现了各种商业化的荧光标记探针和相关试剂。
同时,自动化的FISH 系统也开始出现,使得该技术更加高效和可靠。
随着技术的发展,研究人员实现了多色FISH ,允许在同一样本中同时检测多个目标。
这作者简介:陈烨,博士,研究实习员,主要研究方向为分子病理研究。
通信作者:陈光勇,博士,主任医师,主要研究方向为消化系统疾病病理诊断。
荧光原位杂交(FISH)检测

目
CONTENCT
录
• 荧光原位杂交(fish)检测概述 • FISH检测的基本原理与技术流程 • FISH检测在临床诊断中的应用 • FISH检测的优势与局限性 • FISH检测的实际案例分析
01
荧光原位杂交(fish)检测概述
定义与特点
定义
荧光原位杂交(FISH)是一种基于荧光标记的DNA探针与目标DNA 结合,通过荧光显微镜观察并检测细胞内特定基因或染色体异常的 技术。
FISH技术可以应用于各种样本类型,如细胞、 组织切片、石蜡包埋组织等。
直接观察
FISH技术可以直接在细胞或组织的显微镜下观 察杂交信号,无需进行额外的染色或标记。
灵敏度高
FISH技术能够检测单个基因拷贝数的变化,灵 敏度较高。
局限性
成本高
FISH技术需要使用特殊的探针和 荧光染料,因此成本较高。
80%
基因突变
FISH技术可以检测基因突变,如 抑癌基因突变、致癌基因突变等 。
基因表达分析
基因表达水平
FISH技术可以检测基因表达水 平,了解基因在细胞中的表达 情况。
基因定位
FISH技术可以确定基因在染色 体上的位置,了解基因的染色 体定位。
基因互作
FISH技术可以检测基因间的相 互作用,了解基因间的关系。
细胞或组织的通透性处理
使用适当的试剂使细胞或组织的膜通透性增加,以便探针能 够进入。
杂交反应
探针与靶DNA的杂交
将制备好的探针与固定在样本上的靶 DNA进行杂交,形成探针-靶DNA复 合物。
去除未结合的探针
通过洗涤去除未结合的游离探针,提 高杂交信号的特异性。
信号检测与图像分析
荧光原位杂交实验

实验四荧光原位杂交实验一、实验目的1.掌握核酸杂交的基本原理、过程和操作;2.熟练掌握荧光显微镜的使用方法;3.掌握Image J软件进行图像融合的方法;4.理解荧光原位杂交技术的应用。
二、实验原理核酸杂交是以碱基互补为基础、以双链核酸分子在特定条件下的变性和复性为手段,对核酸分子进行定性和定量检测。
两条互补的核苷酸单链在特定条件下退火形成异质双链;应用荧光标记的探针与待检测材料中的单链核酸进行特异性结合,形成可悲检测的杂交双链核酸。
在显微镜下观察并记录结果。
本实验所用探针是位点特异性标记探针GSP myc,是由SpectrumOrange (552/576)直接标记的荧光DNA探针,长度为200bp,能识别8号染色体的着丝粒部位的α卫星序列。
三、实验器材和试剂防脱载玻片(premiere公司),医用砂轮,20×20mm盖玻片,橡皮胶,平板加热器,杂交盒,恒温水浴锅,玻璃染色缸,香柏油,荧光显微镜拍照系统,MYC基因扩增检测试剂盒。
四、实验步骤1.样品处理1)取细胞培养悬液5ml(107 cell),2000rpm离心5min,去上清;2)加入10ml的0.075M KCl,吹打混匀,静置3min;3)37℃水浴箱低渗30min;4)加固定液2ml,吹打混匀,室温预固定10min;5)2000rpm离心5min,去上清;6)沉淀加固定液5~10ml,吹打混匀,-20℃冰箱静置30min;7)2000rpm离心5min,去上清。
2.制片1)取一张干净的载玻片,用砂轮在背面划“一”标记,尽量在中间或靠下端标记;2)加50ul固定液重悬细胞,取4ul悬液滴加到载玻片上的标记位置,室温晾干;3)平板加热器上烤片,60℃30min,显微镜下观察细胞密度;4)PBS洗涤3min;5)1%多聚甲醛室温固定10min;6)PBS洗涤3min;7)70%、90%、100%梯度乙醇脱水2min;8)取出玻片,室温晾干。
荧光原位杂交(FISH)前处理实验步骤详解及案例分析

荧光原位杂交(FISH)前处理实验步骤详解及案例分析FISH样本前处理真的头疼样本本身的差异,实验多因素的影响都可能会影响杂交效率导致探针信号不佳别着急今天小编以乳腺癌FFPE样本为例从实验步骤的原理入手为你梳理FISH实验前处理实验步骤标本要求1. 标本的类型(1)手术切除标本;(2)粗针穿刺活检标本;(3)麦默通活检标本;(4)大于100个癌细胞的细胞学标本。
2. 标本的固定所有乳腺癌标本离体后都应尽快固定(1h内)。
固定时应将标本每隔5~10mm切开,并可在组织间嵌入纱布或滤纸等物。
固定液量与所浸泡组织的比例应足够。
固定时间以6~72h为宜。
3. 固定液类型3.7%中性(磷酸缓冲)甲醛固定液。
4. 切片厚度以4~5μm为宜。
——对标本的要求来源于《乳腺癌HER2检测指南(2019版)》。
需要注意:1.标本固定的两个时间点很关键。
一要及时固定(1h内)。
固定不及时,细胞发生自溶,DNA降解,DAPI下观察,标本呈现核很浅,甚至有糜烂现象,信号无或缺失严重。
二要注意固定时间以6~72h为宜。
对于小的穿刺标本,建议固定6-24小时,而手术切除的大标本以24小时以上为佳。
2.切片厚度影响。
切片太薄(实际厚度<3um),容易消化过,且信号出现很大比例的丢失,影响结果判读(图1);切片太厚(实际厚度>5um),难于消化,容易出现高背景,信号层面增多影响观察判读(图2)。
图1 切片太薄FFPE样本杂交图(HER2探针,X1000倍)图2 切片太厚FFPE样本杂交图(HER2探针,X1000倍)实验步骤分解1. 玻片预处理1.1 玻片放入65±5℃恒温箱中烤片过夜;【使组织细胞紧紧粘附,后续洗涤等处理时不至于脱落;烤片后立即脱蜡,可减短脱蜡时间、增强脱蜡效果,烤片不短于两小时。
】1.2 取出玻片,将其放入二甲苯中室温脱蜡30分钟;【相似相溶原理,可用环保试剂代替二甲苯。
】1.3 取出玻片,再将其放入另一缸二甲苯室温继续脱蜡10分钟;1.4 取出玻片,再将其放入无水乙醇中室温10分钟;【去除残留二甲苯。
荧光原位杂交实验方法及步骤

荧光原位杂交实验⽅法及步骤2.38.1 实验⽅法及步骤(1) 探针变性将探针在75℃恒温⽔浴中温育5min,⽴即置0℃,5~10min,使双链DNA探针变性。
(2) 标本变性a.将制备好的染⾊体玻⽚标本于50℃培养箱中烤⽚2~3h。
(经Giemsa染⾊的标本需预先在固定液中退⾊后再烤⽚)。
b.取出玻⽚标本,将其浸在70~75℃的体积分数70%甲酰胺/2×SSC的变性液中变性2~3min。
c.⽴即按顺序将标本经体积分数70%、体积分数90%和体积分数100%冰⼄醇系列脱⽔,每次5min,然后空⽓⼲燥。
(3) 杂交将已变性或预退⽕的DNA探针10µL 滴于已变性并脱⽔的玻⽚标本上,盖上18×18盖玻⽚,⽤Parafilm封⽚,置于潮湿暗盒中37℃杂交过夜(约15~17h)。
由于杂交液较少,⽽且杂交温度较⾼,持续时间⼜长,因此为了保持标本的湿润状态,此过程在湿盒中进⾏。
(4) 洗脱此步骤有助于除去⾮特异性结合的探针,从⽽降低本底。
a.杂交次⽇,将标本从37℃温箱中取出,⽤⼑⽚轻轻将盖玻⽚揭掉。
b.将已杂交的玻⽚标本放置于已预热42~50℃的体积分数50%甲酰胺/2×SSC中洗涤3次,每次5min。
c.在已预热42~50℃的1×SSC中洗涤3次,每次5min。
d.在室温下,将玻⽚标本于2×SSC中轻洗⼀下。
e.取出玻⽚,⾃然⼲燥。
f.取200µL复染溶液(PI/antifade或DAPI/antifade染液)滴加在玻⽚标本上,盖上盖玻⽚。
(5) 杂交信号的放⼤(适⽤于使⽤⽣物素标记的探针)a.在玻⽚的杂交部位加150µL封闭液I,⽤保鲜膜覆盖,37℃温育20min。
b.去掉保鲜膜,再加150µL avidin-FITC于标本上,⽤保鲜膜覆盖,37℃继续温育40min。
c.取出标本,将其放⼊已预热42~50℃的洗脱液中洗涤3次,每次5min。
FISH-荧光原位杂交实验原位杂交 实验报告

FISH-荧光原位杂交实验原位杂交实验目的通过实验了解荧光原位杂交技术的基本原理和在生物学、医学领域的应用..掌握原位杂交技术的操作方法;熟练掌握荧光显微镜的使用方法..2. 实验原理荧光原位杂交Fluorescence in situ hybridization FISH是一门新兴的分子细胞遗传学技术;是20世纪80年代末期在原有放射性原位杂交技术的基础上发展起来的一种非放射性原位杂交技术..目前这项技术已经广泛应用于动植物基因组结构研究、染色体精细结构变异分析、病毒感染分析、人类产前诊断、肿瘤遗传学和基因组进化研究等许多领域..FISH的基本原理是用已知的标记单链核酸为探针;按照碱基互补的原则;与待检材料中未知的单链核酸进行特异性结合;形成可被检测的杂交双链核酸..由于DNA分子在染色体上是沿着染色体纵轴呈线性排列;因而可以将探针直接与染色体进行杂交从而将特定的基因在染色体上定位..与传统的放射性标记原位杂交相比;荧光原位杂交具有快速、检测信号强、杂交特性高和可以多重染色等特点;因此在分子细胞遗传学领域受到普遍关注..杂交所用的探针大致可以分为三类:1染色体特异重复序列探针;例如a卫星、卫星III 类的探针;其杂交靶位常大于1Mb;不含散在重复序列;与靶位结合紧密;杂交信号强;易于检测;2全染色体或染色体区域特异性探针;其由一条染色体或染色体上某一区段上极端不同的核苷酸片段所组成;可由克隆到噬菌体和质粒中的染色体特异大片段获得;3特异性位置探针;由一个或几个克隆序列组成..探针的荧光素标记可以采用直接和间接标记的方法..间接标记是采用生物系标记的dUTPbiotin-dUTP经过缺口平移法进行标记;杂交之后用藕联的荧光素的抗生物系的抗体进行检测;同时还可以利用几轮抗生物素蛋白—荧光素、生物素化的抗—抗生物素蛋白、抗生物素蛋白—荧光素的处理;将荧光信号进行放大;从而可以检测500bp的片段..而直接标记法是将荧光素直接与探针核苷酸蔌磷酸戊糖骨架共价结合;或在缺口平移法标记探针时将荧光素核苷三磷酸掺入..直接标记法在检测时步骤简单;但由于不能进行信号放大;因此灵敏度不如间接标记的方法..3. 实验用具及材料Y染色体探针、人外周血中期染色体细胞标本、恒温水浴锅、培养箱、染色缸、载玻片、Nikon E-400、荧光显微镜、盖玻片、封口膜、200mL移液器、20mL移液器、暗盒、指甲油、甲酰胺、氯化钠、柠檬酸钠、氢氧化钠、吐温20..4. 实验方法及步骤1探针及标本的变性1探针变性将探针在75℃怛温水浴中温育5min;立即置0℃;5~10min;使双链DNA探针变性..2标本变性①将制备好的染色体玻片标本于50℃培养箱中烤片2~3h..经Giemsa染色的标本需预先在固定液中退色后再烤片..②取出玻片标本;将其浸在70~75℃的体积分数70%甲酰胺/2×SSC的变性液中变性2~3min..③立即按顺序将标本经体积分数70%、体积分数90%和体积分数100%冰乙醇系列脱水;每次5min;然后空气干燥..2杂交将已变性或预退火的DNA探针10mL滴于已变性并脱水的玻片标本上;盖上18×18盖玻片;用Parafilm封片;置于源潮湿暗盒中37℃要交过夜约15~17h..由于杂交液较少;而且杂交温度较高;持续时间又长;因此为了保持标本的湿润状态;此过程在湿盒中进行..3洗脱此步骤有助于除去非特异性结合的探针;从而降低本底..1杂交次日;将标本从37℃温箱中取出;用刀片轻轻将盖玻片揭掉..2将已杂交的玻片标本放置于已预热42~50℃的体积分数50%甲酰胺/2×SSC中洗涤3次;每次5min..3在已预热42~50℃的1×SSC中洗涤3次;每次5min..4在室温下;将玻片标本2×SSC中轻洗一下..4杂交信号的放大1在玻片的杂交部位加150mL封闭液I;用保鲜膜覆盖;37℃温育20min..2去掉保鲜膜;再加150mL avidin-FITC于标本上;用保鲜膜覆盖;37℃继续温育40min..3取出标本;将其放入已预热42~50℃的洗脱液中洗涤3次;每次5min..4在玻片标本的杂交部位加150mL封闭液II;覆盖保鲜膜;37℃温育20min..5去掉保鲜膜;加150mL antiavidin于标本上;覆盖新的保鲜膜;37℃温育40min..6取出标本;将其放入已预热42~50℃的新洗脱液中;洗涤3次;每次5min..7重复步骤1、2、3;再于2×SSC中室温清洗一下..8取出玻片;自然干燥..9取200mL PI/antifade染液滴加在玻片标本上;盖上盖玻片..5封片可采用不同类型的封片液..如果封片中不含有Mowiol可使封片液产生自封闭作用;为防止盖片与载片之间的溶液挥发;可使用指甲油将盖片周围封闭..封好的玻片标本可以在-20~-70℃的冰箱中的暗盒中保持数月之久..6荧光显微镜观察FISH结果先在可见光源下找到具有细胞分裂相的视野;然后打开荧光激发光源;FITC的激发波长为490nm..细胞被PI染成红色;而经FITC标记的探针的探针所在位置发出绿色荧光..由于本实验使用的是Y染色体上的特异序列;因此在男性外周血染色体标本的杂交中呈阳性;即使在末分裂的细胞中;也可以观察到明显的杂交信号..照相记录实验结果图16-1..附录I FISH相关溶液的配制120×SSC:175.3g NaCl; 882.g柠檬酸钠;加水至1000mL用10mol/L NaOH调pH至7.0..2去离子甲酰胺DF:将10g混合床离子交换树脂加入100mL甲酰胺中..电磁搅拌30min;用Whatmanl号滤纸过滤..3体积分数70%甲酰胺/2×SSC:35mL甲酰胺;5mL 20×SSC;10mL水..4体积分数50%甲酰胺/2×SSC:100mL甲酰胺;20mL 20×SSC;80mL水..5体积分数50%硫酸葡聚糖DS:65℃水浴中融化;4℃或-20℃保存..6杂交液:8mL体积分数25%DS; 20mL 20×SSC混合..或40mL体积分数50%DS;20mL20×SSC;40mL ddH2O混合取上述混合液50mL;与5mL DF混合即成..其终浓度为体积分数10% DS 2×SSC;体积分数50% DF..7 PI/antifade溶液PI原液:先以双蒸水配置溶液;浓度为100mg/mL;取出1mL;加39mL双蒸水;使终浓度为2.5mg /mL..Antifade原液:以PBS缓冲液配制该溶液;使其浓度为10mg/mL;用0.5mmol/L的NaHCO3调pH值为8.0..取上述溶液1mL;加9mL甘油;混匀..PI/antifade溶液:PI与antifade原液按体积比1:9比例充分混匀;-20℃保存备用..8DAPI/antifade溶液:用去离子水配制1mL/mg DAPI储存液;按体积比1:300;以antifade溶液稀释成工作液..9封闭液I:体积分数5% BSA 3mL;20×SSC 1mL;dd H2O 1mL; Tween 20 5mL混合..10封闭液II:体积分数5% BSA 3mL;20×SSC 1mL;goat serum 250mL; dd H2O 750mL; Tween 20 5mL混合..11荧光检测试剂稀释液:体积分数5% BSA 1mL;20×SSC 1mL;dd H2O 3mL; Tween 20 5mL 混合..12洗脱液:100mL 20×SSC;加水于500mL;加Tween20 500 mL..13TE缓冲液:pH8.0: 10mmol/L Tris; HCl; 1mmol/L EDTA;pH7.6: 10mmol/L Tris; HCl; 1mmol/L EDTA;pH7.4: 10mmol/L Tris; HCl; 1mmol/L EDTA..14溶液I:25mmol/L Tris HClpH 7.4; 10mmol/L EDTA..15溶液II:10% SDS;0.2M NaOH..16溶液III:Kac 14.7g; HAc 5.8mL; 加水至50mL..17LB培养基:胰化蛋白胨10g;酵母提取物5g; NaCl 10g; 加水至1000mL;用5mmol/L NaOH 调pH值至7.0..附录II DNA探针的制备质粒DNA克隆的提取、纯化和鉴定..1用接种环挑取一小块-70℃冻存的转化菌;接种于5mL LB培养基中;37℃剧烈震荡过夜..2将收集到的菌液3000r/min离心10min;弃掉上清液..3向菌体沉淀中加入溶液I300mL; 溶液II 350mL;混匀后将其置于冰浴中片刻;再加溶液III 350mL混匀;加酚和氯仿混合液体积比为1:1500mL 后充分混匀..412000r/min离心10min..5取上清液;向其加入600mL异丙醇;充分混匀后以12000r/min离心15~30min;弃掉上清液..6用1500mL体积分数70%乙醇洗涤沉淀2~3次;晾干..7用TE缓冲液溶解DNA沉淀..8加水至200mL;以Rnase A终浓度200mg /mL在50℃水浴中消化30min..9加入酚、氯仿和异丙醇三者体积比25:24:1溶液200mL混匀;12000r/min离心2min..10取上清液;再加入氯仿和异戊醇溶液体积比为24:1200mL混匀;12000r/min离心2min..11取上清液;以20mL 3M NaAc及500mL体积分数100%乙醇沉淀DNA..12可将上述溶液在-70℃放置30min至1h以充分沉淀DNA;然后用12000r/min离心15min..13将沉淀用1.5mL体积分数70%乙醇轻洗;自然晾干..14用TE缓冲液溶解DNA..15取1~2mL上述纯化的DNA溶液;于8.0g/L琼脂糖/TBE缓冲液凝胶电泳鉴定DNA并检测浓度..16取1mg DNA;用相应限制性内切酶4~5单位;BSA100~200mg /mL;于37℃水浴中酶解2~4h..17电泳观察;根据酶切片段数量及大小;估计DNA克隆插入片段大小..附录III 探针的生物素标记探针的标记可采用PCR或缺口平移法来制备;但多数情况下采用缺口平移法来制备..该过程包括以DNase I在DNA双链上作用产生缺口并以此作为第二反应步骤的作用赳噗;即大肠杆菌聚合酶I自缺口处进行修补合成..在修补合成互补链时将生物素标记的d-NTP掺入;从而复制出带有生物素标记的探针..本实验采用缺口平移法;按GIBCO公司提供的方法以biotin-14-dATP标记探针..标记好的探针可以在-20℃下长期保存..总反映体积50mL; DNA 1mg;10×dNTP 5mL; 10×Enzyme Mix 5mL..其中10×dNTP为:500mmol/L Tris·HClpH 7.850mmol/L MgCl2100mmol/Lβ-硫基乙醇100mg /ml去除核酸酶的牛血清白蛋白0.2mmol/L dCTP; 0.2mmol/L dGTP; 0.2mmol/L dTTP0.1mmol/L dATP; 0.1mmol/L biotin-14-dATP10×酶混合为:0.5units/mL DNA聚合酶I0.075untis/mL Dnase I50mmol/L Tris·HClpH 7.55mmol/L醋酸镁1mmol/L β-硫基乙醇0.1mmol/L苯甲基磺酰氟体积分数50%甘油100mg /mL牛血清白蛋白将上述混合液于16℃作用1h..用8.0g/L琼脂糖/TBE缓冲液凝胶电检测标记产物..以DNA片段长约300~500bp为宜..如片段较大;则应加适量Dnase I继续酶切;直至DNA片段长度适中后;加5mL终止缓冲液300mmol/L EDTA终止反应..用乙醇沉淀的方法将探针与非掺入的核苷酸分开..一、荧光原位杂交FISH是一种简单、敏感、而容易操作的方法;结果迅速;并能在同一标本上检测多个不同的基因;可应用于细胞培养、染色体分裂像、冰冻切片和石蜡切片..FISH技术是利用特异的DNA探针;标记了生物素;地高辛、或荧光素;对检测细胞进行DNA-DNA原位杂交;并用荧光法显示..FISH实验步骤试剂配制:1变性液70%甲酰胺+ 2×SSC;pH7.0:4 ml 20×SSC;8 ml 蒸馏水;28 ml 甲酰胺..每次新鲜配制..2杂交后洗涤液:20×SSC 4 ml;蒸馏水16 ml;甲酰胺20 ml..每次新鲜配制..调节pH前升至室温..1. 用硅化玻片;石蜡切片;60℃烤片过夜..二甲苯脱蜡至酒精;斜置切片;空气中干燥..2. 蛋白酶处理:1每个染色缸40 ml 蛋白酶K消化溶液;配制方法如下:2×SSC 40 ml 倒入Facal管;在水浴槽中预热..将消化酶液加入管内;摇动直到酶溶解..2 37℃水浴槽中预热染色缸和蛋白酶K溶液..37℃孵育20 min..3 2×SSC在室温下漂洗切片3次;每次1 min..4梯度酒精脱水-20℃预冷;空气中干燥..3. 变性:1每一个立式染色缸配制40 ml 变性溶液;278℃水浴槽中平衡预热混合液染色缸;378℃孵育8 min;4 即移入-20℃预冷70%酒精的染色缸内2 min;再依次移入80%、90%和100%的-20℃预冷酒精内;每缸2 min;5空气干燥..4. 杂交:1准备探针;2取一个较大的湿盒;交叉放置切片;3滴10 μl 探针在切片的组织上;加盖玻片;4盖上湿盒盖;37℃孵育12~16 h..杂交后水洗:5镊子小心去除盖玻片;643℃预热杂交后水洗溶液40 ml 水洗切片15 min;72×SSC37℃洗两次;每次10 min;8切片放人染色缸的1×PBS内待检测;勿使切片干燥..检测:9从1×PBS中取出切片;除去过多的水分;避免标本干燥..把切片放入湿盒内;同时处理4张切片..10每张切片使用30~60 μl 罗丹明抗-地高辛抗体或FITC卵白素;室温下孵育20 min;11去掉塑料盖膜;把切片放入含1×PBS的染色缸..1×PBS室温下洗3次;每次2 min..扩增:12从1×PBS中取出切片;斜置切片使液体排出;13每张切片滴30~60 μl 抗-卵白素抗体;加塑料盖膜;室温孵育20 min;14去掉塑料盖膜;把切片放入含1×PBS的染色缸..1×PBS室温下洗3次;每次2 min;15从1×PBS中取出切片;斜置切片使液体排出;16每张切片滴30~60 μl 抗-卵白素抗体;加塑料盖膜;室温孵育20 min;171×PBS室温下洗3次;每次2 min..5. 细胞核染色:1张切片加10~20 μl DAPI;覆盖盖玻片并在室温下孵育2~5 ml;2尽可能快的在荧光显微镜下观察或封闭盒内保存在-20℃冰箱..切片在染色之后1h内可以在显微镜下观察..二、用引物介导的原位标记PRINS是PCR和荧光原位杂交FISH的结合; PRINS是由未标记的序列特异性寡核苷酸探针与固定在细胞内的靶DNA互补序列;在聚合酶的驱动下;带有标记的脱氧核苷酸FITC-dUTP或半抗原-dUTP和dATP、dCTP、dGTP的延伸;依赖标记;新合成的DNA就能直接的或间接的带有FITC;用荧光显微镜观察..PRINS实验步骤1. 常规脱蜡浸入0.01 mol/L PBS;2. 用0.2 mol/L 盐酸处理5min;3. 蛋白酶K25 μg/ml消化37℃15 min;4. 分别用80%;95%和100%酒精脱水;室温干片;5. 加PCR混合液25 μL10 mmol/L Tris-HCl;50 mmol/L KCl;1.5 mmol/L MgCl2;各加200 μmol/L dATP;dCTP;dGTP;1.5 mmol/L dig-11-dUTP 1.5 μl;引物250 ng;Taq DNA 聚合酶2 U;加盖片;6. 94℃变性5 min后置入65℃湿盒中5 min;7. 用0.1×SSC液;65℃洗5 min;8. 片于65℃10~20 s;用4×SSC-0.1%吐温20液42℃洗5 min;2次;9. 经Buffer 1液洗后滴加20%羊血清封闭30 min;10. 加地高辛抗体复合物1:500室温下2 h;11. BufferⅢ液洗5 min;12. 用BCIP-NBT显色1~2 h;在镜下控制;终止显色;13. 用中性红或核固红衬染;酒精脱水;二甲苯透明;树脂封片..。
fish报告解读

FISH报告,全称荧光原位杂交(Fluorescence in situ Hybridization)报告,是一种用于检测染色体异常的实验室检测方法。
FISH技术可以用于诊断染色体数目异常、结构异常和基因重排等问题。
在解读FISH报告时,需要关注以下几个方面:
1. 样本来源:了解样本的来源,如血液、组织或细胞等,以及采集方法。
2. 检测目的:明确本次FISH检测的目的,如诊断某种疾病、评估预后或监测治疗效果等。
3. 探针信息:报告中会列出使用的探针名称、编号和荧光素颜色等信息。
这些探针通常针对特定的染色体或基因区域,用于检测目标区域的异常情况。
4. 检测结果:报告中会详细描述每个探针的杂交信号分布情况。
正常的染色体或基因区域应该呈现出均匀的杂交信号,而异常区域则可能出现缺失、重复或易位等现象。
此外,报告中还会给出异常区域的染色体位置、大小和比例等信息。
5. 结论:根据检测结果,报告会给出相应的结论,如正常、异常或待进一步分析等。
对于异常结果,报告还会给出可能的病因、临床意义和建议等。
6. 注意事项:报告中可能会提醒一些与检测结果相关的注意事项,如某些异常可能与遗传性疾病相关,或者需要结合其他检查结果进行综合分析等。
荧光原位杂交结果分析

荧光原位杂交结果分析
荧光原位杂交(FISH)是一种分子生物学技术,用于检测和定位特定的DNA序列,它可以用来确定基因的位置,检测基因的表达水平,以及检测基因的突变。
FISH技术的结果可以用来诊断和治疗疾病,如癌症、糖尿病和先天性疾病。
FISH技术的基本原理是,将一种特定的DNA序列(称为探针)与一种特定的荧光染料结合,然后将探针和染料混合在一起,并将其放置在细胞或组织样本上。
当探针与目标DNA序列结合时,染料就会发出荧光,从而可以检测到目标DNA序列的位置。
FISH技术的结果可以用来诊断和治疗疾病,如癌症、糖尿病和先天性疾病。
例如,FISH技术可以用来检测癌症细胞中的某些基因突变,从而帮助医生确定最佳的治疗方案。
此外,FISH技术还可以用来检测先天性疾病,如唐氏综合征,以及检测糖尿病患者的基因突变。
总之,荧光原位杂交技术是一种重要的分子生物学技术,可以用来检测和定位特定的DNA序列,并可以用来诊断和治疗疾病。
荧光原位杂交实验

一、实验目的
• 通过实验了解荧光原位杂交技术的基本 原理和在生物学、医学领域的应用。 • 掌握原位杂交技术的操作方法,熟练掌 握荧光显微镜的使用方法。
二、实验原理
• FISH的基本原理是用已知的标记单链核酸为探针,按 照碱基互补的原则,与待检材料中未知的单链核酸进 行特异性结合,形成可被检测的杂交双链核酸。由于 DNA分子在染色体上是沿着染色体纵轴呈线性排列, 因而可以将探针直接与染色体进行杂交从而将特定的 基因在染色体上定位。与传统的放射性标记原位杂交 相比,荧光原位杂交具有快速、检测信号强、杂交特 异性高和可以多重染色等特点,因此在分子细胞遗传 学领域受到普遍关注。目前这项技术已经广泛应用于 动植物基因组结构研究、染色体精细结构变异分析、 病毒感染分析、人类产前诊断、肿瘤遗传学和基因组 进化研究等许多领域。
观察结果
• (a)间期细 胞 • (b)中期细 胞,Y染色 体荧光标记 探针
五、作业及思考题
• 1.通过实验总结荧光原位杂交实验的技 术关键。 • 2.实验中会不会出现假阳性,为什么?
6.荧光显微镜观察FISH结果
• 先在可见光源下找到具有细胞分裂相的视野, 然后打开荧光激发光源,FITC的激发波长为 490nm。细胞被PI染成红色,而经FITC标记 的探针所在的位置发出绿色荧光。 • 本实验使用的是Y染色体上的特异序列,因 此在男性外周血染色体标本的杂交中呈阳性, 即使在未分裂的细胞中,也可以观察到明显 的杂交信号。照相记录实验结果。
三、实验用具及材料
• Y染色体探针、人外周血中期染色体细胞 标本、恒温水浴锅、培养箱、染色缸、 载玻片、Nikon E-400、荧光显微镜、盖 玻片、封口膜、200μL移液器、20μL移 液器、暗盒、指甲油、甲酰胺、氯化钠、 柠檬酸钠、氢氧化钠、吐温20。
荧光原位杂交实验 Fluorescence In Situ Hybridization精选版

Biotin(BIO)-11-dUTP Digoxygenin(DIG)-11dUTP Dinitrophenyl (DNP)11-dUTP
khk
9
染色体复染的物质: Propidium Iodide (PI)(红色) DAPI(兰色) quinacrine(绿色)
chromomycine A3(绿色)
khk
17
2)简单重复序列探针(simple repetitive probes) ——异染色质着丝粒探针(heterochromatic centromer probes)
其靶序列为α卫星DNA或卫星III DNA(alpha satellite/satellite III DNA)多位于染色体的着丝粒和异 染色质区域,重复数百次至数千次。 特点:信号强 应用:(a)标记染色体识别 (b)染色体数目异常检测 (c)间期细胞遗传学研究和临床诊断
khk
10
khk
11
染色体“原位抑制”杂交(chromosome in situ suppression, CISS) 克服散在的重复序列造成的杂交背景,提高信号的特异性,在探针 中加入过量的未标记的竞争性DNA(competitor DNA),如human Cot-1 DNA,进行杂交前的预复性。探针中的重复序列与加入的竞 争物中的大量重复序列优先复性,而特异性的单拷贝序列因竞争物 中同源序列拷贝数少,绝大部分仍保持单链状态。
**FISH技术的应用 1)基因(或DNA片段)的染色体定位; 2)染色体数目与结构异常的检测; 3)间期细胞遗传学(绒毛/羊水/精子/卵裂球/其它间期细胞研究与 诊断); 4)肿瘤遗传学研究
khk 12
**用于FISH的探针 1)单拷贝探针: (1)种类:YAC, BAC, Cosmid,Plasmid, cDNA片段
荧光原位杂交FISH实验步骤与方法(精选文档)

荧光原位杂交FISH实验步骤与方法(精选文档)(文档可以直接使用,也可根据实际需要修改使用,可编辑欢迎下载)FISH 实验步骤一、实验仪器:荧光显微镜:高速离心机:可达12000r/min高压灭菌锅:160C以上杀菌恒温箱:为杂交提供恒定温度恒温水浴锅照相机(与荧光显微镜配套):荧光捕捉图片二、试剂的配制:1 、0.2mol/ L (pH7.4 磷酸缓冲溶液(PB试剂为NaH2P04 2H20 和Na2HP04 12H2O。
-----0. 2M 的NaH2P04溶液:31.2g NaH2P042H20,加蒸馏水1000mL溶解-----0. 2M 的Na2HP04溶液:71.632g Na2HP0412H2O 加蒸馏水至1000ml 溶解----0. 2M (pH7.4 磷酸缓冲溶液(PB : 19ml 的NaH2P04溶液和81ml 的Na2HP04溶液充分混合高压灭菌,常温保存。
2、0.03 mol/ L 磷酸盐缓冲溶液( (PBS)试剂为NaCl 和磷酸缓冲溶液PB——0.03MPBS溶液:22.8gNaCI , 150ml磷酸缓冲溶液(PB,加蒸馏水至1000ml,混匀——0.02 MPBS溶液:取100ml 0.03MPBS溶液至150ml容量瓶中,加蒸馏水稀释至150ml——0.01 MPBS溶液:取50ml 0.03MPBS溶液至150ml容量瓶中,加蒸馏水稀释至150ml高压灭菌,常温保存3、4%多聚甲醛溶液(1000ml)(在通风橱内进行操作)-----将略小于2/3体积的水(660ml)加热到50C,------40g多聚甲醛PFA,边搅拌边加入到水中,继续保持60C——1滴2mol/LNaOH溶液,立即澄清,但仍有小颗粒。
——1/3体积的PBS溶液,——用Hcl将pH调至7.2,定容,---- 用孔径为0.22卩谥勺滤膜过滤,—4 C保存最多保存两天,或者取少量保存在-20 C o(加热时温度不宜过高,为60C -65C,否则PFA容易降解,配置好后应尽快使用,否则固定效果较差)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光原位杂交仪实验报告
实验者:魏兰兰
实验时间:2016/10/18—2016/10/19
一、实验目的
1.探针试剂吸液量定量—10ul;
2.观察探针试剂滴液时是否有残留;
3.观察探针试剂滴液后盖板是否能压紧,是否均匀摊开,石蜡是否能完全浸裹;
4.观察上一步试剂对探针试剂有无影响;
5.观察探针试剂对下一步试剂有无影响;
6.观察37℃恒温16小时后,探针试剂是否挥发;
二、实验器材
1.荧光原位杂交仪
2.10ul取样器
3.一次性枪头
4.探针试剂(墨水稀释液)
三、实验步骤
1.10ul定量:利用10ul取样器确定一次性枪头吸液10ul液面所在的刻度位置,经过多次调整杂交仪柱塞泵电机的吸液步数,最终确定电机的吸液步数为1920时,吸液量恰好是10ul。
2.对反应池1运行以下程序步骤以确定实验目的的2.3.4.6项:
3.对反应池2、5运行以下程序步骤以确定实验目的的2.3.5.6项:
四、实验结果
1.本实验3次吸探针试剂量均在10ul刻度线处;
2.本实验3次滴探针试剂时基本没有残留;
3.本实验3次滴探针试剂后盖板均能压紧,目测无缝隙,石蜡完全
浸裹;
4.反应池1、5的上一步试剂均排液排尽,对探针没有其他影响;
5.反应池2因上一步(二甲苯试剂)排液时恰在中间位置残留大约50ul试剂,导致探针试剂压紧后溢出到盖板外1/4-1/3的液量;
6.由于探针试剂用到石蜡覆盖,排液时石蜡不能完成排尽,故而下一步试剂上还会有部分石蜡覆盖,除此之外无其他影响;
7.反应池1、5经过37℃恒温16小时后,探针试剂基本无挥发且成均匀摊开状;反应池2经过37℃恒温16小时后,探针试剂挥发1/2左右(因有溢出)基本成均匀摊开状。
8.盖板掀开后探针试剂表面有石蜡油,一种可能是实验中扩散到盖板内覆盖探针试剂,另一种可能是盖板掀开后扩散探针试剂表面。
