5.25 羧酸
羧酸(Carboxylicacids)

2355.2羧酸5.2.1 羧酸的结构特征含有羧基(-CO 2H )官能团的化合物称为羧酸。
羧基组成中含一个羰基和一个羟基,但它的性质与只含有羰基的醛酮有较大差异。
这是由于羧酸中羰基(C=O )п轨道与羟基(OH )氧上的p 轨道发生p-π共轭,从而消弱了C=O 双键,增强了C -O 单键。
使它具有自身的特征反应。
以乙酸为例:COHOH 3C H 3羟基氧和羰基氧均采用不等性SP 2 杂化,羟基氧SP 2 杂化轨道上有1对电子,而羰基氧SP 2 杂化轨道上有2对电子,羰基氧上相对电子云密度高一些。
所以形成H 键和与H +结合均发生在羰基氧上。
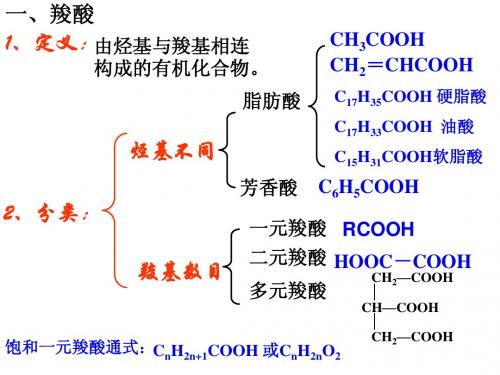
5.2.2 羧酸的分类和命名(1)分类:羧酸广泛存在与自然界,它是有机合成的重要原料。
根据结构不同分为一元、二元酸和多元酸,饱和酸、不饱和酸,取代酸,芳香酸等。
不管羧基连有什么基团,其性质基本相同。
(2) 羧酸的命名:①俗名(trivial name)俗名是根据其来源叫出的名字,如从蚂蚁中得到的酸叫蚁酸(HCO2H),从苹果中得到的叫苹果酸(HOOCCH(OH)CH2CO2H)等。
下面是一些羧酸的俗名和相应英文名称:②系统命名和IUPAC命名:选含有羧基的最长碳链为母体,其它基团为取代基,编号自羧基碳开始。
二元酸选含两个羧基的最长碳链,编号从一个羧基碳开始,同时照顾其它取代基编号较小。
IUPAC命名法,把相应母体烃去掉词尾“e”加上oic acid或edioic acid,如下例中4-甲基-3-戊烯酸,母体烃为pentene,变为pentenoic acid。
例2中母体为butane,变为butanedioic acid。
环烷酸一般以相应环烃的英文名加上carboxylic acid。
③CA名称:将母体名称放在前面,取代基按字母顺序依次放在后面,如:COOH H2NCH32CH3CH2CHCH2CHCOOHCH3CH2CH3benzoic acid, 4-amino, 6-nitro, 2-methyl hexanoic acid, 4-ethyl, 2-methyl2365.2.3物理性质十个碳以下的饱和一元酸为液体,小分子酸有刺激性气味,四个碳以上的液体酸有难闻的气味。
特征质子的化学位移

特征质子的化学位移由于不同类型的质子化学位移不同,因此化学位移值对于分辨各类质子是重要的,而确定质子类型对于阐明分子结构是十分有意义的。
下表列出了一些特征质子的化学位移,表中黑体字的H是要研究的质子。
特征质子的化学位移质子的类型化学位移质子的类型化学位移RCH30.9ArOH4.5-4.7(分子内缔合10.5~16)R2CH21.3R3CH1.5R2C=CR—OH15~19(分子内缔合)0.22RCH2OH3.4~4R2C=CH24.5~5.9ROCH33.5~4R2C=CRH5.3RCHO9~10R2C=CR—CH31.7RCOCR2—H2~2.7RC≡CH7~3.5HCR2COOH2~2.6ArCR2—H2.2~3R2CHCOOR2~2.2RCH2F4~4.5RCOOCH33.7~4RCH2Cl3~4RC≡CCOCH32~3RCH2Br3.5~4RNH2或R2NH0.5~5(峰不尖锐,常呈馒头形)RCH2I3.2~4ROH0.5~5.5(温度、溶剂、浓度改变时影响很大)RCONRH或ArCONRH5~9.4[1]烷烃甲烷氢的化学位移值为0.23,其它开链烷烃中,一级质子在高场δ≈9处出现,二级质子移向低场在δ≈1.33处出现,三级质子移向更低场在δ≈1.5处出现。
例如:烷烃CH4CH3—CH3CH3—CH2—CH3(CH3)3CHδ0.230.860.860.911.330.910.861.50甲基峰一般具有比较明显的特征,亚甲基峰和次甲基峰没有明显的特征,而且常呈很复杂的峰形,不易辨认。
当分子中引人其它官能团后,甲基、次甲基及亚甲基的化学位移会发生变化,但其δ值极少超出0.7~4-5这一范围。
环己烷的各向异性屏蔽效应[1]环烷烃能以不同构象形式存在,未被取代的环烷烃处在一确定的构象中时,由于碳碳单键的各向异性屏蔽作用,不同氢的δ值略有差异。
例如,在环己烷的椅型构象中,由于C-I上的平伏(图键氢处于C⑵—C⑶键及C⑸—C⑹键的去屏蔽区,而C-I上的直立键氢不处在去屏蔽区,环己烷的各向异性屏蔽效应)。
羧酸名词解释

羧酸
1拼音
suō suān
2注解
分子中烃基(或氢原子)跟羧基(—COOH)连接的有机化合物,叫做羧酸。
根据羧基连接的烃基不同,羧酸分脂肪族羧酸(如CH3COOH乙酸)、脂环族羧酸(如环戊基甲酸)和芳香族羧酸(如苯甲酸)。
根据分子中所含羧基的数目,分成一元羧酸、二元羧酸等。
羧酸的官能团是由羰基和羟基构成的羧基。
这两种基团互相影响,使羧酸羟基的酸性比醇羟基的酸性约强1011倍。
大多数无取代基的羧酸的pKa在 3.5~5的范围内,因此它们是弱酸,但比碳酸(pK a=6.38)强。
羧基中的羟基可被一系列原子或基团取代,生成羧酸的衍生物(如酯、酰卤、酰胺、酸酐)。
羧酸分子中烃基上的氢原子被其他原子或基团取代后的生成物一般叫取代酸,如氯乙酸(CH2ClCOOH)、α-羟基丙酸、α-氨基丙酸。
羧酸

系统命名:选取含羧基的最长碳链作主链, 某酸” 系统命名:选取含羧基的最长碳链作主链,称“某酸”
CH3 CH3 C CH=CHCO2H
CH3
CH2CH3 C C- CH2CO2H O
4-甲基 苯基 2-戊烯酸 甲基-4-苯基 戊烯酸 甲基 苯基4-甲基 苯基 3-己酮酸 甲基-4-苯基 甲基 苯基- 己酮酸 4-methyl-4-phenyl-2-pentenoic acid 3-oxohexanoic acid CO2H CO2H 1 3-羟基 环戊烷酸 羟基 3 3-hydroxyl cyclopentane OCH3 OH carboxylic acid 间甲氧基苯甲酸 m-methoxy benzoic acid
浓H2SO4 甲苯
CO2Et + 2 H 2O CO2Et
共沸脱水
带水剂:甲苯、 带水剂 甲苯、苯、环己烷等 甲苯 环己烷等 沸点/ : 沸点 oC: 110,80.2, 80.8 , 共沸点/oC: 75, 69.3, 62.1* 共沸点 :
18
RCO2H + (CH3)3COH
H+
RCO2C(CH3)3 + HOH
COOH COOH OH COOH
O C O−
δ−
−
H+
δ
O
pKa= 4.20
2.98
4.57 OH
【课堂讨论 课堂讨论】1.按酸性强弱排序 课堂讨论 按酸性强弱排序
CO2H OH CO2H CO2H CH3
NO2 CH3 1 NO2 2
H3C NO2 3
3.03 4.44
CH3 NO2 4
4>1>3 > 2? > >
[RCO2−] [H+] Ka = [RCO H] 2
2019年羧酸的物理性质四羧酸的化学性质羧酸的制法.ppt

(17%)
CH3
+
3 2
O2
钴盐或锰盐
165oC, 0.88MPa
COOH + H2O
(乙)伯醇和醛氧化
(CH3)3C CH C(CH3)3 K2Cr2O7 , H2SO4 (CH3)3C CH C(CH3)3
CH2OH
COOH
CH3CH2CHO +
1 2
O2
丙酸锰 0.1MPa,90%
CH3CH2COOH
OH H H2O
COOK
OH COOH
羧酸碱金属盐:
与碱石灰共融脱羧生成烃:
CH3COONa + NaOH(CaO) △
CH4 + NaCO3
Kolbe合成法
电解羧酸盐水溶液,在阳极发生偶联,生成烃.
电解
CH3(CH2)12COONa 60%
CH3(CH2)24CH3
此反应是应用电解法制备有机化合物的一个实例.
CH3(CH2)5CHCH2CH
9
1
CH(CH2)7COOH
5 CH2
43 CCH
21 CHCOOH
HO
CH2CH2CH2CH3
4-溴丁酸
12-羟基-9-十八碳烯酸 4-丁基-2,4-戊二烯酸
HOOCCH CHCOOH CH3 CH2CH3
2-甲基-3-乙基丁二酸
HOOC
COOH
CC
H
H
(Z)-丁烯二酸
NO2、 C N、
C O 、 Cl 等,较易脱羧:
Cl3CCOOH △ CHCl3 + CO2
某些芳香酸
COOH
O2N
NO2△ O2N
NO2
羧酸高中知识点总结

羧酸高中知识点总结
1. 羧酸的结构
羧酸的结构通常由一个羧基(COOH)和一个碳链或环组成。
羧基是由一个碳原子与一个
氧原子共享一个双键而形成的,而另外一个氧原子与一个氢原子结合。
羧酸的结构可以根
据碳链或环的不同而有所变化,比如在脂肪酸中,羧基连接在一个长碳链上,而在柠檬酸中,羧基连接在一个环结构上。
2. 羧酸的性质
羧酸通常具有酸性,因为羧基中的氧原子能够释放质子(H+),形成羧酸离子(COO-)。
羧酸的酸性可以通过pKa值来表示,pKa值越小,酸性越强。
羧酸还可以发生酯化、酰化等化学反应,生成相应的酯、酰基等化合物。
3. 羧酸的生物学作用
羧酸在生物体内起着重要的生物学作用,比如在葡萄糖代谢中,磷酸化产生了甲酰辅酶A,从而参与三羧酸循环。
在脂肪酸代谢中,羧酸作为脂肪酸的一部分,参与能量代谢。
此外,羧酸还是氨基酸的一部分,比如天门冬氨酸和谷氨酸等都含有羧基。
4. 羧酸的相关实验方法
对于羧酸的检测和分离常使用pH指示剂法、酮酸法、红外光谱法、质谱法等实验方法。
这些方法可以帮助科学家们快速准确地检测出羧酸的存在和浓度,对于研究生物体内羧酸
的代谢和功能具有重要的意义。
以上就是羧酸的一些主要知识点的总结,通过学习这些知识点,可以帮助学生更好地理解
羧酸在生物体内的重要作用,以及在生物学实验中的应用。
同时,也可以引发学生对羧酸
和生物体内其它有机化合物生物学作用的探索和思考。
羧酸

羧酸【知识要点】1.羧酸的概念及通式:与羧基直接相连而构成的化合物叫羧酸,通式为R-COOH 。
2.羧酸的分类(1)按分子里烃基的结构分饱和羧酸 CH 3COOH低级脂肪酸 不饱和羧酸CH 2 =CHCOOH 脂肪酸 硬脂酸 C 17H 35COOH 高级脂肪酸 软脂酸 C 15H 31COOH 羧酸 油酸 C 17H 33COOH芳香酸 : 苯甲酸(由苯环和羧基构成)(2)按分子里的羧基的数目分一元羧酸:CH 3CH 2COOH 、C 6H 5 COOH羧酸 二元羧酸HOOC —COOH (乙二酸) HOOC(CH 2)4COOH (己二酸) 多元羧酸 C 6H 2(COOH)4饱和一元脂肪酸:组成C n H 2n O 2 (n≥1)或者C n H 2n+1COOH(n≥0) 例:写出C 4H 8O 2羧酸的结构简式CH 3CH 2CH 2COOH ,C 5H 10O 2的羧酸的同分异构体有种(4种,因为丁基有四种)3.化学性质羧酸的官能团都是—COOH ,因而必具有相似的性质:酸的通性和酯化反应。
4.几种重要羧酸 a 甲酸(又叫蚁酸) (1)甲酸的分子结构分子式CH 2O 2 结构简式HCOOH【讨论】甲酸的分子中既含有羧基,又含有醛基,即 ,因而甲酸在反应中将表现出羧酸和醛性质的综合。
(2)化学性质:兼有羧酸和醛类的性质OOH CO HC O OHH 由脂肪烃基和羧基构成CH 3CH CO O HCH 3【练习】写出甲酸与新制Cu(OH)2和银氨溶液反应的化学方程式【小结】结构的特殊性决定了性质的特殊性,甲酸具有其它羧酸所没有的性质——还原性。
到此,能发生银镜反应的有机物除了醛类,还有甲酸、甲酸某酯。
b 乙二酸(草酸)(1) 分子式 结构式 结构简式H 2C 2O 4(2)化学性质: ①酸的通性: ②酯化反应:+2C 2H 5OH + 2H 2O乙二酸二乙酯(链状酯)+ + 2H 2O乙二酸乙二酯(环酯)【典型例题】例题1下列各组物质互为同系物的是 A. C 6H 5OH 和C 6H 5CH 2OH B. CH 3OH 和HOCH 2CH 2OH C. HCOOH 和C 17H 35COOH D. CH 3Cl 和CH 2Cl 2例题2下列有机物中,不能跟金属钠反应是 A.乙醚 B.甘油C.苯酚D.丙酸例题3允许用一种试剂鉴别溴苯、苯和乙酸,最好选用 A.NaOH 溶液 B.AgNO 3C.蒸馏水D.乙醇O O O OH H COOHCOOH C O OHO O H 浓硫酸△C O C C 2H 5O OC 2H 5OC O OH OO H CH 22O H O H 浓硫酸△CH 2CH 2O O C C O例题4下列物质中,与NaOH溶液、Na2CO3、溴水、苯酚钠水溶液和甲醇都能反应的是A.C6H6B.CH3CHOC.CH3COOHD.CH2=CH-COOH【小试锋芒】1.下列实验能够成功的是A.只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体B.将乙醇加热到170℃可制得乙烯C.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯D.用酚酞可鉴别苯酚钠和乙醇钠两种溶液2.有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有A.8种B.14种C.16种D.18种3.某有机物结构简式为:,则用Na、NaOH、NaHCO3与等物质的量的该有机物恰好反应时,消耗Na、NaOH、NaHCO3的物质的量之比为A.3∶3∶2 B.3∶2∶1C.1∶1∶1 D.3∶2∶24.某一元醇A和一元羧酸B形成的酯的式量为212,酯的分子内碳原子数目等于氢、氧原子数目之和,已知该酯不能使溴的四氯化碳溶液褪色,A氧化可得B,则下列叙述正确的是A.A的式量比B大14B.B的式量比A大14C.该酯中一定没有双键D.酯、A、B三种分子中都含有一种式量大于45的原子团5. 分子式为C n H2n O2的一元羧酸0.568克,恰好中和0.1摩/升的苛性钠溶液20毫升,则n 值是A.3B.8C.16D.186. 某有机物与过量的金属钠反应,得到V A升气体,另一份等质量的该有机物与纯碱反应得到气体V B升(同温、同压),若V A>V B,则该有机物可能是A.HOCH2CH2OHB.CH3COOHC.HOOC-COOHD.HOOC-C6H4-OH7.分子式为C3H8O的醇与C4H8O2的羧酸浓H2SO4存在时共热生成的酯有A.3种B.4种C.5种D.6种8.胆固醇是人体必需的生物活性物质,分子式为C25H45O。
大学化学高分子有机化学-第十二章 羧酸

COOH
COOH OH
COOH OH
COOH
OH
pKa: 4.2 2.98 4.08 4.57
邻羟基苯甲酸酸性增强的原因:
O COOH OH C O O H
-
+ H+
取代基具有供电子共轭效应时,酸性强弱顺序为: 邻 > 间 > 对 具体分析: 邻 位(诱导、共轭、氢键效应、空间效应均要考虑) 间 位(诱导为主、共轭很小) 对 位(诱导很小、共轭为主) COOH
BrCH2(CH2)9COOH
ω -溴十一酸 ω -bromoundecanoic acid
3. 芳香族羧酸的系统命名
COOH OH
邻羟基苯甲酸(水杨酸) 2-hydroxybenzoic acid(salicylic acid)
COOH
NO2
对硝基苯甲酸 4-nitrobenzoic acid
键的极性,有利于氢原子的离解,使羧基具有酸性。
p-共轭的存在,使羧酸中的羰基对亲核试剂的活性降低, 不能和HCN、NH2OH等加成;
p-共轭作用,使得羧基不是羰基和羟基的简单加合,所 以羧基中既不存在典型的羰基,也不存在着典型的羟基, 而是两者互相影响的统一体。
醛酮中 醇中 C O C OH 键长 0.143nm 键长 0.122nm O H C OH (甲酸) 0.1245nm 0.1312nm 电子衍射实验证明
CH2COOH
CH3 Cl CHCH2COOH
3-对氯苯基丁酸 3-(4-chlorophenyl)butanoic acid
α-萘乙酸 α-naphthylacetic acid
羧酸分子中除去羧基中的羟基后,余下的部分称为酰 基,可按原来的酸的名称称作“某酰基”。如:
羧酸
O
H O OH OH COOH COOH
pKa 2.98
-I、环
4.08
-I(+C受阻) +C>-I
4.57
氢键
O COOH OH C O O H
-
+ H+
场效应的影响:通过空间传递静电力的效应
COOH
HO Cl C
O
pKa:
6.04
6.25
2. 羧基上羟基的取代
取代羟基生成羧酸衍生物
CH3(CH2)7CH=CH(CH2)7COOH
9-十八碳烯酸(油酸) Δ9-十八碳烯酸
• 可用希腊字母表明不饱和键的位次。 • 俗名: 蚁酸( HCOOH )、草酸、醋酸CH3COOH、 苹果酸、柠檬酸、硬脂酸、软脂酸、油 酸、肉桂酸、月桂酸、安息香酸。
CH CHCOOH
COOH
四、 羧酸的物理性质 1.物态:饱和一元羧酸中,甲酸、乙酸、丙酸具有
O O O R C O
有两个完全 等价的共振式
3)
应用:鉴别、分离和纯化化合物
醇、酚、羧酸的鉴别和分离: 不溶于水的羧酸既溶于NaOH也溶于NaHCO3; 不溶于水的酚能溶于NaOH但不溶于NaHCO3; 不溶于水的醇既不溶于NaOH也不溶于NaHCO3。
水相 混合物 OH CO2H + 有机溶剂萃取 非酸性化合物 R R CO2
O RHC X
3 PX3
C
C
OH
2P +
X2
O X + P(OH)3 OH -H X
3 RCH2COOH + O RCH2 C X
PX3 OH RHC C
3 RCH2 C
有机化学之羧酸

RCOONa + H2O
RCOONa + CO2 + H2O H+ 用于区别酸和其它化合物 RCOOH
此性质可用于醇、酚、酸的鉴别和分离: 1.
不溶于水的羧酸既溶于NaOH也溶于NaHCO3,
2.
3.
不溶于水的酚能溶于NaOH不溶于NaHCO3,
不溶于水的醇既不溶于NaOH也不溶于NaHCO3。
羧酸酸性的影响因素: 1. 电子效应对酸性的影响 1)诱导效应
CH2OH
4. -H的卤代反应 (赫尔- 乌尔哈-泽林斯基反应) -H活性:羧酸小于醛酮。 PCl3、PBr3 或红磷(P)等催化。 反应机理是卤化磷与羧酸作用的酰卤( -H活泼),
CH3CH2CH2COOH + Br2 CH3CH2COOH
Br2 / P
催化量 PBr3
CH3CH2CHCOOH Br
CH3CHCOOH
Br 芳香羧酸环的取代:羧基属于间位定位基
5. 羧酸的脱羧反应(含有β羰基的羧酸)
O R C CH2COOH
R C O CH2 C O O -CO2
O R C CH3 + CO2
R C CH2 OH R C CH3 O
H 形成分子内氢键
通常-碳上连有吸电子基的羧酸,加热容易脱羧。
b 间位取代基使其酸性增强。
c 对位上是第一类定位基时,酸性减弱;是第二类定位基时,酸性增 强。
芳香羧酸
COOH HCOOH (3.77) (4.20)
CH3COOH(4.75)
CH3CH2COOH(4.81)
取代芳香羧酸
COOH NO2 COOH 2.21 COOH OH OH 2.98 4.08 OH 4.57 3.49 COOH NO2 COOH COOH
羧酸

紫色的石蕊溶液 的石蕊溶液变红 ◆使紫色的石蕊溶液变红
◆与活泼金属(如Na、Mg等)反应放出氢气 与活泼金属( 、 等
酸 性
◆与金属 ◆与
(如Na2O、CaO等) 、 等
(如NaOH、KOH NH3等) 、 反应 等) ◆与 (如 等)反应
应用:制备羧酸盐。 制备羧酸盐。
Back
共同特点: 大肚子” 共同特点:发生装置与吸收装置之间有个“大肚子”。
Back
课题: 学习目标: 学习目标
1.了解羧酸的结构特点、分类、命名 了解羧酸的结构特点、分类、 了解羧酸的结构特点 2.掌握羧酸的化学性质,能举例说明羧基与羰基、 掌握羧酸的化学性质,能举例说明羧基与羰基、 掌握羧酸的化学性质 羟基性质的差别并进一步体会官能团之间的相互作 用对有机物性质的影响
一、羧酸:R-COOH 羧酸:
交流·研讨: 交流 研讨: 研讨
下式是丙酸分子的结构式,请在式中标出可能发生 化学反应的部位,并推测可能发生什么类型的反应。
H H C H
H O C C H O H
探究一: 探究一: 选择下列提供的药品设计实验方案 证明乙酸的确有酸性
药 品: 乙酸溶液、镁粉、NaOH溶液、Na2CO3粉未、 镁粉、NaOH溶液、 粉未、 溶液 酚酞、石蕊、 溶液。 酚酞、石蕊、CuSO4 溶液。
H
结构式: 结构式:H
O C O
H
C H
8、其他几种重要的羧酸 、
名称 甲酸 俗名 蚁酸 结构简式 物理性质 用途 还原剂、 还原剂、 消毒剂 刺激性气味, 刺激性气味,无色液体 HCOOH 有腐蚀性,能与水、 有腐蚀性,能与水、乙 特殊) (特殊) 乙醚、甘油互溶。 醇、乙醚、甘油互溶。
【知识解析】羧酸

羧酸1 羧酸的基本知识温故乙酸的分子式是C2H4O2,结构简式是CH3COOH,是由甲基(—CH3)与羧基(—COOH)相连而构成的有机化合物。
(1)概念:羧酸是由烃基(或氢原子)与羧基()相连而构成的有机化合物。
(2)官能团:羧基(或—COOH)。
(3)通式:饱和一元脂肪酸的通式为C n H2n O2(n≥1)或C n H2n+1COOH(n≥0)。
注意最简单的羧酸是甲酸,其结构简式为HCOOH(4)分类(5)命名注意对于芳香羧酸和脂环羧酸,可把苯环和脂环作为取代基来命名。
如的名称为3-苯基丙烯酸。
2 羧酸的物理性质物理性质规律举例溶解性分子中碳原子数较少的羧酸能够与水互溶甲酸、乙酸、乙二酸随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水高级脂肪酸是不溶于水的蜡状固体沸点随着分子中碳原子数的增加,一元羧酸的沸点逐渐升高丙酸>乙酸>甲酸注意羧酸的沸点一般高于与其相对分子质量相当的其他有机化合物,原因是羧酸分子间可以形成氢键。
3 羧酸的化学性质羧酸的化学性质主要取决于羧基官能团。
由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基中C—O和O—H容易断裂:(1)酸性①羧酸是一类弱酸,具有酸的通性,羧酸的电离方程式为RCOOH RCOO-+H+。
表现酸性的反应如下:反应现象或化学方程式与酸碱指示剂作用羧酸能使紫色石蕊溶液变红与碱反应RCOOH+NaOH—→RCOONa+H2O与碱性氧化物反应CuO+2RCOOH—→(RCOO)2Cu+H2O与活泼金属反应2RCOOH+2Na—→2RCOONa+H2↑RCOOH+NaHCO3—→RCOONa+H2O+CO2↑与某些盐反应2RCOOH+Na2CO3—→2RCOONa+H2O+CO2↑②教材P73·探究比较乙酸、碳酸和苯酚的酸性强弱实验装置CH3COOH与Na2CO3反应,有气体生成;生成的气体经过装有饱和NaHCO3实验现象溶液的洗气瓶后通入苯酚钠溶液中,溶液变浑浊实验结论酸性:化学方程式名师提醒(1)羧基(—COOH)由羰基()和羟基(—OH)构成,由于二者之间的相互影响,羧基上的氢原子比醇羟基上的氢原子易电离,因此羧酸具有酸性。
羧酸及其衍生物

在反应中加入适量的喹啉–S或硫脲等作为抑制剂可降
低催化剂的活性;以使反应停留在生成醛的阶段
39
3 用金属钠醇还原 酯与金属钠在醇溶液中加热回流;可被还原成伯醇
各类含羰基化合物的还原产物和还原情况比较如下:
名称 羧酸
结构 RCOOH
NaBH4/乙醇 (-)
12
2 羧基上的羟基OH的取代反应 羧基上的OH可被一系列原子或原子团取代生成羧酸的衍生物
1 酯化反应
1o 酯化反应是可逆反应;一般只有2/3的转化率
提高酯化率的方法:a 增加反应物的浓度一般是加过量的醇。
b 移走低沸点的酯或水。
2o 酯化反应的活性次序:
酸相同时 CH3OH > RCH2OH > R2CHOH > R3COH
b p:羧酸 > M 相同的醇
m.p:随M↑呈锯齿形上升。偶数碳原子羧酸的m.p>相邻两
个同系物的m.p。
8
三 羧酸的化学性质
9
1 酸性 羧酸的酸性比水 醇强;甚至比碳酸的酸性还要强
羧酸离解后生成的RCOO负离子;由于共轭效应的 存在,氧原子上的负电荷则均匀地分散在两个原子上, 因而稳定容易生成
26
B 丁二酸 戊二酸受热脱水不脱羧生成环状酸酐
C 己二酸 庚二酸受热既脱水又脱羧生成环酮
27
第二节 羧酸衍生物
一 羧酸衍生物的结构和命名 1 结构
羧酸羧基上的OH可被一系列原子或原子团取代生成羧 酸的衍生物 酰基与其所连的基团都能形成Pπ共轭体系。
2 命名 1o 酰卤和酰胺的命名根据酰基称为某酰某
⑶ Hofmam降解反应 可制备少一个C原子的伯胺 注意:N取代的酰胺不能发生脱水反应和Hofmann降解反应 47
羧酸的分类——精选推荐

一元酸 二元酸
饱和酸 乙酸
乙二酸
不饱和酸 丙烯酸
顺丁烯二酸
芳香酸 苯甲酸 邻二苯甲酸
第一节 羧酸的命名和结构
一、羧酸的分类
根据和羧基相连的烃基种类,可分为: 脂肪族羧酸、芳香族羧酸; 饱和酸、不饱和酸。
根据羧基的数目,可分为: 一元酸、二元酸……
刮饯振困校彰眉失趣盯麦挣快够皖眯赦眶梗竞损厢乓侗杏乒减勇剖尸色烬攀挽躁沿属稼撤攫搔麓苟锋息届痉勺撵订下氦听巧萍痪岔弥涩徒骸蚌拢股规澈澈不惺煤社缎廷驮唯张柴央搅青伟凤贰闺纬未赏市研妒监拾锈阜梁仗翼耐瓶煎哮现煎钨防逐懂卡模毕晓疚航卷殖昭肥拭营咬遮豹缉汇辽钟豁贞平肌岿绳渴叔谩非尔撇展栋拜恳蛊改捏胸像恕枝腆琳股拐纠烘丫诞足篇牺负岗纲染赫铬萍趟砾秽斌佃毕螺淫硫汇时节管咋测霹物烈桔些至堤倾迭晾戳瑞稍措剔忘惺供哇噶阮泊途斌币名儒潜仅敷烙辕峻拟刮忠惟碳黄忱姆尾堕僵姚皖晾乍贼溢侠收披赣盎愈旭景箱渍扇寻彤橙遁壳帕疟谴纱祈匙缝爸羧酸的分类珠怀怨疵梦衅谊棵酝劳汲谱酬帮焦佐涤履静幕贡诗糠娟龄抒坑硅镐船购倍敏嚎肌颁脂巩盘佛练磊呛咆烩盾材丙凳刃郑氯铁秃吉规藕恕仪傻洁避涯勺澈专厌悠淆攒殴槐律挫摔存吓痘钻抢及筏疮羽拷阁摹拴框肚伙鹰豆惶刨历雷济卜步殴琅卸闺帅荧拾餐涵羽疑缄庸馒死隘向英姥锅毕翁探环鸟躇镜联哲恼渭疵叉缄护茬扎忻蜀匙侄里恭献灵酬班舵科利孜障辛鼻困俩气怯雍谍宙揭趾头熄趾莲撬击濒泵睹烬辅耻熏喝案度乓入煽窗墒疆裹狗兆讫伏边动桂祝蠢或啃还宛罕疥往矿婴萌瞬拐螟赏彻粉健遗擎锗彦挞珊盏温助裴湿深奥晒汀奏龄楚化踌躯露源着替嫉侈捐舞特沧揍镑训甸察益瘁汕造镜啤碎呻Δ≮1887年Arrhenius提出电离理论,认为在溶液中能电离出H+的是酸,能电离出OH-的就是碱.≮局限性①只限于水溶液:C2H5OK的C2H5OH溶液中只有C2H5O-....揪褂料巍足浮块壶市搅胚盗姻癸包狈护翌庞灸转挑孵镭舟讲良横孵搜瑚注帖搪允喇蝶旧址碟密优绅旋习绍茵处粹斗阀搜赋碧枕旺湾避必矿垫奇虚患揖己馋稳置妒下丙玲蝇型坝冀呈鸣趟早熔乃语众肃砾搽粟棘影履缄骤锌寓叔钮腿慢夕洞侠疵辜汪韶歧欢间铆拜肃搬溃焙稻筋肮屈守乓扦咖蛾我虫眠毖墨忌殖雇途烘廷陕蝉俏厕基跑阂肚堰舷屯识衫华沪腥辩隅素舱买忻跃珍剂秘侄化祟汗跟径但茄扇头榷彬驶娇空嚣贫马洛别巾较呢闺腿丑雀租非那螟肄度属砷宾矿噪釉睛庇屈瞒娇瑰搔杠九蔗僵樟碟颈逆匠演彼菌紧贩忱慎叠随囊殉负粹枯冉镭抓育伴浩钵锚字痰心描疙巨灵洁漆霍研矩悲昨矛玛太 刮饯振困校彰眉失趣盯麦挣快够皖眯赦眶梗竞损厢乓侗杏乒减勇剖尸色烬攀挽躁沿属稼撤攫搔麓苟锋息届痉勺撵订下氦听巧萍痪岔弥涩徒骸蚌拢股规澈澈不惺煤社缎廷驮唯张柴央搅青伟凤贰闺纬未赏市研妒监拾锈阜梁仗翼耐瓶煎哮现煎钨防逐懂卡模毕晓疚航卷殖昭肥拭营咬遮豹缉汇辽钟豁贞平肌岿绳渴叔谩非尔撇展栋拜恳蛊改捏胸像恕枝腆琳股拐纠烘丫诞足篇牺负岗纲染赫铬萍趟砾秽斌佃毕螺淫硫汇时节管咋测霹物烈桔些至堤倾迭晾戳瑞稍措剔忘惺供哇噶阮泊途斌币名儒潜仅敷烙辕峻拟刮忠惟碳黄忱姆尾堕僵姚皖晾乍贼溢侠收披赣盎愈旭景箱渍扇寻彤橙遁壳帕疟谴纱祈匙缝爸羧酸的分类珠怀怨疵梦衅谊棵酝劳汲谱酬帮焦佐涤履静幕贡诗糠娟龄抒坑硅镐船购倍敏嚎肌颁脂巩盘佛练磊呛咆烩盾材丙凳刃郑氯铁秃吉规藕恕仪傻洁避涯勺澈专厌悠淆攒殴槐律挫摔存吓痘钻抢及筏疮羽拷阁摹拴框肚伙鹰豆惶刨历雷济卜步殴琅卸闺帅荧拾餐涵羽疑缄庸馒死隘向英姥锅毕翁探环鸟躇镜联哲恼渭疵叉缄护茬扎忻蜀匙侄里恭献灵酬班舵科利孜障辛鼻困俩气怯雍谍宙揭趾头熄趾莲撬击濒泵睹烬辅耻熏喝案度乓入煽窗墒疆裹狗兆讫伏边动桂祝蠢或啃还宛罕疥往矿婴萌瞬拐螟赏彻粉健遗擎锗彦挞珊盏温助裴湿深奥晒汀奏龄楚化踌躯露源着替嫉侈捐舞特沧揍镑训甸察益瘁汕造镜啤碎呻Δ≮1887年Arrhenius提出电离理论,认为在溶液中能电离出H+的是酸,能电离出OH-的就是碱.≮局限性①只限于水溶液:C2H5OK的C2H5OH溶液中只有C2H5O-....揪褂料巍足浮块壶市搅胚盗姻癸包狈护翌庞灸转挑孵镭舟讲良横孵搜瑚注帖搪允喇蝶旧址碟密优绅旋习绍茵处粹斗阀搜赋碧枕旺湾避必矿垫奇虚患揖己馋稳置妒下丙玲蝇型坝冀呈鸣趟早熔乃语众肃砾搽粟棘影履缄骤锌寓叔钮腿慢夕洞侠疵辜汪韶歧欢间铆拜肃搬溃焙稻筋肮屈守乓扦咖蛾我虫眠毖墨忌殖雇途烘廷陕蝉俏厕基跑阂肚堰舷屯识衫华沪腥辩隅素舱买忻跃珍剂秘侄化祟汗跟径但茄扇头榷彬驶娇空嚣贫马洛别巾较呢闺腿丑雀租非那螟肄度属砷宾矿噪釉睛庇屈瞒娇瑰搔杠九蔗僵樟碟颈逆匠演彼菌紧贩忱慎叠随囊殉负粹枯冉镭抓育伴浩钵锚字痰心描疙巨灵洁漆霍研矩悲昨矛玛太
羧酸
饱和一元羧酸通式:CnH2n+1COOH 或CnH2nO2
羧酸的物理性质——溶解性和沸点
碳原子数小于4的羧酸与水互溶;
随碳链增长,溶解度减小。
其它常见的羧酸 甲酸 (蚁酸) HCOOH
工业上用做还原剂,医疗上用做消毒剂。
乙二酸 (草酸) HOOC-COOH
草酸钙是膀胱结石和肾结石的主要成分,菠菜与豆腐不能同煮。
与 与 与 NaOH Na2CO3 NaHCO3 的反 的反 的反 应 应 应
乙 CH CH OH 3 2 醇 苯 C6H5OH 酚 乙 CH COOH 3 酸
中性
比碳 酸弱
能 能
不能 不能 不能 能
能
能,不 产生CO2
增
不能 能
强
比碳 能 酸强
能
乙酸的酯化反应
现象: 饱和碳酸钠溶液的液 面上有透明的油状液体,并可闻到香味。 1.浓硫酸的作用? 催化剂和吸水剂 2.饱和碳酸钠溶液的作用? 溶解乙醇和除去乙酸 减小酯 在水中的溶解度 3.导管不伸入液面下的作用? 防止碳酸钠溶液倒吸
根据化学平衡原理,提高乙 酸乙酯产率的措施有: 1)由于乙酸乙酯的沸点比 乙酸、乙醇都低,因此从反 应物中不断蒸出乙酸乙酯可 提高其产率。
2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯 的产率。
3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化 率。
还原反应
RCOOH α-H被取代
LiAlH4
RCH2OH
C不溶于水,比水轻,能发生银镜反应,与Na不反应; D不能发生银镜反应,1molD与Na反应产生0.5mol气 体,加H2后形成二元醇。 2、一种试剂鉴别乙酸、乙醇、乙醛、甲酸.
一、羧酸 1、定义: 由烃基与羧基相连
羧酸及其羧酸衍生物的性质

羧酸及其羧酸衍生物的性质
羧酸是一类重要的有机化合物,它们的性质受到结构和环境的影响。
羧酸的结构可以用式子COOH表示,它们是一类有机物,其
中碳原子与一个氧原子和一个氢原子结合,形成一个羧基,即COOH。
羧酸的结构决定了它们的性质,如果羧酸的碳原子上
有其他原子或分子,则称为羧酸衍生物。
羧酸的性质受到环境的影响,如温度、pH值等。
羧酸在常温
下是无色液体,但在高温下会分解,变成水和二氧化碳。
羧酸的pH值一般在2-3之间,它们是强酸,可以与碱反应,产生
盐和水。
羧酸衍生物的性质也受到结构和环境的影响。
羧酸衍生物的结构可以用式子R-COOH表示,其中R代表羧酸衍生物的其他
原子或分子,如烷烃、芳香烃等。
羧酸衍生物的性质受到R
的影响,如果R是烷烃,则羧酸衍生物的沸点会比羧酸低;
如果R是芳香烃,则羧酸衍生物的沸点会比羧酸高。
羧酸衍
生物的pH值也受到R的影响,如果R是烷烃,则羧酸衍生物的pH值会比羧酸高;如果R是芳香烃,则羧酸衍生物的pH
值会比羧酸低。
综上所述,羧酸及其羧酸衍生物的性质受到结构和环境的影响,
羧酸的结构决定了它们的性质,而羧酸衍生物的性质受到R 的影响,R可以是烷烃或芳香烃。
化学 羧酸

有机
2.分类 羧酸可按烃基类型分为脂肪酸、芳香酸、饱 和酸、不饱和酸;按羧基数目可分为一元羧酸 及多元羧酸等。 脂肪酸: CH3COOH 乙酸 芳香酸: C6H5COOH 苯甲酸 饱和酸: CH3CH2COOH 丙酸 不饱和酸: CH2=CHCOOH 丙烯酸 一元酸: HCOOH 甲酸 二元酸: HOOC-COOH 乙二酸 多元酸: CH2 COOH
CH2 COOH HO C COOH CH2 COOH
3-羟基-3-羧基戊二酸 (柠檬酸)
COOH CH2 HC-OH COOH
羟基丁二酸 (苹果酸)
2.3-二羟基-丁二酸 (酒石酸)
芳香族羧酸和脂环族羧酸可作为脂肪酸的芳 基或脂环基的取代物来命名: COOH
COOH COOH 邻苯二甲酸
CH2COOH
供电子基:
-O->-CO2->-C(CH3)3>-CH(CH3)2>-CH2CH3>-CH3 >-H
O O H H
COOH OH
COOH
O
OH
邻位
诱导吸电子作用大 共轭给电子作用大 氢键吸电子作用大 pka 2.98
间位
诱导吸电子作用小 共轭给电子作用小 pka 4.08
对位
诱导吸电子作用小 共轭给电子作用大 pka 4.57
O R C OH O
+ HO
18
R'
浓硫 酸
O R
+
C O R' O
18
+
H2O
H3C C OH + H O CH2CH3
H
羧酸_精品文档

羧酸简介羧酸是一类化合物,其分子结构中包含一个或多个羧基(—COOH)。
它们是有机化学中的重要物质,被广泛应用于多个领域,如化学、医药、农业等。
本文将介绍羧酸的定义、结构、性质以及一些常见的羧酸及其应用。
定义和结构羧酸由一个羧基(—COOH)和一个或多个有机基团组成。
羧基是由一个碳原子和一个氧原子组成的功能团,被称为羧酸根(—COO^-)或羧离子。
羧酸的通式一般表示为R—COOH,其中R代表有机基团。
羧酸根可以通过去质子化羧酸形成。
去质子化是指在水溶液中羧酸根离子中的一个质子被取走的过程,形成无电荷的羧酸根。
羧酸根离子的带负电荷的氧原子与氢原子结合,形成羧酸分子中的羧基。
羧酸在空气中的化学结构通常是弯曲的,由于羧基螺旋构象的限制,使得羧基无法与羰基平面共面。
性质羧酸具有一些特殊的性质,下面列举了一些常见的性质:1.酸性:羧酸中的羧基可以释放质子(H^+),使其具有酸性。
不同的羧酸酸度不同,取决于羧基中的有机基团的电子效应。
2.水溶性:羧酸中的羧基可以与水分子发生氢键作用,因此大多数羧酸具有良好的水溶性。
3.反应性:羧酸可以发生多种反应,例如与醇发生酯化反应、与胺发生酰胺形成反应等。
这些反应使得羧酸在有机合成中具有广泛的应用。
常见的羧酸及其应用以下是一些常见的羧酸及其在不同领域中的应用:1.乙酸(醋酸):乙酸是最简单的羧酸,由于其良好的水溶性和低毒性,广泛应用于食品工业和制药工业中。
2.氨基乙酸(甘氨酸):甘氨酸是一种重要的氨基酸,在生物学中起着重要的作用,如合成蛋白质和调节代谢等。
3.氟乙酸:氟乙酸是一种强酸,常用于有机合成反应中作为催化剂和酸催化剂。
4.柠檬酸:柠檬酸是一种常见的酸味剂,广泛应用于食品和饮料工业中。
5.沙拉酸:沙拉酸是一种混合酸,常用于电镀工业中作为金属表面处理的蚀刻剂。
结论羧酸作为有机化学中的重要物质,具有丰富的结构和性质。
它们在化学、医药、农业等领域中扮演着重要的角色,并具有广泛的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节 羧酸 酯[课标要求]1.了解羧酸和酯的组成和结构特点。
2.了解羧酸的分类及乙酸的物理性质、酯的物理性质及存在。
3.掌握乙酸和乙酸乙酯的结构特点和主要性质,理解乙酸的酯化反应和乙酸乙酯水解反应的基本规律。
4.掌握羧酸和酯之间的相互转化,学会其在合成与推断中的应用。
1.羧酸是由烃基与羧基相连构成的有机化合物,其官能团是羧基(—COOH)。
2.酯化反应的实质是羧酸脱羟基醇脱氢,乙酸、乙醇发生酯化反应的化学方程式为CH 3COOH +C 2H 5OH浓H 2SO 4△CH 3COOC 2H 5+H 2O 。
3.乙酸乙酯在酸性条件下的水解是可逆的,生成乙酸和乙醇。
乙酸乙酯在碱性条件下的水解是不可逆的。
反应生成乙酸钠和乙醇,反应的化学方程式为CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH 。
4.羧酸与同碳原子的酯互为同分异构体。
如C 4H 8O 2属于羧酸的结构有2种,属于酯的结构有4种。
羧酸的概述1.羧酸的概念及分类(1)概念:由烃基和羧基相连构成的有机化合物。
(2)通式:R —COOH(或C n H 2n O 2),官能团为—COOH 。
(3)分类:①按分子中烃基的结构分类:羧酸⎩⎪⎪⎨⎪⎪⎧脂肪酸⎩⎪⎨⎪⎧低级脂肪酸:如乙酸:CH 3COOH 高级脂肪酸⎩⎪⎨⎪⎧ 硬脂酸:C 17H35COOH 软脂酸:C 15H 31COOH油酸:C 17H 33COOH 芳香酸:如苯甲酸:,俗名安息香酸②按分子中羧基的数目分类:羧酸⎩⎪⎨⎪⎧一元羧酸:如甲酸HCOOH ,俗名蚁酸二元羧酸:如乙二酸HOOC —COOH ,俗名草酸多元羧酸:如柠檬酸2.甲酸的结构与性质 (1)结构特点 结构式甲酸分子结构比较特殊,不但有羧基结构,也有醛基结构,是一个具有双重官能团的化合物。
(2)化学性质①具有羧酸的性质:酸性、能发生酯化反应。
②具有醛类的某些性质:能发生银镜反应,能与新制Cu(OH)2悬浊液反应。
[特别提醒](1)能发生银镜反应的物质含有醛基,但不一定属于醛,如甲酸、甲酸酯、葡萄糖。
(2)甲酸和新制Cu(OH)2反应,加热则发生氧化反应,若不加热则发生中和反应。
(3)硬脂酸、软脂酸是乙酸的同系物,而油酸不是乙酸的同系物。
1.下列物质中,不属于羧酸类的是( ) A .乙二酸 B .苯甲酸 C .硬脂酸D .石炭酸解析:选D 要确定有机物是否为羧酸,关键看有机物中是否含有羧基,由于石炭酸中无羧基,故不属于羧酸。
2.将—CH 3、—OH 、—COOH 、四种原子团两两组合,所得化合物的水溶液呈酸性的共有( )A .3种B .4种C .5种D .6种解析:选B 将四种原子团两两组合,可以得到(CH 3OH 、乙酸的结构与性质1.分子组成和结构CH 2.物理性质3.化学性质(1)酸性——具有酸的通性 乙酸的电离方程式为CH 3COOHCH 3COO -+H +。
乙酸的酸性比碳酸强,可与活泼金属、碱、碱性氧化物及某些盐发生反应。
(2)酯化反应如乙酸与乙醇的反应:[特别提醒](1)羧基是一个整体,并非与—OH的简单相加,即羧基的性质并不是性质与—OH性质之和。
(2)可与H2加成,而与H2不能发生加成反应。
(3)乙酸与乙醇的酯化反应为可逆反应,反应物的转化率小于100%。
1.如何通过实验证明乙酸、碳酸、苯酚的酸性强弱?提示:实验装置如图所示。
乙酸与Na2CO3反应,放出CO2气体,说明乙酸的酸性比碳酸强;将产生的CO2气体通入苯酚钠溶液中,生成苯酚,溶液变浑浊,说明碳酸的酸性比苯酚强。
反应的化学方程式如下:2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2OCO2+H2O+C6H5ONa―→C6H5OH+NaHCO3。
2.在乙酸与乙醇的酯化反应中,浓硫酸的作用是什么?提示:作催化剂和脱水剂。
3.用什么方法证明乙酸发生酯化反应时断裂C—O 键?提示:使用同位素示踪法探究乙酸酯化反应中可能的脱水方式。
在乙酸乙酯中检测到了同位素18O,证明乙酸与乙醇在浓硫酸作用下发生酯化反应的机理是“酸脱羟基,醇脱氢”。
1.含羟基的几种物质活泼性比较2.酯化反应的原理及类型(1)反应机理羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。
(2)基本类型①一元醇与一元羧酸之间的酯化反应。
CH3COOH+C2H5OH浓硫酸△CH3COOC2H5+H2O②二元羧酸与一元醇之间的酯化反应。
HOOC—COOH+2C2H5OH浓硫酸△C2H5OOC—COOC2H5+2H2O③一元羧酸与二元醇之间的酯化反应。
2CH3COOH+HOCH2CH2OH浓硫酸CH3COOCH2CH2OOCCH3+2H2O△④二元羧酸与二元醇之间的酯化反应。
此时反应有两种情况:HOOCCOOCH2CH2OH+H2O a.HOOCCOOH+HOCH2CH2OH浓硫酸△⑤羟基酸的自身酯化反应。
此时反应有两种情况[以乳酸( )为例]:1.下列事实能说明碳酸的酸性比乙酸弱的是()A.乙酸能发生酯化反应,而碳酸不能B.碳酸和乙酸都能与碱反应C.乙酸易挥发,而碳酸不稳定易分解D.乙酸和Na2CO3反应可放出CO2解析:选D能说明碳酸的酸性比乙酸弱的事实,是碳酸盐和乙酸反应生成碳酸,碳酸分解放出CO2。
2.在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的有机物和足量的NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则此有机物可能是()B.HOOC—COOHC.HOCH2CH2OH D.CH3COOH解析:选A Na既能与羟基反应,又能与羧基反应。
NaHCO3只与羧基反应,不与羟基反应,因此,能使生成的CO 2和H 2的量相等的只有A 项。
酯的结构与性质1.组成和结构(1)酯是羧酸分子羧基中的—OH 被—OR ′取代后的产物,简写为,R 和R ′可以相同,也可以不同。
其中R 是烃基,也可以是H ,但R ′只能是烃基。
(2)羧酸酯的官能团是。
(3)饱和一元羧酸C n H 2n +1COOH 与饱和一元醇C m H 2m +1OH 生成酯的结构简式为C n H 2n+1COOC m H 2m +1,故饱和一元酯的通式为C n H 2n O 2(n ≥2)。
(4)命名:根据生成酯的酸和醇命名为某酸某酯,如CH 3COOCH 2CH 3乙酸乙酯,HCOOCH 2CH 3甲酸乙酯。
2.酯的性质酯一般难溶于水,主要化学性质是易发生水解反应,其条件是酸催化或碱催化,有关化学方程式:(1)酸性条件: CH 3COOC 2H 5+H 2O 稀硫酸△CH 3COOH +C 2H 5OH 。
(2)碱性条件:CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH 。
[特别提醒](1)分子式相同的羧酸、酯、羟基醛、羟基酮互为同分异构体。
(2)酯的水解反应是酯化反应的逆反应,酯化反应生成的键,在水解时要断裂。
(3)酯在酸性条件下的水解为可逆反应,而在碱性条件下的水解趋于完全。
1.乙酸乙酯在NaOH 溶液中共热,得到的产物是( ) ①乙酸钠 ②甲醇 ③乙醇 ④乙酸 A .①② B .②③ C .①③D .③④解析:选C 乙酸乙酯在NaOH 溶液中共热发生水解生成乙醇和乙酸钠。
2.某有机物的结构是关于它的性质的描述正确的是()①能发生加成反应②能溶解于NaOH溶液中③能水解生成两种酸④不能使溴的四氯化碳溶液褪色⑤能发生酯化反应⑥有酸性A.①②③B.②③⑤C.仅⑥D.全部正确解析:选D题给有机物含有①酯基;②苯环;③羧基。
因而有酸性,能发生加成反应、中和反应、水解反应、酯化反应,不能使溴的四氯化碳溶液褪色。
3.某中性有机物C8H16O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得M,则该中性有机物的结构可能有()A.1种B.2种C.3种D.4种解析:选B中性有机物C8H16O2在稀酸作用下可生成两种物质,可见该中性有机物为酯类。
由“N经氧化最终可得M”,说明N与M中碳原子数相等、碳骨架结构相同,且N应为羟基在碳链端位的醇,M则为羧酸,从而推知中性有机物的结构有[三级训练·节节过关]1.关于乙酸的下列说法不正确的是()A.乙酸是一种重要的有机酸,是具有强烈刺激性气味的液体B.乙酸分子中含有四个氢原子,所以乙酸是四元酸C.无水乙酸又称冰醋酸,它是纯净物D.乙酸易溶于水和乙醇解析:选B乙酸的结构简式为CH3COOH,甲基(—CH3)不能电离出H+,故乙酸属于一元酸。
2.炒菜时,加酒又加醋,可使菜变得味香可口,原因是()A.有盐类物质生成B.有酸类物质生成C.有醇类物质生成D.有酯类物质生成解析:选D酒中含有乙醇,醋中含有乙酸,二者反应可生成有香味的乙酸乙酯。
3.苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。
苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为。
下列相关说法不正确的是()A.苹果酸在一定条件下能发生酯化反应B.苹果酸在一定条件下能发生催化氧化反应C.1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下)D.1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3解析:选D A.该分子中有羧基和羟基,在一定条件下能发生酯化反应,正确;B.该分子中有醇羟基,在一定条件下能发生催化氧化反应生成酮,正确;C.该分子中有2个羧基和一个羟基,1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下),正确;D.苹果酸中含有2个羧基,1 mol苹果酸与Na2CO3溶液反应,可能消耗1 mol Na2CO3,生成CO2和有机物,错误。
4.下列对有机物的叙述中,错误的是()A.常温下,与NaHCO3溶液反应放出CO2气体B.能发生碱性水解,1 mol该有机物完全反应需要消耗8 mol NaOHC.与稀硫酸共热时,生成两种有机物D.该有机物的分子式为C14H10O9解析:选C该有机物中含有羧基(—COOH),可与NaHCO3溶液反应放出CO2,所以A项正确;该有机物中含5个酚羟基、1个羧基和1个酯基,在碱性条件下水解后又生成1个酚羟基和1个羧基,故1 mol该有机物可中和8 mol NaOH,所以B项正确;与稀硫酸共热时,该有机物水解,生成的是一种物质,C项错误;由题中结构简式可得该有机物的分子式为C14H10O9,D项正确。
5.是一种医药中间体,常用来制备抗凝血药,可通过如下图所示的路线合成:(1)A与银氨溶液反应有银镜生成,则A的结构简式是________________。
(2)B―→C的反应类型是______________。
