反应工程原理(罗康碧,罗明河,李沪萍编著)思维导图
思维导图在化学反应工程教学的运用

思维导图在化学反应工程教学的运用摘要:以Xmind软件绘制的“均相单一反应动力学”和“间歇操作的搅拌槽式反应器”知识点的思维导图为例,展示思维导图在“化学反应工程”教学中构建知识体系、拓展思维、提高学习效率的作用。
关键词:思维导图;化学反应工程;Xmind;教学“化学反应工程”是化工类专业开设的一门综合性、工程性和理论性很强的课程。
课程以工业反应过程为研究对象,研究反应过程的技术优化、反应器设计和一般性规律。
《高等数学》《物理化学》和《化工原理》等课程是这门课程的先修课程。
学习该门课程的主要目的是为设计、开发工业反应装置、掌握反应技术及优化工业反应器操作奠定理论基础。
数学模型法是“化学反应工程”的主要研究方法。
利用数学模型解决工程问题是这门课程最鲜明的特点。
课程综合性强、专业术语多、数学公式繁杂、知识领域广泛,使这门课程公认为难教、难学。
在实际教学中,导致学生学习兴趣不大,学习动力不足。
加之老师在授课时重理论轻实践,教与学的效果大打折扣。
在传统黑板+多媒体教学手段下,如何提高学生学习兴趣和学生参与意识,把学生从被动接受变为主动获取学习状态,是摆在教师面前亟待解决的现实问题。
实践证明,思维导图的应用,可有效提高教学质量,帮助学生掌握“化学反应工程”的理论,提高学生的学习能力。
本文以“均相单一反应动力学和理想反应器”为例,介绍思维导图在课程的具体应用。
一、“化学反应工程”教改现状化学反应工程问题的研究方法主要是数学模型法,研究思路可以概括为:小试研究反应规律;中试研究传递过程规律;利用计算机或其他手段综合反应规律和传递规律,建立数学模型;热模试验检验模型的等效性。
数学模型常常涉及复杂的微积分公式,课程难度大,教学效果不佳。
追其问题根源,课程难度大,课堂授课方法陈旧乏味,学生在教学环节主动参与度不够,自主学习能力欠缺。
教学效果的考核形式单一、教学评价不够全面。
针对化学反应工程传统教学方法中存在的不足,教育工作者也做了很多探索,提出来一些解决办法。
生物反应工程原理ppt课件

• 生物技术(工程)的研究内容:基因工程;酶 工程;细胞工程;发酵工程;生物反应器;生 化分离工程;
11
生物技术的特点
多学科、多技术的结合 生物作用剂(生物催化剂)的参与 目的是建立工业生产过程或进行社会服务,这 一过程称为生物反应过程( bioprocess)
生化反应器
检测控制系统
产物提取与精制
副产物
产物
废弃物 32
(2)生物反应过程的四个组成部分
• ①原材料的预处理及培养基的制备; • ②生物催化剂的制备; • ③生物反应器及反应条件的选择与监控; • ④产物的分离纯化工程;
33
(3)生物反应过程的特点
• ①采用生物催化剂; • ②采用可再生资源为主要原料; • ③反应器; • ④产物提取、纯化较难、复杂
• 1993年,日本学者川濑义矩出版了《生物反应工程基础》一 书;
• 1994年,丹麦学者尼尔森(Nielsen)等编著了《生物反应工 程原理》一书;
• 在此期间,我国学者也编著出版了《生物反应工程原理》( 1990)、《生物工艺学》(1992)、《生化工程》(1993) 和《生化反应动力学与反应器》(1996和1998)等书籍。
生物合成速率≈影响因素(生物体、基质、环境 因素、操作条件等)
以获得目的产物为目的:
• 从微观看 转录与转译速率=(基因量、…….等) 调控速率=(表达速率、酶活力、……等)
19
工程思维方法 Engineering sense method
• Adaptability 生物适应性(或可行性) • Continuity 可持续性 • Fixed quantity of process 过程的量化 • Economy 经济性 • Efficiency 效率 • ……
(人教版)化学选修四思维导图:2-1化学反应速率(含答案)
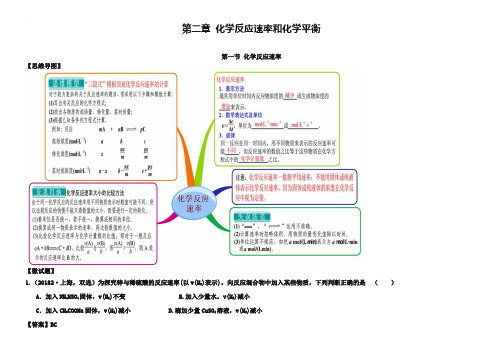
第二章化学反应速率和化学平衡第一节化学反应速率【思维导图】【微试题】1.(20182·上海,双选)为探究锌与稀硫酸的反应速率(以v(H2)表示)。
向反应混合物中加入某些物质,下列判断正确的是()A.加入NH4HSO4固体,v(H2)不变 B.加入少量水,v(H2)减小C.加入CH3COONa固体,v(H2)减小 D.滴加少量CuSO4溶液,v(H2)减小【答案】BC2.(2018海南,双选)对于可逆反应H2(g)+I2(g)2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是()A. H2(g)的消耗速率与HI(g)的生成速率之比为2:1B. 反应进行的净速率是正、逆反应速率之差C. 正、逆反应速率的比值是恒定的D. 达到平衡时,正、逆反应速率相等【答案】BD[:3.(2018·福建卷)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。
下列判断正确的是( )[:A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1【答案】D4.臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是___________和_________。
(填分子式)(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如题表所示。
已知:O3的起始浓度为0.0216 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是___________.②在30°C 、pH=4.0条件下,O 3的分解速率为__________ m ol/(L ·min)。
③据表中的递变规律,推测O 3在下列条件下分解速率依次增大的顺序为______.(填字母代号) a. 40°C 、pH=3.0 b. 10°C 、pH=4.0 c. 30°C 、pH=7.0【答案】(1)O 2 I 2 (2)①OH -; ②1.00×10-4 ; ③b 、a 、c 【解析】本题考察化学反应速率的概念、计算、外界条件对反应速率对影响。
反应工程课件第二章(1)

活性位理论
(1)反应物被分布在催化剂表面上的活性位吸附,成为活性吸附态。 (2)活性吸附态在催化剂的活性位(活性表面)上进行化学反应,生成吸附态产物。 (3)吸附态产物从催化剂活性位上脱附。
2) 固体催化剂的主要组成 固体催化剂一般由活性组分、助催化剂和载
3) 固体催化剂的制备方法
最常用的催化剂制备方法有浸渍法、沉淀法、共混合 法和熔融法。
(1) 浸渍法 将载体放在含有活性组分的水溶液中浸泡,
使活性组分吸附在载体上。如一次浸渍达不到规定的吸附 量,可在干燥后再浸。如要将几种活性组分按一定比例浸 渍到载体上去,常采用多次浸渍的办法。
(2) 沉淀法 在充分搅拌的条件下,向含有催化剂各组
• 催化反应可以分为均相催化和多相催化,反应在同相中进行 称为均相催化;反应在两相界面上进行称为多相催化。
2.1.2 固体催化剂 1) 固体催化剂的作用
催化剂是能够加速化学反应速率而本身 能复原的物质。催化剂有下列性质: (1)产生中间产物,改变反应途径,因而降低反应 活化能和加速反应速率; (2)不能改变平衡状态和反应热; (3)必然同时加速正反应和逆反应的速率; (4)具有选择性,使化学反应朝着期望的方向进行, 抑制不需要的副反应。
• 多种性能不同催化剂的开发促使同一产品在反应器、生产流 程甚至生产方法和原科方面都发生了根本性的变革,使产品 的投资、原料消耗等技术经济指标不断优化,同时环境污染 不断减少。在通常条件下难以获得的化学产品可以通过催化 作用实现工业生产,催化是现代化学工业的基石。
• 同一种反应物系,使用不同的催化剂可以得到不同的产品。 例如乙烯氧化使用银催化剂 可得环氧乙烧;乙烯氧化使用 钯系催化剂可得乙酸;但这两个过程的主要副反应都是深度 氧化生成二氧化碳和水。另一方面,使用同一系列的催化剂 ,也可使不同的反应物系发生催化作用。例如使用银系固体 催化剂,可使甲醇氧化制甲醛,乙醇氧化制乙醛,乙烯氧化 制环氧乙烷,乙二醇氧化制乙二醛。
《反应工程整》课件

随着环保意识的提高,反应工程需要 更加注重环保,减少废气、废水和固 废的产生,降低能耗和资源消耗,实 现绿色生产。
新型反应器的研发与优化
01
新型反应器的研究
针对特定反应过程,研究开发新型反应器,以提 高反应效率和产物收率。
02
反应器的优化
通过对现有反应器的优化改造,提高其性能和效 率,降低能耗和物耗,实现可持续发展。
《反应工程整》ppt 课件
目录
• 反应工程概述 • 反应工程的基本原理 • 反应工程的应用领域 • 反应工程的前沿技术 • 反应工程的挑战与展望 • 案例分析
01
反应工程概述
定义与特点
定义
反应工程是研究化学反应和相关传递过程在工业 反应器中的集成和优化的一门科学。
特点
反应工程注重化学反应与传递过程的相互影响, 强调工业反应器的实际应用,涉及范围广泛,包 括化学、物理、数学等多个领域。
详细描述
对某环保处理技术的反应过程进行分析,研究反应机理、 反应动力学以及传递特性对处理效果的影响。通过分析反 应过程,发现反应条件和工艺参数的优化空间,为提高处 理效果提供指导。
总结词
工艺参数优化
总结词
处理效果评估
详细描述
对优化后的环保处理技术进行实际应用和效果评估。通过 对比优化前后的处理效果数据,发现优化方案显著提高了 处理效率和降低了能耗,证明了优化的效果。
反应工程的历史与发展
01 历史回顾
反应工程的发展可以追溯到20世纪初,随着化学 工业的快速发展和科学技术的不断进步,反应工 程逐渐成为一门独立的学科。
02 当前发展
当前,反应工程的研究领域不断扩大,涉及的新 技术和新方法也不断涌现,如计算流体力学、人 工智能等在反应工程中的应用越来越广泛。
生物反应工程原理 PPT课件

dc k2 (a0 c)(b0 c) dt
式中:k2——二级反应速率常数; a0,b0——底物A和底物B的初始浓度; c——t时产物C的浓度。 (9-3)式积分可得
b ( a c) 1 ln 0 0 k 2t a0 b0 a0 (b0 c)
对连锁酶促反应过程,如ABC,有
(9-24)
式中:kL——液膜传质系数; a——传质比表面积; [S]———液体主体中的底物浓度; [S]s——固定化酶表面处底物浓度。 稳定状态下,传质速率等于酶促反应速率。当反应遵循米氏方程规则时,则
N s kL a([S ] [S ]s )
rmax[S ]s K m [ S ]s
酶促反应的特征
酶的催化作用具有专一性、酶的催化作用条件温和、对环境条件极为敏感、 催化效率极高等特征。酶具有降低反应活化能的能力,所有更多的底物将有足 够的能量来形成产物。尽管平衡常数不变,在酶存在时平衡更迅速达到。 对于酶降低反应的活化能的机制有两种模型。一种是契合模型,即酶和底 物通过特异性结合位点精确的契合在一起,形成一个酶-底物复合物进行酶促反 应,也称为锁-钥匙模型。另一种是酶与底物结合时,能改变自身形状,使其活 性中心包围底物并精确地与其结合,此种机制被称为诱导配合模型。当底物分 子相互接触发生反应时,底物与酶先形成一个中间产物,即是将底物分子活化 的过程,活化分子越多反应就越快,然后中间产物再分解得到产物。
d[ S ] rmax dt
式中:[S]——底物浓度; rmax——最大反应速率。 当反应速率与底物浓度的一次方成正比,称为一级反应,即酶催化AB的 过程
db k1 (a0 b) dt
式中:k1——一级反应速率常数; a0——底物A的初始浓度; b——t时产物B的浓度。
模块复习 《化学反应原理》核心知识结构图

模块复习一、《化学反应原理》核心知识结构图键能/kJ·mol—1436 946 393 298K时氮气跟氢气反应的热化学方程式正确的是A.N2(g)+3H2(g)===2NH3(g) △H=—104kJ·mol—1B.N2+3H2===2NH3△H=—104kJ·mol—1C.N2(g)+H2(g)===NH3(g) △H=+989kJ·mol—1D.N2(g)+3H2(g)===2NH3(g) △H=+989kJ·mol—1(二)盖斯定律的应用2.100g C不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:C(s)+ 12O2(g)═ CO(g)△H = -110.35 k J·mol-1CO(g)+ 12O2(g)═ CO2(g)△H = -282.57 k J·mol-1与这些碳完全燃烧相比,损失的热量为A.39.292 kJ B.3274.3 kJ C.784.92 kJ D.2489.44 kJ(三)原电池的工作原理,书写化学电源的电极反应式,金属的电化学腐蚀3.关于原电池的叙述中,错误的是A.构成原电池正极和负极的必须是两种不同的金属B.原电池是将化学能转化为电能的装置C.在原电池中,电子流出的一极是负极,发生氧化反应D.原电池放电时,电流的方向是从负极到正极4.右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2 =2CO2 +4H2O 。
下列说法正确的是:A.左电极为电池的负极,a处通入的物质是甲醇B.右电极为电池的负极,b处通入的物质是空气C.负极反应式为:CH3OH +H2O-6e—=CO2 +6H+D.正极反应式为:O2 +2H2O +4e—=4OH―5.以下现象与电化腐蚀无关的是A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎为纯铁)容易生锈C.铁质器件附有铜质配件,在接触处易生铁锈D.银质奖牌长期放置后在其奖牌的表面变暗(四)电解原理及电极反应式的书写6.用铂作电极电解一定浓度的下列物质的水溶液。
