分子立体结构
分子的立体构型

目前二十五页\总数七十九页\编于十七点
值得注意的是价层电子对互斥模型 只能解释化合物分子的空间构形,却 无法解释许多深层次的问题。
为了解决这一矛盾,鲍林提出了杂
化轨道理论
目前二十六页\总数七十九页\编于十七点
三、杂化轨道理论简介----鲍林
1、杂化:杂化是指在形成分子时,由于原子的相 互影响,若干不同类型能量相近的原子轨道混杂起 来,重新组合成一组新的原子轨道。这种重新组 合的过程叫做杂化,所形成的新的轨道称为杂化轨 道。
目前十页\总数七十九页\编于十七点
孤电子对的计算 =½(a-xb)
分子或 中心原 a
x
b
离子 子
H2O
O
6
1
2
SO2
S
6
2
2
NH4+
N
5-1=4
4
1
CO32- C
4+2=6
3
2
中心原子 上的孤电 子对数
2
1
0
0
目前十一页\总数七十九页\编于十七点
二、价层互斥理论
剖析内容
排斥力最小
对ABn型的分子或离子,中心原子A价层电子对(包括
优选分子的立体构型
目前一页\总数七十九页\编于十七点
所谓“分子的立体构型”指多原子构成的共 价分子中的原子的空间关系问题。
在O2、HCl这样的双原子分子中不存在分子
的立体结构问题。
O2
HCl
目前二页\总数七十九页\编于十七点
一、形形色色的分子
1、三原子分子立体结构
CO2
直线形
180°
H2O
V形 105°
“混杂”起来,形成能量相等,成份相同的四个sp3杂 化轨道,然后四个sp3杂化轨道上的电子间相互排 斥,使四个sp3杂化轨道指向空间距离最远的正四面 体的四个顶点,碳原子四个sp3杂化轨道分别与四个 氢原子的1s轨道形成四个相同的sp3键,从而形成 CH4分子。由于四个C-H键完全相同,所以形成的CH4 分子为正四面体,键角为109°28 ′
第二节 分子的立体结构

BeCl2的成键情况
2p 2p
2p
sp杂化
Be:
2s
激发 2s
sp
Cl
Be
Cl
Cl
我们知道乙炔的结构式为
Be
Cl
乙炔的结构式:
H
C
C
H
每个碳原子的另一个 sp轨道则各与一个氢原子的 1s轨道重叠形成一个 sp-s б 键 p轨道则与另一个碳原子的两个未 杂化的 p以肩并肩的形式重叠形成两个 πsp-sp 键。б 键,每个碳原子相互垂直未杂化的 两个碳原子的 也与两个 sp杂化轨道垂直的 sp杂化轨道重叠形成一个 p轨道。 乙炔分子中每个碳原子都与 CO2 分子中碳原子一样采取 sp杂化形成两个在一条直线上的 sp杂化轨道,并留下两个相互
价层 电子对数 VSEPR 模型 VSEPR 直线形 模型名称 中心原子杂 化轨道类型 典型例子
2
sp
CO2
原子轨道以哪种方式杂化能得到两个在一条直线上的杂化轨道呢? 形成的分子,两个原子形成的分子一定是直线形的。所以价层电子对为 2时,不可能有孤电子对,只能是两个 б 键 原子轨道以哪种方式杂化能得到四个指向四面体四个形顶点的杂化轨道呢? 很好。价层电子对为 价层电子对数为 2时,可不可能含有孤电子对呢?为什么? 2时,一定不会有孤电子对,若有一对孤电子对,另外就只有一个 б 键,也就只能有两个原子 原子轨道以哪种方式杂化能得到三个伸向平面三角形顶点的杂化轨道呢?
第二节 分子的立体构型
二、确实分子立体构型的理论 2、杂化轨道理论 VSEPR模型与中心原子的杂化轨道类型
价层 电子对 VSEPR 模型 VSEPR 直线形 模型名称 中心原子杂 化轨道类型 典型例子
2
3
化学 分子的立体结构

杂化轨道与形成它的原子轨道形状不同,但成键能力强。
杂化轨道与形成它的原子轨道的总数一样。
由1个s轨道和3个p轨道杂化成的轨道称为sp3杂化轨道。 共4个轨道。 由1个s轨道和2个p轨道杂化成的轨道称为sp2杂化轨道。 共3个轨道。 由1个s轨道和1个p轨道杂化成的轨道称为sp杂化轨道。 共2 个轨道。
杂化类型与价层电子对数相关。
σ键 孤 价层 VSEPR 立体构型 杂化 电子对 电子对 电子对 模型名称 名称 轨道类型
BO2-
2
0
NO2- 2
1
ClO2- 2
2
NO3- 3
0
SO32-
3
1
NH4+ 4
0
2
直线形 直线形 sp杂化
3 平面三角形 V形 sp2杂化
4 正四面体形 V形 sp3杂化
3 平面三角形平面三角形 sp2杂化
Cu(OH)2+4NH3·H2O=Cu(NH3)42++2OH-+4H2O
析出的深蓝色晶体为[Cu(NH3)4]SO4·H2O
深蓝色是由于存在[Cu(NH3)4]2+
Cu(NH3)42+的构造如下:
↓NH3
2+
H3N→C↑u←NH3
NH3
实验2-3
向盛有氯化铁溶液的试管中滴加1滴硫氰化钾〔KSCN〕 溶液,观察并记录现象。
σ键电子对=中心原子所连原子数
孤电子对=
1 2
(a-xb)
a为中心原子的价电子数;
x为中心原子结合的原子数;
分子立体构型、结构与种类

CH3OH
资料卡片: 形形色色的分子 C60
C20
C40 分子的立体构型、结构和种类
C70
分子的立体构型、结构和种类
分子的立体构型、结构和种类
思考:
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
分子的立体构型、结构和种类
直线形 V形
二、价层电子对互斥理论(VSEPR)- 预测分子的立体结构
价层电子对数
2
3
4
VSEPR模型
直线形 平面三角形
四面体形
5
三角双锥形
6
正八面体形
分子的立体构型、结构和种类
n
2
3
4
价
电
直线 平面三 正四面体
子 对
180 角形 109°28′
0
1200
空
间
M
构
M
M
型
分子的立体构型、结构和种类
(1)如果中心原子无孤电子对,则分子立体
构型与VSEPR模型相同
ABn(n为B原子数) 分子立体构 价层电子对数 型(VSEPR同)
三氟化硼、碳酸根离子、硫酸根离子、硝酸根 离子、甲烷、铵根离子、五氯化磷、六氟化硫
分子的立体构型、结构和种类
4.价层电子对互斥模型(VSEPR模型) 基本要点
分子(或离子)的中心原子周围的价 电子对的几何构型,主要取决于价电 子对数,价电子对尽量远离,使它们 之间斥力最小。
分子的立体构型、结构和种类
2p
sp
两个sp杂化轨道
分子的立体构型、结构和种类
sp杂化轨道的形成过程
z
z
180°
z
z
y
y
分子的立体构型(VSEPR)

第二节 分子的立体结构
共价键
复习回顾
σ键 成键方式 “头碰头”,呈轴对称
π键 成键方式 “肩并肩”,呈镜像对称
键参数
键能
衡量化学键稳定性
键长 键角 描述分子的立体结构的重要因素
一、形形色色的分子
思考:在O2、HCl这样 的双原子分子中存在
分子的立体结构问题
吗?何谓“分子的立
三原子分子
分子 的立 四原子分子 体结
构
直线 形,如CO2 V 形,如H20
平面三角 形,如HCHO、BF3
三角锥 形,如NH3
五原子分子——— 最常见的是正四面体形,如CH4
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
直线形 V形
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
体结构”?
O2
HCl
H2O
CO2
所谓“分子的立体结 构”指多原子构成的 共价分子中的原子的 空间关系问题。
C2H2
CH2O
COCl2
NH3
P4
CH4
CH3CH2OH CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
分子的立体结构是怎样测定的?
测分子体结构:红外光谱仪→吸收峰→分析。
型
分子的立体结 构模型
分子 的空
间构 型
CO2
20
2
直线形
直线形
SO2
21
3
SO3
30
3
PCl3
31
4
H2S
22
4
选修3第二章第2节《分子的立体结构》教案

选修3第二章第2节《分子的立体结构》教案教学目标:1.了解分子的立体结构及其对物质性质的影响。
2.学会运用VSEPR模型预测分子的立体结构。
3.能够运用杂化轨道理论解释分子的立体结构。
教学重点:1.分子的立体结构及其对物质性质的影响。
2.VSEPR模型预测分子的立体结构。
3.杂化轨道理论解释分子的立体结构。
教学难点:1.VSEPR模型的理解和应用。
2.杂化轨道理论的理解和应用。
教学准备:1.PPT课件2.教学模型3.分子模型教学过程:一、导入1.通过展示一些具有不同立体结构的分子模型,引发学生对分子立体结构的兴趣。
2.提问:你们知道分子的立体结构对物质性质有什么影响吗?二、新课讲解1.讲解分子的立体结构及其对物质性质的影响a.分子的立体结构是指分子中原子的空间排列方式。
b.分子的立体结构对物质的性质,如熔点、沸点、溶解性等有着重要影响。
2.讲解VSEPR模型预测分子的立体结构a.介绍VSEPR模型的原理和步骤。
b.通过实例演示如何运用VSEPR模型预测分子的立体结构。
3.讲解杂化轨道理论解释分子的立体结构a.介绍杂化轨道理论的基本概念。
b.通过实例演示如何运用杂化轨道理论解释分子的立体结构。
三、案例分析1.分析案例一:水分子H2O的立体结构a.运用VSEPR模型预测H2O的立体结构。
b.运用杂化轨道理论解释H2O的立体结构。
2.分析案例二:氨分子NH3的立体结构a.运用VSEPR模型预测NH3的立体结构。
b.运用杂化轨道理论解释NH3的立体结构。
四、互动环节1.学生分组,每组选择一个分子,运用VSEPR模型和杂化轨道理论预测和解释其立体结构。
2.各组汇报成果,其他组进行评价和讨论。
六、作业教学反思:本节课通过讲解和案例分析,让学生了解了分子的立体结构及其对物质性质的影响,学会了运用VSEPR模型和杂化轨道理论预测和解释分子的立体结构。
在教学过程中,要注意引导学生积极参与,培养学生的动手能力和思维能力。
(完整版)分子立体结构

学生阅读P37-39页,分组讨论完成学案, 然后总结中心原子孤电子对数、价层电子对 数的计算方法。
3、如何确定价层电子对数
以ABn型分子为例
中心原子:A 价层电子对= σ键电子对+中心原子的孤电子对 σ键电子对=n 中心原子的孤电子对=(a-xb ±离子电荷数)/2
阳离子应减去电荷数,阴离子应加上电荷数 a:中心原子价电子数 X:中心原子结合的原子数(即ABn中的 n) b=8-该原子的价电子数(氢为1)(注意是B原子的)
2、分子的立体结构—— 成键电子对间的空间构型
(1)中心原子价电子全部用于成键时:
电子对的空间构型和分子的立体结构相同 例1:BeCl2
电子对的空间构型为直线型 分子的立体结构为直线型
2、分子的立体结构—— 平面三角形
分子的立体结构为平面三角形
2
2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子 式、结构式及分子的空间结构:
分子
电子式 结构式
:: -O:: = :: -
:: : :
CO2
:O::C::O: O=C=O
H2O
H :O :H
H-O-H
NH3
H:N :H H
H-N-H H
CH2O
H:C :H O
H-C-H
CHH4 H:C :H
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
直线形
V形
同为四原子分子,CH2O与 NH3 分 子的的空间结构也不同,什么原因?
平面 三角形
三角锥形
探究与讨论:
1、写出H、C、N、O等原子的电子式:
原子
H
C
N
电子式
H·
分子的立体结构

银氨溶液的配制 AgOH↓ Ag++ NH3·H2O = AgOH↓+ NH4+ 白色沉淀 AgOH+2NH3·H2O = [Ag(NH3)2]++ OH-+2H2O 二氨合银离子 Fe3+的检验 Fe3+ + SCN- = [Fe(SCN) ]2+ 血红色 黄色 (n=1Fe3+ + nSCN- = [Fe(SCN)n ]3-n (n=1-6) 冰晶石(六氟合铝酸钠) 冰晶石(六氟合铝酸钠):Na3[AlF6] 黄血盐: 黄血盐:K4[Fe(CN)6] 赤盐: 赤盐:K3[Fe(CN)6]
金属阳离子/ 金属阳离子/过渡金属原 子/高价态非金属元素
中心原子/离子 中心原子/
注意: 注意:配位共价键和正常共价键只是在形成过程上 存在不同,一旦形成之后两者是完全等价的。 存在不同,一旦形成之后两者是完全等价的。
配位物:通常把金属离子(或原子)与某些分子或 配位物:通常把金属离子(或原子) 离子以配位键结合形成的化合物称为配位化合物, 离子以配位键结合形成的化合物称为配位化合物, 简称配合物。 简称配合物。 常见的配合物: 常见的配合物: [Cu(H2O)4]2+ 四水合铜离子 2+ H 2O ↓ H2O→Cu←OH2 ↑ H 2O 天蓝色
马桥中学
刘于侯
一、形形色色的分子 化学式 CO2 结构式 比例模型 球棍模型 立体构型 直线形
H2O
V形 形
CH2OLeabharlann 三角形化学式 NH3
结构式
比例模型
球棍模型
立体构型 三角锥形
CH4 正四面体 C2H4 平面四边 形 思考:根据以上分子的立体构型,推测CS 思考:根据以上分子的立体构型,推测CS2、H2S、PH3、 PCl3、 CCl4 、SiH4、 COCl2分子的立体构型。 分子的立体构型。
第二节 分子的立体结构

SO2 O
S O
S
V形 O
O
思考与交流
化学式
结构式
ቤተ መጻሕፍቲ ባይዱVSEPR
分子或离子 的立体结构
BF3
F B
F F
F B F 平面 三角形
F
小结: NH3 H H3O+ H O H
+
孤对电子
+ O
H
H
三角锥形
H
中心原子周围的原子与孤对电子的对 数加起来为4,它们形成四面体结构,一 对孤对电子占据一个顶点。 在共价分子中,如果中心原子化合价的绝 对值等于其最外层电子数,则一般无孤对电子。
CH4 CCl4 SiH4
价层电子对互斥理论
电子 成键 对数 对数 2 2 3 孤对电 电子对空 子数 间构型 0 直线 0 1 0 1 2 四面体 三角形 分子空间 构型 直线 三角形 V形 四面体 三角锥 V形 实例 BeCl2
BF3
SnCl2 CH4 NH3 H2O
3
2 4
4
3 2
(2) 中心原子周围的原子与孤对电子的 对数加起来为4,它们形成四面体结构,一 对孤对电子占据一个顶点。 2、杂化轨道的基本要点
NH3
N H H H
107°
3、五原子分子的可能立体结构更多,
最常见的是正四面体形
化学式 结构式 键角 分子立体 结构模型
CH4
109°28′
4、形形色色的分子
这种立体结构,是由 二、价层电子对互斥模型(VSEPR) 于分子中的价电子对 这种模型把分子分成以下两大类: 互相排斥的结果。
(1)中心原子上的价电子都用于形成共价键,它 们的立体结构可用中心原子周围的原子数n来预测
ABn
分子的立体构型
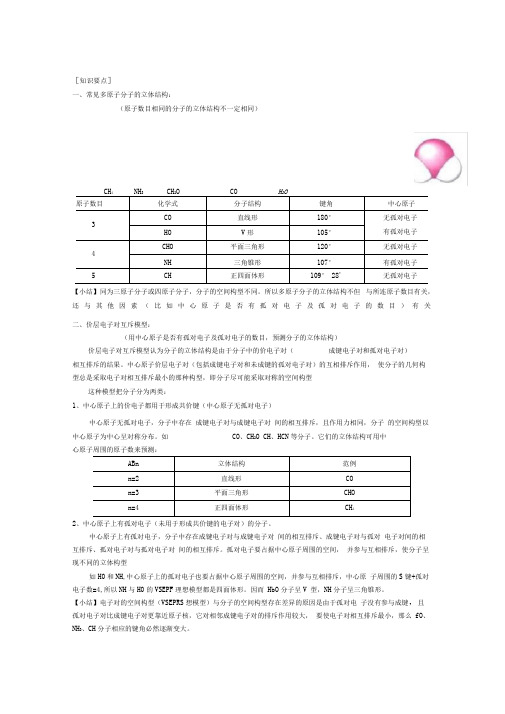
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)43 22原子数目化学式分子结构 键角中心原子 3CO直线形180° 无孤对电子 HO V 形105° 有孤对电子 4CHO 平面三角形 120° 无孤对电子 NH三角锥形 107° 有孤对电子 5CH正四面体形109° 28'无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但 与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关 二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用, 使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在 成键电子对与成键电子对 间的相互排斥,且作用力相同,分子 的空间构型以中心原子为中心呈对称分布。
如 CO 、CH 2O CH 、HCN 等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn 立体结构 范例n=2 直线形 CO n=3 平面三角形 CHO n=4正四面体形CH 42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对 间的相互排斥、成键电子对与孤对 电子对间的相互排斥、孤对电子对与孤对电子对 间的相互排斥。
孤对电子要占据中心原子周围的空间, 并参与互相排斥,使分子呈现不同的立体构型如H0和NH ,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原 子周围的S 键+孤对电子数=4,所以NH 与H0的VSEPF 理想模型都是四面体形。
人教版化学选3第二章 第二节 分子的立体结构

对ABn型分子,B围绕A成键,则A为中心原子,n 值为中心原子结合的原子数。
-
平面 正 三角形 四面体
3)填写孤对电子与分子的空间构型关系,中心原子 结合的原子数(n值)与分子的空间构型关系。
中心无孤对电子
代表物
中心原子含孤对电 子对数
0 0 0 2 1
:O::C::O:
H .. .. H C O .. H H : C :H H .. . . ..
V
分子
表 的立 格 一 四原子分子
平面三角 形,如HCHO、BF3
体结
三角锥
形,如NH3
构
五原子分子——— 最常见的是正四面体 形,如CH
4
★☆★通过填表,你能发现什么问题?
探究:同为三原子分子,CO2 和 H2O 分子的空间
结构却不同,同为四原子分子,CH2O与 NH3 分子 的空间结构也不同,什么原因?
: : : : : :
H 2O
NH3
中心存在孤对电子 3 107°
2
105°
V形
三角锥形
二、价层电子对互斥模型
(VSEPR模型)
1、内容:中心原子价电子层电子对(包括__ 成键( σ键) _ 电子对和 未成键 的孤对电子对) 的互相 排斥 作用,使分子的几何构型总是采 取电子对相互 排斥最小 的那种构型,即分子 尽可能采取对称的空间构型。
无孤对电子 CH2O CH4 H2O NH3
AB3 平面三角形 AB4 AB2 AB3 正四面体 V形 三角锥形
有孤对电子
应用反馈:
化学式 HCN 中心原子 孤对电子数 中心原子结 合的原子数 空间构型 直线形
三角锥形
SO32NH2- BF3 H3O+ SiCl4 CHCl3 NH4+
分子的立体构型
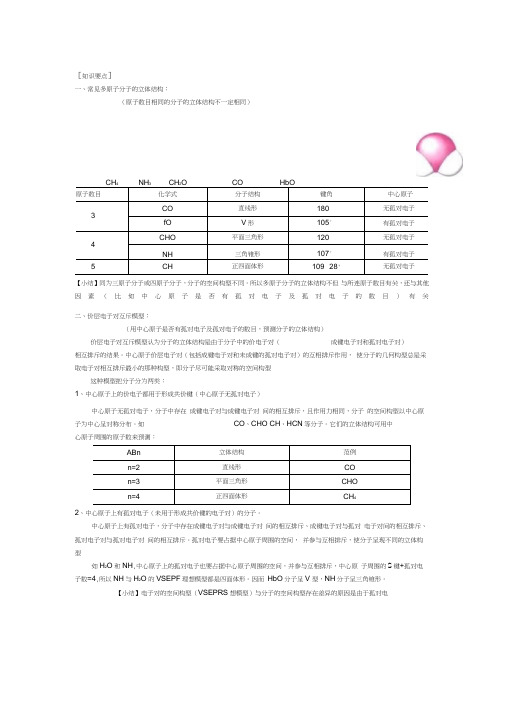
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)CH4 NH3 CH2O CO HbO原子数目化学式分子结构键角中心原子3CO直线形180°无孤对电子fO V形105°有孤对电子4CHO平面三角形120°无孤对电子NH三角锥形107°有孤对电子5CH正四面体形109° 28' 无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在成键电子对与成键电子对间的相互排斥,且作用力相同,分子的空间构型以中心原子为中心呈对称分布。
如CO、CHO CH、HCN等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn立体结构范例n=2直线形COn=3平面三角形CHOn=4正四面体形CH42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对间的相互排斥、成键电子对与孤对电子对间的相互排斥、孤对电子对与孤对电子对间的相互排斥。
孤对电子要占据中心原子周围的空间,并参与互相排斥,使分子呈现不同的立体构型如H2O和NH,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原子周围的S键+孤对电子数=4,所以NH与H2O的VSEPF理想模型都是四面体形。
分子的立体结构

2、用价层电子对互斥理论推测下列分子的空 间构型: (1)BeCl2 (2)NH3 (3)H2O (4)PCl3 (1)直线形(2)三角锥形(3)V形(4)三角形
3、在BF3、BeF3分子中B、Be原子各用哪几个 原子轨道杂化?形成什么类型的杂化轨道?
B原子参与杂化的原子轨道是一个2s和两个2p, 形成三个sp2杂化轨道;Be原子参与杂化的原子 轨道是一个2s和一个2p,形成两个sp杂化轨道。
sp杂化
sp2杂化
sp杂化和sp2杂化
sp3杂化
5、几种常见分子的中心原子的杂化轨道 类型 sp杂化: BeCl2、CO2 sp2杂化: CH2O、SO2 sp3杂化: NH3、NH4-、H2O
6、杂化轨道只用于形成键或者用来容纳未参与 成键的孤对电子,未参与杂化的p轨道,可用于 形成键。
1、配位键:
在四水合铜离子中,铜离子与水分子之间的化学键 是由水分子提供孤对电子对给予铜离子,铜离子接 受水分子的孤对电子形成的,这类“电子对给予与 接受键”被称为配位键。
2、配位化合物: 金属离子(或原子)与某些分子或离子(称为 配位体)以配位键结合形成的化合物。
向盛有硫酸铜水溶液的试管里加入氨水, 首先形成难溶物,继续添加氨水难溶物 溶解,得到深蓝色的透明溶液;若加入 极性较小的溶剂(如乙醇),将析出深 蓝色晶体。
2、鲍林的“杂化轨道”理论的主要内容是:
当原子形成分子时,它的电子轨道因为受到 其它原子的影响会有所改变,可以把原来的 不同轨道混合起来,组成新的轨道,使其成 键能力增强,从而使所形成的分子更稳定。
3、杂化轨道的过程
杂化轨道认为在形成分子时,通常在激发、杂化和 轨道重叠等过程。如CH4分子的形成过程:碳原子 2s轨道中1个电子吸收能量跃迁到2p空轨道上,这 个过程称为激发,但此时各个轨道的能量并不完全 相同,于是1个2s轨道和3个2p轨道“混合”起来, 形成能量相等、成分相同的4个sp3杂化轨道,然后 4个sp3杂化轨道上的电子间相互排斥,使四个杂化 轨道指向空间距离最远的正四面体的四个顶点,碳 原子的4个sp3杂化轨道分别与4个H原子的1s轨道形 成4个相同的键,从而形成CH4分子。由于C-H键 完全相同,所以形成的CH4分子为正四面体形,键 角是109°28’。
分子的立体结构(杂化轨道理论)

01
02
03
04
sp杂化
一个s轨道和一个p轨道杂化 ,形成两个sp杂化轨道,形
状为直线型。
sp2杂化
一个s轨道和两个p轨道杂化 ,形成三个sp2杂化轨道,形
状为平面三角形。
sp3杂化
一个s轨道和三个p轨道杂化 ,形成四个sp3杂化轨道,形
状为正四面体型。
其他杂化类型
如dsp2、d2sp3等,涉及d轨 道的参与,形成更复杂的分子
指导新材料的设计和合成
通过研究杂化轨道理论,可以深入了解 分子中原子间的相互作用和电子排布规 律,从而揭示分子立体结构的本质。
通过调控分子的立体结构,可以设计 和合成具有特定功能的新材料,如催 化剂、药物、光电材料等。
预测和解释分子的性质
基于杂化轨道理论,可以预测和解释 分子的几何构型、键长、键角以及分 子的物理和化学性质。
预测反应活性
通过了解分子的电子云分布和键能,可以预测分子在化学反应中的 活性和选择性。
指导新材料设计
杂化轨道理论为设计具有特定功能和性质的新材料提供了理论指导。
研究成果与不足
成果
杂化轨道理论在解释和预测分子 的立体结构方面取得了显著成果 ,成功应用于多种有机和无机化 合物的结构和性质研究。
不足
对于某些复杂体系,如过渡金属 化合物和生物大分子,杂化轨道 理论的解释力有限,需要进一步 完善和发展。
分子的立体结构杂化轨道理论
contents
目录
• 引言 • 杂化轨道理论基础 • 分子的立体构型与杂化轨道 • 杂化轨道理论与化学键性质 • 杂化轨道理论与化学反应性 • 总结与展望
01 引言
分子的立体结构概述
分子立体结构的定义
选修三第二节分子立体构型

均为正四面体
因孤电子对数不同故...
思考:为什么实际分子构型中键角不同?
V排SEP斥R模力型立:体结孤构 电子对-孤电子对>孤电子对-成
键电子对>成键电子优对化-成指键导电P子25对
本节内容小结:优化指导P27 作业:教材P39思考与交流
价层电子 VSEPR模型 实际的
分子或离子 对数
的立体结构 立体结
平面三角型
同为四原子分子,HCHO或BF3与
NH3 分子的空间结构也不同,什么原因?
价层电子对互斥理论可以用来解释 或预测分子的立体结构。
二、价层电子对互斥理论(教材P37) 1、分子的立体结构是“价层电子对”相互的排结斥果。
2、价层电子对指 分子中的中心原子上的电子对 , 包括 (σ键电子对+中心原子上的孤。电子对)
孤电子对数为 0,价层电子对数为 4 。
2)VSEPR模型
3)实际的立体构型
教材P44~1 价层电子对数=σ键电子对数
(与中心原子结合的原子数)
分子或离 子
中心原子 上孤电子 对数
σ键电 价层电 VSEP 实际的 子对数 子对数 R模型 立体结
的立体 构 结构
SO2
1
CO2
0
CO32-
0
SO32NH3
21
NH4+
N 5-1=4 4
10
CO32-
C 4+2=6 3
2
0
CO2
C
42
20
SO42-
S 6+2=8 4
20
价层电子对=σ键电子对+中心原子上的孤电子对
分子或离 子
BF3 NH3 SO32H3O+
分子的立体结构和分子的空间结构

分子的立体结构和分子的空间结构
分子的立体结构和分子的空间结构是两个相关的概念,它们都描述了分子中原子在空间中的排列和位置。
分子的立体结构指的是分子中原子的三维排列形式,包括键长、键角、二面角等参数。
分子的立体结构决定了分子的形状和外观,例如直线形、平面形、四面体形等。
分子的空间结构则更侧重于分子中原子的相对位置关系,包括键长、键角、二面角等参数。
分子的空间结构描述了原子在空间中的相对位置和排列,与键结的化学键种类有关。
分子的空间结构也称为分子的几何构型或分子构型。
总之,分子的立体结构和分子的空间结构都是描述分子中原子的排列和位置,但侧重点略有不同。
选修三第二节分子立体构型

3、 σ键电子对数依据
分子式 确定。
H2O中的中心原子为O,O有2对σ键电子对 NH3中的中心原子为N,N有3对σ键电子对 CO2中的中心原子为C,C有2对σ键电子对
4、中心原子上的孤对电子数的确定方法:
中心原子的价电子数 1 中心原子上的孤电子对数= 2 (a-xb) 与中心原子结合的原子数 (即σ键电子对数)
形形色色的分子
C60
C20
C40
C70
那么分子结构又是怎么测定的呢 科学视野—(指导阅读P37) 测定分子结构的现代仪器之一 ——红外光谱仪
测分子体结构:红外光谱仪→呈现的吸收峰 →分析分子立体构型。
确定化学键及官能团的 种类及数目
直线型
V型
同为三原子分子,CO2 和 H2O 分子的
空间结构不同,什么原因?
C:2s22p2
2s
2p
激发
2p
2s
sp3
sp 杂化
3
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状 完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道
。
为了四个杂化轨道在空间尽可能远离,使轨道间的 排斥最小,4个杂化轨道的伸展方向成什么立体构型?
sp杂化轨道的形成过程
z z 180° z z
例如: Sp2 杂化 —— BF3分子的形成
F
B
F
F
B: 1s22s22p1没有3个成单电 子 2p
2s
激发
2s
sp2
2p
sp2杂化
形成3个P— Sp2 σ键
sp3杂化轨道的形成过程
z z z 109°28′ y x x s 轨道与3个p 轨道进行的杂化, 形成4个sp3 杂化轨道。 每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分 每两个轨道间的夹角为109.5°, 空间构型为正四面体型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子 数
数
型及名称 构型及名称
CO2 2
0
直线形
O
C
O
直线形
CO323
SO2 2
O
0
OC
平面三角形 平面三角形
O
1
平面三角形
OS
V形 O
二、价层互斥理论
4.价电子对的空间构型即VSEPR模型应用
分子或 离子
CH4
NH3
H2O
价层电子对 数
4
3
2
孤电子对 VSEPR模 分子的立体
数
型及名称 构型及名称
3
HH
CH4 H :C :H
4
H
CO2 :O::C::O:
2
3
14
4
0
4
2
0
2
价层电子对数 =δ键个数+中心原子上的孤对电子对个数 δ键电子对数 = 与中心原子结合的原子数
2.成键σ键电子对和未成键的孤对电子对
ABn 价层电子对数 =δ键个数+中心原子上的孤对电子对个数
δ键电子对数 = 与中心原子结合的原子数
中心原子上的孤电子对数 =½(a-xb)
a: 对于原子:为中心原子的最外层电子数
(对于阳离子:a为中心原子的 最外层电子数减 去离子的电荷数;对于阴离子: a为中心原子 的最外层电子数加上离子的电荷数) x 为与中心原子结合的原子数 b 为与中心原子结合的原子最多能接受的电子数 (H为1,其他原子为“8-该原子的最外层电子数)
▪ 2、以N和Cl为例,说明如何根据主族元素在 周期表上的位置确定它最多能接受的电子 数。
二、价层电子对互斥理论
2.价层电子对(σ键电子对和未成键的孤对电子对)
代表物 电子式 中心原子结合 σ键电子 孤对电 价层电
原子数
对
子对 子对数
:
: :: : : ::
H2O H :O : H
2
2
2
4
NH3 H :N :H
一、形形色色的分子
1、双原子分子立体结构 (直线形)
O2
HCl
2、三原子分子立体结构 (有直线形和V形)
直线形
CO2 180°
V形
H2O 105°
3、四原子分子立) 体结构(常见的是平面三角形、 三角锥形)
平面三角形
HCHO 120°
三角锥形
NH3 107°
4、五原子分子立体结构 最常见的是正四面体
形
2 1 AB2
平面三角形
BF3
V形
SO2
ABn 型分子的VSEPR模型和立体结构
价
成孤
层 VSEPR 键 对 分子 电子对的排
电
电 电 类型 布方式
子 模型 子 子
立体结构
实例
对
对对
数
数数
直线
2 形 2 0 AB2
直线形
CO2
3
平面 三角
3
0 AB3
形
2 1 AB2
平面三角形
BF3
V形
SO2
价 VSEPR 层 模型 电 子 对 数
测分子立体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
为了探究其原因,发展了许多结构理论。有一 种十分简单的理论叫做价层电子对互斥理论,这 种简单的理论可以用来预测分子的立体结构。
二、价层电子对互斥理论
1.内容
对ABn型的分子或离子,中心原子A价层电子对
(包括成键σ键电子对和未成键的孤对电子对)之 间由于存在排斥力,将使分子的几何构型总是采取 电子对相互排斥最小的那种构型,以使彼此之间斥 力最小,分子体系能量最低,最稳定。
σ键电子对和 孤对电子对
排斥力最小
思考与交流
▪ 1、以S和P为例,说明如何根据主族元素 在周期表上的位置确定它的价电子数。
成键 孤对 分 电子 电子 子 对数 对数 类
型
实例 电方子式对的排布 分子构型
4
4
四面 体
3
0 AB4 1 AB3
正四面体 CH4 三角锥形 NH3
2
2 AB2
V形
H2O
如何确定ABn型分子的立体结构?
1)先确定中心原子A的价层电子对数
价层电子对数= σ键电子对数+中心原子上的孤电子对数
中心原子上的孤电子对数=21 (a-xb)
正四面体
CH4
一、形形色色的分子
5、其它
P4
正四面体 60°
C2H2
直线形 180°
资料卡片: 形形色色的分子 C60
C20
C40
C70
▪ 分子世界如此形形色色,异彩纷呈, 美不胜收,常使人流连忘返。
▪ 那么分子结构又是怎么测定的呢
科学视野—分子的立体结构是怎样测定的?
(指导阅读P37)
早年的科学家主要靠对物质的宏观性质进行系统总结得 出规律后进行推测,如今,科学家已经创造了许许多多测 定分子结构的现代仪器,红外光谱就是其中的一种。
A
二、价层电子对互斥理论
3.价电子对的空间构型即VSEPR模型
电子对数目:2
VSEPR模型: 直线
3
平面三角形
4
正四面体
二、价层电子对互斥理论
中键4心电. 原子VS子 对E的 互PR孤 相模对 排型电 斥应子。用也推—测要—分占子据预的中测立心分体原子模子立型的体必空构须间略,型去并与成
V分S子EP或R模σ型键中电的子孤对电子孤电对子对 VSEPR模 分子的立体
孤电子对的计算 =½(a-xb)
分子或 中心原 a
x
b
离子 子
H2O
O
6
2
1
SO2
S
6
2
2
NH4+
N
5-1=4
4
1
CO32- C
4+2=6 3
2
中心原子 上的孤电 子对数
2
1
0
0
二、价层电子对斥理论
剖析内容
排斥力最小
对ABn型的分子或离子,中心原子A价层电子对
(包括成键σ键电子对和未成键的孤对电子对)之 间由于存在排斥力,将使分子的几何构型总是采取 电子对相互排斥最小的那种构型,以使彼此之间斥 力最小,分子体系能量最低,最稳定。
H
0
正四面体
H
C
H
正四面H体
1
四面体
N
H
H
H 三角锥形
2
四面体
O
H H
V形
ABn 型分子的VSEPR模型和分子立体结构
价
成孤
层 VSEPR 键 对 分子 电子对的排
电
电 电 类型 布方式
子 模型 子 子
对
对对
分子立体结 实 例 构
数
数数
直线
2 形 2 0 AB2
直线形
CO2
3
平面 三角
3
0 AB3
2)确定VSEPR模型的立体结构
▪ 价层电子对数 n与VSEPR模型的立体结构的关系
▪ n=2
n=3
n=4
n=5
n=6
▪ 直线型 平面三角形 四面体 三角双锥体 八面体
3)略去VSEPR模型中心原子上的孤电子对,便得到了实际的 立体结构
