蛋白酶专一性酶切位点的影响因素分析
蛋白酶酶切位点
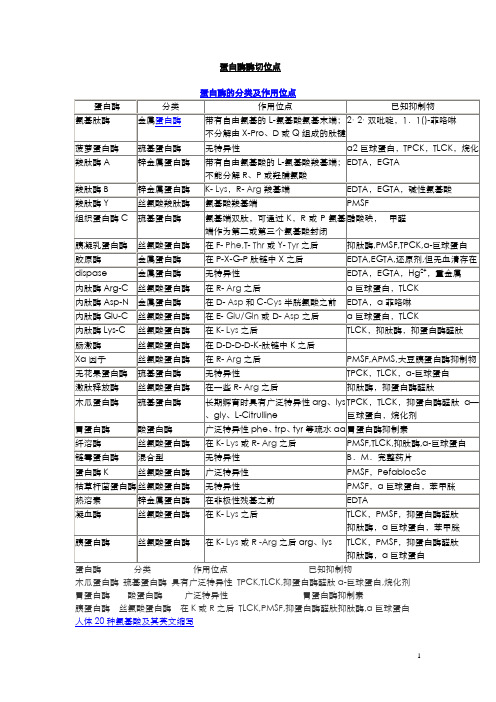
蛋白酶酶切位点木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写名称三字符号单字符号丙氨酸Ala A精氨酸Arg R天冬氨酸Asp D半胱氨酸Cys C谷氨酰胺Gln Q谷氨酸Glu/Gln E组氨酸His H异亮氨酸Ile I甘氨酸Gly G天冬酰胺Asn N亮氨酸Leu L赖氨酸Lys K甲硫氨酸Met M苯丙氨酸Phe F脯氨酸Pro P丝氨酸Ser S苏氨酸Thr T色氨酸Trp W酪氨酸Tyr Y缬氨酸Val V【生化】特异性蛋白酶的酶切位点胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
胰凝乳蛋白酶phe、trp、tyr 等疏水aa。
胃蛋白酶phe、trp、tyr等疏水aa。
木瓜蛋白酶arg、lys。
葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。
碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。
梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。
CNBr断裂Met。
羟胺断裂asn—gly间的肽键。
二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。
木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。
木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。
木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。
木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。
至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。
胶原蛋白酶的作用位点

胶原蛋白酶的作用位点胶原蛋白酶是一类能够降解胶原蛋白的酶,它在生物体内发挥着重要的生理功能。
胶原蛋白是人体最丰富的蛋白质,在维持组织结构和功能方面起着重要作用。
胶原蛋白酶主要作用于胶原蛋白的特定位点,参与细胞外基质的降解和修复等生理过程。
胶原蛋白酶的作用位点主要位于胶原蛋白的多肽链中,这些位点具有特定的氨基酸序列。
胶原蛋白的多肽链由三个α螺旋结构组成,酶切位点通常位于这些α螺旋结构之间。
胶原蛋白酶通过水解胶原蛋白的特定位点,使其断裂并释放出具有生物活性的胶原蛋白片段。
胶原蛋白酶的作用位点可以分为内切位点和外切位点两类。
内切位点是指胶原蛋白酶作用于胶原蛋白多肽链内部的特定位点,使其断裂。
内切位点通常位于两个甘氨酸之间,甘氨酸是胶原蛋白中最富含的氨基酸。
胶原蛋白酶通过水解甘氨酸之间的肽键,使胶原蛋白链断裂并释放出含有活性位点的胶原蛋白片段。
外切位点是指胶原蛋白酶作用于胶原蛋白多肽链的末端或侧链的特定位点,使其断裂。
外切位点通常位于胶原蛋白的氨基或羧基末端,或者位于侧链中的特定氨基酸。
胶原蛋白酶通过水解这些特定位点的肽键,使胶原蛋白链断裂并释放出含有活性位点的胶原蛋白片段。
胶原蛋白酶的作用位点具有一定的特异性。
不同类型的胶原蛋白酶对胶原蛋白的作用位点有所差异。
例如,胰蛋白酶和粒细胞弹性蛋白酶主要作用于胶原蛋白的内切位点,而胶原酶主要作用于胶原蛋白的外切位点。
此外,胶原蛋白酶的作用位点还受到其他因素的调控,如pH值、离子浓度和共存的蛋白质等。
胶原蛋白酶在生物体内发挥着重要的生理功能。
它参与细胞外基质的降解和修复过程,维持组织结构的稳定性和弹性。
胶原蛋白酶还参与了胶原蛋白的合成和降解平衡,对于维持组织的正常功能具有重要意义。
胶原蛋白酶的异常活性与多种疾病的发生和发展密切相关,如关节炎、皮肤老化等。
胶原蛋白酶的作用位点主要位于胶原蛋白的特定氨基酸序列中,通过水解胶原蛋白的特定位点,使其断裂并释放出含有活性位点的胶原蛋白片段。
蛋白酶专一性酶切位点的影响因素分析

蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease Specific CleavageSitesAbstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
tev蛋白酶切位点的dna序列

tev蛋白酶切位点的dna序列
Tev蛋白酶切位点的DNA序列是指Tev蛋白酶可以识别并切割的DNA序列,也被称为Tev切割位点。
Tev蛋白酶是一种常用的内切酶,具有高度特异性和高效性。
Tev蛋白酶的切割位点为5'-G|TATAC-3',其中“|”所示的位置为切割位点。
因此,Tev蛋白酶切割位点的DNA序列为5'-GTTAAC-3'。
Tev蛋白酶的切割位点的序列具有较高的特异性和保守性,因此在进行基因克隆和重组DNA技术时,Tev蛋白酶切割位点的选择非常重要。
在进行DNA片段连接时,通过在DNA的末端引入Tev蛋白酶切割位点,可以使用Tev蛋白酶将DNA 片段剪切开,并通过该切口将不同的DNA片段连接起来。
需要注意的是,Tev蛋白酶切割位点的DNA序列只是其中一种常用的切割位点序列,不同种类的内切酶所识别的切割位点序列也是不同的。
因此,在进行基因克隆和重组DNA技术时,需要选择适合特定目的的内切酶切割位点序列。
蛋白酶专一性酶切位点的影响因素分析汇总

蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease Specific CleavageSitesAbstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
蛋白酶k切割位点

蛋白酶k切割位点
蛋白酶K切割位点是指蛋白酶K能够识别并切割的特定氨基酸序列。
蛋白酶K是一种丝氨酸蛋白酶,它能够切割蛋白质中的丝氨酸残基和苏氨酸残基。
蛋白酶K切割位点的研究对于理解蛋白质的结构和功能具有重要意义。
蛋白酶K切割位点的研究始于20世纪60年代。
当时,科学家们发现蛋白酶K能够切割一些特定的蛋白质,但并不清楚它是如何选择切割位点的。
随着技术的进步,科学家们逐渐发现了蛋白酶K切割位点的规律。
蛋白酶K切割位点通常是由一段特定的氨基酸序列组成。
这段序列通常包含一个丝氨酸残基或苏氨酸残基,以及一些特定的氨基酸。
蛋白酶K能够识别这段序列,并在丝氨酸或苏氨酸残基的侧链上切割。
蛋白酶K切割位点的序列通常被表示为“P1-P1'”,其中P1表示丝氨酸或苏氨酸残基,P1'表示切割位点的下一个氨基酸。
蛋白酶K切割位点的研究对于许多领域都具有重要意义。
例如,在生物技术领域,研究蛋白酶K切割位点可以帮助科学家设计更好的蛋白质表达系统。
在医学领域,研究蛋白酶K切割位点可以帮助科学家理解一些疾病的发生机制,从而开发更有效的治疗方法。
蛋白酶K切割位点是蛋白酶K能够识别并切割的特定氨基酸序列。
研究蛋白酶K切割位点对于理解蛋白质的结构和功能具有重要意义,
也有着广泛的应用前景。
蛋白酶专一性酶切位点地影响因素分析报告

蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease SpecificCleavage SitesAbstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
蛋白酶切位点
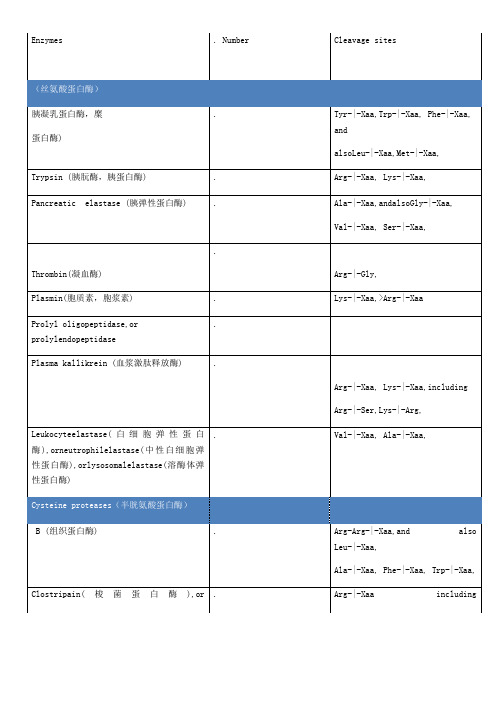
Arg-|-Xaa, Lys-|-Xaa,
AminopeptidaseA,or angiotensinase,or glutamyl-aminopeptidase
.
Glu-|-Xaa>>Asp-|-Xaa,
Dipeptidyl-peptidaseI,or cathepsin(组织蛋白酶)C or J
.
Plasma kallikrein (血浆激肽释放酶)
.
Arg-|-Xaa, Lys-|-Xaa,including
Arg-|-Ser,Lys-|-Arg,
Leukocyteelastase(白细胞弹性蛋白酶),orneutrophilelastase(中性白细胞弹性蛋白酶),orlysosomalelastase(溶酶体弹性蛋白酶)
≠AlaorVal
脑啡肽酶),or enkephalinase(脑啡肽酶),or neutralendopeptidase
.
Xaa-|-Tyr,Xaa-|-Phe, Xaa-|-Trp,and
Xaa-|-Leu,
Thimet oligopeptidase(甲拌磷寡肽 酶),or endo-oligopeptidase A,or endopeptidase(肽链内切 酶),or pz-peptidease(肠促胰 酶素)
.
Xaa-Yaa-|-Zaa,if Xaa≠ArgorLys,or
Yaa ≠Pro,orZaa≠Pro
Dipeptidyl-peptidase IV
.
Preferentially Xaa-Pro-|-Zaa,(but also Xaa-Ala-|-Yaa)withYaa ≠Pro or Hyp
Prolyl tripeptyl-peptidase
蛋白酶的分类及酶切位点
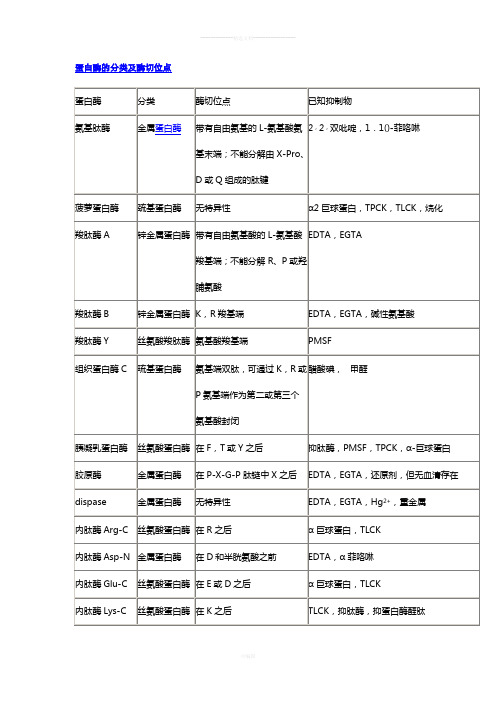
蛋白酶的分类及酶切位点氨基酸0.ppt氨基酸的名称与符号alanine 丙氨酸Ala Aarginine 精氨酸Arg Rasparagine 天冬酰氨Asn Asx Naspartic acid 天冬氨酸Asp Asx Dcysteine 半胱氨酸Cys Cglutamine 谷氨酰胺Gln Glx Qglutamic acid 谷氨酸Glu Glx Eglycine 甘氨酸Gly Ghistidine 组氨酸His Hisoleucine 异亮氨酸Ile Ileucine 亮氨酸Leu Llysine 赖氨酸Lys Kmethionine 甲硫氨酸Met Mphenylalanine 苯丙氨酸Phe Fproline 脯氨酸Pro Pserine 丝氨酸Ser Sthreonine 苏氨酸Thr Ttryptophan 色氨酸Trp Wtyrosine 酪氨酸Tyr Yvaline 缬氨酸Val V血清终止胰酶消化的原理血清终止的原理其实是竞争抑制。
就是用过量的牛血清中含有的蛋白来和胰酶结合。
不给胰酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!什么样的细胞不能用胰酶-EDTA消化植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。
正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。
一般和胰蛋白酶配合使用。
原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。
它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活《军医进修学院学报》1992年02期加入收藏投稿正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究焦顺昌赵东海黄昌霞王洪海【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。
蛋白酶的分类及酶切位点

蛋白酶的分类及酶切位点氨基酸0.ppt氨基酸的名称与符号alanine 丙氨酸Ala Aarginine 精氨酸Arg Rasparagine 天冬酰氨Asn Asx Naspartic acid 天冬氨酸Asp Asx Dcysteine 半胱氨酸Cys Cglutamine 谷氨酰胺Gln Glx Qglutamic acid 谷氨酸Glu Glx Eglycine 甘氨酸Gly Ghistidine 组氨酸His Hisoleucine 异亮氨酸Ile Ileucine 亮氨酸Leu Llysine 赖氨酸Lys Kmethionine 甲硫氨酸Met Mphenylalanine 苯丙氨酸Phe Fproline 脯氨酸Pro Pserine 丝氨酸Ser Sthreonine 苏氨酸Thr Ttryptophan 色氨酸Trp Wtyrosine 酪氨酸Tyr Yvaline 缬氨酸Val V血清终止胰酶消化的原理血清终止的原理其实是竞争抑制。
就是用过量的牛血清中含有的蛋白来和胰酶结合。
不给胰酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!什么样的细胞不能用胰酶-EDTA消化植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。
正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。
一般和胰蛋白酶配合使用。
原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。
它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活《军医进修学院学报》1992年02期加入收藏投稿正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究焦顺昌赵东海黄昌霞王洪海【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。
酪蛋白水解酶酶切位点

酪蛋白水解酶酶切位点1. 引言酪蛋白水解酶是一种在生物体内起着重要作用的酶,它能够将酪蛋白分解为更小的肽段或氨基酸。
酪蛋白水解酶的活性主要通过酶切位点来实现,这些位点是酪蛋白水解酶识别和切割酪蛋白的特定序列。
本文将详细介绍酪蛋白水解酶酶切位点的相关知识。
2. 酪蛋白水解酶的功能酪蛋白水解酶是一类具有水解酶活性的酶,它主要存在于胃液、肠液和乳液中。
酪蛋白水解酶能够将酪蛋白分解为更小的肽段或氨基酸,从而促进蛋白质的消化和吸收。
在人体内,酪蛋白水解酶的功能对于维持肠道健康和促进营养吸收非常重要。
3. 酪蛋白水解酶酶切位点的定义酪蛋白水解酶酶切位点是指酪蛋白水解酶识别和切割酪蛋白的特定序列。
酶切位点通常由一串氨基酸组成,其中包含一个特定的氨基酸序列,这个序列是酪蛋白水解酶识别的关键。
酪蛋白水解酶在识别酶切位点后,会通过水解作用将酪蛋白切割成较小的肽段或氨基酸。
4. 酪蛋白水解酶酶切位点的特点酪蛋白水解酶酶切位点具有以下几个特点:•特异性:酪蛋白水解酶对酶切位点的识别是高度特异的,只有特定的氨基酸序列才能被酪蛋白水解酶识别和切割。
•多样性:酪蛋白水解酶可以识别和切割多种不同的酶切位点,这些位点在不同的酪蛋白中具有差异。
•位点长度:酪蛋白水解酶酶切位点的长度通常在4-8个氨基酸之间,其中包含一个特定的氨基酸序列。
5. 酪蛋白水解酶酶切位点的识别酪蛋白水解酶通过特定的结构域识别和结合酶切位点。
这些结构域可以与酪蛋白的特定氨基酸序列发生相互作用,从而实现酶切作用。
酪蛋白水解酶的结构域通常包括活性位点和底物结合位点。
6. 酪蛋白水解酶酶切位点的应用酪蛋白水解酶酶切位点的应用非常广泛,主要包括以下几个方面:•食品工业:酪蛋白水解酶酶切位点可以用于制作乳清蛋白饮料、乳清蛋白粉等乳制品。
通过酶切作用,可以将乳清蛋白分解为更小的肽段,增加其溶解度和稳定性。
•医药领域:酪蛋白水解酶酶切位点可以用于制备生物活性肽。
通过酶切作用,可以将酪蛋白分解为具有生物活性的肽段,如抗菌肽、抗氧化肽等,用于药物研发和治疗。
免疫蛋白酶体酶切位点预测

A Dissertation Submitted in Partial Fulfillment of the Requirementsfor the Degree of Master in EngineeringThe Predication of Immunoproteasome Cleavage SitesCandidate : Liu YingMajor : Bioinformatical TechnologySupervisor : Prof. Zhou YanhongHuazhong University of Science and TechnologyWuhan, Hubei 430074, P. R. ChinaJanuary, 2012独创性声明本人声明所呈交的学位论文是我个人在导师指导下进行的研究工作及取得的研究成果。
尽我所知,除文中已经标明引用的内容外,本论文不包含任何其他个人或集体已经发表或撰写过的研究成果。
对本文的研究做出贡献的个人和集体,均已在文中以明确方式标明。
本人完全意识到本声明的法律结果由本人承担。
学位论文作者签名:日期:年月日学位论文版权使用授权书本学位论文作者完全了解学校有关保留、使用学位论文的规定,即:学校有权保留并向国家有关部门或机构送交论文的复印件和电子版,允许论文被查阅和借阅。
本人授权华中科技大学可以将本学位论文的全部或部分内容编入有关数据库进行检索,可以采用影印、缩印或扫描等复制手段保存和汇编本学位论文。
保密□,在年解密后适用本授权书。
本论文属于不保密□。
(请在以上方框内打“√”)学位论文作者签名:指导教师签名:日期:年月日日期:年月日摘要免疫蛋白酶体对蛋白质的裂解,是MHC-I途径的起始环节,限定了能被呈递以致引起CTL抗原反应多肽的基本特征。
将免疫酶切预测结果整合到MHC-I抗原表位预测中,能有效提高预测准确度。
而MHC-I抗原表位在免疫相关研究中占有重要地位,因此,免疫蛋白酶体剪切位点的预测也就具有重要意义。
furin蛋白酶切位点

furin蛋白酶切位点
Furin蛋白酶切位点是指Furin蛋白酶在水解底物时识别和剪切的特定氨基酸序列。
Furin蛋白酶是一种负责剪切和激活其他蛋白质的酶,特别是那些在内质网和高尔基体合成的蛋白质前体。
Furin蛋白酶切位点通常由Arg-Xaa-(Lys/Arg)-Arg或Arg-Xaa-Xaa-Arg的序列组成,其中“Xaa”表示任意氨基酸。
Furin蛋白酶切割的底物包括许多生物活性物质、细胞因子、生长因子、肽类激素、病毒蛋白等。
由于Furin蛋白酶切割后的蛋白质具有更强的生物活性,因此Furin蛋白酶在许多生理和病理过程中发挥着重要作用。
Furin蛋白酶切位点的研究对于深入理解其生物学功能和探索其在疾病治疗中的应用具有重要意义。
近年来,基于Furin蛋白酶切位点的治疗策略已成为一种新兴的治疗手段,值得进一步研究和探索。
蛋白酶酶切位点
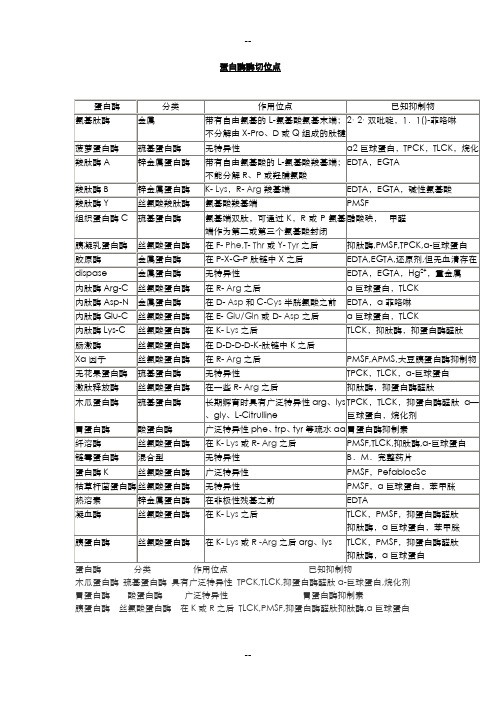
蛋白酶酶切位点木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白名称三字符号单字符号Ala AArg RAsp DCys CGln QGlu/Gln EHis HIle IGly GAsn NLeu LLys KMet MPhe FPro PSer SThr TTrp WTyr YVal V胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
胰凝乳蛋白酶phe、trp、tyr 等疏水aa。
胃蛋白酶phe、trp、tyr等疏水aa。
木瓜蛋白酶arg、lys。
葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。
碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。
梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。
CNBr断裂Met。
羟胺断裂asn—gly间的肽键。
二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。
木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。
木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。
木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。
至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。
纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)溶菌酶,分子量25000,约占可溶性蛋白质的20%;及纤维素酶等不同的酶。
蛋白酶-酶切位点

or angiotensinase, or glutamyl-aminopeptidase Dipeptidyl-peptidases and tripeptidyl-peptidases Dipeptidyl-peptidase I, or cathepsin C or J
Dipeptidyl-peptidase IV
Cathepsin B
Clostripain, or endoproteinase Arg-C Calpain-1,
酶名称
中文
E.C.号
酶切位点
丝氨酸蛋白酶
胰凝乳蛋白酶,糜蛋白酶
胰朊酶,胰蛋白酶 胰弹性蛋白酶 凝血酶 胞质素,胞浆素
E.C.3.4.21
E.C.3.4.21.1
E.C.3.4.21.4 E.C.3.4.21.36 E.C.3.4.21.5 E.C.3.4.21.7
基氨肽酶
二肽基肽酶和三肽基肽酶 组织蛋白酶
E.C.3.4.14 E.C.3.4.14.1
二肽基肽酶 IV
C.3.4.14.5
脯氨酰三肽-肽酶
E.C.3.4.14.12
肽基-二肽酶
E.C.3.4.15
肽基-二肽酶 A,血管紧张素转化 E.C.3.4.15.1
酶
金属羧肽酶
E.C.3.4.17
羧肽酶 A
羧肽酶 N,羧基肽酶,激肽酶 I E.C.3.4.17.3 Xaa-|-Lys >>Xaa-|-Arg
羧肽酶 U 或 R 谷氨酸羧肽酶,叶酸水解酶
E.C.3.4.17.20 E.C.3.4.17.21
Xaa-|-Arg and Xaa-|-Lys Xaa-|-Glu, preferentially with Xaa=Asp or Glu
3c蛋白酶酶切位点

3c蛋白酶酶切位点
1. 什么是3C蛋白酶?
3C蛋白酶是一种重要的酶,属于半胱氨酸蛋白酶家族,能够特异性地水解多种蛋白质。
它在许多生物学过程中都起着重要的作用,如病毒复制、细胞凋亡、细胞周期调控等。
2. 3C蛋白酶的酶切位点有哪些?
3C蛋白酶的酶切位点为“Q-G/S-X-X-D/E”,其中Q表示谷氨酰氨基酸,G/S表示甘氨酰氨基酸或丝氨酰氨基酸,X表示任意氨基酸,D/E表示天冬氨酸或谷氨酸。
在这个位点上,3C蛋白酶能够特异性地水解蛋白质,从而发挥其生物学功能。
3. 3C蛋白酶酶切位点的应用
由于3C蛋白酶能够特异性地水解蛋白质,因此它被广泛应用于生物学研究中。
例如,在病毒复制研究中,研究人员常常使用3C蛋白酶来裂解病毒蛋白,以便研究病毒复制的机制。
此外,在蛋白质相互作用研究中,研究人员也常常使用3C蛋白酶来切割蛋白质,以便研究蛋白质相互作用的机制。
4. 3C蛋白酶酶切位点的注意事项
在使用3C蛋白酶进行酶切时,需要注意以下几点。
首先,酶切位点需要严格控制,以免对目标蛋白产生不必要的影响。
其次,酶切时间和温度也需要严格控制,以免过度水解或过度热失活。
最后,需要注意酶切产物的纯度和活性,以便后续实验的进行。
5. 结论
3C蛋白酶是一种重要的酶,在生物学研究中有着广泛的应用。
其酶切位点为“Q-G/S-X-X-D/E”,需要严格控制酶切条件和产物的纯度和活性。
常用蛋白酶切割位点
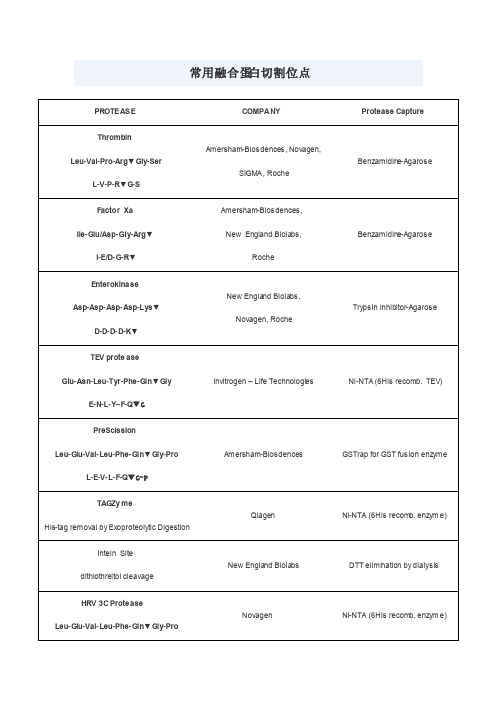
TAGZy me His-tag removal by Exoproteolytic Digestion
Qiagen
Ni-NTA (6His recomb. enzym e)
Intein Site dithiothreitol cleavage
New England Biolabs
常用融合蛋白切割位点
PROTEAS E
COMPANY
Protease Capture
Thrombin Leu-Val-Pro-Arg▼ Gly-Ser
L-V-P-R▼ G-S
Amersham-Biosciences, Novagen, SIGMA, Roche
Benzam idine-Agaros e
1.胰蛋白酶属肽链内切酶,能把多肽链 中Lys 和 Arg 残基中的羧基侧 切断。 2.胰凝乳蛋白酶(亦称糜蛋白酶)属肽链内切酶,主要切断多肽链中的芳香族氨基酸 (Phe、Trp、Tyr)残基的羧基 一侧。 3.羧肽酶(分 A 和 B 型),一般的题目中没有特别指明的话就是两种类型的功能都具备,可 以从羧基端切除氨基酸(若羧基端的 第1个或第 2个氨基酸为 Pro 的则不能切除 )。 4.溴化氰处理,专一性的切割甲硫氨酸羧基端的肽 键。
Ni-NTA (6His recomb. TEV)
PreScission Leu- Glu-Val- Leu-Phe- Gl n▼ Gl y-Pro
L-E-V- L- F-Q▼ G- P
Am ersham-Bios ciences
GSTrap for GST fusion enzyme
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白酶专一性酶切位点的影响因素分析内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease Specific Cleavage Sites Abstract: Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatichydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pHvalues,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
生物活性肽有的是天然存在的,如谷胱甘肽、催产素、加压素、舒缓激肽、部分抗菌肽等,有的生物活性肽是以非活性的状态存在于某些蛋白质中,当用特定的蛋白酶水解后被释放出来,才成为有特定生理活性的肽。
同种蛋白质经不同的蛋白酶酶解后,可以产生具有不同氨基酸序列、不同生理功能的生物活性肽,如大豆蛋白、卵清白蛋白、牛乳蛋白、酪蛋白经不同的蛋白酶酶解可以产生具有降血压、抗氧化、防病、祛病、增强人体免疫力、促消化吸收等不同生理作用的肽[1]。
由于生物活性肽在药物、保健品等领域具有广阔的应用前景,因此对生物活性肽的研究与开发具有重要意义。
2.生物活性肽的制备为了研究生物活性肽的结构与功能,开发相关药物或保健品等,需大量制备生物活性肽。
目前,获得生物活性肽的主要途径有以下3种:①直接分离提取;②化学合成或重组DNA技术;③体外水解蛋白质[1]。
天然生物活性肽分布很广泛,目前已经从动物、植物、微生物及部分海洋生物中直接分离出多种生物活性肽。
天然生物活性肽通常具有高效、低毒、无污染等特点[2]。
化学合成法有固相与液相两种方式,其基本原理几乎一样。
化学合成法发展较早,也比较成熟。
重组DNA法一旦建立好系统,就可以大量地重复性生产所要的活性肽。
然而,这些制备方法存在一定的局限性。
生物活性肽在生物体内的含量一般是微量的,如谷胱甘肽、催产素等,而且目前从天然生物体中分离纯化获得活性肽的工艺还不是很完善。
化学法合成仍有许多缺点,包括①消旋化现象;②侧链官能团需要保护;③整体效率低;④使用大量的有毒溶剂,且成本高昂。
因此化学合成法多半用在实验室,或是高价肽的生产上。
重组DNA技术在基因的表达与产品回收上仍有问题,同时该法生产的活性肽种类也有限制,不能生产酰胺肽,也不适合制备短链肽[3]。
酶法水解由于反应较温和、对蛋白质营养价值破坏小、使用的试剂毒性较低、反应具有空间立体性、产物没有消旋化现象、反应位点具有方向性、无异味等优越性,在现阶段被广泛用于制备生物活性肽。
生物活性肽具有促进矿物质吸收、抑制细菌、抗高血压、抗氧化、抗疲劳、神经调节、免疫调节等生理活性,而这些功能是原蛋白质或其组成氨基酸不具备的,且许多活性肽的组成氨基酸不一定是必需氨基酸,选择合适蛋白酶水解把其有生物活性肽链片段释放出来,从而制备出具有各种各样生理功能的生物活性肽。
这就为更充分的利用蛋白质资源,特别是为那些原本认为生物效价不高的蛋白质资源提供了新的机遇[4]。
迄今,获得生物活性肽的大量研究主要集中在蛋白质水解酶和蛋白质的筛选以及酶解条件的优化上,通过改善水解工艺,进一步提高生物活性肽得率。
随着生物信息学的发展及生物活性肽研究的不断深入,越来越多的蛋白质一级结构及活性肽的氨基酸序列得到阐明,免疫学的发展使得蛋白酶的酶切位点也越来越明确,这为从原料蛋白质中寻找已知氨基酸组成序列的生物活性肽提供了基础。
研究表明,具有特定生物活性的肽具有相似的结构特征,而其活性与肽的理化性质相关。
因此,根据活性肽的氨基酸组成结构信息和不同蛋白酶的水解位点特异性可以利用计算机使用特定酶模拟定向的释放活性肽,如黎观红等(2003)利用Access数据库软件建立了一个生物活性肽数据库,利用自编程序可用来寻找蛋白质中潜在的生物活性肽从该蛋白质中释放出来的适宜的酶。
陈征松等(2007)建立了活性肽搜寻与蛋白模拟水解数据库,实现了蛋白质用单酶或者复酶的模拟水解。
Vanessa Vermeirssen等(2004)建立蛋白质数据库并进行了实验,取得初步成果。
但酶法制备活性肽过程中一个具有挑战性的问题是,在蛋白质酶切过程中,会出现漏切位点和非专一性酶切位点,最终无法保证绝对把蛋白质酶切为常规的肽段,造成许多不必要的产物生成。
这是利用蛋白酶催化合成活性肽最明显的副作用。
对于常用的酶解来说,局部构象、三维结构、实验条件、酶切位点附近的其它氨基酸以及其它偶然因素都会影响蛋白水解酶的酶切效果[5]。
因此,研究蛋白质的酶切位点的影响因素,分析蛋白质的酶切规律,对制备高纯度、高产率的目标活性肽以及进一步研究其活性与结构的关系,具有重要意义。
3.蛋白酶和蛋白质的选择蛋白酶的选择是酶法制备活性肽的关键步骤。
在酶的筛选过程中,应以原料蛋白的组成和酶的专一性为参考,也可根据目标活性肽的结构特点进行选择或通过酶工程来生产特定酶[6]。
根据水解方式不同可将目前常用蛋白酶分为以下2类[7]:(1)内切酶:作用于蛋白质分子内部肽键。
包括动物蛋白酶,如胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶等;植物蛋白酶,如木瓜蛋白酶、菠萝蛋白酶、无花果蛋白酶等;以及微生物来源蛋白酶,如丹麦Novo公司生产的碱性蛋白酶Alcalase、复合蛋白酶Protamex、中性蛋白酶Neutrase等。
(2)外切酶:作用于蛋白质或多肽分子氨基或羧基末端的肽键,生成游离氨基酸,其中作用于氨基末端的称为氨肽酶,作用于羧基末端的称为羧肽酶。
外切酶的一个重要特性就是能够把处于肽链末端的疏水性氨基酸水解出来,降低多肽的苦味。
常见的一些蛋白酶及其作用位点见表1。
表1常见蛋白酶的作用位点种类来源最适pH作用位点胃蛋白酶胃黏膜2~3Phe-,Leu-胰蛋白酶胰脏7~9Arg-,Lys-胰凝乳蛋白酶胰脏 3.7Tyr-,Trp-,Phe-,Leu-木瓜蛋白酶木瓜果实5~7Arg-,Lys-,Phe-X菠萝蛋白酶菠萝果实5~7.5Lys-,Ala-,Tyr-,Gly-碱性蛋白酶Carlsber 枯草杆菌6.5~8.5Ala-,Leu-,Val-,Tyr-,Phe-,Try-许多动物蛋白和植物蛋白都可作为的来源。
部分活性肽来自乳蛋白、酪蛋白、乳清、鸡蛋和肌肉蛋白质等动物蛋白质。
此外,海洋生物如鱼、鲑鱼、牡蛎、大型藻类、鱿鱼、海胆、虾、雪螃蟹、海马也可作为活性肽的蛋白质源。
植物蛋白质常用的包括大豆、豆类(扁豆、鹰嘴豆、豌豆和豆类)、燕麦、小麦、火麻仁、油菜和亚麻籽。
目前,选择用于制备活性肽的蛋白质应该基于2个标准[8]:(1)使用未充分利用能够进一步增值且蛋白质含量丰富的食品工业副产物;(2)含有特定氨基酸序列或特定药理氨基酸残基的蛋白质。
蛋白质的合理选择,对提高目标肽的产率至关重要。
4.酶切位点的影响因素分析4.1.温度对酶切位点的影响4.1.1.对专一性酶切位点的影响一般情况下,蛋白酶在最适温度时酶切速率最大,偏离最适温度时活性降低。
温度变化影响蛋白质的空间结构,从而影响了其对蛋白酶的亲和力。
例如温度升高时,蛋白质底物中更多的酶切位点暴露出来,酶切更容易进行。
研究发现,随着温度升高,蛋白质中更多的专一性酶切位点被水解,水解范围更广泛。
Seronei Chelulei Cheison等(2011)使用MALDI-TOF-MS(基质辅助激光解吸电离飞行时间质谱)分析了温度变化(25℃、37.5℃、和50℃)结合不同的碱性pH值(7.8、8.65、9.5)对胰蛋白酶水解β-乳球蛋白模式的影响[9]。
一般情况下,胰蛋白酶为肽链内切酶,水解赖氨酸或精氨酸的羧基与其它氨基酸(脯氨酸除外)形成的肽键。
结果发现,随着温度升高,更多的赖氨酸残基和精氨酸残基被水解。
在pH7.8和50℃的条件下水解10分钟之后,所有可能的专一性酶切位点都被水解。
因为脯氨酸能影响蛋白酶水解肽键,所以Lys47-Pro48未被水解。
在25℃,只有β-乳球蛋白的末端区域被酶解,然而,随着温度升高,β-乳球蛋白中心区域也开始被水解。
Blanca Hern′andez-Ledesma(2006)将牛的β-乳球蛋白A(β-Lg A)在非变性和变性加热条件下用嗜热菌蛋白酶水解,用HPLC-MS/MS确定水解过程中释放的肽段[10]。
一般情况下,嗜热菌蛋白酶水解疏水性或芳香族氨基酸的氨基端肽键,例如亮氨酸、异亮氨酸、苯丙氨酸、酪氨酸和缬氨酸。
