蛋白酶酶切位点
gpi蛋白酶切位点

gpi蛋白酶切位点
GPI蛋白酶切位点是指一种特定的蛋白酶切割位点,它与GPI
锚点蛋白的后修饰有关。
GPI锚点蛋白是一类通过糖脂酰肌醇糖脂
锚定到细胞膜表面的蛋白质。
在这类蛋白质的合成过程中,它们的
C末端会发生GPI锚点的后修饰。
这种后修饰是通过GPI蛋白酶酶
解C末端的信号肽,然后将GPI锚点脂质连接到蛋白质上。
GPI蛋白酶切位点通常是一个特定的氨基酸序列,包括丝氨酸、脯氨酸和甘氨酸残基。
这个序列通常被描述为(S/T)N,其中S代表
丝氨酸,T代表脯氨酸,N代表甘氨酸。
当蛋白质合成到达细胞膜上时,GPI蛋白酶会识别这个特定的序列,并切割蛋白质,使其可以
与GPI锚点脂质连接。
另外,GPI蛋白酶切位点的识别和切割还可能受到其他细胞因
子或信号通路的调控。
这些调控因子可能会影响GPI蛋白酶的活性
或与其结合的亚基,进而影响GPI锚点蛋白的后修饰过程。
总的来说,GPI蛋白酶切位点是与GPI锚点蛋白后修饰相关的
特定氨基酸序列,它在蛋白质合成过程中起着重要的作用。
对于这
一过程的深入理解有助于揭示细胞膜蛋白的合成和功能调控机制。
tev蛋白酶切位点的dna序列

tev蛋白酶切位点的dna序列
Tev蛋白酶切位点的DNA序列是指Tev蛋白酶可以识别并切割的DNA序列,也被称为Tev切割位点。
Tev蛋白酶是一种常用的内切酶,具有高度特异性和高效性。
Tev蛋白酶的切割位点为5'-G|TATAC-3',其中“|”所示的位置为切割位点。
因此,Tev蛋白酶切割位点的DNA序列为5'-GTTAAC-3'。
Tev蛋白酶的切割位点的序列具有较高的特异性和保守性,因此在进行基因克隆和重组DNA技术时,Tev蛋白酶切割位点的选择非常重要。
在进行DNA片段连接时,通过在DNA的末端引入Tev蛋白酶切割位点,可以使用Tev蛋白酶将DNA 片段剪切开,并通过该切口将不同的DNA片段连接起来。
需要注意的是,Tev蛋白酶切割位点的DNA序列只是其中一种常用的切割位点序列,不同种类的内切酶所识别的切割位点序列也是不同的。
因此,在进行基因克隆和重组DNA技术时,需要选择适合特定目的的内切酶切割位点序列。
蛋白酶专一性酶切位点的影响因素分析汇总

蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease Specific CleavageSitesAbstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
蛋白酶k切割位点

蛋白酶k切割位点
蛋白酶K切割位点是指蛋白酶K能够识别并切割的特定氨基酸序列。
蛋白酶K是一种丝氨酸蛋白酶,它能够切割蛋白质中的丝氨酸残基和苏氨酸残基。
蛋白酶K切割位点的研究对于理解蛋白质的结构和功能具有重要意义。
蛋白酶K切割位点的研究始于20世纪60年代。
当时,科学家们发现蛋白酶K能够切割一些特定的蛋白质,但并不清楚它是如何选择切割位点的。
随着技术的进步,科学家们逐渐发现了蛋白酶K切割位点的规律。
蛋白酶K切割位点通常是由一段特定的氨基酸序列组成。
这段序列通常包含一个丝氨酸残基或苏氨酸残基,以及一些特定的氨基酸。
蛋白酶K能够识别这段序列,并在丝氨酸或苏氨酸残基的侧链上切割。
蛋白酶K切割位点的序列通常被表示为“P1-P1'”,其中P1表示丝氨酸或苏氨酸残基,P1'表示切割位点的下一个氨基酸。
蛋白酶K切割位点的研究对于许多领域都具有重要意义。
例如,在生物技术领域,研究蛋白酶K切割位点可以帮助科学家设计更好的蛋白质表达系统。
在医学领域,研究蛋白酶K切割位点可以帮助科学家理解一些疾病的发生机制,从而开发更有效的治疗方法。
蛋白酶K切割位点是蛋白酶K能够识别并切割的特定氨基酸序列。
研究蛋白酶K切割位点对于理解蛋白质的结构和功能具有重要意义,
也有着广泛的应用前景。
蛋白酶专一性酶切位点地影响因素分析报告

蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease SpecificCleavage SitesAbstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
蛋白酶酶切位点

蛋白酶酶切位点蛋白酶的分类及作用位点蛋白酶分类作用位点已知抑制物,,氨基肽酶金属蛋白酶带有自由氨基的L-氨基酸氨基末端,22双吡啶,1,1()-菲咯啉不分解由X-Pro、D或Q组成的肽键菠萝蛋白酶巯基蛋白酶无特异性α2巨球蛋白,TPCK,TLCK,烷化羧肽酶A 锌金属蛋白酶带有自由氨基酸的L-氨基酸羧基端,EDTA,EGTA不能分解R、P或羟脯氨酸羧肽酶B 锌金属蛋白酶 K- Lys,R- Arg羧基端 EDTA,EGTA,碱性氨基酸羧肽酶Y 丝氨酸羧肽酶氨基酸羧基端 PMSF组织蛋白酶C 琉基蛋白酶氨基端双肽,可通过K,R或P氨基醋酸碘, 甲醛端作为第二或第三个氨基酸封闭胰凝乳蛋白酶丝氨酸蛋白酶在F- Phe,T- Thr或Y- Tyr之后抑肽酶,PMSF,TPCK,α-巨球蛋白胶原酶金属蛋白酶在P-X-G-P肽链中X之后EDTA,EGTA,还原剂,但无血清存在2+dispase 金属蛋白酶无特异性 EDTA,EGTA,Hg,重金属内肽酶Arg-C 丝氨酸蛋白酶在R- Arg之后α巨球蛋白,TLCK 内肽酶Asp-N 金属蛋白酶在D- Asp和C-Cys半胱氨酸之前EDTA,α菲咯啉内肽酶Glu-C 丝氨酸蛋白酶在E- Glu/Gln 或D- Asp之后α巨球蛋白,TLCK 内肽酶Lys-C 丝氨酸蛋白酶在K- Lys之后TLCK,抑肽酶,抑蛋白酶醛肽肠激酶丝氨酸蛋白酶在D-D-D-D-K-肽链中K之后Xa因子丝氨酸蛋白酶在R- Arg之后 PMSF,APMS,大豆胰蛋白酶抑制物无花果蛋白酶琉基蛋白酶无特异性TPCK,TLCK,α-巨球蛋白激肽释放酶丝氨酸蛋白酶在一些R- Arg之后抑肽酶,抑蛋白酶醛肽木瓜蛋白酶巯基蛋白酶长期孵育时具有广泛特异性arg、lys TPCK,TLCK,抑蛋白酶醛肽α—、gly、L-Citrulline 巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性phe、trp、tyr等疏水aa 胃蛋白酶抑制素纤溶酶丝氨酸蛋白酶在K- Lys或R- Arg之后 PMSF,TLCK,抑肽酶,α-巨球蛋白链霉蛋白酶混合型无特异性 B,M,完整药片蛋白酶K 丝氨酸蛋白酶广泛特异性 PMSF,PefablocSc 枯草杆菌蛋白酶丝氨酸蛋白酶无特异性PMSF,α巨球蛋白,苯甲脒热溶素锌金属蛋白酶在非极性残基之前 EDTA凝血酶丝氨酸蛋白酶在K- Lys之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白,苯甲脒胰蛋白酶丝氨酸蛋白酶在K- Lys或R -Arg之后arg、lys TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白蛋白酶分类作用位点已知抑制物木瓜蛋白酶巯基蛋白酶具有广泛特异性 TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写1名称三字符号单字符号丙氨酸 Ala A精氨酸 Arg R天冬氨酸 Asp D半胱氨酸 Cys C谷氨酰胺 Gln Q谷氨酸 Glu/Gln E组氨酸 His H异亮氨酸 Ile I甘氨酸 Gly G天冬酰胺 Asn N亮氨酸 Leu L赖氨酸 Lys K甲硫氨酸 Met M苯丙氨酸 Phe F脯氨酸 Pro P丝氨酸 Ser S苏氨酸 Thr T色氨酸 Trp W酪氨酸 Tyr Y缬氨酸 Val V【生化】特异性蛋白酶的酶切位点胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
v8蛋白酶酶切位点

v8蛋白酶酶切位点说到V8蛋白酶,嘿,大家是不是都觉得有点陌生呢?这个V8蛋白酶也没什么可怕的,它就是一种在研究生物化学的实验室里,用得比较多的酶,专门负责切割蛋白质链中的某些特定位置。
你要问,它和我们的生活有什么关系?别急,慢慢道来。
V8蛋白酶的工作就像是“剪刀手”,它根据自己的“口味”去识别蛋白质上的某些特定序列,然后把这些蛋白质“剪开”。
说白了,它能在特定的地方切开蛋白质,像把一个长长的链条截成几段。
而V8蛋白酶最牛逼的地方就是它能识别和切割那些带负电荷的氨基酸。
你说这不酷吗?蛋白质链就像是一个个小小的魔方,只有V8蛋白酶能用自己独特的“魔法”将它们按一定规律拆解。
特别是,它主要盯上那些带有谷氨酸(Glutamic acid,简称E)和天冬氨酸(Aspartic acid,简称D)的氨基酸位置,这就像它有一份“专属菜单”,只要在这份菜单上的,就能准确地“剪”到,准确到什么程度呢?就像你切蛋糕一样,保证每一刀都切得又准又稳,没一点儿差错。
你会觉得,这么强大,V8蛋白酶是不是有点“高冷”呢?其实它也挺温柔的,毕竟它可不会随便乱切,切得也不是那么随便的,都是有严格要求的。
它不仅仅是为了“拆分蛋白质”而去工作的,还有一些特殊的任务,像是帮助我们解析不同的蛋白质结构,或者帮助那些科学家们搞清楚一大堆复杂的生物过程。
可以说,V8蛋白酶在科学研究中的作用,就像一个精准的医生,凭借自己独特的能力,去“诊断”蛋白质的结构、功能,甚至参与一些疾病的研究,最终为人类的健康事业贡献自己的微薄之力。
但是你知道吗?V8蛋白酶也有个特点,就是它在一些条件下可能会变得“不听话”。
有时候它可能就变得不稳定,搞得科学家们的实验进程都停滞不前。
简直就是那种“就差一点就能成功”,却偏偏出问题的那种类型。
别小看它,这个蛋白酶在实验室里可是个“大腕”,很多研究都离不开它。
可要是它不合作,实验可能就会泡汤。
所以,科学家们得小心翼翼地调控条件,保证它“心情愉快”,从而确保它在实验中稳定发挥作用。
蛋白酶酶切位点

蛋白酶酶切位点蛋白酶的分类及作用位点蛋白酶分类作用位点已知抑制物,,氨基肽酶金属蛋白酶带有自由氨基的L-氨基酸氨基末端,22双吡啶,1,1()-菲咯啉不分解由X-Pro、D或Q组成的肽键菠萝蛋白酶巯基蛋白酶无特异性α2巨球蛋白,TPCK,TLCK,烷化羧肽酶A 锌金属蛋白酶带有自由氨基酸的L-氨基酸羧基端,EDTA,EGTA不能分解R、P或羟脯氨酸羧肽酶B 锌金属蛋白酶 K- Lys,R- Arg羧基端 EDTA,EGTA,碱性氨基酸羧肽酶Y 丝氨酸羧肽酶氨基酸羧基端 PMSF组织蛋白酶C 琉基蛋白酶氨基端双肽,可通过K,R或P氨基醋酸碘, 甲醛端作为第二或第三个氨基酸封闭胰凝乳蛋白酶丝氨酸蛋白酶在F- Phe,T- Thr或Y- Tyr之后抑肽酶,PMSF,TPCK,α-巨球蛋白胶原酶金属蛋白酶在P-X-G-P肽链中X之后EDTA,EGTA,还原剂,但无血清存在2+dispase 金属蛋白酶无特异性 EDTA,EGTA,Hg,重金属内肽酶Arg-C 丝氨酸蛋白酶在R- Arg之后α巨球蛋白,TLCK 内肽酶Asp-N 金属蛋白酶在D- Asp和C-Cys半胱氨酸之前EDTA,α菲咯啉内肽酶Glu-C 丝氨酸蛋白酶在E- Glu/Gln 或D- Asp之后α巨球蛋白,TLCK 内肽酶Lys-C 丝氨酸蛋白酶在K- Lys之后TLCK,抑肽酶,抑蛋白酶醛肽肠激酶丝氨酸蛋白酶在D-D-D-D-K-肽链中K之后Xa因子丝氨酸蛋白酶在R- Arg之后 PMSF,APMS,大豆胰蛋白酶抑制物无花果蛋白酶琉基蛋白酶无特异性TPCK,TLCK,α-巨球蛋白激肽释放酶丝氨酸蛋白酶在一些R- Arg之后抑肽酶,抑蛋白酶醛肽木瓜蛋白酶巯基蛋白酶长期孵育时具有广泛特异性arg、lys TPCK,TLCK,抑蛋白酶醛肽α—、gly、L-Citrulline 巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性phe、trp、tyr等疏水aa 胃蛋白酶抑制素纤溶酶丝氨酸蛋白酶在K- Lys或R- Arg之后 PMSF,TLCK,抑肽酶,α-巨球蛋白链霉蛋白酶混合型无特异性 B,M,完整药片蛋白酶K 丝氨酸蛋白酶广泛特异性 PMSF,PefablocSc 枯草杆菌蛋白酶丝氨酸蛋白酶无特异性PMSF,α巨球蛋白,苯甲脒热溶素锌金属蛋白酶在非极性残基之前 EDTA凝血酶丝氨酸蛋白酶在K- Lys之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白,苯甲脒胰蛋白酶丝氨酸蛋白酶在K- Lys或R -Arg之后arg、lys TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白蛋白酶分类作用位点已知抑制物木瓜蛋白酶巯基蛋白酶具有广泛特异性 TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写1名称三字符号单字符号丙氨酸 Ala A精氨酸 Arg R天冬氨酸 Asp D半胱氨酸 Cys C谷氨酰胺 Gln Q谷氨酸 Glu/Gln E组氨酸 His H异亮氨酸 Ile I甘氨酸 Gly G天冬酰胺 Asn N亮氨酸 Leu L赖氨酸 Lys K甲硫氨酸 Met M苯丙氨酸 Phe F脯氨酸 Pro P丝氨酸 Ser S苏氨酸 Thr T色氨酸 Trp W酪氨酸 Tyr Y缬氨酸 Val V【生化】特异性蛋白酶的酶切位点胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
蛋白酶的分类及酶切位点
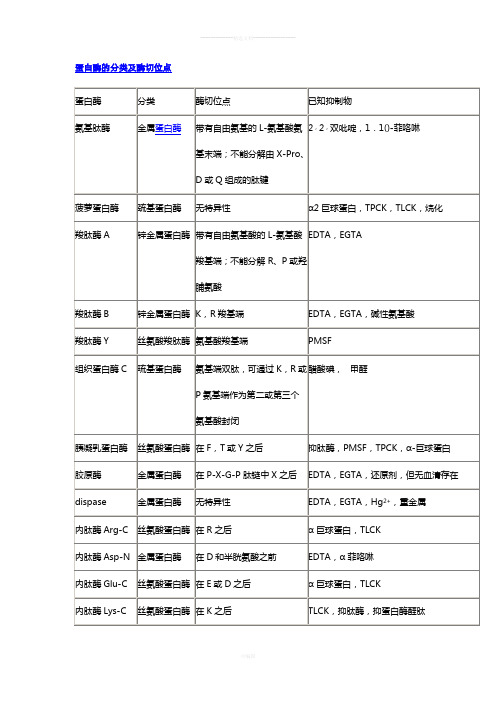
蛋白酶的分类及酶切位点氨基酸0.ppt氨基酸的名称与符号alanine 丙氨酸Ala Aarginine 精氨酸Arg Rasparagine 天冬酰氨Asn Asx Naspartic acid 天冬氨酸Asp Asx Dcysteine 半胱氨酸Cys Cglutamine 谷氨酰胺Gln Glx Qglutamic acid 谷氨酸Glu Glx Eglycine 甘氨酸Gly Ghistidine 组氨酸His Hisoleucine 异亮氨酸Ile Ileucine 亮氨酸Leu Llysine 赖氨酸Lys Kmethionine 甲硫氨酸Met Mphenylalanine 苯丙氨酸Phe Fproline 脯氨酸Pro Pserine 丝氨酸Ser Sthreonine 苏氨酸Thr Ttryptophan 色氨酸Trp Wtyrosine 酪氨酸Tyr Yvaline 缬氨酸Val V血清终止胰酶消化的原理血清终止的原理其实是竞争抑制。
就是用过量的牛血清中含有的蛋白来和胰酶结合。
不给胰酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!什么样的细胞不能用胰酶-EDTA消化植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。
正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。
一般和胰蛋白酶配合使用。
原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。
它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活《军医进修学院学报》1992年02期加入收藏投稿正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究焦顺昌赵东海黄昌霞王洪海【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。
蛋白酶专一性酶切位点的影响因素分析

蛋白酶专一性酶切位点的影响因素分析摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。
酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。
蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。
本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。
关键词:生物活性肽;蛋白酶;水解条件;酶切位点Influencing Factors Analysis of Protease Specific CleavageSitesAbstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production.Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites1.前言生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。
蛋白酶酶切位点
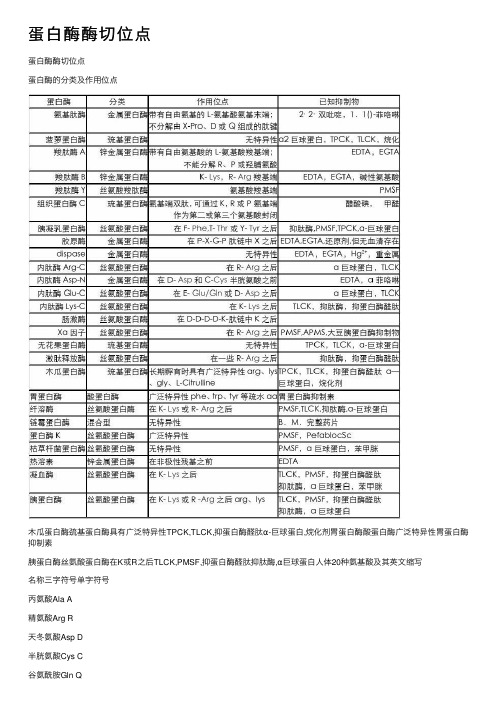
蛋⽩酶酶切位点蛋⽩酶酶切位点蛋⽩酶的分类及作⽤位点⽊⽠蛋⽩酶巯基蛋⽩酶具有⼴泛特异性TPCK,TLCK,抑蛋⽩酶醛肽α-巨球蛋⽩,烷化剂胃蛋⽩酶酸蛋⽩酶⼴泛特异性胃蛋⽩酶抑制素胰蛋⽩酶丝氨酸蛋⽩酶在K或R之后TLCK,PMSF,抑蛋⽩酶醛肽抑肽酶,α巨球蛋⽩⼈体20种氨基酸及其英⽂缩写名称三字符号单字符号丙氨酸Ala A精氨酸Arg R天冬氨酸Asp D半胱氨酸Cys C⾕氨酰胺Gln Q⾕氨酸Glu/Gln E组氨酸His H异亮氨酸Ile I⽢氨酸Gly G天冬酰胺Asn N亮氨酸Leu L赖氨酸Lys K甲硫氨酸Met M苯丙氨酸Phe F脯氨酸Pro P丝氨酸Ser S苏氨酸Thr T⾊氨酸Trp W酪氨酸Tyr Y缬氨酸Val V【⽣化】特异性蛋⽩酶的酶切位点胰蛋⽩酶arg、lys,得到以arg、lys为C末端残基的肽段。
胰凝乳蛋⽩酶phe、trp、tyr 等疏⽔aa。
胃蛋⽩酶phe、trp、tyr等疏⽔aa。
⽊⽠蛋⽩酶arg、lys。
葡萄球菌蛋⽩酶,磷酸缓冲液ph7.8时断裂glu、asp。
碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。
梭菌蛋⽩酶arg,⽤于不溶性蛋⽩的长时间裂解。
CNBr断裂Met。
羟胺断裂asn—gly间的肽键。
⼆硫键可以⽤巯基化合物还原法或者过甲酸氧化法断裂.。
⽊⽠蛋⽩酶(Papain),⼜称⽊⽠酶,是⼀种蛋⽩⽔解酶。
⽊⽠蛋⽩酶是番⽊⽠(Carieapapaya)中含有的⼀种低特异性蛋⽩⽔解酶,⼴泛地存在于番⽊⽠的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。
⽊⽠蛋⽩酶的活性中⼼含半胱氨酸,属于巯基蛋⽩酶,它具有酶活⾼、热稳定性好、天然卫⽣安全等特点,因此在⾷品、医药、饲料、⽇化、⽪⾰及纺织等⾏业得到⼴泛应⽤。
⽊⽠蛋⽩酶是⼀种蛋⽩⽔解酶,分⼦量为23406,由⼀种单肽链组成,含有212个氨基酸残基。
⾄少有三个氨基酸残基存在于酶的活性中⼼部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对⼆硫键,且都不在活性部位。
蛋白酶酶切位点

蛋白酶酶切位点蛋白酶的分类及作用位点蛋白酶分类作用位点已知抑制物,,氨基肽酶金属蛋白酶带有自由氨基的L-氨基酸氨基末端,22双吡啶,1,1()-菲咯啉不分解由X-Pro、D或Q组成的肽键菠萝蛋白酶巯基蛋白酶无特异性α2巨球蛋白,TPCK,TLCK,烷化羧肽酶A 锌金属蛋白酶带有自由氨基酸的L-氨基酸羧基端,EDTA,EGTA不能分解R、P或羟脯氨酸羧肽酶B 锌金属蛋白酶 K- Lys,R- Arg羧基端 EDTA,EGTA,碱性氨基酸羧肽酶Y 丝氨酸羧肽酶氨基酸羧基端 PMSF组织蛋白酶C 琉基蛋白酶氨基端双肽,可通过K,R或P氨基醋酸碘, 甲醛端作为第二或第三个氨基酸封闭胰凝乳蛋白酶丝氨酸蛋白酶在F- Phe,T- Thr或Y- Tyr之后抑肽酶,PMSF,TPCK,α-巨球蛋白胶原酶金属蛋白酶在P-X-G-P肽链中X之后EDTA,EGTA,还原剂,但无血清存在2+dispase 金属蛋白酶无特异性 EDTA,EGTA,Hg,重金属内肽酶Arg-C 丝氨酸蛋白酶在R- Arg之后α巨球蛋白,TLCK 内肽酶Asp-N 金属蛋白酶在D- Asp和C-Cys半胱氨酸之前EDTA,α菲咯啉内肽酶Glu-C 丝氨酸蛋白酶在E- Glu/Gln 或D- Asp之后α巨球蛋白,TLCK 内肽酶Lys-C 丝氨酸蛋白酶在K- Lys之后TLCK,抑肽酶,抑蛋白酶醛肽肠激酶丝氨酸蛋白酶在D-D-D-D-K-肽链中K之后Xa因子丝氨酸蛋白酶在R- Arg之后 PMSF,APMS,大豆胰蛋白酶抑制物无花果蛋白酶琉基蛋白酶无特异性TPCK,TLCK,α-巨球蛋白激肽释放酶丝氨酸蛋白酶在一些R- Arg之后抑肽酶,抑蛋白酶醛肽木瓜蛋白酶巯基蛋白酶长期孵育时具有广泛特异性arg、lys TPCK,TLCK,抑蛋白酶醛肽α—、gly、L-Citrulline 巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性phe、trp、tyr等疏水aa 胃蛋白酶抑制素纤溶酶丝氨酸蛋白酶在K- Lys或R- Arg之后 PMSF,TLCK,抑肽酶,α-巨球蛋白链霉蛋白酶混合型无特异性 B,M,完整药片蛋白酶K 丝氨酸蛋白酶广泛特异性 PMSF,PefablocSc 枯草杆菌蛋白酶丝氨酸蛋白酶无特异性PMSF,α巨球蛋白,苯甲脒热溶素锌金属蛋白酶在非极性残基之前 EDTA凝血酶丝氨酸蛋白酶在K- Lys之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白,苯甲脒胰蛋白酶丝氨酸蛋白酶在K- Lys或R -Arg之后arg、lys TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白蛋白酶分类作用位点已知抑制物木瓜蛋白酶巯基蛋白酶具有广泛特异性 TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写1名称三字符号单字符号丙氨酸 Ala A精氨酸 Arg R天冬氨酸 Asp D半胱氨酸 Cys C谷氨酰胺 Gln Q谷氨酸 Glu/Gln E组氨酸 His H异亮氨酸 Ile I甘氨酸 Gly G天冬酰胺 Asn N亮氨酸 Leu L赖氨酸 Lys K甲硫氨酸 Met M苯丙氨酸 Phe F脯氨酸 Pro P丝氨酸 Ser S苏氨酸 Thr T色氨酸 Trp W酪氨酸 Tyr Y缬氨酸 Val V【生化】特异性蛋白酶的酶切位点胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
furin蛋白酶切位点

furin蛋白酶切位点
Furin蛋白酶切位点是指Furin蛋白酶在水解底物时识别和剪切的特定氨基酸序列。
Furin蛋白酶是一种负责剪切和激活其他蛋白质的酶,特别是那些在内质网和高尔基体合成的蛋白质前体。
Furin蛋白酶切位点通常由Arg-Xaa-(Lys/Arg)-Arg或Arg-Xaa-Xaa-Arg的序列组成,其中“Xaa”表示任意氨基酸。
Furin蛋白酶切割的底物包括许多生物活性物质、细胞因子、生长因子、肽类激素、病毒蛋白等。
由于Furin蛋白酶切割后的蛋白质具有更强的生物活性,因此Furin蛋白酶在许多生理和病理过程中发挥着重要作用。
Furin蛋白酶切位点的研究对于深入理解其生物学功能和探索其在疾病治疗中的应用具有重要意义。
近年来,基于Furin蛋白酶切位点的治疗策略已成为一种新兴的治疗手段,值得进一步研究和探索。
常用蛋白酶切割位点
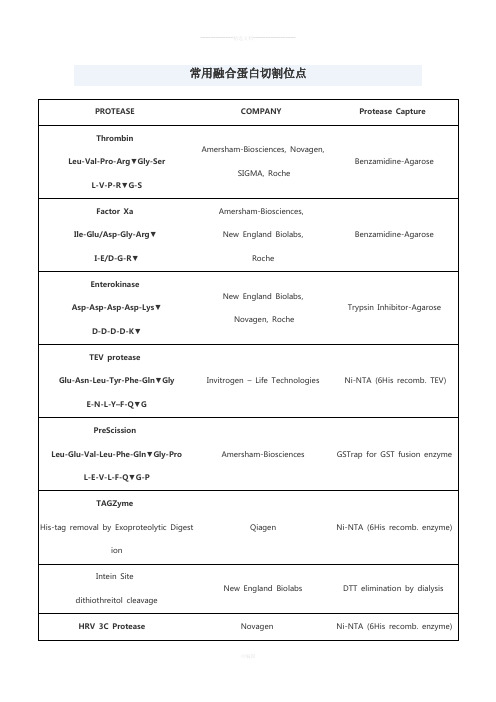
I-E/D-G-R▼
Amersham-Biosciences,
New England Biolabs,
Roche
Benzamidine-Agarose
Enterokinase
Asp-Asp-Asp-Asp-Lys▼
D-D-D-D-K▼
New England Biolabs,
Leu-Glu-Val-Leu-Phe-Gln▼Gly-Pro
L-E-V-L-F-Q▼G-P
Amersham-Biosciences
GSTrap for GST fusion enzyme
TAGZyme
His-tag removal by Exoproteolytic Digestion
Qiagen
Novagen, Roche
Trypsin Inhibitor-Agarose
TEV protease
Glu-Asn-Leu-Tyr-Phe-Gln▼Gly
E-N-L-Y–F-Q▼G
Invitrogen – Life Technologies
Ni-NTA (6His recomb. TEV)
PreScission
羧肽酶
羧肽酶B可以切割C端的Lys或Arg;羧肽酶A可以切割C端除了Lys、Arg、Pro的氨基酸,但如果倒数第二个氨基酸为Pro两种羧肽酶均不能作用
1.胰蛋白酶属肽链内切酶,能把多肽链中Lys和Arg残基中的羧基侧切断。
2.胰凝乳蛋白酶(亦称糜蛋白酶)属肽链内切酶,主要切断多肽链中的芳香族氨基酸(Phe、Trp、Tyr)残基的羧基一侧。
常用融合蛋白切割位点
PROTEASE
COMPANY
蛋白酶酶切位点

蛋白酶酶切位点木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写名称三字符号单字符号丙氨酸Ala A精氨酸Arg R天冬氨酸Asp D半胱氨酸Cys C谷氨酰胺Gln Q谷氨酸Glu/Gln E组氨酸His H异亮氨酸Ile I甘氨酸Gly G天冬酰胺Asn N亮氨酸Leu L赖氨酸Lys K甲硫氨酸Met M苯丙氨酸Phe F脯氨酸Pro P丝氨酸Ser S苏氨酸Thr T色氨酸Trp W酪氨酸Tyr Y缬氨酸Val V【生化】特异性蛋白酶的酶切位点胰蛋白酶ar g、lys,得到以arg、lys为C末端残基的肽段。
胰凝乳蛋白酶phe、trp、tyr 等疏水aa。
胃蛋白酶ph e、trp、tyr等疏水aa。
木瓜蛋白酶a rg、lys。
葡萄球菌蛋白酶,磷酸缓冲液p h7.8时断裂gl u、asp。
碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂gl u。
梭菌蛋白酶a rg,用于不溶性蛋白的长时间裂解。
CNBr断裂Met。
羟胺断裂as n—gly间的肽键。
二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。
木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。
木瓜蛋白酶是番木瓜(Cariea papay a)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。
木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。
木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。
3c蛋白酶酶切位点

3c蛋白酶酶切位点
1. 什么是3C蛋白酶?
3C蛋白酶是一种重要的酶,属于半胱氨酸蛋白酶家族,能够特异性地水解多种蛋白质。
它在许多生物学过程中都起着重要的作用,如病毒复制、细胞凋亡、细胞周期调控等。
2. 3C蛋白酶的酶切位点有哪些?
3C蛋白酶的酶切位点为“Q-G/S-X-X-D/E”,其中Q表示谷氨酰氨基酸,G/S表示甘氨酰氨基酸或丝氨酰氨基酸,X表示任意氨基酸,D/E表示天冬氨酸或谷氨酸。
在这个位点上,3C蛋白酶能够特异性地水解蛋白质,从而发挥其生物学功能。
3. 3C蛋白酶酶切位点的应用
由于3C蛋白酶能够特异性地水解蛋白质,因此它被广泛应用于生物学研究中。
例如,在病毒复制研究中,研究人员常常使用3C蛋白酶来裂解病毒蛋白,以便研究病毒复制的机制。
此外,在蛋白质相互作用研究中,研究人员也常常使用3C蛋白酶来切割蛋白质,以便研究蛋白质相互作用的机制。
4. 3C蛋白酶酶切位点的注意事项
在使用3C蛋白酶进行酶切时,需要注意以下几点。
首先,酶切位点需要严格控制,以免对目标蛋白产生不必要的影响。
其次,酶切时间和温度也需要严格控制,以免过度水解或过度热失活。
最后,需要注意酶切产物的纯度和活性,以便后续实验的进行。
5. 结论
3C蛋白酶是一种重要的酶,在生物学研究中有着广泛的应用。
其酶切位点为“Q-G/S-X-X-D/E”,需要严格控制酶切条件和产物的纯度和活性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白酶酶切位点
木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素
胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写
名称三字符号单字符号
丙氨酸Ala A
精氨酸Arg R
天冬氨酸Asp D
半胱氨酸Cys C
谷氨酰胺Gln Q
谷氨酸Glu/Gln E
组氨酸His H
异亮氨酸Ile I
甘氨酸Gly G
天冬酰胺Asn N
亮氨酸Leu L
赖氨酸Lys K
甲硫氨酸Met M
苯丙氨酸Phe F
脯氨酸Pro P
丝氨酸Ser S
苏氨酸Thr T
色氨酸Trp W
酪氨酸Tyr Y
缬氨酸Val V
【生化】特异性蛋白酶的酶切位点
胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
胰凝乳蛋白酶phe、trp、tyr 等疏水aa。
胃蛋白酶phe、trp、tyr等疏水aa。
木瓜蛋白酶arg、lys。
葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。
碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。
梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。
CNBr断裂Met。
羟胺断裂asn—gly间的肽键。
二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。
木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。
木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。
木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。
木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。
至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。
纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)溶菌酶,分子量25000,约占可溶性蛋白质的20%;及纤维素酶等不同的酶。
番木瓜未成熟果实中含有木瓜蛋白酶(Papain)、木瓜凝乳蛋白酶A(Chymopapain A )、木瓜凝乳蛋白酶B(Chym opapain B )、木瓜肽酶B (PapayaPeptidase B ) 等多种蛋白水解酶。
且已知四种半胱氨酸蛋白酶的一级结构具有高度的同源性。
其中,木瓜蛋白酶属巯基蛋白酶,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N-端具有二个羧基的氨基酸或芳香L-氨基酸的肽键。
木瓜蛋白酶papain属巯基蛋白酶,具有较宽的底物特异性,作用于蛋白质中L-精氨酸、L-赖氨酸、甘氨酸和L-瓜氨酸残基羧基参与形成的肽键。
此酶属内肽酶,能切开全蛋蛋白质分子内部肽链—CO-NH—生成分子量较小的多肽类。
最适合pH值5.7(一般3~9.5皆可),在中性或偏酸性时亦有作用,等电点I= 8.75;最适合温度55~60℃(一般10~85℃皆可),耐热性强,在90℃时也不会完全失活;受氧化剂抑制,还原性物质激活。
胃蛋白酶为什么不水解自身_百度文库
胃蛋白酶是一种酸性蛋白酶。
由胃部中的胃粘膜主细胞释放出没有活性的胃蛋白酶原。
酶原在遇到由胃壁细胞所释放的胃酸中的盐酸后切去44个氨基酸残基将被激活,其最适pH值约为1.5~2.2,在中性或碱性pH值的溶液中,胃蛋白酶会发生解链而丧失活性。
胃蛋白酶在对蛋白质或多肽进行水解时,具有一定的氨基酸序列特异性,倾向于水解氨基端或羧基端为芳香族氨基酸(苯丙氨酸、色氨酸和酪氨酸)或亮氨酸的肽键。
胰蛋白酶和糜蛋白酶:
糜蛋白酶潜在切点太多了,你联合用的话会出好多峰,要控制好反应时间或者建议glu-C 配合trypsin 切E + K + R
或glu-C + lysyl endopeptidase 切E + K
都很特异,比较好的结果,顺便说一下trypsin太猛不要放太多。
搭配糜蛋白酶反应要彻底点,主要的切点W Y F T。
