重组蛋白酶K使用说明
蛋白酶k配制、使用方法及作用

蛋白酶k配制、使用方法及作用蛋白酶K是一种常用的酶制剂,具有广泛的应用领域,下面将详细介绍它的配制方法、使用方法及作用。
蛋白酶K的配制方法比较简单,一般可按照以下步骤进行:1. 准备一定浓度的蛋白酶K酶制剂。
通常我们可以购买到蛋白酶K的商业制剂,也可以从合适的菌株中提取纯化蛋白酶K。
2. 将蛋白酶K粉末溶解在适宜的缓冲液中。
常用的缓冲液可以选择0.1M Tris-HCl(pH7.5)或者PBS(磷酸盐缓冲液)等。
3. 根据实验需求,可以调节蛋白酶K的浓度。
通常浓度为10-50μg/ml之间。
蛋白酶K的使用方法主要分为两种情况:1. 蛋白酶K用于蛋白质的纯化。
在蛋白纯化过程中,蛋白酶K可以用于除去污染物中的蛋白质,如核酸、脂质等。
在纯化过程中,将蛋白酶K加入到待纯化的蛋白质溶液中,经过一定时间的反应,蛋白酶K可以选择性地降解污染物,从而提高纯化效果。
2. 蛋白酶K用于蛋白质的消化。
在一些实验中,需要将蛋白质进行部分或完全地降解,以便进一步研究其功能或结构。
蛋白酶K可以切割蛋白质链中特定的氨基酸残基,从而实现蛋白质消化的目的。
将适量的蛋白酶K加入蛋白质溶液中,经过一定时间的反应,蛋白质可以被降解成较小的片段。
蛋白酶K的作用主要有以下几个方面:1. 选择性降解污染物。
蛋白酶K在蛋白纯化过程中,具有很高的特异性,可以选择性地降解污染物,从而提高纯化效果。
2. 促进蛋白质的降解。
蛋白酶K可以选择性地切割蛋白质链中特定的氨基酸残基,从而促进蛋白质的降解,有助于进一步研究蛋白质的功能和结构。
3. 提高实验效果。
在一些实验中,特定的蛋白质消化可以提高实验效果,如Western blotting中的蛋白质转膜效果,蛋白质结构分析中的质谱检测等。
综上所述,蛋白酶K是一种常用的酶制剂,通过选择性降解污染物和促进蛋白质降解的作用,能够在蛋白质纯化和实验研究中发挥重要的作用。
在使用时,我们需要根据具体需求选择适当的配制方法和使用条件,以获得较好的实验效果。
蛋白酶k在核酸提取的作用

蛋白酶k在核酸提取的作用蛋白酶K是一种广泛应用于核酸提取中的蛋白酶。
它属于一种碱性蛋白酶,其分子量为28 kDa。
它可以在非常广泛的PH范围内活性发挥,不会受到对数从而丢失活性。
此外,它在宽范围的温度下活性较高,这使得它在破坏细菌细胞壁和去除核酸中的蛋白质方面非常有用。
蛋白酶K可以高效地降解许多不同的蛋白质,因此在核酸提取中它的作用非常重要。
由于细胞膜的存在,使得核酸在提取之前需要先破碎细胞壁,蛋白酶K可以发挥其高效的降解蛋白质的能力,有助于破坏菌细胞壁,将细胞膜破裂,激发各种酶的活性,使核酸得以更容易地被提取。
此外,在细胞膜破裂方面蛋白酶K也具有很好的可控性和选择性,不会造成过度破碎,以至于破坏了核酸。
在核酸提取的过程中,细胞的蛋白质也是需要清除的。
蛋白酶K能够清除细胞内部含有的蛋白质,从而达到更好地提取DNA或RNA的效果。
因为这些蛋白质具有不同程度的被保护性,如果不进行清除,很容易影响到实验数据的准确性。
蛋白酶K可以通过特定的方式清除蛋白质,而不会对DNA或RNA的提取造成太大的影响。
此外,蛋白酶K作为一种比其他酶都更具有广谱性和特异性的蛋白酶,它可以通过不同的途径和机制来去除高度离子化和脂溶性的化合物以及有毒物质,从而为核酸的提取和实验后的研究打下了坚实的基础。
在实验室的核酸提取中,蛋白酶K是一种非常重要的酶,它可以很好地协助实验人员完成细胞膜的破裂并去除蛋白质。
此外,由于其非常广谱性的特点,它还可以帮助清除实验中的一些有毒的化学物质。
因此,蛋白酶K在细胞生物学和分子生物学领域具有广泛的应用前景,对于细胞组份分析,单细胞分析,核酸定量检测等方面具有广泛的应用价值,已经成为分子生物学领域中不可或缺的工具之一。
裂解液和蛋白酶k

裂解液和蛋白酶k全文共四篇示例,供读者参考第一篇示例:裂解液是一种用于蛋白质降解的酶解液,能够将蛋白质分解成更小的肽段或氨基酸。
裂解液可用于生物化学实验中,以帮助研究人员了解蛋白质的结构和功能。
其中一种常用的裂解液是蛋白酶K,它是一种特异性的蛋白酶,能够识别和切割蛋白质中特定的氨基酸序列。
蛋白酶K最初从金黄色葡萄球菌中分离出来,因此也被称为金黄葡萄球菌蛋白酶K。
它是一种内切蛋白酶,主要作用于蛋白质分子的内部,将蛋白质分解成较短的肽段。
蛋白酶K主要识别和切割具有亮氨酸的肽键,通常切割的蛋白质序列为拉链式结构。
这些特性使得蛋白酶K成为一种非常有效的蛋白酶,可以用于蛋白质的定量分析和序列分析等实验中。
在生物化学实验中,蛋白酶K通常与其他蛋白酶一起使用,以实现更全面的蛋白质裂解。
常常将酸性蛋白酶和胰蛋白酶与蛋白酶K一起使用,以实现对各种类型蛋白质的全面降解。
通过使用多种不同特性的蛋白酶,可以更全面地了解蛋白质的结构和功能,为后续的研究工作提供重要的信息。
除了在生物化学实验中的应用外,蛋白酶K还被广泛应用于食品工业和生物技术领域。
在食品工业中,蛋白酶K被用于生产各种蛋白质基的食品添加剂,如增稠剂、发酵剂和增味剂等。
在生物技术领域,蛋白酶K则被用于蛋白质的纯化和分析,以及基因工程技术中的蛋白质合成和修饰等方面。
第二篇示例:裂解液和蛋白酶K是生物化学领域中常用的两种工具,它们在生物学和生物技术领域有着广泛的应用。
裂解液是一种含有多种蛋白酶的混合物,用来降解复杂蛋白质分子为小分子肽或氨基酸。
而蛋白酶K 则是一种特殊的蛋白酶,具有较高的特异性和活性,常用于蛋白质的裂解和鉴定。
裂解液是由多种蛋白酶组成的混合物,常见的成分包括胃蛋白酶、胰蛋白酶、木瓜蛋白酶等。
这些蛋白酶在不同的PH值和温度条件下具有不同的活性,可以针对不同类型的蛋白质进行裂解。
一般来说,裂解液的制备需要注意蛋白酶的选择、浓度控制、PH值和温度的调节等因素,以保证裂解效果和裂解产物的纯度。
蛋白酶k失活温度

蛋白酶k失活温度
蛋白酶K是一种非常重要的酶,它是一种特殊的蛋白酶,非常适合用
于蛋白质的裂解,能够将各种大小的蛋白质与肽断裂成较小的片段,
因此在生物化学实验中得到了广泛的应用。
但是,在使用蛋白酶K的
过程中需要注意到一些温度方面的问题,其中失活温度就是比较重要
的一个方面。
蛋白酶K是一种特殊的酶,它非常适合用于分析蛋白质的构建分析,
特别是分析蛋白质中的氨基酸序列。
在使用蛋白酶K时,需要注意到
失活温度这个问题。
一般来说,蛋白酶K的失活温度是在60~70℃之间,超过这个温度就可能导致蛋白酶K的失活。
蛋白酶K的失活温度是指这种酶所能承受的最高温度。
当温度超过其
失活温度时,蛋白酶K的分子结构就会发生变化,致使其酶活性降低,重新折叠的能力也下降,从而导致其失活。
因此,如果在使用过程中
温度过高,就会导致蛋白酶K的酶活性下降,不能对目标蛋白质进行
有效裂解,从而影响后续的实验和结果。
为了避免这种情况的发生,使用者要注意在使用蛋白酶K时,需要控
制好温度。
通常建议温度设置在40~60℃之间,确保在蛋白酶K的适宜温度范围内使用,可以有效的保持其酶活性,同时也应注意所加入
的缓冲液的温度,避免温度过高导致蛋白酶K的失活。
总之,蛋白酶K是一种非常有用的酶,它在分析蛋白质时能够发挥重要作用。
但是,在使用蛋白酶K时要注意控制好温度,避免超过其失活温度,影响其酶活性。
对于温度控制不好的时候,可以考虑进行降温,恢复其酶活性,从而保证实验结果的准确性和可靠性。
蛋白酶k作用

蛋白酶k作用蛋白酶K是一种酶,它对某些蛋白质的降解具有特别的作用。
在本文中,我将通过分步骤的方式来阐述蛋白酶K的作用。
步骤一:了解蛋白酶K蛋白酶K是一种丝氨酸蛋白酶,它在一定程度上可以减少蛋白质的降解时间。
它的作用是使蛋白质进一步降解,成为可以被消化吸收的氨基酸。
步骤二:了解蛋白质的降解在身体消化吸收中,蛋白质需要被降解成为小分子的氨基酸,然后被吸收进入体内。
这个过程需要依赖于多种蛋白酶的作用,蛋白酶K就是其中的一种。
步骤三:蛋白酶K在消化中的作用正常情况下,蛋白质的消化需要在胃酸的作用下进行。
然后,胃液中的其他酶类可以将蛋白质进一步降解。
其中,蛋白酶K在胰液的作用下,可以进一步分解蛋白质为更小的氨基酸。
步骤四:蛋白酶K在保健中的应用随着科学技术的不断进步,人们对于蛋白质的消化吸收也越来越关注。
一些保健品中含有蛋白酶K等辅酶,在帮助消化吸收蛋白质方面起到了较好的作用。
例如,一些蛋白质粉中,会添加蛋白酶K等物质,帮助人体更好地消化蛋白质。
步骤五:蛋白酶K的注意事项尽管蛋白酶K对于蛋白质入体消化吸收具有较好的作用,但是需要注意的是,过量的摄入可能会对身体造成不良的影响。
因此,在使用蛋白酶K或者含有蛋白酶K的保健品前,需要咨询专业医生或者保健师的意见。
综上所述,蛋白酶K作为一种丝氨酸蛋白酶,在蛋白质消化降解方面具有一定的作用。
在人们日常的保健中,蛋白酶K也被广泛应用于蛋白质粉、饮品等保健品中。
但是,我们需要注意,对于蛋白酶K 的使用需要谨慎,不能过度摄入。
1911 蛋白酶K

使用方法: 根据实验需要使用,用纯水稀释。
相关产品:
产品 总蛋白提取试剂盒 核蛋白提取试剂盒 膜/胞浆/核蛋白分步提取试剂盒
产品号 BB-3101 BB-3102 BB-3104
产品 磷酸化蛋白富集试剂盒 膜蛋白提取试剂盒 活性蛋白提取试剂盒
产品号 BB-3108 BB-3103 BB-3106
400-8363-211
本产品仅供科学研究使用!请勿用于临床1 BB-3121 BB-3122 BB-3123 BB-3125 BB-3126 BB-3105 BB-3181 BB-3183 BB-3187
产品说明书
BCA 蛋白定量试剂盒 植物核蛋白提取试剂盒 细菌膜蛋白提取试剂盒 植物总蛋白提取试剂盒 植物膜蛋白提取试剂盒 蛋白酶抑制剂混合物 真菌蛋白提取试剂盒 磷酸酶抑制剂混合物 细菌蛋白提取盒(2D 电泳用) 酵母蛋白提取盒(2D 电泳用) 线粒体蛋白提取盒(2D 电泳用)
蛋白酶 K(20mg/ml)
货号:BB-1911
试剂盒储存条件: -20℃保存。
试剂盒组成:
产品组成 规格
蛋白酶 K(20mg/ml) 使用说明书
有效期: 一年。
BB-1911-1 1ml 1ml 1
BB-1911-2 5ml 1ml*5 1
产品说明书 V2.16
组份编号 31010A
※ ※ ※ 使用前请仔细阅读产品说明书 ※ ※ ※
-1-
咨询邮箱:bestbio@ 电话:021-33921235
400-8363-211
本产品仅供科学研究使用!请勿用于临床、诊断、食品、化妆品检测等用途!
产品说明书
● 样品或试剂被细菌或真菌污染或试剂交叉污染可能会导致错误的结果。 ● 最好使用一次性吸头、管、瓶或玻璃器皿,可重复使用的玻璃器皿必须在使用前清
蛋白酶k孵育方法

蛋白酶k孵育方法蛋白酶K孵育方法是一种在生物实验中广泛应用的技术,主要用于降解蛋白质分子,从而实现对生物大分子相互作用的研究。
本文将详细介绍蛋白酶K 孵育方法的操作步骤、应用领域及注意事项,以帮助实验者更好地掌握这一重要技术。
一、蛋白酶K孵育方法的操作步骤1.准备实验材料:蛋白酶K、酶标仪、蛋白质样品、缓冲液等。
2.配制蛋白酶K工作液:根据实验需要,将蛋白酶K溶解在缓冲液中,制备成适当浓度的蛋白酶K工作液。
3.样品处理:将待降解的蛋白质样品加入蛋白酶K工作液中,充分混合。
4.孵育:将混合液放入恒温培养箱中,进行适当时间的孵育。
孵育温度和时间需要根据蛋白酶K的活性以及实验目的进行调整。
5.终止反应:孵育结束后,加入终止缓冲液,终止蛋白酶K的活性。
6.检测:用酶标仪检测蛋白质降解程度,可以通过测量吸光度或荧光强度等方法进行。
二、蛋白酶K孵育方法的应用领域1.蛋白质降解研究:蛋白酶K孵育方法可以用于研究蛋白质之间的相互作用,以及蛋白质在生物体内的降解机制。
2.酶动力学研究:通过蛋白酶K孵育方法,可以测定酶的活性、酶促反应速率等参数,为酶动力学模型构建提供实验数据。
3.药物筛选:蛋白酶K孵育方法可用于筛选具有抑制蛋白酶活性的潜在药物,为药物研发提供依据。
三、注意事项1.蛋白酶K活性较高,容易降解蛋白质,因此在操作过程中需注意防护,避免与皮肤和眼睛接触。
2.孵育过程中,应根据实验需求严格控制温度和时间,以保证蛋白质降解效果。
3.终止反应时,应充分混合终止缓冲液,以确保蛋白酶K活性被完全终止。
4.蛋白酶K孵育方法中的缓冲液配制和实验条件需根据具体实验要求进行优化,以获得较好的实验结果。
总之,蛋白酶K孵育方法是一种具有广泛应用价值的生物实验技术。
通过对操作步骤、应用领域和注意事项的掌握,实验者可以更好地应用这一技术,为生物科学研究和药物开发提供有力支持。
蛋白酶k实验检测报告
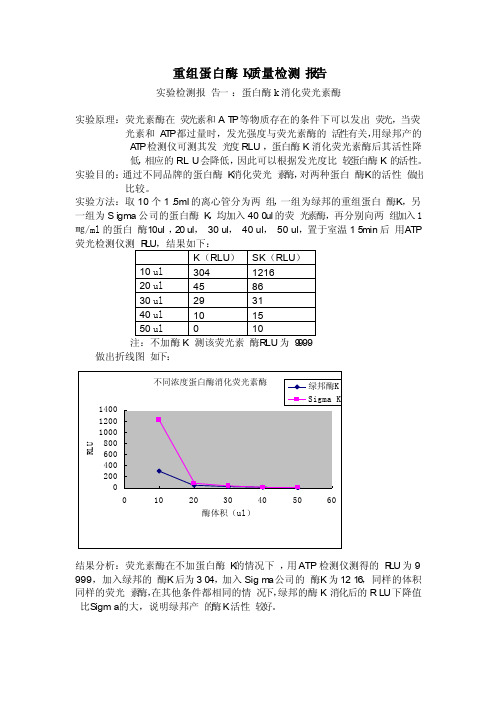
重组蛋白酶K质量检测报告实验检测报告一:蛋白酶k消化荧光素酶实验原理:荧光素酶在荧光素和AT P等物质存在的条件下可以发出荧光,当荧光素和A T P都过量时,发光强度与荧光素酶的活性有关,用绿邦产的A T P检测仪可测其发光度RLU,蛋白酶K消化荧光素酶后其活性降低,相应的RLU会降低,因此可以根据发光度比较蛋白酶K的活性。
实验目的:通过不同品牌的蛋白酶K消化荧光素酶,对两种蛋白酶K的活性做出比较。
实验方法:取10个1.5ml的离心管分为两组,一组为绿邦的重组蛋白酶K,另一组为Sigma公司的蛋白酶K,均加入400ul的荧光素酶,再分别向两组加入1㎎/ml的蛋白酶10ul,20 ul,30 ul,40 ul,50 ul,置于室温15min后用ATP 荧光注:不加酶K 测该荧光素酶R LU为9999做出折线图如下:结果分析:荧光素酶在不加蛋白酶K的情况下,用ATP检测仪测得的R LU为9999,加入绿邦的酶K后为304,加入Sigm a公司的酶K为1216,同样的体积同样的荧光素酶,在其他条件都相同的情况下,绿邦的酶K消化后的RLU下降值比Sigma的大,说明绿邦产的酶K活性较好。
实验检测报告二:蛋白酶K消化酪蛋白实验原理:酪蛋白在A280与A650有紫外吸收峰,由分光光度计测吸光值可检测酪蛋白被酶消化的量,进而比较两种不同品牌蛋白酶K的活性。
实验方法:⒈配制10㎎∕ml的酪蛋白溶液⒉将绿邦公司的蛋白酶K和Sigma公司的蛋白酶K配成1.5㎎∕ml用于检检测实验:⒊取十个1.5 ml的离心管分为两组,一组为绿邦的酶K(zk),一组为Sigma公司的酶K(sk),分别向离心管中加入以下试剂:800ul酪蛋白+100ulK+250ul水800ul酪蛋白+150ulK+200ul水800ul酪蛋白+200ulK+150ul水800ul酪蛋白+250ulK+100ul水800ul酪蛋白+300ulK+50ul水⒋室温条件下,吸混匀后的混合液稀释10倍测OD650,结果如下:5.室温条件下,吸混匀后的混合液稀释10倍测OD280,结果如下:通过A280与A650紫外吸收值的不同时间变化比较,发现绿邦的蛋白酶K的消化能力要稍微好于Sigma的蛋白酶K。
总DNA提取(蛋白酶K法)

改进蛋白酶K法提取环境微生物样品总DNA(Zhu S)
所需试剂:
0.15M NaCl
0.1M EDTA
1% SDS
NaAc (3M, pH 5.2)
蛋白酶K溶液20mg/ml (用无菌水配制)
溶菌酶溶液50mg/ml (用无菌水配制)
液氮
实验步骤:
(1)将适量环境样品(如土壤或污泥)装入1.5 ml Eppendorf管;
(2)加入1 ml 0.15M NaCl-0.1M EDTA;
(3)加入溶菌酶(sigma)至终浓度为2mg/ml并置于37℃水浴中温育1h;
(4)冻融三个循环(液氮3 min-65℃干热器3min);
(5)分别加入蛋白酶K溶液和SDS至终浓度为0.02和0.5%(wt / vol每一百ml 溶
液中溶质克数),65℃温育1h;
(6)裂解液依次用等体积的酚、酚-氯仿-异戊醇(25:24:1)、氯仿抽提;
(7)加入1/4体积的NaAc (3M, pH 5.2)和2体积冷的纯乙醇沉淀核酸;-20℃放
置1h;
(8)离心收集12000prm,10min,回收DNA沉淀;
(9)DNA沉淀用70%乙醇和无水乙醇洗涤后风干;
(10)每管加入30-50ulTE(Tris-HCl缓冲液)回溶及电泳检测,-20℃保存。
注:这种方法比较适合提取土壤环境微生物样品的总DNA。
因为本法没有利用机械力量破碎细胞,因而所提取到的总DNA受机械剪切的程度较少,故用这种方法提出的DNA进行PCR扩增,其产物通常含有较少的嵌合体(chimera)。
人组织蛋白酶K(cath-K)说明书
白酶 K(cath-K)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入组织蛋白酶
K(cath-K),再与 HRP 标记的组织蛋白酶 K(cath-K)抗体结合,形成抗体-抗原-酶标抗体复合
物,经过彻底洗涤后加底物 TMB 显色。TMB 在 HRP 酶的催化下转化成蓝色,并在酸的作
用下转化成最终的黄色。颜色的深浅和样品中的组织蛋白酶 K(cath-K)呈正相关。用酶标仪
大于标准品孔第一孔的 OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计 算时请最后乘以总稀释倍数(×n×5)。 5. 封板膜只限一次性使用,以避免交叉污染。 6.底物请避光保存。 7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准. 8.所有样品,洗涤液和各种废弃物都应按传染物处理。 9.本试剂不同批号组分不得混用。 10. 如与英文说明书有异,以英文说明书为准。 保存条件及有效期 1.试剂盒保存:;2-8℃。 2.有效期:6 个月
用完,板条应装入密封袋中保存。 2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。 3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。一次加样时间最好
控制在 5 分钟内,如标本数量多,推荐使用排枪加样。 4. 请每次测定的同时做标准曲线,最好做复孔。如标本中待测物质含量过高(样本 OD 值
在 450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人组织蛋白酶 K(cath-K)
浓度。
试剂盒组成
1 30 倍浓缩洗涤液
20ml×1 瓶
7 终止液
6ml×1 瓶
2 酶标试剂
6ml×1 瓶
8 标准品(240pg/ml) 0.5ml×1 瓶
蛋白酶K溶液说明书

北京索莱宝科技有限公司
蛋白酶K溶液(10mg/ml)说明书
货号:P1120
规格:1ml/5ml
保存:-20℃储存,有效期至少12个月。
产品说明:
Proteinase K,中文名为蛋白酶K。
进口产品配置,不含DNase,不含RNase,可直接使用。
可以用于消化各种蛋白。
用于各种常见的分子生物学、细胞生物学等相关实验,例如基因组DNA抽提、酶的消化去除等。
酶活力>30U/mg。
在37ºC、pH7.5条件下,每分钟可水解底物酪蛋白生成1µmol酪氨酸所需蛋白酶K的量,定义为一个单位(U)蛋白酶K酶活力。
在很宽的pH范围内有效,有效的pH范围为pH4.0-12.5,最佳pH范围为pH7.5-8.0。
蛋白酶K的最佳反应温度为65℃,但在65℃或更高的温度蛋白酶K自身的也非常迅速地降解。
很多时候反应温度选择50-55℃。
在0.2-1%SDS或约10mM尿素存在的情况下,蛋白酶K显示更高的酶活性。
蛋白酶K的常用工作浓度为0.05-1mg/ml,根据所用缓冲液是否含有SDS、尿素、pH是否适合、温度是否适合等因素确定具体的工作浓度。
常用浓度的EDTA、Triton X-100、Tween20、Sarkosyl、盐酸胍对蛋白酶K的活力影响不大。
注意事项:
如果每次的使用量很小,可以适当分装后再使用。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
第1页共1页。
重组蛋白酶K使用说明

重组蛋白酶K使用说明酶活:45U/mg蛋白保存:-20℃保存,有效期至少2年。
产品简介:蛋白酶K是一种枯草蛋白酶类的高活性蛋白酶,从林伯氏白色念球菌(tritirachium album limber)中纯化得到,用于生物样品中蛋白质的一般降解。
该酶有两个ca2+结合位点,它们离酶的活性中心有一定距离,与催化机理并无直接关系。
然而,如果从该酶中除去ca2+,由于出现远程的结构变化,催化活性将丧失80%左右,但其剩余活性通常已足以降解在一般情况下污染酸制品的蛋白质。
蛋白酶K是一种切割活性较广的丝氨酸蛋白酶。
它切割脂族氨基酸和芳香族氨基酸的羧基端肽键。
在较广的pH范围内(pH4-12.5)均有活性,在尿素和SDS中也较为稳定,还具有降解天然蛋白质的能力。
蛋白酶K的用途广泛,主要的应用行业包括:医疗及基础研究领域:基因诊断试剂盒;基因组DNA提取试剂盒;RNA提取试剂盒中取出DNA和RNA制备中的核酸酶;此外,还应用于:皮革工业(皮革软化及精细化、脱毛和软化、蚕丝脱胶)制备脉冲电泳的染色体DNA;提取组织中非蛋白成分时,降解含有蛋白质杂质;食品、酿造工业:肉类嫩化、酒类澄清;洗涤工业:酶洗衣粉、洗衣液等也有应用。
使用说明:蛋白酶K配成液态后-20ºC保存12个月。
溶解后,建议分装保存,避免反复冻溶。
如果需要在2~8ºC环境下放置,超过3天后,建议过滤除菌或加入抑菌剂如0.3%叠氮化钠,防止微生物污染。
稀释缓冲液根据需要,利用20mM Tris-HCL缓冲液(pH7.5)溶解成20mg/ml的工作浓度质量说明活性单位定义37ºC、pH7.5条件下,每分钟可水解底物酪蛋白生成1µmol酪氨酸所需蛋白酶K的量,定义为一个单位(U)。
脱氧核糖核酸酶残留以λDNA为底物,37ºC消化4小时以上,未检测到脱氧核糖核酸酶活性。
核糖核酸酶残留37ºC消化12小时以上,未检测到核糖核酸酶活性。
重组蛋白酶K

重组蛋白酶K蛋白酶K来源于林伯氏白色念球菌(Tritirachium album limber)的蛋白酶K 基因,我公司采用基因突变技术,对基因进行定点突变后,将其重组到酵母染色体上,利用发酵技术,通过诱导获得高活性的重组蛋白酶K,通过基因改造后,提高大大提高了酶的活性,蛋白酶K是一种切割活性较广的丝氨酸蛋白酶。
在pH 4到pH 12的条件下均有活性,在SDS、尿素或EDTA存在时亦很稳定。
它切割脂族氨基酸和芳香族氨基酸的羧基端肽键,用于生物样品中蛋白质的降解。
此酶经脱色和色谱纯化去除了RNA和DNA,也检测不到其它杂酶活性。
由于蛋白酶K在尿素和SDS中稳定,还具有降解天然蛋白质的能力,因而它应用很广泛,主要用在基因诊断试剂盒、基因组DNA提取试剂盒、RNA提取试剂盒中去除DNA和RNA制备中的核酸酶,也可以于提取组织中非蛋白成份降解含有蛋白质的杂质。
譬如DNA疫苗和肝素的制备等。
规格:100毫克每支或根据客户需求分装成指定规格比活性值:大于40 U/mg。
来源种属:林伯氏白色念球菌(Tritirachium album limber)分子质量:28,650储存和使用:干粉状态可在4ºC条件下低温保藏。
溶解后分装为客户所需浓度,-20ºC贮存。
运输可在常温下进行。
酶最适温度为37℃。
干粉条件下有效期为12个月,液态时-20ºC保存8个月,溶解状态下最好分装成若干份,方便使用,最好禁止反复冻溶。
实验提示1.通常使用终浓度为20mg/毫升用于核酸分离2.富含蛋白成分的样品可增加试剂用量,例如200毫克肝组织,需2.5毫克蛋白酶K3.理想孵育温度为37-50℃左右4.孵育时间为15分钟至48小时;理想孵育时间为2小时稀释缓冲液:20 mM Tris-HCL缓冲液(pH 7.5),客户根据需要,利用稀释缓冲液溶解成所需浓度。
质量控制:使用承诺绿邦秉着“信誉至上、客户满意、质量承诺”的宗旨为我们的用户提供优质产品和服务。
蛋白酶k 过硫酸铵

蛋白酶k 过硫酸铵
蛋白酶K是一种特定的蛋白酶,它属于内切酶,可以特异性地
水解酪氨酸残基。
蛋白酶K通常被用于蛋白质的纯化和分析,因为
它可以在特定的酪氨酸残基处切割蛋白质分子,从而产生特定的片段。
这对于研究蛋白质的结构和功能非常有用。
过硫酸铵是一种常用的沉淀剂,常用于蛋白质的沉淀和富集。
通过加入过硫酸铵,可以使蛋白质沉淀出来,从而方便后续的纯化
和分析。
过硫酸铵沉淀法是一种常见的蛋白质富集方法,适用于大
多数蛋白质。
当这两者结合在一起使用时,可以实现对蛋白质的高效纯化和
富集。
首先使用蛋白酶K对蛋白质进行特异性切割,然后加入过硫
酸铵沉淀蛋白质,从而可以得到高纯度的特定蛋白质片段。
这种方
法常用于蛋白质组学研究和蛋白质功能分析中。
总的来说,蛋白酶K和过硫酸铵在蛋白质研究中起着重要作用,它们可以相互配合,实现对蛋白质的高效纯化和分析。
这些方法对
于揭示蛋白质的结构和功能具有重要意义,对生物医学研究和药物
开发具有重要意义。
组织蛋白酶k重组蛋白人源-概述说明以及解释

组织蛋白酶k重组蛋白人源-概述说明以及解释1.引言1.1 概述概述组织蛋白酶k是一种重要的酶类,具有广泛的生物活性和生理功能。
在细胞内参与多种生物学过程,如细胞信号传导、蛋白质降解和基因转录调控等。
鉴于其在细胞调控中的重要作用,人们越来越关注组织蛋白酶k 的功能和机制。
本文主要关注组织蛋白酶k的重组蛋白人源,即将其进行人工合成和改造,使其能够更好地适应人体环境和需求。
重组蛋白人源的研究对于深入了解组织蛋白酶k的结构和功能,并且为相关疾病的治疗提供有效的工具和方法具有重要意义。
在本文中,我们将首先介绍组织蛋白酶k的重要性,包括其在细胞调控中的作用和其与疾病发生发展的关联。
接着,我们将对组织蛋白酶k的结构和功能进行详细的探讨,以便更好地理解其重组蛋白人源的需求和改造方向。
通过对重组蛋白人源的研究,我们可以改善其在医学领域的应用前景,例如用于疾病的预防和治疗。
此外,我们还将探讨重组蛋白的发展趋势,包括基因工程技术在重组蛋白人源中的应用、重组蛋白药物的研发和生产等方面。
综上所述,研究组织蛋白酶k的重组蛋白人源具有重要的现实意义和应用前景,对于推进医学科学的发展和相关疾病的治疗具有重要的意义。
本文将围绕此主题展开讨论,并通过详细的研究和探讨,为相关领域的研究提供有价值的参考和指导。
文章结构部分内容如下:1.2 文章结构本文章主要包含引言、正文和结论三部分。
引言部分介绍了本篇文章的概述、文章结构和目的。
正文部分主要分为两个小节,分别是组织蛋白酶k的重要性和蛋白酶k的结构和功能。
在组织蛋白酶k的重要性一节中,会详细介绍组织蛋白酶k在生物体内的作用和功能,以及其在相关领域的应用价值。
在蛋白酶k的结构和功能一节中,会对其分子结构进行解析,并探讨其在酶学中的功能和作用机制。
结论部分由两个小节组成,分别是重组蛋白的应用前景和重组蛋白的发展趋势。
在重组蛋白的应用前景一节中,会探讨重组蛋白在医药领域、工业生产和科学研究中的应用前景,以及其在新药开发、治疗疾病等方面的潜力。
蛋白酶k降解蛋白的机制

蛋白酶k降解蛋白的机制
蛋白酶K是一种酶类分子,常用于分解蛋白质。
蛋白酶K的降解
机制基于其具有特殊的基序结构,该结构能够与蛋白质中的氨基酸序
列相互作用,将其分解成更小的分子。
蛋白酶K主要靠其特殊的催化活性对蛋白质进行降解。
在分解过
程中,蛋白酶K的分子将其分子中的水分子活化,形成了与水分子结
合的活性中心,这个活性中心包括一个催化酯结构。
在水分子的帮助下,蛋白酶K会攻击蛋白质中的亚硫酸酯键,将其降解为较小的单元,然后迅速释放蛋白质残基,并继续降解蛋白质,直到降解为氨基酸为止。
在这个降解过程中,蛋白酶K不会对其他分子进行攻击,只会对
蛋白质进行分解。
这种高度选择性的催化活性表明,蛋白酶K在分解
蛋白质方面具有非常重要的作用。
因此,研究蛋白酶K的机制,可以
帮助人们更好地理解生物体内的废弃物质代谢过程,并可能有助于发
展治疗各种疾病的创新药物。
总之,蛋白酶K的降解机制是通过其特殊的基序结构以及催化活
性实现的。
这种降解机制贯穿了分解蛋白质中的整个过程,并展示了
蛋白酶K在降解蛋白质方面的高度选择性和催化活性。
蛋白酶k灭活方法

蛋白酶k灭活方法
蛋白酶K是一种特殊的蛋白酶,常用于灭活一些特定的蛋白质或去除其活性。
以下是常见的蛋白酶K的灭活方法:
1. 热灭活:将蛋白酶K暴露在高温下,通常在70-100摄氏度范围内,可以迅速灭活蛋白酶K活性。
热灭活是一种简单有效的灭活方法,适用于不敏感于高温的蛋白酶K。
2. 钙离子螯合剂:蛋白酶K的活性对钙离子依赖性较强,因此加入一些能与钙离子络合的化合物(如EDTA)可以灭活蛋白酶K。
加入适量的EDTA可以有效地结合蛋白酶K中的钙离子,破坏其活性。
3. 蛋白酶抑制剂:蛋白酶K可以被一些特定的蛋白酶抑制剂(如PMSF)灭活。
这些抑制剂可以与蛋白酶K中的活性位点结合,从而阻止其对底物的降解活性。
4. 酸碱处理:蛋白酶K对pH值较低(酸性条件)或较高(碱性条件)的环境敏感,可以通过改变pH值来灭活蛋白酶K。
这些方法可以单独使用或相互结合使用,以灭活蛋白酶K并保持样品的完整性。
选择合适的方法要根据具体的实验目的和蛋白酶K的特性来确定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重组蛋白酶K使用说明
酶活:45U/mg蛋白
保存:-20℃保存,有效期至少2年。
产品简介:
蛋白酶K是一种枯草蛋白酶类的高活性蛋白酶,从林伯氏白色念球菌(tritirachium album limber)中纯化得到,用于生物样品中蛋白质的一般降解。
该酶有两个ca2+结合位点,它们离酶的活性中心有一定距离,与催化机理并无直接关系。
然而,如果从该酶中除去ca2+,由于出现远程的结构变化,催化活性将丧失80%左右,但其剩余活性通常已足以降解在一般情况下污染酸制品的蛋白质。
蛋白酶K是一种切割活性较广的丝氨酸蛋白酶。
它切割脂族氨基酸和芳香族氨基酸的羧基端肽键。
在较广的pH范围内(pH4-12.5)均有活性,在尿素和SDS中也较为稳定,还具有降解天然蛋白质的能力。
蛋白酶K的用途广泛,主要的应用行业包括:医疗及基础研究领域:基因诊断试剂盒;基因组DNA提取试剂盒;RNA提取试剂盒中取出DNA和RNA制备中的核酸酶;此外,还应用于:皮革工业(皮革软化及精细化、脱毛和软化、蚕丝脱胶)制备脉冲电泳的染色体DNA;提取组织中非蛋白成分时,降解含有蛋白质杂质;食品、酿造工业:肉类嫩化、酒类澄清;洗涤工业:酶洗衣粉、洗衣液等也有应用。
使用说明:
蛋白酶K配成液态后-20ºC保存12个月。
溶解后,建议分装保存,避免反复冻溶。
如果需要在2~8ºC环境下放置,超过3天后,建议过滤除菌或加入抑菌剂如0.3%叠氮化钠,防止微生物污染。
稀释缓冲液
根据需要,利用20mM Tris-HCL缓冲液(pH7.5)溶解成20mg/ml的工作浓度
质量说明
活性单位定义
37ºC、pH7.5条件下,每分钟可水解底物酪蛋白生成1µmol酪氨酸所需蛋白酶K的量,定义为一个单位(U)。
脱氧核糖核酸酶残留
以λDNA为底物,37ºC消化4小时以上,未检测到脱氧核糖核酸酶活性。
核糖核酸酶残留
37ºC消化12小时以上,未检测到核糖核酸酶活性。
酶活性测定
酶纯度测定(SDS-PAGE)
结果:蛋白酶K 纯度超过99.2%(扫描SDS-PAGE 胶)
酶质检结果(来自于某大型生物技术有限公司)序号
检验项目检验标准
是否合格(合格√)
1
动物基因组提取(蛋白酶K 浓度为20mg/ml )不影响动物基因组的有效提取
√与不加蛋白酶K 的样品相比,能有效降解蛋白质
√2
降解蛋白质能力
与15ug BSA37℃孵育1小时,BSA 可有效降解
√
质检结论:合格(√)让步放行()需要复检()不合格()
蛋白酶K 比活性值
产品来源本产品Sigma 产品比活性值(U/mg)
45
>30
1059062452612
28.65。
