嘌呤霉素说明书教学内容
fugene 4k 转染试剂 中文说明书

2022版 CTM694原英文技术手册TM694中 文 说 明 书适用产品目录号:E5911和E5912FuGENE ®4K TransfectionReagent普洛麦格(北京)生物技术有限公司Promega (Beijing) Biotech Co., Ltd 地址:北京市东城区北三环东路36号环球贸易中心B座907-909电话:************网址:技术支持电话:400 810 8133技术支持邮箱:*************************CTM 6942022制作1所有技术文献的英文原版均可在/ protocols 获得。
请访问该网址以确定您使用的说明书是否为最新版本。
如果您在使用该试剂盒时有任何问题,请与Promega 北京技术服务部联系。
电子邮箱:*************************1. 描述 (2)2. 产品组分和储存条件 (2)3. 一般注意事项 (2)3. A. 转染试剂与DNA的比例 (3)3. B. DNA (3)3. C. 时间 (3)3. D. 血清 (3)3. E. 细胞培养条件 (3)3. F. 稳定转染 (3)4. 推荐操作步骤 (4)4. A. 细胞铺板 (5)4. B. FuGENE® 4K Transfection Reagent准备 (5)4. C. 一般转染操作步骤 (6)4. D. 稳定转染操作步骤 (8)4. E. 转染优化 (9)4. F. 报告基因活性和细胞健康的多重检测方案 (11)5. 疑难解答 (12)FuGENE® 4K Transfection Reagent普洛麦格(北京)生物技术有限公司Promega (Beijing) Biotech Co., Ltd 地址:北京市东城区北三环东路36号环球贸易中心B座907-909电话:************网址:技术支持电话:400 810 8133技术支持邮箱:*************************CTM 6942022制作21. 描述FuGENE® 4K Transfection Reagent是一个多组分,非脂质体试剂,用于将DNA高效、低毒地转染至多种哺乳动物细胞系中,无需在加入试剂-DNA复合物后更换培养基。
碧云天 L31600 pLenti-TLR2-sgRNA 产品说明书
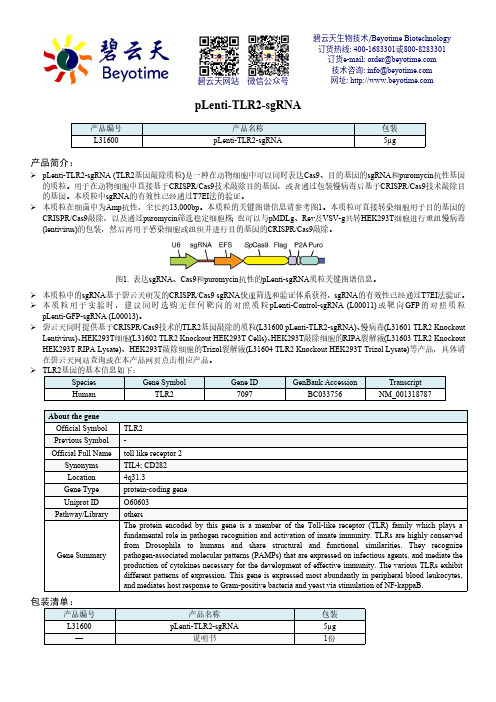
pLenti-TLR2-sgRNA产品简介:pLenti-TLR2-sgRNA (TLR2基因敲除质粒)是一种在动物细胞中可以同时表达Cas9、目的基因的sgRNA 和puromycin 抗性基因的质粒。
用于在动物细胞中直接基于CRISPR/Cas9技术敲除目的基因,或者通过包装慢病毒后基于CRISPR/Cas9技术敲除目的基因。
本质粒中sgRNA 的有效性已经通过T7EI 法的验证。
本质粒在细菌中为Amp 抗性,全长约13,000bp 。
本质粒的关键图谱信息请参考图1。
本质粒可直接转染细胞用于目的基因的CRISPR/Cas9敲除,以及通过puromycin 筛选稳定细胞株;也可以与pMDLg 、Rev 及VSV-g 共转HEK293T 细胞进行重组慢病毒(lentivirus)的包装,然后再用于感染细胞或组织并进行目的基因的CRISPR/Cas9敲除。
图1. 表达sgRNA 、Cas9和puromycin 抗性的pLenti-sgRNA 质粒关键图谱信息。
本质粒中的sgRNA 基于碧云天研发的CRISPR/Cas9 sgRNA 快速筛选和验证体系获得,sgRNA 的有效性已经通过T7EI 法验证。
本质粒用于实验时,建议同时选购无任何靶向的对照质粒pLenti-Control-sgRNA (L00011)或靶向GFP 的对照质粒pLenti-GFP-sgRNA (L00013)。
碧云天同时提供基于CRISPR/Cas9技术的TLR2基因敲除的质粒(L31600 pLenti-TLR2-sgRNA)、慢病毒(L31601 TLR2 Knockout Lentivirus)、HEK293T 细胞(L31602 TLR2 Knockout HEK293T Cells)、HEK293T 敲除细胞的RIPA 裂解液(L31603 TLR2 Knockout HEK293T RIPA Lysate)、HEK293T 敲除细胞的Trizol 裂解液(L31604 TLR2 Knockout HEK293T Trizol Lysate)等产品,具体请在碧云天网站查询或在本产品网页点击相应产品。
嘌呤霉素盐酸盐58-58-2

14.3 运输危险类别
欧洲陆运危规 : 6.1
国际海运危规 : 6.1
国际空运危规 : 6.1
14.4 包裹组
欧洲陆运危规 : III
国际海运危规 : III
国际空运危规 : III
14.5 环境危害
欧洲陆运危规 :否
国际海运危规 海运污染物 :否
国际空运危规 : 否
14.6 对使用者的特别预防
无数据资料
6.2 环境预防措施
丢弃处理请参阅第160节
6.3 抑制和清除溢出物的方法和材料
避免接触皮肤和眼睛。避免形成粉尘和气溶胶。在有粉尘生成的地方,提供合适的排风设备。
7 安全操作与储存
7.1 安全操作的注意事项
无数据资料
7.2 安全储存的条件,包括任何不兼容性
无数据资料
7.3 特定用途
避免与皮肤、眼睛和衣服接触。休息前和操作本品后立即洗手。Aldrich-D60400页码4的7
4.2 最重要的症状和影响,急性的和滞后的
主要症状和影响,急性和迟发效应
4.3 及时的医疗处理和所需的特殊处理的说明和指示
如必要的话,戴自给式呼吸器去救火。
5 消防措施
5.1 灭火介质
火灾特征
https:// 1/4
化学品安全技术说明书
无数据资料 灭火方法及灭火剂 碳氧化物,氮氧化物,氯化氢气体,氢氰酸
吸入 可能引起眼睛刺激。 吞咽 无数据资料 皮肤 无数据资料 眼睛 无数据资料 接触后的征兆和症状 无数据资料 附加说明 无数据资料
https:// 3/4
化学品安全技术说明书
12 生态学资料
12.1 毒性
无数据资料
12.2 持久存留性和降解性
Polybrene (Hexadimethrine Bromide)说明书

Polybrene (Hexadimethrine Bromide)产品编号 产品名称包装 C0351-1ml Polybrene (Hexadimethrine Bromide) 10mg/ml×1mlC0351-50mgPolybrene (Hexadimethrine Bromide)50mg产品简介:Polybrene (聚凝胺),也称Hexadimethrine Bromide (海美溴铵),是一种聚溴化季铵阳离子,可显著提高慢病毒(lentivirus)、腺病毒(adenovirus)等病毒对细胞的感染效率。
本产品为进口分装。
Polybrene 的化学名称为1,5-Dimethyl-1,5-diazaundecamethylene polymethobromide ,分子式为(C 13H 30Br 2N 2)n ,CAS 号为28728-55-4,纯度≥94% (titration)。
Polybrene 可显著提高慢病毒、腺病毒等病毒对某些细胞的感染效率,其原理可能是通过中和细胞表面唾液酸与病毒颗粒之间的静电排斥从而促进吸附作用。
另外,Polybrene 也可用于哺乳动物细胞的转染、增强脂质体的转染效率。
带正电荷的Polybrene 也是一种抗肝素剂(肝素拮抗剂),可中和红细胞表面负电荷而常用于制备非特异性凝集的红细胞;其抗凝特性也为体外测定肝素活性提供了一种准确、快速、简单的方法。
Polybrene 在蛋白测序中有一定的作用:少量的Polybrene 在自动测序分析中可明显增加多肽的降解;加入Polybrene 能提高PVDF 膜的亲水性,降低测序过程中多肽的机械损伤。
Polybrene 也可降低某些酶原的自发激活而用于酶动力学测定。
本产品为进口分装,其中10mg/ml 包装产品为超纯水配制并用0.22μm 滤膜除菌处理。
50mg 包装为粉末装。
包装清单:产品编号 产品名称包装 C0351-1ml Polybrene (Hexadimethrine Bromide) 10mg/ml×1mlC0351-50mgPolybrene (Hexadimethrine Bromide)50mg —说明书1份保存条件:4ºC 保存,至少一年有效;-20ºC 保存,至少二年有效。
Vero-EGFP 细胞说明书

重庆英茂盛业‐产品说明书Vero ‐EGFP 细胞说明书品名:Vero ‐EGFP 细胞 货号:CG008包装:1×10^6~1×10^7 1 支细胞株类型:稳定表达EGFP 荧光蛋白多克隆细胞株 细胞来源:Vero(非洲绿猴肾细胞) 表达基因:EGFP 抗性:嘌呤霉素培养基:DMEM (g i b c o 货号:12100-061)培养基+10%FBS消化液:0.25%胰蛋白酶,0.53mM EDTA 冻存液:50%胎牛血清,40%DMEM ,10%DMSO 培养条件:37℃,5% CO 2 产品简介:Vero-EGFP 细胞稳定表达EGFP 荧光蛋白,培养时无需抗生素维持。
可作为慢病毒感染实验中的对照细胞株使用。
细胞株构建方法:慢病毒载体pLV ‐EGFP ‐C (货号VL3215)包装慢病毒后感染Vero 细胞,用嘌呤霉素筛选得到EGFP 过表达多克隆细胞株。
收到细胞的处理:根据客户所在地及发货季节,我们可能采用干冰运输的冻存细胞或者常温运输的培养瓶细胞两种不同形式发货。
收到细胞后根据细胞运输类型采用下面两种方式操作。
干冰运输细胞:1、 37℃水浴融化细胞冻存液,间或摇动冻存管以加速融化过程。
待细胞冻存液完全融化后,用70%乙醇消毒细胞冻存管外壁。
2、 室温200g 离心 5 分钟收集细胞。
吸去上清。
3、 用1ml 培养基重悬细胞。
4、 将细胞接种到6mm 培养皿或25cm 培养瓶中,补加5ml培养基,37℃ 5%CO 2 培养。
常温运输细胞:1、 3000g 10min 室温离心收集细胞。
2、 用细胞培养基轻柔吹吸重悬细胞。
3、 接种到25cm 培养瓶或60mm 培养皿,补足培养基到5ml 。
4、 放到细胞培养箱,37℃ 5%CO2培养过夜。
5、 第二天观察细胞贴壁情况,换液去除未贴壁细胞,继续培养。
6、 细胞生长后及时消化传代,尽早冻存1~2支。
细胞传代:1、 传代前将细胞培养液、PBS 和胰蛋白酶温浴到37℃。
嘌呤霉素溶液(Puromycin,1mgml)

北京雷根生物技术有限公司
嘌呤霉素溶液(Puromycin,1mg/ml)
简介:
嘌呤霉素(Puromycin,PM )是一种蛋白质合成抑制剂,它具有与tRNA 分子末端类似的结构,能够同氨基酸结合,代替氨酰化的tRNA 同核糖体的A 位点结合,并掺入到生长的肽链中。
虽然嘌呤霉素能够同A 位点结合,但是不能参与随后的任何反应,因而导致蛋白质合成的终止并释放出C-末端含有嘌呤霉素的不成熟的多肽。
嘌呤霉素分子量为544.43,CAS 号为53-79-2。
Leagene Puromycin solution 经过滤除菌,可用于科研领域,不用于临床诊断或治疗。
组成:
操作步骤(仅供参考):
1、根据实验具体要求操作。
2、Puromycin solution(1mg/ml)其摩尔数为1.84mmol/L,而Puromycin 工作浓度一般为10~100μmol/L。
3、以工作浓度为100μmol/L 为例,即1mg/ml 稀释18.4倍,即每10ml 培养基中加入Puromycin solution(1mg/ml)544μl。
注意事项:
1、注意无菌操作,避免污染。
2、避免反复冻融,以免失效。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:6个月有效。
相关:编号
名称CA0069Storage
Puromycin solution(1mg/ml)
1ml -20℃避光使用说明书1份编号
名称CA0075
青霉素-链霉素混合溶液(100×双抗)TE0002碱性磷酸酶(ALP)检测试剂盒(PNP 微板法)。
Puromycin(嘌呤霉素)产品使用说明书
嘌呤霉素(Puromycin)使用说明书◼产品包装和保存条件注:a. 建议分装保存,避免反复冻融,否则活性受到影响。
b. 嘌呤霉素为了达到最理想的稳定状态和最长的保质期,最好存放于-20°C,保质期为1年。
◼产品简介嘌呤霉素(Puromycin)—pac基因筛选抗生素Puromycin是由Streptomycesalboniger(白黑链霉菌)产生的一种肽基核苷抗生素,可抑制原核细胞和真核细胞的肽基转移。
Puromycin可抑制革兰氏阳性菌和多种动物细胞和昆虫细胞的增殖,但是真菌和革兰氏阴性菌对Puromycin具有抗性,在一些特殊的情况下,Puromycin也可用于大肠杆菌。
目前,Puromycin最重要的应用是用于选择携带pac 抗性基因的转染细胞。
不同细胞对Puromycin的敏感度不同,在筛选之前,要通过预实验确定Puromycin的最佳筛选浓度,推荐用1~10 μg/mL的范围筛选合适的浓度,Puromycin最常用的工作浓度为1~3 μg/mL,Puromycin的作用时间是3-10天之间,可参考文献并进行预实验摸索。
◼产品使用使用步骤:(哺乳动物细胞筛选)►嘌呤霉素杀灭曲线的确定(目的稳定转染细胞株,仅作参考)为了筛选到稳定表达待研究目的的细胞株,确定杀死未转染细胞的最低浓度嘌呤霉素至关重要。
所以初次做实验的客户需要建立适合自己实验体系的杀死曲线(kill curve)。
(1)24孔板内以5~8x104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如:0~15 μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
磷霉素说明书

磷霉素一种抗生素,分子式C3H7O4P。
它最初从Streptomyces fradicle中分离;对革兰氏阳性和阴性菌有效。
其作用机理是抑制细菌细胞壁的合成,是一种有希望作为药用的抗生素。
能与一种细菌细胞壁合成酶相结合,阻碍细菌利用有关物质合成细胞壁的第一步反应,从而起杀菌作用。
主要用于敏感的革兰阴性菌引起的尿路、皮肤及软组织、肠道等部位感染。
目录基本信息药理1.药效学2.动力学药理作用适应症用法用量制剂与规格用法及用量禁用慎用给药说明不良反应相互作用磷霉素钙片磷霉素钠基本信息名称:磷霉素英文名:Fosfomycin磷霉素药效学磷霉素抑制细菌细胞壁的早期合成,其分子结构与磷酸烯醇丙酮酸相似,故可竞争同一转移酶,使细菌细胞壁的合成受到阻抑而导致细菌死亡。
本品作用于敏感菌后,电镜观察发现细菌形态有明显改变,中膈细胞壁增厚、弯曲和不规则,细胞壁变薄或消失。
本品和血浆蛋白不结合,半减期为 1.5~2.0h,进入体内后组织分布广,以肾组织中浓度为最高,其次为心、肺、肝等组织,在胎儿循环、胆汁、乳汁、骨髓、脓液、脑、眼房水及支气管分泌物中也有相当浓度;本品也可透过血脑屏障,炎症时脑脊液浓度可达同时期血药浓度的 50%以上。
口服本品后约各有 1/3自尿、粪中排泄,肌注或静注本品后 24h内 90%由尿中排出。
血液透析能清除 70%~80%的药物,故血透后宜加用 1次全量。
口服磷霉素钙后约 30~40%可自胃肠道吸收。
正常人口服本品 0.5、1.0和2.0g后 2~4小时血药浓度达峰值,血药峰值分别为 3.5、5.3和 7.0μg/ml,其吸收不受食物的影响。
每6小时口服磷霉素钙 0.5g,稳态血药浓度可达 6~8μg/ml。
肌注磷霉素钠 1小时后血药浓度可达峰值,肌注0.5和1g,血药峰浓度分别为 17和 28μg/ml,每 6小时肌注1g的稳态血药浓度为 30~40μg/ml。
静注磷霉素钠0.5和1g的血药峰浓度各为 28和46μg/ml,1小时后即下降 50%左右。
Lenti-Pac HIV 慢病毒包装试剂盒 使用手册说明书

Lenti-Pac™HIV慢病毒包装试剂盒使用手册目录1产品概述2试剂盒组成3包装慢病毒颗粒所需的实验材料4慢病毒颗粒转导靶细胞所需的实验材料5实验前的准备6慢病毒颗粒的包装制备原理7制备慢病毒8慢病毒滴度检验9慢病毒感染目的细胞10使用许可与质量保证GeneCopoeia,Inc.广州易锦生物技术有限公司广州高新技术产业开发区广州科学城掬泉路3号广州国际企业孵化器F区8楼邮编:510663电话:4006-020-200邮箱:******************英文网址:中文网址:©2022GeneCopoeia,Inc.HIV(人类免疫缺陷病毒)骨架的慢病毒载体是目前最常用的慢病毒表达载体,它能在体外或体内实验有效介导外源基因转导多种分化或非分化哺乳动物细胞,使外源基因稳定整合靶细胞的基因组,并进行稳定的高水平表达。
GeneCopoeia Lenti-Pac™HIV慢病毒包装系统是安全性较高的第三代慢病毒包装系统,表达载体自身失活,不产生额外的慢病毒复制。
该系统包括:混合包装质粒、EndoFectin™-Lenti转染试剂、可进一步提高滴度的TiterBoost™滴度增强剂、以及eGFP阳性对照质粒。
Lenti-Pac™HIV慢病毒包装系统可将HIV载体的慢病毒表达克隆包装成为具有转导效果的慢病毒颗粒,包装所得的慢病毒颗粒可立即使用,介导目的基因在哺乳动物细胞进行高效表达。
GeneCopoeia提供40000多种人源及小鼠源的慢病毒载体ORF表达克隆,以及针对人源、小鼠源、大鼠源及其他哺乳类动物染色体组靶基因的慢病毒载体shRNA克隆。
除此以外,GeneCopoeia同时提供20000多种人源慢病毒载体miRNA前体表达克隆、miRNA抑制剂表达克隆以及启动子报告克隆,18000种小鼠的慢病毒载体启动子报告克隆。
以上所有克隆均应用HIV骨架,可随时应用于慢病毒包装。
根据疾病控制中心制定的标准,GeneCopoeia第三代HIV慢病毒包装系统满足生物安全第二级别(BSL-2)的要求。
汉恒生物-LipoFiter转染试剂中文说明书

LipoFiter TM 转染试剂操作说明保存条件:4℃保存,一年有效(避免反复冻融)。
LipoFiter TM 简介LipoFiter TM 脂质体转染试剂( LipoFiter TM Liposomal Transfection Reagent )是一种适合于把质粒或其它形式的核酸,以及核酸蛋白复合物转染到培养的真核细胞中的高效阳离子脂质体转染试剂。
LipoFiter TM 优点1、转染效率高,重复性好,操作简单。
2、无明显细胞毒性,用LipoFiter TM 转染细胞后,对于大多数细胞72 小时内不更换培养液无明显细胞毒性。
3、LipoFiter TM 对于贴壁细胞和悬浮细胞都适用,并且可以用于稳定表达细胞株的筛选。
LipoFiter TM 使用说明1.细胞培养:以293T 细胞为例,转染前一天(20-24 小时) ~0.4×106 细胞(具体的细胞数量据细胞大小和细胞生长速度而定)铺到六孔板内,使第二天细胞汇合度(confluent)能达到约50%~70%。
注1:汉恒生物LipoFiter TM 对细胞毒性极小,因此无需通过增大细胞汇合度来抵抗转染试剂毒性,我们实验证明,50%~70% confluent 时细胞的转染效率可以达到最优。
注2:其它培养板或培养皿参考六孔板进行操作,其他培养介质如培养板,培养皿的详细细胞接1种数目请按照比例自行换算。
2.在进行下述转染步骤前,把六孔板每孔内换成新鲜细胞培养液。
培养液的体积约为2 ml。
注:其他培养介质培养液体积参见《各种培养介质下LipoFiter TM 转染DNA 详表》,抗生素、Glutamine 等对LipoFiter TM 转染并无影响。
如果LipoFiter 对目的细胞毒性较大,建议去除转染体系内的抗生素。
3.把LipoFiter TM 脂质体转染试剂轻轻混匀。
4.对于待转染的六孔板中一个孔的细胞,取一只洁净无菌离心管,加入4 μg 质粒DNA(其他培养介质DNA 用量参见附表)到250 μl DMEM 溶液,用枪轻轻吹打混匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
说明:蛋白质合成抑制剂。
抑制细菌、藻类原生物和哺乳动物细胞生长。
嘌呤霉素(Puromycin)是由白黑链霉菌(Streptomyces alboniger)发酵代谢产生的一种氨基糖苷类抗生素,通过抑制蛋白质合成而杀死革兰氏阳性菌,各种动物和昆虫细胞。
某种特殊情况下有效作用大肠杆菌。
作用机制在于嘌呤霉素是氨酰-tRNA分子3’末端的类似物,能够与核糖体的A位点结合并掺入到延伸的肽链中。
嘌呤霉素同A位点结合后,不会参与随后的任何反应,从而导致蛋白质合成的提前终止并释放出C-末端含有嘌呤霉素的不成熟多肽。
嘌呤霉素产生菌Streptomyces alboniger内发现的pac基因编码嘌呤霉素N-乙酰转移酶(PAC),赋予机体对嘌呤霉素产生抗性。
这一特性如今普遍应用于筛选特定携带pac基因质粒的哺乳动物稳定转染细胞株。
嘌呤霉素在细胞稳转株筛选中的普遍应用与慢病毒载体的特性有关,现在商业化的慢病毒载体多数都携带pac基因。
在某些特定情况下,嘌呤霉素亦可以用来筛选转化携带pac基因质粒的大肠杆菌菌株。
溶解性:溶于水,参考浓度50mg/ml。
使用方法
1.建议使用浓度
哺乳动物细胞:1-10 μg/mL,最佳浓度需要杀灭曲线来确定;
大肠杆菌:LB琼脂培养基筛选稳定转化pac基因的大肠杆菌,使用浓度为
125μg/mL。
注:使用嘌呤霉素筛选大肠杆菌稳转株需要精确的pH值调节,而且受宿主细胞本身的影响。
2.溶解方法
用蒸馏水溶解嘌呤霉素配制成50 mg/ml的母液,经0.22 μm滤膜过滤除菌后分装于-20℃冻存;也可溶于甲醇,配制成10 mg/ml的储存液。
3. 嘌呤霉素杀灭曲线的确定(以shRNA转染或者慢病毒转导为例)
嘌呤霉素有效筛选浓度跟细胞类型、生长状态、细胞密度、细胞代谢情况及细胞所处细胞周期位置等有关。
为了筛选到稳定表达的shRNA细胞株,确定杀死未转染/转导细胞的最低浓度嘌呤霉素至关重要。
建议初次做实验的客户一定要建立适合自身实验体系的杀死曲线(kill curve)。
1)Day 1:24孔板内以5~8 x 104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
37℃细胞孵育过夜;
2)Day 2:a)准备筛选培养基:含不同浓度嘌呤霉素的新鲜培养基(如
0-15μg/mL,至少5个梯度);b)往孵育过夜后的细胞内更换新鲜配制的筛选培养基;之后37℃孵育细胞;
3)Day 4:更换新鲜的筛选培养基,并观察细胞存活率。
4)根据细胞的生长状态,约2-3天更换新鲜的筛选培养基;
5)每日监测细胞,观察存活细胞率,从而确定抗生素筛选开始4-6天内有效杀死非转染或者所有非转导细胞的药物最低浓度。
4. 哺乳动物稳定转染细胞株的筛选
等转染含有pac基因的质粒后,细胞在含有嘌呤霉素的培养基中增殖,以筛选出稳定转染子。
1)细胞转染48h后,将细胞(原样或稀释)置于含有适当浓度嘌呤霉素的新鲜培养基中培养。
注意:当细胞处于分裂活跃期时,抗生素作用最明显。
细胞过于密集,抗生素产生的效力会明显下降。
最好进行细胞分盘使其密度不超过25%。
2)每隔2-3天,移除和更换含有嘌呤霉素的培养基。
3)筛选7天后评估细胞形成的病灶。
病灶可能需要额外的一周或者更多时间,这依赖于宿主细胞系和转染筛选效率。
注意:每日进行细胞生长状态的观察。
嘌呤霉素的筛选至少需要48h,有效浓度嘌呤霉素的筛选周期一般在3-10天。
4)转移和放置5-10个抗性克隆到一个35mm的培养皿中,用选择培养基继续培养7天。
此次富集培养是为日后的细胞毒性实验做准备。
注意事项
1)为了您的安全和健康,请穿实验服并戴一次性手套操作。
2)嘌呤霉素为有毒化合物,操作时请小心拿放。
