常见化合物一览表
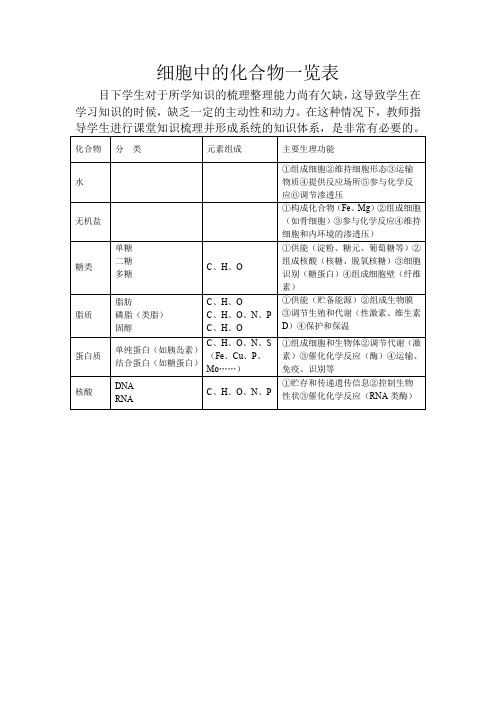
细胞中的化合物一览表
①构成化合物(Fe、Mg)②组成细胞(如骨细胞)③参与化学反应④维持细胞和内环境的渗透压)
糖类
单糖
二糖
多糖
C、H、O
①供能(淀粉、糖元、葡萄糖等)②组成核酸(核糖、脱氧核糖)③细胞识别(糖蛋白)④组成细胞壁(纤维素)
脂质
脂肪
磷脂(类脂)
固醇
C、H、O
CБайду номын сангаасH、O、N、P
C、H、O
①供能(贮备能源)②组成生物膜
③调节生殖和代谢(性激素、维生素D)④保护和保温
蛋白质
单纯蛋白(如胰岛素)
结合蛋白(如糖蛋白)
C、H、O、N、S
(Fe、Cu、P、Mo……)
①组成细胞和生物体②调节代谢(激素)③催化化学反应(酶)④运输、免疫、识别等
核酸
DNA
RNA
C、H、O、N、P
①贮存和传递遗传信息②控制生物性状③催化化学反应(RNA类酶)
细胞中的化合物一览表
目下学生对于所学知识的梳理整理能力尚有欠缺,这导致学生在学习知识的时候,缺乏一定的主动性和动力。在这种情况下,教师指导学生进行课堂知识梳理并形成系统的知识体系,是非常有必要的。
化合物
分类
元素组成
主要生理功能
水
①组成细胞②维持细胞形态③运输物质④提供反应场所⑤参与化学反应⑥调节渗透压
初中化学化合价一览表

-1
NaHSO4
硫酸氢钠
12 亚硫酸根 SO3
-2
Na2SO3
亚硫酸钠
13
乙酸(俗名醋
醋酸根 CH3COO -1 (CNHH34C)O2HOPHO
14 磷酸氢根 HPO4 -2
4
磷酸二氢
酸) 磷酸氢胺
15 根
H2PO4 -1 Ca(H2PO4)2 磷酸二氢钙
备注:常见元素化合价的记忆口诀 氟氯溴碘负一价;正一氢银与钾钠;氧的负二先记清;正二镁钙钡和锌 正三是铝正四硅;下面再把变价归;全部金属是正价;一二铜来二三铁。 锰正二四与六七;碳的二四要牢记。非金属负主正不齐;氯的负一正一五七。 氮磷负三与正五;不同磷三氮二四。硫有负二正四六;边记边用就会熟。
硝酸钾 硫酸铜 碳酸钠
5 铵根
NH4
+1
6 磷酸根 PO4
-3
7 高锰酸根 MnO4 -1
NH4Cl H3PO4 KMnO4
氯化铵 磷酸(正磷酸)
高锰酸钾
8 锰酸根 MnO4 -2 K2MnO4
锰酸钾
9 氯酸根 ClO3 -1KClO3源自氯酸钾10 碳酸氢根 HCO3
-1
NaHCO3
碳酸氢钠
11 硫酸氢根 HSO4
27 铂 Pt
195
11 钠 Na
23
+1
28 金 Au
197
12 镁 Mg
24
+2
29 汞 Hg
201
13 铝 Al
27
+3
碘I
30
127
14 硅 Si
28
+4
31 锡 Sn 118.7
15 磷 P
常见的化合物

常见的化合物常见的化合物1.单质、化合物(1)单质、化合物的涵义①由同一种元素组成的纯净物叫单质,单质又可分为金属和非金属。
②由两种或两种以上元素组成的纯净物叫化合物;化合物可根据组成元素的不同,分为无机化合物和有机化合物。
(2)单质、化合物的联系与区别①单质和化合物都是纯净物。
②两者的区别在于:单质由同一种元素组成,化合物由不同种元素组成。
简单地,可根据它们的化学式进行判断。
2.常见氧化物的性质(1)氧化物的定义氧化物是由两种元素(其中一种是氧元素)组成的化合物。
常见的氧化物有:二氧化碳、一氧化碳、氧化铁、水、二氧化硫等。
(2)一氧化碳的性质①一氧化碳的化学性质化学性质化学反应实验现象可燃性2CO+O2=2CO2发出蓝色火焰,产生的气体使澄清石灰水变浑浊,放出大量热量还原性CO+CuO===Cu+C02黑色固体变成红色,生成的气体使澄清石灰水变浑浊②一氧化碳与二氧化碳的相互转化③一氧化碳有毒,能跟血液中的血红蛋白紧密结合,使血红蛋白失去结合O的能力,致使人体因缺氧窒息而死亡。
(3)二氧化硫的性质二氧化硫是具有刺激性气味的气体,它是酸雨产生的原因之一。
SO2+H2O==H2SO3。
3.重要的盐(1)盐的涵义盐是酸跟碱中和的产物,这是数量很大的一类物质。
(2)常见盐的性质和用途物质氯化钠NaCl碳酸钠Na2C03碳酸钙Ca俗名食盐纯碱、苏打大理石、石灰石物理性质易溶于水的无色透明晶体,不易潮解白色粉末,从水溶液中析出Na2CO310H20晶体,易风化难溶于水的白色固体化学性质其水溶液含有Cl-,能与可溶性银盐(如AgN03)生成不溶于稀硝酸的白色沉淀:AgN03+NaCl==AgCl↓+NaNO3水溶液呈碱性,能在水溶液中电离出OH-CaC03+2HCl==CaCl2+H20+C02物质氯化钠NaCl碳酸钠Na2CO3碳酸钙Ca用途医学上使用的生理盐水就是0.9%的氯化钠,食用、防腐、化工原料等制玻璃是大理石、石灰石的主要成分,制石灰、水泥,建筑材料4.酸的主要性质及用途(1)酸的涵义电离时所生成的阳离子全部是H十的化合物叫做酸。
常见化合物一览表
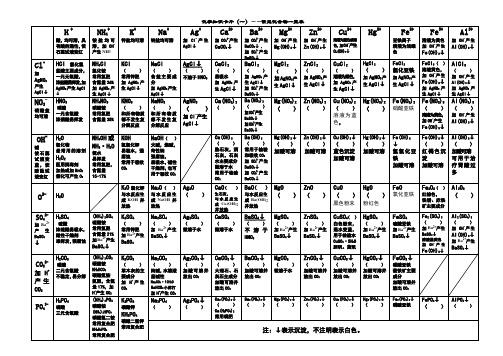
磷酸铵 (NH4)2HPO4 磷酸氢二铵 常用复合肥 NH4H2PO4 常用复合肥
K+
钾盐均可溶
KCl
(
)
常用钾肥
加 AgNO3 产
生 AgCl↓
KNO3
(
)
和所有物质
都不发生复
分解反应
KOH
氢氧化钾 易吸水,强 腐蚀 常用于吸收 CO2
K2O 氧化钾
与水反应生 成 KOH 并 放热
Al(NO3)3
()
加 OH- 产 生
Al(OH)3↓
Fe(OH)3↓ () 红褐色沉 淀 加酸可溶
Al(OH)3↓ () 加酸可溶 可用于治 疗胃酸过 多
Fe2O3( ) Al2O3
红棕色, (
)
铁锈、赤铁
矿主要成分
Fe2(SO4)3
(
)
加 Ba2+产生
BaSO4↓
溶液显黄色
加 OH- 产 生
Fe(OH)3↓
Cl-
加
AgNO3
产生 AgCl↓
NO3-
硝酸盐 均可溶
OH-
碱 使石蕊 试液变 蓝,使 酚酞试 液变红
O2-
SO42-
加 Ba2+ 产生 BaSO4
↓
CO32-
加 H+ 产生 CO2
PO43-
H+
酸,均可溶,具 有酸的通性,使 石蕊试液变红
NH4+
铵盐均可 溶,加 OH产生 NH3
HCl 氯化氢
盐酸主要成分, 一元无氧酸, 浓盐酸易挥发,加 AgNO3 产生 AgCl
Ca(OH)2
(
)
熟石灰,消
常见化合物

目录1.硫酸2.盐酸3.氢氧化钠4.碳酸氢钠5.磷酸二氢钠6.磷酸氢二钠7.次氯酸钠8.异噻唑啉酮9.柠檬酸10.EDTA11.聚合氯化铝12.磷酸三钠13.无水肼联氨14.水合肼联氨15.亚硫酸氢钠16.阻缓剂(连云港)17.杀菌灭藻剂(连云港)18.阻垢剂MAS2081硫酸2【分子式】H2SO4;H2SO4.H2O(一水物),H2SO4.2H2O(二水物)【结构式】【性状】纯硫酸为无色透明的状液体,相对密度(20℃)1.8318,熔点10.38℃,沸点280℃,折射率1.4297,加热时它会发出SO3,直至酸的浓度降低到98.3%为止,而成为恒沸溶液,沸点338℃硫酸一水物相对密度1.438,二水物相对密度1.650,熔点-39.47℃,沸点167℃,折射率1.405.他们的热力学常数见表1-1硫酸能与水和乙醇以任何比例混合,并放出大量的热。
其外观通常因纯度之不同而呈现无色至红棕色。
硫酸为最活泼的无机酸之一,腐蚀性极强。
不纯的硫酸能溶解所有的金属。
65%浓度的硫酸在冷态时即能溶解铁、铝、铜、铅;热态时的作用更强。
95%浓度以上的冷态浓硫酸不和铁、铝等金属反应,因为铁、铝在冷浓硫酸中被钝化,浓硫酸是一中氧化性酸,加热后的氧化性能更强。
稀酸能溶解铝、铬、钴、钙、镍、锌等金属,热态时的溶解能力增强。
但是,稀酸不能溶解铅和汞,也极难与高硅铁反应。
浓硫酸有极强的吸水性,能使木材、棉布、纸张等碳水化合物脱水炭化,故接触人体能引起严重烧伤。
硫酸几乎与所有的金属、氧化物、氢氧化物反应而生成硫酸盐(包括正盐和酸式盐)。
硫酸的浓度与其熔点的高低呈反比关系。
常见浓度的熔点如表1-2所示。
含有20%以上的游离SO3 的浓硫酸称为发烟硫酸。
发烟硫酸为无色或棕色油状稠厚的发烟液体,有强烈的刺激性臭味,吸水性强。
与水可以任意比例混合,放出大量热并可能引起爆炸。
其腐蚀性及氧化性比普通硫酸更大。
常见浓度的硫酸熔点浓度/%熔点/℃98-393-3278-3874-44【质量标准】(1)国内标准国家标准GB534-89(工业硫酸)【危害与对策】硫酸有极强的腐蚀性和吸水性,能严重烧伤人体,故接触和使用硫酸时必须穿戴规定的防护用具,由于硫酸在溶于水时能产生大量的热,存放应特别注意;在配制硫酸水溶液时,一定要将硫酸缓慢倒入水中,并随时搅拌;千万不要将水倒入硫酸中!以防发生喷酸事故而造成人身伤害。
【知识点】常见化合物一览表
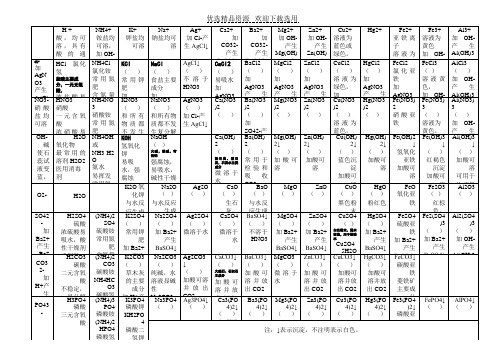
Na+ 钠盐均可 溶 NaCl ( ) 食盐主要 成分 加 NaNO3 AgNO3 ( ) 产 生 和所有物 AgCl↓ 质都不发 生复分解 NaOH 反应 ( )
火碱,烧碱,苛 性钠
Ag+ 加 Cl-产 生 AgCl↓ AgCl↓ ( ) 不 溶 于 HNO3 AgNO3 ( ) 加 Cl-产 生 AgCl↓
浓 盐酸易 HNO3 挥 发,加 硝酸 AgNO3 一元含产 氧 生 酸 AgCl↓ 浓硝酸易 H2O 挥发 氧化物 最常用的 溶剂 H2O2 医用消毒 剂 加热或加 MnO2 催 H2O 化可产生 O2 H2SO4 硫酸 浓硫酸易 吸水,酸 性干燥剂 难挥发, H2CO3 强腐蚀 碳酸 二元含氧 酸 不稳定, 易分解 H3PO4 磷酸 三元含氧 酸
优选精品资源 欢迎下载选用
H+ 酸,均可 溶,具有 酸 的 通 性 ,使 石 HCl 氯化 蕊 氢试液变 盐酸主要成 红
分,一元无氧 酸,
Cl-
加 AgN O3 产生 AgCl NO3↓ 硝酸 盐均 可溶 OH碱 使石 蕊试 液变 蓝, 使酚 酞试 O2液变 红 SO42 加 Ba2+ 产生 BaS O4↓ CO3 2加 H+产 生 CO2 PO43 -
微溶于 水 Ag2O 常 用 CaO 于 ( ) 检 ( 验 ) 生石 CO2 灰, Ag2SO4 CaSO4 与水反 ( ) ( ) 应生成 微溶于水 Ca(OH) 微溶于 水 2 并放热 Ag2CO3 ↓ ( ) 加酸可溶 并 放 出 CO2 Ag3PO4↓ ( ) CaCO3↓ ( )
大理石、石灰石 主成分
Mg2+ Zn2+ 加 OH加 OH产生 产生 Mg(OH) Zn(OH) MgCl22↓ ZnCl2 2↓ ( ) ( ) 加 加 AgNO3 AgNO3 产 生 产 生 Mg(NO3 Zn(NO3 AgCl↓ AgCl↓ )2 )2 ( ) ( ) Mg(OH) 2↓ ( ) 加酸可 溶 MgO ( ) MgSO4 ( ) 加 Ba2+ 产生 BaSO4↓ MgCO3 ( ) 微溶于 水 Mg3(PO 4)2↓ ( ) Zn(OH) 2↓ ( ) 加酸可 溶 ZnO )
常见的化学物质

乳酸:有机化合物,化学式C3H6O3,无色或带黄色的糖浆状液体,牛奶中含有它,人常时间运动感到肌肉酸痛就是因为肌肉分泌了乳酸,过一会就消失了是因为乳酸在体内与氧气反应转变为了二氧化碳和水。
·软脂酸:有机化合物,化学式C16H32O2[CH3(CH2)14COOH],又叫十六酸,白色鳞片状固体,带珠光,用于制肥皂或化装品。
S水:水的化学式H2O,每个水分子由2个氢原子和一的氧原子构成,是自然界最常见的氧化物,纯净的水是没有颜色没有气味没有味道的液体,通电时可产生H2和O2,是维持生命的重要物质。
·水杨酸:学名邻羟苯甲酸,化学式C7H6O3,以酯的形式存在于自然界中,遇FeCl3溶液显紫色,羧基酸性比碳酸强,羟基酸性比碳酸弱。
水杨酸具有防腐、杀菌、消毒作用,可用于合成染料和制药。
·三氧化二铁:化学式Fe2O3。
又称“氧化铁”,俗称铁丹、铁红、土铁、赤铁矿等,红棕色至黑色立方晶体,常用见为红棕色粉末。
有碱性氧化物通性,广泛用于炼铁和建筑业。
三氧化二砷:见砒霜。
三硝基甲苯:化学式C7H5N3O6,学名2,4,6-三硝基甲苯,俗名“TNT”,浅黄色晶体,微溶于水,是一种较安全的爆炸力强的炸药,世界上常规武器大多采用此类炸药。
·三氯化铁:化学式FeCl3,黄色粉末,可由铁在氯气中燃烧制得,溶于水为黄褐色液体,用于化学试剂,遇苯酚会变为紫色,可用于鉴定苯酚的存在,也叫氯化铁。
三氯甲烷:见氯仿。
三碘甲烷:见碘仿。
烧碱:见氢氧化钠石墨:化学式C,一种结晶形碳,天然出产的矿物,呈钢灰色或黑色,质软,质软,具滑腻感。
有金属光泽,呈六方体,叶片状,密度2.25g·cm-3莫氏硬度为1,能导电,化学性质不活泼,耐腐蚀,与酸、碱不起作用,在空气或氧气中加强热生成二氧化碳,用作抗磨材料和润滑剂,并用于制造坩埚、电极和原子反应堆的减速剂,与锑粉、黏土混合用于制铅笔芯。
·石膏:一种无机化合物,化学式CaSO4·2H2O,透明结晶体,应用于医药、雕塑等。
常见谷物每100克中碳水化合物含量一览表

常见谷物每100克中碳水化合物含量一览表在饮食中,碳水化合物是身体能量的重要来源之一。
了解不同食物中碳水化合物的含量可以帮助我们合理安排饮食,保持健康的生活方式。
本文将为您提供常见谷物每100克中碳水化合物的含量一览表,以供参考。
白米饭白米饭是我们日常饮食中常见的主食之一,它含有丰富的碳水化合物。
每100克白米饭的碳水化合物含量约为77克,是日常能量的重要来源之一。
小麦面粉小麦面粉是烹饪食物时常用的一种原料,它也是碳水化合物的主要来源之一。
每100克小麦面粉的碳水化合物含量约为73克。
燕麦片燕麦片是一种营养丰富的谷物,它不仅含有碳水化合物,还富含膳食纤维和蛋白质。
每100克燕麦片的碳水化合物含量约为67克。
玉米玉米也是一种常见的谷物,它含有较高的碳水化合物含量。
每100克玉米的碳水化合物含量约为19克。
大麦大麦是一种营养价值较高的谷物,它含有丰富的膳食纤维和碳水化合物。
每100克大麦的碳水化合物含量约为73克。
糙米糙米相比白米饭在加工过程中保留了较多的营养成分,其中也包含了较多的碳水化合物。
每100克糙米的碳水化合物含量约为77克。
黑米黑米是一种营养丰富的谷物,它含有较高的碳水化合物含量。
每100克黑米的碳水化合物含量约为73克。
糯米糯米是一种常用的米种,也是我们日常饮食中的主要来源之一。
每100克糯米的碳水化合物含量约为77克。
绿豆绿豆是一种富含蛋白质和碳水化合物的谷物,含有较少的脂肪。
每100克绿豆的碳水化合物含量约为62克。
黄豆黄豆是一种常见的谷物,含有丰富的蛋白质和碳水化合物。
每100克黄豆的碳水化合物含量约为30克。
通过了解常见谷物中碳水化合物的含量,我们可以根据自身需求合理安排饮食,并且了解每种食物的营养价值。
当然,除了碳水化合物以外,我们也要注意均衡摄入其他营养素,并保持适量运动,才能保持身体健康。
以上就是常见谷物每100克中碳水化合物含量的一览表,希望对您有所帮助!这是一份常见谷物每100克中碳水化合物含量的一览表。
环境管理物质管理规范及管制

Cr(VI)六价铬
Packaging material包装材料 (Please see the remark) Ink墨水
PBB/PBDE(DecaBDE) 聚溴联苯/聚溴二苯醚( 含十溴联苯醚)
Plastic塑料 Wire线材
Sony产品环境管理物质含量规定
Other Brominated organic compounds其他有机溴 化合物 Polychlorinated biphenyls 多氯联苯(PCB) Polychlorinated naphthalenes多氯化萘 (PCN) Polychlorinated terphenyls 多氯三联苯(PCT) Short-chain chlorinated paraffins 短链氯代烷烃 (SCCP) Other chlorinated organic compounds其他有机氯 化合物 Tributyl tin compounds,Triphenyl tin compounds 三丁基锡化合物,三苯 基锡化合物 Asbestos石棉 Formaldehyde甲醛 Plastic塑料 Wire线材 Plastic塑料 Wire线材 Plastic塑料 Wire线材 Plastic塑料 Wire线材 All uses 所有用途 Plastic塑料 Wire线材 Ink墨水 Level 3 3级 Not contained 不含有 Not contained 不含有 Not contained 不含有 Not contained 不含有 Level 3 3级 Not contained 不含有 Immediately Immediately Immediately Immediately Immediately Immediately For Sony’s Level 3 material For Sony’s Level 1 material For Sony’s Level 1 material For Sony’s Level 1 material For Sony’s Level 1 material For Sony’s Level 3 material For Sony’s Level 1 material
常见不相容化学品一览表
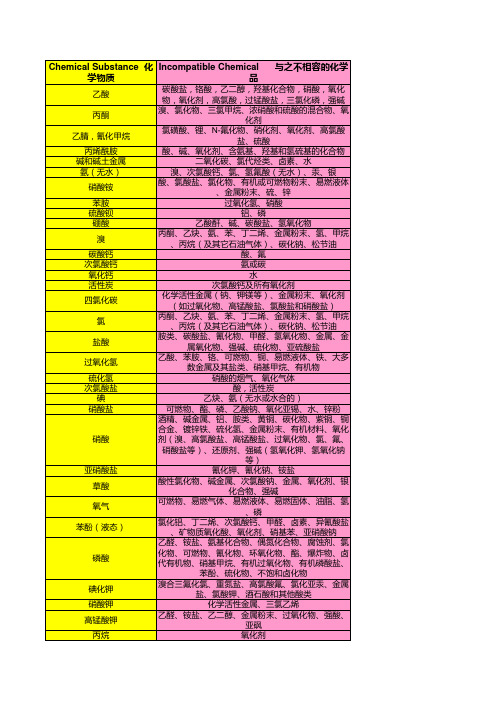
乙醛、铵盐、氨基化合物、偶氮化合物、腐蚀剂、氯
磷酸
化物、可燃物、氰化物、环氧化物、酯、爆炸物、卤 代有机物、硝基甲烷、有机过氧化物、有机磷酸盐、
苯酚、硫化物、不饱和卤化物
碘化钾
溴合三氟化氯、重氮盐、高氯酸氟、氯化亚汞、金属 盐、氯酸钾、酒石酸和其他酸类
硝酸钾
化学活性金属、三氯乙烯
高锰酸钾
乙醛、铵盐、乙二醇、金属粉末、过氧化物、强酸、 亚砜
丙烷
氧化剂
硝酸银 氯酸钠
硫
硫酸
酒石酸 四氯乙烯 三氟乙酸
尿素
水 锌 硝酸锌 氧化锌 氢氟酸(无水) 过氧化物 易燃液体
乙醛、乙炔、酒精、炔、铝、胺类、氨、氯磺酸、杂 酚油、铁盐、镁、还原剂、强碱 酸、铵盐、可氧化物、硫 氧化物
碱、卤素、锂、乙炔基金属、有机物、氧化物、氯酸 钾、高氯酸钾、高锰酸钾、还原剂、钠和强氧化剂
丙烯酰胺
酸、碱、氧化剂、含氨基、羟基和氢硫基的化合物
碱和碱土金属
二氧化碳、氯代烃类、卤素、水
氨(无水)
溴、次氯酸钙、氯、氢氟酸(无水)、汞、银
硝酸铵
酸、氯酸盐、氯化物、有机或可燃物粉末、易燃液体 、金属粉末、硫、锌
苯胺
过氧化氢、硝酸
硫酸钡
铝、磷
硼酸
乙酸酐、碱、碳酸盐、氢氧化物
溴
丙酮、乙炔、氨、苯、丁二烯、金属粉末、氢、甲烷 、丙烷(及其它石油气体)、碳化钠、松节油
碳酸钙
酸、氟
次氯酸钙
氨或碳
氧化钙
水
活性炭
次氯酸钙及所有氧化剂
四氯化碳
化学活性金属(钠、钾镁等)、金属粉末、氧化剂 (如过氧化物、高锰酸盐、氯酸盐和硝酸盐)
氯
丙酮、乙炔、氨、苯、丁二烯、金属粉末、氢、甲烷 、丙烷(及其它石油气体)、碳化钠、松节油
初中一年级化学常见化合物的认识

初中一年级化学常见化合物的认识化学是自然科学的一个重要分支,研究的是物质的组成、结构、性质和变化规律。
在初中一年级化学学习中,我们需要了解和认识一些常见的化合物。
本文将对初中一年级化学常见化合物的认识进行介绍。
一、水(H2O)水是我们日常生活中最常见的化合物之一。
它由氢元素和氧元素组成,化学式为H2O。
水的重要性不言而喻,它是维持生物体内外稳定环境的媒介和溶剂。
同时,水还是许多化学反应的重要参与者。
二、二氧化碳(CO2)二氧化碳是一种气体,化学式为CO2。
它由碳元素和氧元素组成。
二氧化碳广泛存在于自然界,例如在空气中的浓度就有0.04%左右。
二氧化碳在植物的光合作用中起着重要的作用,同时也是温室效应的主要原因之一。
三、氧化铁(Fe2O3)氧化铁是一种化合物,由铁元素和氧元素组成,化学式为Fe2O3。
氧化铁有不同的颜色,例如红色的赤铁矿和黑色的磁铁矿。
氧化铁在建筑、制造染料等方面有广泛的应用。
四、盐酸(HCl)盐酸是一种强酸,化学式为HCl。
它由氢元素和氯元素组成。
盐酸是无色液体,有强烈的刺激性气味。
盐酸广泛用于化学实验和工业生产中,例如金属清洗、制备氯化物等。
五、氧化钙(CaO)氧化钙是一种无机化合物,由钙元素和氧元素组成,化学式为CaO。
氧化钙是白色固体,常见于建筑材料中,例如石灰石和石灰石等。
在工业生产中,氧化钙也用于制备水泥和玻璃等。
六、氯化钠(NaCl)氯化钠是一种无机盐,由钠元素和氯元素组成,化学式为NaCl。
氯化钠是食盐的主要成分,也是我们日常饮食中必不可少的调味品。
此外,氯化钠在化学实验和医药领域也有重要应用。
七、硫酸(H2SO4)硫酸是一种强酸,化学式为H2SO4。
它由氢元素、硫元素和氧元素组成。
硫酸是一种无色液体,具有强烈的腐蚀性。
它广泛用于工业生产中,例如制造肥料、制药和清洁剂等。
八、硝酸(HNO3)硝酸是一种强酸,化学式为HNO3。
它由氢元素、氮元素和氧元素组成。
硝酸常见于农业领域,用作肥料的制造和土壤调整。
分子量一览表
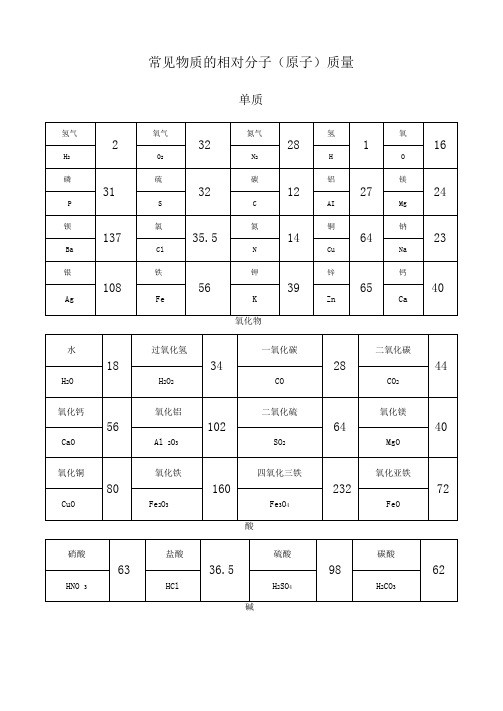
单质
氢气
2
氧气
32
氮气
28
氢
1
氧
16
H2
02
N2
H
O
磷
31
硫
32
碳
12
铝
27
镁
24
P
S
C
AI
Mg
钡
137
氯
35.5
氮
14
铜
64
钠
23
Ba
Cl
N
Cu
Na
银
108
铁
56
钾
39
锌
65钙Biblioteka 40AgFe
K
Zn
Ca
氧化物
水
18
过氧化氢
34
一氧化碳
28
二氧化碳
44
H2O
H2O2
CO
CO2
Ba(OH)2
氢氧化钙
74
氢氧化镁
58
氢氧化铝
78
氢氧化铁
107
Ca(OH)2
Mg(OH)2
Al(OH)3
Fe(OH)3
硝酸铵
80
氯化铵
53.5
硫酸铵
132
碳酸铵
96
NH4NO3
NH4CI
(NH4)2SO4
(NH4)2CO3
硝酸钾
101
氯化钾
74.5
硫酸钾
174
碳酸钾
138
KNO3
KCl
K2SO4
K2CO3
硫酸铁
400
氯化铁
162.5
FeCl2
初中化学常见化合物百科

初中化学常见化合物百科一、硫酸(H2SO4)硫酸,化学式H2SO4,是一种无色、无臭的液体。
它是常见的酸性化合物,常用于工业生产和实验室中。
硫酸是强酸,具有高腐蚀性和强氧化性。
硫酸的主要用途是作为化学反应的催化剂和溶剂。
它可以用来制造肥料、洗涤剂、染料和药物。
此外,硫酸还被广泛用于纺织工业、金属加工和石油炼制等领域。
在实验室中,硫酸常用于酸碱中和反应、酸性溶液的制备和酸性物质的检验。
它可以用来检测金属和非金属离子,以及硫酸盐的形成。
然而,由于硫酸具有高腐蚀性,使用时需要注意安全措施,避免与皮肤和眼睛接触。
二、水(H2O)水,分子式H2O,是地球上最常见的化合物之一。
它是无色、无味、无臭的液体,可以在自然界中以三种形态存在:固态、液态和气态。
水在生物体中具有重要的作用。
它是生物体内化学反应的介质,并参与许多生物过程,如新陈代谢、运输和溶解。
此外,水还能保持恒定的体温,起到调节环境温度的作用。
在化学反应中,水可以作为溶剂和反应物。
它具有较高的溶解度,能够溶解许多物质,使其形成溶液。
此外,水还可以通过蒸发和沸腾,帮助调节反应温度和平衡反应浓度。
三、二氧化碳(CO2)二氧化碳,化学式CO2,是一种无色、无味的气体。
它存在于大气中,也可以通过燃烧、呼吸和发酵等过程释放到环境中。
二氧化碳在自然界中起到重要的生态角色。
它是植物进行光合作用的原料之一,可以通过光合作用将二氧化碳转化为有机物质。
此外,二氧化碳还能吸收地球表面的热量,起到保持地球温暖的作用。
在实际应用中,二氧化碳有许多重要的用途。
它可以作为消防灭火剂、酒精饮料的气体克制剂和压缩空气的驱动剂。
此外,二氧化碳还被用于制造碳酸饮料、化工催化剂和植物栽培。
四、盐酸(HCl)盐酸,化学式HCl,是一种无色、有刺激性气味的液体。
它是一种强酸,可以溶解在水中。
盐酸在实验室和工业中具有广泛的应用。
盐酸主要用于酸碱反应和金属清洗。
在实验室中,它可以调节溶液的酸碱性,并用于酸化反应和产生气体的实验。
100种化合物

100种化合物1. AgNO3:硝酸银2. AgCl:氯化银3. BaSO4:硫酸钡4. BaCl2:氯化钡5. Ba(NO3)2:硝酸钡6. CaCO3:碳酸钙7. Ca(OH)2:氢氧化钙8. CaO:氧化钙9. CaCl2:氯化钙10. CuSO4:硫酸铜11. Cu(OH)2:氢氧化铜12. CuO:氧化铜13. CuCl2:氯化铜14. FeCl3:氯化铁15. Fe(OH)3:氢氧化铁16. Fe2(SO4)3:硫酸铁17. FeCl2:氯化亚铁18. FeSO4:硫酸亚铁19. Al2(SO4)3:硫酸铝20. AlCl3:氯化铝21. MgCl2:氯化镁22. Mg(NO3)2:硝酸镁23. ZnCl2:氯化锌24. ZnSO4:硫酸锌25. NaOH:氢氧化钠26. NaCl:氯化钠27. Na2CO3:碳酸钠28. NaHCO3:碳酸氢钠29. KCl:氯化钾30. K2CO3:碳酸钾31. KNO3:硝酸钾32. HCl:盐酸33. H2SO4:硫酸34. HNO3:硝酸35. H3PO4:磷酸36. NH4Cl:氯化铵37. (NH4)2SO4:硫酸铵38. NH4NO3:硝酸铵39. Na2SO4:硫酸钠40. KAl(SO4)2:硫酸铝钾41. KClO3:氯酸钾42. KMnO4:高锰酸钾43. MnO2:二氧化锰44. SO2:二氧化硫45. SO3:三氧化硫46. CO:一氧化碳47. CO2:二氧化碳48. SiO2:二氧化硅49. P2O5:五氧化二磷50. H2O2:过氧化氢51. N2O5:五氧化二氮52. NO2:二氧化氮53. NO:一氧化氮54. N2:氮气55. O2:氧气56. O3:臭氧57. Cl2:氯气58. Br2:溴气59. I2:碘气60. HF:氟化氢61. HCl:氯化氢62. HBr:溴化氢63. HI:碘化氢64. CH4:甲烷65. C2H4:乙烯66. C2H2:乙炔67. C6H6:苯68. C7H8:甲苯69. C2H5OH:乙醇70. CH3COOH:乙酸71. C6H12O6:葡萄糖72. C12H22O11:蔗糖73. (C6H10O5)n:淀粉74. C3H6O3:乳酸75. C17H35COOH:油酸76. C15H31COOH:软脂酸77. C17H33COOH:硬脂酸78. C17H35COOCH2:油酸甘油酯79. C15H31COOCH2:软脂酸甘油酯80. C17H33COOCH2:硬脂酸甘油酯81. C6H12O6:果糖82. CH3CHO:乙醛83. CH3COOH:甲酸84. H2CO3:碳酸85. H2S:硫化氢86. NH3:氨气87. NaHSO4:硫酸氢钠88. NaHCO3:碳酸氢钠89. Na2HPO4:磷酸二氢钠90. NaH2PO4:磷酸二氢钠91. H2O:水,一种不含金属离子的碱。
常见食物含碳水化合物量一览表

常见食物含碳水化合物量一览表
以下是一份常见食物的含碳水化合物量一览表,旨在帮助您了解各种食物中的碳水化合物含量。
请注意,这些数值仅供参考,并可能因品牌、加工程度和烹饪方法的不同而有所变化。
主食类
- 米饭(100克): 28克
- 面条(100克): 25克
- 面包(一片): 15克
- 饼干(一片): 10克
- 粥(100克): 10克
蔬菜类
- 土豆(中等大小): 37克
- 玉米(一根): 20克
- 红萝卜(一个): 7克
- 西兰花(100克): 5克
- 菠菜(100克): 1克
水果类
- 苹果(中型): 20克- 橙子(中型): 12克- 香蕉(中型): 25克- 葡萄(100克): 17克- 草莓(100克): 8克
肉类和豆类
- 牛肉(100克): 0克- 鸡肉(100克): 0克- 鱼(100克): 0克
- 黄豆(100克): 10克- 红豆(100克): 20克
坚果和种子
- 杏仁(一把): 6克
- 花生(一把): 5克
- 蓝莓(100克): 14克
- 南瓜子(一把): 5克
- 核桃(一颗): 4克
请注意,此表格中的数值是基于常见食物的平均值,可能会有一些不准确或有所变化。
如果您对自己的碳水化合物摄入量有特殊需求,建议您与营养师或医生进行进一步的咨询和定制化建议。
> 注意:以上数据仅供参考,具体数据请参考食品包装上的营养标签。
常见食物碳水化合物含量表

常见食物碳水化合物含量表常见食物的碳水化合物含量表:1.稻米(东北)、稻米、黄米、米饭、米粥、米粉、糯米、血糯米:碳水化合物含量为75.3、77.5、45.6、58、25、9.8、78.2、77.5、73.7、62.7.2.方便面、挂面、花卷、煎饼、苦荞麦粉、烙饼、馒头、面条:碳水化合物含量为 70.4、74.5、72.5、74.7、60.2、51、48.3、58.3.素虾、芸豆、红薯、胡萝卜、姜、萝卜、马铃薯、藕、山药、菠萝、草莓、橙、柑、甘蔗、桂圆、桂圆干:碳水化合物含量为16.6、54.2、23.1、7.7、7.6、4、16.5、15.2、92.9、9.5、6、10.5、11.5、15.4、16.2、62.8.4.白瓜子、山核桃、松子、松子仁、西瓜子、榛子、杏仁、面筋、艾窝窝、饼干、蛋糕、豆汁、江米条、凉粉、绿豆糕、驴打滚、麻花、面包、通心粉、小麦粉、小米、小米粥、燕麦片、油饼、玉米、玉米面、豇豆、豆腐、豆腐干、豆腐皮、豆浆粉、豆沙、腐乳、腐竹、黄豆、绿豆、素鸡、豌豆、赤豆、油豆腐:碳水化合物含量为 75.4、71.5、73.5、8.4、61.6、40.4、66.6、66.9、58.9、54.3、55.7、4.3、3.9、58.5、51、77.4、22、9.7、7.8、7.3、16.1、7、12.3、9.6、9.9、17.1、10.9、20.8、7.5、28.6、11.9、72.6、17.3、16、13、64.2、77.2.5.月饼、冰激凌、茶叶、橘汁、奶糖、巧克力、苹果酱、炼乳、母乳、奶酪、牛奶、牛乳粉、酸奶、羊乳、豆奶粉、健儿粉、乳儿粉、鹌鹑蛋、鸡蛋、松花蛋、鸭蛋:碳水化合物含量为 52.3、17.3、50.3、23.2、84.5、51.9、68.7、55.4、7.4、3.5、3.4、51.9、9.3、5.4、68.7、82.7、73.5、2.1、1.3、4.5、3.1.6.香肠、火腿肠、狗肉、酱牛肉:这里没有给出具体的碳水化合物含量,建议在饮食中适量摄入。
常见化合物

常见化合物NaCl 氯化钠NaOH 氢氧化钠Na2CO3 碳酸钠NaHCO3 碳酸氢钠BaCl2 氯化钡BaSO4 硫酸钡Ba(OH)2 氢氧化钡AgNO3 硝酸银Ca(OH)2 氢氧化钙沉淀:BaCO3 碳酸钡BaSO4 硫酸钡CaCO3 碳酸钙AgCl 氯化银酸:H2SO4 硫酸HCl 氢硫酸(盐酸)HNO3 硝酸常见化合物的俗称俗称主要化学成分硅的化合物:石英、水晶SiO2砂子SiO2钠的化合物:食盐NaCl苏打、纯碱Na2CO3苛性钠、烧碱、苛性碱NaOH芒硝Na2SO4·10H2大苏打、海波Na2S2O3小苏打NaHCO3钾的化合物:苛性钾KOH灰锰钾KmnO4铵的化合物:硝铵、铵硝石NH4NO3硫铵、肥田粉(NH4)2SO4碳铵NH4HCO3钡的化合物:重晶石BaSO4钙的化合物:电石CaC2石灰石CaCO3萤石CaF2熟石灰、消石灰Ca(OH)2漂白粉Ca(ClO)2、CaCl2生石灰CaO无水石膏CaSO4熟石膏2CaSO4·H2O生石膏CaSO4·2H2O普钙Ca(H2PO4)2、CaSO4重钙Ca(H2PO4)2镁的化合物:卤盐、苦卤MgCl2泻盐MgSO4·7H2O菱镁矿MgCO3铝的化合物:矾土Al2O3刚玉、红宝石、绿宝石Al2O3明矾K2Al(SO4)2·12H2O铁的化合物:铁红Fe2O3赤铁矿Fe2O3磁铁矿Fe3O4菱铁矿FeCO3绿矾FeSO4·7H2O黄铁矿FeS2锰的化合物:软锰矿MnO2锌的化合物:锌矾、皓矾ZnSO4·7H2O 铅的化合物:方铅矿PbS铜的化合物:辉铜矿Cu2S胆矾、蓝矾CuSO4·5H2O波尔多液CuSO4、Ca(OH)2、S砷的化合物:砒霜As2O3雄黄As2S2雌黄As2S3有机化合物:沼气CH4电石气C2H2蚁醛、福尔马林HCHO蚁酸HCOOH醋酸CH3COOH酒精CH3CH2OH石灰酸C6H5OH甘油C3H8O3草酸C2H2O4。
常见挥发性有机物(VOCs)一览表

常见挥发性有机物(VOCs)一览表VOCs是挥发性有机化合物(Volatile Organic Compounds)的英文缩写,其定义有好几种,美国ASTM D3960-98标准将其定义为任何能参加大气光化学反应的有机化合物。
美国联邦环保署(EPA)这样定义:挥发性有机化合物是除CO、CO2、H2CO3、金属碳化物、金属碳酸盐和碳酸铵外,任何参加大气光化学反应的碳化合物。
在我国,VOCs(volatile organic compounds)挥发性有机物是指常温下饱和蒸汽压大于70.91 Pa、标准大气压101.3kPa下沸点在50~260℃以下且初馏点等于250摄氏度的有机化合物,或在常温常压下任何能挥发的有机固体或液体。
目前,我国VOCs的环境质量标准暂未颁布,VOCs的排放标准暂时没有国家标准,但各重点监测区域相继颁布了地方排放标准或行业标准。
国标对于VOCs的监测,使用的是《环境空气挥发性有机物的测定罐采样/气相色谱-质谱法》(HJ 759-2015)。
该方法可对直链烃、环烷烃、芳香烃、含氧化合物、苯系物、卤代烃等大多数挥发性有机物检测分析,检测组分多达67种,是目前VOC检测组分最齐全的方法。
同时,该方法与美国环保署(EPA)TO-14/15标准较为一致,基本上包含了TO-14/15重点监测组分,是我国各级环境监测站开展挥发性有机物监测的重要指导文件。
从环境监测的角度来讲,VOCs是以氢火焰离子检测器检出的非甲烷总烃类检出物的总称,主要包括烷烃类、芳烃类、烯烃类、卤烃类、酯类、醛类、酮类和其他有机化合物。
综上所述,VOC和VOCs其实是同一类物质,即挥发性有机化合物(Volatile Organic Compounds)的英文缩写,由于挥发性有机化合物一般成分不止一种,因此VOCs更精准。
下表为常见VOCs种类:。
初中化学化合物大全

初中化学化合物大全
本文档收集了初中化学中常见的化合物及其性质。
以下是一些
常见的化合物。
碳酸盐类化合物
- 碳酸钠(Na2CO3):无色结晶体,可溶于水,呈碱性。
- 碳酸氢钠(NaHCO3):白色结晶体,可溶于水,呈弱碱性。
- 碳酸钙(CaCO3):白色结晶体,几乎不溶于水,是石灰石
的主要成分。
氯化物类化合物
- 氯化钠(NaCl):无色结晶体,可溶于水,呈中性。
- 氯化氢(HCl):无色气体,可溶于水,呈酸性。
- 氯化钙(CaCl2):白色结晶体,可溶于水,具有吸湿性。
水合物类化合物
- 蓝石(CuSO4·5H2O):蓝色结晶体,可溶于水,是一种普遍用于实验室的蓝色试剂。
- 明矾(Al2(SO4)3·18H2O):无色结晶体,可溶于水,常用于水处理和染料工业。
氧化物类化合物
- 二氧化碳(CO2):无色气体,不溶于水,是二氧化碳气体的主要成分。
- 二氧化硅(SiO2):白色结晶体,几乎不溶于水,是石英的主要成分。
以上只是初中化学中的一部分化合物,每种化合物都有其独特的性质和用途。
在研究化学的过程中,我们将更深入地研究这些化合物以及它们之间的反应和相互作用。
欢迎进一步探索和发现更多有趣的化学化合物!。
分子量一览表
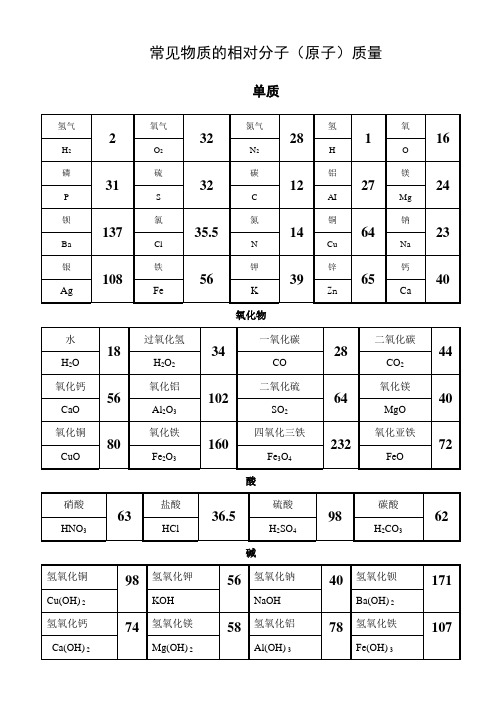
AgCl
KClO3
KMnO4
NaHCO3
盐
有机化合物
甲烷
16
乙醇
46
乙酸
60
尿素
60
葡萄糖
180
CH4
C2H5OH
CH3COOH
CO(NH2)2
C6H12O6
其他
氨气
17
NH3
400
氯化铁
162.5
FeCl2
FeSO4
Fe2(SO4)3
FeCl3
硫酸铜
160
氯化铜
135
氯化镁
95
碳酸镁
84
CuSO4
CuCl2
MgCl2
MgCO3
硫酸锌
151
氯化锌
136
氯化铝
133.5
碳酸氢铵
79
ZnSO4
ZnCl2
AlCl3
NH4HCO3
氯化银
143.5
氯酸钾
122.5
高锰酸钾
158
碳酸氢钠
常见物质的相对分子
单质
氢气
2
氧气
32
氮气
28
氢
1
氧
16
H2
O2
N2
H
O
磷
31
硫
32
碳
12
铝
27
镁
24
P
S
C
AI
Mg
钡
137
氯
35.5
氮
14
铜
64
钠
23
Ba
Cl
N
Cu
Na
银
108
铁
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe(NO3)3
(
溶液为黄色, 加 OH 产生
Al(NO3)3
)
-
) (
加 Cl 产生 AgCl↓ Ca(OH)2
( ) 熟石灰,消 石灰,石灰 水主要成分 微溶于水 常用于检验 CO2
加 OH 产 生
Al(OH)3↓ Al(OH)3↓ ( ) 加酸可溶 可用于治 疗胃酸过 多
Fe(OH)3↓ Fe(OH)3↓ ( ) 红褐色沉 淀 加酸可溶
化学知识卡片(一)——常见化合物一览表
H
+
NH4
+
K
+
Na
+
Ag+
加 Cl 产 生 AgCl↓
-
Ca2+
加 CO3 产生
2-
Ba2+
加 CO3 产生 BaCO3↓ , 2加 SO4 产生 BaSO4↓
2-
Mg2+
加 OH 产 生
-
Zn2+
加 OH 产 生
-
Cu2+
溶液为蓝色或绿 色, OH 产生 加
MgCl2
(
ZnCl2
) (
) 加 AgNO3 产 生 AgCl↓
CuCl2
( ) 溶液为绿色, 加 AgNO3 产 生 AgCl↓
加 AgNO3 产 生 AgCl↓
HgCl2 ( ) 加 AgNO3 产 生 AgCl↓
FeCl2 氯化亚铁 加 AgNO3 产 生 AgCl↓
Fe(OH)3↓
加 AgNO3 产 生 AgCl↓
Na2CO3
( ) 纯碱, 水溶液 显碱性
Na2CO3·10H2O NaHCO3 小苏打
Ag2CO3↓
( ) 加酸可溶并 放出 CO2
CaCO3↓
( ) 大理石、石 灰石主成分 加酸可溶并 放出 CO2 Ca3(PO4)2↓ ( ) Ca(H2PO4)2 常用磷肥
BaCO3↓
( ) 加酸可溶并 放出 CO2
(NH4)3PO4
磷酸铵 (NH4)2HPO4 磷酸氢二铵 常用复合肥 NH4H2PO4 常用复合肥
K3PO4
磷酸钾
Na3PO4
( )
Ag3PO4↓
( )
Ba3(PO4)2↓ ( )
Mg3(PO4)2↓ ( )
Zn3(PO4)2↓ ( )
Cu3(PO4)2↓ ( )
Hg3(PO4)2↓ ( )
FePO4↓ AlPO4↓ ) ( ) (
Ba(OH)2
( ) 常用于检验 和吸收 CO2 2加 SO4 产生 BaSO4↓ 2加 CO3 产生 BaCO3↓
K2O 氧化钾
Na2O(
O
2-
H2O H2SO4
硫酸 浓硫酸易吸水, 酸性干燥剂 难挥发, 强腐蚀
与水反应生 成 KOH 并 放热
) 与水反应生 成 NaOH 并 放热
Ag2O
( )
CaO (
NO3硝酸盐 均可溶
HNO3
硝酸 一元含氧酸 浓硝酸易挥发
NH4NO3
硝酸铵 常用氮肥 含氮量 35%
KNO3
( ) 和所有物质 都不发生复 分解反应
NaNO3
( ) 和所有物质 都不发生复 分解反应
AgNO3 (
-
Ca(NO3)2 )
( )
Ba(NO3)2
( ) 2加SO4 产生 BaSO4↓ 2加CO3 产生 BaCO3↓
KH2PO4
磷酸二氢钾 常用复合肥
注:↓表示沉淀,不注明表示白色。
( )
BaSO4 ↓
BaSO4↓
BaSO4↓
BaSO4↓
不 溶 于 HNO3
( ) 加 Ba2+产生
( ) 加 Ba2+产生
BaSO4↓
BaSO4↓
) HgSO4 白色粉末, ( ) 遇水变蓝, 加 Ba2+产生 用于检验水 BaSO4↓ CuSO4·5H2O 胆矾、蓝矾
Fe2(SO4)3
( ) 加 Ba2+产生 BaSO4↓
溶液黄色, 加 OH 产 生 ( ) 加 OH 产 生 Al(OH)3↓ 加 AgNO3 产 生 AgCl↓
Cl加
HCl
AgNO3
产生 AgCl↓
氯化氢 盐酸主要成分, 一元无氧酸, 浓盐酸易挥发, 加 AgNO3 产生 AgCl
↓
NH4Cl
氯化铵 常用氮肥 含氮量 26% 加 AgNO3 产 生 AgCl↓
Mg(NO3)2 Zn(NO3)2 Cu(NO3)2 Hg(NO3)2 Fe(NO3)2 ) ( ) ( ( ) ( ) 硝酸亚铁
溶液为蓝 色, Mg(OH)2↓ ( ) 加酸可溶 Zn(OH)2↓ Cu(OH)2↓ ( ) ( ) 加酸可溶 蓝色沉淀 加酸可溶 Hg(OH)2↓ Fe(OH)2 ( ) ↓ 加酸可溶 氢氧化亚 铁 加酸可溶
溶液显黄色 加 OH 产 生
BaSO4↓
Al(OH)3↓
加 Ba2+产生
Fe(OH)3↓
BaSO4↓
CO32加 H 产生 CO2
+
H2CO3
碳酸 二元含氧酸 不稳定, 易分解
(NH4)2CO3
碳酸铵 NH4HCO3 碳酸氢铵 氮肥,含氮 量 17%,加 + H 产生 CO2
K2CO3
( ) 草木灰的主 要成分 + 加 H 产生 CO2
)
BaO (
) MgO
生石灰 与水反应生 成 Ca(OH)2
并放热
与水反应生 成 Ba(OH)2 并放热
( MgSO4
ZnO ) ( ZnSO4
CuO ) ( CuSO( 4
HgO ) (
粉红色
FeO ) 氧化亚铁 FeSO4
硫酸亚铁 加 Ba2+产生
Fe2O3(
黑色粉末
) 红棕色, 铁锈、赤铁 矿主要成分
MgCO3
( ) 微溶于水
ZnCO3↓
( ) 加酸可溶并 放出 CO2
CuCO3↓
( ) 加酸可溶并 放出 CO2
HgCO3↓
( ) 加酸可溶并 放出 CO2
FeCO3↓
碳酸亚铁 菱铁矿主要 成分 加酸可溶并 放出 CO2 Fe3(PO4)2↓ 磷酸亚铁
加 H 产生 CO2
+
PO4
3-
H3PO4
磷酸 三元含氧酸
KCl
( ) 常用钾肥 加 AgNO3 产 生 AgCl↓
NaCl
( ) 食盐主要成 分 加 AgNO3 产生 AgCl↓
AgCl↓
( ) 不溶于 HNO3
CaCl2
( ) 易吸水 加 AgNO3 产 生 AgCl↓
BaCl2
( ) 加 AgNO3 产 生 AgCl↓ 2加 SO4 产生 BaSO4↓
Al2O3 ( )
Al2(SO4)3
( ) 加 OH 产 生
SO42加 Ba 产 生
2+
(NH4)2SO4
硫酸铵 常用氮肥 含氮量 21% 加 Ba2+产生
K2SO4
( ) 常用钾肥 2+ 加 Ba 产生
Na2SO4
( ) 加 Ba2+ 产 生
Ag2SO4
( ) 微溶于水
CaSO4
( ) 微溶于水
BaSO4↓
OH碱 使石蕊 试液变 蓝,使 酚酞试 液变红
H2O
氧化物 最常用的溶剂
NH4OH 或 NH3·H2O
氨水 易挥发 常用氮肥, 含氮量 15-17%
KOH
氢氧化钾 易吸水,强 腐蚀 常用于吸收 CO2
NaOH(
H2O2
医用消毒剂 加热或加 MnO2 催化可产生 O2
) 火碱,烧碱, 苛性钠 强腐蚀, 易吸水, 碱性 干燥剂, 也可 用于吸收 CO2
Hg2+
Fe2+
亚铁离子 溶液为浅绿 色
Fe3+
溶液为黄色 加 OH 产 生
Al3+
加 OH 产 生
-
酸,均可溶,具 有酸的通性, 使 石蕊试液变红
铵盐均可 溶,加 OH 产生 NH3
钾盐均可溶
钠盐均可溶
CaCO3↓
Mg(OH)2↓
Zn(OH)2↓
Cu(OH)2↓
Al(OH)3↓
Fe(OH)3↓ FeCl3( ) AlCl3
