硝酸根测定方法(高锰酸钾滴定法)
地表水硝酸根测试方法

地表水硝酸根测试方法
地表水中硝酸根的测试方法一般有以下几种:
1. 紫外光谱法:硝酸根在紫外光谱中吸收较强的峰位在200-220nm,可以通过紫外光谱仪测定水样中硝酸根的吸光度,进
而计算出硝酸根的浓度。
2. 离子选择电极法:使用硝酸盐选择电极,将其插入水样中,根据电极测量电位变化来判断硝酸根的浓度。
3. pH指示剂法:将pH指示剂加入水样中,当硝酸根浓度较
高时,水样呈现碱性,指示剂颜色发生改变,通过颜色的变化来判断硝酸根的浓度。
4. 高效液相色谱法:通过高效液相色谱仪分离和检测水样中的硝酸根,通过峰面积或峰高来计算硝酸根的浓度。
5. 倍卤法:将水样与含有Cl-、Br-、HNO3溶液混合,硝酸根
通过氯、溴与亚铁离子生成五卤化合物沉淀,通过测定沉淀的重量或测定亚铁离子的浓度来计算硝酸根的浓度。
需要注意的是,不同的测试方法适用于不同范围的硝酸根浓度,选择合适的测试方法确保准确度和可靠性。
同时,测试前应提前校准所用仪器和检测试剂,遵循相应的操作规程。
硝酸根,亚硝酸根的测定

硝酸(根)钠、亚硝酸(根)钠的测定准确量取10.00mL吸收液于200mL容量瓶中,用蒸馏水定容,摇匀,装入滴定管中。
取10.00mL稀释液于三角瓶中,加10mL饱和硫酸铵溶液,加热出现白色固体(干固),取下冷却至室温。
加入25.00mL硫酸亚铁铵标准溶液、10mL浓硫酸,加热煮沸1-2分钟驱赶NO2后,用高锰酸钾标准溶液滴定至微红色,30秒不变色即为终点。
同时做空白。
NaNO3(g/L)=(A-B)×N×0.02833×1000×20/10A—空白校对毫升数B –试样耗用毫升数N--高锰酸钾标准溶液的当量浓度0.02833—NaNO3的毫克当量:单位:克20—稀释倍数10—取样体积(mL)NO3-(g/L)=(C1V1-C2V2)×62×20/(3×10)C1,V1—硫酸亚铁铵的体积(mL)和浓度C2,V2—高锰酸钾的体积(mL)和当量浓度20—稀释倍数10—取样体积取50mL(1+5)硫酸于三角瓶中,加入高锰酸钾至微红色,加热至40-60℃,再准确加入25.00mL 高锰酸钾标准溶液,用稀释液滴定至微红色,半分钟不退色即为终点。
NaNO2(g/L)= 25×N×0.0345×1000×20/VN--高锰酸钾标准溶液的当量浓度0.0345—1mL高锰酸钾相当NaNO2的克数。
单位:克V—滴定稀释液的体积(mL)20—稀释倍数NO2-(g/L)= C2V2×46×20/(2×V)C2,V2—高锰酸钾的体积(mL)和当量浓度V—耗用稀释液体积(mL)20—稀释倍数10—取样体积注意:①高锰酸钾当量浓度C2=0.1(高锰酸钾摩尔浓度0.02mol/L);②硫酸亚铁铵浓度0.1mol/L;③计算结果均为原吸收液浓度;④(1+5)硫酸必须加热至40-60℃;⑤加硫酸亚铁铵溶液前必须冷却到室温。
硝酸根测定方法

硝酸根测定方法嘿,朋友们!今天咱来聊聊硝酸根的测定方法,这可真是个有趣又重要的事儿呢!你想想看,硝酸根就像是个调皮的小精灵,在各种物质里藏着,我们得想办法把它给揪出来。
那怎么揪呢?这就得靠一些巧妙的办法啦。
比如说,有一种方法就像是猎人追踪猎物的足迹一样。
我们通过一些化学反应,让硝酸根现形。
就好像猎物总会在地上留下脚印,硝酸根在特定的条件下也会露出马脚。
然后我们根据这些迹象,就能判断出它到底在不在那里。
还有一种方法呢,就像是给硝酸根做个独特的标记。
利用一些特殊的试剂,和硝酸根产生特别的反应,就好像给它贴上了一个只有我们能认得出来的标签。
这样一来,我们就能轻松地找到它啦。
你说这是不是很有意思呀?就好像我们在玩一个找宝藏的游戏,而硝酸根就是我们要找的那个大宝藏!测定硝酸根的过程也像是一场冒险呢。
有时候可能会遇到一些小挫折,就像路上的小石子会绊你一下,但咱可不能怕呀!要鼓起勇气继续往前冲。
想象一下,如果我们没有掌握好这些方法,那岂不是就像在黑暗中摸索,找不到方向呀?那可不行,我们得把这个小调皮给抓住,搞清楚它的情况。
而且呀,这些方法都不是随随便便就能成功的,得细心,得耐心。
就跟做饭一样,火候不到不行,调料放错了也不行。
咱得认真对待,才能得到准确的结果。
在实际操作中,每一步都要小心谨慎,可不能马虎大意哦。
就像走钢丝一样,稍有不慎就可能掉下去。
但只要我们掌握了技巧,保持平衡,就能顺利走到对岸。
总之呢,硝酸根的测定方法可真是一门大学问呀!我们要不断地学习、实践,才能把这个小精灵给牢牢抓住。
朋友们,加油吧,让我们一起在这个奇妙的化学世界里探索,找出那些隐藏的硝酸根!相信自己,我们一定能行!原创不易,请尊重原创,谢谢!。
硝酸根的测定方法

硝酸根的测定方法嘿,朋友们!今天咱来聊聊硝酸根的测定方法。
这可真是个有意思的事儿呢!你想想看,硝酸根就像个调皮的小精灵,藏在各种物质里,我们得想办法把它给揪出来。
那怎么揪呢?有一种常见的方法是分光光度法。
就好像我们拿着一个特别的“照妖镜”,让硝酸根在特定的光线照射下现形。
通过一系列的操作和试剂的加入,让它乖乖地显色,然后我们就能根据颜色的深浅来判断硝酸根的含量啦。
这是不是很神奇?就像我们能看到肉眼看不到的东西一样。
还有一种离子色谱法,这就像是给硝酸根开辟了一条专属通道,让它顺着这条道儿跑出来,然后我们在终点等着抓住它。
这个方法可厉害了,能把硝酸根分得清清楚楚,一点都不含糊。
再说说还原滴定法吧,这就像是一场和硝酸根的“捉迷藏”游戏。
我们先把它变成别的形态,然后再通过滴定的方式慢慢找到它,就像一点点揭开它的神秘面纱。
哎呀,这硝酸根的测定方法可真是各有各的妙处啊!你说要是没有这些方法,我们怎么能知道那些物质里到底有多少硝酸根呢?那岂不是像在黑暗中摸索一样。
在实际操作中,可得小心谨慎哦!每一步都要像走钢丝一样稳稳当当的,不然一不小心就可能出错啦。
就好比搭积木,一块没放好,可能整个就垮了。
而且,不同的方法适用的情况也不一样哦,就像不同的鞋子适合不同的场合,我们得根据具体情况来选择合适的方法。
总之,硝酸根的测定可不是一件简单的事儿,但也绝对不是什么难到登天的任务。
只要我们认真对待,掌握好方法,就一定能把这个调皮的小精灵给抓住。
大家可别小瞧了这小小的硝酸根测定,它在很多领域都有着重要的作用呢!比如环境监测、化工生产等等。
所以啊,学会它,用处可大着呢!这就是我对硝酸根测定方法的一些分享啦,大家觉得怎么样呢?。
水中硝酸根的测定
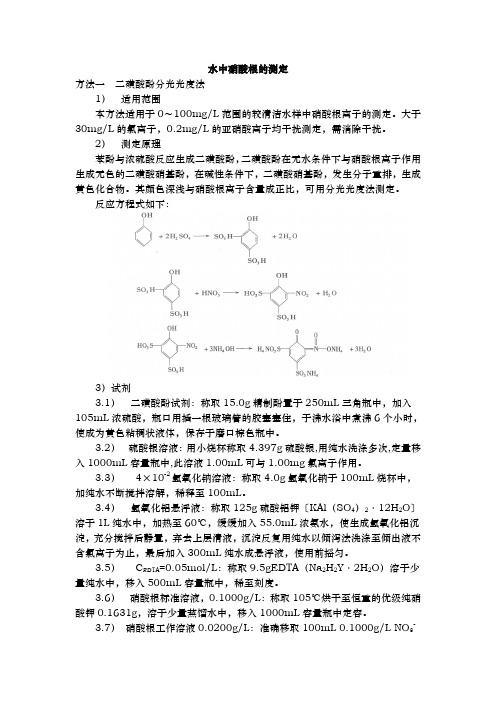
水中硝酸根的测定方法一二磺酸酚分光光度法1)适用范围本方法适用于0~100mg/L范围的较清洁水样中硝酸根离子的测定。
大于30mg/L的氯离子,0.2mg/L的亚硝酸离子均干扰测定,需消除干扰。
2)测定原理苯酚与浓硫酸反应生成二磺酸酚,二磺酸酚在无水条件下与硝酸根离子作用生成无色的二磺酸硝基酚,在碱性条件下,二磺酸硝基酚,发生分子重排,生成黄色化合物。
其颜色深浅与硝酸根离子含量成正比,可用分光光度法测定。
反应方程式如下:3)试剂3.1)二磺酸酚试剂:称取15.0g精制酚置于250mL三角瓶中,加入105mL浓硫酸,瓶口用插一根玻璃管的胶塞塞住,于沸水浴中煮沸6个小时,使成为黄色粘稠状液体,保存于磨口棕色瓶中。
3.2)硫酸银溶液:用小烧杯称取4.397g硫酸银,用纯水洗涤多次,定量移入1000mL容量瓶中,此溶液1.00mL可与1.00mg氯离子作用。
3.3)4×10-2氢氧化钠溶液:称取4.0g氢氧化钠于100mL烧杯中,加纯水不断搅拌溶解,稀释至100mL。
3.4)氢氧化铝悬浮液:称取125g硫酸铝钾〔KAl(SO4)2·12H2O〕溶于1L纯水中,加热至60℃,缓缓加入55.0mL浓氨水,使生成氢氧化铝沉淀,充分搅拌后静置,弃去上层清液,沉淀反复用纯水以倾泻法洗涤至倾出液不含氯离子为止,最后加入300mL纯水成悬浮液,使用前摇匀。
3.5)C EDTA=0.05mol/L:称取9.5gEDTA(Na2H2Y·2H2O)溶于少量纯水中,移入500mL容量瓶中,稀至刻度。
3.6)硝酸根标准溶液,0.1000g/L:称取105℃烘干至恒重的优级纯硝酸钾0.1631g,溶于少量蒸馏水中,移入1000mL容量瓶中定容。
3.7)硝酸根工作溶液0.0200g/L:准确移取100mL 0.1000g/L NO3-标准溶液于500mL容量瓶中,用水稀释至刻度即可。
(20mg/L)3.8)1+1氨水。
硝酸根测定方法(高锰酸钾滴定法)

硝酸根的测定方法(高锰酸钾滴定法)
1、测试原理
用高锰酸钾溶液去除水样中亚铁离子的干扰,后加入硫酸亚铁铵和硫酸溶液,
加热,使亚铁离子和硝酸根反应完全,后加入高锰酸钾溶液反滴定。
3Fe2++NO3-+4H+=3Fe3++NO+2H2O
NO+FeSO4=Fe(NO)SO4(棕色)
Fe(NO)SO4=NO↑+FeSO4
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
2、测定仪器及试剂
硫酸溶液(1:1水溶液)、硫酸亚铁铵(0.25mol/L标准溶液)、KMnO4溶液
(0.02mol/L标准溶液)、移液管。
3、标准溶液的配制
A 硫酸溶液(1:1水溶液)。
B 0.25mol/L硫酸亚铁铵溶液的配制:5.7克硫酸亚铁铵加入100毫升的容量
瓶中,冲至刻度,摇匀。
C 0.02mol/L KMnO4标准溶液的配制:0.79克KMnO4加入250毫升的容量瓶中,冲至刻度,摇匀。
4、实验过程
用移液管移取10毫升水样置于250毫升干燥的锥形瓶中,加入100毫升去离子水,滴加1:1硫酸水溶液调PH值0~1,用0.02mol/L KMnO4标准溶液滴定至溶
液成粉红色,再在上述溶液中加入已知量的硫酸亚铁铵,补加5~8毫升1:1硫酸,加热煮沸数分钟,使Fe2+和NO3-充分反应完全,冷却后,用0.02mol/L KMnO4标准溶液滴定至溶液成粉红色为终点。
5、计算公式
式中:V1—加入硫酸亚铁铵标准溶液的体积(ml)
V2—加入KMnO4标准溶液滴定的体积(ml) C1--硫酸亚铁铵标准溶液的浓度(mol/L) C2-- KMnO4标准溶液的浓度(mol/L)
V—取样量(ml)。
硝酸根离子检测方法

硝酸根离子检测方法硝酸根离子(NO3-)是一种常见的无机阴离子,广泛存在于自然界中的土壤、水体和空气中。
然而,硝酸根离子的过度积累会导致水体和土壤的污染,对环境和人类健康造成潜在的危害。
因此,准确检测硝酸根离子含量是环境保护和水质监测的重要任务之一。
为了检测硝酸根离子,科学家们发展了多种方法,下面将介绍其中一些常用的检测方法。
1. 纳氏法纳氏法是一种常用的检测硝酸根离子的定性和定量分析方法。
该方法基于硝酸根离子与亚硫酸铵反应生成硫酸根离子的化学反应。
在适当的pH条件下,硝酸根离子与亚硫酸铵反应生成氨气,氨气可以通过氨电极进行检测。
根据生成的氨气量可以确定硝酸根离子的含量。
2. 紫外光谱法紫外光谱法是一种常用的检测硝酸根离子的定性和定量分析方法。
硝酸根离子在紫外光谱中有一定的吸收峰,根据吸收峰的强度可以确定硝酸根离子的浓度。
这种方法无需特殊试剂,操作简便,但需要专业的紫外光谱仪器进行分析。
3. 离子色谱法离子色谱法是一种常用的检测硝酸根离子的定性和定量分析方法。
该方法基于硝酸根离子在特定条件下与色谱柱中的固定相发生离子交换反应。
通过调节流动相的组成和pH值,硝酸根离子可以与其他离子分离,进而进行定量分析。
离子色谱法具有高灵敏度和准确性,适用于复杂样品的分析。
4. 光度法光度法是一种常用的检测硝酸根离子的定量分析方法。
该方法基于硝酸根离子与邻苯二甲酸二乙酯反应生成紫色化合物的化学反应。
通过测量反应产物的吸光度,可以确定硝酸根离子的浓度。
光度法操作简便,结果准确可靠,适用于大批量样品的分析。
除了上述方法,还有许多其他方法可以用于检测硝酸根离子,如荧光法、电化学法等。
每种方法都有其优缺点,选择合适的检测方法需要考虑样品性质、目标浓度范围、设备可用性等因素。
总结起来,硝酸根离子的检测方法多种多样,通过选择合适的方法可以实现对硝酸根离子含量的准确分析。
这些方法在环境保护、水质监测和农业管理等领域起着重要作用,为我们提供了科学依据,以保护环境和维护人类健康。
硝酸根离子含量检测方法

硝酸根离子含量检测方法嘿,你问硝酸根离子含量检测方法啊?这事儿咱得好好说说。
先得准备一些东西哇。
比如说要有检测试剂,还有一些玻璃器皿啥的。
可不能随便找些东西就来检测,那可不行。
就像你做饭得有锅碗瓢盆一样,检测也得有合适的工具。
然后呢,可以用一种比较常见的方法,就是比色法。
把要检测的样品弄一点出来,放到一个容器里。
加上一些特定的试剂,这些试剂会和硝酸根离子发生反应,然后产生颜色变化。
就像变魔术一样,不过这可不是为了好玩,是为了检测硝酸根离子呢。
接着观察颜色的变化。
如果颜色变得很深,那可能硝酸根离子含量就比较高;如果颜色比较浅,那含量可能就比较低。
这就像看红绿灯一样,颜色不同代表的意思也不同。
还可以用仪器来检测。
有那种专门检测硝酸根离子的仪器,把样品放进去,仪器就会告诉你硝酸根离子的含量是多少。
这就像用温度计测量体温一样,很方便。
在检测的过程中,要注意一些问题哦。
比如说样品要取好,不能有杂质混进去,不然会影响检测结果。
还有操作要规范,不能乱搞一气。
就像你做作业得认真,不能乱写乱画。
我记得有一次我们做实验,就是检测硝酸根离子含量。
大家都很认真地准备东西,按照步骤来操作。
看着试剂和样品发生反应,颜色慢慢变化,心里可紧张了。
最后得出了结果,大家都很兴奋。
通过这次实验,我们也学会了怎么检测硝酸根离子含量。
总之啊,检测硝酸根离子含量有方法。
准备好工具,用对方法,注意细节。
这样就能准确地知道硝酸根离子的含量啦。
赶紧试试吧。
硝酸根离子的检验

硝酸根离子的检验硝酸根离子在用于环境监测,制药和其他商业上的应用中,具有重要意义。
硝酸根离子的检验是它的重要组成部分,这也是化学分析中最常见的类别之一。
本文将讨论硝酸根离子的检测原理,以及常用的检验方法。
硝酸根离子的检测原理硝酸根离子的检测原理大致如下:硝酸根离子是指一类具有一定电荷的离子,它们有时可以与氢离子结合,形成硝酸根离子的溶液。
这种溶液可以用酸碱指示剂和碱离子进行滴定,可以测量出硝酸根离子的含量。
常用的硝酸根离子检验方法常用的硝酸根离子检验方法包括次氯酸根离子滴定法,K或MnCl2滴定法,硝酸根离子滴定法,四氯化碳滴定法,氯化滴定法,氯化滴定法,氯盐滴定法,次氯酸根滴定法等。
1.氯酸根离子滴定法:它使用过氯酸作为滴定剂,用来测量水中次氯酸根离子的含量,它可以产生持久的绿色染料,以指示离子的浓度。
2. K或MnCl2滴定法:它使用K或MnCl2作为滴定剂,用来测定水中K和MnCl2含量。
该滴定法使用指示剂,其颜色变化可以用来指示离子浓度的变化。
3.酸根离子滴定法:它使用硫酸作为滴定剂,可以测量水中的硝酸根离子的含量。
这种方法需要用指示剂,其颜色变化可指示离子浓度的变化。
4.氯化碳滴定法:它使用四氯化碳作为滴定剂,可以测量水中的硝酸根离子的含量。
该滴定法使用指示剂,其颜色变化可以用来指示离子浓度的变化。
5.化滴定法:它使用氯化钠作为滴定剂,可以测量水中的硝酸根离子的含量。
该滴定法使用指示剂,其颜色变化可以用来指示离子浓度的变化。
6.化滴定法:它使用氯化钠或氯化钾作为滴定剂,可以测量水中的硝酸根离子的含量。
该滴定法使用指示剂,其颜色变化可以用来指示离子浓度的变化。
7.盐滴定法:它使用氯盐作为滴定剂,可以测量水中的硝酸根离子的含量。
该滴定法使用指示剂,其颜色变化可以用来指示离子浓度的变化。
8.氯酸根滴定法:它是一种特殊的滴定法,使用次氯酸作为滴定剂,可以测量水中的硝酸根离子的含量。
这种滴定法使用指示剂,其颜色变化可以用来指示离子浓度的变化。
硝酸根测定方法

硝酸根测定方法硝酸根(NO3-)是一种常见的无机阴离子,具有较高的溶解度。
在环境和水质监测中,测定硝酸根的含量是非常重要的,因为高浓度的硝酸根可能会引起水质污染和健康问题。
高锰酸钾滴定法是一种常用的测定硝酸根含量的方法。
下面将详细介绍高锰酸钾滴定法的原理和步骤。
1.原理高锰酸钾滴定法基于硝酸根和高锰酸根(MnO4-)的反应,其中高锰酸根在酸性条件下会被还原为无色的锰离子(Mn2+)。
硝酸根会将高锰酸根还原成锰离子,反应的平衡方程式如下:2MnO4^-+10NO3^-+16H+→2Mn2++10NO2+8H2O通过滴定法,我们可以测定溶液中硝酸根的含量。
2.实验步骤2.1准备工作准备0.02 mol/L高锰酸钾溶液和1 mol/L硝酸溶液。
使用超纯水对玻璃仪器和容器进行清洗,以避免任何外部污染物影响测量结果。
2.2样品的处理取一定体积的待测样品溶液,预处理样品以去除任何干扰物。
常用的预处理方法包括沉淀、提取和蒸馏等。
2.3滴定步骤2.3.1将经过预处理的待测样品取一定体积(通常为50mL),加入滴定瓶中。
2.3.2用酸性底物(例如硫酸)将溶液酸化,使其pH值低于2、这是为了提供适当的环境条件,使高锰酸钾可以与硝酸根反应。
2.3.3用硝酸溶液进行滴定,加入适量的硝酸溶液,使溶液呈现出浅粉红色。
2.3.4 开始滴定,缓慢滴加0.02 mol/L的高锰酸钾溶液,同时用漏斗进行搅拌。
当溶液的颜色从粉红色变成浅粉红色时,停止加高锰酸钾溶液。
2.3.5记录滴定所需的用量。
滴定的终点是当溶液颜色由浅粉红色变为淡黄色。
终点滴定液的颜色可以通过加入淀粉指示剂更明显地观察到,淀粉会在溶液中形成深蓝色络合物,表示滴定已经结束。
2.3.6计算硝酸根的含量,根据滴定所需的高锰酸钾溶液的体积和硝酸根的摩尔比例,计算出硝酸根的浓度。
硝酸根的测定结果用摩尔浓度或质量浓度表示。
3.注意事项3.1高锰酸钾溶液的浓度必须准确、稳定,而且滴定的速度应缓慢,以避免过度滴定。
硝酸根含量测试作业指导书

硝酸根含量测试作业指导书1. 目的测量化学品中硝酸根的含量。
2. 方法一2.1 试剂2.11 可调节离子浓度: ISA (Orion Cat. NO : 9307 11)2.12 防硝酸根干扰的溶液: ISS (Orion Cat. NO : 9307 10)2.13 1000 ppm N 标准溶液: (Orion Cat. NO : 920707)2.2 电极的准备2.21 参考电极(参考3.1)a : 内壁用1ml的注射器注入绿色饱和氯化银(AgCl) 标准溶液( Orion Cat.No.: 900002)b : 外室用1ml 的注射器注入2% 的ISA 溶液注意﹕- 每次使用前﹐外室必须装满填充液。
- 外部溶液水平线必须最少高于试样液1英寸。
- 内室溶液也必须最少高于外室溶液(水平线) 1英寸。
- 短期(1周以内) 电极可放在 D.I.水中, 但若长期(大于1周)应排出液体, 以干燥贮藏和保管。
2.22 硝酸根电极( 参考﹕3.2 )a : 旋转感应器到电极体﹐直至上紧。
b : 用蒸馏水浸泡电极体约15 分钟﹐后用100ppm N 标准溶液于试验前浸泡最少 1 小时。
注意﹕- 电极可放在浓度为0.01M 的硝酸根溶液中保存1~2天。
- 若2~3天则应排空﹐干燥保存。
- 可在空气中放置1小时左右。
2.3 试样的准备2.31 精确称取约 2 克的试样放入150ml的烧杯中。
2.32 加入100ml 的 D.I.水。
注意﹕建议所有实验应在 2 小时内完成﹐否则硝酸根会分解。
2.4 用pH计测量( 参考﹕3.3 )2.41 相联电极和pH 计。
2.42 按电源开启pH 计。
2.43 按“MODE”到指示为毫伏电压。
2.44 从容量瓶中移到100ml 的试样加在150ml的烧杯中。
2.45 准备稀的ISA 溶液(20%)。
2.46 加入各1ml 的ISA 和ISS 溶液并用磁化搅拌器不停搅拌。
2.47 用 D.I.水冲洗电极后放入烧杯中﹐最后检查电极上是否有气泡在薄膜表面出现。
硝酸根离子的检验

硝酸根离子的检验
硝酸根离子在日常生活中是常见的污染物,也可以用于工业用途,所以检验硝酸根离子的含量是必不可少的。
本文主要介绍了硝酸根离子的检验方法,以及关于硝酸根离子的常见问题。
一、硝酸根离子的检验方法
1.导率检验法
在温度一定的情况下,硝酸根离子的电导率与盐度之间存在一定关系,所以可以利用电导率检验法来检验硝酸根离子的含量。
具体方法为将待检样品加入电导率仪中,在固定温度(一般为25摄氏度)下,测量硝酸根离子的电导率,然后与硝酸根离子盐度对照表中对应的电导率值进行比较,就可以推知硝酸根离子的含量。
2.酸滴定法
盐酸滴定法是一种简单而有效的检验硝酸根离子的方法,可以准确检验出样品的硝酸根离子含量。
具体方法为:将样品加入标准滴定液中,加热至显色,然后冷却,用盐酸对样品进行滴定,直至液体清澈,最后测定滴定所用液体的体积,就可以推知样品的硝酸根离子含量。
三、硝酸根离子的常见问题
1.酸根离子的污染问题
由于硝酸根离子的挥发性特点,检验标准和测量方法有时存在一定的偏差,因此当硝酸根离子的含量超标时,就会对空气、土壤和水体等环境造成一定的污染。
2.酸根离子的处理方法
硝酸根离子的污染处理效果较好,主要有氧化法、生物法、吸附法、沉淀法和膜分离法等,具体可以根据现场情况进行选择。
另外,硝酸根离子还可以利用反渗透和蒸发法进行除去。
总之,硝酸根离子的检测对于防止污染、保护环境等都有很大的作用,应该加强对硝酸根离子的监督和检测,减少给环境带来的负面影响。
硝酸根离子的测定(终)
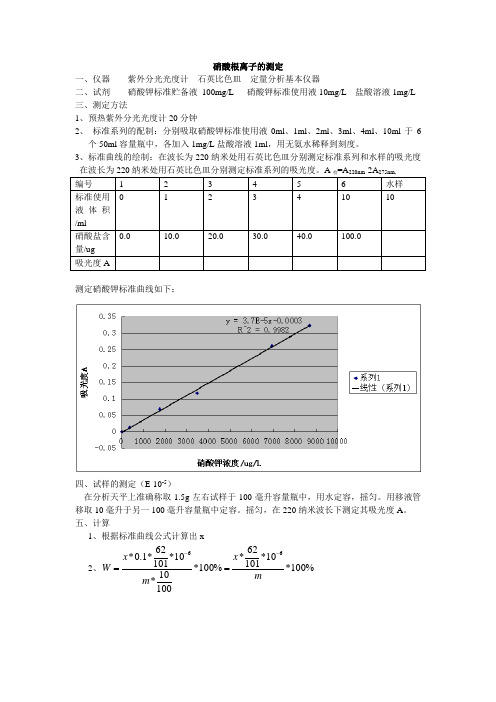
硝酸根离子的测定
一、仪器 紫外分光光度计 石英比色皿 定量分析基本仪器
二、试剂 硝酸钾标准贮备液 100mg/L 硝酸钾标准使用液10mg/L 盐酸溶液1mg/L 三、测定方法
1、预热紫外分光光度计20分钟
2、 标准系列的配制:分别吸取硝酸钾标准使用液0ml 、1ml 、2ml 、3ml 、4ml 、10ml 于6 个50ml 容量瓶中,各加入1mg/L 盐酸溶液1ml ,用无氨水稀释到刻度。
3、标准曲线的绘制:在波长为220纳米处用石英比色皿分别测定标准系列和水样的吸光度 在波长为220纳米处用石英比色皿分别测定标准系列的吸光度。
A 校=A 220nm -2A 275nm, 编号 1 2 3 4 5 6 水样 标准使用液体积/ml 0
1
2
3
4
10
10
硝酸盐含量/ug
0.0 10.0 20.0 30.0 40.0 100.0 吸光度A
测定硝酸钾标准曲线如下:
四、试样的测定(E-10-5)
在分析天平上准确称取1.5g 左右试样于100毫升容量瓶中,用水定容,摇匀。
用移液管移取10毫升于另一100毫升容量瓶中定容。
摇匀,在220纳米波长下测定其吸光度A 。
五、计算
1、根据标准曲线公式计算出x
2、%100*10*10162*%100*100
10*10*10162*
1.0*66m x m x W --==。
水质分析中硝酸根检测不同方法的对照

2019年第11期广东化工第46卷总第397期·79·水质分析中硝酸根检测不同方法的对照张大希(广东省佛山地质局,广东佛山52800)Control of Different Methods for Detection of Nitrate Root in Water QualityAnalysisZhang Daxi(Foshan Geological Bureau,Guangdong province,Foshan 52800,China)Abstract:Water quality analysis includes the detection and analysis of water from various sources,such as surface water,groundwater,drinking water and industrial wastewater in life.Its testing items include anions:chloride ions,sulfuric acid ions,bicarbonate and ions,nitric acid ions and other projects.Cationic ions include:calcium ions,magnesium ions,ammonium root ions,potassium ions,sodium ions and so on.The detection of nitric acid in water quality analysis is one of the important experimental projects,in which different methods have advantages and disadvantages,the most commonly used methods are spectrophotometry,ultraviolet spectrophotometry,Ion chromatography,3methods.Keywords:water quality analysis ;nitric acid root detection ;spectrophotometry ;ultraviolet spectrophotometry ;ion chromatography1前言水质分析中[1],硝酸根的检测常用的方法包括:二磺酸酚分光光度法、紫外分光广度法、离子色谱法[2]中方法。
硝酸根 标准

硝酸根标准下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!硝酸根是有机化学中一个重要的离子,它是硝酸的阴离子形式。
硝酸根鉴定

硝酸根离子的鉴定通常涉及化学反应,这些反应可以用来检测溶液中是否存在硝酸根离子。
以下是一些常用的鉴定方法:1. 硝酸银法(silver nitrate test):硝酸根离子与银离子反应生成不溶于水和酸的白色沉淀,即银硝化物(AgNO3)。
反应方程式:Ag+ (aq) + NO3 (aq) → AgNO3 (s)这个方法适用于检测溶液中的硝酸根离子。
如果出现白色沉淀,则表明溶液中含有硝酸根离子。
2. 盐酸酸化的硝酸银法:在酸性条件下,硝酸根离子与银离子反应生成白色沉淀。
反应方程式:Ag+ (aq) + Cl (aq) → AgCl (s)这个方法用于检测氯离子,但也可以用来间接检测硝酸根离子,因为如果溶液中有硝酸根离子,它们会与银离子反应生成沉淀,而不会产生氯银沉淀。
3. 硝酸钡法(barium nitrate test):硝酸根离子与钡离子反应生成不溶于水和酸的白色沉淀,即钡硝化物(Ba(NO3)2)。
反应方程式:Ba2+ (aq) + NO3 (aq) → Ba(NO3)2 (s)这个方法可以用来检测硝酸根离子,如果出现白色沉淀,则表明溶液中含有硝酸根离子。
4. 滴定法:可以使用滴定方法,如Volhard滴定或F滴定,使用标准溶液(如硫酸或盐酸)滴定含有硝酸根离子的溶液。
通过滴定过程中消耗的标准溶液的体积,可以计算出硝酸根离子的浓度。
5. 离子色谱法:离子色谱是一种用于分离和定量离子分析的技术,可以用来测定溶液中的硝酸根离子浓度。
在实验室中,硝酸根离子的鉴定通常需要专业的化学知识和实验技能。
在进行鉴定之前,应确保遵守实验室安全规程,并使用适当的实验室设备。
一种硝酸根的检测方法

一种碱回收炉清灰剂RYT硝酸根的标准测定方法一、测试原理:在酸性溶液中用过量的铁(Ⅱ)将硝酸根还原。
过量的铁(Ⅱ)用重铬酸钾标准溶液滴定。
3Fe2++2NO3-+4H+--→3Fe3++NO↑+2H2O6Fe2++Cr072-+14H+--→6Fe3++2Cr3++7H20二、测定仪器及试剂:1、硫酸亚铁-硫酸溶液:92g硫酸亚铁(FesO4·7H20)溶于100mL1硫酸(1+9)溶液,用水稀释至1000mL,摇匀。
2、试亚铁灵指示剂(1-10邻菲啰啉-硫酸亚铁):0.0025mol/L3、重铬酸钾标准溶液C(1/6K2Cr07)=0.100mol/L:称取4.9031g预先150℃烘干2h的重铬酸钾(基准试剂),溶于100mL水中,转移至1000mL容量瓶,用水定容至刻度,摇匀。
三、实验过程:1、用孔径1.5mm标准筛将清灰剂样品过筛,分别收集筛上物和筛下物,并按3:7(筛上物:筛下物)的比例在研钵中充分磨细混匀。
将研磨好的样品用干净的称量瓶盛装,并置于105℃烘箱中烘干,备用。
2、称取0.15-0.20g(精准至0.0001g)充分研细混匀的试样,放入250mL锥形瓶中,加入50mL水,摇匀。
3、加热至沸,微沸5min,取下冷却。
加入5g氯化钠,摇匀。
再加入10.00mL硫酸亚铁-硫酸溶液,摇匀。
4、在通风橱中,边晃动锥形瓶边缓慢加入20mL浓硫酸,加热至沸,微沸3min。
流水冷却。
5、加入50mL冷水和1滴试亚铁灵指示剂。
用重铬酸钾标准溶液滴定至溶液由棕红色变为绿色。
同时做空白试验。
四、计算公式:以质量分数表示硝酸根(NO3)含量,按下式计算:式中:C(1/6K2Cro7)—重铬酸钾标准溶液的浓度mol/LV O—重铬酸钾滴定空白溶液时所消耗的体积mLV1—重铬酸钾滴定试样溶液时所消耗的体积mL20.67—硝酸根的摩尔质量,M(1/3NO3),g/m0l。
高锰酸钾的滴定实验报告

高锰酸钾的滴定实验报告高锰酸钾的滴定实验报告引言:高锰酸钾是一种常用的氧化剂,在化学实验中经常被用于滴定分析。
本次实验旨在通过滴定分析的方法确定未知溶液中含有的亚硝酸根离子的浓度。
实验步骤:1. 实验前准备:a. 将高锰酸钾固体称取一定质量,溶解于蒸馏水中,制备出一定浓度的高锰酸钾溶液。
b. 准备一定浓度的硫酸溶液,用于稀释高锰酸钾溶液。
c. 配制出一定浓度的硝酸铵溶液,用于还原高锰酸钾溶液中的高锰酸根离子。
2. 滴定实验:a. 取一定体积的未知溶液,加入适量的硝酸铵溶液,使高锰酸钾完全被还原为无色的Mn2+离子。
b. 加入硫酸溶液,使溶液酸性增加,以促进滴定反应的进行。
c. 使用标准的亚硝酸钠溶液进行滴定,滴定至溶液颜色由粉红色变为浅粉色。
d. 记录滴定所需的亚硝酸钠溶液的体积。
3. 数据处理:a. 根据滴定所需的亚硝酸钠溶液的体积,计算出未知溶液中亚硝酸根离子的浓度。
b. 进行数据的统计分析和误差分析,评估实验结果的可靠性。
实验结果:根据实验数据计算得出未知溶液中亚硝酸根离子的浓度为X mol/L。
讨论:1. 实验误差分析:a. 实验中可能存在的误差包括仪器误差、人为误差以及化学反应的不完全性等。
b. 通过对实验步骤的细致控制和重复实验,可以减小实验误差的影响。
2. 实验结果的可靠性:a. 实验结果的可靠性受到多个因素的影响,包括实验条件的控制、实验操作的准确性以及数据处理的精确度等。
b. 通过对实验过程的仔细分析和数据处理的严谨性,可以提高实验结果的可靠性。
结论:通过高锰酸钾的滴定实验,成功确定了未知溶液中亚硝酸根离子的浓度为X mol/L。
实验结果可靠性较高,但仍需进一步加强实验操作的准确性和数据处理的精确性。
总结:本次滴定实验通过使用高锰酸钾作为氧化剂,亚硝酸钠作为滴定剂,成功测定了未知溶液中亚硝酸根离子的浓度。
实验过程中需要注意实验条件的控制和实验操作的准确性,以提高实验结果的可靠性。
硝酸根的鉴定

硝酸根的鉴定:
方法一:用浓硫酸加铜片,浓缩液或晶体中加入少量浓硫酸,加热。
有红棕色气体放出即含有硝酸根离子。
方法二:在溶液中加入盐酸,让溶液呈酸性,使硝酸具有氧化性.然后在溶液中加入氯化亚铁溶液,如果溶液颜色变黄,且生成的气体遇到空气后变为红棕色,证明有硝酸根离子。
硝酸根:即三氧化氮,是一种不稳定的氮氧化物,化学式为NO3。
硝酸根离子有氧化性,在酸性溶液中能使亚铁离子氧化成铁离子,而自己则还原为一氧化氮。
一般地,硝酸根是指硝酸盐的阴离子。
它是五氧化二氮气相分解的中间产物。
该物质存在时间很短,但吸收光谱能检测到它的存在。
实验证明它具有顺磁性。
三氧化氮的空间构型可能为平面正三角形,但至今未将它分离出来。
常见的含有硝酸根的化学物质有,硝酸银、硝酸钾、硝酸钠、硝酸铵等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硝酸根的测定方法(高锰酸钾滴定法)
1、测试原理
用高锰酸钾溶液去除水样中亚铁离子的干扰,后加入硫酸亚铁铵和硫酸溶液,
加热,使亚铁离子和硝酸根反应完全,后加入高锰酸钾溶液反滴定。
3Fe2++NO3-+4H+=3Fe3++NO+2H2O
NO+FeSO4=Fe(NO)SO4(棕色)
Fe(NO)SO4=NO↑+FeSO4
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
2、测定仪器及试剂
硫酸溶液(1:1水溶液)、硫酸亚铁铵(0.25mol/L标准溶液)、KMnO4溶液
(0.02mol/L标准溶液)、移液管。
3、标准溶液的配制
A 硫酸溶液(1:1水溶液)。
B 0.25mol/L硫酸亚铁铵溶液的配制:5.7克硫酸亚铁铵加入100毫升的容量
瓶中,冲至刻度,摇匀。
C 0.02mol/L KMnO4标准溶液的配制:0.79克KMnO4加入250毫升的容量瓶中,冲至刻度,摇匀。
4、实验过程
用移液管移取10毫升水样置于250毫升干燥的锥形瓶中,加入100毫升去离子水,滴加1:1硫酸水溶液调PH值0~1,用0.02mol/L KMnO4标准溶液滴定至溶
液成粉红色,再在上述溶液中加入已知量的硫酸亚铁铵,补加5~8毫升1:1硫酸,加热煮沸数分钟,使Fe2+和NO3-充分反应完全,冷却后,用0.02mol/L KMnO4标准溶液滴定至溶液成粉红色为终点。
5、计算公式
式中:V1—加入硫酸亚铁铵标准溶液的体积(ml)
V2—加入KMnO4标准溶液滴定的体积(ml) C1--硫酸亚铁铵标准溶液的浓度(mol/L) C2-- KMnO4标准溶液的浓度(mol/L)
V—取样量(ml)。
