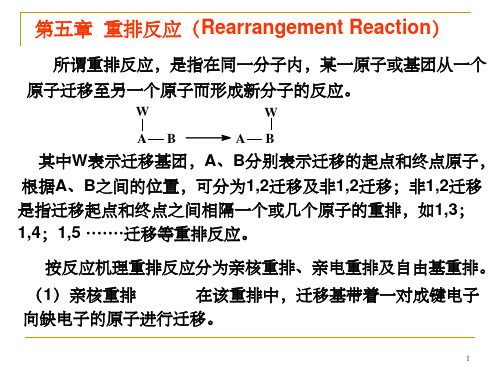
第五章 重排反应
合集下载
第五章重排的反应

第五章 重排反应
重排反应: 在同一个有机分子中,由于试剂或介质的影响,一个基
团或原子从一个原子迁移到另一个原子上,形成的新分子 中,碳骨架发生了变化(其中氢的迁移不会改变碳骨架),这 种反应称为重排反应。
W
A
BC
D
1
2
3
4
A为迁移起点原子
W
A B C D AB为1,2重排
AC为1,3重排
1
2
3
4 AD为1,4重排
卤代物与此类似:
-Cl
Cl
Cl
Cl
Cl
碳正离子在环上,得缩环产品:
NaNO2/HOAc NH2 HNO2 (HONO)
-N2
碳正离子不在环上,得扩环产品:
CH2NH2 (HONO)
CH2
-N2
H2O
CH2OH
H2O
OH
1ቤተ መጻሕፍቲ ባይዱ形成C+ 形式
(1)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl
CC OH OH
4) 半频哪醇(semipinacol)
R2 R3 R1 C C R4
OH L
L = -X, -NH2,-SPh...
(1) 四取代邻乙二醇的重排 四取代连乙二醇中,如果R相同,反应简单,只得到
一种产物。 如果R不相同,反应复杂,产品取决于连乙二醇的结
构及迁移基团的能力。 X 对称的邻乙二醇的重排
(3) 羟基位于脂环上的连乙二醇的重排 重排时可引起环的扩大或缩小。两个羟基处于a或e
键不同时,产物不同。
OH OH
Ph Ph
H 2SO 4/Et2O r.t. 2 h
重排反应: 在同一个有机分子中,由于试剂或介质的影响,一个基
团或原子从一个原子迁移到另一个原子上,形成的新分子 中,碳骨架发生了变化(其中氢的迁移不会改变碳骨架),这 种反应称为重排反应。
W
A
BC
D
1
2
3
4
A为迁移起点原子
W
A B C D AB为1,2重排
AC为1,3重排
1
2
3
4 AD为1,4重排
卤代物与此类似:
-Cl
Cl
Cl
Cl
Cl
碳正离子在环上,得缩环产品:
NaNO2/HOAc NH2 HNO2 (HONO)
-N2
碳正离子不在环上,得扩环产品:
CH2NH2 (HONO)
CH2
-N2
H2O
CH2OH
H2O
OH
1ቤተ መጻሕፍቲ ባይዱ形成C+ 形式
(1)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl
CC OH OH
4) 半频哪醇(semipinacol)
R2 R3 R1 C C R4
OH L
L = -X, -NH2,-SPh...
(1) 四取代邻乙二醇的重排 四取代连乙二醇中,如果R相同,反应简单,只得到
一种产物。 如果R不相同,反应复杂,产品取决于连乙二醇的结
构及迁移基团的能力。 X 对称的邻乙二醇的重排
(3) 羟基位于脂环上的连乙二醇的重排 重排时可引起环的扩大或缩小。两个羟基处于a或e
键不同时,产物不同。
OH OH
Ph Ph
H 2SO 4/Et2O r.t. 2 h
第五章 重排反应

CH2N2
PhCOOAg/EtOH
CH2COOH 多一个碳的酸
O光
O
N2
C O H2O
COOH
Curtius (库尔悌斯)反应
酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯
异氰酸酯水解则得到胺:
第二节 由碳原子到杂原子的重排
H3C H3C
C
C
CH3
CH3 61%
H3C CH C
H3C
H3C
CH2
31%
(H3C)3C
C H
CH2
3%
二 Pinacol 邻二醇(或邻二官能团)合成酮的方法
RR
H+
R
RCCR
R C CR
OH OH
OR
机理:
RR R C CR
OH OH
H+
RR
R C CR
OH
R R C CR
OH R
H+
R
-H+
OO CC G
G为吸电子基时,G所在的芳环迁移(实际产物为混合物)
OO
CC
G
OH
应用实例:
OCH3
CC OO
OCH3 KOH/n-BuOH/H2O
回流
OCH3 OH
C COOH
2 94%
CH2COOH
CO CO
KOH/H2O
CH2COOH
OH (HOOCCH2)2 C COOH
柠檬酸
四 Favorski (法沃尔斯基)重排
OO
KOH
Ar C C Ar
△
机理:
OH O Ar C C OK
Ar
O O OH Ar C C
第五章 重排反应

N OH H H N OH2 H2O H2O R' C N R R' C NHR (酰胺) O
R C R' R' C N R OH2
R C R' R' C N R OH
Backmann重排为反式重排,与羟基处于反式位置的烃基迁移到氮原 子上。 OH 例如: N
C OCH 3 PCl 5
Et2O 10 ℃
N
H
H
H H2O H
N
OH2
H -H+ H
N
OH
H H N
O
H
Z异构体
HO H N H H
+
H2O H N -H2O H
H
N
H N
H
H
H H2O H
OH2 N -H+
H
OH N
H
O NH
H
H
思考题
CH3 N OH
H2SO4
?
HN O
CH3
CH3 HO N
H2SO4
?
O
N H
CH3
2、霍夫曼(Hofmann)重排
第三节 丛杂原子到碳原子的重排
RCOOH
RCOCl
CH2N(CH3)2
CH2 N2
RCOCHN2
HBr
R-CO-CH2Br
Na2CO3
O R C
H3C H2C N CH3
CH2
重排
O
O R C HC N
CH3 CH3
① CH3I ② KOH
R C
HC CHPh
CH2Ph
Zn-Hg HCl
RCH2CH2CH2Ph
O2N
R C R' R' C N R OH2
R C R' R' C N R OH
Backmann重排为反式重排,与羟基处于反式位置的烃基迁移到氮原 子上。 OH 例如: N
C OCH 3 PCl 5
Et2O 10 ℃
N
H
H
H H2O H
N
OH2
H -H+ H
N
OH
H H N
O
H
Z异构体
HO H N H H
+
H2O H N -H2O H
H
N
H N
H
H
H H2O H
OH2 N -H+
H
OH N
H
O NH
H
H
思考题
CH3 N OH
H2SO4
?
HN O
CH3
CH3 HO N
H2SO4
?
O
N H
CH3
2、霍夫曼(Hofmann)重排
第三节 丛杂原子到碳原子的重排
RCOOH
RCOCl
CH2N(CH3)2
CH2 N2
RCOCHN2
HBr
R-CO-CH2Br
Na2CO3
O R C
H3C H2C N CH3
CH2
重排
O
O R C HC N
CH3 CH3
① CH3I ② KOH
R C
HC CHPh
CH2Ph
Zn-Hg HCl
RCH2CH2CH2Ph
O2N
第五章--重排反应

△
1 23
2 OH
3
1 CH3 190℃
3
1 CH3
△
2 OH
OH CH3
CH3 OH
O CH3
CH3 O
Curtius (库尔悌斯) 反应
酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯
异氰酸酯水解则得到胺:
反应机理
实例
Schmidt (施密特)反应
羧酸、醛或酮分别与等摩尔旳叠氮酸(HN3)在强酸(硫酸、聚磷 酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及 酰胺:
(CH3)3C-CH3NH2
NaNO2 HCl
(c)-OH, 加 H+ (-H2O)
(CH3)3C-CH2N2Cl
-N2 (CH3)3C-CH2
△
(CH3)3C-CH2OH
H+ -H2O
(CH3)3C-CH2
(CH3)3C-CH2=CH2 H+ (CH3)3C-CH-CH3
2 迁移基团迁移顺序
OCH3
Ph
Semipinacol重排
RR R C CR
OH Y
OH
Cl
C
H C
Ph
HNO2
Cl
Ph NH2
RR R CCR
OH
OH
H
C C Ph
Cl
Ph
O H
C C Ph Ph
O OH
+ CH3NO2
HO CH2NH2
HO CH2
O
CH2NO2 [H]/Ni
HNO2
OH
三、二苯基乙二酮 ——二苯乙醇酸型重排
R PCl5 + R' C
OH N
1 23
2 OH
3
1 CH3 190℃
3
1 CH3
△
2 OH
OH CH3
CH3 OH
O CH3
CH3 O
Curtius (库尔悌斯) 反应
酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯
异氰酸酯水解则得到胺:
反应机理
实例
Schmidt (施密特)反应
羧酸、醛或酮分别与等摩尔旳叠氮酸(HN3)在强酸(硫酸、聚磷 酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及 酰胺:
(CH3)3C-CH3NH2
NaNO2 HCl
(c)-OH, 加 H+ (-H2O)
(CH3)3C-CH2N2Cl
-N2 (CH3)3C-CH2
△
(CH3)3C-CH2OH
H+ -H2O
(CH3)3C-CH2
(CH3)3C-CH2=CH2 H+ (CH3)3C-CH-CH3
2 迁移基团迁移顺序
OCH3
Ph
Semipinacol重排
RR R C CR
OH Y
OH
Cl
C
H C
Ph
HNO2
Cl
Ph NH2
RR R CCR
OH
OH
H
C C Ph
Cl
Ph
O H
C C Ph Ph
O OH
+ CH3NO2
HO CH2NH2
HO CH2
O
CH2NO2 [H]/Ni
HNO2
OH
三、二苯基乙二酮 ——二苯乙醇酸型重排
R PCl5 + R' C
OH N
第五章_重排反应

CH3— C — C — CH3
+
—
O — BF3
_
CH3
CH3— C — C — CH3
— —
— —
O
CH3
+
OH OH
OH O
— —
R
— —
— —
— —
— —
— —
R — C — C—R
3
1
H
+
R — C — C— R R
3
1
2
R ~ + —H
3:
R — C — C —R R
3
1
2
脂环族氨基醇和脂环族卤代醇则发生环扩大或环缩小反应:
在上述过程中,叔碳正离子(Ⅰ)重排成质子化酮的动力 是具有未共享电子对的氧对碳正离子(Ⅱ)有更大的稳定作用, 同时碳正子(Ⅱ)亦容易从羟基上脱去质子而生成稳定的最后 产物。
在反应过程中,凡是能生成类似的碳正离子者,都能发生 此类重排。
例如,与Pinacol醇结构相似的α,β-卤代醇、氨基醇和环氧 化物、α -羟基酮等在相应的条件下的类似重排反应(通常称为 半Pinacol重排,这种情况不能象Pinacol醇那样可以选择正离子 中心):
(CH3)2C
CHCH3
— N2
OH NH2 CH3 CH3 C OH CHCH3
重排
OH N2 CH3
—
CH3— C — CHCH3
+
CH3— C — C H(CH3)2
O
—
OH
—H
+
— —
CH3 CH3
CH3 CH3
— —
—
CH3— C —— C — CH3 O
药物合成反应第五章 重排反应

重排反应中键的裂解和形成方式: 异裂(离子型) 均裂(游离基型) 环状过渡态(σ键迁移型)
离子型重排反应: 1.阴离子型重排(亲核重排)
C— A— Y Z -Y C— A Z C— A — Z
2.阳离子型重排(亲电重排)
X— B— C Y -Y X— B— C B— C X
3.游离基型重排反应: 重排反应中间体呈游离基状态
O
O COEt
*
5 0%
COEt
+ *
5 0%
*
O Ar X R
M eO Ar M eO H
OR X
-X
-
OAr R
O M eO Ar R
-
R Ar C O 2M e
M eO H
R Ar C O 2M e
• 碳负离子缺少共振稳定时 • 卤代酮羰基无可烯醇化的氢时 • 二卤代酮时
五 、Wolff(沃尔夫)重排 和Arndt-Eistert (阿恩特-埃斯特尔特)
例:
C 2H 5 C C 2H 5 Br CONH2 N a O Br H 2O
C 2H 5 C 2H 5 C O
(3)构型保持
Ph H2 H * C O N H B r 2 /N a O H C C 2 CH3 Ph H2 H * C C NH2 CH3
(4)当酰胺分子的适当位置有羟基、氨基存在时, 可以分子内成环。
HO HNO2
CH2 O
O HBr Cl C Ph C H Ph
A g N O 2 /E tO H Cl
O C
H C
Ph Ph
HO
Ph SPh
O Ph
HO O
CH3 Ph
Ph
O CH3
第五章、重排反应

第五章、重排反应
化学反应中,一般碳的骨架不变。分子的碳架或官能团的位置发生改 变的反应称之为分子重排反应。重排反应在分子内进行,故称之为分 子重排反应。 重排反应为烃基或氢原子在分子内进行迁移的反应。迁移可以是基团、 原子。所以可以称基团或原子的迁移的反应为重排反应。 重排反应常在试剂作用下(酸、碱、金属离子)、加热或光照或其他
物理因素下发生。
第一节 缺电子重排
重排反应分为:缺电子重排、富电子重排和芳环重排。 缺电子重排反应:通过缺电子原子发生的重排反应为缺电子重排反应。
一、碳正离子的重排
碳原子重排分为:碳烯重排和碳正离子重排。
_ Nu : R C C L _ _L R
+
R C C Nu
C
C _ H+ R C C
_ Nu : R C C
(双分子还原)
例:
CH3 NO2 _ Zn, OH EtOH CH3 H3C H
+
H3C NH2
CH3 NH2
NHNH
二、Fries(傅瑞斯)重排
酚酯在lewis酸作用下,重排转化为酚酮的重排反应:
OCOR AlCl3 OH O C R + OH
(低温为主)
(高温为主)
O C
R
OH o C H3C COCH3 OH O H3C
例:
Cl C O C6H5
EtONa EtOH
C6H5 COOH
例:
Cl O
EtONa EtOH
COOEt
RONa ROH NaOH
COOR
COOH
机 理:
Cl
_ OR _
Cl O O
_ OR
O
OR _ O
化学反应中,一般碳的骨架不变。分子的碳架或官能团的位置发生改 变的反应称之为分子重排反应。重排反应在分子内进行,故称之为分 子重排反应。 重排反应为烃基或氢原子在分子内进行迁移的反应。迁移可以是基团、 原子。所以可以称基团或原子的迁移的反应为重排反应。 重排反应常在试剂作用下(酸、碱、金属离子)、加热或光照或其他
物理因素下发生。
第一节 缺电子重排
重排反应分为:缺电子重排、富电子重排和芳环重排。 缺电子重排反应:通过缺电子原子发生的重排反应为缺电子重排反应。
一、碳正离子的重排
碳原子重排分为:碳烯重排和碳正离子重排。
_ Nu : R C C L _ _L R
+
R C C Nu
C
C _ H+ R C C
_ Nu : R C C
(双分子还原)
例:
CH3 NO2 _ Zn, OH EtOH CH3 H3C H
+
H3C NH2
CH3 NH2
NHNH
二、Fries(傅瑞斯)重排
酚酯在lewis酸作用下,重排转化为酚酮的重排反应:
OCOR AlCl3 OH O C R + OH
(低温为主)
(高温为主)
O C
R
OH o C H3C COCH3 OH O H3C
例:
Cl C O C6H5
EtONa EtOH
C6H5 COOH
例:
Cl O
EtONa EtOH
COOEt
RONa ROH NaOH
COOR
COOH
机 理:
Cl
_ OR _
Cl O O
_ OR
O
OR _ O
第5章 重排反应

3. 羟基位于脂环上的邻二叔醇的重排
O
O H
O HO H+ O
HO
OH
O
OH HO OH
OH HO
191
第一节 从碳原子到碳原子的重排二 频纳醇重排(Pinacol)
4. Semipinacol重排 可以形成碳正离子的邻位取代醇也可以发生 Pinacol重排, 称为Semipinacol重排.
R R R C C R OH Y R R R C C R OH
Ph C Ph C O C6H4OCH3-p 28%
151
第一节 从碳原子到碳原子的重排二 频纳醇重排(Pinacol)
2. 三取代邻二叔醇的重排
酸性条件下, 叔羟基质子化离去.
Ph Ph CH C OH OH C6H4CH3-p HCl (g) Ph Ph CH C OH C6H4CH3-p H迁移 Ph C O Ph C H C6H4CH3-p
21
CH3 CH3 C CH2 NH2
CH3
HNO2 / H - N2
+
CH3 CH3 C CH2 CH3 C
CH3 CH2 H2O - H+ CH3
OH C CH2 CH3
CH3
亲核重排
CH3
CH3
CH3
PhCH2OCH3
PhLi
Ph
CH3 CH O
Ph
CH OLi
H3O+
CH3 Ph CH OH
CH3CH3 Ph C C Ph Ph H2SO4 Ph C C CH3
OH OH
CH3O 迁移基团电荷密度越高越有利于迁移
121
第一节 从碳原子到碳原子的重排二 频纳醇重排(Pinacol)
O
O H
O HO H+ O
HO
OH
O
OH HO OH
OH HO
191
第一节 从碳原子到碳原子的重排二 频纳醇重排(Pinacol)
4. Semipinacol重排 可以形成碳正离子的邻位取代醇也可以发生 Pinacol重排, 称为Semipinacol重排.
R R R C C R OH Y R R R C C R OH
Ph C Ph C O C6H4OCH3-p 28%
151
第一节 从碳原子到碳原子的重排二 频纳醇重排(Pinacol)
2. 三取代邻二叔醇的重排
酸性条件下, 叔羟基质子化离去.
Ph Ph CH C OH OH C6H4CH3-p HCl (g) Ph Ph CH C OH C6H4CH3-p H迁移 Ph C O Ph C H C6H4CH3-p
21
CH3 CH3 C CH2 NH2
CH3
HNO2 / H - N2
+
CH3 CH3 C CH2 CH3 C
CH3 CH2 H2O - H+ CH3
OH C CH2 CH3
CH3
亲核重排
CH3
CH3
CH3
PhCH2OCH3
PhLi
Ph
CH3 CH O
Ph
CH OLi
H3O+
CH3 Ph CH OH
CH3CH3 Ph C C Ph Ph H2SO4 Ph C C CH3
OH OH
CH3O 迁移基团电荷密度越高越有利于迁移
121
第一节 从碳原子到碳原子的重排二 频纳醇重排(Pinacol)
第五章 重排反应

CO NH2
CH3OBr -400C 68%
NHCOCH3
上有-OH、 C=C时 3 当 α -C上有-OH、-NH2、-X、C=C时,生 成醛。 成醛。
NaOBr H2 O -NH3
R CH CO NH2 X
R CH NH2 X
RCHO
RCH
CH CONH2
NaOBr
R CH
δ-
δ+ δ-
H2 O -NH3 R CH2 CHO
C6H17
O HN
H N
O O
CH3O
O HN
H N
O OCH3 O
O HN
H N
O O C O OCH3
O
O
H2O △
O HN
H N
OH COOH O
(阿脲酸) 阿脲酸)
四
Cl O H RO
Favorski重排 Favorski重排
Cl O SN2 O O RO OR
COOR
ROH
COOR
+ RO
酰脲 的酰胺在NaOH+H 中溶解度小,难于水解, >C8的酰胺在NaOH+H2O中溶解度小,难于水解, 而与未重排的酰胺反应,生成酰脲, 而与未重排的酰胺反应,生成酰脲,使伯胺 收率降低。 收率降低。
改用RONa+ROH(如 改用RONa+ROH(如MeONa+MeOH) RONa+ROH(
NaOBr / H2O C11H23 CO NH2 Br2 / CH3ONa / CH3OH C11H23 CO NHC NH C11H23 O C11H23 NHCOO CH3 △ H2 O C11H23 NH2
第五章-重排反应

12
二、 Pinacol重排
(邻二醇或邻二官能团合成醛酮的方法)
药 学 院 药 物 合 成 反 应
定义:在酸催化下,邻二叔醇失去一分子水, 重排成醛或酮的反应称Pinacol重排。
R1发生1,2-迁移
1
2
1
2
邻二醇
羰基类化合物
13
二、 Pinacol重排
反应机理:
(☆☆☆☆☆)
邻二醇
不对称的质子化酮
RCONH2 + NaOBr R N C O H2O RNH2
机理:
R C NH2 O OH Br2 R C NHBr O R N C O
R C N Br O
• 供电性R速度快于 吸电性R • 重排后R保留原来 手性
40
H2O/OH
RNH2 + CO3
2
36
15
二、 Pinacol重排 2、影响因素
i. 碳正离子稳定性的影响
ii. 立体化学因素的影响
iii.迁移基团迁移能力的影响
iv.反应条件的影响
16
i. 碳正离子稳定性的影响
关键:不对称连二醇类化合物重排的方向决定于羟基失去后,所 生成碳正离子的稳定性,通常与基团迁移能力的大小无关 。
不对称的邻二醇
OH COOH O
29
4)Favorski 卤化酮重排 法沃尔斯基重排
(☆☆☆)
定义: -卤代酮在亲核碱(NaOH, RONa等)条件下,发生重排,α-基团迁移到 卤素位置,得到羧酸盐、酯或酰胺的反应称为Favorski卤化酮重排反应。
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt α-卤代酮的反应 COOH
二、 Pinacol重排
(邻二醇或邻二官能团合成醛酮的方法)
药 学 院 药 物 合 成 反 应
定义:在酸催化下,邻二叔醇失去一分子水, 重排成醛或酮的反应称Pinacol重排。
R1发生1,2-迁移
1
2
1
2
邻二醇
羰基类化合物
13
二、 Pinacol重排
反应机理:
(☆☆☆☆☆)
邻二醇
不对称的质子化酮
RCONH2 + NaOBr R N C O H2O RNH2
机理:
R C NH2 O OH Br2 R C NHBr O R N C O
R C N Br O
• 供电性R速度快于 吸电性R • 重排后R保留原来 手性
40
H2O/OH
RNH2 + CO3
2
36
15
二、 Pinacol重排 2、影响因素
i. 碳正离子稳定性的影响
ii. 立体化学因素的影响
iii.迁移基团迁移能力的影响
iv.反应条件的影响
16
i. 碳正离子稳定性的影响
关键:不对称连二醇类化合物重排的方向决定于羟基失去后,所 生成碳正离子的稳定性,通常与基团迁移能力的大小无关 。
不对称的邻二醇
OH COOH O
29
4)Favorski 卤化酮重排 法沃尔斯基重排
(☆☆☆)
定义: -卤代酮在亲核碱(NaOH, RONa等)条件下,发生重排,α-基团迁移到 卤素位置,得到羧酸盐、酯或酰胺的反应称为Favorski卤化酮重排反应。
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt α-卤代酮的反应 COOH
《药物合成反应》第五章重排反应课件

02
重排反应的类型与
机理
类型介绍
基团迁移重排
基团从分子中的某一位置迁移 到另一位置,如烃基、芳基、
酰基等。
碳碳重排
碳原子之间的位置互子之间的位置互 换,如酯的水解反应。
碳氮重排
碳原子与氮原子之间的位置互 换,如曼尼希反应。
机理解析
01
02
03
课程特色
通过实例解析和实验操作,加深学生对重排反应的理 解和掌握。
重排反应的定义与重要性
重排反应
指在化学反应中,分子或离子的结构发生改变,导致元素间的相对位置和化学 键发生变化的一类反应。
重要性
重排反应在药物合成中具有重要意义,许多药物分子中的关键结构都涉及到重 排反应。了解和掌握重排反应的原理和实验操作,对于药物合成和开发具有重 要意义。
重排反应的挑战与
展望
重排反应的挑战
反应条件的控制
重排反应通常需要特定的反应条 件,如温度、压力、催化剂等, 控制这些条件是重排反应的关键 挑战之一。
选择性控制
重排反应往往伴随着多种副反应, 提高反应的选择性是实现高效合 成的重要挑战。
适用范围局限
某些重排反应只适用于特定类型 的底物,扩大重排反应的适用范 围对于实际应用至关重要。
电子转移
重排过程中,电子从供体 转移到受体,导致键的断 裂和形成。
键的断裂与形成
重排过程中,某些键断裂 并形成新的键,导致原子 或基团的位置发生变化。
过渡态
重排过程中,原子或基团 通过一个过渡态迅速达到 新的稳定状态。
实例分析
霍夫曼重排
在胺的羧酸盐和醇中加热时,可得到 重排后生成的酰胺。
贝克重排
在酚酯中加热时,可得到重排后生成 的酚的羟基被对位取代的酯。
第五章 重排反应

H2O
H R N
O OH RNH2
酰基叠氮可由叠氮化钠与酰化剂反应得到,酰肼与亚 硝酸反应也可形成酰基叠氮。加热重排不需太高温度,大 约100℃左右即可进行。
当羧酸与叠氮酸反应时,经叠氮酸加成反应,生成产物 也可失去一分子氮引起向缺电子氮原子的重排反应,结果 生成胺盐,这个反应是在酸性条件下进行的,称为Schmidt 反应。
.CCl3 1.00 >19
:CBr2 1.00 0.4
Br2 1.00 0.6
3-甲基1-丁烯 0.17
3.2
1.9
13.5
一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三 烯卡宾,在这些分子中,空的P轨道参与共轭体系,不显示 明显的缺电子特征,实际上是环丙烯正离子和卓鎓离子的 共轭碱。
+
+
二、卡宾的制备 1、重氮化合物分解制备卡宾 低分子量的重氮甲烷具有毒性、不稳定,在实验室中, 重氮甲烷的制备是由苯磺酰甲胺或苯二甲酰甲胺亚硝化后 再用碱反应制备的。
R hv R O Ar hv CN OMe hv Ar
R R Ar Ar
R R Ar CN OMe Ar
R R Ar Ar Ar MeO
O +
R R
C:
O+
-
O +
Ar NC Ar Ar
C:
O
Ar Ar
O+
-
O +
C:
4、多卤化物的2-消除形成卡宾 无β-氢原子的卤化物在用强碱处理时,进行α-消除卤化 氢形成卡宾,其他的如有机汞化物也可以进行α-消除反应形 成卡宾。
HNO2
O R R O
CH2N2+
第五章 重排反应

的顺序为芳基>烷基(3。>2 。 >1 。)>氢。
CH3 CH2OH H CH3 CH2OH2 H2O CH3 CH2 H CH3 H CH3
CH3
CH2 -N2
CH2NH2 CH3
NaNO2 HCl CH CH2
CH3 CH2 CH2 N CH3 CH CH3
N
H
(2) wagner—Meerwein重排(原菠烷重排)
5.1.6 羧酸与叠氮酸作用(Schmidt反应)
在硫酸存在下,羧酸与叠氮酸反应生成胺
RCOOH + HN3 H2SO4 RNH2 + CO2 + N2
CH3CH2NH2 85% Cl
NH2 H 61%
CH2CH2COOH NaN3 + H2SO4/C6H5 Cl
COOH H
50 ℃
NaN3 + H2SO4/CHCl3 40℃
RCOCl RCONHNH 2 NaN3 HNO 2 RCON3 RNCO C2H 5OH RNHCO2C2H 5 H 2O RNH 2 H2O RNH2
机理:
O RCOCl + NaN3 R C N3
-N2
O R C N RN C O
H2O
RNH2
Hofmann重排类似Curtius重排,适用于多数
O RCHO + CH2N 2
O + CH3CHN2 (C2H5)O
R H
CH 2
H+
O RCOCH3 + R
O CH3 92%
由阿拉伯糖四乙酸酯以62%产率生成1-脱氧果糖 四乙酸酯。
CHO (CHOCOCH3)3 + CH2N2 CHOCOCH3 H 3C O (CHOCOCH3)3 CHOCOCH3
CH3 CH2OH H CH3 CH2OH2 H2O CH3 CH2 H CH3 H CH3
CH3
CH2 -N2
CH2NH2 CH3
NaNO2 HCl CH CH2
CH3 CH2 CH2 N CH3 CH CH3
N
H
(2) wagner—Meerwein重排(原菠烷重排)
5.1.6 羧酸与叠氮酸作用(Schmidt反应)
在硫酸存在下,羧酸与叠氮酸反应生成胺
RCOOH + HN3 H2SO4 RNH2 + CO2 + N2
CH3CH2NH2 85% Cl
NH2 H 61%
CH2CH2COOH NaN3 + H2SO4/C6H5 Cl
COOH H
50 ℃
NaN3 + H2SO4/CHCl3 40℃
RCOCl RCONHNH 2 NaN3 HNO 2 RCON3 RNCO C2H 5OH RNHCO2C2H 5 H 2O RNH 2 H2O RNH2
机理:
O RCOCl + NaN3 R C N3
-N2
O R C N RN C O
H2O
RNH2
Hofmann重排类似Curtius重排,适用于多数
O RCHO + CH2N 2
O + CH3CHN2 (C2H5)O
R H
CH 2
H+
O RCOCH3 + R
O CH3 92%
由阿拉伯糖四乙酸酯以62%产率生成1-脱氧果糖 四乙酸酯。
CHO (CHOCOCH3)3 + CH2N2 CHOCOCH3 H 3C O (CHOCOCH3)3 CHOCOCH3
第五章 重排反应(Rearrangement reaction)
CH3
+
C CH2
CH3
C CH2 CH3
1,2-烷基迁移
CH3
+
C CH2 CH3 CH3
CH3
H+
CH3 C CH CH3
CH3
转变成更稳定的正离子是重排的一个动力,另外,转变成中 性化合物也是重排的一种动力,有时为促进重排,常在离去基或
其β-位上引入活性基团。如庚醇(heptanol)在三苯基膦的作用
原子或基团发生迁移。如下列化合物在酸催化下重排,得氢迁
移产物醛或酮。
H Ph Ph C C
OH OH
CH3(CH2)4 O
HCl(g) CH3 25 。C ,3h
CH3 CH2CCH2OH O OH
TsOH/C6H6
Ph Ph C C
OH
CH3(CH2)4 O
CH3
CH3 CH2CHCHO O
(90%) (80%)
5
下,经重排、水解得双环[2.2.1]庚醇:
OH NHTs Ph3P/DEAD
OPPh3
NHTs Ph3P=O
+
NHTs H
Ar O ArCO2
O
NHTs
(80%)
除此之外,碳正离子也可通过其他方式形成,如烯烃的卤加成, 氨基的重氮化等形式。
Br2 50。C Br
+ Br Br
+
Br Br
6
苯基迁移
HO
OH
HO
O
在脂环系统中,若两个羟基均处于同一脂环上,且呈顺式,
此时,离去基团(⊕OH2)与迁移基团互成反式,经重排得相 应的酮;若两个羟基呈反式,发生σ键迁移,得缩环产物。
颜范勇-第五章重排反应全

+C H O H 3
C H H 3 C C C 3 O C H 3
III 重排反应的动力是:由三级C+生成更加稳定的质子化的酮
• (2)、温度 : 低温下用酸处理时,重排反应优先于单纯 的脱水反应; 较高温度和强酸条件下,可以发生脱水反 应,生成二烯烃。这是Pinacol重排反应的 主要副反应。
3.反应物结构的影响
_ _
C H 3 C C H 3 O
=
=
4)Semipinacol重排 :
• 邻二叔醇重排重排过程中先消除一个羟基,生成 了β-位碳正离子的中间体,再发生迁移重排。因 此,凡能生成相同中间体的其他类型反应物,均 可进行类似的Pinacol重排,得到酮类化合物。这 类重排称Semipinacol重排。
• 迁移基团:通常是芳基的迁移能力大于烷基, 氢的迁移能力不确定,有时比芳烃还要大, 有时却比烷基要小
①
对称的邻二叔醇重排
R2 R1 C R2 C R1
OH OH
• 生成相同的碳正离子,得单一产物。主要 取决于R1和R2的迁移能力,电子云密度大 的基团优先转移。
• 基团迁移的优先次序: • ⑴、如迁移基团是烷基则:3o > 2o > 1o • ⑵、芳基>烃基
的一个 σ-键沿π体系经环状过渡态迁移到另一端 生成一个新σ-键,伴随π键的转移。(了解)
H H H
第一节
从碳原子到碳原子的重排
Wagner-Meerwein重排
Pinacol重排
苯偶酰-二苯乙醇酸型重排 Favorski重排 Wolff重排
一. Wagner-Meerwein重排
• 定义:终点碳原子上羟基、卤原子或重 氮基等,在质子酸或Lewis酸催化下离 去形成碳正离子,其邻近的烷基、芳基 或氢作1,2-迁移至该碳原子,同时形成 更稳定的起点碳正离子,后经亲核取代 或质子消除而生成新化合物的反应。
C H H 3 C C C 3 O C H 3
III 重排反应的动力是:由三级C+生成更加稳定的质子化的酮
• (2)、温度 : 低温下用酸处理时,重排反应优先于单纯 的脱水反应; 较高温度和强酸条件下,可以发生脱水反 应,生成二烯烃。这是Pinacol重排反应的 主要副反应。
3.反应物结构的影响
_ _
C H 3 C C H 3 O
=
=
4)Semipinacol重排 :
• 邻二叔醇重排重排过程中先消除一个羟基,生成 了β-位碳正离子的中间体,再发生迁移重排。因 此,凡能生成相同中间体的其他类型反应物,均 可进行类似的Pinacol重排,得到酮类化合物。这 类重排称Semipinacol重排。
• 迁移基团:通常是芳基的迁移能力大于烷基, 氢的迁移能力不确定,有时比芳烃还要大, 有时却比烷基要小
①
对称的邻二叔醇重排
R2 R1 C R2 C R1
OH OH
• 生成相同的碳正离子,得单一产物。主要 取决于R1和R2的迁移能力,电子云密度大 的基团优先转移。
• 基团迁移的优先次序: • ⑴、如迁移基团是烷基则:3o > 2o > 1o • ⑵、芳基>烃基
的一个 σ-键沿π体系经环状过渡态迁移到另一端 生成一个新σ-键,伴随π键的转移。(了解)
H H H
第一节
从碳原子到碳原子的重排
Wagner-Meerwein重排
Pinacol重排
苯偶酰-二苯乙醇酸型重排 Favorski重排 Wolff重排
一. Wagner-Meerwein重排
• 定义:终点碳原子上羟基、卤原子或重 氮基等,在质子酸或Lewis酸催化下离 去形成碳正离子,其邻近的烷基、芳基 或氢作1,2-迁移至该碳原子,同时形成 更稳定的起点碳正离子,后经亲核取代 或质子消除而生成新化合物的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-卤代酮在亲核碱(NaOH,RONa等)存在的条件下,发生
重排得到羧酸盐、酯或酰胺的反应称为Favorski卤代酮重
排反应。
PhCH2 C CH2Cl O
NaOH
PhCH2CH2COO
Organic Reactions for Drug Synthesis
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt
Organic Reactions for Drug Synthesis
R1 R4 R2 C R3 C R5 OH
H+(-H2O)
R1 R 4 R2 C R3 C R5
重排
R1 R2
R4 C C R5 R3
H2O(-H ) R1
R2
+
OH C
R4 C R5 R3
Organic Reactions for Drug Synthesis
N
OH H2SO4 140℃
95%
NH O
Organic Reactions for Drug Synthesis
H3C C N
OH LiAlH4 AlCl3 THF
NHCH2CH3
OH LiAlH AlCl 4 3 C N PhCH2NHPh Et2O Ph Ph
Organic Reactions for Drug Synthesis
Ph OH
例子参考p241
Organic Reactions for Drug Synthesis
三、二苯基乙二酮 ——二苯乙醇酸型重排
二苯基乙二酮(苯偶酰)类化合物用碱处理,生成二苯基 -羟基酸(二苯乙醇酸)的反应称为苯偶酰-二苯乙醇酸型重 排反应。
C6H5 C C C6H5 O O C6H5 OH C COO C6H5
Curtius重排
Schmidt羰基化合物的降解反应
Baeyer-Villiger氧化重排
Organic Reactions for Drug Synthesis
一、Beckmann重排
醛肟或酮肟类化合物在酸性催化剂的作用下, 重排成取代酰胺的反应称为Beckmann重排。
R R'
C N
OH
H
O R C NHR'
(1)催化剂:质子酸 H+ ,H2SO4 , HCl, H3PO4 非质子酸PCl5, SOCl2, TsCl, AlCl3
OH C N R R C OPCl4 N 离去基团
PCl5 +
R R'
用质子酸(极性溶剂中)催化时存在异构化问题
R C R' N OH H R R' C N OH
R和 R'相差不大时,会发生异构化 但R=CH3, R'=Ph不会发生异构化
Organic Reactions for Drug Synthesis
(2)肟的结构 迁移基团在迁移过程中构型保留
CH3 Ph C H
CH3 C NOH
H
* CH3 C NHCH CH3 Ph 构型保持率99.6%
O
脂环酮肟发生扩环反应生成内酰胺
O CH3 H2NOH HO N CH3 H O NH CH3
二、Hofmann酰胺重排为胺类
酰胺用溴(或氯)和碱处理转变为少一个 碳原子的伯胺的反应称为Hofmann酰胺重排 为胺类反应或称为Hofmann降解反应。
RCONH2 + Br2 + 4 OH
2 RNH2 + CO3
Organic Reactions for Drug Synthesis
+ 2 Br + 2 H2O
分类:
离子型机理(亲核重排,亲电重排)
自由基重排 周环机理重排(σ-键迁移重排)
Organic Reactions for Drug Synthesis
从碳原子到碳原子的重排
从碳原子到杂原子的重排 从杂原子到碳原子的重排 -键迁移重排
Organic Reactions for Drug Synthesis
Ar' Ar C C Ar' O O Ar C C OH OHO + Ar HO C C Ar' O OH
迁移能力:吸电子基取代的芳环> 供电子基取代的芳环
Organic Reactions for Drug Synthesis
O OH O ref.
O KOH
COOH OH
O
HO HOOC
Organic Reactions for Drug Synthesis
CH3 C CH3
Organic Reactions for Drug Synthesis
3.三取代的连二乙醇
在三取代邻二叔醇结构,一个是叔羟基,另一个为仲羟基
R2 H R1 C C R3
OH OH
Ph H Ph C C Ph H
+
H Ph C C Ph
H
Ph Ph CH C O Ph (B)
OH OH
6%
Organic Reactions for Drug Synthesis
2.不对称的连二乙醇
R1 R1 C
重排的方向决定于羟基失去的难易
R2 C R2
OH OH
羟基离去后碳正离子的稳定性: 叔碳>仲碳>伯碳
Organic Reactions for Drug Synthesis
P CH3OC 6H5 Ph H2SO4 P CH3OC 6H5 C C Ph OH OH P CH3OC 6H5 P CH3OC6H5 C Ph + P CH3OC 6H5 C O
(EtO-)
O
R
H C C O
H C R
'
EtONa
H H R C C R a C b O OEt
'
a) R
H C
H C
R'
b) R
H C
H C
R'
COOEt H R H2 C H C R' COOEt
EtOOC H R H C H2 C R'
COOEt
Organic Reactions for Drug Synthesis
79%
C8H17 KOH/C3H7OH.H2O C8H17 O HO HOOC O HN H N
O
甾体缩环 92~100%
O 1)CH3O /CH3OH O O 2) H2O HN H N OH COOH O
O Organic Reactions for Drug Synthesis
97%
四、Favorski卤代酮重排
Cl O
Cl RO O OR O O
COOR
ROH
+ RO COOR
Organic Reactions for Drug Synthesis
Cl
O CH3 C EtONa
O
O EtO EtONa
COOEt CH2
主
CH2COOEt C 所连接的取代基越少越稳定
Organic Reactions for Drug Synthesis
Organic Reactions for Drug Synthesis
机理 R OH H C N R' OH2 R C N
R' R C N R' OH
Organic Reactions for Drug Synthesis
OH2 R C N R' 反式迁移 R C N R' O R C NHR' H2O
第五章 重排反应
Rearrangement Reaction
Organic Reactions for Drug Synthesis
定义:受试剂或介质的影响,同一有机分子内的一个基团或原子从一个
原子迁移到另一个原子上,使分子构架发生改变而形成一个新的分子
的反应称为重排反应。
W A B A
W B
A:重排起点原子,B:重排终点原子,W:重排基团
用以制备各类伯胺。
Organic Reactions for Drug Synthesis
(C2H5)2NCH2CH2CONH2
NaOCl/H2O
(C2H5)2NCH2CH2NH2
CONH2 NaOBr/H2O N NH2 N 65~71%
Organic Reactions for Drug Synthesis
五、Wolff重排
重氮酮在银、银盐或铜存在条件下,或用光照射或热分
解都消除氮分子而重排为烯酮,生成的烯酮进一步与羟基 或胺类化合物作用得到酯类、酰胺或羧酸的反应称为 Wolff重排反应。
R C C R O N N R R
Organic Reactions for Drug Synthesis
R C C R O R'OH R R O CH C OR'
C C O
Br(CH2)9 C CHN2 O
NH3.H2O/AgNO3 Br(CH2)9CH2CONH2 49%
O N2
h CH3OH
H
H3COOC
Organic Reactions for Drug Synthesis
75%
第二节 从碳原子到杂原子的重排
Beckmann重排
Hofmann酰胺重排为胺类
CH3 R C COOH
R R
α-卤 代 酮 的 反 应
CH3 NaNH2 R R C CH3 O CNH2
α-基团迁移到卤素位置
Organic Reactions for Drug Synthesis
重排得到羧酸盐、酯或酰胺的反应称为Favorski卤代酮重
排反应。
PhCH2 C CH2Cl O
NaOH
PhCH2CH2COO
Organic Reactions for Drug Synthesis
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt
Organic Reactions for Drug Synthesis
R1 R4 R2 C R3 C R5 OH
H+(-H2O)
R1 R 4 R2 C R3 C R5
重排
R1 R2
R4 C C R5 R3
H2O(-H ) R1
R2
+
OH C
R4 C R5 R3
Organic Reactions for Drug Synthesis
N
OH H2SO4 140℃
95%
NH O
Organic Reactions for Drug Synthesis
H3C C N
OH LiAlH4 AlCl3 THF
NHCH2CH3
OH LiAlH AlCl 4 3 C N PhCH2NHPh Et2O Ph Ph
Organic Reactions for Drug Synthesis
Ph OH
例子参考p241
Organic Reactions for Drug Synthesis
三、二苯基乙二酮 ——二苯乙醇酸型重排
二苯基乙二酮(苯偶酰)类化合物用碱处理,生成二苯基 -羟基酸(二苯乙醇酸)的反应称为苯偶酰-二苯乙醇酸型重 排反应。
C6H5 C C C6H5 O O C6H5 OH C COO C6H5
Curtius重排
Schmidt羰基化合物的降解反应
Baeyer-Villiger氧化重排
Organic Reactions for Drug Synthesis
一、Beckmann重排
醛肟或酮肟类化合物在酸性催化剂的作用下, 重排成取代酰胺的反应称为Beckmann重排。
R R'
C N
OH
H
O R C NHR'
(1)催化剂:质子酸 H+ ,H2SO4 , HCl, H3PO4 非质子酸PCl5, SOCl2, TsCl, AlCl3
OH C N R R C OPCl4 N 离去基团
PCl5 +
R R'
用质子酸(极性溶剂中)催化时存在异构化问题
R C R' N OH H R R' C N OH
R和 R'相差不大时,会发生异构化 但R=CH3, R'=Ph不会发生异构化
Organic Reactions for Drug Synthesis
(2)肟的结构 迁移基团在迁移过程中构型保留
CH3 Ph C H
CH3 C NOH
H
* CH3 C NHCH CH3 Ph 构型保持率99.6%
O
脂环酮肟发生扩环反应生成内酰胺
O CH3 H2NOH HO N CH3 H O NH CH3
二、Hofmann酰胺重排为胺类
酰胺用溴(或氯)和碱处理转变为少一个 碳原子的伯胺的反应称为Hofmann酰胺重排 为胺类反应或称为Hofmann降解反应。
RCONH2 + Br2 + 4 OH
2 RNH2 + CO3
Organic Reactions for Drug Synthesis
+ 2 Br + 2 H2O
分类:
离子型机理(亲核重排,亲电重排)
自由基重排 周环机理重排(σ-键迁移重排)
Organic Reactions for Drug Synthesis
从碳原子到碳原子的重排
从碳原子到杂原子的重排 从杂原子到碳原子的重排 -键迁移重排
Organic Reactions for Drug Synthesis
Ar' Ar C C Ar' O O Ar C C OH OHO + Ar HO C C Ar' O OH
迁移能力:吸电子基取代的芳环> 供电子基取代的芳环
Organic Reactions for Drug Synthesis
O OH O ref.
O KOH
COOH OH
O
HO HOOC
Organic Reactions for Drug Synthesis
CH3 C CH3
Organic Reactions for Drug Synthesis
3.三取代的连二乙醇
在三取代邻二叔醇结构,一个是叔羟基,另一个为仲羟基
R2 H R1 C C R3
OH OH
Ph H Ph C C Ph H
+
H Ph C C Ph
H
Ph Ph CH C O Ph (B)
OH OH
6%
Organic Reactions for Drug Synthesis
2.不对称的连二乙醇
R1 R1 C
重排的方向决定于羟基失去的难易
R2 C R2
OH OH
羟基离去后碳正离子的稳定性: 叔碳>仲碳>伯碳
Organic Reactions for Drug Synthesis
P CH3OC 6H5 Ph H2SO4 P CH3OC 6H5 C C Ph OH OH P CH3OC 6H5 P CH3OC6H5 C Ph + P CH3OC 6H5 C O
(EtO-)
O
R
H C C O
H C R
'
EtONa
H H R C C R a C b O OEt
'
a) R
H C
H C
R'
b) R
H C
H C
R'
COOEt H R H2 C H C R' COOEt
EtOOC H R H C H2 C R'
COOEt
Organic Reactions for Drug Synthesis
79%
C8H17 KOH/C3H7OH.H2O C8H17 O HO HOOC O HN H N
O
甾体缩环 92~100%
O 1)CH3O /CH3OH O O 2) H2O HN H N OH COOH O
O Organic Reactions for Drug Synthesis
97%
四、Favorski卤代酮重排
Cl O
Cl RO O OR O O
COOR
ROH
+ RO COOR
Organic Reactions for Drug Synthesis
Cl
O CH3 C EtONa
O
O EtO EtONa
COOEt CH2
主
CH2COOEt C 所连接的取代基越少越稳定
Organic Reactions for Drug Synthesis
Organic Reactions for Drug Synthesis
机理 R OH H C N R' OH2 R C N
R' R C N R' OH
Organic Reactions for Drug Synthesis
OH2 R C N R' 反式迁移 R C N R' O R C NHR' H2O
第五章 重排反应
Rearrangement Reaction
Organic Reactions for Drug Synthesis
定义:受试剂或介质的影响,同一有机分子内的一个基团或原子从一个
原子迁移到另一个原子上,使分子构架发生改变而形成一个新的分子
的反应称为重排反应。
W A B A
W B
A:重排起点原子,B:重排终点原子,W:重排基团
用以制备各类伯胺。
Organic Reactions for Drug Synthesis
(C2H5)2NCH2CH2CONH2
NaOCl/H2O
(C2H5)2NCH2CH2NH2
CONH2 NaOBr/H2O N NH2 N 65~71%
Organic Reactions for Drug Synthesis
五、Wolff重排
重氮酮在银、银盐或铜存在条件下,或用光照射或热分
解都消除氮分子而重排为烯酮,生成的烯酮进一步与羟基 或胺类化合物作用得到酯类、酰胺或羧酸的反应称为 Wolff重排反应。
R C C R O N N R R
Organic Reactions for Drug Synthesis
R C C R O R'OH R R O CH C OR'
C C O
Br(CH2)9 C CHN2 O
NH3.H2O/AgNO3 Br(CH2)9CH2CONH2 49%
O N2
h CH3OH
H
H3COOC
Organic Reactions for Drug Synthesis
75%
第二节 从碳原子到杂原子的重排
Beckmann重排
Hofmann酰胺重排为胺类
CH3 R C COOH
R R
α-卤 代 酮 的 反 应
CH3 NaNH2 R R C CH3 O CNH2
α-基团迁移到卤素位置
Organic Reactions for Drug Synthesis
