物理化学经典例题 03
物理化学经典习题及答案资料

7.从热力学基本关系式可导出: A
U U ( A) p T ( B) S V V S
H (C ) p V S
A ( D) T S V
8.根据熵的统计意义可以判断下列过程中何者的熵 值减小? C (A)液态水可逆相变为水蒸气 (B) 碳酸钙分解生成氧化钙 (C) 乙烯聚合成聚乙烯 (D) 理想气体绝热可逆压缩
29. 对于反应2Ag+(m1) + H2(p) → 2Ag(s) + 2H+(m2), 以下原电池设计正确的是: D (A) Ag(s)| Ag+(m1) || H+(m2) | H2(p) (Pt) (B) Ag(s)-AgCl(s)| Ag+(m1) || H+(m2) | H2(p) (Pt) (C) (Pt) H2(p)| H+(m2)|| Ag+(m1) | AgCl(s)-Ag(s) (D) (Pt) H2(p)| H+(m2)|| Ag+(m1) | Ag(s)
18. 已知373K时液体A和液体B的饱和蒸气压为分别为 105 Pa和0.5×105 Pa。若A和B形成理想液态混合物, 则 ΔmixHm= ,ΔmixVm= ,当A在溶液中的摩尔分 数为0.5时,在气相中A的摩尔分数为 。 D (A) 0, 0, 1/3 (C) <0, < 0, 1/3 (B) 0, >0, 2/3 (D) 0, 0, 2/3
(D) (U/nB)S,p, n
CB
A 15. 下列四个偏微商中哪个是化学势? (A) (U/nB)S,V, n (B) (H/nB) S,V, n
CB
CB
(C) (A/nB)T,p, n
第五版物理化学第三章习题答案-图文

第五版物理化学第三章习题答案-图文以下是为大家整理的第五版物理化学第三章习题答案-图文的相关范文,本文关键词为第五,物理化学,第三章,习题,答案,图文,第三章,热力学,第,您可以从右上方搜索框检索更多相关文章,如果您觉得有用,请继续关注我们并推荐给您的好友,您可以在综合文库中查看更多范文。
第三章热力学第二定律3.1卡诺热机在(1)热机效率;(2)当向环境作功。
解:卡诺热机的效率为时,系统从高温热源吸收的热及向低温热源放出的热的高温热源和的低温热源间工作。
求根据定义3.2卡诺热机在(1)热机效率;(2)当从高温热源吸热解:(1)由卡诺循环的热机效率得出时,系统对环境作的功的高温热源和的低温热源间工作,求:及向低温热源放出的热(2)3.3卡诺热机在(1)热机效率;(2)当向低温热源放热解:(1)时,系统从高温热源吸热及对环境所作的功。
的高温热源和的低温热源间工作,求1(2)3.4试说明:在高温热源和低温热源间工作的不可逆热机与卡诺机联合操作时,若令卡诺热机得到的功wr等于不可逆热机作出的功-w。
假设不可逆热机的热机效率大于卡诺热机效率证:(反证法)设ηir>ηr不可逆热机从高温热源吸热则,向低温热源放热,对环境作功,其结果必然是有热量从低温热源流向高温热源,而违反势热力学第二定律的克劳修斯说法。
逆向卡诺热机从环境得功则从低温热源吸热向高温热源放热若使逆向卡诺热机向高温热源放出的热不可逆热机从高温热源吸收的热相等,即总的结果是:得自单一低温热源的热,变成了环境作功,违背了热力学第二定律的开尔文说法,同样也就违背了克劳修斯说法。
23.5高温热源温度低温热源,求此过程。
,低温热源温度,今有120KJ的热直接从高温热源传给解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6不同的热机中作于情况下,当热机从高温热源吸热(1)可逆热机效率(2)不可逆热机效率(3)不可逆热机效率解:设热机向低温热源放热。
物理化学第三章 习题
返回
2013-7-28
物理化学复习课
(8)某一化学反应的热效应除以反应温度T,即得此反应 得rSm。 解:不正确。化学反应的热效应rHm=QpQr。而rSm= Qr/T。所以rSmrHm/T。如果该反应的(rGm)T,p=0,则该 式成立。平衡时可逆。 T2 (9)在恒压下用酒精灯 S C p dT / T 加热某物质,该物质的熵变 T1 解:不正确。如该物质在加热过程中无相变化则该式成 立。否则不能成立。 (10)对于绝热系统,可用S0判断过程的方向和限度。
上一内容 下一内容 回主目录
A 九、证明题 试用热力学第二定律证明两条等温可逆线不会相交。 M
返回
2013-7-28
物理化学复习课
十、判断题 × 1、恒温过程的Q一定是零。 × 2、所有绝热过程的Q为零,sysS也必为零。 3、不可逆过程就是过程发生后,系统不能再复原的过 × 程 4、当热由系统传给环境时,系统的焓必减少。 5、一氧化碳的标准摩尔生成焓也是同温度下石墨的标 × 准摩尔燃烧焓。 6、实际气体绝热可逆过程的S一定为零,G不一定为 零。
)。
T , p ,nC
G D. n B
2、在298K.100kPa下将3mol O2(g),与4mol Ar(g)在一刚 性密闭容器内恒温混合,则此过程的( C ) A . W < 0 B. Δ U < 0 C. Δ S >0 D. Δ G > 0 3、 在一定温度范围内,某化学反应的⊿rHm与温度无关 ,那么该反应的⊿rSm随温度的升高而(C )。
解:不正确。若加上环境不对系统作功则设法成立。否则不能成立
上一内容 下一内容 回主目录
返回
物理化学经典例题 03

蒸发过程的熵变 n vap H m 10 4.06 104 J vap S 1088J K 1 T 373.15K 因系统从环境吸热, 并对环境作体积功, 故不是隔离系统, 熵 增大并不表示过程不可逆.
V2 1 (2) T S (压缩) nRln 5molRln 28.82J K 1 V1 2
(3)
S
mix
S T S(压缩) (28.82 28.82)J K 0
2mol O2 300K 1dm3 3mol N2 2mol O2 300K 1dm3
mix S T S(N2 ) T S(O2 ) (17.29 11.53) 28.82J K 1
2018/11/12 2
V2 T S (O2 ) nO2 Rln 2molRln2 11.53J K 1 V1
因 Q = 0, W = 0, 为隔离系统, mixS > 0, 故过程不可逆.
整个过程: U = 0, H = 0, Q = Q1 + Q2 + Q3 = Q3 = 491kJ, W =-Q =-491 kJ
p1 405.6 S nR ln 2 8.314ln · K 1 14.75J · K 1 J p4 167.1 2018/11/12
1
此过程实为: 3mol N2 300K 1dm3
不考虑其它气体的影响时, 每种气体的状态都可认为没有变 化, 故 p, U, H, S 等状态函数均不变.
物理化学题库及详解答案

物理化学题库及详解答案物理化学是一门结合物理学和化学的学科,它通过物理原理来解释化学现象,是化学领域中一个重要的分支。
以下是一些物理化学的题目以及相应的详解答案。
题目一:理想气体状态方程的应用题目内容:某理想气体在标准状态下的体积为22.4L,压力为1atm,求该气体在3atm压力下,体积变为多少?详解答案:根据理想气体状态方程 PV = nRT,其中P是压力,V是体积,n是摩尔数,R是理想气体常数,T是温度。
在标准状态下,P1 = 1atm,V1 = 22.4L,T1 = 273.15K。
假设气体摩尔数n和温度T不变,仅压力变化到P2 = 3atm。
将已知条件代入理想气体状态方程,得到:\[ P1V1 = nRT1 \]\[ P2V2 = nRT2 \]由于n和R是常数,且T1 = T2(温度不变),我们可以简化方程为:\[ \frac{P1}{P2} = \frac{V2}{V1} \]代入已知数值:\[ \frac{1}{3} = \frac{V2}{22.4} \]\[ V2 = \frac{1}{3} \times 22.4 = 7.46667L \]所以,在3atm的压力下,该气体的体积约为7.47L。
题目二:热力学第一定律的应用题目内容:1摩尔的单原子理想气体在等压过程中吸收了100J的热量,如果该过程的效率为40%,求该过程中气体对外做的功。
详解答案:热力学第一定律表明能量守恒,即ΔU = Q - W,其中ΔU是内能的变化,Q是吸收的热量,W是对外做的功。
对于单原子理想气体,内能仅与温度有关,且ΔU = nCvΔT,其中Cv 是摩尔定容热容,对于单原子理想气体,Cv = 3R/2(R是理想气体常数)。
由于效率η = W/Q,我们有:\[ W = ηQ \]\[ W = 0.4 \times 100J = 40J \]现在我们需要找到内能的变化。
由于过程是等压的,我们可以利用盖-吕萨克定律(Gay-Lussac's law)PV = nRT,由于n和R是常数,我们可以简化为PΔV = ΔT。
北京大学《物理化学》课后章节练习题第3章习题及答案

第三章 习题1. 在413.15K 时,纯C 6H 5Cl 和C 6H 5Br 的蒸气压分别为125.238kPa 和66.104kPa 。
假定两液体组成理想液体,若有一混合液,在413.15K 、101.325kPa 下沸腾,试求该溶液的组成,以及在此情况下,液面上蒸气的组成。
2. 液体A 与液体B 形成理想溶液。
在343.15K 时,1mol A 和2mol B 所成溶液的蒸气压为50.663kPa ,若在溶液中再加入3mol A ,则溶液的蒸气压增加到70.928kpa ,试求:(1)和。
*A p *B p (2)对第一种溶液,气相中A 、B 的摩尔分数各位若干?3. 若气体的状态方程为m (1)pV p RT β−=,求其逸度的表示式。
4. 液体A 和B 形成理想溶液。
现有一含有A 的物质的量分数为0.4的蒸气相,放在一个带活塞的气缸内,恒温下将蒸气慢慢压缩。
已知和分别为*A p *B p 0.4p θ×和1.2p θ×,计算:(a) 当液体开始凝聚出来时的蒸气总压。
(b) 该溶液在正常沸点b T 时的组成。
5. 在288.2K 、p θ时,某酒窖中存有10.0 m 3的酒,其中含乙醇96%(质量分数)。
今欲加水调制为含乙醇56%的酒,问(1)应加多少体积的水?(2)能得到多少立方米的含醇56%的酒已知该条件下水的密度999.1 kg.m -3,水和乙醇的偏摩尔体积分别为 乙醇的质量分数V H2O,m / (10-6 m 3.mol -1)V 乙醇,m / (10-6 m 3.mol -1)96%14.61 58.01 56%17.11 56.586. K 2SO 4在水溶液中的偏摩尔体积V 2,m 在298K 为V 2,m /m 3=3.228×10-5+1.821×10-5m 1/2/(mol·kg -1)1/2+2.2×10-8 m /(mol·kg -1)。
物理化学第三章习题答案

第三章热力学第二定律3.1 卡诺热机在的高温热源和的低温热源间工作;求1 热机效率;2 当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热;解:卡诺热机的效率为根据定义3.2 卡诺热机在的高温热源和的低温热源间工作,求:1 热机效率;2 当从高温热源吸热时,系统对环境作的功及向低温热源放出的热解:1 由卡诺循环的热机效率得出23.3 卡诺热机在的高温热源和的低温热源间工作,求1热机效率;2当向低温热源放热时,系统从高温热源吸热及对环境所作的功;解: 123.4 试说明:在高温热源和低温热源间工作的不可逆热机与卡诺机联合操作时,若令卡诺热机得到的功r W 等于不可逆热机作出的功-W ;假设不可逆热机的热机效率大于卡诺热机效率,其结果必然是有热量从低温热源流向高温热源,而违反势热力学第二定律的克劳修斯说法;证: 反证法 设 r ir ηη>不可逆热机从高温热源吸热,向低温热源放热,对环境作功则逆向卡诺热机从环境得功从低温热源吸热向高温热源放热则若使逆向卡诺热机向高温热源放出的热不可逆热机从高温热源吸收的热相等,即总的结果是:得自单一低温热源的热,变成了环境作功,违背了热力学第二定律的开尔文说法,同样也就违背了克劳修斯说法;3.5 高温热源温度,低温热源温度,今有120KJ的热直接从高温热源传给低温热源,求此过程;解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6 不同的热机中作于的高温热源及的低温热源之间;求下列三种情况下,当热机从高温热源吸热时,两热源的总熵变;1 可逆热机效率;2 不可逆热机效率;3 不可逆热机效率;解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为;3.7 已知水的比定压热容;今有1 kg,10℃的水经下列三种不同过程加热成100 ℃的水,求过程的;1系统与100℃的热源接触;2系统先与55℃的热源接触至热平衡,再与100℃的热源接触;3系统先与40℃,70℃的热源接触至热平衡,再与100℃的热源接触;解:熵为状态函数,在三种情况下系统的熵变相同在过程中系统所得到的热为热源所放出的热,因此3.8 已知氮N2, g的摩尔定压热容与温度的函数关系为将始态为300 K,100 kPa下1 mol的N2g置于1000 K的热源中,求下列过程1经恒压过程;2经恒容过程达到平衡态时的;解:1在恒压的情况下2在恒容情况下,将氮N2, g看作理想气体将代替上面各式中的,即可求得所需各量3.9 始态为,的某双原子理想气体1 mol,经下列不同途径变化到,的末态;求各步骤及途径的;1 恒温可逆膨胀;2先恒容冷却至使压力降至100 kPa,再恒压加热至;3 先绝热可逆膨胀到使压力降至100 kPa,再恒压加热至;解:1对理想气体恒温可逆膨胀,△U= 0,因此2先计算恒容冷却至使压力降至100 kPa,系统的温度T:3同理,先绝热可逆膨胀到使压力降至100 kPa时系统的温度T:根据理想气体绝热过程状态方程,各热力学量计算如下3.10 1mol理想气体在T=300K下,从始态100KPa 到下列各过程,求及;1 可逆膨胀到压力50Kpa;2 反抗恒定外压50Kpa,不可逆膨胀至平衡态;3 向真空自由膨胀至原体积的2倍3.11 某双原子理想气体从始态,经不同过程变化到下述状态,求各过程的解:1 过程1为PVT变化过程232.12 2 mol双原子理想气体从始态300 K,50 dm3,先恒容加热至400 K,再恒压加热至体积增大到100 dm3,求整个过程的;解:过程图示如下先求出末态的温度因此,3.13 4mol单原子理想气体从始态750K,150KPa,先恒容冷却使压力降至50KPa,再恒温可逆压缩至100KPa,求整个过程的解:ab3.14 3mol双原子理想气体从始态,先恒温可逆压缩使体积缩小至,再恒压加热至,求整个过程的及;解:ab3.15 5 mol单原子理想气体,从始态300 K,50 kPa先绝热可逆压缩至100 kPa,再恒压冷却至体积为85dm3的末态;求整个过程的Q,W,△U,△H及△S;3.16 始态300K,1MPa的单原子理想气体2mol,反抗0.2MPa的恒定外压绝热不可逆膨胀至平衡态;求过程的解:3.17 组成为的单原子气体A与双原子气体B的理想气体混合物共10 mol,从始态,绝热可逆压缩至的平衡态;求过程的;解:过程图示如下混合理想气体的绝热可逆状态方程推导如下容易得到3.18 单原子气体A与双原子气体B的理想气体混合物共8 mol,组成为,始态;今绝热反抗恒定外压不可逆膨胀至末态体积的平衡态;求过程的;解:过程图示如下先确定末态温度,绝热过程,因此3.19 常压下将100 g,27℃的水与200 g,72℃的水在绝热容器中混合,求最终水温t及过程的熵变;已知水的比定压热容;解:3.20 将温度均为300K,压力均为100KPa的100的的恒温恒压混合;求过程,假设和均可认为是理想气体;解:3.21 绝热恒容容器中有一绝热耐压隔板,隔板一侧为2mol的200K,的单原子理想气体A,另一侧为3mol的400K,100的双原子理想气体B;今将容器中的绝热隔板撤去,气体A与气体B混合达到平衡态,求过程的;解:A Bn=2mol n=3moln=2+3molT=200K T=400K T=V=V=V=∵绝热恒容 混合过程,Q = 0, W = 0 ∴△U = 00=40025×320023×20=4002002222)-)+-)-)+-T R T R T C n T C n B m ,V B A m ,V A ((((T 2 = 342.86K注:对理想气体,一种组分的存在不影响另外组分;即A 和B 的末态体积均为容器的体积;3.22 绝热恒容容器中有一绝热耐压隔板,隔板两侧均为N 2g;一侧容积50 dm 3,内有200 K 的N 2g 2 mol ;另一侧容积为75 dm 3, 内有500 K 的N 2g 4 mol ;N 2g 可认为理想气体;今将容器中的绝热隔板撤去,使系统达到平衡态;求过程的;解:过程图示如下同上题,末态温度T 确定如下经过第一步变化,两部分的体积和为即,除了隔板外,状态2与末态相同,因此注意21与22题的比较;3.23 甲醇在101.325KPa下的沸点正常沸点为,在此条件下的摩尔蒸发焓,求在上述温度、压力条件下,1Kg液态甲醇全部成为甲醇蒸汽时;解:3.24 常压下冰的熔点为0℃,比熔化焓,水的比定压热熔;在一绝热容器中有1 kg,25℃的水,现向容器中加入0.5 kg,0℃的冰,这是系统的始态;求系统达到平衡后,过程的;解:过程图示如下将过程看作恒压绝热过程;由于1 kg,25℃的水降温至0℃为只能导致克冰融化,因此3.25 常压下冰的熔点是,比熔化焓,水的比定压热熔,系统的始态为一绝热容器中1kg,的水及0.5kg 的冰,求系统达到平衡态后,过程的熵; 解:3.27 已知常压下冰的熔点为0℃,摩尔熔化焓,苯的熔点为5.5 1℃,摩尔熔化焓;液态水和固态苯的摩尔定压热容分别为及;今有两个用绝热层包围的容器,一容器中为0℃的8 mol H2Os与2 mol H2Ol成平衡,另一容器中为5.510℃的5 mol C6H6l与5 mol C6H6s成平衡;现将两容器接触,去掉两容器间的绝热层,使两容器达到新的平衡态;求过程的;解:粗略估算表明,5 mol C6H6l 完全凝固将使8 mol H2Os完全熔化,因此,过程图示如下总的过程为恒压绝热过程, ,3.28 将装有0.1 mol乙醚C2H52Ol的小玻璃瓶放入容积为10 dm3的恒容密闭的真空容器中,并在35.51℃的恒温槽中恒温;35.51℃为在101.325 kPa下乙醚的沸点;已知在此条件下乙醚的摩尔蒸发焓;今将小玻璃瓶打破,乙醚蒸发至平衡态;求1乙醚蒸气的压力;2过程的;解:将乙醚蒸气看作理想气体,由于恒温各状态函数的变化计算如下△H=△H1+△H2△S=△S1+△S2忽略液态乙醚的体积3.30.容积为20 dm3的密闭容器中共有2 mol H2O成气液平衡;已知80℃,100℃下水的饱和蒸气压分别为及,25 ℃水的摩尔蒸发焓;水和水蒸气在25 ~ 100 ℃间的平均定压摩尔热容分别为和;今将系统从80℃的平衡态恒容加热到100℃;求过程的;解:先估算100 ℃时,系统中是否存在液态水;设终态只存在水蒸气,其物质量为n, 则显然,只有一部分水蒸发,末态仍为气液平衡;因此有以下过程:设立如下途径第一步和第四步为可逆相变,第二步为液态水的恒温变压,第三步为液态水的恒压变温;先求80℃和100℃时水的摩尔蒸发热:3.31. O2g的摩尔定压热容与温度的函数关系为已知25 ℃下O2g的标准摩尔熵;求O2g 在100℃,50 kPa下的摩尔规定熵值;解:由公式3.32. 若参加化学反应的各物质的摩尔定压热容可表示为试推导化学反应的标准摩尔反应熵与温度T的函数关系式,并说明积分常数如何确定;解:对于标准摩尔反应熵,有式中3.33. 已知25℃时液态水的标准摩尔生成吉布斯函,水在25℃时的饱和蒸气压;求25℃时水蒸气的标准摩尔生成吉布斯函数; 解:恒温下3.34. 100℃的恒温槽中有一带有活塞的导热圆筒,筒中为2 mol N2g及装与小玻璃瓶中的3 mol H2Ol;环境的压力即系统的压力维持120 kPa不变;今将小玻璃瓶打碎,液态水蒸发至平衡态;求过程的;已知:水在100℃时的饱和蒸气压为,在此条件下水的摩尔蒸发焓;3.35. 已知100℃水的饱和蒸气压为101.325 kPa,此条件下水的摩尔蒸发焓;在置于100℃恒温槽中的容积为100 dm3的密闭容器中,有压力120 kPa的过饱和蒸气;此状态为亚稳态;今过饱和蒸气失稳,部分凝结成液态水达到热力学稳定的平衡态;求过程的;解:凝结蒸气的物质量为热力学各量计算如下3.36 已知在101.325 kPa下,水的沸点为100℃,其比蒸发焓;已知液态水和水蒸气在100~120℃范围内的平均比定压热容分别为:及;今有101.325 kPa下120℃的1 kg过热水变成同样温度、压力下的水蒸气;设计可逆途径,并按可逆途径分别求过程的及;解:设计可逆途径如下3.37 已知在100 kPa下水的凝固点为0℃,在-5 ℃,过冷水的比凝固焓,过冷水和冰的饱和蒸气压分别为,;今在100 kPa下,有-5℃ 1 kg的过冷水变为同样温度、压力下的冰,设计可逆途径,分别按可逆途径计算过程的及;解:设计可逆途径如下第二步、第四步为可逆相变,,第一步、第五步为凝聚相的恒温变压过程,,因此3.38 已知在-5℃,水和冰的密度分别为和;在-5℃,水和冰的相平衡压力为59.8 MPa;今有-℃C的1 kg水在100 kPa下凝固成同样温度下的冰,求过程的;假设,水和冰的密度不随压力改变;3.39 若在某温度范围内,一液体及其蒸气的摩尔定压热容均可表示成的形式,则液体的摩尔蒸发焓为其中,为积分常数; 试应用克劳修斯-克拉佩龙方程的微分式,推导出该温度范围内液体的饱和蒸气压p的对数ln p与热力学温度T 的函数关系式,积分常数为I;解:克—克方程为不定积分:3.40 化学反应如下:1利用附录中各物质的Sθm,△f Gθm数据,求上述反应在25℃时的△r Sθm,△r Gθm;2利用附录中各物质的△f Gθm数据,计算上述反应在25℃时的;325℃,若始态CH4g和H2g的分压均为150 kPa,末态COg和H2g的分压均为50 kPa,求反应的;解:3.41 已知化学反应中各物质的摩尔定压热容与温度间的函数关系为这个反应的标准摩尔反应熵与温度的关系为试用热力学基本方程推导出该反应的标准摩尔反应吉布斯函数与温度T的函数关系式;说明积分常数如何确定;解:根据方程热力学基本方程4.42 汞Hg在100 kPa下的熔点为-38.87℃,此时比融化焓;液态汞和固态汞的密度分别为和;求:1压力为10MPa下汞的熔点;2若要汞的熔点为-35℃,压力需增大之多少;解:根据Clapeyron方程,蒸气压与熔点间的关系为3.43 已知水在77℃时的饱和蒸气压为41.891 kPa;水在101.325 kPa下的正常沸点为100℃;求 1下面表示水的蒸气压与温度关系的方程式中的A和B值;2在此温度范围内水的摩尔蒸发焓;3在多大压力下水的沸点为105℃;解:1将两个点带入方程得2根据Clausius-Clapeyron方程33.44 水H2O和氯仿CHCl3在101.325 kPa下的正常沸点分别为100℃和61.5℃,摩尔蒸发焓分别为和;求两液体具有相同饱和蒸气压时的温度;解:根据Clausius-Clapeyron方程设它们具有相同蒸气压时的温度为T,则3.45 因同一温度下液体及其饱和蒸汽压的摩尔定压热容不同故液体的摩尔蒸发焓是温度的函数,试推导液体饱和蒸汽压与温度关系的克劳修斯——克拉佩龙方程的不定积分式;解:克—克方程不定积分得:3.46 求证:2 对理想气体证明:由H=fH,P可得对理想气体,3.50证明 1焦耳-汤姆逊系数2对理想气体证明:由H=fT,PdP PHdT T H dH T m p m m )()(∂∂+∂∂= m p Tm p m T m H C P HTH P H P T,)()()()(∂∂-=∂∂∂∂-=∂∂VdP TdS dH +=V PST P H T T +∂∂=∂∂∴)()(麦克斯韦关系式 P T T VP S )()(∂∂=∂∂- 代入上式V T TVP H P T +∂∂-=∂∂)()(T J mp m p mH C V T T V PT -=-∂∂-=∂∂μ,)()(2对于理想气体 p nRT V =pRT V m = p RT V p m =∂∂)(0,,=-=-=-mp m m m p mT J C V V C V T pRμ。
物理化学 答案 第三章_习题解答

Ο 在 298.15K 的 Δ r H m = −9.20kJ ⋅ mol −1 ,C2H5OH (1) 的标准摩尔燃烧焓为-1366.8kJ·mol 1, CH3COOH (1)
-
Ο 的为-874.54kJ·mol 1。试求 CH3COOC2H5(1)的标准摩尔生成焓 Δ f H m (298.15K) 。
-
解:根据题给数据,可设计下列过程:
Δr H m CH 2COOH (1) + C2 H 5OH (1) + 5O2 ( g ) ⎯⎯⎯ → CH 3COOC2 H 5 (1) + H 2O (1) + 5O2
Ο
Δ c H1
恒温 25℃ 4CO2(g)+5H2O(1)
Δc H 2
Ο Δ c H 2 = Δ c H1 − Δ r H m (298.15K ) Ο Ο Δ c H1 = Δ c H m (CH 3 COOH ,1, 298.15 K ) + Δ c H m (C2 HOH ,1, 298.15K )
(3) Δ r Η m = Δ f Η m (CH 3 OH ) − Δ f Η m (CH 4 ) −
Θ
Θ
Θ
1 Δ f ΗΘ m (O2 ) 2
= −238.7 − (−74.81) = −163.89 KJ ⋅ mol −1
Θ Θ Θ Δr Sm = Sm (CH 3 OH ) − S m (CH 4 ) −
= −393.51 − 74.81 − (−484.5) = −16.18 KJ ⋅ mol −1
Δ r C p ,m = C p ,m (CO2 ) + C p , m (CH 4 ) − C p ,m (CH 3COOH ) = 31.4 + 37.7 − 52.3 = 16.8 J ⋅ mol −1
物理化学习题解答(三)

物理化学习题解答(三)习题p200~2031.有5mol某双原子理想气体,已知其C v,m=2.5R,从始态400K,200kPa,经绝热可逆压缩至400kPa后,再真空膨胀至200kPa,求整个过程的Q,W,ΔU,ΔH和ΔS。
解:(1) 绝热可逆:Q1=0,ΔS1=0,W1=ΔU1。
T1γp11-γ=T2γp21-γ,(T2/T1)γ=( p1/p2) 1-γ,γln(T2/T1)=(1-γ)ln( p1/p2)ln(T2/T1)=(1/γ-1)ln( p1/p2)= (5/7-1)ln(200/400)= 0.198042T2=T1exp(0.198042)=400exp(0.198042)=487.6KW1=ΔU1=n C v,m(T2-T1)=5×2.5×8.314×(487.6-400)=9103.83JΔH1=n C p,m(T2-T1)=5×3.5×8.314×(527.8-400)=12745.36J(2) 真空膨胀:Q2=0,W2=ΔH2=ΔU2=0。
设计等温可逆过程:ΔS2=nR ln(p1/p2)=5×8.314×ln(400/200)=28.81 J.K-1整个过程:Q=Q1+Q2=0,W=W1+W2=W1=9103.83JΔU=ΔU1+ΔU2=ΔU1=9103.83JΔH=ΔH1+ΔH2=ΔH1=12745.36JΔS=ΔS1+ΔS2=ΔS2=28.81 J.K-12.有5molHe(g),可看作理想气体,已知其C v,m=1.5R,从始态273K,100kPa,变到终态298K,1000kPa,计算该过程的熵变ΔS。
解:(1) 设计等温可逆过程:273K,100kPa→273K,1000kPaΔS1=nR ln(p1/p2)=5×8.314×ln(100/1000)= -95.72J.K-1(2) 设计等压可逆过程:273K,1000kPa→298K,1000kPaΔS2=nC p,m ln(T2/T1)=5×2.5×8.314ln(298/273)=9.106J.K-1则:273K,100kPa→298K,1000kPaΔS=ΔS1+ΔS2=-95.72+9.106=-86.61 J.K-13.在绝热容器中,将0.10kg、283K的水与0.20kg、313K的水混合,求混合过程的熵变ΔS mix。
物理化学第3章 部分习题解答

m有机物
Tb ,有机物 W有机物 / M 有机物 W醇 Kb
M 有机物
K bW有机物 1.0291 2 0.1647 kg mol 1 W醇Tb ,有机物 100 0.1250
此有机物质的相对摩尔质量为0.1647kg · -1。 mol
12. 人的血液(可视为水溶液)在101.325kPa于-0.56℃凝固。已知 水的K f 1.86 K kg mol 1 。(1)求血液在37℃时的渗透压; (2)在同温度下,1dm3蔗糖(C12H22O11)水溶液中需含有多 少克蔗糖时才能与血液有相同的渗透压?
解:(1) m血液
c糖
M糖
V糖
c血 m 血 0.3011
W
糖
c糖V糖M 糖 0.3011 1 342 .3 103 .1 g
水溶液中需含有103.1克蔗糖时才能与血液有相同的渗透压。
20. 288.15K时,1mol NaOH溶在4.59mol H2O中所形成溶液的蒸气 压为596.5Pa。在该温度下,纯水的蒸汽压为1705Pa,求: (1)溶液中水的活度等于多少?(2)在溶液中,水的化学势 与纯水相差多少?
+
1 mol A + 2 mol B 混合物
分离前: G1 2mol ( A RT ln 0.5) 2mol ( B RT ln 0.5) 1 2 G 分离后: 2 1mol A 1mol ( A RT ln ) 2mol ( B RT ln ) 3 3 G G2 G1 2139 J, W G 2139 J, 即环境对体系所做的最小功为2139 J。
物理化学第三章习题和答案

第三章 化学反应系统热力学 (习题答案) 2007-6-6§3.1 标准热化学数据 练习1 所有单质的 Om f G ∆ (T )皆为零?为什么?试举例说明?答:所有处于标准状态的稳定单质的O m f G ∆ (T )(因为生成稳定单质,稳定单质的状态未发生改变);如单质碳有石墨和金刚石两种,O m f G ∆ (298.15K ,石墨,)=0kJmol -1.而O m f G ∆ (298.15K ,金刚石,)=2.9kJmol -1, (课本522页),石墨到金刚石状态要发生改变,即要发生相变,所以O m f G ∆ (298.15K ,金刚石,)=2.9kJmol -1,不等于零。
2 化合物的标准生成热(焓)定义成:“由稳定单质在298.15K 和100KPaPa 下反应生成1mol 化合物的反应热”是否准确?为什么?答:单独处于各自标准态下,温度为T 的稳定单质生成单独处于标准态下、温度为T 的1mol 化合物B 过程的焓变。
此定义中(1)强调压力为一个标准大气压,而不强调温度;(2)变化前后都单独处于标准态。
所以题中的定义不准确,3 一定温度、压力下,发生单位化学反应过程中系统与环境交换的热Q p 与化学反应摩尔焓变n r H ∆是否相同?为什么?答: 等压不作其他功时(W ’=0),数值上Q p =n r H ∆; Q p 是过程量,与具体的过程有关,而n r H ∆是状态函数与过程无关,对一定的化学反应有固定的数值;如将一个化学反应至于一个绝热系统中Q p 为零,但n r H ∆有确定的数值。
§3.2 化学反应热力学函数改变值的计算. 练习1 O m r G ∆(T ),m r G ∆(T ),Om f G ∆(B ,相态,T )各自的含义是什么?答:Om r G ∆(T ): 温度为T ,压力为P θ,发生单位反应的ΔG;m r G ∆(T ): 温度为T ,压力为P ,发生单位反应的ΔG;Omf G ∆(B ,相态,T ): 温度为T ,压力为P θ,由各自处于标准状态下的稳定单质,生成处于标准态1mol 化合物反应的ΔG;2 25℃时,H 2O(l)及H 2O(g)的标准摩尔生成焓分别为-285.838及-241.825kJ mol -1 。
南京大学《物理化学》每章典型例题

甲苯的密度第一章热力学第一定律与热化学例题1 1mol 理想气体于27℃、101325Pa状态下受某恒定外压恒温压缩到平衡,再由该状态恒容升温到97 ℃,则压力升到1013.25kPa。
求整个过程的W、Q、△U及△H。
已知该气体的CV,m 恒定为20.92Jmol-1 K-1。
解题思路:需先利用理想气体状态方程计算有关状态:(T1=27℃, p1=101325Pa,V1)→(T2=27℃, p2=p外=?,V2=?)→(T3=97℃, p3=1013.25kPa,V3= V2)例题2水在 -5℃的结冰过程为不可逆过程,计算时要利用0℃结冰的可逆相变过程,即H2O(l,1 mol,-5℃,) H2O(s,1 mol,-5℃,)↓△H2 ↑△H4H2O(l,1 mol, 0℃,) H2O(s,1 mol,0℃,)∴△H1=△H2+△H3+△H4例题3 在 298.15K 时,使 5.27 克的甲醇(摩尔质量为32克) 在弹式量热计中恒容燃烧,放出 119.50kJ 的热量。
忽略压力对焓的影响。
(1) 计算甲醇的标准燃烧焓。
(2) 已知298.15K时 H2O(l) 和CO2(g)的标准摩尔生成焓分别为-285.83 kJ?mol-1 、-393.51 kJ?mol-1,计算CH3OH(l)的。
(3) 如果甲醇的标准蒸发焓为 35.27kJ?mol-1,计算CH3OH(g) 的。
解:(1) 甲醇燃烧反应:CH3OH(l) +O2(g) → CO2(g) + 2H2O(l)QV==-119.50 kJ/(5.27/32)mol =-725.62 kJ?mol-1Qp==+= (-725.62-0.5×8.3145×298.15×10-3)kJ?.mol-1=-726.86 kJ?mol -1(2) = (CO2) + 2(H2O )-[CH3OH(l)][CH3OH (l)] = (CO2) + 2 (H2O )-= [-393.51+2×(-285.83)-(-726.86) ] kJ?mol-1=-238.31 kJ?mol-1(3) CH3OH (l) →CH3OH (g) , = 35.27 kJ?.mol-1[CH3OH (g)] = [CH3OH (l)] += (-38.31+35.27)kJ?.mol -1=-203.04 kJ?mol-1第二章热力学第二定律例1. 1mol 理想气体从300K ,100kPa下等压加热到600K,求此过程的Q、W、 U、 H、 S、G。
物理化学第三章课后习题解答

第三章习题及答案1.试确定在22H ()I (g)g+2HI(g)的平衡系统中的组分数。
(1)反应前只有HI ;(2)反应前有等物质的量的2H 和2I ;(3)反应前有任意量的2H 、2I 及HI 。
解(1)1113'=−−=−−=R R S K (2)1113=−−=K (3)2013=−−=K 4.环己烷在其正常沸点为80.75℃时的气化热为1358J g −⋅。
在此温度是液体和蒸气的密度分别为0.7199和0.00293g cm −⋅。
(1)计算在沸点时d d p/T 的近似值(仅考虑液体体积);(2)估计在50.510Pa ×时的沸点;(3)欲使环己烷在25℃沸腾,应将压力减压到多少?解(1)根据克拉贝龙方程:6vap m,B m m 31d 358841011d [(g)(l)]353.75840.00290.71992.9510Pa K H p T T V V −⎡⎤⎢⎥∆××⎢⎥==−⎛⎞⎢⎥××−⎜⎟⎢⎥⎝⎠⎣⎦=×⋅若忽略液体体积:6vap m,B 31m d 35884102.9310Pa K 1d (g)353.75840.0029H p T TV −⎡⎤∆⎢⎥××≈==×⋅⎢⎥⎢⎥××⎣⎦(2)由克克方程:vap m,B 211255211ln R 0.5103588411ln 108.314353.75H p p T T T ∆⎛⎞=−⎜⎟⎝⎠⎛⎞××=−⎜⎟⎝⎠解得:2331.29KT =(3)将5211298K,353.75K,10Pa T T p ===代入克克方程得:42 1.4810Pa p =×。
5.溴苯Br H C 56的正常沸点为156.15℃,试计算在373K 时溴苯的蒸气压?与实验值Pa 1088.14×比较并解释这一现象。
物理化学第三章习题答案精品PPT课件

H 2 n fus H m (273.15K ) 60.12kJ
H 56.21kJ
S S1 S2 S3
S1
nC p,m
(l )
ln
T2 T1
28.45J K 1
S3
nC
p,m
(
s)
ln
T1 T2
13.87 J
K 1
S2
n fus H m T2
220.10J K 1
S 205.52J K 1
nR ln
p1 p2
?
S1 nSm 0.04 205.14 8.21J K 1
S2 S1 S ?
H nC p,m (T2 T1) ? G H (T2S2 T1S1) ?
6.1mol某双原子理想气体,从300K、pθ等温可逆压缩到10pθ, 计算该过程的Q、W、∆U、∆H、∆S、∆A和∆G。
可逆地压缩到100 kPa,计算该过程的Q、W、∆U、∆H、
∆S、∆A和∆G 。S巳m 知 (298.15K) = 130.59 J·K-
1解·m:o1l-01m。ol理想气体 绝 热 可逆10mol理想气体
298.15K,50 kPa
T2,100kPa
T2
(
p2
)
R C p ,m
T2 363.27K
T1
p1
Q0
W U nCV ,m (T2 T1) 13.57kJ
H nCp,m (T 2T1) 18.99kJ
G H (T2S2 T1S1) H S(T2 T1)
10mol理想气体 S10mol理想气体 298.15K,100kPa 298.15K,50 kPa
S nR ln 100 57.63J K 1 50
物理化学习题及答案

物理化学习题及答案物理化学是研究物质的物理性质和化学性质之间关系的科学。
它结合了物理学的原理和化学的实验方法,以探究物质在不同条件下的性质和行为。
以下是一些物理化学的习题及答案,供学习者参考。
# 习题1:热力学第一定律某理想气体在等压条件下,从状态A(\( P_1, V_1 \))变化到状态B (\( P_2, V_2 \))。
已知气体的摩尔热容在等压条件下为\( C_p \)。
求气体在这一过程中的内能变化。
答案:由于气体在等压条件下变化,根据热力学第一定律,内能变化\( \Delta U \)可以通过热量\( Q \)计算:\[ \Delta U = Q - W \]其中,\( W \)是做功,对于等压过程,\( W = P \Delta V \)。
由于\( P \)是常数,\( \Delta V = V_2 - V_1 \),所以:\[ W = P(V_2 - V_1) \]将\( W \)代入第一定律公式,得到:\[ \Delta U = Q - P(V_2 - V_1) \]由于\( Q = nC_p \Delta T \),而\( \Delta T \)可以通过\( \Delta V \)和\( C_p \)计算,所以:\[ \Delta U = nC_p \Delta T - P(V_2 - V_1) \]最终,内能变化只与温度变化有关,与体积变化无关。
# 习题2:理想气体状态方程一个理想气体在标准状态下(0°C,1 atm)的体积是22.4 L。
如果这个气体被压缩到1/4其原始体积,求最终的压强。
答案:根据理想气体状态方程\( PV = nRT \),其中\( P \)是压强,\( V \)是体积,\( n \)是摩尔数,\( R \)是理想气体常数,\( T \)是温度。
在这个问题中,温度和摩尔数保持不变,所以:\[ P_1V_1 = P_2V_2 \]代入已知值,\( P_1 = 1 \) atm,\( V_1 = 22.4 \) L,\( V_2 =\frac{22.4}{4} \) L,解得:\[ P_2 = \frac{P_1V_1}{V_2} = \frac{1 \times 22.4}{22.4/4} =4 \text{ atm} \]# 习题3:化学平衡在一个封闭容器中,反应 \( A(g) \leftrightarrow 2B(g) \) 达到平衡。
物理化学第三章练习题.ppt
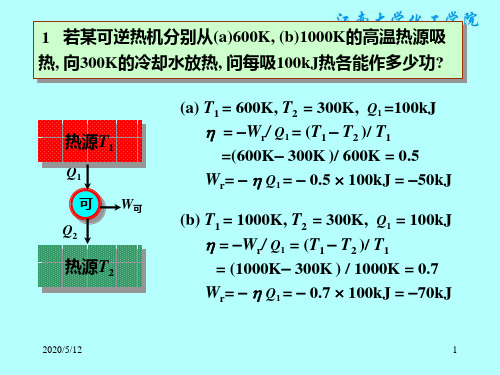
温度为273K的水与373K的恒温热源接触, 当水温升至 17 (1)1kg ′ 373K时, 求水的熵变, 热源的熵变及隔离系统总熵变.
(2)倘若水是先与保持323K的恒温热源接触, 达到平衡后再与保 持373K的恒温热源接触, 并使水温最终升至373K, 求总熵变. (3)根据(1), (2)计算结果, 说明用何种加热方式既能使水温由 273K升至373K, 又能使总熵变接近于零? 设水的比热容为 4.184 J K-1 g-1 . m=1kg H2O(l) T1=273K 热源 T=373K
100 105 Pa 10 3 m 3 300K 0.05663 J K 1
2l n 200 l n 100 J K 1 150 150
2019/3/31
9
返回
12
PT = c =100×298 =29800 kPa· k T2= 29800/200 = 149k △U=nCV,m △T=2×2.5×8.314×(149-298)= - 6.194kJ
1
Q=Q1+Q2=1.247KJ △S= △S1+ △S2=5.76J· K-1
③ Q1=0 △S1=0
P1 T ( ) P2
2019/3/31
1
P11 T1 P21 T
Cp ,m 1.4 C V ,m
1.4 200 1 T1 ( ) 1.4 300 246.1K 100
6
, 将3.45mol理想气体从15℃, 100kPa压缩到 10 在恒熵条件下 ′ 700kPa, 然后保持容积不变, 降温至15℃. 求过程之Q, W, U, H 及S. 已知Cp,m=20.785 Jmol-1 K-1. n=3.45mol, pg T1=288.15K p1=100kPa dS=0 n=3.45mol, pg T2=? 压缩 p2=700kPa dV=0 n=3.45mol, pg T3=288.15K 降温 V3 = V2
物理化学第三章 习题解答

第三章 习题解答1. 在298 K 和标准压力下,含甲醇(B)的摩尔分数x B 为0.458的水溶液的密度为0.89463kg dm -⋅,甲醇的偏摩尔体积313(CH OH)39.80 cm mol V -=⋅,试求该水溶液中水的偏摩尔体积2(H O)V 。
解:3322(CH OH)(CH OH)(H O)(H O)V n V n V =+3330.45832(10.458)18()dm 0.02729 dm 0.894610mV ρ⨯+-⨯===⨯ 3313120.027290.45839.8010(H O)() cm mol 16.72 cm mol 10.458V ----⨯⨯=⋅=⋅-2. 298 K 和标准压力下,有一甲醇物质的量分数为0.4的甲醇-水混合物。
如果往大量的此混合物中加入1 mol 水,混合物的体积增加17.35 cm 3;如果往大量的此混合物中加1 mol 甲醇,混合物的体积增加39.01 cm 3。
试计算将0.4 mol 的甲醇和0.6 mol 的水混合时,此混合物的体积为若干?此混合过程中体积的变化为若干?已知298 K 和标准压力下甲醇的密度为0.79113g cm -⋅,水的密度为0.99713g cm -⋅。
解:312(H O)17.35cm mol V -=⋅313(CH OH)39.01 cm mol V -=⋅33322(CH OH)(CH OH)(H O)(H O)26.01 cm V n V n V =+=混合前的体积为:33[(18/0.9971)0.6(32/0.7911)0.4] cm 27.01 cm ⨯+⨯=31.00 cm V ∆=3. 298 K 时,K 2SO 4在水溶液中的偏摩尔体积V B 与其质量摩尔浓度的关系式为:1/2B 32.28018.220.222V m m =++,巳知纯水的摩尔体积V A , m = 17.96 cm 3·mol -1,试求在该溶液中水的偏摩体积与K 2SO 4浓度m 的关系式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) Q2 = 0,
p2 1 1 5/ 3 2 T3 T2 5/ 3 5 p3 T3 T2 (2) 0.4 303K
1
(3) V = 0, W3 = 0,
Q3 U 3 nCV ,m (T4 T3 ) 3 {2 8.314 (500 303.14)}J 4.91kJ 2 T4 500 p4 p3 101.3 kPa 167.1kPa T3 303
5
例10 温度为200℃, 体积为20 dm3的1mol氧, 反抗1013 kPa的 恒外压进行绝热膨胀, 直到气体的压力与外压平衡, 设氧服从 理想气体行为, 则气体在该过程中的熵变为多少? 已知Cp, m = 7R/2.
由
Q = 0,
U = W,
nRT2 nCV ,m (T2 T1 ) p2 p V1 nRT2 p2V1 2 7 5 1m ol RT2 (101.3 20 8.314 473.2)J 2 2 RT1 8.314 473.2 得 T2 407.6K 又 p1 k Pa 196.7k Pa V1 20
T2 p1 S nC p,m ln nR ln T1 p2 407.6 196.7 7 8.314ln 8.314ln · K 1 J K 1 1.18J 473.2 101.3 2
1
此过程实为: 3mol N2 300K 1dm3
不考虑其它气体的影响时, 每种气体的状态都可认为没有变 化, 故 p, U, H, S 等状态函数均不变.
2018/11/12
3
例8 2 mol某理想气体, 其恒容摩尔热容为3R/2, 由500 K, 4052 kPa的始态, 依次经历下列过程: (1)在恒外压2026 kPa下, 绝热 膨胀至平衡态, (2)再可逆绝热膨胀至1013 kPa; (3)最后恒容加 热至500 K的终态. 试求整个过程的Q, W, U, H及S. n = 2mol n = 2mol n = 2mol n = 2mol Q = 0 dS = 0 T = ? dV = 0 T1 = 500K 1 T2 = ? T4 = 500K 3 p1 = 405.2 膨胀 p2 = 202.6 膨胀 p3 = 101.3 p4 = ? kPa kPa kPa (1) Q1 = 0, U1 = W1 nRT2 nRT1 nCVm(T2-T1) p2 p p 1 2 p2 nRT1 3 2 R(T2 T1 ) nRT2 2 p1 4 T2 T1 400K 5
K 1· mol1), 由始态400 K, 例5 5 mol理想气体(Cpm = 2910 J·
200 kPa恒压冷却到300 气体 p1 = 200kPa T1 = 400K
T2 T1
p环 = 200kPa 5 mol理想气体 p2 = p1 = 200kPa T2 = 300K
Q p H nC p,mdT 5 29.10 (300 400) 14.55kJ
U
T
T2
1
nCV ,m dT
T2
W = U-Q = - 1040+14.55 = 415 kJ 或 W =-pV = -nR T = - 5×8.314 ×(-100)= 415 kJ
整个过程: U = 0, H = 0, Q = Q1 + Q2 + Q3 = Q3 = 491kJ, W =-Q =-491 kJ
p1 405.6 S nR ln 2 8.314ln · K 1 14.75J · K 1 J p4 167.1 2018/11/12
V2 1 (2) T S (压缩) nRln 5molRln 28.82J K 1 V1 2
(3)
S
mix
S T S(压缩) (28.82 28.82)J K 0
2mol O2 300K 1dm3 3mol N2 2mol O2 300K 1dm3
T2 S nC p,m ln 41.86J K 1 T1
2018/11/12 1
T1
n(C p ,m R )dT 10 .40kJ
例6 一绝热容器中有一隔板, 隔板一边为3mol N2, 另一边为2 mol O2, 两边皆为300K, 1dm3. N2 和 O2可视为理想气体. (1) 抽隔板后求混合过程的熵变 mixS, 并判断过程的可逆性; (2) 将混合气体恒温压缩至 1dm3, 求熵变. 1 (3) 求上述两步骤熵变之和 . mix S T S(N2 ) T S(O2 ) (17.29 11.53) 28.82J K 3mol N2 2mol O2 3mol N2 2mol O2 300K 300K 300K 1dm3 1dm3 2dm3 (1) 容器绝热: Q = 0, 容器体积不变: W = 0, 故 U = 0. 理想气体U = 0 , 则 T = 0, 恒温过程. V2 T S (N2 ) nN2 Rln 3molRln2 17.29J K 1 V1
mix S T S(N2 ) T S(O2 ) (17.29 11.53) 28.82J K 1
2018/11/12 2
V2 T S (O2 ) nO2 Rln 2molRln2 11.53J K 1 V1
因 Q = 0, W = 0, 为隔离系统, mixS > 0, 故过程不可逆.
