天津大学无机化学课件第十一章卤素和氧族(1)
天津工业大学无机化学氧族元素.ppt
1s
)
2
(
1s
)
2
(
2
s
)
2
(
2s
)
2
(
2
px
)
2
2 2
py pz
2 2
1 2 py 2 2 pz
(
2
px
)
= n(n 2)B.M. 1.73B.M.
1+
3 2
O2
2
,
MO
:
( 1s
)2
(
1s
)2
(
2s
2
(0.80) HO -(0.08)
HS
2
2
2
O (1.68) 3
HS O 2-(1.88H) 2SO3(1.80)
1
24
S
O
2-(1.00)
S O 2-(1.04) 46
0
23
SO 24
(2.15)
Z
2
(-0.28) -2
0
2
4
6
OH(-0.79)
-1
HO 2
(-2.46)
H O -2 22
(-0.68)
)2
(
2s
)2
(
2
px
)2
2 2
2 py
2 pz
2 py
2 pz
2 2
(
2 px
)
= n(n 2)B.M. 0
1
O
+ 2
,
MO
无机化学——卤素和氧族元素

以萤石和浓H2SO4作用,工业上生产HF是把反应物放在衬铅 的铁制容器中进行(因生成PbF2保护层阻止进一步腐蚀铁) 。氢氟酸一般用塑料制容器盛装。HF溶于水即为氢氟酸。
CaF2+H2SO4(浓)=CaSO4+2HF↑
(3).非金属卤化物的水解
(3)非金属卤化物的水解:此法适用于HBr和HI的制备,以水滴 到非金属卤化物上,卤化氢即源源不断地发生: PBr3+3H2O==H3PO3+3HBr PI3+3H2O==H3PO3+3HI 实际上不需要事先制成卤化磷,把溴滴加在磷和少许水的 混和物中或把水逐滴加人磷和碘的混和物中即可连续地产 生HBr或HI: 2P+6H2O+3Br2==2H3PO3+6HBr 2P+6H2O+3I2==2H3PO3+6HI
砹是在二十世纪四十年代才被科学家所发现。它是人工合成元 素。其合成的人工核反应为:
20983Bi+42He→21185At+210n
砹希腊词原意是不稳定。它的同位素的半衰期只有8.3小时。
11.2.1 卤素-基本物理性质(ns2np5 )
元素 原子序数 价电子结构 主要氧化数 原子共价半径/pm X-离子半径/pm 第一电离势/(kJ·mol-1) 电子亲合势/(kJ·mol-1) X-的水合能/(kJ·mol-1) X2的离解能/(kJ·mol-1) EØ (X2/X-)/V 电负性(Pauling标度)
ቤተ መጻሕፍቲ ባይዱ
氟
氯
溴
碘
9
17
35
53
2s22p5 3s23p5 4s24p5 5s25p5
-1
-1,+1,+3,+5,+7
天津大学无机化学课件第十一章卤素和氧族

2019/10/24
课件
12
11-2-2 卤族单质 1.物理性质
氟(F2) 氯(Cl2) 溴(Br2) 碘(I2) 集均聚为状双态分子气体 气体 液体 固体 熔(具点有/℃稳定-2的198.电6 子构-1型01及较高–7的.2键能)113.5 沸在点周/期℃表中-1,8整8 族是-3双4.原6 子分5子8.7的6 只有18卤4.素3
氙 氡
2019/10/24
课件
4
P区元素的特点
(3)金属的熔点较低
0
ⅢA ⅣA ⅤA ⅥA ⅦA He 氦
2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3
Al 铝
660.4℃
Si
硅
P
磷
S
硫这C些l 金氯属Ar 氩
4 5
Ga 镓
29.78 ℃
In 铟
156.6 ℃
Ge 锗
973.4 ℃
Sn 锡
熔、沸点升高
∵ 固态为分子晶体 ∴ 熔、沸点较低
2019/10/24
课件
13
11-2-2 鹵素单质 1.物理性质
氟(F2) 氯(Cl2) 溴(Br2) 碘(I2)
集聚状态 气体 气体 液体 固体
熔点/℃ -219.6 -101 沸点/℃ -188 -34.6
–7.2 113.5 58.76 184.3
6
无机化学多媒体电子教案
第十一章 卤素和氧族元素
第一节
结束
2019/10/24
课件
7
无机化学多媒体电子教案
第十一章 卤素和氧族元素
第二节
卤素
2019/10/24
课件
8
11-2-1 卤族元素通性
11第十一章卤素和氧族

5 In 铟 Sn 锡 Sb 锑 Te合碲增I合碘减 Xe 氙 6 Tl 铊 Pb 铅 Bi 铋 Po物 强A物t 砹弱 Rn 氡
P区元素的特点
(3)金属的熔点较低
0
ⅢA ⅣA ⅤA ⅥA ⅦA He 氦
2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3
Al 铝
660.4℃
Si
硅
P
磷
S
硫这C些l 金氯属Ar 氩
氧11化4 数为1+333 2.8 2.5 1氧14化0 数为10+058
ns np
nd-1、0 -1、0 -1、0
拆主开要3氧对化电子数 -1、0 +1、+3 +1氧、化+3数+为1、+7+3
ns np
+n5d、+7 +5、+7 +5、+7
r) 碘(I) 原子序数 特9殊性 17 35 53
P区元素的特点(2)具有多种氧化数
这因非种原金现子n属象的s、元称价n素为电p还电子具子构有可型负参为氧与n化成s2数键np1-5
惰性电子对效应
0
ⅢA ⅣA ⅤA Ⅵ低A Ⅶ高A He 氦
2 B 硼 C 碳 N 氮 O氧氧 F氧氟 Ne 氖 3 Al 铝 Si 硅 P 磷 S 化数硫稳 定C化数l 氯稳定 Ar 氩 4 Ga 镓 Ge 锗 As 砷 Se化硒性B化r 溴性 Kr 氪
0
ⅢA Ⅳ如A 超Ⅴ纯A 锗ⅥA ⅦA He 氦
2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪 5 In 铟 Sn 锡 Sb 锑 Te 碲 I 碘 Xe 氙 6 Tl 铊 Pb 铅 Bi 铋 Po At 砹 Rn 氡
《卤素和氧族元素》课件

卤素元素和氧族元素的比较
电子亲和能
卤素元素的电子亲和能比氧族 元素大。
化学反应
卤素元素通常表现出较强的还 原性,而氧族元素则具有良好 的氧化性。
物理性质
卤素元素在常温下通常是二原 子分子存在,而氧族元素则有 固、液、气三种常见的状态。
结论
• 卤素元素相对较小,电负性较高,还原性强。 • 氧族元素则相对较大,电负性较低,氧化性强。 • 两类元素广泛应用于医药、化工、材料等领域。 通过对卤素和氧族元素的学习,我们可以更好地了解这两类元素在科学及工业领域中的应用前景。
卤素和氧族元素
本课程介绍卤素和氧族元素的基本概念及特点,并比较两类元素的差异。通 过学习,您将更好地了解这两类元素在自然界和科技领域的应用。
卤素元素
离子半径和电负性
卤素元素的离子半径随原子序数的增加而增加,电负性随原子序数的增加而减小。
2
物理性质和化学性质
卤素元素在常温下通常是二原子分子存在,活泼性大,具有较强的还原性和卤化 性。
3
产生和应用
卤素元素通常是从海水中提纯或从盐矿中提取得到,广泛应用于医药、化工、冶 金等领域。
氧族元素
离子半径和电负性
氧族元素的离子半径比卤素元素小,电负性比卤素元素大。
物理性质和化学性质
氧族元素常见状态为气体、液体、固体,活泼性小,具有良好的氧化性和还原性。
产生和应用
氧族元素可以得到空气中分离或通过化学反应制备,具有广泛的应用领域,例如材料、能源、 环保等。
应用与前景
卤素元素和氧族元素作为元素周期表中的两类元素,各自在不同领域都有丰 富的应用。例如,卤素元素常应用于消毒、农药、制药、合成材料等领域, 而氧族元素则有着重要的能源存储、电化学催化、气体分离等应用。
无机化学课件第十一章

3. 存在、分离、性质
氟广泛存在于自然界 萤石(CaF2) 冰晶石(Na3AlF6) 氟磷灰石(Ca3(PO4)2CaCFCl)2
氯: 主要以海水和内地盐湖中的NaCl形式存在
溴,碘:以Na,K,Mg的无机盐形 式存在于海水中
分离:从卤化物中分离卤素单质
2 P(s) + 3 Br2(g) 2 P(s) + 5 I2(g)
2 PBr3(l) 2 PCl3(s)
(无色发烟) (红色)
与 H2 的反应 在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大
量热,导致爆炸。
F2(g) + H2(g)
2 HF(g)
Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下,可
1.强氧化性 F ,Cl ,Br ,I 能力依次减弱
2
2 22
2.与单质作用
F2 在任何温度下都可与金属直接化合,生成高价氟 化物。F2 与 Cu、Ni、Mg 作用时由于金属表面生成一层 致密氟化物保护膜而中止反应。所以 F2 可储存在 Cu、 Ni、Mg 或合金制成的容器中。
Cl2 可与各种金属作用,但干燥的 Cl2 不与 Fe 反应, 因此,Cl2 可储存在铁罐中。
烈。
2 S(s) + Cl2(g)
S2Cl2(l)
(红黄色液体)
S(s) + Cl2(g)(过量)
SCl2(l) (深红色发烟液体)
2 P(s) + 3 Cl2(g)
2 PCl3(l) (无色发烟液体)
2 P(s) + 5 Cl2(g)(过量)
2 PCl5(s) (淡黄色固体)
《卤素和氧族元素》课件

氧族元素在工业上的应用
氧族元素在工业上主要用于生产含氧酸及其盐类,如硫酸、磷酸、硝酸等。这些 酸是工业中重要的原料,可用于制造化肥、农药、颜料、炸药、洗涤剂等。
氧族元素还用于制造其他含氧无机化合物,如含氧酸盐、氧化物和过氧化物等。 这些化合物在化工、轻工、纺织、冶金和电子等领域有广泛应用。
氧族元素在化学研究中的应用
卤素和氧族元素面临的挑战与机遇
资源短缺问题
随着卤素和氧族元素的广泛应用,资源短缺 问题逐渐凸显,例如稀土元素、氟元素的短 缺等。这需要加强资源的循环利用,提高资 源利用率,同时积极寻找替代资源。
环境问题
卤素和氧族元素的开采、生产和应用过程中 会对环境造成一定的影响,例如对水体、土 壤和空气的污染等。这需要加强环境保护措 施,推广清洁生产技术,降低对环境的负面 影响。
详细描述
氧是空气的主要成分之一,具有强烈 的氧化性,可以与许多元素发生反应 ,如与氢气反应生成水,与金属反应 生成金属氧化物等。
硫的性质与反应
总结词
硫是一种常见的非金属元素,具有多种化合价和独特的反应性。
详细描述
硫有多种化合价,如-2、0、+4、+6等,因此可以形成多种化合物,如硫化物、硫酸盐等。硫还可以 与许多元素发生反应,如与金属反应生成金属硫化物,与氢气反应生成硫化氢等。
氧族元素在化学研究中具有重要地位,它们是许多有机和无机化合物的组成部分,对于合成新的化合物和材料具有关键作用 。
氧族元素在化学反应中常作为氧化剂或还原剂参与反应,如硫化物在高温下可与氢气反应生成硫和水;硒化物可与金属反应 生成金属硒化物;二氧化硫可与氧气发生催化氧化反应生成三氧化硫等。了解氧族元素的性质和反应机制有助于深入理解化 学反应机理,推动化学科学的发展。
天津大学无机化学ppt课件下载

Inorganic Chemistry
绪论 1学时 第一章 化学反应中 的质量关系和能量 关系(3学时)
目 录
第二章 化学反应的 方向、速率和限度 (8学时)
第三章 酸碱反应和 沉淀反应(7学时)
§1 化学中的计量 §2 化学反应中的质量关系 §3 化学反应中的能量关系
1学时 1学时 1学时
光 学 纤 维 胃 镜
用光导纤维 做手术,不 用开刀
20/51
F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破敌 火力网,压制敌方防空系统,摧毁严密防守的指挥所、战略要地 、重要工业目标,还可执行侦察任务,具有一定空战能力。21/51
近年发现和发明的新物质层出不穷,如球碳、管碳、俄 罗斯套娃、团簇化合物、笼合物等。
§1 镧系元素和锕系元素该素 §2 稀土元素
6/51
1 化学的研究对象 绪论 2 化学的主要分支
3பைடு நூலகம்怎样学习化学
7/51
什么是化学?它研究的对象是什么?如何才能学好化 学?这是开始学化学首先要解决的问题。下面就从回答这些 问题来开始我们的化学学习。
一.化学研 究的物质
物质是不依赖于人们的感觉而存在并且可以 被人们的感觉所认识的客观实在。简而言之,物 质是客观存在的东西。
36/51
(2)炼金术、炼丹时期(公元前后—公元 1500年)
➢ 中国炼丹术的产生有两个原因:一是五行说(五 行无常胜),此为理论基础;二是封建主的贪得 无厌,梦想长生。战国末期有了炼丹术,汉代有 较大发展,唐代达到高潮。当时所谓的丹主要是 三仙丹HgO,丹砂HgS,铅丹Pb3O4等。这些丹 实际上都是剧毒的,许多皇帝因服丹而亡。
1学时 3学时 4学时
57天津大学无机化学第十一章卤素和氧族PPT课件

16.07.2020
64 4.0
nd39.90
并相差2 I1/(kJ·
1) ns
mol-
np
1681
1251
nd
氧11化4 数为1+333 2.8 2.5 1氧14化0 数为10+058
拆开3对电子
-1、0 -1、0 -1、0
主要氧ns化数np-1、0
+n1d、+3
氧化数为+7
+1、+3 +1、+3
16.07.2020
11-1 p区元素概述
0 ⅢA ⅣA ⅤA ⅥA ⅦA He 氦 2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪 5 In 铟 Sn 锡 Sb 锑 Te 碲 I 碘 Xe 氙 6 Tl 铊 Pb 铅 Bi 铋 Po At 砹 Rn 氡
0
ⅢA Ⅳ如A 超Ⅴ纯A 锗ⅥA ⅦA He 氦
2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪
天津大学无机化学课件第十一章卤素和氧族(1)

近年来,由于大气中NO、NO2等氮 氧化物和氯氟化碳(CFCl3、CF2Cl2) 等含量过多,使臭氧层遭到破坏,
则必须采取措施来保护臭氧层
18.12.2020
编辑课件
9
11-3-2 氧气和臭氧
臭氧的分子结构
sp2杂化
O
2s 2p sp2杂化
O
2s 2p sp2杂化
O
3准4 金属52
4s24p4 5s25p4
金8属4
6s26p4
主要氧价获化层两数个电电子-1、子构0-2可型、 -+达2为4、、到n0+s、62稳n-++2p62定4、,、+0电4其、子-++原262层、、子+0结4、 -
原子半构径,/pm即有常6较6见强的的1氧0非4化金数属1为17性-2 137 153
无机化学氧多族媒元体素 电子教案 第十一章 卤素和氧族元素
第三节
氧族元素
18.12.2020
编辑课件
1
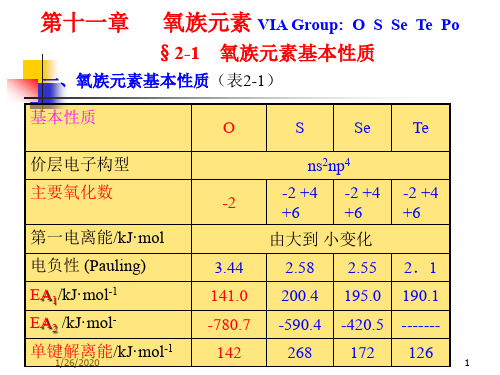
11-3-1 氧族元素概述
11-3-1 氧族元素概述 0
ⅢA ⅣA ⅤA ⅥA ⅦA He 氦 2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
离子 r(M硫2、-)/p硒m 、1碲40还可18利4 用1外98层d轨22道1 形 -
半I1径/(krJ(M·成m6o+氧)l/-p1)化m 数13-为14+21、2090+04、94+4261的化856合69物
67 812
电负性( p) 3.5 2.5 2.4 2.1 2.0
18.12.2020
天津大学无机化学教研室《无机化学》复习全书(卤素和氧族元素)

第11章卤素和氧族元素11.1 复习笔记一、p区元素概述1.P区元素组成P区元素包括周期表中的ⅢA~ⅦA和零族元素,该区元素沿B-Si-As-Te-At对角线将其分为两部分,对角线右上角为非金属元素(含对角线上的元素),对角线左下角为10种金属元素。
2.P区元素的特性(1)金属性周期变化规律P区同族元素从上往下原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。
除ⅦA族外,都是由典型的非金属元素经准金属过渡到典型的金属元素。
(2)价层电子变化规律①P区元素(零族除外)原子的价层电子构型为。
ns、np电子均可参与成键,原子表现出多种氧化数;②随着价层np电子的增多,失电子趋势减弱,逐渐变为共用电子,甚至变为得电子。
P区非金属元素除有正氧化数外,还有负氧化数。
(3)元素稳定性ⅢA~ⅤA族同族元素从上往下低氧化数化合物的稳定性增强,高氧化数化合物的稳定性减弱,该现象称为“惰性电子对效应”;(4)物理性质①P区金属的熔点一般较低;②P区某些金属具有半导体性质,如超纯锗、砷化镓、锑化镓等。
二、卤族元素1.卤族元素通性(1)卤族组成卤族元素又称卤素,是周期系ⅦA族元素,即氟(F)、氯(C1)、溴(Br)、碘(I)、砹(At)的总称,其中砹为放射性元素;(2)卤族元素的基本特性①价层电子构型:卤素原子的价层电子构型为ns2np5,与稳定的8电子构型(ns2np6)比较,仅缺少1个电子;②核电荷数及原子半径:卤素原子的核电荷是同周期元素中最多的(稀有气体除外),原子半径是同周期元素中最小的,最容易取得电子;③非金属性:卤素和同周期元素比较,非金属性是最强的;在本族内从上往下电负性逐渐减小,因而从氟到碘非金属性依次减弱;④电离能:卤素原子的第一电离能都很大;⑤氧化数:卤素在化合物中最常见的氧化数是-1。
氟没有正氧化数,其他卤族元素,若与电负性较大的元素化合可以表现出正氧化数:+1、+3、+5和+7,而且相邻氧化数之间的差数均为2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
典8型非金16属
2s22p4 3s23p4
3准4 金属52
4s24p4 5s25p4
金8属4
6s26p4
主要氧价获化层两数电个子 电-1、构子0-2型可、 -+2为达4、、到n0+s、62稳n-++2p62定4、,、+0电4其、子-++2原62层、、子+0结4、 -
原子半构径,/pm即有常6较6见强的的1氧0非4化金数属1为17性-2 137 153
4 3
键
三中心 四电子 大键
臭此氧大分子键中为无不单定电域键 子,为反磁性物或质离域键
典8型非金16属
2s22p4 3s23p4
3准4 金属52
4s24p4 5s25p4
金8属4
6s26p4
主要氧化数 -1金、0-属2、 性-+24增、、0+强、6 -++,262、非、+04金、 -++属262、、性+04、减弱原子半径/pm 66 104 117 137 增大153 离子 r(M2-)/pm 140 184 198 221 增大-
2021/2/9
课件
7
11-3-2 氧气和臭氧
臭氧1的1形-3-成2 氧气和臭氧
通过电子流、质子流、
短波辐射(紫外线)
O2 hν 2O O2 + O hν→ O3
通过闪电, 无声放电也可生成
2021/2/9
课件
8
11-3-2 氧气和臭氧
臭氧1保1护-3-层2 氧气和臭氧
存在于离地面20-40km的高空,是保护地
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪 5 In 铟 Sn 锡 Sb 锑 Te 碲 I 碘 Xe 氙 6 Tl 铊 Pb 铅 Bi 铋 Po At 砹 Rn 氡
称为氧族元素
2021/2/9
课件
2
11-3-1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
半径 r(M6+)/pm - 29 42 56 67
I1/(kJ·mol-1) 1314 1000 941 869 812 电负性 (p) 3.5 2.5 2.4 2.1 2.0
2021/2/9
课件
4
11-3-1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 价层电子构型
半径 r(M6+)/pm - 29 42 I1/(kJ·mol-1) 1314 1000 941 电负性 ( p) 3.5 2.5 2.4
56 67 869 减8小12 2.1 减小2.0
2021/2/9
课件
5
11-3-1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 价层电子构型
原子序数 8 16 34 52 84
价主层要电氧子化以广属构数单的在型质成地2-1s存 矿 壳、202-为无重2p在元中、4稀单金。素以-+324s散质属2、为,氧、30+元存硫p分很化、64 素在化-++4布多物262s。,物2、、4最金、+0p在常矿44、 -++自存中5262s2、然在、5+0p放4界于4、元射6s素2性-6p4 原子半径硫/p化m物形66式存1在04 117 137 153 离子 r(M2-)/pm 140 184 198 221 -
6
11-3-1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 8 16 34 52 84
价层电子构型 2与s22大p4 多3s2数3p4金4s属24p元4 素5s25p4 6s26p4
主与要大氧多化二数数元金-离1属形、0-2子元成、 型-+素2共4、化、0价+形、6合型-++成262物化、、+0合4、 -++2物62、、+04、 -
无机化学氧多族媒元体素 电子教案 第十一章 卤素和氧族元素
第三节 氧族元素
2021/2/9
课件
1
11-3-1 氧族元素概述
11-3-1 氧族元素概述 0
ⅢA ⅣA ⅤA ⅥA ⅦA 氦 2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
面生物免受太阳强烈辐射的防御屏障
近年来,由于大气中NO、NO2等氮 氧化物和氯氟化碳(CFCl3、CF2Cl2) 等含量过多,使臭氧层遭到破坏,
则必须采取措施来保护臭氧层
2021/2/9
课件
9
11-3-2 氧气和臭氧
臭氧的分子结构
O
sp2杂化
2s 2p sp2杂化
O
2s 2p sp2杂化
O
2s 2p
离子 r(M硫2、-)/p硒m 、1碲40还可18利4 用1外98层d轨22道1 形 -
半I1径/(krJ(M·成m6o+氧)l/-p1化)m 数13-为14+21、2090+04、94+4261的化856合69物
67 812
电负性( p) 3.5 2.5 2.4 2.1 2.0
2021/2/9
课件
半径 r(M6+)/pm - 29 42 56 67
I1/(kJ·mol-1) 1314 1000 941 869 812 电负性 ( p) 3.5 2.5 2.4 2.1 2.0
2021/2/9
课件
3
11-3-1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 8 16 34 52 84
价原主为纯大氧层子要电生氧量常半氧子径命用的用化为主等构/元于纯作p数型m火角二素医氧制药 。 十2-。疗用冷1s少调有6、2有多(0半是年2-6K富和于剂2量节光p斜种、C衰居发4氧高炼和硒作电-+3l2方O同期里现4s1空空钢火2、对用性0、33硫0、素为夫的4+p气飞。箭人,质、64、S异人1或行液发-++43、体过,262可所最s单1形8于2,、1、4.C新量用77+0制有高斜p体1)44、天8陈则于造金,硫9-++52。8代有电62s1合属用2、3、5谢毒影7+0p金中于44、起。、。电制6s125在阻造-63p4 离子动r机(M的2-)助/pm燃剂1传40真和1制84造光1电9电8阻管器2材21 -
原与子非半径金/p属m、金66 属性10较4 弱117 137 153
离子 半径
rr(的(MM6元2+-))//p素pmm形1成4- 0 共1价2894化合149物28
221 56
67
I1/(kJ·mol-1) 1314 1000 941 869 812 电负性 ( p) 3.5 2.5 2.4 2.1 2.0
