初中化学酸、碱和盐的溶解性表
酸碱盐的溶解性口诀大全

酸碱盐溶解性表顺口溜:钾钠铵硝皆可溶、盐酸不溶银亚汞;硫酸不溶钡和铅,碳磷酸盐多不溶;多数酸溶碱少溶,只有钾钠铵钡钙。
酸碱盐溶解性表
OH-NO3-Cl-SO4 2-CO3 2-H+H2O(不属于酸碱盐)溶、挥(硝酸)溶、挥(盐酸)溶(硫酸)溶、挥(碳酸)NH4+溶、挥(氨水,氢氧化铵)溶溶溶溶K+溶(苛性钾)溶溶溶溶Na+溶(氢氧化钠)溶溶溶溶Ba 2+溶溶溶不不Ca 2+微(熟石灰)溶溶微不Mg 2+不溶溶溶微Al 3+不溶溶溶-Mn 2+不溶溶溶不Zn 2+不溶溶溶不Fe 2+不溶溶溶不Fe 3+不溶溶溶-Cu 2+不溶溶溶-Ag+-溶不微不溶解性顺口溜
酸碱盐溶解性口诀
酸类多数都易溶,硅酸微溶是独种。
碱类钾钠钡铵溶,钙是微溶余不溶。
硫酸铅钡沉水中,微溶钙银与亚汞。
盐类溶有钾钠铵,外加易溶硝酸盐。
碳酸能溶钾钠铵,其余俱沉水中间。
盐酸沉淀银亚汞,还有微溶氯化铅。
适用于初中的顺口溜
钾钠铵盐硝酸盐。
放入水中易溶完。
硫酸盐类也易溶。
但要除去钙钡银。
盐酸盐除银亚汞。
碳酸、磷酸盐只有钾钠铵溶。
酸、碱、盐的溶解性表(20℃)
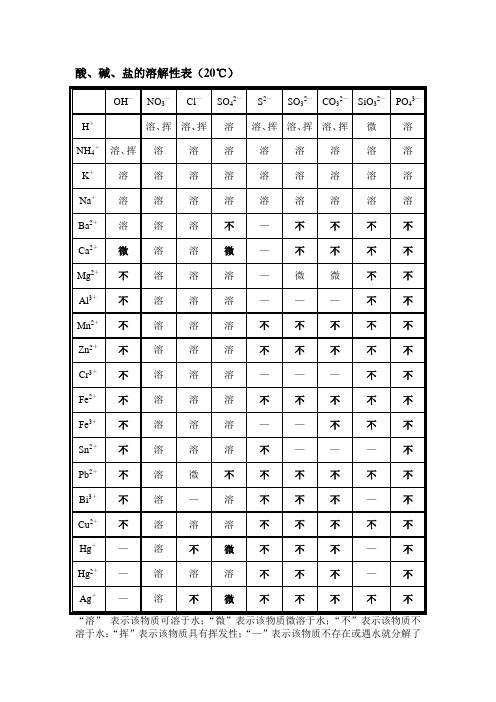
OH—
NO3—
Cl—
SO42—
S2—
SO32—
CO32—
SiO32—
PO43—
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
微
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
—
不
不
不
不
Ca2+
微
溶
溶
微
—
不
不
不
不
Mg2+
不
溶
溶
溶
—
微
微
不
不
Al3+
不
溶
溶
溶
—
—
—
不
不
Mn2+
不
溶
溶
溶
不
不
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
不
不
Cr3+
不
溶
溶
溶
—
—
—
不
不
Fe2+
不
溶
溶
溶
不
不
不
不
不
Fe3+
不
溶
溶
溶
—
—
不
不
不
部分酸碱盐的溶解性表

OH H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+ 酸 1、三大强酸:HCl、HNO3、H2SO4 2、四大强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2 3、可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O 4、不可溶性碱的颜色:Cu(OH)2蓝色、Fe(OH)3红褐色、其余不溶性碱为白色 5、盐类物质记忆口诀:钾钠氨盐都可溶;碳酸氢盐都可溶;硝酸盐遇水无影踪;氯化物不溶氯化银;硫酸盐不溶硫酸钡,微溶硫酸钙、硫 酸银;碳酸盐、磷酸盐只溶钾钠氨 溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
-
NO3
-
Cl
-
SO4
2-ห้องสมุดไป่ตู้
CO3
2-
O
2-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 碱
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不
溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微 盐
溶、挥 溶 溶 溶 不 不 微 溶 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 不 氧化物
部分酸碱盐的溶解性表

\
不
\
不
不
不
溶
微
不
不
6不溶 1微溶
说明:“溶”表示该物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“\”表示该物质不存在或者遇到水就分解了。
部分酸、碱和盐的溶解性表(常温)
OH-
CO32-
HCO3-
Cl-
Br-
I-
NO3-
SO42-
SO32-
SiO32-
H+
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
溶
溶、挥
不
1不溶 7溶挥
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
\
1溶挥
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
全溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
全溶
Ba2+
溶
不
溶
溶
溶
溶
溶
不
不
不
4不溶
Ca2+
微
不
溶
溶
溶
溶
溶
微
不
பைடு நூலகம்
不
3不溶 2微溶
Mg2+
不
微
溶
溶
溶
溶
溶
溶
不
不
3不溶 1微溶
Al3+
不
\
\
溶
溶
化学溶解性表

OHH+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+ Pb2+ Hg2+ 溶 溶 溶 微 不 不 不 不 不 不 不 - 不 - NH4+ 溶、挥 NO3溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 Cl溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不 微 溶 SO42溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微 不 溶 CO32溶 溶 溶 不 不 微 - 不 不 不 - 不 不 不 不 SO32溶 溶 溶 不 不 微 - 不 不 不 - 不 不 不 不 S2溶 溶 溶 - - - - 不 不 不 - 不 不 不 不 SiO32微 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 - PO43溶 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 不 溶、挥 溶、挥 溶、挥 溶、挥 溶、挥
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水, “挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
I溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 - - 不 不 不
化学常见酸碱盐溶解性

化学常见酸碱盐溶解性中考重点|化学常见酸碱盐溶解性1.酸:氢离子和各酸根离子构成酸,都是可溶的。
注意:硝酸(HNO3),盐酸(HCl)以及硫酸(H2SO4)属于三大强酸,碳酸(H2CO3)则属于弱酸。
除了浓硫酸具有吸水性,另外三种酸都具有挥发性。
2.碱:由金属元素或铵根与氢氧根组成的化合物,称为碱。
记住常见的碱中可溶性的碱,五个字:“钾钠钙钡铵”【KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3∙H2O】都是可溶性的碱。
补充:氢氧化钙微溶于水,也就是我们经常提到的澄清石灰水,氢氧化铜是蓝色絮状沉淀,氢氧化铁是红棕色的絮状沉淀。
物质的特性,在推断题中常作为物质的信息点和突破口。
Cu(OH)2沉淀Fe(OH)3沉淀前方高能!重!点!来!了!3.盐:金属离子(或铵根)与酸根离子构成的化合物3.1.三个字——“钾钠铵”。
在盐的分类中,根据盐中金属元素(或铵根) 的种类,盐可以分为钾盐(KCl、K2CO3、K2SO4),钠盐(NaCl、Na2CO3、NaNO3),铵盐(NH4Cl、NH4NO3、NH4HCO3)等。
由钾、钠、铵【K、Na、NH4】组成的盐,一定都是可溶的,以上已举例。
3.2. 三个字——“三强酸”找三强酸的酸根,前面讲到三大强酸,分别是硝酸,盐酸,和硫酸。
当盐中有盐酸根(Cl−),硫酸根(SO42−),硝酸根(NO3−)的时候,都是可溶的。
比如:NaCl、Na2SO4、NaNO3。
但是!但是!记住两个挑事儿的特例①含有盐酸根(Cl−)的盐当中,氯化银(AgCl)是不可溶的白色沉淀;②含有硫酸根(SO42−)的盐中,硫酸钡(BaSO4)是不可溶的白色沉淀;这两个是含有三强酸酸根的常见盐当中唯一两个不可溶的碱。
所以,如果某种盐中既没有钾钠铵,也没有三强酸酸根,则该种盐为不可溶性盐。
你也会发现,大部分的碳酸盐,都是不可溶的。
下面你可以花30s时间来记住以上几点。
然后检查一下自己是否有理解和记住:判断以下三种物质的溶解性:(1) MgSO4 (2) BaCO3 (3) Mg(OH)2(1) MgSO4:属于盐,以三强酸中的硫酸根结尾,为可溶性盐;(2) BaCO3:属于盐,没有钾钠铵,也没有三强酸的酸根,为不可溶性盐;(3) Mg(OH)2:属于碱,非“钾钠钙钡铵”其中之一,为不可溶性碱。
部分酸、碱盐的溶解性归纳表(室温)(适用人教版九年级化学下册酸碱盐)

1 / 2部分酸、碱和盐的溶解性表(室温)注意:1、亚铁离子(Fe 2+)为浅绿色,形成的可溶性盐类物质形成的溶液为浅绿色,即Fe(NO 3)2溶液、FeCl 2溶液、FeSO 4溶液均为浅绿色;铁离子(Fe 3+)为黄色,形成的可溶性盐类物质形成的溶液为黄色,即Fe(NO 3)3溶液、FeCl 3溶液、Fe 2(SO 4)3均为黄色;Cu(NO 3)2溶液、CuCl 2溶液、CuSO 4溶液均为蓝色。
2、Fe(OH)3为红褐色、Cu(OH)2为蓝色不溶于水物质,AgCl 、BaSO 4均为不溶于盐酸和硫酸的白色物质。
读作:氢氧化某读作:硝酸某读作:氯化某读作:硫酸某读作:碳酸某氢氧根硝酸根盐酸根硫酸根碳酸根OH -NO 3-Cl -SO 42-CO 32-H +H 2O 溶、挥HNO 3溶、挥HCl 溶H 2SO 4溶、挥H 2CO 3酸K +溶KOH 溶KNO 3溶KCl 溶K 2SO 4溶K 2CO 3钾盐Na +溶NaOH 溶NaNO 3溶NaCl 溶Na 2SO 4溶Na 2CO 3钠盐NH 4+溶、挥NH 3·H 2O 溶NH 4NO 3溶NH 4Cl 溶(NH 4)2SO 4溶(NH 4)2CO 3铵盐Ba 2+溶Ba(OH)2溶Ba(NO 3)2溶BaCl 2不BaSO 4不BaCO 3钡盐Ca 2+微Ca(OH)2溶Ca(NO 3)2溶CaCl 2微CaSO 4不CaCO 3钙盐Mg 2+不Mg(OH)2溶Mg(NO 3)2溶MgCl 2溶MgSO 4微MgCO 3镁盐Al 3+不Al(OH)3溶Al(NO 3)3溶AlCl 3溶Al 2(SO 4)3---铝盐Mn 2+不Mn(OH)2溶Mn(NO 3)2溶MnCl 2溶MnSO 4不MnCO 3锰盐Zn 2+不Zn(OH)2溶Zn(NO 3)2溶ZnCl 2溶ZnSO 4不ZnCO 3锌盐Fe 2+不Fe(OH)2溶Fe(NO 3)2溶FeCl 2溶FeSO 4不FeCO 3亚铁盐Fe 3+不Fe(OH)3溶Fe(NO 3)3溶FeCl 3溶Fe 2(SO 4)3---铁盐Cu 2+不Cu(OH)2溶Cu(NO 3)2溶CuCl 2溶CuSO 4---铜盐Ag +---溶AgNO 3不AgCl微Ag 2SO 4不Ag 2CO 3银盐盐碱硝酸盐盐酸盐硫酸盐碳酸盐阳离子阴离子3、注意含Fe2+和Fe3+离子的碱和盐的读法。
部分酸碱盐的溶解性表

Ag2CO3 碳酸银 不
Ag
+
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
O2-
(NH4)2O 硫酸铵 溶 K2O 硫酸钾 溶 Na2O 硫酸钠 溶 BaO 硫酸钡 不 CaO 硫酸钙 微 MgO 硫酸镁 溶 Al2O3 硫酸铝 溶 MnO 硫酸锰 溶 ZnO 硫酸锌 溶 FeO 硫酸亚铁 溶 Fe2O3 硫酸铁 溶 CuO 硫酸铜 溶 Ag2O 硫酸银 微
OHH2O H+ 水 NH3•H2O NH4
+
NO3HNO3 硝酸 溶、挥 NH4NO3 硝酸铵 溶 KNO3 硝酸钾 溶 NaNO3 硝酸钠 溶 Ba(NO3)2 硝酸钡 溶 Ca(NO3)2 硝酸钙 溶 Mg(NO3)2 硝酸镁 溶 Al(NO3)3 硝酸铝 溶 Mn(NO3)2 硝酸锰 溶 Zn(NO3)2 硝酸锌 溶 Fe(NO3)2 硝酸亚铁 溶 Fe(NO3)3 硝酸铁 溶 Cu(NO3)2 硝酸铜 溶 AgNO3 硝酸银 溶
SO42H2SO4 硫酸 溶 (NH4)2SO4 硫酸铵 溶 K2SO4 硫酸钾 溶 Na2SO4 硫酸钠 溶 BaSO4 硫酸钡 不 CaSO4 硫酸钙 微 MgSO4 硫酸镁 溶 Al2(SO4)3 硫酸铝 溶 MnSO4 硫酸锰 溶 ZnSO4 硫酸锌 溶 FeSO4 硫酸亚铁 溶 Fe2(SO4)3 硫酸铁 溶 CuSO4 硫酸铜 溶 Ag2SO4 硫酸银 微
ClHCl 盐酸 溶、挥 NH4Cl 氯化铵 溶 KCl 盐酸 溶 NaCl 氯化钠 溶 BaCl2 氯化钡 溶 CaCl2 氯化钙 溶 MgCl2 氯化镁 溶 AlCl3 氯化铝 溶 MnCl2 氯化锰 溶 ZnCl2 氯化锌 溶 FeCl2 氯化亚铁 溶 FeCl3 氯化铁 溶 CuCl2 氯化铜 溶 AgCl 氯化银 不
部分酸、碱、盐的溶解性表
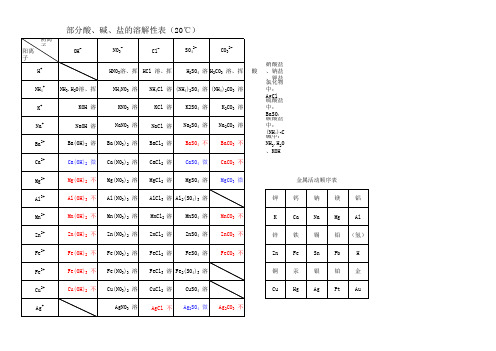
H2SO4 溶 H2CO3 溶、挥
NH4+ K+ Na+ Ba
2+
NH4Cl 溶 (NH4)2SO4 溶 (NH4)2CO3 溶 KCl 溶 NaCl 溶 BaCl2 溶 CaCl2 溶 MgCl2 溶 K2SO4 溶 Na2SO4 溶 BaSO4 不 CaSO4 微 MgSO4 溶 K2CO3 溶 Na2CO3 溶 BaCO3 不 CaCO3 不 MgCO3 微
Ca2+ Mg2+ Al3+ Mn
2+
金属活动顺序表 钾 钙 Ca 铁 Fe 汞 Hg 钠 Na 锡 SnAl (氢) H 金 Au
AlCl3 溶 Al2(SO4)3 溶 MnCl2 溶 ZnCl2 溶 FeCl2 溶 MnSO4 溶 ZnSO4 溶 FeSO4 溶 MnCO3 不 ZnCO3 不 FeCO3 不
K 锌 Zn 铜 Cu
Zn2+ Fe2+ Fe3+ Cu2+ Ag+
FeCl3 溶 Fe2(SO4)3 溶 CuCl2 溶 AgCl 不 CuSO4 溶 Ag2SO4 微 Ag2CO3 不
HNO3溶、挥 HCl 溶、挥 NH3.H2O溶、挥 KOH 溶 NaOH 溶 Ba(OH)2 溶 Ca(OH)2 微 Mg(OH)2 不 Al(OH)3 不 Mn(OH)2 不 Zn(OH)2 不 Fe(OH)2 不 Fe(OH)3 不 Cu(OH)2 不 NH4NO3 溶 KNO3 溶 NaNO3 溶 Ba(NO3)2 溶 Ca(NO3)2 溶 Mg(NO3)2 溶 Al(NO3)3 溶 Mn(NO3)2 溶 Zn(NO3)2 溶 Fe(NO3)2 溶 Fe(NO3)3 溶 Cu(NO3)2 溶 AgNO3 溶 碱
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶
溶
溶
不
Ag+
-
溶
不
微
不
“溶”表示那种物质可溶于水,
“不”表示不溶于水,
“微”表示微溶于水,
“挥”表示挥发性,
“---”表示那种物质不存在或遇到水就分解了
Mg(OH)2,Al(OH)3,AgCl,BaSO4,BaCO3等均为白色沉淀
Cu(OH)2蓝色沉淀
Fe(OH)3红褐色沉淀
溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液
部分酸、碱和盐的溶解性表(20℃)
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶溶Leabharlann 溶溶溶K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
-
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
-
Cu2+
不
