溶液中的铝形态
铝在土壤中的化学行为

铝在土壤中的化学行为铝是一种常见的金属元素,它在土壤中的化学行为具有一定的特点和影响。
本文将从铝的形态、作用机制和影响因素等方面探讨铝在土壤中的化学行为。
1. 铝的形态铝在土壤中以不同形态存在,主要有可交换态铝、水溶态铝和固相态铝。
可交换态铝是指与土壤颗粒表面结合较弱的铝离子,容易与土壤溶液中其他离子发生交换反应。
水溶态铝是指溶解在土壤水溶液中的铝离子,其浓度决定了土壤中铝的毒性。
固相态铝是指与土壤颗粒结合较稳定的铝化合物,如铝氧化物和铝矽酸盐等。
2. 铝的作用机制铝在土壤中的化学行为主要通过以下几种机制影响土壤的性质和植物的生长:(1) 水解作用:铝离子在土壤溶液中发生水解反应,生成氢氧化铝及其多聚体,使土壤溶液的pH值降低。
(2) 离子交换作用:可交换态铝与土壤颗粒表面的其他离子发生交换反应,导致土壤负荷增加。
(3) 毒害作用:水溶态铝可以直接毒害植物根系,抑制植物的生长和养分吸收。
(4) 土壤结构破坏:铝与土壤颗粒结合形成固相态铝化合物,使土壤颗粒结构疏松,导致土壤质地变差。
3. 铝的影响因素铝在土壤中的化学行为受到多个因素的影响,主要包括土壤pH值、有机质含量、土壤类型和水分状况等。
(1) 土壤pH值:土壤pH值是影响铝形态和毒性的重要因素。
酸性土壤中铝的含量较高,容易形成水溶态铝。
(2) 有机质含量:有机质能够与铝形成螯合物,减少水溶态铝的浓度,降低铝的毒性。
(3) 土壤类型:不同土壤类型中的铝含量和形态有所不同,影响了铝的活性和毒性。
(4) 水分状况:水分状况对土壤中铝形态的转化和迁移有一定的影响,过湿或过干条件下铝的毒性可能增强。
铝在土壤中的化学行为是一个复杂的过程,涉及铝的形态转化、作用机制和影响因素等方面。
了解铝在土壤中的化学行为对于合理利用土壤资源、保护环境和提高农作物产量具有重要意义。
铝合金常见的腐蚀形式

铝合金常见的腐蚀形式铝合金常见的腐蚀形式如下:1.点蚀点蚀出现在金属表层非常局部的范围内或位置上,导致洞穴或坑点并向内部延伸,甚至是导致穿孔。
如果坑口的直径比点穴深度小时,称之为点蚀;假如坑口直径超过坑的深度时,可称之为坑蚀。
实际上,点蚀与坑蚀并无严格界限。
铝在含氯化物的水溶液中所出现的为常见的点腐蚀。
形成原因:在铝的腐蚀中,点腐蚀最常见,是由于铝的某一范围的电位与基体电位不同造成的,或由电位与铝基体电位不同的杂质存在造成的。
2.晶间腐蚀此类腐蚀是在晶粒或晶体自身未遭受明显侵蚀情形下,出现在金属或合金晶界处的一类选择性腐蚀,会使材料力学性能剧降,以致导致结构损坏或事故。
晶间腐蚀原因是在某些条件下晶界很活泼,如晶界处有杂质,或晶界处某一合金元素增多或减少,也就是说晶界上必须有一层薄薄的对铝的其余部分呈电负性的范围,它优先腐蚀。
高纯铝在盐酸中及高温水中可出现这类腐蚀,Al-Mg、Al-Zn-Mg、AI-Mg-Si、AI-Cu合金都对晶间腐蚀相对比较敏感。
3.电偶腐蚀铝的特征性腐蚀形态中有一种叫电偶腐蚀。
当一种相对比较活泼的金属如铝(阳极)与一种不太活泼的金属处在相同环境中相触碰时或有导体相联时,形成电偶并造成电流的流动,进而导致电偶腐蚀。
电偶腐蚀又被称为触碰腐蚀或双金属腐蚀。
形成原因:铝的自然电位是负,当铝与别的金属触碰时,铝一直呈阳极,腐蚀加快,近乎任何铝及铝合金都难以规避电偶腐蚀。
当这两种相触碰的金属两者之间的电位差愈大时,电偶腐蚀也愈明显。
应特别注意的是,在电偶腐蚀中,面积因素极为重要,大阴极和小阳极是最不利的搭配。
4.缝隙腐蚀形成原因:同种或异种金属相触碰,或金属与非金属相触碰,就会形成间隙,就会在间隙处或其邻近处形成腐蚀,间隙外没有腐蚀,是由于间隙内氧的缺乏造成的,因为此时形成浓差电池。
缝隙腐蚀与合金种类近乎无关,即使非常耐蚀的合金也会出现。
间隙顶部酸性环境是腐蚀原动力,是堆积物(垢)下腐蚀的一类,6063合金建筑铝型材表面灰浆下腐蚀是一类非常普通的垢下缝隙腐蚀。
铝和冷水反应的现象

铝和冷水反应的现象铝是一种广泛应用的金属材料,其在工业和日常生活中都有着重要的应用。
然而,铝与一些物质如氧气、酸、碱等发生反应,其产生的现象却是截然不同的。
本文着重讨论铝与冷水反应的现象及其背后的化学原理。
一、铝与冷水反应的现象铝与冷水并不会发生激烈的反应,但在一些特殊情况下,可以观察到以下现象:1. 产生微弱的氢气:当将铝片或粉末放入冷水中时,可以观察到一些气泡从铝表面产生并缓慢地上升。
这些气泡其实是氢气,最终逸出水面。
2. 发生微小的爆炸:如果将一块铝片放入水中,并立即用灯火点燃,会观察到铝片瞬间燃烧,并发出短暂的爆响声。
这是因为铝与水反应产生氢气,氢气集聚到一定程度后发生了爆炸反应。
二、铝与水反应的化学原理铝和水反应的化学方程式为:2Al + 3H2O → Al2O3 + 3H2。
在这个化学反应中,铝原子和水分子发生反应,生成了氢气和氧化铝。
氢气是由水中的氧原子和铝原子共同生成的,它一直在铝表面产生并逸出水面。
铝在水中的氧化是一种热力学上的不稳定反应。
铝表面形成了一层氧化铝,这层氧化物能够使铝表面与水离子形成缓慢反应的反应物质,同时也能直接参与反应生成氢气和铝离子。
当铝与水立即反应时,产生的氢气会迅速集聚并达到可燃程度,过量的氢气在被加热的情况下就会发生爆炸反应。
这也是炸弹中的重要成分之一。
三、影响铝与水反应的因素1.温度温度是影响铝和水反应的一个关键因素。
在高温下,铝与水反应更加活跃,产生更多的氢气。
而在低温下,则不太容易产生反应。
2.铝的形态铝的形态也是影响铝与水反应的重要因素。
在粉末的形态下,铝表面积更大,更容易与水反应。
相反,在块状形态下,铝表面积更小,与水的反应更慢。
3.水的形态不同形态的水也会影响铝与水反应。
当水是纯的蒸馏水时,反应速度更慢。
而当水中含有一些酸性物质时,反应速度会更快。
四、铝与水反应的应用铝与水反应广泛应用于制氢和燃料电池技术。
通过加热铝和水的混合物,可以产生大量的氢气。
铝的腐蚀形态

铝及其合金除了在少数介质中呈现全面腐蚀,如碱溶液和磷酸溶液外,一般都发生局部腐蚀。
常见的腐蚀形态:点腐蚀、电偶腐蚀、晶间腐蚀、缝隙腐蚀、丝状腐蚀、层状腐蚀、应力腐蚀形裂与腐蚀疲劳等,这些腐蚀形态在船舶舰艇与海洋设施中都可能发生。
铝合金的应力腐蚀形裂与腐蚀疲劳是在应力(拉应力或交变应力)与腐蚀联合作用下发生的破坏,比较多见于高强度铝合金。
由于破坏发生比较突然,大多发生在受力的结构中,具有极大的瞬间破坏危险,引起学术界和工程界的广泛兴趣并进行了比较细致深入的研究,形成了从实验研究到机里探讨等大量着作。
点腐蚀点蚀又称孔蚀,是在金属中产生针状、点状、小孔状的一种极为局部的腐蚀形态,它是阳极反应的一种独特形式。
点蚀最早是由局部电池引起的,随着时间延长,点蚀速度逐渐放慢。
工业纯铝即1XXX系合金对点蚀有很高的抵抗能力,含有少量Cu的3003合金也有良好的抗蚀性。
工业纯铝的点蚀速度随其纯度的提高而下降,特别是当其Fe、Cu含量低时;Al-Mg 系的5XXX合金也有良好的抗点蚀性能,它们的舰船与海洋设施中用得较多,故可称为海洋变形铝合金。
Al-Mg-Si系6XXX合金既有点蚀倾向又有晶间腐蚀倾向。
硬铝和超硬铝薄板应包覆铝与Al-Zn-Mg合金,以防点蚀。
铝及铝合金的点蚀程度随介质不同而异,田园大气比工业大气和海洋大气中的轻,水中产生的点蚀比大气中的严重,材料表面状态不同点蚀程度也不同,有包铝层的合金的点蚀比未包铝合金的轻得多。
在大气、淡水、海水以及中性水溶液中都会发生点腐蚀,严重的点蚀可导致穿孔。
幸运的是腐蚀孔达到一定深度会停止发展。
铝的抗蚀性比钢及镀锌钢的高得多,钢会一直腐蚀下去,而镀锌钢在镀锌层破坏后会加速剧烈地腐蚀。
点蚀程度还与介质及合金有关。
实验证明,铝合金点腐蚀介质中还必须存在破坏局部钝态的阴离子,如氯离子、氟离子等。
从铝合金系来看,高纯铝不易发生点腐蚀,含铜的铝合金对点腐蚀最敏感、而3XXX系及5XXX系合金有相当强的耐点蚀性能。
测定水中铝的方法
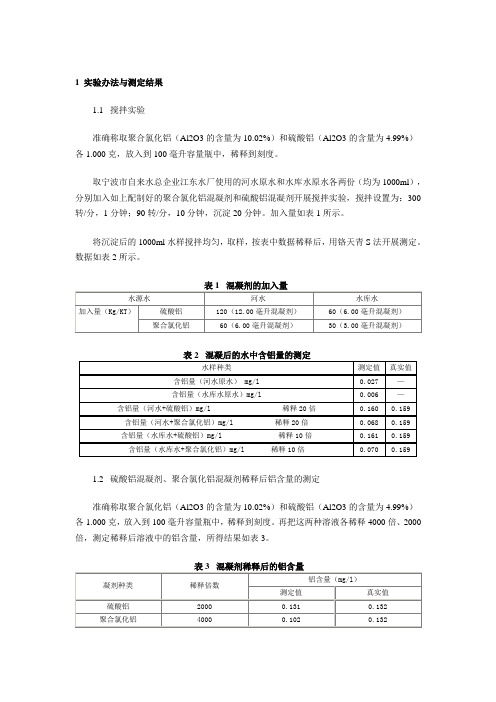
1 实验办法与测定结果1.1 搅拌实验准确称取聚合氯化铝(Al2O3的含量为10.02%)和硫酸铝(Al2O3的含量为4.99%)各1.000克,放入到100毫升容量瓶中,稀释到刻度。
取宁波市自来水总企业江东水厂使用的河水原水和水库水原水各两份(均为1000ml),分别加入如上配制好的聚合氯化铝混凝剂和硫酸铝混凝剂开展搅拌实验,搅拌设置为:300转/分,1分钟;90转/分,10分钟,沉淀20分钟。
加入量如表1所示。
将沉淀后的1000ml水样搅拌均匀,取样,按表中数据稀释后,用铬天青S法开展测定。
数据如表2所示。
1.2 硫酸铝混凝剂、聚合氯化铝混凝剂稀释后铝含量的测定准确称取聚合氯化铝(Al2O3的含量为10.02%)和硫酸铝(Al2O3的含量为4.99%)各1.000克,放入到100毫升容量瓶中,稀释到刻度。
再把这两种溶液各稀释4000倍、2000倍,测定稀释后溶液中的铝含量,所得结果如表3。
1.3 改进铬天青S法(一)实验实验办法和顺序同1.1,只是先将样品倒入一干净烧杯中,将pH调节到3前后,再用碱液(10%氢氧化钠溶液)将pH调节到7前后,或者先用碱液(10%氢氧化钠溶液)将pH 调节到11前后,再用酸液(1+1盐酸)将pH调节到7前后,调节时的pH测定用pH试纸即可。
然后取样,再按照铬天青S法开展测定。
混凝剂为聚合氯化铝、硫酸铝,加入量分别为30Kg/KT、60Kg/KT,测定数据如表3.水库原水含铝量:0.014 mg/L。
1.4 改进铬天青S法(二)实验实验办法和顺序同1.1,但样品先开展前处理,办法为:取一定量的试样,用盐酸溶液将pH调整到1以下,将试样加热近沸,用氢氧化钠溶液将试样pH调整到7前后,再按照铬天青S法开展测定。
测定数据如表5,实验中所用原水为水库水,所用混凝剂为聚合氯化铝,加入量为30 Kg/KT。
1.5 用铬天青S法和改进铬天青S法对水厂滤后水的测定结果在使用硫酸铝混凝剂和聚合氯化铝混凝剂的水厂各取滤后水水样一个,在不加酸不加碱、先加酸(到pH为3)后加碱(到pH为7)、先加碱(到pH为11)后加酸(到pH为7)、先加酸(到pH<1=后加热近沸再加碱(到pH为7)的前处理条件下测定水样中的铝含量,测定数据如表6所示。
三草酸合铁酸钾晶体K3概况

21.(12分)三草酸合铁酸钾晶体K3 [Fe(C3O4 )3]·3H2O可有于摄影和蓝色印刷。
某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1HNO、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1mol·L-1KI、0.1 mol·L-1CuSO4、20% KSCN、澄清石灰水,氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C)观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
验证固体产物中钾元素存在的方法是,现象是。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设假设1:;假设2:;假设3:。
②设计实验方案证明你的假设(不要在答题卡上作答.........)③实验过程根据②中方案进行实验。
在答题卡...上按下表的格式写出实验步骤、预期现象与结论。
四、(本题包括3小题,共34分)22.(12分)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2\、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有(要求写出两条)(2)滤渣I的主要成分有。
(3)从滤渣Ⅱ中可回收利用的主要物质有。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3===Mg(ClO3)2+2NaCl已知四种化合物的溶解度(S )随温度(T )变化曲线如下图所示:①将反应物按化学反应方程式计量数比混合制备Mg(ClO 3)2.简述可制备Mg(ClO 3)2的原因: 。
磷酸铝化学式

磷酸铝化学式磷酸铝是一种重要的有机无机复合物,广泛应用于农业、建筑、医疗、水处理、石油化工等行业。
磷酸铝具有优良的分散性,颗粒状和液体两种形态,可以溶于水、乙醇、甲醇等溶剂。
它的化学式是Al2(H2PO4)3,也叫磷酸铝酸酐,它也可以叫做磷酸三铝,比重是1.83g/cm3。
磷酸铝的制备过程是:用碱性磷酸铝钙溶液(氢磷酸钙溶液),通过反应形成氢氧化铝,氢氧化铝和磷酸钙形成磷酸铝结晶,磷酸铝结晶沉淀在溶液中。
磷酸铝的物化性质:磷酸铝具有优良的沉淀稳定性,由于含有硝酸根离子,磷酸铝具有独特的难溶性,在碱性溶液中能够快速沉淀,呈褐黑色固体,极易溶于水,有着较强的分散效果,可以有效抗菌、防腐蚀,被广泛应用在农药、制氢和水处理行业。
磷酸铝的主要用途是农业种植,用作施肥材料,也可以用作有机污泥处理缓冲剂,能够有效降低氨基酸的毒性,增加有机酸和氨基酸的含量,改善有机污染物的质量。
另外,磷酸铝还可以用于建筑材料的生产,可以改善建筑材料的力学性能,如增加砂浆的弹性和耐水性等,以及用作医药中的保鲜剂,被广泛应用于食品、药物和其他领域。
磷酸铝是一种有用的无机有机杂化材料,由于其优良的分散性和反应灵敏性,使其在农业、建筑和医疗等方面有着广泛的应用,如作为施肥材料、缓冲剂、或是作为建筑材料中用于改善力学性能、或者作为医药中的保鲜剂等等。
磷酸铝具有稳定性强、效果好、环境友好等优点,以及成本低、质量高等特点,可以有效地解决因有机污染而造成的各种问题,成为当前研究的热点之一。
综上所述,磷酸铝是一种有效的物质,具有优异的物理、化学性质和反应速率,可以彻底解决有机污染问题,尤其是在农业、建筑等领域已被广泛应用。
未来,随着研究的深入及质量的不断提高,磷酸铝将在更多领域发挥更大的作用。
新型絮凝剂聚合氯化铝钙中铝形态表征及钙含量测定

2 实验 部 分
1 前 言
聚合 氯 化 铝 是应 用广 泛 的一种 无 机 高分 子 絮 凝 剂 , 实 际 上 是 铝 盐 水 解 过 程 的 中 间产 物 Dz, 它 . ] 其溶 液 中铝 的存 在形 态 是 决 定其 絮 凝 效果 的一 个 关键 的因素 。研究 表 明 , 形 态 是 絮凝 过程 中的 Al 。 最 有效 的形态 , 取有 效 的方 法 获得高 含量 的 A 采 l 。
聚 合氯化铝钙
铝形态
钙含量
A src U sn 2 n C b ta t ig A103a dCa O ̄t ru h hg e eau eb k n o rs lto a e h e f cua t PACC. h o g ih tmp rt r a ea ds u ou inc ng t en w l c ln - t o Thsp p rrsa c e h om f lmiim n acu i h e fo c ln. a igtc nq ec nifu n eo h lm i- i a e e e rh st ef r o u nu a dc lim t en w c ua t B kn eh iu a l e c nt eau n a n l n
含量的影响较 小。在 最佳配 比条件下 , 生成 的 Ak为最佳 ; 焙烧温度提 高 A1 Al含 量减 小, 1 含 量增 大; . 、 Ab 增长酸溶反 应
时问 b 量 减 少 ; 加 酸 用量 , 。A 含 增 、 L含 量减 少 , b 量 增 大 。 含
关键词 新型 絮凝剂
何 丽莉 ( 阳职业技 术 学院 辽 王承 智 辽阳 110 ) 1 0 4
摘 要 以 Al 3和 C C  ̄ 2 0 a O 为原 料 经 高温 焙 烧 酸 溶 制 备 工 艺合 成 新 型 高效 絮 凝 剂 —— 聚 合 氯 化 铝 钙 。 采 用 一F r0 ern
Ferron比色法中不同Ferron体系、溶解度和实验温度等因素对测定单核铝

3 B , 上海金立科学仪器有 限公 司) , 恒 温磁力搅拌 器 ( 8 5 — 2 B,
苏州威尔实验用 品有 限公 司) ,电子天平 ( F A 2 2 0 4 B, 上 海精
为确保 实验条件 的最 优 化 以获得 最准 确灵 敏 的分 析结 果, F e r r o n比色法从建立 到 目前得以广泛应用 的几 十年发展 进程 中,已有众 多研究 者们 分别 从 各 自角度对 F e r r o n比色 法进行 了探索 , 主要考察 了如 F e r r o n显色试剂配方 、适宜 的 p H 范围 、 显色剂 的加入顺序 和加样方式等 因素[ ” ] 。本研究 已对 F e r r o n显色 剂用 量 ( [ - F e r r o n 3 ) 这一 关键 因素进 行 了系
素尚未进行过系统研究 。以 A1 - F e r r o n显色 体系 摩尔 吸光 系数 e 值 为关键 ,系列 考察 了不 同 F e r r o n体 系 、 F e r r o n溶解度 、 实验温度 、 离子强度和参 比体 系这五个 因素对 F e r r o n比色法测定单核铝浓度准确度的影响 。 研究结 果表明 : 不同 F e r r o n体系 、F e r r o n的溶解度 、实验温度是 F e r r o n比色法 中的重要 因素 , 测定 时应 当 予以高度重视 ,否则会影 响测量结 果的准确 性 ; 溶液 的离子强度 以及参 比体 系等则对测定基本无影 响。通过
作者简介 : 金 晶 ,女 ,1 9 8 3 年 生 ,南 京 大 学化 学 系硕 士 研 究 生
第3 5 卷 , 第9 期
2 0 1 5年 9 月
光
谱
学
电化学法制备高Alb含量铝系混凝剂的表征及混凝效能研究

电化学法制备高Alb含量铝系混凝剂的表征及混凝效能研究戴常超 郭嘉钰 刘峻峰 黄琳琳 张 杰 冯玉杰(哈尔滨工业大学环境学院,哈尔滨 150090) 摘要 以铝板作为阴阳两极,氯化钠为电解液,采用电化学方法制备了一种高Alb含量的铝系混凝剂。
采用Al-Ferron逐时络合比色法对Alb含量进行了表征,结果表明:以1mol/L NaCl作为电解液,在电流密度为50A/m2的条件下电解30min制备的铝系混凝剂的Alb含量为73.98%。
对铝系混凝剂投加量进行了优化,结果表明最佳投加量为4.14mg/L。
采用松花江水的连续流混凝试验结果表明:平均浊度去除率为94.25%,平均COD去除率为60.49%,具有良好的应用前景。
关键词 电化学法 铝系混凝剂 高Alb含量 地表水中图分类号:TU992文献标识码:A文章编号:1002-8471(2020)S2-0220-05DOI:10.13789/j.cnki.wwe1964.2020.S2.033基金项目:国家重点研发计划(2017YFA0207203)。
Study on coagulation efficiency of Aluminum coagulant with high Albcontent prepared by electrochemical methodDai Changchao,Guo Jiayu,Liu Junfeng,Huang Linlin,Zhang Jie,Feng Yujie(School of Environment,Harbin Institute of Technology,Harbin 1500904,China)Abstract:A kind of high Albcontent aluminum coagulant was prepared by electrochemicalmethod with aluminum sheet as electrode and sodium chloride as electrolyte.The content of Albwas characterized by Al ferron time-by-time complex colorimetry.The results showed that the Albcontent of aluminum coagulant prepared at the current density of 50A/m2 for 30min in 1mol/LNaCl electrolyte was 73.98%.The dosage of aluminum coagulant was optimized,and the optimaldosage is 4.14mg/L.The experimental results of continuous flow coagulation of Songhua river wa-ter showed that the average turbidity removal rate is 94.25%and the average COD removal rateis 60.49%.Keywords:Electrochemical method;Aluminum coagulant;High Albcontent;Surfacewater source0 引言铝系混凝剂因其自身优良的混凝效能而成为目前应用较为广泛的无机高分子混凝剂之一[1]。
盐雾环境中的6061-T4铝合金腐蚀情况探讨

盐雾环境中的6061-T4铝合金腐蚀情况探讨发布时间:2023-02-22T03:10:27.346Z 来源:《城镇建设》2022年19期5卷作者:石杰文[导读] 6061-T4铝合金是一种高强度、耐腐蚀的工程铝合金,石杰文湖南省产商品质量检验研究院湖南省长沙市 410007摘要:6061-T4铝合金是一种高强度、耐腐蚀的工程铝合金,在航空航天、汽车、船舶等领域得到了广泛的应用。
目前,国内外学者对铝合金材料在盐雾环境中不同介质中的腐蚀行为进行了大量研究,取得了很多重要进展。
本文以6061-T4铝合金为研究对象,针对其在不同盐雾环境下的腐蚀情况进行分析。
关键词:6061-T4铝合金;盐雾腐蚀;腐蚀产物;腐蚀机理6061 铝合金是 6000 系列铝合金的典型代表,属于Al -Mg -Si 系铝合金,是一种冷处理铝锻造产品,随着我国海洋工业的迅速发展,6061铝合金将越来越多地用于海洋工程。
海洋环境的高湿热、高盐雾、高温、强辐射等特性使得其在海洋工程中的使用受到了极大的限制。
因此,对铝合金材料耐海水腐蚀的研究也越来越受到人们的关注。
本文通过对6061铝合金长期暴露于工业海洋大气中的腐蚀行为进行了分析,结果表明:海水中的Cl-会腐蚀和破坏6061铝合金的氧化膜,使其渗入氧化膜而导致点蚀。
1.实验材料6061-T4铝合金试验过程中,采用电子万能试验机对铝合金试样进行拉伸试验。
试样材料为6061-T4铝合金,其表面处理包括喷砂、去氧化皮、电沉积。
测试仪器为HR-10A型X射线衍射仪(XRD),采用扫描电子显微镜(SEM)观察其表面形貌,采用能谱仪测定其物相组成。
溶液配制:实验所用溶液为含有 NaCl、 KCl的盐雾溶液。
为了避免盐雾对铝合金表面造成腐蚀,实验时将两种溶液按不同比例混合,并使用真空泵将混有不同浓度盐雾的两种溶液分别从各自样品中抽出,用蒸馏水冲洗,再通过真空泵抽干后进行测试。
为保证两种盐水不发生化学反应,测试前在每一试样中加入1g硫酸铜做腐蚀试验。
铝与naoh反应

铝与naoh反应
铝与氢氧化钠溶液反应的化学方程式为:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
铝与氢氧化钠溶液反应分为两个步骤,第一步:2Al+6H2O=2Al(OH)3+3H2↑,第二步:Al(OH)3+NaOH=NaAlO2+2H2O,两个方程式叠加得到
2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
铝和氢氧化钠反应方程式:Al+2H2O+2NaOH==2NaAlO2+3H2↑。
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。
铝是活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
但是由于铝化合物的氧化性很弱,铝不易从其化合物中被还原出来,因而迟迟不能分离出金属铝。
氢氧化钠,化学式为NaOH,俗称烧碱、火碱、苛性钠,为一种具有强腐蚀性的强碱,一般为片状或块状形态,易溶于水(溶于水时放热)并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气(潮解)和二氧化碳(变质),可加入盐酸检验是否变质。
铝是一种金属单质,外观呈银白色固体状,与氢氧化钠溶液反应时会先与溶液中的水反应,生成的两性氢氧化物氢氧化铝在与氢氧化钠反应。
柠檬酸铝溶液中铝的形态研究

&) FGHIJK !
OP / QRSTUV !
5W
8?$@A 6
!"#$%&’() ! *+,-$./01 ! 23456789)$:#;<= ! >567?@ #-$:#AB!,C ! DE&F7@ ! GHI: #$JK " L,-$./01MN ! OP&QRS TUVWXYZJT[SWX\]^ " *+_[ I456- ! ‘a$RbScdefgh@56<i:# ! j>k4I&F7 " lmUVWXno pQ@qr$msS]tuvwx # $%&’ ( yz{ f|}~ ! # &)*+, ( "Ez{ #$ ! %&’()E* O+,$&#WX " -./ L+ $%&’ 2 &)*+, z{ #$ )t 01 $%&’ $10L 2 z{ #$ 1 3$4567 I89:; " ><*y $%&’ = >$z{f &)*+,! L?"@AB:; ?C " DE &
?D .’/" D
GHJ9 $%&’( 678 $% Z[+ +, B9<Y 012 32%4(’5671’+ 58 (12 $%K7 ;477 956926(34(’56 ’6 $%&’( 48(23 <’4%A7’7 B’(1 (12 +, =4%>2
3 D
FH+,c! i" X" 7/> LPNPND !FF*C DP. 9+B! ’" g" ] 9+! ’" j" ] i+! F" 9" T+"C8&# +F .0( E8$B(C2$.1 +F /(.C+#("6D !FFJH ## # D ( 6 G3 - klm ! _ \ ‘ ! efg " "# N ee c # 70$1+" U&’"( )"(*&+ = D !FFJH ## # D ( 6 G3 1
铝各形态的浓度的对数(lgc)随溶液ph变化的关系

铝各形态的浓度的对数(lgc)随溶液ph变化
的关系
铝各形态的浓度的对数(lgc)随溶液pH变化的关系如下:
随着溶液pH的增加,铝的不同形态的浓度的对数会发生变化。
一开始,随着溶液pH的增加,铝的可溶性形态(如Al(H2O)63+和
Al(OH)2+)的浓度逐渐增加。
随着溶液pH的继续增加,铝的水解形态(如Al(OH)3)开始出现并逐渐增加其浓度。
当溶液pH达到一定值时,铝的可溶性形态的浓度和水解形态的浓度达到平衡,此时铝的总浓度
最高。
然而,随着溶液pH继续增加,铝的水解形态的浓度开始下降,
而不可溶性形态(如Al(OH)3(s)和Al(OH)3·H2O(s))的浓度逐渐增加。
当溶液pH继续升高时,铝的水解形态几乎完全转化为不可溶性形态,其浓度最高。
总的来说,随着溶液pH的增加,铝的可溶性形态的浓度先增加
后减少,而不可溶性形态的浓度则相反。
这种关系是由铝与水的反应
以及溶液中控制铝形态分布的酸碱性条件所决定的。
铝的形态分析

不同Ph条件下铝的形态分析1.材料与方法1.1 试验设备试验过程中主要采用的仪器和药品:721分光光度计、配备1 cm专用石英比色皿、pH计、温度计、100μg·mL - 1铝标准溶液,实际使用时按需要稀释、1.0 mol·L - 1NH4Ac2HAc缓冲液:称取15.416 g NH4Ac 固体加入去离子水溶解至200 mL ,并用HAc 将pH 值控制在5.5 、1.0 × 10- 2mol· L – 1 8-羟基喹啉(8-HQ)溶液由甲醇配制,使用时按需要进行稀释、NaOH和HNO3 .以上试剂均为分析纯。
1.2.试验方法本研究采用单因素试验法,试验条件及各因素的水平如表1 所示.试验过程中主要考察的铝型态包括:单核铝、溶解铝、悬浮铝和聚合铝;考察的影响因素有温度和pH.为了考察混凝剂种类对饮用水残余铝形态的影响,采用了硫酸铝为自配水的铝源,将配好的水样密封恒温保存并定期取样,试验周期为4~7 d. 水样预处理方法及形态分析方法参见文献[7 ] .2. pH对铝形态分布的影响试验过程中,明矾配水的总铝质量浓度为0.178 mg·L - 1.由图1和图2可知,pH和水力停留时间对氯化铝溶液中的铝形态分布有着重要影响. 当pH =6.5时,悬浮铝为水样中铝的主要存在形态,在初始时刻占总铝质量浓度的65.2% 。
随着pH的升高,悬浮铝的质量分数呈明显下降趋势. 由图1可知(不同pH条件下氯化铝模拟配水中初始时刻的铝形态分布),当pH由6.5增为7.5时,水样中悬浮铝的质量分数将降至总铝的 6.2 %.同时,多核铝质量浓度随pH的升高先增加后减小,在pH = 7.5时达到最高.单核铝和溶解铝有着相似的变化规律.二者在pH> 7.0 时,为铝的主要存在形态;停留时间越长pH越高二者间的质量浓度差值越小.在初始时刻当pH = 6.5 时差值最大,为0.027 mg·L - 1;而4d后,二者质量浓度相当.表明偏酸性环境更有利于多核铝的存在,随着pH 的升高和停留时间的增加多核铝逐渐向其它形态转化.由图2(不同pH条件下反应时间对铝形态分布的影响)可知:当pH < 7.0时,随着水力停留时间的增加,溶液中悬浮铝的质量分数呈上升趋势;而当pH为7.0~8.0 时,各中铝形态的质量浓度变化较小,建议在混凝处理之前将原水的pH控制在 6.5 左右;同时,为提高水质稳定性,防止管道“后沉淀”现象的发生,建议在饮用水进入输配水管网前将其pH调至8.0以上.3.水温和pH对铝形态影响的机制分析对比不同水温和pH条件下各铝形态的变化规律可知,二者对铝形态分布均存在影响,且随着水温和溶液pH的升高或降低具有一致的变化趋势;然而与溶液pH 值相比,铝形态随水温的变化相对较小.当水温由5 ℃升高到25 ℃时,特定pH条件下的硫酸铝配水中无机单核铝或溶解铝的增加量均在0.04 mg·L- 1左右.而当溶液pH在 6.5~7.5 之间变化时,每升高0.1个pH单位将使单核铝和溶解铝质量浓度增加约0.01 mg·L - 1. 由化学反应热力学可知,水温的升高将引起溶液中化学平衡常数的变化.当水温从 5 ℃升高到25 ℃时,水分子的离子积由10- 14.8增为10- 14. 此外,水温的变化也将对铝的水解-聚合反应过程产生一定影响;然而,由于其含铝物种的标准焓变较高,受水温的影响也相对较小,认为水温对反应过程的影响主要表现在其对水解离反应的影响.特定pH条件下,随着水温的升高水的离子积不断增加;由于溶液中的H+浓度基本保持恒定,使得溶液中的OH-浓度也呈现上升趋势,进而对铝的形态分布造成影响.类似地,特定水温条件下水溶液的离子积为恒定值.随着溶液pH值的升高,H+浓度将随之降低,OH-浓度则呈明显上升趋势.由于OH-的强配位作用也将导致溶液中无机单核铝和溶解铝质量浓度的增加.综上分析可知,忽略水温对其它反应过程的影响,其与pH 对溶液中铝形态分布的影响在机制上是一致的:均由溶液中OH-浓度的变化所引起. 为验证上述假设,将水温组和pH 组的单核铝和溶解铝质量浓度对pOH作图,如图5 所示.从中可知,随pOH的增加单核铝和溶解铝质量浓度均呈现明显下降趋势,且 2 组数据间无较大偏差. 这表明水温和pH对铝形态分布的影响可归结为溶液中OH-浓度的影响;因此,采用pOH作为饮用水中铝形态控制的指标将比水温和pH更为有效.4.结论(1)温度和pH对饮用水中铝的形态分布影响显著.当pH > 7.0时,单核铝和溶解铝为铝的主要存在形态且温度和pH值越高,其质量浓度也越高.在偏酸性环境中,悬浮铝和多核铝质量浓度相对较高且随温度和pH的升高呈下降趋势.(2)当pH > 7.0时,单核铝质量浓度占总铝质量浓度的90 %左右,且随水力停留时间的变化不大.采用硫酸铝为混凝剂,同时保持较高的温度和pH则有利于保持铝的形态稳定,保障管网系统的配水能力和消毒效果,但其生物毒性较大. (3)水温和pH对溶液中铝形态分布的影响是一致的,均是由溶液中OH-浓度的改变所引起.文献:1.王文东,杨宏伟,蒋晶,祝万鹏,蒋展鹏水温和pH对饮用水中铝形态分布的影响(1.清华大学环境科学与工程系,北京100084 ;2.北京科技大学土木与环境工程学院,北京100083)2.王文东, 杨宏伟, 祝万鹏, 等. 凝胶层析-荧光分光光度法联用分析饮用水中铝的形态[J ] . 环境化学, 2007 , 26 (1) :79-81.。
铝离子 ph 形态

铝离子 ph 形态
铝离子是一种常见的无机离子,其化学符号为Al3+。
在水中,铝离子的化学性质受pH 值的影响,形态也会发生改变。
以下将对铝离子在不同pH值下的形态进行详细介绍。
1. pH值为1.5-3.5
在pH值为1.5-3.5时,铝离子以Al3+的形式存在,这是因为在强酸性环境下,氢离子占据了水分子中的可供配位的位置,导致铝离子没有足够的水分子包合,只能以其阳离子形式存在。
此时,铝离子的存在形式为[Al(H2O)6]3+,它具有六面体结构,中心是Al3+阳离子,周围配位六个水分子。
在pH值为6.0-8.0的中性环境下,铝离子会形成更加稳定的羟基-铝物种,并存在于溶液中。
此时,铝离子的存在形式为[Al(OH)4]−,其中铝离子和四个氢氧根离子形成了四面体结构。
此种形式的铝离子常常被认为是有利于人体摄入和吸收的。
4. pH值为8.0或以上
在pH值为8.0或以上的弱碱性环境下,铝离子会形成[Al(OH)6]3-,它是由Al3+离子和六个氢氧根离子形成的八面体结构,被称为坩埚结构Al。
在这种形式下,铝离子与周围环境分离,不易被生物吸收,因此可导致铝的积累,引起散发性脑病等疾病。
综上所述,铝离子的形态受pH值的影响,随着环境的变化,它的形态也会发生改变。
在中性或弱酸性环境下,铝离子形成的化合物对于生物没有太大的危害,而在强碱性环境下,铝离子可以处于不稳定的状态,会导致铝的积聚和人体健康的问题。
因此,在日常生活中要尽可能减少使用含铝化合物的物品,给身体健康带来风险。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液中的铝形态
摘要:铝离子在溶液中的反应较复杂,本文根据铝离子在水中的分布进行研究,提出了溶液中铝离子的形态,并在溶液沉淀时的形态和所进行的反应进行研究,
为今后研究奠定了基础。
水中铝的形态转化和分布极为复杂。
在水中铝离子发生水解反应,仅其水解
形态就大致有三类:单体轻基形态、聚合羚基形态和胶体聚合形态或无定形氢氧
化铝溶胶。
此外,溶解态铝能与水中氟离子、硫酸根离子等无机配位体以及水杨酸、腐殖酸或富里酸等有机配位体形成更稳定的无机或有机铝络合物[1]。
铝的水化学反应主要是高价金属离子在水中进行的一系列水解反应,最终生
成氢氧化铝沉淀。
但它不同于其它非过渡金属离子的水解反应[2],主要是:
1.铝离子其有两性化学特征
当铝离子溶解水中时,首先生成水合铝络离子,一般认为是六水分子配位络
合的
Al(H2O)63+。
水合铝络离子在水中会发生一系列水解反应,释放H+质子而
导致水体pH
降低:
在酸性水体中,铝水解生成Al(OH)2+的pH值大致在pH4。
0左右,并且
在pH4一5。
5的水体中,单体羟基络合形态,如Al3+、Al(OH)2+、Al(oH)
十是水中优势的水解形态[3]。
在pH7以上水体中,铝水解生成物主要是Al(OH)3沉淀物。
而在碱性溶液中,如pH9以上,铝水解沉淀物会再溶解而生成铝酸阴
离子Al(OH)-4:
因此,铝的水解形态随pH的变化而具有不同的形态分布,单体形态分布随
pH的变化如图
2.水解铝趋于聚合
水中单体轻基铝络离子强烈趋于聚合反应,生成二聚体、低聚体及高聚体等
多种聚合形态。
例如:单体经基铝〔AI(oH)〕2+在PH升高或OH一增加时,会发先缩聚反应而生成二聚体,缩聚作用原理是在两相邻单体轻基铝络离子的轻基
之间架桥而形成一对具有共同边的八面体结构当水中pH或OH-离子继续增加时。
铝的水解聚合反应会继续下去,生成多种聚合形态,最终生成〔Al(oH)3〕。
无定形沉淀物。
水中铝的聚合形态分布取决于水中铝浓度及其pH值,即与水中
的oH/Al比及动力学因素相关。
在铝离子浓度>10-2M、OH/Al比为1时,主要形
态是聚体或低聚体。
在《5x10-3M、pH5。
8一6。
8的水体中,聚合经基络合形
态一般是优势形态。
在3<OH/Al>1之间,水中就可能会存在多种聚合羟基铝形态,如〔AI6(OH)10〕6+等等。
在OH/Al比》3时,铝水解聚合生成胶的无定形沉淀物。
虽然已提出多种类型的象合形态,但目前较一致的着法是低子13个铝的聚
合物,一般,在OH/AI比<1。
5的铝溶液中,铝水解形态主要是单体或低聚体形态。
在H/Al>2。
2-2。
5时,水中优势形态是13铝高聚物。
聚合铝构象韵稳定性
取决于溶液中的双电层厚度,聚合物的正电荷数及水中OH-离子浓度。
稳定的聚
合构象是呈八面体形的六员环状结构而延展开,其过程是由线型到面型到体型[4]。
由此,铝的水解及聚合反应过程包括:(l)水解生成单体和二聚体形态。
(2)水解缩聚反应,单体或二聚体沿a、b结晶轴定向聚合。
生成二维聚合络离
子而成长为三水铭右奎层片结构。
(3)各层片平行定向缩聚,并沿c轴垂直成
长为三维聚合体。
(4)各铝形悉间继续缩聚聚集而生成无定形胶溶沉淀物。
因此,铝的水解形态大致可分为三类:单体形态、片状聚合形态、三维胶体聚合形态。
兰类不同形悉铝具有不同的化学行为,在特定oH/AI或pH值时,水解平衡
体系中的聚合形态[4]。
3.与水中阴离子络合
在pH4一9的水中,铝的形态转化规律通拿是几以上述三类形态进行的。
但
在水中存在其它阴离子时,会竞争络合水中铝离子,甚至形成更稳定的其它络离子。
水中的氟离子是最强烈钓竞争阴离子,并可形成六种稳定的氟铝络离子。
其
反应平衡常数高达107一102。
因此,即使水中存在极痕量氟离子,也会对溶解
态铝产生显著的影响。
如在含F一2mg/L的天然水中,大部分溶解态铝是以
AIF2+、AIF2+、AIF形态存在。
硫酸根阴离子是天然水体中主要的阴离子成分,因而天然水体中普遍存在两
种磷酸铝络离子,AISO42+和AI(so4)2-。
在硫酸根阴离子含量多而低pH的水
体或在硫化物氧化性水体中,硫酸铝络离子形态将是天然水体的优势形态,但硫
酸铝络合物的平衡常数远小于氟化铝络合物,因而其络合影响也弱得多。
磷酸根和硅酸阴离子也竞争络合水中溶解态铝,形成多种络合沉淀物。
络合
程度取决于pH及铝的形态。
最稳定的单体磷酸铝似是AIPO4。
而在溶液中,磷酸根和硅酸阴离子大部分将被Alb专属吸附聚集而沉淀。
磷酸根阴离子趋于与两个Alb络离子结合。
取代水分子而形成聚磷酸铝沉淀物。
水中这些无机阴离子的存在会增大与其固态氢氧化铝处于平衡状态的溶解铝
浓度。
在水中同时存在几种不同类型的无机阴离子时,其形态分布取决于各反应
的平衡常数、阴离子浓度及pH值。
除无机阴离子外,许多天然有机配位体也具
有迁移络合水及土壤中铝的能力,并可显著增大水中铝的溶解度,如富里酸和腐
殖酸、多酚类、还原糖及有机酸化合物等等。
水杨酸与铝形成六员环状结构的可
溶性鳌合物[5]。
而大多数有机铝络合物,如富里酸和腐殖酸铝络合物通常多以微胶体形式存在,并受其聚集、絮凝沉淀作用的影响。
因而,天然水中的有机铝络合物似是随
时间而逐渐降低。
此外,许多合成有机物,如EDT、ANTA、STPP(三聚磷酸钠)
也都是铝的鳌合剂。
在这些有机物污染水体中,都可能会含较高浓度的溶解态铝
络离子[6]。
4.总结
综上所述,水中铝的化学形态很大程度上取决于水体的pH值、总有机碳和
各种配位体的含量和种类。
通常,在有机碳含量较高或碱度较大的水体中,有机
络合态或聚合羟基络合态是优势形态。
在氟离子浓度较高的水体中,氟化铝络离
子是优势的无机形态。
但在有机碳含量低的酸性水体中,单体经基络离子占优势。
参考文献:
[1]栾兆坤. 水中铝的形态及其形态研究方法[J]. 环境化学,1987,2(6):46-56.
[2]刘文新,栾兆坤,汤鸿霄. 水体中铝(Ⅲ)的化学形态及其生态效应的研究进展[J]. 生态学报,1996,4(16):212-220.
[3]廖敏,谢正苗,王锐.菌藻共生体去除废水中砷初探[J].环境污染与防治,
1997,4(20):11-14
[4]栾兆坤,冯利,汤鸿霄. 水解聚合铝溶液中形态分布的定量模拟研究[J]. 环境科学学报,1995,1(15):39-47.
[5]杨占峰. 白云鄂博矿区饮用水混凝过滤除氟的研究[D]. 西安建筑科技大学,2003.
[6]石慧. 我国淡水环境中铝的水质基准研究[D]. 南昌大学,2016.。
