物质结构元素周期律-复习课-PPT课件(高考复习课件)
合集下载
高考化学二轮复习课件:专题6物质结构和元素周期律

高考二轮专题复习与测试·化学 随堂讲义·第一部分 知识复习专题
专题六 物质结构和元素周期律
栏 目 链 接
K 课标考 纲展示
考纲展示 1.了解元素、核素和同位素的含义。 2.了解原子构成;知道原子序数、核电 荷数、质子数、中子数、核外电子数以及 它们之间的相互关系;了解原子、离子等 概念的含义。 3.了解1~18号元素的原子核外电子排布 ,能用原子结构示意图表示原子和简单离 子的结构。 4.了解元素周期表(长式)的结构(周期、 族)及其应用。掌握同一周期、同一主族元 素的原子结构与元素性质的递变规律。 5.了解元素(主族和零族)原子结构、在周 期表中的位置、性质及其它们之间的关系 。 6.知道化学键的含义。能用电子式、结 构式和结构简式表示某些物质的结构。 7.能识别典型的离子化合物和共价化合 物,能从化学键变化的角度认识化学反应 的实质。
栏 目 链 接
(1) 这些元素中, ________ 是最活泼的金属元素; K
________ 是最活泼的非金属元素; ________ 是最不活泼 F Ar
的元素。
H核心 自 查 (2) 短 周 期 元 素 最 高 价 氧 化 物 对 应 的 水 化 物 中 , HClO4 酸性最强; ________ NaOH 碱性最强; ________ Al(OH)3 呈两性 ________ (填化学式)。 (3)⑥和⑭的金属性较强的是________ ;其最高价氧化 Ca 物 的 水 化 物 的 碱 性 强 弱 顺 序 是 Ca(OH)2>Mg(OH)2 _____________________________________________ 。
栏 目 链 接
栏 目 链 接
H核心 自 查 1.下列 8 种符号: 36Li、37Li、 23Na、 11
专题六 物质结构和元素周期律
栏 目 链 接
K 课标考 纲展示
考纲展示 1.了解元素、核素和同位素的含义。 2.了解原子构成;知道原子序数、核电 荷数、质子数、中子数、核外电子数以及 它们之间的相互关系;了解原子、离子等 概念的含义。 3.了解1~18号元素的原子核外电子排布 ,能用原子结构示意图表示原子和简单离 子的结构。 4.了解元素周期表(长式)的结构(周期、 族)及其应用。掌握同一周期、同一主族元 素的原子结构与元素性质的递变规律。 5.了解元素(主族和零族)原子结构、在周 期表中的位置、性质及其它们之间的关系 。 6.知道化学键的含义。能用电子式、结 构式和结构简式表示某些物质的结构。 7.能识别典型的离子化合物和共价化合 物,能从化学键变化的角度认识化学反应 的实质。
栏 目 链 接
(1) 这些元素中, ________ 是最活泼的金属元素; K
________ 是最活泼的非金属元素; ________ 是最不活泼 F Ar
的元素。
H核心 自 查 (2) 短 周 期 元 素 最 高 价 氧 化 物 对 应 的 水 化 物 中 , HClO4 酸性最强; ________ NaOH 碱性最强; ________ Al(OH)3 呈两性 ________ (填化学式)。 (3)⑥和⑭的金属性较强的是________ ;其最高价氧化 Ca 物 的 水 化 物 的 碱 性 强 弱 顺 序 是 Ca(OH)2>Mg(OH)2 _____________________________________________ 。
栏 目 链 接
栏 目 链 接
H核心 自 查 1.下列 8 种符号: 36Li、37Li、 23Na、 11
《元素周期律》精品教学课件-PPTppt【人教版】

金属性
金属原子 的还原性
金属性: 元素原子失去电子能力的强弱
Al
失3个电子 Al3+
如何判断金属性强弱?
金属性
1、单质跟水(或酸)反
1、反应条件是否苛刻 2、反应现象是否明显 3、反应速度是否快速
应置换出氢气的难易程度
2、最高价氧化物的水化
物的碱性强弱
3、相互置换反应
Fe + Cu2+ == Cu + Fe2+
《元素周期律》精品教学课件-PPTppt 【人教 版】优 秀课件 (实用 教材)
3、下列关于元素周期律的叙述正确的是 B A、随着元素原子序数的递增,原子最外层电子数总是 从1到8重复出现 B、元素的性质随着核电荷数的递增而呈周期性变化 C、随着元素核电荷数的递增,元素的最高化合价从+1 到+7,最低化合价从—7到—1重复出现 D、元素性质的周期性变化是指原子核外电子排布的周 期性变化、原子半径的周期性变化及元素主要化合价的 周期性变化
小结:原子核外电子排布规律
① 能量最低原理:先排K层,排满K层后再排L层,排 满L层再排M层。注意并不以此类推。
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多容纳 8个电子(K为最外层为2个) 次外层最多容纳18个电子(K为次外层为2个) 倒数第三层最多容纳32个电子)
注意:多条规律必须同时兼顾。
实 质
结构
核 外 (电 最子 外排 层布 电呈 子周 数期 )性 变 化
决定 元 素 性 质 呈 周 期 性 变 化
性质
主要化合价 原子半径 金属性、非金属性
原理说明
• 电子层数相同的原子:随着核电荷数的增 加,带正电的原子核电荷数增多,对核外 带负电的电子吸引力增大,原子半径收缩, 最外层电子失去能力越来越弱,得电子能 力越来越强,故元素的金属性减弱,非金 属性增强。
【授课】第一章物质结构元素周期律复习课件【精品】
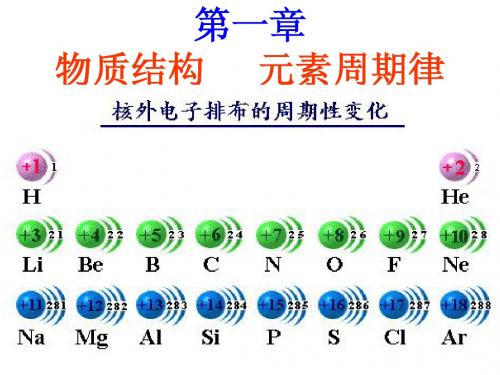
(3)同周期元素随原子序数递增,主要化合价呈 周期性变化;
最高正价:+1~+7 最低负价:由-4~-1
3、元素性质呈周期性变化的根本原因是 元素原子的核外电子排列呈周期性变化 4、同周期、同主族元素结构、性质的递 变规律及金属元素、非金属元素的分区: 分界线左边是金属元素,分界线右边 是非金属元素,最右一个纵行是稀有气体 元素。见下图: 注意:金属性、非金属性是元素的性质
32
1、理解几个概念:
1)元素:具有相同核电荷数(质子数)的同一类原子的总称。 2)核素:把具有一定数目质子和一定数目中子的一种原子 叫做核素。 3)同位素:质子数相同而中子数不同的同一元素的不同 原子互称为同位素。(同一种元素的不同核素互称为同位素 ) 如:1H、2H、3H;12C、14C
1、1H、2H、3H、H+、H2是( D ) A.氢的5种同位素 B.5种氢元素 C.氢的5种同素异形体 D.氢元素的5种不同微粒
· · · ·
· · H Cl · · · ·
· ·
分子结构和化学键
用电子式表示离子键、共价键的形成过程
.
2
+ +
· · H Cl · ·
· ·
H×
×
H
· ·
离子键和共价键的比较
离 子 键 成键微粒 阴、阳离子 成键本质 静电作用 · 表示方法 Na+ [: ·:Cl ] 共 价 键 原子 共用电子对
注意:NH4+的盐除外。
复习课 第一章 物质结构 元素周期律
(一)原子结构
(二)元素周期表 (三)元素周期律
(一)原子结构知识
原子
A
zX
{ {
原子核
决定 元素 质子z 种类
高考化学大一轮复习 第五单元 物质结构 元素周期律 5.2 元素周期表 元素周期律课件

12/12/2021
解解析析
答案
第十五页,共五十七页。
-16-
基础(jīchǔ)梳
理
考点(kǎo diǎn)突破
1.内容与实质
元素(yuán sù)周期律及其应用
原子序数
原子核外电子排布
12/12/2021
第十六页,共五十七页。
-17-
基础(jīchǔ)梳
理
考点(kǎo diǎn)突破
2.元素周期表中主族元素性质的递变规律
构成,共 7 个 副族(B):完全由长周期 元素构成,共 7 个 第Ⅷ族:第8、9、10 纵行,共 3 个纵行 0 族:第 18 纵行
12/12/2021
第五页,共五十七页。
-6-
基础(jīchǔ)
梳理
考点(kǎo diǎn)突破
特别提醒(1)含元素种类最多的族是ⅢB族,共有32种元素。 (2)过渡元素包括7个副族和第Ⅷ族,全部都是金属元素,原子(yuánzǐ)最外层 电子不超过2个(1~2个)。 (3)最外层电子为3~7个的原子一定属于主族元素,且最外层电子数即为主族的
电子层 结构
电子 层数 最外层 电子数
核电荷数(核 内质子数)
原子半径
同周期(左→右)
相同(xiānɡ tónɡ)
递增 (1→7 或 2)
递增 递减
同主族(上→下)
递增
相同 (族序数) 递增
递减
离子半径
12/12/2021
阳离子逐渐 减小 阴离子逐渐 减小
第十七页,共五十七页。
逐渐 增大
-18-
基础(jīchǔ)梳
B、C三种元素组成的18电子微粒是甲醇,能发生氧化反应,D正确。
关闭
重庆市2015高考化学二轮专题复习课件:专题五 物质结构和元素周期律(共184张PPT)

考点突破
审题答题
(6)最外层电子数是次外层电子数4倍的元素:Ne;
(1)理解离子键的形成,能根据离子化合物的结构特征解释其
物理性质。(2)了解共价键,能用键能、键长、键角等说明简 单分子的某些性质。(3)了解配位键的概念及简单配合物。(4) 了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体 的结构与性质的关系。(5)理解金属键的含义,能用金属键理
论解释金属的一些物理性质。(6)了解简单分子如 CH4,H2O,
应用。(5)以第3周期为例,掌握同一周期内元素性质的递变规 律与原子结构的关系。(6)以ⅠA族和ⅦA族为例,掌握同一主 族内元素性质递变规律与原子结构的关系。 (7) 了解金属、非 金属在元素周期表中的位置及其性质递变的规律。 (8) 了解化
学键的定义;了解离子键、共价键的形成。
考点突破 审题答题
2.化学键与物质的性质
专题五
物质结构和元素周期律
考点突破
审题答题Βιβλιοθήκη [最新考纲]1.原子结构与元素周期律 (1) 了解元素、核素和同位素的含义。 (2) 了解原子的构成;了 解原子序数、核电荷数、质子数、中子数、核外电子数以及它 们之间的相互关系。 (3) 了解原子核外电子排布。 (4) 掌握元素
周期律的实质;了解元素周期表 ( 长式)的结构 ( 周期、族 ) 及其
解析
具有相同电子层结构的微粒,核电荷数越大其离子半
径越小。选项 A, Al3+ 具有第二周期稀有气体电子层结构; 选项 B ,磷离子半径大于负二价硫离子的半径;选项 C , Ar 为稀有气体元素,不能形成离子;选项D,K+具有与钙离子 相同的电子层结构,且半径小于负二价硫离子。
答案
D
考点突破
复习章节物质结构元素周期律市公开课金奖市赛课一等奖课件

第4页
质量数:将原子核内所有质子和中子相 对质量取近似整数值加起来,所得值。
质量数(A)=质子数(Z)+中子数(N)
同位素:质子数相同而中子数不同同一个元素不同原子互称同位素。
同位素相对原子质量 同位素一个原子质量
= 碳-12一个原子质量1/12
第5页
例: 一个氧原子16O质量 一个碳原子12C质量1/12
第15页
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
碱
Al(OH)3 + NaOH = NaAlO2 + 2H2O Al(OH)3 + OH– = AlO2– + 2H2O
酸
Al(OH)3是两性氢氧化物
既能跟酸反应,又能跟碱反应氢氧化物, 叫作两性氢氧化物。
4. 阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n
第2页
核外电子数相同(10个电子)微粒
原 子: Ne
分 子: CH4、NH3、H2O、HF 阳离子: Na+、Mg2+、Al3+、 H3O+ 、NH4+ 阴离子: O2- 、F-、OH-
第3页
掌握下列几种概念: 1、什么是质量数?什么是同位素? 2、什么是同位素相对原子质量? 3、元素相对原子质量: 4、元素近似相对原子质量:
周期表结构:
①周期:7个周期(7个横行)(三短,三长,一不完全)
②族:16个族(18个纵行)
7个主族:由短周期和长周期共同构成族
7个副族:仅由长周期元素构成族
Ⅷ族:(8,9,10三个纵行)Fe、Co、Ni等9种元素
质量数:将原子核内所有质子和中子相 对质量取近似整数值加起来,所得值。
质量数(A)=质子数(Z)+中子数(N)
同位素:质子数相同而中子数不同同一个元素不同原子互称同位素。
同位素相对原子质量 同位素一个原子质量
= 碳-12一个原子质量1/12
第5页
例: 一个氧原子16O质量 一个碳原子12C质量1/12
第15页
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
碱
Al(OH)3 + NaOH = NaAlO2 + 2H2O Al(OH)3 + OH– = AlO2– + 2H2O
酸
Al(OH)3是两性氢氧化物
既能跟酸反应,又能跟碱反应氢氧化物, 叫作两性氢氧化物。
4. 阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n
第2页
核外电子数相同(10个电子)微粒
原 子: Ne
分 子: CH4、NH3、H2O、HF 阳离子: Na+、Mg2+、Al3+、 H3O+ 、NH4+ 阴离子: O2- 、F-、OH-
第3页
掌握下列几种概念: 1、什么是质量数?什么是同位素? 2、什么是同位素相对原子质量? 3、元素相对原子质量: 4、元素近似相对原子质量:
周期表结构:
①周期:7个周期(7个横行)(三短,三长,一不完全)
②族:16个族(18个纵行)
7个主族:由短周期和长周期共同构成族
7个副族:仅由长周期元素构成族
Ⅷ族:(8,9,10三个纵行)Fe、Co、Ni等9种元素
2023届高考化学一轮复习 第4讲 元素周期表 化学键 分子结构与性质 课件(103张PPT)

逐渐__增_强___
逐渐__减_弱___
酸性_增__强___
酸性_减__弱___
碱性_减__弱___
碱性_增__强___
_增_强__
_减_弱__
(1) 元素主要化合价 ①F 无正价,O 无最高正价。 ②主族元素最高正价=原子核外最外层电子数(O、F 除外)。 ③非金属元素的最低化合价=原子核外最外层电子数-8(H 除外);最高正化合价 +|最低负化合价|=8(H、B 除外)。
族序数等于周期序数 3 倍的元素 根据金属性、非 金属性最强的元素
金属性推断
非金属性最强的元素
空气中含量最多的元素
根据含量推断 地壳中含量最多的元素
地壳中含量最多的金属元素
元素 _____H_、_B_e_、__A_l ______
___C_、_S_____ __O____
___N_a____ ___F___ ___N___ ___O___
类型 6 利用元素在周期表中的位置推断元素 (2021·南京、盐城一模)图为元素周期表中短周期的一部分,下列说法不正
确的是( A ) A. 离子半径:M->Z2->Y- B. 电负性:Y>M>Z C. 简单气态氢化物的稳定性: Y>M>Z D. Y 元素基态原子的简化电子排布式:[X]2s22p5
逐渐_减__弱___
逐渐__增_强___
非金属性
逐渐__增_强___
逐渐__减_弱___
元素性质 化合物性质
内容 第一电离能 电负性
最高价氧化物对应水化物 氢化物稳定性
同周期(从左到右) 同主族(自上而下)
总体呈现__增__大____的
趋势,但__Ⅱ_A___族和 逐渐__减__小__
高三化学高考备考专题物质结构元素周期律课件

Cl2得到电子的能力比Br2的弱
如N2的电子式错写为N⋮⋮N。
CO2的结构式:O==C==O
正误判断,正确的打“√”,错误的打“×”
氯和溴属于同一主族,最外层电子数相等,D项错误。
备考要点
1.掌握微粒结构与相互作用力间的关系,能熟练书写微粒的电子式。 2.掌握表示微粒结构及组成的化学用语。 3.掌握元素周期表和元素周期律,会利用其推断“位—构—性”
4.理清化学键类型与物质类型的对应关系
5.表示物质组成和结构的化学用语 结构示意图
球棍模型 比例模型
电子式
CO2:
结构式
结构简式 分子式或化
学式
乙醇: 对二甲苯:
明矾:KAl(SO4)2·12H2O
6.常考微粒电子式类型 (1)阳离子,如:Na+、Ca2+、
(2)阴离子,如:
、
、
(3)官能团,如:羟基
对点训练
1.氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依 次增大的同族元素,则镆(Mc)在元素周期表中的位置为_第__七__周__期__Ⅴ__A_族__, 已知某种Mc同位素的质量数为288,则其中子数为__1_7_3_。 2.短周期元素aA+、bB2+、cC2-、dD-具有相同的电子层结构,则 (1)原子序数大小关系: b>a>d>c 。 (2)原子半径大小关系: A>B>C>D 。 (3)离子半径大小关系: C2->D->A+>B2+ 。
解析 等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,B项 正确; 24 g镁、27 g铝的物质的量均为1 mol,1个镁原子和1个铝原子所含的质 子数分别为12、13,故24 g镁与27 g铝中含有的质子数分别为12 mol和13 mol, A项错误; 1个重水分子含有10个中子,1个水分子含有8个中子,1 mol重水与1 mol 水中含有的中子数之比为10∶8(5∶4),C项错误; 1个乙烷分子中含有7对共用电子,而1个乙烯分子中含有6对共用电子, 故1 mol乙烷与1 mol乙烯中,含有的化学键数之比为7∶6,D项错误。
高考化学大一轮复习 第5章 物质结构 元素周期律 51 元素周期表和元素周期律课件

12/12/2021
30
板块一
板块二
板块三第三十页,共五十页。
高考一轮总复习 ·化学 (经典版)
2.用 A+、B-、C2-、D、E、F、G 和 H 分别表示含有 18 个电子的八种微粒(离子或分子),请回答下列问题:
(1)A 元素是___K___、B 元素是__C__l__、C 元素是__S__。 (用元素符号表示)
题组一 等电子粒子的判断与应用 1.A+、B+、C-、D、E 五种粒子(分子或离子)中,每 个粒子均有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。
12/12/2021
28
板块一
板块二
板块第三二十八页,共五十页。
高考一轮总复习 ·化学 (经典版)
请回答: (1)C-的电子式是_____··O_····_··H__]_-______。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: ________N__H_+ 4__+__H_2_O____N__H_3_·_H_2_O_+__H__+_____、 _________H_3_O__+_+__N_H__3=_=_=__N_H__+ 4 _+__H_2_O_________。
高考一轮总复习 ·化学 (经典版)
第5章 物质结构(jiégòu) 元素周期律
第1节 原子结构
12/12/2021
1
板块一
板块二
板块三第一页,共五十页。
高考一轮总复习 ·化学 (经典版)
考试说明
1.了解原子结构示意图、分子式、结构式和结构简式 的表示方法。
2.了解相对原子质量、相对分子质量的定义,并能进 行有关计算。
12/12/2021
高中化学物质结构元素周期表复习

B
地壳中含量最多的金属和非金属 Al O
特
殊
知
识
点 找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd Rh
比较同族元素的 金属性 Ba>Ca>Mg
C
非金属性 F>Cl>Br
比
最高价氧化物的水化物的酸碱性
例如:Ca(OH)2微溶,Mg(OH)2难溶,则Be(OH)2更难溶
三、化学键
相邻的原子之间的强烈相互作用。
类型 比较ຫໍສະໝຸດ 离子键共价键阴、阳离子间通过静电
原子间通过共用电子对所形
概作念用所形成的化学键
成的化学键。
阴、阳离子
成键微粒
得失电子
成 键 条离件子化合物
如NaCl、铵盐
存在 ( 举离例子)半径越小,离子所
带电荷数越多,离子键
* 键 的 强越弱强(判离断子化合物的熔
沸点越高)
原子
电子对共用
非金属单质:H2 共价化合物:HCl 某些离子化合物
通常原子半径越小, 共用电子对越多,共价 键越强,形成的单质或 化合物越稳定
分类
极性键和非极性键
定义 由离子离子键化构合成物的化合物
结构粒子
化学键 类型
阴、阳离子
元
素
名
周期数、族数
称
原子序数
原子量
物理或化学特性 原子结构特征含量等其它特征 元素的性质 原子或离子结构 最高或最低化合价 根据分子式的计算 根据化学方程式的计算
最活泼金属 Cs、最活泼非金属 F2
找 最轻的金属 Li、最轻的非金属 H2 元 最高熔沸点是 C、最低熔沸点是 He
物质结构和元素周期律-PPT课件

答案:D
19
A.质子数为 7
B.最外层电子数为 2
C.核外电子数为 7
D.核外有 3 个电子层
解析:示意图中“+12”表示该原子质子数为 12,核外电子
共 12 个,电子排布情况为:最内层 2 个电子,次外层 8 个电
子,最外层 2 个电子,电子层数为 3,故应选 B、D。
答案:BD
9
大家有疑问的,可以询问和交流
4
典例剖析
【例 1·单选Ⅰ】下列说法正确的是( )。 A.同位素3648Se、6380Zn 具有相同的质量数 B.1210Na 与1119Na 互称为核素 C.氟元素的符号为197F D.同一元素的不同核素互称为同位素 解析:6384Se、6380Zn 质子数不同,不互为同位素,A 错误;2110Na 与1119Na 互称为同位素,B 错误;氟元素的符号为 F,C 错误。 答案:D
2
6.以ⅠA 和ⅦA 族为例,了解同一主族内元素性质递变规 律与原子结构的关系。
7.了解金属、非金属在元素周期表中的位置及其性质递变 的规律。
8.了解化学键的定义。了解离子键、共价键的形成。了解 化学反应的本质。
3
元素、核素、同位素
1.元素 元素是具有相同的___核__电__荷__数___(即__质__子__数__)的一类原子 的总称。 2.核素 核素是具有一定数目质子和一定数目中子的一种原子。 3.同位素 质子数___相__同___而中子数___不__同___的同一元素的不同原子 互称为同位素。
17
3.共价键 (1)定义:通过____共__用__电__子__对__而形成的相互作用。非金属 元素原子之间一般形成共价键。例如,
(2)共价键的分类。 ①非极性键:由同种元素原子形成的共价键,如 H-H 等。 ②极性键:由不同种元素原子形成的共价键,如 H-Cl 等。 4.化学反应的本质 化学反应的本质是旧化学键断裂,新化学键形成的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质结构 元素周期律
复习课
考纲要求:
1.了解元素、核素和同位素的含义。 2.了解原子构成。了解原子序数、核电荷数、质子数、 中子数、核外电子数以及它们之间的相互关系。 3.了解原子核外电子排布。 4.掌握元素周期律的实质。了解元素周期表(长式)的 结构(周期、族)及其应用。 5.以第3周期为例,掌握同一周期内元素性质的递变规 律与原子结构的关系。 6.以IA和VIIA族为例,掌握同一主族内元素性质递变规 律与原子结构的关系。 7.了解金属、非金属在元素周期表中的位置及其性质递 变的规律。 8.了解化学键的定义。了解离子键、共价键的形成。
数是内层电子数的2倍,元素YA是l 地壳中含量最丰富的 金属元素,SZ原子的最外层电子数是其电子层数的2倍。 下列说法错误的是(A )
A. 元素W、X的氯化物中,各原子均满足8电子的稳定
结构 LiCl
CCl4
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生
原子电子层结构特征
——短周期元素原子的排布特征
⑥⑦电 次子 外层 层数电与子最数外是层 最电 外子 层数 电相 子等数的2倍原的子原是子HAl、Be;、 是 Li、Si;
⑧最外层电子数是内层电子总数一半的原子 是 Li、P ; ⑨族序数等于周期数元素 H、Be、Al ; ⑩最高正价与最低负价代数和为零的元素 C、Si;
;
②只含共价键的有③ ⑤ ⑥ ⑦;
③既含离子键又含共价键的有① ② ⑨ ;
④不含化学键的有 ⑧
;
⑤属于离子化合物的有 ① ② ④ ⑨ ;
⑥属于共价化合物的有 ⑤ ⑥ ⑦ 。
物质中化学键的存在
(1)离子化合物中一定有离子键,可能还有共价键。如 (NH4)2SO4、Na2O2等。 (2)共价化合物中只有共价键,一定没有离子键,如CH4、 CO2、H2SO4等。 (3)非金属单质中只有共价键,如Cl2、O2、金刚石等。 (4)构成稀有气体的单质分子,是单原子分子,分子中不 存在化学键。 (5)非金属元素之间也可以形成离子键,如NH4Cl中存在 离子键。 (6)活泼金属与活泼非金属形成的化合物不一定含离子键, 如AlCl3为共价化合物。 (7)离子化合物熔融时可以导电,共价化合物熔融时不导 电。
2011-2014全国课标卷
题号 2014
2013
2012
2011
内容 原子结构推 原子结构
断
推断
原子结构、 原子结构、
元素周期律 元素周期律
推断
推断
形式:选择题 分值:6分
例1:(2011新课标)
Li
短周期元素W、X、Y和Z的原子序数依次增大。元素W
是制备一种高效电池的重要材料,CX原子的最外层电子
2. 顺序(原子序数依次增大) 3.原子电子层结构特征 4. 元素的特征
原子电子层结构特征
记熟短周期元素的原子或离子的结构示意图, 尤其是特殊的电子层结构 注意:记熟是准确快速解题的前提
原子电子层结构特征
——短周期元素原子的排布特征
①原子核中无中子的原子是 H , ②最外层有一个电子的原子是 H、L;i、Na ③最外层有两个电子的原子是 He、Be、Mg ; ④最外层电子数等于次外层电子数的原子为 Be ; ⑤最外层电子数是次外层电子数2倍的原子 是C; 最外层电子数是次外层电子数3倍的原子是 O ;
元素的特征 关键是平时的积累
元素的特征
——核电荷数为1~18的元素的特征性质
①气态密度最小,原子核中只有质子没有中子, 原子序数、电子层数、最外层电子数三者均相等 的元素 H ; ②单质硬度最大,熔沸点最高,形成化合物种类最 多,正负化合价代数和为零,气态氢化物中含氢 量最高,可用来测定文物年代的元素 C ; ③原子半径最大的元素 Na ,最小的是 H 。
成
D. 元素Z可与元素X形成共价化合物XZ2
例2:(2012新课标 )
H
短周期元素W、X、Y、Z的原子序数依次增大,其中W
的阴离子的核外电子数与X、Y、Z原子的核外内层电子
数年而相代ZN不同,e能。 工C形业X成的上双一采原种用子核液分素态子在空。考气根古分据时馏以常方上用法叙来来述鉴生,定产N下一或Y列些的O说文单法物质中的,
正确的是( C)
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的
化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的
化合物的沸点
我们的问题
—推断能力有待提高
我们的问题
—基础知识要落实
例1:(2011新课标全国) 短周期元素W、X、Y和Z的原子序数依次增大。元素W 是制备一种高效电池的重要材料,X原子的最外层电子 数是内层电子数的2倍,元素Y是地壳中含量最丰富的 金属元素,Z原子的最外层电子数是其电子层数的2倍。
例 X原 H、5子:YO序、(2数NZ0a、1依2SM次天、增津CG大∙改l五。编种X)元、素Z同分主属族三,个可短形周成期离,子且
化合物ZX;Y、M同主族,可形成MY2、MY3两
种分子。 回答下列问题:
第二周期
⑴Y在元素周期表中的位置为 第IIA族 。
⑵上述元素的最高价氧化物对应的水化物酸性
最强的是HClO4(写化学式),非金属气态氢化物
例2:(2012新课标 ) 短周期元素W、X、Y、Z的原子序数依次增大,其中 W的阴离子的核外电子数与X、Y、Z原子的核外内层 电子数相同。X的一种核素在考古时常用来鉴定一些文 物的年代,工业上采用液态空气分馏方法来生产Y的单 质,而Z不能形成双原子分子。
信息给出方式
1. 范围(短周期元素、或前20号元素)
元素的特征
——核电荷数为1~18的元素的特征性质
④空气中含量最多的元素或气态氢化物的水溶液
呈碱性的元素是 N ;
⑤地壳中含量最多的元素、氢化物沸点最高的元
素或氢化物在通常情况下呈液态的元素是 O ;
⑥元素的气态氢化物和它的最高价氧化物的水化
物能起化合反应的元素是 N ;
⑦最轻的金属单质是 Li
;
⑧在空气中能自然的是 P ;
⑨常用作半导体材料的是 Si ;
⑩用作照明弹的是 Mg ,用作烟幕弹的是 P 。
问题考查知识点
1.元素位置(周期、族) 2.原子、离子半径比较(学案最后第1点) 3.元素之间组成的微粒的化学式、电子式、 结构式、化学键类型、化学反应等
4.根据同周期、同主族元素递变规律,比较元 素的金属性、非金属性;气态氢化物稳定性、 最高价氧化物对应水化物的酸碱性、离子的氧 化性或还原性
微粒半径大小比较的方法
(1)先看电子层数:层数越多,半径越大 (2)层数相同看核电荷数:核电荷数越多,半径 越小 (3)层数和核电荷数都相同看核外电子数:电子 数越多,半径越大 如Fe3+<Fe2+,Cl<Cl-
A、B、C三种元素的原子序数依次为a、b、c,它
们的离子An+、Bn-、Cm-具有相同的电子层结构,
非属性越强:单质与氢气化合越容易 氢化物越稳定
最高价氧化物对应水化物酸性越强 非金属阴离子还原性越弱
强 氢化物还原性越弱
强
金属性越强:单质与水或酸反应越剧烈 最高价氧化物对应水化物碱性越强 金属阳离子氧化性越弱
例3:(2012海南) 下列有关化学用语使用正确的是(BD)
A.NH4Br的电子式: B.S2-的结构示意图:
还原性最强的是 H2S (写化学式)。
⑶Y、G的单质或两元素之间形成的化合物可作
水消毒剂的有
(写出其中两种物质的
化学式)。 O3、Cl2、ClO2
且n>m,则a、b、c由大到小的排列顺序
是 a>c>b ;离子半径由大到小的排列顺序
是
;原子半径由小到大的顺序是 C<B<A。
Bn->Cm->Aห้องสมุดไป่ตู้+
【2014全国I】X、Y、Z均为短周期元索,X、Y处
于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+
和Z-具有相同的电子层结构。下列说法正确的是
C.乙酸的分子式:CH3COOH D.原子核内有l8个中子的氯原子:
例4:(2012北京) 已知33As、35Br位于同一周期,下列关系正确的 是( C) A.原子半径:As>Cl>P B.热稳定性:HC1>AsH3>HBr C.还原性:As3−>S2−>Cl− D.酸性:H3AsO4>H2SO4>H3PO4
A.原子最外层电子数:X>Y>Z
B
B.原子序数: X>Y>Z
C.单质沸点: X>Y>Z
D.离子半径: X2->Y+>Z—
化学键
化学键
离子键
共价键
极性键 非极性键
化学键
(1)对于下列物质:①NaOH ②Na2O2 ③Cl2
④NaCl ⑤C2H6 ⑥H2O⑦AlCl3 ⑧Ar ⑨NH4Cl
①只含离子键的有 ④
复习课
考纲要求:
1.了解元素、核素和同位素的含义。 2.了解原子构成。了解原子序数、核电荷数、质子数、 中子数、核外电子数以及它们之间的相互关系。 3.了解原子核外电子排布。 4.掌握元素周期律的实质。了解元素周期表(长式)的 结构(周期、族)及其应用。 5.以第3周期为例,掌握同一周期内元素性质的递变规 律与原子结构的关系。 6.以IA和VIIA族为例,掌握同一主族内元素性质递变规 律与原子结构的关系。 7.了解金属、非金属在元素周期表中的位置及其性质递 变的规律。 8.了解化学键的定义。了解离子键、共价键的形成。
数是内层电子数的2倍,元素YA是l 地壳中含量最丰富的 金属元素,SZ原子的最外层电子数是其电子层数的2倍。 下列说法错误的是(A )
A. 元素W、X的氯化物中,各原子均满足8电子的稳定
结构 LiCl
CCl4
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生
原子电子层结构特征
——短周期元素原子的排布特征
⑥⑦电 次子 外层 层数电与子最数外是层 最电 外子 层数 电相 子等数的2倍原的子原是子HAl、Be;、 是 Li、Si;
⑧最外层电子数是内层电子总数一半的原子 是 Li、P ; ⑨族序数等于周期数元素 H、Be、Al ; ⑩最高正价与最低负价代数和为零的元素 C、Si;
;
②只含共价键的有③ ⑤ ⑥ ⑦;
③既含离子键又含共价键的有① ② ⑨ ;
④不含化学键的有 ⑧
;
⑤属于离子化合物的有 ① ② ④ ⑨ ;
⑥属于共价化合物的有 ⑤ ⑥ ⑦ 。
物质中化学键的存在
(1)离子化合物中一定有离子键,可能还有共价键。如 (NH4)2SO4、Na2O2等。 (2)共价化合物中只有共价键,一定没有离子键,如CH4、 CO2、H2SO4等。 (3)非金属单质中只有共价键,如Cl2、O2、金刚石等。 (4)构成稀有气体的单质分子,是单原子分子,分子中不 存在化学键。 (5)非金属元素之间也可以形成离子键,如NH4Cl中存在 离子键。 (6)活泼金属与活泼非金属形成的化合物不一定含离子键, 如AlCl3为共价化合物。 (7)离子化合物熔融时可以导电,共价化合物熔融时不导 电。
2011-2014全国课标卷
题号 2014
2013
2012
2011
内容 原子结构推 原子结构
断
推断
原子结构、 原子结构、
元素周期律 元素周期律
推断
推断
形式:选择题 分值:6分
例1:(2011新课标)
Li
短周期元素W、X、Y和Z的原子序数依次增大。元素W
是制备一种高效电池的重要材料,CX原子的最外层电子
2. 顺序(原子序数依次增大) 3.原子电子层结构特征 4. 元素的特征
原子电子层结构特征
记熟短周期元素的原子或离子的结构示意图, 尤其是特殊的电子层结构 注意:记熟是准确快速解题的前提
原子电子层结构特征
——短周期元素原子的排布特征
①原子核中无中子的原子是 H , ②最外层有一个电子的原子是 H、L;i、Na ③最外层有两个电子的原子是 He、Be、Mg ; ④最外层电子数等于次外层电子数的原子为 Be ; ⑤最外层电子数是次外层电子数2倍的原子 是C; 最外层电子数是次外层电子数3倍的原子是 O ;
元素的特征 关键是平时的积累
元素的特征
——核电荷数为1~18的元素的特征性质
①气态密度最小,原子核中只有质子没有中子, 原子序数、电子层数、最外层电子数三者均相等 的元素 H ; ②单质硬度最大,熔沸点最高,形成化合物种类最 多,正负化合价代数和为零,气态氢化物中含氢 量最高,可用来测定文物年代的元素 C ; ③原子半径最大的元素 Na ,最小的是 H 。
成
D. 元素Z可与元素X形成共价化合物XZ2
例2:(2012新课标 )
H
短周期元素W、X、Y、Z的原子序数依次增大,其中W
的阴离子的核外电子数与X、Y、Z原子的核外内层电子
数年而相代ZN不同,e能。 工C形业X成的上双一采原种用子核液分素态子在空。考气根古分据时馏以常方上用法叙来来述鉴生,定产N下一或Y列些的O说文单法物质中的,
正确的是( C)
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的
化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的
化合物的沸点
我们的问题
—推断能力有待提高
我们的问题
—基础知识要落实
例1:(2011新课标全国) 短周期元素W、X、Y和Z的原子序数依次增大。元素W 是制备一种高效电池的重要材料,X原子的最外层电子 数是内层电子数的2倍,元素Y是地壳中含量最丰富的 金属元素,Z原子的最外层电子数是其电子层数的2倍。
例 X原 H、5子:YO序、(2数NZ0a、1依2SM次天、增津CG大∙改l五。编种X)元、素Z同分主属族三,个可短形周成期离,子且
化合物ZX;Y、M同主族,可形成MY2、MY3两
种分子。 回答下列问题:
第二周期
⑴Y在元素周期表中的位置为 第IIA族 。
⑵上述元素的最高价氧化物对应的水化物酸性
最强的是HClO4(写化学式),非金属气态氢化物
例2:(2012新课标 ) 短周期元素W、X、Y、Z的原子序数依次增大,其中 W的阴离子的核外电子数与X、Y、Z原子的核外内层 电子数相同。X的一种核素在考古时常用来鉴定一些文 物的年代,工业上采用液态空气分馏方法来生产Y的单 质,而Z不能形成双原子分子。
信息给出方式
1. 范围(短周期元素、或前20号元素)
元素的特征
——核电荷数为1~18的元素的特征性质
④空气中含量最多的元素或气态氢化物的水溶液
呈碱性的元素是 N ;
⑤地壳中含量最多的元素、氢化物沸点最高的元
素或氢化物在通常情况下呈液态的元素是 O ;
⑥元素的气态氢化物和它的最高价氧化物的水化
物能起化合反应的元素是 N ;
⑦最轻的金属单质是 Li
;
⑧在空气中能自然的是 P ;
⑨常用作半导体材料的是 Si ;
⑩用作照明弹的是 Mg ,用作烟幕弹的是 P 。
问题考查知识点
1.元素位置(周期、族) 2.原子、离子半径比较(学案最后第1点) 3.元素之间组成的微粒的化学式、电子式、 结构式、化学键类型、化学反应等
4.根据同周期、同主族元素递变规律,比较元 素的金属性、非金属性;气态氢化物稳定性、 最高价氧化物对应水化物的酸碱性、离子的氧 化性或还原性
微粒半径大小比较的方法
(1)先看电子层数:层数越多,半径越大 (2)层数相同看核电荷数:核电荷数越多,半径 越小 (3)层数和核电荷数都相同看核外电子数:电子 数越多,半径越大 如Fe3+<Fe2+,Cl<Cl-
A、B、C三种元素的原子序数依次为a、b、c,它
们的离子An+、Bn-、Cm-具有相同的电子层结构,
非属性越强:单质与氢气化合越容易 氢化物越稳定
最高价氧化物对应水化物酸性越强 非金属阴离子还原性越弱
强 氢化物还原性越弱
强
金属性越强:单质与水或酸反应越剧烈 最高价氧化物对应水化物碱性越强 金属阳离子氧化性越弱
例3:(2012海南) 下列有关化学用语使用正确的是(BD)
A.NH4Br的电子式: B.S2-的结构示意图:
还原性最强的是 H2S (写化学式)。
⑶Y、G的单质或两元素之间形成的化合物可作
水消毒剂的有
(写出其中两种物质的
化学式)。 O3、Cl2、ClO2
且n>m,则a、b、c由大到小的排列顺序
是 a>c>b ;离子半径由大到小的排列顺序
是
;原子半径由小到大的顺序是 C<B<A。
Bn->Cm->Aห้องสมุดไป่ตู้+
【2014全国I】X、Y、Z均为短周期元索,X、Y处
于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+
和Z-具有相同的电子层结构。下列说法正确的是
C.乙酸的分子式:CH3COOH D.原子核内有l8个中子的氯原子:
例4:(2012北京) 已知33As、35Br位于同一周期,下列关系正确的 是( C) A.原子半径:As>Cl>P B.热稳定性:HC1>AsH3>HBr C.还原性:As3−>S2−>Cl− D.酸性:H3AsO4>H2SO4>H3PO4
A.原子最外层电子数:X>Y>Z
B
B.原子序数: X>Y>Z
C.单质沸点: X>Y>Z
D.离子半径: X2->Y+>Z—
化学键
化学键
离子键
共价键
极性键 非极性键
化学键
(1)对于下列物质:①NaOH ②Na2O2 ③Cl2
④NaCl ⑤C2H6 ⑥H2O⑦AlCl3 ⑧Ar ⑨NH4Cl
①只含离子键的有 ④
