第12章d区元素和f区元素[1].
第12章-d区元素和f区元素知识分享

第12章d区元素和f区元素【12-1】试用d区元素价电子层结构的特点来说明d区元素的特性。
解:d 区元素最后一个电子填充到d 轨道上,其价层电子组态为:(n-1)d1-8ns1-2,位于周期表的中部,包括ⅢB -ⅦB和Ⅷ族元素,它们都是过渡元素,每个元素都有多种氧化值。
同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。
同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。
各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。
同副族过渡元素的电离能递变不很规则。
熔点、沸点高, 密度大, 导电性、导热性、延展性好。
在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。
化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。
或:d 区元素价电子层结构是(n-1)d1-8ns1-2。
它们ns轨道上的电子数几乎保持不变,主要差别在于(n-1)d 轨道上的电子数不同。
又因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,由此构成了d区元素的一些特性:全部是金属,原子半径小,密度大,熔、沸点高,有良好的导热、导电性能,化学性质相近。
大多具有可变的氧化态。
由于d轨道有未成对电子,水合离子一般具有颜色。
由于所带电荷高,离子半径小,且往往具有未充满的d电子轨道,所以容易形成配合物。
【12-2】完成下列反应式:(1)TiO2+H2SO4(浓)→(2)TiO2++Zn+H+→(3)TiO2+C+Cl2→(4)V2O5+NaOH→(5)V2O5+H2SO4→(6)V2O5+HCl→(7)VO2++H2C2O4+H+→解:(1)TiO2 + H2SO4 (浓) = TiOSO4 + H2O(2)2TiO2+ + Zn + 4 H+ = 2 Ti3+ + Zn2+ +2 H2O(3)TiO2 + 2 C + 2 Cl2 (加热) = TiCl4 + 2 CO(4)V2O5 + 6 NaOH = 2 Na3VO4 + 3 H2O(5)V2O5 + H2SO4 = (VO2)2SO4 + H2O(6)V2O5 + 6 HCl = 2 VOCl2 + Cl2 + 3 H2O(7)2VO+ + H2C2O4 + 2 H+ = 2VO2+ + 2CO2 +2H2O【12-3】在酸性溶液中钒的电势图为已知φθ(Zn2+/Zn)=-0.76V, φθ(Sn2+/Sn)=-0.14V, φθ(Fe3+/Fe2+)=0.77V。
无机化学ds区、d区和f区过度元素ppt课件

上页 下页 目录 返回
8.2 铜族和锌族化合物 8.2.1 概述 价电子构型: (n-1)d10ns1-2 对于铜族元素,又称IB族,可失去s上的电子,又可失 去d上电子,氧化数+1、+2、+3。常见的是:Cu→+2, Ag→+1,Au→+3。 因 IB 族离子具有较强的极化力,变形性也大,故其二 元化合物一般有相当程度的共价性,难溶于水。 对于ⅡB族,只能失去最外层2个电子,形成+2价化合 物。汞有+1(以双聚离子[Hg-Hg]2+形式存在) 从 Zn2+→Cd2+→Hg2+ 极化力和变形性依次增强,当与 易变形的阴离子形成的化合物,有相当程度的共价性, 所以Hg2+的这类化合物溶解度较小,且显色。
上页 下页 目录 返回
AgNO3: 最重要的可溶性银盐,Ag与65%HNO3,反应后制得, Ag+具有氧化性 。 遇光或加热易分解而析出银,注意保存在棕色瓶中。 2AgNO3→2Ag+2NO2+O2 AgI在人工降雨中作冰核形成剂 HgCl2: Hg取sp杂化,为共价化合物,直线构型。熔点较低 (280℃),易升华,故俗名升汞,能溶于水(25℃, 7g/100g水),有毒,稀溶液可杀菌,∴外科用作手术器 械的消毒剂。
无机化学ds区 、d区和f区过 度元素
8.1 过渡元素概述
8.1.1 基本划区 价电子构型:(n-1)d1-10ns1-2 铜族:货币元素 锌族:低熔点重金属;汞(常温下唯一的一种液体金属) 钒族:酸土元素 铁系元素 铂系元素 镧系元素和锕系元素
上页 下页 目录 返回
8.1.2 过渡元素的特性 ● 过渡元素都是金属 ● 许多元素形成多种氧化态 除了s电子参与成键,d电子也部分或全部参与成键( ⅡB族除外) ,从而导致丰富的氧化还原行为。 ● 过渡元素的水合离子多具有特征颜色 过渡元素的离子在水溶液中常呈现一定的颜色,这与该 离子存在未成对d电子有关, d-d跃迁,一般d0, d10没有颜 色。 ● 形成配合物的能力比较强 过渡元素的离子存在空的ns,np和部分填充或全空的(n1)d轨道,可接受配位体的出对孤对电子。
高中《无机化学》第十六至十八章测试题及答案

高中《无机化学》第十六至十八章测试题及答案(d区元素、f区元素)(总9页)-本页仅作为预览文档封面,使用时请删除本页-高中《无机化学》第十六至十八章测试题及答案(d区元素、f区元素)第十六章 d区元素(一)一、填空题1、在所有过渡元素中,熔点最高的金属是 W ,熔点最低的是 Hg ,硬度最大的是 Cr ,密度最大的是 Os ,导电性最好的是 Ag ,耐海水腐蚀的是Ti 。
2、分别写出下列离子的颜色:[Fe(H2O)6]2+淡绿色,FeO42-紫色,[FeCl4]-黄色,[Fe(H2O)6]3+淡紫色,[Ti(H2O)6]3+紫色,VO43-淡黄色,[Co(H2O)6]2+粉红色,[Mn(H2O)6]2+粉红色,[Ni(H2O)6]2+绿色。
3、CrCl3溶液与氨水反应生成灰绿色的 Cr(OH)3沉淀该产物与NaOH溶液反应生成亮绿色的 Cr(OH)4-。
4、锰在自然界主要以软锰矿的形式存在,在强氧化剂(如KClO3)作用下碱熔时只能得到 +6 价锰的化合物,而得不到高锰酸盐,这是因为后者在碱中和受热均分解。
5、K2Cr2O7(s)与浓H2SO4反应生成的氧化物为 CrO3,它为橙红色,遇酒精立即着火,生成铬的一种绿色氧化物,其化学式为 Cr2O3。
KMnO4(s)与浓H2SO4作用生成的氧化物为 Mn2O7;MnO2与浓H2SO4反应生成的气体是O2。
6、高锰酸钾是强氧化剂,它在酸性溶液中与H2O2反应的主要产物是 O2和 Mn2+,它在中性或弱碱性溶液中与Na2SO3反应的主要产物为 SO42-和MnO2。
7、在强碱性条件下,KMnO4溶液与MnO2反应生成绿色的 K2MnO4;在该产物中加入硫酸后生成紫色的 KMnO4和褐色的 MnO2。
8、三氯化铁蒸气中含有的聚合分子化学式为 Fe2Cl6,其结构与金属 Al 的氯化物相似。
FeCl3能溶于有机溶剂。
9、既可用于鉴定Fe3+,又可用于鉴定Co2+的试剂是 KCNS ,当Fe3+存在时,能干扰Co2+的鉴定,可加入 NaF 因生成 FeF63-而将Fe3+掩蔽起来,消除对Co2+鉴定的干扰。
元素周期表口诀

周期表化学元素周期表图集(20张)的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目)递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。
沿着周期表向下,周期的长度逐渐上升,并按元素的电子排布划分出s区元素、p区元素、d区元素和f区元素。
而同一栏中的则称为同一族,同一族的元素有着相似的化学性质。
在印刷的周期表中,会列出元素的符号和原子序数。
而很多亦会附有以下的资料,以元素X为例:A:质量数(Mass number) ,即在数量上等于原子核(质子加中子)的粒子数目。
Z:原子序数,即是质子的数目。
由于它是固定的,一般不会标示出来。
e:净电荷,正负号写在数字后面。
n:原子数目,元素在非单原子状态(分子或化合物)时的数目。
除此之外,部份较高级的周期表更会列出元素的电子排布、电负性和价电子数目。
元素读音第一周期元素:1 氢(qīng) 2 氦(hài) 元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè)第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒn g) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)H氢qīng He氦hàiLi锂lǐ Be铍pí B硼péng C碳tàn N氮dàn O氧yǎng F 氟fú Ne氖nǎi Na钠nà Mg镁měi Al铝lǚ Si硅guī P磷lín S硫liú Cl氯lǜ Ar 氩yà K钾jiǎ Ca钙gài Sc钪kàng Ti钛tài V钒fán Cr铬gè Mn锰měng Fe 铁tiě Co钴gǔ Ni镍niè Cu铜tóng Zn锌xīn Ga镓jiā Ge锗zhě As砷shēn Se 硒xīBr溴xiù Kr氪kè Rb铷rú Sr锶sī Y钇yǐ Zr锆gào Nb铌ní Mo钼mù Tc 锝dé Ru钌liǎo Rh铑lǎo Pd钯bǎ Ag银yín Cd镉gé In铟yīn Sn锡xī Sb锑tī Te碲dì I碘diǎn Xe氙xiān Cs铯sè Ba钡bèi La镧lán Hf铪hāTa钽tǎn W 钨wū Re铼lái Os锇é Ir铱yī Pt铂bó Au金jīn Hg汞gǒng Tl铊tā Pb铅qiān Bi铋bì Po钋pō At砹ài Rn氡dōng Fr钫fāng Ra镭léi Ac锕ā Ce铈shì Pr 镨pǔ Nd钕nǚ Pm钷pǒ Sm钐shān Eu铕yǒu Gd钆gá Tb铽tè Dy镝dī Ho 钬huǒ Er铒ěr Tm铥diū Yb镱yì Lu镥lǔ Th钍tǔ Pa镤pú U铀yóu Np镎náPu钚bù Am镅méi Cm锔jú Bk锫péi Cf锎kāi Es锿āi Fm镄fèi Md钔mén No 锘nuò Lr铹láo第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 防雷啊!唉,没办法,这么难记的东东,又必须要背,就只能这样了。
课件化学--d区元素

钛或钛合金的密度与人的骨 骼相近,对体内有机物不起化学 反应,且亲和力强,易为人体所 容纳,对任何消毒方式都能适应, 因而常用于接骨、制造人工关节 等。又称为生命金属。
用水浸取除去可溶盐,得海绵状钛,电弧熔 融得钛锭。
§ 2-2 钛的重要化合物
1. 二氧化钛
天然二氧化钛称“金红石”,含杂质。
人工制备纯TiO2俗称“钛白粉”,是优良的白色 涂料,着色力强,遮盖力强,化学稳定性好,优于
除s电子外,d电子可参与成金属键,自左向右未成对价电 子增多,至VIB族(铬族)可能提供6个单电子,相互作用力大, 金属键强,因此在过渡系中,铬族(Cr,Mo,W)熔点最高, 硬度也很大,除Mn和Tc外(熔点反常)随后自左向右熔点又有 规律下降。
铬族价电子层构型: (n-1)d5ns1
熔点变化示意图
此外,钛或钛合金还具有特 殊的记忆功能、超导功能和储氢 功能等。
Zr,Hf是稀有金属,锆矿主要有锆英石ZrSO4, 价电子结构(n-1)d2ns2,d0电子结构较稳定, 所以除最外层s电子,次外层d电子也参加成键, Ti,Zr,Hf最稳定的氧化态是+4。其次是+3, +2较少见。
由于镧系收缩,铪的离子半径与锆接近,所以
FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O TiOSO4 + 2H2O = H2TiO3 + H2SO4 H2TiO3 = TiO2 + H2O
d,f区元素

12.1.1 d区元素的特殊性
d区元素显示出许多区别于主族元素的性质:
• 熔沸点高、硬度密度大的金属大都集中在这一区 • 同一周期从左到右,元素化学性质的变化远不如s区p区
显著。
• 不少元素形成有颜色的化合物 • 许多元素形成多种氧化态从而导致丰富的氧化还原行为 • 形成配合物的能力比较强 ,参与工业催化过程和酶催
化过程的能力强
12.2 钒
• 钒的价电子层结构为3d34s2,5个电子都有成键作用,所以 • 在酸性介质中,钒的元素电势图为
A / V
VO2+ 主要氧化态为+5,但也存在+4,+3,+2。
-0.25 -1.2 1.0 VO2+ 0.36 V3+ V2+ V -0.25
所以V2+、V3+具有还原性,VO2+是稳定的,而VO2+具有氧化 性。 不同的氧化态的钒具有不同的颜色。例如: VO2+(黄色)可 被Fe2+、H2C2O4等还原为VO2+(蓝色)
[Cr(H2O)6]Cl3 紫色
[Cr(H2O)5Cl]Cl2· H2O 浅绿 [Cr(H2O)4Cl2]Cl· 2H2O 深绿
2. Cr(VI)的化合物
Cr(VI)的化合物通常是由自然界存在的铬铁矿Fe(CrO2)2,
借助于碱熔法制得的,即把铬铁矿和Na2CO3混合,并在空 气中煅烧。用水浸取煅烧后的熔体,Na2CrO4进入水中,浓 缩,得黄色晶体Na2CrO4;酸化得红色晶体。 4Fe(CrO2)2 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
电子分别填充在3d 亚层4d 亚层和5d 亚层上.
ds区,d区和f区元素

子构型具有接受配位体孤对电子的条件,因此它
们容易形成配合物,一般容易形成氟配合物、氰 配合物和氨配合物。 此外,过渡元素氧化物水合物的酸碱变化规律 和主族元素相似。对同种元素而言,低价的显碱
性,高价的显酸性。注意p304列出的ⅢB-ⅦB族过
渡元素最高价态氧化物水合物的酸碱性。
8.2 铜族和锌族元素的化合物 8.2.1 通性
3. 锌配合物 Zn2+和氨水、KCN等能形成无色的四配位离子: [Zn(NH3)4]2+、[Zn(CN)4]2-、[Zn(CN)4]2-用于电镀中 4. 汞配合物 Hg(I)形成配合物倾向较小。 Hg(II)易和CN-、SCN-、Cl-、Br-、I-离子均生成 [ML4]2-配离子。
Hg2++2I-→HgI2↓(红色)+2I-→[HgI4]2[HgI4]2-与碱混合后叫奈氏试剂,用于鉴定NH4+、
3. 形成配合物(Zn2+,Al3+的分离)
Zn 2 Al3
2 NH 3O H
Zn(OH ) 2 Al(OH ) 3
2 NH 3O H
[ Zn( NH 3 ) 4 ] 2 (白色) Al(OH )(白色) 3
8.2.3 重要的盐类 1. 几种常用的盐 硫酸铜、硝酸银、氯化汞、氯化亚汞(p306-308自 己看书,了解基本性质和用途) 2. Cu2+和Cu+的相互转化 从Cu(I)结构(3d10)看,Cu(I)是稳定的,如自然 界中有Cu2O和Cu2S的矿物存在。但在水溶液中Cu+ 易歧化,这是由于Cu2+的电荷比Cu+多,半径又小, 所以Cu2+的水合焓(-2100kJ· -1)比Cu+的(-593 mol kJ· -1)代数值小得多,∴水溶液中Cu2+比Cu+稳)4)]2+、[CuCl4]2-、[Cu(NH3)4]2+等,
元素周期表口诀歌

元素周期表口诀歌元素周期表口诀歌元素周期表是学习化学必须掌握的一个知识点,接下来店铺搜集了元素周期表口诀歌,仅供大家参考,希望帮助到大家。
元素周期表口诀歌我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜;我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;我是硼,有点红,论起电子我很穷;我是碳,反应慢,既能成链又成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在;我是钛,过渡来,航天飞机我来盖;我是铬,正六铬,酒精过来变绿色;我是锰,价态多,七氧化物爆炸猛;我是铁,用途广,不锈钢喊我叫爷;我是铜,色紫红,投入硝酸气棕红;我是砷,颜色深,三价元素夺你魂;我是溴,挥发臭,液态非金我来秀;我是铷,碱金属,沾水烟花钾不如;我是碘,升华烟,遇到淀粉蓝点点;我是铯,金黄色,入水爆炸容器破;我是钨,高温度,其他金属早呜呼;我是金,很稳定,扔进王水影无形;我是汞,有剧毒,液态金属我为独;我是铀,浓缩后,造原子弹我最牛;我是镓,易融化,沸点很高难蒸发;我是铟,软如金,轻微放射宜小心;我是铊,能脱发,投毒出名看清华;我是锗,可晶格,红外窗口能当壳;我是硒,补人体,口服液里有玄机;我是铅,能储电,子弹头里也出现。
元素周期表相关记忆技巧1、化合价实质之歌化合价实质要记准,金正非负单质零;氢一氧二应记住,正负总价和为零;许多元素有变价,条件不同价不同。
注:“金正”指金属的化合价通常显正价:“非负”指非金属的化合价通常显负价。
8 ds区、d区和f区

8.4 锰的重要化合物 价层电子构型为 (n-1)d5ns2 ,锰也许是氧化态最多的元 素,除多种正氧化态外还显示多种负氧化态(例如-1,-2和3氧化态), 最常见的则是+7、+2和+4氧化态。 单质锰主要用于合金钢 Mn(Ⅱ)盐: Mn(Ⅱ)强酸盐均溶于水,只有少数弱酸盐如MnS、 MnCO3难溶。 Mn(Ⅱ)盐从溶液中结晶出来时,常带结晶水的粉红色 晶体,如MnSO4· 7H2O,水溶液浓度大时为粉红色,少时 几乎为无色。 Mn2+(3d5)稳定,只有强氧化剂如NaBiO3、 (NH4)2S2O8、PbO2等才能将Mn2+氧化为MnO4-等: 2Mn2++14H++NaBiO3→2MnO4-+5Bi3++5Na++7H2O 此反应用于鉴定Mn2+。
上页 下页 目录 返回
铬化合物毒性浅析 绝大多数三价铬化合物不溶于水,无毒、无害,但水 溶性无机三价铬盐极易在酸性环境下水解,形成的游离酸 对人体有剌激作用。 六价铬毒性主要是由于强氧化性对有机体的腐蚀与破坏, 可以通过吸入、接触、口服造成人体中毒。吸入六价铬将 引起呼吸道感染,粘膜溃疡,甚至鼻穿孔;皮肤接触六价 铬可能引发皮炎,伤口若接触六价铬将出现铬疮;口服大 剂量六价铬化合物将引起消化系统腐烂,出现肾损伤。流 行病学研究证实,长期暴露在高浓度六价铬的气雾中的工 人,呼吸系统癌症(主要是肺癌)发病率高于平均值,其 潜伏期超过15年。
上页 下页 目录 返回
Ag2O 和 MnO2、Cr2O3、CuO 的混合物能在室温下, 将 CO 迅速氧化成 CO2,可用于防毒面具中。 Ag2O+CO—→2Ag+CO2 Ag+,Cu2+,Zn2+盐溶液加入适量氨水,生成沉淀,但 都能溶于过量氨水中。 8.2.3 重要的盐类 CuSO4: CuSO4· 5H2O实际为[Cu(H2O)4]SO4· H2O 无水CuSO4为白色粉末,吸水性强,吸水后显兰色, 可用于检验有机液体中的水分,也可作干燥剂,从有机液 体中除去水分。 2Cu2++4I-→2CuI+I2 铜盐含量的定量分析法。
无机及分析化学第十二章重要的生命元素详解演示文稿

与金属钾和钠相比,镁和钙的金属活动性相对较 弱,与冷水作用缓慢,但与酸作用可置换出氢气。
金属镁具有重要的用途,镁铝合金以其密度小, 硬度大、韧性高的特点,在飞机和汽车制造中得到 广泛的应用。
2020/11/21
2020/11/21
元素在地壳中的含量称为丰度,常用质量分数表 示。
12-1 地球上分布最广的10种元素的质量分数
元素符号 质量分数/% 元素符号 质量分数/%
O H Si 52.32 16.95 1 6.67 Fe Ca Mg 1.50 1.48 1.39
Al Na 5.53 1.95 K Ti 1.08 0.22
2020/11/21
12.1.2 元素的分类
1.金属和非金属元素
按长式周期表中硼—硅—砷—碲—6砹和铝—锗— 锑—钋之间的对角线来区分。
位于对角线左下方的都是金属元素; 右上方的都是非金属元素。 对角线附近的锗、砷、锑、碲称为准金属元素。
2020/11/21
Hale Waihona Puke 金属非金属2.普通元素和稀有元素
根据元素在自然界中的分布及应用情况,将元 素分为普通元素和稀有元素。稀有元素一般指在 自然界中含量少,或被人们发现的较晚,或对它 们研究的较少,或提炼它们比较困难,以致在工 业上应用也较晚的元素。前四周期(Li,Be,稀 有气体除外),ds区元素为普通元素,其余为稀 有元素。
工业上生产镁和钙的氧化物主要是煅烧菱镁矿和 石灰石的方法来制备的。
2020/11/21
20
(3)镁、钙的生物效应
镁是一种细胞内部结构 的稳定剂和细胞内酶的辅因子, 是许多酶的激活剂。细胞内的 核苷酸以镁的配合物的形式存 在。在绿色植物的光合作用中, 镁也有着非常重要的作用。叶 绿素分子中Mg2+扮演着结构中 心和活性中心的作用。此外, 在生物体内的糖代谢中,镁也 具有非常重要的作用。
大学无机化学 d区元素介绍
△ Δ
△
3
3H2O Cr2O3 2OH- Cr(OH)4
(2) Cr(OH)3
Cr 3
(适量)OH- (灰绿)
H
பைடு நூலகம்
Cr(OH)3 (s) H ∆ H2O Cr2O3 (绿)
OH -
(亮绿色)
Cr(OH)
4
(3) Cr(H2O)3 6 的水解
Ac, (104-112,人工合成元素)
57-71
89-103
2
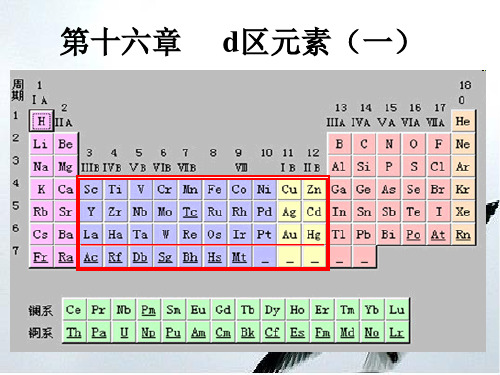
第十六章
d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒
§16.3 铬 钼 钨 多酸型配合物 §16.4 锰
§16.5 铁 钴 镍
§16.1 d区元素概述
16.1.1 d区元素通性
1.原子的价电子层构型:
(n-1)d1-10ns1-2
3Sn 2Cr 7H 2 O 3Cl 2 2CrCl 3 2KCl 7H 2 O
4
14H
K 2 Cr2 O 7 (s) 14HCl(浓)
☆2 ☆铬(Ⅲ)的化合物
(1) Cr2O3的制备与性质 △ Δ 2Cr2O3 制备:4Cr 3O2
(NH4 ) 2 Cr2O7 Cr2O3 N 2 4H2O
-7
2Ag2 CrO4 (s, 砖红) 2H 2BaCrO4 (s, 柠檬黄) 2H 2PbCrO4 (s, 黄) 2H
(3) K2Cr2O7的氧化性
E (Cr2 O /Cr ) = 1.33V
2 Cr2 O 3SO 3 8H 27 3 3SO 2Cr 4H 2 O 24
第十五章 d 区和 f 区元素

2.以下金属需 O2 存在才与碱反应: Mn K2 MnO4 Fe Fe2 O3 ·XH2O Pd + NaOH + O —→ PdO+H2 O 2 Mo Na2MoO4 (熔碱) W Na2 WO4 (熔碱 )
3.Ru(钌)、Pt(铂)受熔融苛性碱或 Na2O2 腐蚀: Ru + 2 KOH + KClO3 K2RuO4 + KCl + H2O
Ru + 2 Na2O2(熔融)== Na2RuO4 + 2NaO Ni 、Co 不与熔融碱反应。熔融碱实验可用镍坩埚,不用 Fe、Pt 坩埚。Co 脆。
m
=
n( n 2) B.M .
六、过渡元素氧化物水合物的酸碱性
(一)最高氧化态氧化物的水合物
碱 性 ↗
ⅢB ⅣB Sc(OH)3 Y(OH)3 La(OH)3
ⅤB
ⅥB
ⅦB HMnO4 HTcO4 HReO4
酸 性 ↗
酸性↗ 规律与主族相同。
(二)低氧化态氧化物水合物
M(OH)2、M(OH)3 一般呈碱性,且碱性主要取决于 Ksp: Ksp↗,碱性↗。
七、形成配合物倾向:比主族 M 大得多
原因: ① (n-1)d 与 ns 能量相近,(n-1)d 电子参与成键; ② d 区 Mn+: (9 17)e 构型, (强极化力 + 大变形性) 。 与配体互相极化,使 M-L 键共价性↑。
n+
八、形式多碱、多酸倾向
(一)多碱
是较高价态 Mn+ 在一定 pH 值下多步水解通过羟桥键而形成的多核配合物: 例:[Fe(H2O)6 ]3+ 水解形成 [Fe2(H2 O)8 (OH)2 ]4+ H2O H H2O H2 O O OH2 \ / \ / Fe Fe 2 个八面体共棱 / \ / \ H2 O O OH2 H2 O H H2O pH ↗ pH ↗ 胶体溶液 Fe2 O3 ·xH2 O↓
f区元素
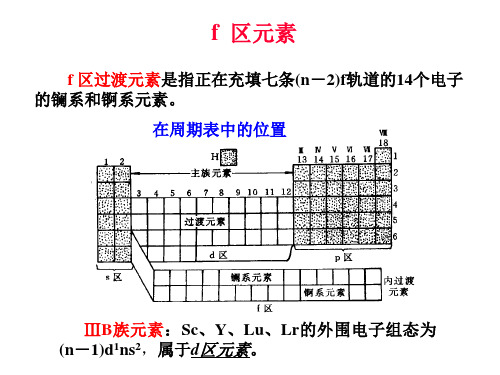
f 区过渡元素是指正在充填七条(n-2)f轨道的14个电子 的镧系和锕系元素。 f 区元素在周期表中的位置如图所示:
ⅢB族元素:Sc、Y、Lu、Lr的外围电子组态为 (n-1)d1ns2,属于d区元素。
镧系元素和锕系元素
习惯上所称的镧系元素是指从 57 La-71Lu的15个元素, 以Ln表示。本来镧系元素并不包括Lu(镥), 将它归在一起 是因Lu与其前面的从 57La到 70Yb(镱)的14个填充4f轨道电 子的元素的性质非常相似。 同样,Lr(铑)与其前面的89Ac到102No(锘)的14个填 充5f轨道电子的元素性质也非常相似,因而在习惯上也把从 89Ac到103Lr的15个元素统称为锕系元素,记作An,按理锕系 元素并不包括Lr。
而呈现+2氧化态。显然镧系离子在氧化态变化的 周期性规律正是镧系元素电子层排布呈现周期性规 律的反映。
镧系元素的光学性质
镧系离子的颜色来源于: ① 荷移跃迁 电荷从配体的分子轨道向金属离子空轨道跃迁 。其光谱的谱带具有较大的强度和较短的波长,且受配体及金 属离子的氧化还原性所影响。 ② f-d(u→g)跃迁 光谱选律所允许的跃迁。因而谱线强度 大,一般出现在紫外区,其中+2价离子也可能出现在可见区。 ③ f-f(u→u)跃迁 光谱选律所禁阻的跃迁。然而, 由于中心 离子与配体的电子振动偶合、晶格振动和旋-轨偶合使禁阻产 生松动,从而使f-f跃迁得以实现。 可以发现: 除La3+和Lu3+的4f亚层为全空或全满外,其余+3 价离子的4f电子都可以在7条4f轨道之间任意配布,从而产生多 种多样的电子能级,这种能级不但比主族元素多,而且也比d区 过渡元素多,因此,+3价镧系元素离子可以吸收从紫外、可见 到红外光区的各种波长的辐射。据报导,具有未充满f电子轨道 的原子或离子的光谱约有3万条可以观察到的谱线。
元素周期表说明

表格说明周期表化学元素周期表图集(20张)的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目)递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。
沿着周期表向下,周期的长度逐渐上升,并按元素的电子排布划分出s区元素、p区元素、d区元素和f区元素。
而同一栏中的则称为同一族,同一族的元素有着相似的化学性质。
在印刷的周期表中,会列出元素的符号和原子序数。
而很多亦会附有以下的资料,以元素X为例:A:质量数(Mass number) ,即在数量上等于原子核(质子加中子)的粒子数目。
Z:原子序数,即是质子的数目。
由于它是固定的,一般不会标示出来。
e:净电荷,正负号写在数字后面。
n:原子数目,元素在非单原子状态(分子或化合物)时的数目。
除此之外,部份较高级的周期表更会列出元素的电子排布、电负性和价电子数目。
元素读音第一周期元素:1 氢(qīng) 2 氦(hài) 元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi) 第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà) 第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè) 第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān) 第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng) 第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鈩(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109 䥑(mài) 110 鐽(dá) 111 錀(lún) 112 鎶(gē)[暂定] 注:新元素汉字请使用Win7系统浏览,XP系统下无法显示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+4
(划横线表示常见氧化态)
+4 左 氧化态先升+5高后降低
右
上 同族
+6
高氧
化态
趋向
精品课件
下 稳定
3. 水合离子大多具有颜色
4. 易形成配合物
§12.3 钒
V
3d 34s 2
+2、+3、+4、+5
钒为分散元素,不独立成矿。在其它金属冶炼 时以副产物得到单质。
由于钝化,在常温下表现出化学惰性。
离子色彩丰富:V2+紫、 V3+绿 、VO2+兰、 VO2+、 VO3-黄
(2) 氧化还原性
2Cr3+ + 3H2O2 + 10OH- 2CrO42- + 8H2O
(3) 生成配合物
特征: Cr3+
C.N.= 6
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2 [Cr(H2O)4Cl2]Cl [Cr(NH3)(H2O)5]Cl3
(紫) (亮绿) (暗绿) (浅红)
12.5.1 锰(II)的化合物
Mn2+ +
NaBiO3 + H+
MnO4-+ Na++ Bi3++ H2O
S2O82- + H+ Ag+ MnO4- + SO42- + H2O
精品课件
12.5.2 锰(IV)的化合物
HCl(浓) MnCl4(棕) MnCl2 + Cl2
MnO2 + H2SO4(浓)
较稳定
1.507
0.564
2.26
0.9A5θ MnO4-——Mn1O.4521-——MnO2—-—1M.1n93+——Mn2+——Mn
1.23
1.695
精品课件
0.564
0.60
-0.20
0.1
-1.55
θ B
MnO4-——MnO42-——MnO2——Mn(OH)3——Mn(OH)2——Mn
Aθ与 Bθ相差大:酸性介质:氧化剂, 碱性介质:把低价态氧化为高价
[Cr(NH3)6]Cl3
精品课件
注: Cr3+ + 3NH3H2O
Cr(OH)3 + 3NH4+
不直接形成NH3配合物, 应在NH3~NH4+ 体系中。
12.4.2 钼和钨的化合物
MoO3 + 2NaOH(aq)
Na2MoO4 + H2O
MoO3 + 2NH3H2O
(NH3)2MoO4 + H2O
橙红色
V2O5xH2O
红棕
pH < 1 VO2+
淡黄
精品课件
§12.4 铬、钼、
钨
存在
ⅥB
铬在自然界存在 FeO·Cr2O3 或FeCrO4铬铁矿
铬 Cr 3d54s1
钼 Mo 4d55s1
辉钼矿MoS2
钨W (Fe、Mn)WO4黑钨矿5d46s2 CaWO4白钨矿
精品课件
铬的氧化态与形态变化
Cr2O72- + H2O 桔黄(H+)
(2) 生成难溶盐
CrO42(Cr2O72-)
+
用于鉴别
Ag+
Ba2+ Pb2+
精品课件
Ag2CrO4 (棕红) BaCrO4 (黄) PbCrO4 (黄)
(3) 过氧化物
乙醚
Cr2O72- + 4H2O2 +2H+
CrO5 + 5H2O
O
O
O
Cr
O
O
Cr(Ⅱ):Cr2+
Cr(Ⅲ):Cr 3+(酸性介质)
CrO2- 、[Cr(OH)4-] (碱性介 Cr(Ⅵ):Cr2O72- (酸性介质)
CrO42- (碱性介质)
1.33V
-
0.41AθV :
-0.91V
Cr2O72-————Cr3+————Cr2+————Cr
-0.13V
-
1.1V
Bθ:
CrO42-
第十二章 d区元素和f区元素
精品课件
精品课件
§12.1 d区元素概 1述2.1.1 d区元素和过渡元 素过渡元素:具有部分填充d或f壳层电子的元素。
12.1.2 d区元素的特性 1. 单质的相似性
因为价电子数较多、原子半径较小, 金属键 较强。所以,金属的熔沸点较高、硬度较大、导 电导热性较好。
O R
R
深蓝色溶液
形成配合物而稳定 用于鉴定反应
Cr(III)
(1) 含氧化合物 (NH4)2Cr2O7
浓H2SO4 Cr2(SO4)3 N2 + Cr2O3 + 4H2O
精品课件 NaOH
NaCrO2
桃红
Cr3+ + 3OH-
H+ Cr3+ + H2O Cr(OH)3
OH- [Cr(OH)4]-
酸根极易聚合:V2O7 4- 、V3O9 3- 、V10O286-
pH下降,聚合
度增加,颜色从无色→黄色→深红,酸度足够大时为VO2+
精品课件
V2O5
2NH4 VO3 偏钒酸铵
性质:
(1) 两性偏酸性;
V2O5 + 2NH3 + H2O
V2O5 +
2H+ 6OH-
(2) 氧化性;
V2O5 + 6HCl(浓)
MnSO4 + H2O + 1/2 O2
2KOH(s) + O2 K2MnO4(墨绿) + H2O
前两个反应表现氧化性,后一个反应表现还原性。
12.5.3 锰(VI)和锰(VII)的化合物
Mn(VI): 存在于碱性介质中
MnO42- +
H2O
MnO4- + MnO2 + OH- 歧化
-1.4V
————Cr(OH)3————Cr(OH)2————Cr
-1.2V酸性|介质氧化性强,碱性精品介课件质还原性强 CrO - ————————
2
12.4.1 铬的化合物
Cr(VI)
(III、VI)
(1) 存在形式与转化 —— CrO42- ~ Cr2O72-
2CrO42- + 2H+ 黄(OH-)
金属中: 硬度最大者— Cr ; 熔点最高者— W ; 密度最大者 — Os ; 最易吸收
H2者— Pd。
精品课件
2. 氧化态
元素 Fe
+2
+3 氧化态 +4
+6 Fe Ru
+7 Os
Sc
Ti
V
Cr
Mn
Co
Ni
+2
+2
+2
+2
+2
+2
+3
+3
+3
+3
+3
+3
+3
+4 +4
+2+、6 +3 +4 +4、+6、+8
2VO2+(淡黄) + H2O 2VO43-(无色) + 3H2O
2VOCl2 + Cl2+ 3H2O
精品课件
钒的含氧酸盐 特点:酸度、浓度不同,聚合程度不同。
VO43- pH=12-10.6 V2O74- pH = 9 H2V4O134-
pH = 7
H4V5O16
棕
无色
pH= 2-4 HV10O284- pH < 2
WO3 + 2NaOH(aq)
Na2WO4 + H2O
MoO42- + 2H+ WO42- + 2H+
H2MoO4 H2WO4
H2MoO4 H2WO4
MoO3 + H2O WO3 +精品H课2件O
H2CrO4
§12.5
氧化性和酸性增强
锰
H2MoO4
Mn
3d 54s2
主要氧化态:+2、+3、+4、+5、+6、+7
