第十八章 d区元素(1)
过渡元素(1)

O V OOO-
O V OO
O V OO- +H2O
PH=12-10.6
pH 10 pH 9 VO43 (浅黄色) pH 12 HVO4 2 HV2O73 V3O93 pH 7 pH 6.5 pH 3.2 V5O143(红棕色)V2O5 xH 2O(砖红色) pH 1 V10O286(黄色) VO2 (浅黄色)
二、钛及其化合物
二氧化钛的制取
二氧化钛的工业生产,几乎包括了全部无机化学工艺过程,因而被喻 为“工艺艺术品”。
二氧化钛的生产可采用硫酸法或氯化法,以钛铁矿为原料的二氧化钛 生产常以硫酸法为主。该法主要过程有:(1)硫酸分解精矿制取硫酸氧钛溶 液(2)净化除铁(3)水解制偏钛酸(4)偏钛酸煅烧制二氧化钛。 钛铁矿精矿成分除FeTiO3外,还有Fe2O3以及SiO2, Al2O3, MnO, CaO, MgO等杂质。160~200°C下,用浓硫酸分解精矿的主要反应如下:
[V (O2 )]3 H 2O2 2 H 2O [VO2 (O2 ) 2 ]3 6 H
钒酸盐与过氧化氢的反应,在分析上可用于定量和比色测定钒。 即使在酸性很强的溶液中也没有[V(H2O)6]4+和[V(H2O)6]5+,因为V(IV)、 V(V)的电荷高、半径小,在水溶液中容易水解,常以氧合离子形式存在。 钒的电位图:
过渡元素(I)
d区元素通常称为过渡元素,但目前对过渡元素的范围有不同的划分方法。一
种把具有未充满的d电子层或f层的元素称为过渡元素,包括周期系第四、五、六
周期从ⅢB族到VⅢ族的元素,共有直列。另一种采取较为广义的划分,即把 常见氧化态时含有未充满的d或f电子层的那些元素称为过渡元素,即IB族也为过
d区元素一(相关知识点)
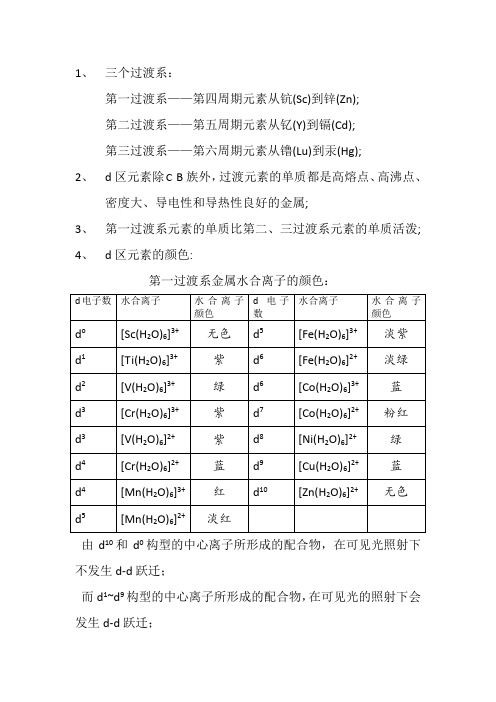
1、三个过渡系:第一过渡系——第四周期元素从钪(Sc)到锌(Zn);第二过渡系——第五周期元素从钇(Y)到镉(Cd);第三过渡系——第六周期元素从镥(Lu)到汞(Hg);2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、密度大、导电性和导热性良好的金属;3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼;4、d区元素的颜色:第一过渡系金属水合离子的颜色:由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;(2)加热TiO 22nH O 可得到白色粉末状的TiO 2:3002222CTiO nH O TiO nH O −−−→+;(3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;(4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法:通常用TiO 2、碳和氯气在800C~900C 时进行反应:800~900224222C CTiO C Cl TiCl CO ++−−−−→+ ;用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下:2TiCl 4+H 2=2TiCl 3+2HCl ;(8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在;(9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:TiO2++H2O2=[TiO](H2O2)]2+(橘黄色) ;(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):2TiO2++Zn+4H+=2Ti3++Zn2++2H2O ;(11)向含有Ti3+的溶液中加入碳酸时:2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:4Ti3++2H2O+O2=4TiO2++4H+;(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;6、(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;浓硫酸和氢氟酸仅在加热条件下与钒发生作用;(4)加热时。
第18章 d区元素吉林大学无机化学
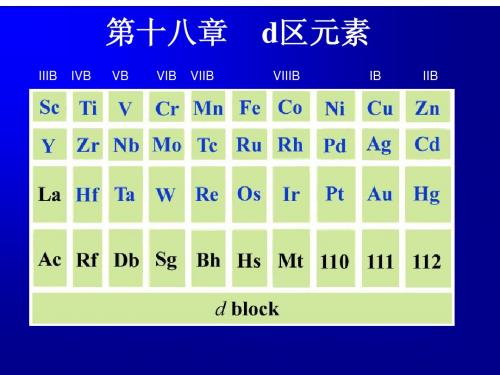
1.507V 1.695V 0.564V
Mn2+ MnO2 MnO42-
MnO 4 / MnO 2
2 MnO 4 / MnO 4
还原产物
例如:与SO32-反应
酸性 中性 碱性
还原产物还与KMnO4加入方式有关。
由软锰矿制备KMnO4 软锰矿 粉碎
氧化剂
OH- △
K2MnO4 墨绿色
铬的单质 铬的化合物
水溶液中离子及其反应
概述
铬分族(VIB):Cr, Mo, W 价电子构型:(n-1)d 4-5ns1-2
Cr : 3d 4 s
5
5
1 1
常见化合价:+6, +3,+2
Mo : 4d 5s W : 5d 6 s
4 2
(1)铬元素的电势图 2 1.23 E A / Cr O
(3) Cl2或NaClO氧化: 2K2MnO4+ Cl2 == 2KMnO4 + 2KCl
§18.3 铁 钴 镍
铁、钴、镍的单质 铁、钴、镍的化合物 水溶液中铁、钴、镍的
离子及其反应
铁、钴、镍的单质
Ⅷ族
Fe Ru Os
Co Rh Ir
Ni Pd Pt
铁系
铂系
Fe Co Ni
价电子构型 6 2 3d 4s 7 2 3d 4s 8 2 3d 4s
2 NH3 H2O + 2 H+
Mn + 2 H+ = Mn2+ + H2(g) 合并: Mn + 2 NH4+ + 2 H2O = Mn2+ + 2 NH3.H2O + H2(g) (似Mg)
高中《无机化学》第十六至十八章测试题及答案

高中《无机化学》第十六至十八章测试题及答案(d区元素、f区元素)(总9页)-本页仅作为预览文档封面,使用时请删除本页-高中《无机化学》第十六至十八章测试题及答案(d区元素、f区元素)第十六章 d区元素(一)一、填空题1、在所有过渡元素中,熔点最高的金属是 W ,熔点最低的是 Hg ,硬度最大的是 Cr ,密度最大的是 Os ,导电性最好的是 Ag ,耐海水腐蚀的是Ti 。
2、分别写出下列离子的颜色:[Fe(H2O)6]2+淡绿色,FeO42-紫色,[FeCl4]-黄色,[Fe(H2O)6]3+淡紫色,[Ti(H2O)6]3+紫色,VO43-淡黄色,[Co(H2O)6]2+粉红色,[Mn(H2O)6]2+粉红色,[Ni(H2O)6]2+绿色。
3、CrCl3溶液与氨水反应生成灰绿色的 Cr(OH)3沉淀该产物与NaOH溶液反应生成亮绿色的 Cr(OH)4-。
4、锰在自然界主要以软锰矿的形式存在,在强氧化剂(如KClO3)作用下碱熔时只能得到 +6 价锰的化合物,而得不到高锰酸盐,这是因为后者在碱中和受热均分解。
5、K2Cr2O7(s)与浓H2SO4反应生成的氧化物为 CrO3,它为橙红色,遇酒精立即着火,生成铬的一种绿色氧化物,其化学式为 Cr2O3。
KMnO4(s)与浓H2SO4作用生成的氧化物为 Mn2O7;MnO2与浓H2SO4反应生成的气体是O2。
6、高锰酸钾是强氧化剂,它在酸性溶液中与H2O2反应的主要产物是 O2和 Mn2+,它在中性或弱碱性溶液中与Na2SO3反应的主要产物为 SO42-和MnO2。
7、在强碱性条件下,KMnO4溶液与MnO2反应生成绿色的 K2MnO4;在该产物中加入硫酸后生成紫色的 KMnO4和褐色的 MnO2。
8、三氯化铁蒸气中含有的聚合分子化学式为 Fe2Cl6,其结构与金属 Al 的氯化物相似。
FeCl3能溶于有机溶剂。
9、既可用于鉴定Fe3+,又可用于鉴定Co2+的试剂是 KCNS ,当Fe3+存在时,能干扰Co2+的鉴定,可加入 NaF 因生成 FeF63-而将Fe3+掩蔽起来,消除对Co2+鉴定的干扰。
d区金属
后果
(1) Y3+半径88pm落在Er3+88.1pm附近,Y进入稀土元素。 Sc半径接近Lu3+,常与Y3+共生,Sc也成为稀土元素。 (2) Zr与Hf、Nb与Ta、Mo与W三对元素半径十分接近、化 学性质十分相近,常伴生在一起,难以分离。 Zr(IV) Nb(V) Mo(VI)
80pm
Hf(IV) 79pm
度大,是宇航、航海、化工设备等的
理想材料。
• 强度好: Al的2-3倍,Mg的5倍 耐热合金用于飞机发动机 • 刚性大 : 约为钢的一半,比AlMg大 钛能与骨骼肌肉生长在一 • 质轻: 4.54g/ml钢的一半 起,称为“生物金属”。 时 间 强度/重量比: 1957 1968 1948 1952 金属中最大 1978 1990 2000 • • 抗腐蚀: 960 2000 钛关节 104005 21000 420000 年产量/T 3 与不锈钢相同,对海水与铂同 45053
所以第五和第六周期的同副族 元素及其化合物,性质相似, 结构相似,以致给分离工作带 来了困难。
ý É ª Ø Ó ë ¶ ¹ ¶ Ô Ë Ô ×°¾ 200 190 180 170 160 150 140 130 120 110 100 20 30
六
五 四
同 族 从 上 到 下 原 子 半 径 略 增 加
Cr -0.90 稀 HCl H2 SO4 Cu +0.339 HNO3 , 浓 热 H2 SO4
Mn -1.18 稀 HCl H2 SO4 等 Zn -0.762 稀 HCl H2 SO4 等
可溶该 金属的 酸 元素
各种酸 Fe -0.409 稀 HCl H2 SO4 等
M
2
课件化学--d区元素

钛或钛合金的密度与人的骨 骼相近,对体内有机物不起化学 反应,且亲和力强,易为人体所 容纳,对任何消毒方式都能适应, 因而常用于接骨、制造人工关节 等。又称为生命金属。
用水浸取除去可溶盐,得海绵状钛,电弧熔 融得钛锭。
§ 2-2 钛的重要化合物
1. 二氧化钛
天然二氧化钛称“金红石”,含杂质。
人工制备纯TiO2俗称“钛白粉”,是优良的白色 涂料,着色力强,遮盖力强,化学稳定性好,优于
除s电子外,d电子可参与成金属键,自左向右未成对价电 子增多,至VIB族(铬族)可能提供6个单电子,相互作用力大, 金属键强,因此在过渡系中,铬族(Cr,Mo,W)熔点最高, 硬度也很大,除Mn和Tc外(熔点反常)随后自左向右熔点又有 规律下降。
铬族价电子层构型: (n-1)d5ns1
熔点变化示意图
此外,钛或钛合金还具有特 殊的记忆功能、超导功能和储氢 功能等。
Zr,Hf是稀有金属,锆矿主要有锆英石ZrSO4, 价电子结构(n-1)d2ns2,d0电子结构较稳定, 所以除最外层s电子,次外层d电子也参加成键, Ti,Zr,Hf最稳定的氧化态是+4。其次是+3, +2较少见。
由于镧系收缩,铪的离子半径与锆接近,所以
FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O TiOSO4 + 2H2O = H2TiO3 + H2SO4 H2TiO3 = TiO2 + H2O
ds区元素[1]详解
![ds区元素[1]详解](https://img.taocdn.com/s3/m/fdaf6df46294dd88d0d26b99.png)
ds区元素
11.1 ds区元素概述 11.2 ds区元素单质的重要性质 11.3 ds区元素的重要化合物
11.1 ds 区元素概述
IB族: Cu
IIB族: Zn
Ag
Cd
Au
Hg
(n-1)d10ns1
(n-1)d10ns2
虽然这些元素的最外层电子数分别与IA族和IIA族相同,
但它们之间的性质却有很大的差异。
Zn:419℃; Cd:321℃ Hg:-39℃,是室温下唯一的液态金属
(3)铜族导电性很好:Ag > Cu > Au
(4)易形成合金,可用于提取贵金属 黄铜:Cu-Zn;汞齐:Na-Hg, Au-Hg, Ag-Hg
(5)铜族延展性好: Au > Ag > Cu (6)Hg慢性中毒;Cd使蛋白酶失活。
我国铜矿储量世界第三,江西德兴有我国最大铜业基地。 银矿:自然界有辉银矿Ag2S、角银矿AgCl深红银矿Ag3SbS3; 也有单质银矿。
金矿:主要以单质存在,分成岩脉金(散布在岩石中)和冲 积金(分散在砂砾中);山东、黑龙江和新疆有很多金矿,
如碲金矿AuTe2
锌矿: 闪锌矿ZnS,菱锌矿ZnCO3 镉矿: 镉常与锌共生在一起。
这是因为ds区元素的有效核电荷比相应的s区元素高得
多 (d,f 电子对外层电子的屏蔽作用不完全 ) ,所以 ds 区 元素的化学性质远不如s区元素活泼。
IB族元素d轨道都是刚好填满10个d电子,由于刚填满的d 电子不很稳定,除失去1个s电子外,还有可能失去1个或2 个d电子而形成+2或+3氧化态; IIB族元素d轨道电子已比较稳定,只能失去最外层的2个 s电子,呈+2氧化态; ds区与s区元素性质对比 IB IIB IA IIA
无机化学精品课程-过渡元素金属汞及其化合物ppt课件

1.Hg22+与Hg2+的相互转化
反应: Hg+Hg2+==Hg22+ 可自发向右进行 要使上述平衡向左移动,采取的方法有两类: (1)形成沉淀:向Hg22+的溶液中加入 NaOH,H2S,NH3等试剂,因产生沉淀,平衡向左 移动. (2)形成配合物:加入过量浓HCl或KI,因形成 HgX42-配离子,平衡向左移动.
(3)浓HCl: Hg2++4Cl-===HgCl42-
Hg22++2HCl==Hg2Cl2↓+2HNO3 Hg2Cl2+2HCl(浓)==H2[HgCl4]+Hg
(4)NaOH: Hg2++2OH-==HgO↓(黄)+H2O Hg22++2OH-==Hg2(OH)2==Hg↓+HgO↓+H2O
(5)KI: Hg2++2I-==HgI2↓(红)
16
作业
教材P.259 – 263: 6, 12, 13, 17, 19, 20, 24,
26, 27 (加:计算CFSE), 37,
40
思考(不写书面作业): 1, 22, 31, 41, 42
17
Zn2+,Cd2+,Hg2+均形成稳定的[M(CN)4]2-配合物,且从 上到下稳定性依次增强,而Hg22+不形成配合物.
7
(3.)与X-(F-除外)形成配合物 Hg2+的卤素配合物稳定性按Cl-<Br-<I-增加. K2[HgI4]和KOH的混合溶液称为奈斯勒试剂, 当有微量NH4+离子存在时,滴入试剂立刻生成 特殊的红棕色的碘化氨基·氧合二汞(Ⅱ)沉淀:
chapter 18 第18章 ds 区元素

(四)Ag 、Au 在O2 存在下都能 溶于KCN 溶液,形成配合物
Ag(CN) 2
Au(C 4 N)
有O2 时Cu能溶于氨水:
4 Cu O 2 8 NH 3 2 H 2O 4 Cu(NH ) 4 O H 3 2
无色 O2 蓝色
2 C u(NH ) 4 3
3Ag2S 8HNO3 (浓) △ 6 AgNO 3 S 2 NO 4 H O 3 2
M2S 4 CN 2[M(CN) ] S 2 2
6、 配合物
中心体:Cu+ 、Ag+ 均为d10 型离子,具有 空的外层s,p 轨道。 配位体:X-、NH3、S2O32–、CN –等 配位数:2、4 构型:直线型或四面体型。
△ 3C u2 2NO 3S 4H O 2
3 2CuS 10CN 2Cu(CN) 2S 2 (CN)2 4
5、配合物
Cu2+与CN– 形成配合物时比较特殊:
2
2Cu
4CN 2CuCN (CN) 2 (白色) CN–
Cu(CN) 2
三、 Cu(II) 与Cu(I) 的转化
0.153V + 0.52V Cu Cu2+ Cu I2 0.535V I
-
2Cu 2 4I 2CuI I 2
K sp 5.06 10 12
▼ 水溶液中:稳定性 Cu(I) < Cu(II) 水合热
Cu 2O H 2SO4 CuSO 4 Cu H 2O
2Cu Cu2 Cu K 1.2 106
▼ 有配合剂、沉淀剂存在时Cu(I)稳定性提高 电极电势减小,阻止歧化
d区元素

(3)与B、C、N形成间充式化合物,m.p.比 纯金属还高 ,TiC、 WC、TiN、TiB 的 m.p. > 3000℃,硬度都接近于金刚石
ZnS (硫化锌) ZnS (BaSO4) (锌钡白) CdS/CdSe (镉红)
铬酸盐
白色
红色
Pb(Cr, Mo, S)O4 (钼红)
黄色
CdS (镉黄)
PbCrO4或Pb(Cr, S)O4 (铬黄) ZnCrO4 (铬酸锌)
绿色
Cr2O3 铬绿 (氧化铬绿) (铅铬黄+铁蓝) (Co, Ni, Zn)2O4 (尖晶石绿)
许多国家都在颁布相应的法律限制使用含有危害人体健康和 环境的重金属元素(如 Cd、Cr、Hg、Mo等)的颜料, 因此, 发展新型、无毒的无机颜料材料已迫在眉睫 。已有人将 γ– Ce2S3 掺杂着碱金属作为红色和黄色颜料. 它们可用于染色制衣 工业和塑料工业,从而替代了CdSe1-xSx材料。
(1 ) 颜色的互补 (2 ) 无机化合物生色机理— 产生能量较低的激发态
水可以部分地被氯离子所置换,形成不同的水合异 构体,并呈现不同的颜色:
[Cr(III)(H2O)6] Cl3
紫色 淡绿色
[Cr(III)Cl(H2O)5]Cl2· H2O
[Cr(III)Cl2(H2O)4]Cl· 2H2O
暗绿色
实验室见到的三价铬离子溶液常为淡绿色,就是 因为部分内界H2O被溶液中的氯离子所置换的缘故。
第一电离能
总趋势: 同周期 左→右 小→大 同副族 不规律
大学无机化学 d区元素介绍
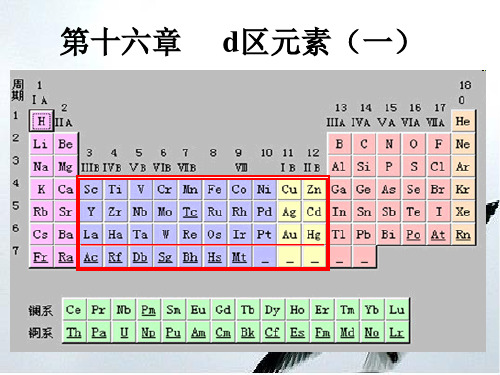
△ Δ
△
3
3H2O Cr2O3 2OH- Cr(OH)4
(2) Cr(OH)3
Cr 3
(适量)OH- (灰绿)
H
பைடு நூலகம்
Cr(OH)3 (s) H ∆ H2O Cr2O3 (绿)
OH -
(亮绿色)
Cr(OH)
4
(3) Cr(H2O)3 6 的水解
Ac, (104-112,人工合成元素)
57-71
89-103
2
第十六章
d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒
§16.3 铬 钼 钨 多酸型配合物 §16.4 锰
§16.5 铁 钴 镍
§16.1 d区元素概述
16.1.1 d区元素通性
1.原子的价电子层构型:
(n-1)d1-10ns1-2
3Sn 2Cr 7H 2 O 3Cl 2 2CrCl 3 2KCl 7H 2 O
4
14H
K 2 Cr2 O 7 (s) 14HCl(浓)
☆2 ☆铬(Ⅲ)的化合物
(1) Cr2O3的制备与性质 △ Δ 2Cr2O3 制备:4Cr 3O2
(NH4 ) 2 Cr2O7 Cr2O3 N 2 4H2O
-7
2Ag2 CrO4 (s, 砖红) 2H 2BaCrO4 (s, 柠檬黄) 2H 2PbCrO4 (s, 黄) 2H
(3) K2Cr2O7的氧化性
E (Cr2 O /Cr ) = 1.33V
2 Cr2 O 3SO 3 8H 27 3 3SO 2Cr 4H 2 O 24
d 区 元 素

d区元素
二、 钒(V)、铌(Nb)和钽(Ta)
钒的化合物都有五彩缤纷的美丽色彩,故以瑞典女神 Vanadies命名。钒在地壳中的丰度为0.0136%,它的分布广泛且 分散,海水中含量在10-9数量级,但在海洋生物体内得到富积, 如海鞘体内钒的含量是海水的几千倍。钒的主要矿物为绿硫钒 (VS2或V2S5)、铅钒矿(Pb5(VO4)3Cl)等。我国四川攀枝花蕴 藏的钒钛铁矿是重要的钒资源。同样由于镧系收缩的影响,铌和 钽性质相似,在自然界可与铁共生,它们共生的矿物的主要成分 可以用通式Fe(MO3)2表示。钒、铌、钽均是稀有金属。
d区元素
1. 金属钒及其化合物
钒是银灰色有延展性的金属,但不纯时硬而脆。钒是 活泼金属,易呈钝态,常温下不与水、苛性碱及稀的非氧 化性酸作用,可溶于氢氟酸、强氧化性酸和王水,也能与 熔融的苛性碱反应。高温下可与大多数非金属反应,甚至 比钛还容易与氧、碳、氮和氢化合,所以制备钒金属单质 很难,常用较活泼金属(如钙)热还原V2O5得到。
d区元素
锆和铪主要用于原子能工业。锆合金强度高, 可用作核反应堆中核燃料的包套材料。铪具有特别 强的热中子吸收能力,主要用于军舰和潜艇原子反 应堆的控制棒。锆不与人体的血液、骨骼及组织发 生作用,已用作外科和牙科医疗器械,并能强化和 代替骨骼。铪合金难熔,具有抗氧化性,用作火箭 喷嘴、发动机和宇宙飞行器等。
d区元素
d区元素
2. 铌和钽
铌和钽都是钢灰色金属,略带蓝色。它们具有极 其相似的性质,都有很强的抗腐蚀能力,能抵抗浓热 的盐酸、硫酸、硝酸和王水。铌和钽只能溶于氢氟酸 或氢氟酸与硝酸的热混合液中,在熔融碱中被氧化为 铌酸盐或钽酸盐。铌酸盐或钽酸盐进一步转化为其氧 化物,再由金属热还原得到铌或钽单质。
无机化学第四版(下册)第十八章习题答案

第18章非金属元素小结18-1 略18-2为什么氟和其他卤素不同,没有多种可变的正氧化态?解:因为F是电负性最大的元素,在形成化合物时,电子云总是偏向F,而且F处于第二周期,没有空d轨道参与成键,所以,和其他卤素不同,没有多种可变的正氧化态。
18-3 小结p区元素的原子半径、电离能、电子亲和能和电负性,在按周期性递变规律的同时,还有哪些反常之处?说明其原因。
解:p区元素的原子半径、电离能、电子亲和能和电负性,对同一周期,一般是自左向右原子半径依次减小,电离能依次增大,电子亲和能依次增大,电负性依次增大。
对于同一族,一般是从上到下原子半径依次增大,电离能依次减小,电子亲和能依次减小,电负性依次减小。
但第V A族的N、P、As等的第一电离能和电子亲和能出现反常,第一电离能比同周期VIA族的O、S、Se大,电子亲和能比同周期IV A族的C、Si、Ge小,这是由于V A族元素的外层p轨道处于半充满,结构稳定,不易失去电子,也不易接受电子。
另外,F的电子亲和能要小于Cl,O的电子亲和能小于S,N的电子亲和能小于P等,这是由于第二周期p区元素的原子半径太小,电子云密度大,电子之间排斥力很强,以致当加合一个外来电子形成负离子时,因排斥力大使放出的能量减小,导致上述反常结果。
18-4 概括非金属元素的氢化物有哪些共性?解:非金属元素的氢化物都是以共价键结合的分子型氢化物,在通常状况下为气体或挥发性液体,都能与氧、卤素、氧化态高的金属离子以及一些含氧酸盐等氧化剂作用。
18-5 已知下列数据(298K):△f G mӨ[H2S(aq)]= -27.9 kJ·mol-1;△f G mӨ[S2-(aq)]= 85.8 kJ·mol-1;△f G mӨ[H2Se(aq)] = 22.2 kJ·mol-1;△f G mӨ[Se2-(aq)] = 129.3 kJ·mol-1试计算下列反应在298K时的△r G mӨ和平衡常数K,并比较两者中哪一个酸性较强?(1) H2S(aq) -→ 2H+(aq) + S2-(aq)(2) H2Se(aq) -→2H+(aq) + Se2-(aq)解:(1) H2S(aq) -→ 2H+(aq) + S2-(aq)298K △r G1Ө= △f G mӨ[S2-(aq)]-△f G mӨ[H2S(aq)]= 85.8-(-27.9) = 113.7kJ·mol-1由△r G1Ө = - RTlnK1Ө求得:K1Ө = 1.17×10-20(2) H2Se(aq) -→2H+(aq) + Se2-(aq)298K △r G2Ө= △f G mӨ[Se2-(aq)]-△f G mӨ[H2Se(aq)]= 129.3-22.2) = 107.1kJ·mol-1由△r G2Ө = - RTlnK2Ө求得:K2Ө = 1.68×10-19通过(1)、(2)的计算结果可知:H2Se的酸性比H2S的酸性强。
苏州大学《无机化学》d区元素

MnO4
-
强OHH+歧化/强氧化剂/电解
MnO42-
紫红
暗绿
三、Fe
1、常见的价态有: Fe2+(实际上是淡绿色的[Fe(H2O)6]2+);
Fe3+(实际上是淡紫色的[Fe(H2O)6]3+,此离子水解 后才略显黄色); 2、主要反应有:
(1) Fe
2+
NH3/OH-
淡绿色
Fe(OH)2
白色
O2
2H[CuCl2] + H2SO4
6、Cu2+的其它主要反应有:
CuS(s)
H2S 黑色
盐 血 赤 2+ u C 鉴别
Cu2[Fe(CN)6](s) 红棕色
Cu2+
蓝色 I-
OH-/NH3 Cu(OH)2(s) 蓝色沉淀 S 2O 2
3 -
NH3
[Cu(NH3)4]2+
深蓝色
C6H12O6葡萄糖
CuI(s)
Cr2O72橙红
CrO42黄
分别生成砖红、淡黄、黄色沉淀
其中,上图中常见的还原剂为:Fe2+、I ˉ、H2S、 SO32-等;强氧化剂通常用过硫酸盐(S2O82-)。
二、Mn
1、常见的价态有: MnO4-(+7); MnO2(+4); MnO42- (+6) Mn2+ (+2)
2、重要化合物(离子)之间的转化:
(4). Fe3+比Fe2+易水解,水解产物为胶状物,可使 在水中悬浮的杂质聚沉下来,从而使混浊的水变清, 所以FeCl3可作净水剂。 (5). Fe3+/Fe2+常见的配合物有: 6配位的水合配离子[Fe(H2O)6]2/3+; “棕色环”配离子[Fe(NO)(H2O)5]2+——可用 来鉴别NO2-/NO3-; 可鉴别Fe3+的血红色配离子;氰根配离子 (黄血盐/赤血盐)→Prussian或Turnbull蓝。
镧系元素_高等教育-工学

★★★★★第18章镧系元素习题1. 按顺序写出镧系元素的名称、元素符号和价层电子构型。
解:镧La,5d1 6s2;铈Ce,4f15d1 6s2;镨Pr,4f3 6s2;钕Nd,4f4 6s2;钷Pm,4f5 6s2;钐Sm,4f6 6s2;铕Eu,4f7 6s2;钆Gd,4f7 5d1 6s2;铽Tb,4f9 6s2;镝Dy,4f10 6s2;钬Ho,4f11 6s2; 铒Er,4f12 6s2; 铥Tm,4f13 6s2; 镱Yb,4f14 6s2; 镥Lu, 4f14 5d1 6s2。
2. 什么是“镧系收缩”,它的起因和后果如何?解:镧系元素随着原子序数的增加原子半径的减小称为镧系收缩(lanthanide contraction)。
从La到Lu,随着原子序数增大,4f轨道中的电子逐渐增多,因4f电子对6s电子屏蔽较完全(屏蔽常数 = 0.99),原子核对最外层6s电子吸引力的增强较慢,使原子半径缓慢减小。
但镧系元素原子半径收缩的趋势不十分明显,从La到Lu原子序数增大了15,半径收缩只有15 pm,平均1 pm/核电荷。
镧系收缩使第六周期镧系后面的副族元素的半径大致减小了11pm,从而与第五周期同族元素的原子半径几乎相等(详见表10-3),又因为同族元素的价层电子构型相同,因此,他们的性质十分接近,在自然界中常共生在一起而难以分离,如Zr与Hf,Nb与Ta,Mo 与W,Tc与Re等。
3. 镧系元素常见的氧化态为+3。
为什么铈、镨、铽、镝的氧化态常呈现+4,而钐、铕、铥、镱却能呈现+2氧化态?解:镧系元素在形成化合物时,失去最外层的2个s电子, 次外层的1个d电子, 或外数第3层的1个f电子,所需电离能较小,镧系元素的特征氧化数为+3。
众所周知,电子层有一种保持或接近全空、半充满与全充满的倾向。
由于这个原因,铈Ce与铽Tb常呈现+4氧化态: Ce+4 (4f0)、Tb+4 (4f7)。
Pr+4 (4f1)、Dy+4 (4f8) 也可呈现+4氧化态,但没有Ce4+、Tb4+稳定;同理,Eu2+、Yb2+的电子结构分别为半充满的4f7和全充满的4f14,稳定性显然比Sm2+(4f6)、Tm2+(4f13)高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对中心原子内层 (n-1) d电子产生强烈 排斥d电子发生重排 内轨型配合物
(4)稳定性 由于 (n-1)d 轨道的能量比 nd 轨道的能 量低对同一个中心体而言,一般内轨型配合 物比外轨型配合物稳定。 5. 配合物的磁性 • 物质的磁性是指它在磁场中表现出来的性质。 • 物质受磁场的影响可分为:反磁性和顺磁性。
(2)原因—镧系(Ln)收缩(Lanthanide Contraction)
镧系元素的原子半径和Ln3+离子半径/pm
IIIB
21 Sc
160.6 73.2
原子序数 元素符号 原子半径 Ln3+离子半径
58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 70 Lu
39 Y
181 89.3
57 La
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4 106.1 103.4 101.3 99.5 97.9 96.4 95.0 93.8 92.3 90.8 89.4 88.1 86.9 85.8 84.8
[Sc(H2O)6]3+ [Ti(H2O)6]3+ [V(H2O)6]3+ [Cr(H2O)6]3+ [V(H2O)6]2+ [Cr(H2O)6]2+ [Mn(H2O)6]3+
无色溶液 紫色 绿色 紫色 紫色 蓝色 红色
第一过渡系金属水合离子的颜色(续前表)
d电子数 d5 d5 d6 d6 d7 d8 d9 d10 水合离子 [Mn(H2O)6]2+ [Fe(H2O)6]3+ [Fe(H2O)6]2+ [Co(H2O)6]3+ [Co(H2O)6]2+ [Ni(H2O)6]2+ [Cu(H2O)6]2+ [Zn(H2O)6]2+ 水合离子的 颜色 淡红色 淡紫色 淡绿色 蓝色 粉红色 绿色 蓝色 无色
外层只有1-2个电子,易失去,所以它
们都是金属元素。
18.1.3 原子半径
1. 周期的变化
(1)现象 第一过渡系元素的原子半径/pm
元素 r/pm 现象 Sc Ti V Cr Mn 117 Fe 117 Co Ni Cu 117 Zn 125
144 136 122 118
116 115
半径缓慢减小
5p
[Ag(NH3)2]+
NH3 NH3 4d
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型 (1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+ 3d8 外轨型
四面体
Ni2+
3d
4s
4p ClCl- Cl-
[NiCl4]2Cl3d 4s
4p
sp3杂化
(2)[Ni(CN)4]2-:Ni 3d84s2
W Cr Os Ag
18.1.6 单质的化学性质
第四周期过渡元素的金属的标准电极电势 元素
Sc Ti -1.63 V -1.2 Ni Cr -0.90 Cu Mn -1.18 Zn
元素
Fe
Co
-0.409 -0.282 -0.236 +0.337 -0.762
从左到右,金属的标准电极电势总趋 势升高,活泼性逐渐降低。
3d64s2 3d74s2 3d84s2 3d104s1 3d104s2 Fe +8 +8 Co +9 +4 Ni +10 +4 Cu +11 +3 Zn +12 +2
(1)现象:
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB Ⅷ
(第一列) 已制备出族氧化态化合物
(RuO4,OsO4,FeO4)。 Ⅷ (第二列、第三列)至ⅡB均 未制备出族氧化态化合物。
3. 过渡元素形成配合物的倾向
过渡元素具有能量相近的空价
电子轨道。 d轨道部分的填充电子,对核 的屏蔽效应小,吸引配体 能力强, 导致有很强的形成配合物的倾向。
4. 过渡元素形成的常见还原剂和氧化剂 常见还原剂和氧化剂
IIIB 还原剂 相应氧 化产物 氧化剂 相应还 原产物 IVB TiCl3 VB VIB CrCl2 VIIB VIII FeSO4
(1)定义
含有未成对电子的物质被磁场所吸引, 称此为顺磁性物质。 (2)表示
顺磁性物质产生的磁效应用磁矩表示
μ n(n 2) (B.M)
式中, µ为磁矩; n 为未成对电子数; B.M 为波尔磁子。
半径增大
(2)原因——屏蔽效应(Screening Effect)
2. 族的变化
(1)现象 d区各族元素原子的共价半径/pm
族
周期 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4
5
Sc Ti V Cr Mn Fe Co Ni Cu Zn 144 136 122 118 117 117 116 115 117 125
18.1.7 化合物的性质
1. 最高氧化态水合物的酸碱性 元素最高氧化态氧化物的水合物酸碱性
IIIB
碱 性 增 强
Sc(OH)3 弱碱性 Y(OH)3 中强碱
IVB
Ti(OH)4 两性 Zr(OH)4 两性 微碱
VB
HVO3 两性 Nb(OH)5 两性
VIB
H2CrO4 强酸性 H2MoO4 弱酸性
镧系收缩使它后面的各对过渡元素性
质相似,分离困难。 如下表: 过渡系元素的离子半径
ⅢB Y3+ 89.3 La3+ 101.6 ⅣB Zr4+ 80 Hf4+ 79 ⅤB Nb5+ 70 Ta5+ 69 ⅥB Mo6+ 62 W6+ 62
18.1.4 氧化态
1. 同周期元素族氧化态稳定性变化趋势 第一过渡系元素族氧化态和实际最高氧化态
过渡金属从左到右,族氧化态稳定
性下降,低氧化态稳定性上升。
3. 同族元素族氧化态稳定性变化趋势
(1)现象 低 氧 化 态 稳 定 性 增 强 高 氧 化 态 稳 定 性 增 强
IIIA Ga In Tl
VIB Cr Mo W
(2)规律
d区元素氧化态另一条明显的变化 是:同族元素自上而下形成族氧化态的
配位体至少有一对孤对电子 (如F- 、H2O、 CN- ); L将孤对电子填入杂化轨道,形成配键。
形成配位键的必要条件:
中心原子有空轨道,配位体有孤对电子
1. 配位数为2的配合物的杂化方式及空间构型 [Ag(NH3)2]+:Ag 4d105s1
sp杂化
Ag+ 4d10
直线形
外轨型
4d
5s
Fe2+ Co2+ Ni2+ Cu2+ Zn2+
稳定性增大
(1)现象
最不稳定的二价离子是 Sc2+,迄今
未制得 Sc2+ 水合物;
最稳定的二价离子是Zn2+,尚未发现
高于 +2 的氧化态。 (2)规律
d 区金属自左至右,低氧化态稳定性 上升。
(3)原因
核电荷逐渐增加对价层电子控制能
力逐渐加大的结果。
FeF63-
• 中心原子采用内层的(n-1)d、ns、np轨道
杂化所形成的配合物称内轨型配合物。
如:Ni(CN)42Fe(CN)63-
(2)形成条件 • 电负性高的配位原子, 易生成外轨型配合物, 如:卤素、H2O;
• 电负性低的配位原子, 易生成内轨型配合物,
如:CN-、NO2-;
• 内层d轨道已经全部占据且填充了成对电子。
VIIB
HMnO4 强酸性 HTcO4 酸性
La(OH)3 强碱性
Ac(OH)3 强碱
Hf(OH)4 两性 微碱
Ta(OH)5 两性
H2WO4 弱酸性
HReO4 弱酸性
酸 性 增 强
2. d区元素离子的颜色 第一过渡系金属水合离子的颜色
d电子数 水合离子 水合离子 的颜色
d0 d1 d2 d3 d3 d4 d4
(2)规律:
从左到右,形成族氧化态的能力下降。
(3)原因:
与 d 电子数有关:
成单电子数减少,一旦d轨道达到半满
后,d电子成键能力大大降低。
2. 同周期元素低氧化态(+2氧化态)稳定性变
化趋势 +2氧化态稳定性变化趋势
d电子 组态
d1
d2
d3
V2+
d4
Cr2+
d5
Mn2+
d6
d7
d8
d9
d10
M2+(aq) Sc2+ Ti2+
18.1 d区元素的通性 18.1.1 过渡元素与过渡系
副族 ⅢB ⅣB ⅤB ⅥB ⅦB
钪 钛 钒 铬 锰
Ⅷ ⅠB ⅡB
铁系、铂系
铜
锌
4
5
第一
第二
Sc
Y
Ti
V
Cr Mn Fe Co Ni
Cu
Ag
Zn
Cd
Zr Nb Mo Tc Ru Rh Pd
6
7
第三 La Hf Ta
W
Re Os Ir
Pt
Au
Hg
如Zn2+,3d10。 • NH3介乎于两种情况之间:时内时外,中心 离子的电荷增多,有利于形成内轨型配合物
Co(NH3)63+。
