第12章-d区元素和f区元素
第12章-d区元素和f区元素知识分享

第12章d区元素和f区元素【12-1】试用d区元素价电子层结构的特点来说明d区元素的特性。
解:d 区元素最后一个电子填充到d 轨道上,其价层电子组态为:(n-1)d1-8ns1-2,位于周期表的中部,包括ⅢB -ⅦB和Ⅷ族元素,它们都是过渡元素,每个元素都有多种氧化值。
同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。
同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。
各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。
同副族过渡元素的电离能递变不很规则。
熔点、沸点高, 密度大, 导电性、导热性、延展性好。
在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。
化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。
或:d 区元素价电子层结构是(n-1)d1-8ns1-2。
它们ns轨道上的电子数几乎保持不变,主要差别在于(n-1)d 轨道上的电子数不同。
又因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,由此构成了d区元素的一些特性:全部是金属,原子半径小,密度大,熔、沸点高,有良好的导热、导电性能,化学性质相近。
大多具有可变的氧化态。
由于d轨道有未成对电子,水合离子一般具有颜色。
由于所带电荷高,离子半径小,且往往具有未充满的d电子轨道,所以容易形成配合物。
【12-2】完成下列反应式:(1)TiO2+H2SO4(浓)→(2)TiO2++Zn+H+→(3)TiO2+C+Cl2→(4)V2O5+NaOH→(5)V2O5+H2SO4→(6)V2O5+HCl→(7)VO2++H2C2O4+H+→解:(1)TiO2 + H2SO4 (浓) = TiOSO4 + H2O(2)2TiO2+ + Zn + 4 H+ = 2 Ti3+ + Zn2+ +2 H2O(3)TiO2 + 2 C + 2 Cl2 (加热) = TiCl4 + 2 CO(4)V2O5 + 6 NaOH = 2 Na3VO4 + 3 H2O(5)V2O5 + H2SO4 = (VO2)2SO4 + H2O(6)V2O5 + 6 HCl = 2 VOCl2 + Cl2 + 3 H2O(7)2VO+ + H2C2O4 + 2 H+ = 2VO2+ + 2CO2 +2H2O【12-3】在酸性溶液中钒的电势图为已知φθ(Zn2+/Zn)=-0.76V, φθ(Sn2+/Sn)=-0.14V, φθ(Fe3+/Fe2+)=0.77V。
无机化学ds区、d区和f区过度元素ppt课件

上页 下页 目录 返回
8.2 铜族和锌族化合物 8.2.1 概述 价电子构型: (n-1)d10ns1-2 对于铜族元素,又称IB族,可失去s上的电子,又可失 去d上电子,氧化数+1、+2、+3。常见的是:Cu→+2, Ag→+1,Au→+3。 因 IB 族离子具有较强的极化力,变形性也大,故其二 元化合物一般有相当程度的共价性,难溶于水。 对于ⅡB族,只能失去最外层2个电子,形成+2价化合 物。汞有+1(以双聚离子[Hg-Hg]2+形式存在) 从 Zn2+→Cd2+→Hg2+ 极化力和变形性依次增强,当与 易变形的阴离子形成的化合物,有相当程度的共价性, 所以Hg2+的这类化合物溶解度较小,且显色。
上页 下页 目录 返回
AgNO3: 最重要的可溶性银盐,Ag与65%HNO3,反应后制得, Ag+具有氧化性 。 遇光或加热易分解而析出银,注意保存在棕色瓶中。 2AgNO3→2Ag+2NO2+O2 AgI在人工降雨中作冰核形成剂 HgCl2: Hg取sp杂化,为共价化合物,直线构型。熔点较低 (280℃),易升华,故俗名升汞,能溶于水(25℃, 7g/100g水),有毒,稀溶液可杀菌,∴外科用作手术器 械的消毒剂。
无机化学ds区 、d区和f区过 度元素
8.1 过渡元素概述
8.1.1 基本划区 价电子构型:(n-1)d1-10ns1-2 铜族:货币元素 锌族:低熔点重金属;汞(常温下唯一的一种液体金属) 钒族:酸土元素 铁系元素 铂系元素 镧系元素和锕系元素
上页 下页 目录 返回
8.1.2 过渡元素的特性 ● 过渡元素都是金属 ● 许多元素形成多种氧化态 除了s电子参与成键,d电子也部分或全部参与成键( ⅡB族除外) ,从而导致丰富的氧化还原行为。 ● 过渡元素的水合离子多具有特征颜色 过渡元素的离子在水溶液中常呈现一定的颜色,这与该 离子存在未成对d电子有关, d-d跃迁,一般d0, d10没有颜 色。 ● 形成配合物的能力比较强 过渡元素的离子存在空的ns,np和部分填充或全空的(n1)d轨道,可接受配位体的出对孤对电子。
常见非金属元素及其化合物

2019/8/17
11
§9 常见非金属元素及其化合物
• ⑤稀有贵金属:铂、铱、锇、钌、铑、钯; • ⑥放射性稀有金属:钋、镭、锕系元素。
稀有元素常用于黑色和有色冶金工业以制造特种钢、超 硬合金和耐火合金等。在原子能工业、化学工业、电气工 业、电子管、半导体、超音速飞机、火箭、航天技术方面 都占有重要的地位。
第九章
§9 常见非金属元素及其化合物
常见非金属元素及其化合物
学习内容
1、非金属元素元素性质的 相似性和递变规律。
2、常见非金属元素及其化 合物的性质。
IA
1
1H
氢
2
3
4
5
6
准金属 非金属
2 He
IIIA IVA VA VIA VIIA 氦
5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮氧 氟 氖
0.0314 0.046
0.00182 0.00125
0.00052 0.000072
2019/8/17
气体
CH4 Kr N2O H2 Xe
O3
体积分数 质量分数
/%
/%
0.00022 0.00012
0.00011 0.00029
0.0001 0.00015
0.00005 0.000003
0.0000087 0.000036
镧铈 镨 钕 钷 钐 铕 钆 铽镝 钬 铒 铥 镱 镥
89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101Md 102No 103 Lr
课件化学--d区元素

钛或钛合金的密度与人的骨 骼相近,对体内有机物不起化学 反应,且亲和力强,易为人体所 容纳,对任何消毒方式都能适应, 因而常用于接骨、制造人工关节 等。又称为生命金属。
用水浸取除去可溶盐,得海绵状钛,电弧熔 融得钛锭。
§ 2-2 钛的重要化合物
1. 二氧化钛
天然二氧化钛称“金红石”,含杂质。
人工制备纯TiO2俗称“钛白粉”,是优良的白色 涂料,着色力强,遮盖力强,化学稳定性好,优于
除s电子外,d电子可参与成金属键,自左向右未成对价电 子增多,至VIB族(铬族)可能提供6个单电子,相互作用力大, 金属键强,因此在过渡系中,铬族(Cr,Mo,W)熔点最高, 硬度也很大,除Mn和Tc外(熔点反常)随后自左向右熔点又有 规律下降。
铬族价电子层构型: (n-1)d5ns1
熔点变化示意图
此外,钛或钛合金还具有特 殊的记忆功能、超导功能和储氢 功能等。
Zr,Hf是稀有金属,锆矿主要有锆英石ZrSO4, 价电子结构(n-1)d2ns2,d0电子结构较稳定, 所以除最外层s电子,次外层d电子也参加成键, Ti,Zr,Hf最稳定的氧化态是+4。其次是+3, +2较少见。
由于镧系收缩,铪的离子半径与锆接近,所以
FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O TiOSO4 + 2H2O = H2TiO3 + H2SO4 H2TiO3 = TiO2 + H2O
d,f区元素

12.1.1 d区元素的特殊性
d区元素显示出许多区别于主族元素的性质:
• 熔沸点高、硬度密度大的金属大都集中在这一区 • 同一周期从左到右,元素化学性质的变化远不如s区p区
显著。
• 不少元素形成有颜色的化合物 • 许多元素形成多种氧化态从而导致丰富的氧化还原行为 • 形成配合物的能力比较强 ,参与工业催化过程和酶催
化过程的能力强
12.2 钒
• 钒的价电子层结构为3d34s2,5个电子都有成键作用,所以 • 在酸性介质中,钒的元素电势图为
A / V
VO2+ 主要氧化态为+5,但也存在+4,+3,+2。
-0.25 -1.2 1.0 VO2+ 0.36 V3+ V2+ V -0.25
所以V2+、V3+具有还原性,VO2+是稳定的,而VO2+具有氧化 性。 不同的氧化态的钒具有不同的颜色。例如: VO2+(黄色)可 被Fe2+、H2C2O4等还原为VO2+(蓝色)
[Cr(H2O)6]Cl3 紫色
[Cr(H2O)5Cl]Cl2· H2O 浅绿 [Cr(H2O)4Cl2]Cl· 2H2O 深绿
2. Cr(VI)的化合物
Cr(VI)的化合物通常是由自然界存在的铬铁矿Fe(CrO2)2,
借助于碱熔法制得的,即把铬铁矿和Na2CO3混合,并在空 气中煅烧。用水浸取煅烧后的熔体,Na2CrO4进入水中,浓 缩,得黄色晶体Na2CrO4;酸化得红色晶体。 4Fe(CrO2)2 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
电子分别填充在3d 亚层4d 亚层和5d 亚层上.
ds区,d区和f区元素

子构型具有接受配位体孤对电子的条件,因此它
们容易形成配合物,一般容易形成氟配合物、氰 配合物和氨配合物。 此外,过渡元素氧化物水合物的酸碱变化规律 和主族元素相似。对同种元素而言,低价的显碱
性,高价的显酸性。注意p304列出的ⅢB-ⅦB族过
渡元素最高价态氧化物水合物的酸碱性。
8.2 铜族和锌族元素的化合物 8.2.1 通性
3. 锌配合物 Zn2+和氨水、KCN等能形成无色的四配位离子: [Zn(NH3)4]2+、[Zn(CN)4]2-、[Zn(CN)4]2-用于电镀中 4. 汞配合物 Hg(I)形成配合物倾向较小。 Hg(II)易和CN-、SCN-、Cl-、Br-、I-离子均生成 [ML4]2-配离子。
Hg2++2I-→HgI2↓(红色)+2I-→[HgI4]2[HgI4]2-与碱混合后叫奈氏试剂,用于鉴定NH4+、
3. 形成配合物(Zn2+,Al3+的分离)
Zn 2 Al3
2 NH 3O H
Zn(OH ) 2 Al(OH ) 3
2 NH 3O H
[ Zn( NH 3 ) 4 ] 2 (白色) Al(OH )(白色) 3
8.2.3 重要的盐类 1. 几种常用的盐 硫酸铜、硝酸银、氯化汞、氯化亚汞(p306-308自 己看书,了解基本性质和用途) 2. Cu2+和Cu+的相互转化 从Cu(I)结构(3d10)看,Cu(I)是稳定的,如自然 界中有Cu2O和Cu2S的矿物存在。但在水溶液中Cu+ 易歧化,这是由于Cu2+的电荷比Cu+多,半径又小, 所以Cu2+的水合焓(-2100kJ· -1)比Cu+的(-593 mol kJ· -1)代数值小得多,∴水溶液中Cu2+比Cu+稳)4)]2+、[CuCl4]2-、[Cu(NH3)4]2+等,
高中化学电子排布、第一电离能和电负性知识归纳

高中化学电子排布、第一电离能和电负性知识归纳一、原子结构1. 原子的组成: 原子核、核外电子2. 原子的特点:原子不显电性,体积小,质量小,质量主要集中在原子核上,原子核的密度非常大3. 核外电子排布规律(1 )能量最低原理(2 )每一层最多容纳电子数:2n 2 个(3 )最外层电子数不超过8 个(K 层为最外层时不超过2 个)(4 )次外层电子数不超过18 个,倒数第三层不超过32 个二、能层与能级能量最低原理: 原子的电子排布遵循能使整个原子的能量处于最低状态基态原子: 处于最低能量的原子1. 能层: 核外电子的能量是不同的, 按电子能量差异,可以将核外电子分成不同的能层——电子层同一能层的电子,能量也可能不同,还可以分成不同能级能级数2. 能级:s 、p 、d 、f····以s 、p 、d 、f···· 排序的各能级可容纳的最多电子数依次为1 、3 、5 、7 、······ 的二倍。
能级数= 能层序数(n)三、构造原理1. 电子排布式Na :1s 2 2s 2 2p 6 3s 1试书写N 、Cl 、K 、26 Fe 原子的核外电子排布式注意:24 Cr :1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 129 Cu :1s 2 2s 2 2p 6 3s 2 3p 26 3d 10 4s 1离子电子排布式书写——先失去最外层电子与能量最低原则无关1) 、能量最低原理2 )、每个原子轨道上最多能容纳__2__ 个电子,且自旋方向__ 相反____ (泡利不相容原理)3 )、当电子排布在同一能级时,总是__ 首先单独占一个轨道__ ,而且自旋方向_ 相同__。
(洪特规则)4) 、补充规则:全充满(p 6 ,d 10 ,f 14 )和半充满(p 3 ,d 5 ,f 7 )更稳定2. 简化电子排布式15P:[Ne]3s 2 3p 3 (表示内层电子与Ne 相同。
第12章镧系与锕系元素

Th 钍
6d1 7s2
6d2 7s2
Bk 锫(pei)
Cf 锎 Es 锿(ai)
5f9 6d0 7s2
5d10 6d0 7s2 5f11 6d0 7s2
Pa 镤(pu) 5f2 6d1 7s2
U 铀
Np 镎 Am 镅 Cm 锔
5f3 6d1 7s2
5f4 6d1 7s2 5f7 6d0 7s2 5f7 6d1 7s2
+3
+2
Ba2+ Sm Eu Yb
La3+(4f 0)、 Gd3+(4f 7) 和 Lu3+(4f 14) 为稳定结构,难以生成 +2 和 +4 氧化态; Ce3+(4f 1) 和 Tb3+(4f 8) 失去1个电子即达稳定结构, 易生成 +4 氧化态;Eu3+(4f 6) 和 Yb3+(4f 结构,易出现 +2 氧化态 .
镧系元素的原子、离子半径
元素
57La 58Ce 59Pr
60Nd
61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er
69Tm
70Yb 71Lu
Ln价电子构型 原子半径/pm 187.9 4f05d16s2 182.4 4f15d16s2 182.8 4f3 6s2 182.1 4f4 6s2 181.1 4f5 6s2 180.4 4f6 6s2 204.2 4f7 6s2 180.1 4f75d16s2 178.3 4f9 6s2 177.4 4f10 6s2 176.6 4f11 6s2 175.7 4f12 6s2 174.6 4f13 6s2 4f145d16s2 193.9 4f145d16s2 173.5
高中化学原子结构和元素的性质

思考与交流
从元素周期表中查出铜、银、金的外围电子 层排布。它们是否符合构造原理?
元素
Cu
Ag
Au
电子层排布
元素周期表 3d104s1 4d105s1 5d106s1
构造原理 3d94s2
4d95s2 5d96s2
结论
有少数元素的基态原子的电子排布对 于构造原理有一个电子的偏差,如Cu、Ag、 Au等。
最外层电子数:从1到8 元素周期系的形成是由于元素的原子核外电子的排
布发生周期性的重复
科学探究(教材p14)
1、横行
七个周期;2,8,8,18,18,32种;每一周期开头第一 个元素的最外层的排布通式为ns1,结尾元素的电子排 布式为ns2np6;第一周期只有一个1s能级,其结尾元素 的电子排布式为1s2,跟其他周期的结尾元素的原子电 子排布式不同。
4. 各能级包含的原子轨道数:
(1)ns能级各有1个原子轨道;
(2)np能级各有3个原子轨道; (3)nd能级各有5个原子轨道; (4)nf能级各有7个原子轨道;
第二周期元素基态原子的电子排布如下图所示 (在图中每个方框代表一个原子轨道,每个箭头 代表一个电子):
第二周期元素基态原子的电子排布图
基态与激发态、光谱 1.基态原子与激发态原子
(1)基态原子:处于最低能量 的原子叫基态原子。
(2)激发态原子: 当基态原子的电子 吸收能量后,电子 会跃迁到较高的能 级,变成激发态原 子。
2.原子光谱: 不同元素的原子发生跃迁时会吸收或释 放不同的光,可以用光谱仪摄取各种 元素的电子的吸收光谱或发射光谱,总 称为原子光谱。
• P区元素:最后一个电子填充在p能级上的元素。 结构特点:ns2np1-6。 包括ⅢA族-ⅦA族和0族。 绝大多数为非金属。
8 ds区、d区和f区

8.4 锰的重要化合物 价层电子构型为 (n-1)d5ns2 ,锰也许是氧化态最多的元 素,除多种正氧化态外还显示多种负氧化态(例如-1,-2和3氧化态), 最常见的则是+7、+2和+4氧化态。 单质锰主要用于合金钢 Mn(Ⅱ)盐: Mn(Ⅱ)强酸盐均溶于水,只有少数弱酸盐如MnS、 MnCO3难溶。 Mn(Ⅱ)盐从溶液中结晶出来时,常带结晶水的粉红色 晶体,如MnSO4· 7H2O,水溶液浓度大时为粉红色,少时 几乎为无色。 Mn2+(3d5)稳定,只有强氧化剂如NaBiO3、 (NH4)2S2O8、PbO2等才能将Mn2+氧化为MnO4-等: 2Mn2++14H++NaBiO3→2MnO4-+5Bi3++5Na++7H2O 此反应用于鉴定Mn2+。
上页 下页 目录 返回
铬化合物毒性浅析 绝大多数三价铬化合物不溶于水,无毒、无害,但水 溶性无机三价铬盐极易在酸性环境下水解,形成的游离酸 对人体有剌激作用。 六价铬毒性主要是由于强氧化性对有机体的腐蚀与破坏, 可以通过吸入、接触、口服造成人体中毒。吸入六价铬将 引起呼吸道感染,粘膜溃疡,甚至鼻穿孔;皮肤接触六价 铬可能引发皮炎,伤口若接触六价铬将出现铬疮;口服大 剂量六价铬化合物将引起消化系统腐烂,出现肾损伤。流 行病学研究证实,长期暴露在高浓度六价铬的气雾中的工 人,呼吸系统癌症(主要是肺癌)发病率高于平均值,其 潜伏期超过15年。
上页 下页 目录 返回
Ag2O 和 MnO2、Cr2O3、CuO 的混合物能在室温下, 将 CO 迅速氧化成 CO2,可用于防毒面具中。 Ag2O+CO—→2Ag+CO2 Ag+,Cu2+,Zn2+盐溶液加入适量氨水,生成沉淀,但 都能溶于过量氨水中。 8.2.3 重要的盐类 CuSO4: CuSO4· 5H2O实际为[Cu(H2O)4]SO4· H2O 无水CuSO4为白色粉末,吸水性强,吸水后显兰色, 可用于检验有机液体中的水分,也可作干燥剂,从有机液 体中除去水分。 2Cu2++4I-→2CuI+I2 铜盐含量的定量分析法。
第十二章:.硼族元素

“缺电子化合物”有空的价层轨道,所以有非常强的 继续接受电子对的能力, (1)自身聚合 (2)路易斯酸 (3)多中心缺电子键
§12-3 硼及其化合物(Boron and its Compounds) 一、单质 1、单质硼有多种同素异形体
4MnSO4 10NaBiO3 14H2 SO4 4NaMnO4 5Bi2 (SO4 )3 3Na2 SO4 14H2O
3、解释: (1)西奇威克:刚充满的d(或f)亚层的屏蔽作用较弱,价 电子受到核引力较强,强穿透力的ns电子极难失去;
(2)德拉戈:重元素的价层轨道的重迭程度较差;全满 d(和f)亚层强烈排斥键合原子的原子实。
(i) B2O3与SiO2:固态酸性; (ii) H3BO3与H4SiO4都是很弱的酸; (iii) 多硼酸盐与多硅酸盐结构相似; (iv) 硼烷、硅烷可燃性气体。
(2)常温不活泼,仅与F2反应,在高温下活泼, (3) 与氧化性的酸反应,生成H3BO3
B + 3HNO3 (浓) = H3BO3 + 3NO2
2B+3X2 2BX3
3CaF2 + B2O3 + 3H2SO4 (浓) = 2BF3 + 3CaSO4 + 3H2O
c.卤化法
d.置换法
B2O3 + 3C + 3Cl2 = 2BCl3 + 3CO
BF3 (g)+AlCl3 AlF3 + BCl3
BF3 (g)+ AlBr3 AlF3 + BBr3
过渡元素(1)

VO2 Fe2 2 H VO 2 Fe3 H 2O 2VO2 H 2C2O4 2 H VO 2 2CO2 2 H 2O VO2 2 I 4 H V 3 I 2 2 H 2O 2VO2 3Zn 8H 2V 2 3Zn 2 2 H 2O
在酸性溶液中,VO2+可被Fe2+,SO32-,H2C2O4,I-,Zn等还原剂还原,还原 产物具有丰富多彩的颜色。 Fe2+只能将V(V)还原为VO2+,I-只能将V(V)还原 为V3+,而Zn可将其还原为V2+。如在NH4VO3的酸性溶液中加入Zn,会依次 看到蓝色(VO2+)绿色(V3+)及紫色(V2+),这是一种分级还原的过程。 V(Ⅲ),V(Ⅱ)是强还原剂,尤其在碱性条件下,很容易被空气中的氧所氧化, V(Ⅱ)的化合物还能从水中置换出氢。
二、钛及其化合物
二氧化钛的制取
二氧化钛的工业生产,几乎包括了全部无机化学工艺过程,因而被喻 为“工艺艺术品”。
二氧化钛的生产可采用硫酸法或氯化法,以钛铁矿为原料的二氧化钛 生产常以硫酸法为主。该法主要过程有:(1)硫酸分解精矿制取硫酸氧钛溶 液(2)净化除铁(3)水解制偏钛酸(4)偏钛酸煅烧制二氧化钛。 钛铁矿精矿成分除FeTiO3外,还有Fe2O3以及SiO2, Al2O3, MnO, CaO, MgO等杂质。160~200°C下,用浓硫酸分解精矿的主要反应如下:
四、铬及其化合物
铬的价电子结构为3d54s1,可形成氧化值为+2、+3、+6的化合物,其中 +3、+6的化合物较常见。铬的化合物主要有氧化物、氢氧化物、含氧酸及其 盐类,呈现多种颜色。
f区元素
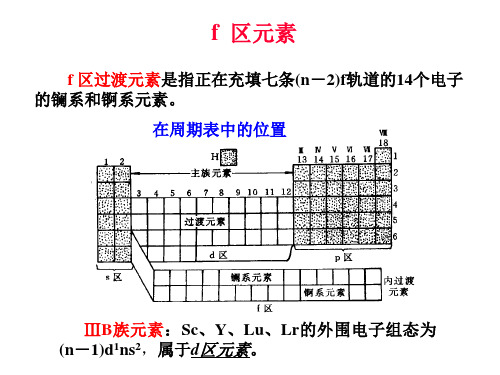
f 区过渡元素是指正在充填七条(n-2)f轨道的14个电子 的镧系和锕系元素。 f 区元素在周期表中的位置如图所示:
ⅢB族元素:Sc、Y、Lu、Lr的外围电子组态为 (n-1)d1ns2,属于d区元素。
镧系元素和锕系元素
习惯上所称的镧系元素是指从 57 La-71Lu的15个元素, 以Ln表示。本来镧系元素并不包括Lu(镥), 将它归在一起 是因Lu与其前面的从 57La到 70Yb(镱)的14个填充4f轨道电 子的元素的性质非常相似。 同样,Lr(铑)与其前面的89Ac到102No(锘)的14个填 充5f轨道电子的元素性质也非常相似,因而在习惯上也把从 89Ac到103Lr的15个元素统称为锕系元素,记作An,按理锕系 元素并不包括Lr。
而呈现+2氧化态。显然镧系离子在氧化态变化的 周期性规律正是镧系元素电子层排布呈现周期性规 律的反映。
镧系元素的光学性质
镧系离子的颜色来源于: ① 荷移跃迁 电荷从配体的分子轨道向金属离子空轨道跃迁 。其光谱的谱带具有较大的强度和较短的波长,且受配体及金 属离子的氧化还原性所影响。 ② f-d(u→g)跃迁 光谱选律所允许的跃迁。因而谱线强度 大,一般出现在紫外区,其中+2价离子也可能出现在可见区。 ③ f-f(u→u)跃迁 光谱选律所禁阻的跃迁。然而, 由于中心 离子与配体的电子振动偶合、晶格振动和旋-轨偶合使禁阻产 生松动,从而使f-f跃迁得以实现。 可以发现: 除La3+和Lu3+的4f亚层为全空或全满外,其余+3 价离子的4f电子都可以在7条4f轨道之间任意配布,从而产生多 种多样的电子能级,这种能级不但比主族元素多,而且也比d区 过渡元素多,因此,+3价镧系元素离子可以吸收从紫外、可见 到红外光区的各种波长的辐射。据报导,具有未充满f电子轨道 的原子或离子的光谱约有3万条可以观察到的谱线。
高中化学竞赛中过渡元素的讲解

过渡元素(一)要求(1)从电子层结构的特点理解d区元素的通性。
(2)了解钛、钒、铬重要化合物的化学性质。
了解钼、钨的重要化合物。
(3)掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的化学性质以及各氧化态锰之间相互转化关系。
(4)掌握铁、钴、镍的化合物在反应性上的差异。
熟悉铁、钴、镍的重要配合物。
(5)了解铂及其重要化合物的性质。
(一) 过渡元素通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
因此过渡元素实际上包括d区元素和f区元素。
本章主要讨论d区元素。
d区元素价电子构型为(n-1)d1~8ns1~2(Pd 4d10和Pt 5d96s1例外), 最外两层电子均未填满。
由此构成了d区元素如下通性:(1)单质相似性最外层电子一般不超过2个,较易失去,所以它们都是金属。
又因为d区元素有较大的有效核电荷,d电子有一定的成键能力,所以它们一般有较小的原子半径、较大的密度、较高的熔点和良好的导电导热性。
例如Os的密度(22.488 g∙cm−3),W的熔点(3380 o C,Cr的硬度都是金属中最大的。
d区元素化学活泼性也较接近。
(2)有可变氧化态因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,所以除ⅢB族只有+3氧化态外,其他各族都有可变的氧化态。
氧化态变化趋势是同一周期从左到右逐渐升高,然后降低;同一族从上到下高氧化态趋于稳定。
例如MnO4−有强氧化性,而ReO4−无氧化性。
例1对同一族元素来说,随周期数增加,为什么主族元素低氧化态趋于稳定而过渡元素高氧化态趋于稳定?主族元素(主要表现在ⅢA,ⅣA,ⅤA族)随周期数增加,低氧化态趋于稳定的原因一般归因于“惰性电子对效应”。
为什么过渡元素随周期数增加高氧化态趋于稳定呢? 仔细研究一下过渡元素的电离能可发现:I1和I2往往是第二、第三过渡系列比第一过渡系列的大,但从I3开始,往往第二、第三过渡系列比第一过渡系列的小。
d区元素和f区元素

2KMnO4 + 3K2SO3 + H2O = 2MnO2↓ + 3K2SO4 + 2KOH
强碱性介质:
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
整理课件
17
§12.6 铁系元素
元素
Fe
电子组态 3d64s2
氧化态 +2,+3,(+6)
整理课件
26
2. 后果
(1) Y3+半径88pm落在Er3+88.1pm附近,Y进入稀土元素。 Sc半径接近Lu3+,常与Y3+共生,Sc也成为稀土元素。
(2) Zr与Hf、Nb与Ta、Mo与W三对元素半径十分接近、化 学性质十分相近,常伴生在一起,难以分离。
Zr(IV) Nb(V) 80pm 70pm
较稳定
1.507
0.564
2.26
0.95
1.51
-1.19
θ A
MnO4-——MnO42-——MnO2——Mn3+——Mn2+——Mn
1.695
1.23
整理课件
14
0.564
0.60
-0.20
0.1
-1.55
θ B
MnO4-——MnO42-——MnO2——Mn(OH)3——Mn(OH)2——Mn
密度最大者 — Os ; 最易吸收H2者— Pd。
整理课件
3
2. 氧化态
元 素 Sc Ti V
+2 +2
+3 +3 +3
氧化态
+4 +4
第十二章d区元素-2014版

2Cr3 3S2O82 7H2O Ag+ Cr2O72 SO24 14H 2CrO2- 3H2O2 2OH- 2CrO42 4H2O
3)氧化性
2Cr3 Zn 2Cr2 Zn2
+3价铬的配合物Cr3+具有较强的配合能力,容易与H2O、NH3、Cl-、 CN-等形成配位数为6的配离子。
-0.74
碱性溶液中
-1.3
2-
Cr O4
-0.12
Cr(OH)3 -1.1
-1.4
Cr(OH)2
Cr -1.2
-
Cr O2
多形成+3、+6价的化合物
8.3.1.2 铬的化合物
Cr2O3(铬绿)
微溶于水,两性化合物,能溶于酸,也溶于浓的强碱。
4Cr 3O2 Δ 2Cr2 O 3
(NH 4 )2 Cr2O7 Δ Cr2O3 N2 4H 2O
1)水合离子均有颜色
M2+水合离子 M2+无水盐
[Fe(H2O)6]2+ 浅绿色
Fe2+ 白色
[Co(H2O)6]2+ 粉红色
Co2+ 蓝色
[Ni(H2O)6]2+ 亮绿色
Ni2+ 黄色
2)它们的硝酸盐、硫酸盐、氯化物等易溶于水,在水 中存在微弱的水解,溶液显酸性。碳酸盐、磷酸 盐、硫化物则难溶于水
第十二章 d区元素
本单元内容
第一节 d区元素通性 第二节 Cr元素 第三节 Mn 元素 第四节 Fe、Co、Ni元素
第一节 d区元素概述
IIIB-VIIIB (n-1)d1-8ns1-2)
过渡元素
第一节 过渡元素通性
厦门大学无机化学第12章-ds区元素

第十二章ds区元素12。
1 铜族元素 (1)12。
2 锌族元素 (10)12.1 铜族元素12。
1.1 铜族元素通性铜族元素1。
铜族元素通性铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。
有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高.对于Cu、Ag、Au,Δ(I2—I1)Au 〈Δ(I2—I1)Cu < Δ(I2-I1)Ag所以常见氧化态物+3,+2,+1。
铜、银、金的标准电势图如下所示:12.1.2 铜族元素金属单质2。
铜族元素金属单质(1).物理性质铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。
这可能与d电子也参与形成金属键有关。
由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。
铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。
(2)。
化学性质铜族元素的化学活性远较碱金属低,并按Cu—-Ag-—Au的顺序递减.在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。
铜绿可防止金属进一步腐蚀,其组成是可变的。
银和金不会发生该反应。
空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。
()在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。
但当有空气存在时,铜可缓慢溶解于这些稀酸中:浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3—,使Cu == Cu++e-的平衡向右移动:铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:铜、银、金在强碱中均很稳定。
12。
1。
3 铜族元素重要化合物3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第12章 d区元素和f区元素【12-1】试用d区元素价电子层结构的特点来说明d区元素的特性。
解:d区元素最后一个电子填充到d轨道上,其价层电子组态为:(n-1)d1-8ns1-2,位于周期表的中部,包括ⅢB-ⅦB和Ⅷ族元素,它们都是过渡元素,每个元素都有多种氧化值。
同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。
同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。
各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。
同副族过渡元素的电离能递变不很规则。
熔点、沸点高,密度大,导电性、导热性、延展性好。
在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。
化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。
或:d区元素价电子层结构是(n-1)d1-8ns1-2。
它们ns轨道上的电子数几乎保持不变,主要差别在于(n-1)d轨道上的电子数不同。
又因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,由此构成了d区元素的一些特性:全部是金属,原子半径小,密度大,熔、沸点高,有良好的导热、导电性能,化学性质相近。
大多具有可变的氧化态。
由于d轨道有未成对电子,水合离子一般具有颜色。
由于所带电荷高,离子半径小,且往往具有未充满的d电子轨道,所以容易形成配合物。
【12-2】完成下列反应式:(1)TiO2+H2SO4(浓)→(2)TiO2++Zn+H+→(3)TiO2+C+Cl2→(4)V2O5+NaOH→(5)V2O5+H2SO4→(6)V2O5+HCl→(7)VO2++H2C2O4+H+→解:(1)TiO2 + H2SO4 (浓) = TiOSO4 + H2O(2)2TiO2+ + Zn + 4 H+ = 2 Ti3+ + Zn2+ +2 H2O(3)TiO2 + 2 C + 2 Cl2 (加热) = TiCl4 + 2 CO(4)V2O5 + 6 NaOH = 2 Na3VO4 + 3 H2O(5)V2O5 + H2SO4 = (VO2)2SO4 + H2O(6)V2O5 + 6 HCl = 2 VOCl2 + Cl2 + 3 H2O(7)2VO+ + H2C2O4 + 2 H+ = 2VO2+ + 2CO2 +2H2O【12-3】在酸性溶液中钒的电势图为已知φθ(Zn2+/Zn)=-0.76V, φθ(Sn2+/Sn)=-0.14V, φθ(Fe3+/Fe2+)=0.77V。
问实现下列变化,各使用什么还原剂为宜?(1)VO2+→V2+(2)VO2+→V3+(3)VO2+→VO2+解:(1)VO2+→ V2+:E⊖(VO2+/ V2+) = 0.37V ,用Zn、Sn(2)VO2+→ V3+:E⊖(VO2+/ V3+) = 0.68V ,用Zn、Sn(3)VO2+→ VO2+:E⊖(VO2+/ VO2+) = 1.0V ,用Fe2+、Zn、Sn【12-4】完成下列反应式:(1)(NH4)2Cr2O7→(2)Cr2O3+NaOH→(3)Cr3++NH3·H2O→(4)Cr(OH)4-+Br2+OH-→(5)Cr2O72-+Pb2++H2O→(6)MoO42-+NH4++PO43-+H+→(7)Na2WO4+HCl→解:(1) (NH4)2Cr2O7 (加热) = Cr2O3 + N2 + 4 H2O(2)Cr2O3 + 2 NaOH = 2 NaCrO2 + H2O(3)Cr3+ + 6 NH3• H2O = [Cr(NH3)6]3+ + 6 H2O(4)2Cr(OH)4- + 3Br2+ 8OH- = 2CrO42- +6Br- + 8H2O(5)Cr2O72- + 2 Pb2+ + H2O = 2 PbCrO4 +2 H+(6)12 MoO42- + 3 NH4+ + 3 PO43- + 24 H+ = (NH4)3[P(Mo3O9)4]↓ + 12 H2O(7)Na2WO4 + 2 HCl = H2WO4↓+ 2 NaCl【12-5】BaCrO4和BaSO4的溶度积相近,为什么BaCrO4可溶于强酸,而BaSO4则不溶?解:由于在溶液中存在着如下平衡:2CrO42- +2 H+⇌ Cr2O72- + H2O。
在强酸溶液中,平衡想右移动,溶液中游离铬酸根浓度大大降低,几乎都转化为重铬酸根,而重铬酸钡是易溶物质,所以铬酸钡能溶于强酸中。
因为硫酸是强酸,在强酸溶液中游离的硫酸根浓度几乎不会降低,所以硫酸钡不溶。
【12-6】以K2Cr2O7为主要原料制备K2CrO4,CrCl3和Cr2O3,用方程式表示各步的反应。
解:【12-7】试用热力学原理判断,(NH4)2Cr2O7的下列两种分解过程,哪种反应趋势更大?(1)(NH4)2Cr2O7(s)=Cr2O3(s)+N2(g)+4H2O(g)(2)(NH4)2Cr2O7(s)=2Cr2O3(s)+NH3(g)+H2O(g)解:【12-8】完成下列反应式:−∆(1)MnO2+KOH+KClO3−→(2)MnO4-+H2O2+H+→(3)MnO4-+NO2-+H2O→(4)MnO4-+NO2-+OH-→(5)K2MnO4+HAc→解:(1)3 MnO2 + 6 KOH + KClO3(加热) = 3K2MnO4 + KCl + 3 H2O(2)2MnO4- + 5H2O2+ 6H+ = 2Mn2+ + 5O2 + 8H2O(3)2MnO4-+ 3NO2-+ H2O = 2MnO2 + 3NO3-+ 2OH-(4)2MnO4- + NO2- + 2OH- = 2MnO42- +NO3- + H2O(5)3 K2MnO4 + 4 HAc = 2 KMnO4 + MnO2 + 2 H2O + 4 KAc【12-9】以MnO2为主要原料制备MnCl2,K2MnO4和KMnO4,用方程式来表示各步反应。
MnO+H O+2H=Mn+O+2H O解:+2+222222K MnO+Cl=2KMnO+2KCl24242MnO+O+4KOH=2K MnO+2H O22242【12-10】完成下列反应式:(1)FeCl3+NaF→(2)Co(OH)3+H2SO4→(3)Co2++SCN-(4)Ni(OH)2+Br2+OH-→(5)Ni+CO→解:(1)FeCl3 + 6 NaF = Na3[FeF6] + 3 NaCl(2)4Co(OH)3 + 4H2SO4 = 4CoSO4 + O2 + 10H2O(3)Co2+ + 4 SCN- = [Co(SCN)4]2-(4)2 Ni(OH)2 + Br2 + 2 OH- = 2 Ni(OH)3 + 2Br-(5)Ni + 4CO = Ni(CO)4【12-11】铁能使Cu2+还原,而铜能使Fe3+还原,这两事实有无矛盾?解:无矛盾。
在前一个事实中,铁是还原剂,二价铜离子是氧化剂,查书附录得:Eθ(Cu2+/Cu)=0.337V,Eθ(Fe2+/Fe)=-0.440V,氧化剂标准电极电位高于还原剂标准电极电位近0.8V,反应可以自发进行;而在后一个事实中,三价铁离子是氧化剂,铜是还原剂,Eθ(Fe3+/Fe2+)=0.771V,氧化剂标准电极电位高于还原剂标准电极电位约0.43V,反应可以自发进行。
【12-12】用反应式说明下列现象:(1)在Fe2+溶液中加入NaOH溶液,先生成灰绿色沉淀,然后沉淀逐渐变成红棕色。
(2)过滤后,沉淀用酸溶解,加几滴KSCN溶液,立刻变成血红色,再通入SO2气体,则血红色消失。
(3)向红色消失的溶液中滴加KMnO4溶液,其紫红色会褪去。
(4)最后加入黄血盐溶液生成蓝色沉淀。
解:(1) Fe 2+ + 2OH - = Fe(OH)2↓ 4 Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(2) Fe(OH)3 + 3H + =Fe 3+ + 3H 2O Fe 3+ + nSCN - = Fe(NCS)n (3-n)+ Fe(NCS)n 3-n + SO 2 + 2H 2O =2Fe 2+ + SO 42- + 2nSCN - + 4H +(3) MnO 4- + 5Fe 2+ + 8H + =M n 2+ + 5Fe 3+ + 4H 2O MnO 4- + 10SCN - + 16H + = 2M n 2+ + 5(SCN)2 + 8H 2O (4) Fe 3+ + Fe(CN)4- + K +=KFe(CN)Fe ↓ 1) Fe 2+ + 2OH - = Fe(OH)2↓4 Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(2) Fe(OH)3 + 3H + =Fe 3+ + 3H 2O Fe 3+ + nSCN - = Fe(NCS)n (3-n)+ Fe(NCS)n 3-n + SO 2 + 2H 2O =2Fe 2+ + SO 42- + 2nSCN - + 4H +(3) MnO 4- + 5Fe 2+ + 8H + =M n 2+ + 5Fe 3+ + 4H 2O MnO 4- + 10SCN - + 16H + = 2M n 2+ + 5(SCN)2 + 8H 2O (4) Fe 3+ + Fe(CN)4- + K + =KFe(CN)Fe ↓【12-13】指出下列实验结果,并写出反应式:(1)用浓盐酸分边处理Fe(OH)3,CoO(OH)及NiO(OH)沉淀。
(2)分边在FeSO 4,CoSO 4及NiSO 4溶液中加入过量氨水,然后放置在无CO 2是空气中。
解:(1)沉淀都可以溶解,且CoO(OH),NiO(OH)与浓盐酸反应有气体放出。
(1)沉淀都可以溶解,且CoO(OH), NiO(OH)与浓盐酸反应有气体放出Fe(OH)3 + 3HCl = FeCl 3 + 3H 2O2CoO(OH) + 6HCl = 2CoCl 2 + Cl 2↑ + 4H 2O 2NiO(OH) + 6HCl = 2NiCl 2 + Cl 2↑ + 4H 2O(1)FeSO 4中加入氨水,先得到白色胶状沉淀,放置在空气中一段时间,得到棕红色沉淀,CoSO 4加入氨水后无沉淀,放置在空气中一段时间变为橙黄色溶液, NiSO 4加入氨水得到蓝色溶液。
Fe 2+ + 2NH 3·H 2O = Fe(OH)2↓ + 2NH 4+4 Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3Co 2+ + 6NH 3·H 2O = [Co(NH 3)6]2+ + 6H 2O4 [Co(NH 3)6]2+ + O 2 + 2H 2O = 2 [Co(NH 3)6]3+ + 4OH -Ni 2+ + 6NH 3·H 2O = [Ni(NH 3)6]2+ + 6H 2O【12-14】已知Cr(CO)6,Ru(CO)5和Pt(CO)4都是反磁性的羰基化合物。
