糖化血红蛋白(HbA1c)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)产品技术要求sainuopu
糖化血红蛋白测定试剂盒(荧光免疫层析法)产品技术要求

糖化血红蛋白测定试剂盒(荧光免疫层析法)组成:每种包装规格含相应人份数的检测卡、加样枪头、干燥剂、样本缓冲液及1个校准信息卡。
不同批号试剂盒中各组分不可互换。
预期用途:用于体外定量测定人全血中糖化血红蛋白(HbA1c)的百分比含量。
2.1外观1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2装量样本缓冲液装量偏差应不大于±10%。
2.3宽度试纸条宽度为4.0±0.2mm。
2.4移行速度液体移行速度不低于10mm/min。
2.5空白限试剂盒的空白限不大于3%。
2.6线性在[3,15]% 范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度[8,12]%、低浓度[4,6]%两水平样本重复测定10次,其测定值的变异系数(CV)应不大于10%。
2.8准确度用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性取不含HbA1c的样本,加入以下物质平行检测3次,结果均应不大于3%。
表1 特异性2.10溯源性根据GB/T21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
2.11批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于10%。
2.12 稳定性原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8,2.9项,结果应符合各项目的要求。
糖化血红蛋白测定试剂盒(荧光免疫层析法)产品技术要求12

糖化血红蛋白测定试剂盒(荧光免疫层析法)
组成:
校准信息卡:ID卡或IC卡(内含校准曲线)。
预期用途:本试剂盒用于体外定量测定人全血中糖化血红蛋白(HbA1c)的百分比含量。
糖化血红蛋白可以稳定可靠地反映出检测前120天内的平均血糖水平,且不受抽血时间,是否空腹,是否适用胰岛素等因素影响。
2.1外观
1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;
2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2宽度
试纸条宽度为4.0±0.2mm。
2.3移行速度
液体移行速度不低于10mm/min。
2.4空白检出限
试剂盒的空白检出限不大于3%。
2.5线性
在[3,15]% 范围内,线性相关系数应满足r≥0.990。
2.6重复性
用高浓度[8,12]%、低浓度[4,6]%两水平样本重复测定10次,其测定值的变异系数(CV)应不大于10%。
2.7批间差
用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于10%。
2.8准确度
用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性
取不含HbA1c的样本,加入以下物质平行检测3次,结果均应不大于3%。
表1 特异性
2.10 稳定性
原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.3,2.4,2.5,2.6,2.7项,结果应符合各项目的要求。
糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)产品技术要求shangjing

糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)
适用范围:用于体外定量测定人全血中糖化血红蛋白的含量。
1.1 包装规格
试剂1:3×60mL,试剂2:1×60mL;
试剂1:50×240μL,试剂2:1×4mL。
1.2 主要组成成分
2.1 外观和性状
试剂1为乳白色悬浮液,无沉淀。
试剂2为无色澄清液体,无异物。
2.2 净含量
每瓶试剂的净含量应不少于标示值。
2.3 试剂空白吸光度
用蒸馏水加入试剂作为样品测试时,试剂空白吸光度A应≤1.0。
2.4 分析灵敏度
测含已知浓度糖化血红蛋白(HbA1c)的样本时,吸光度差值(ΔA)应≥0.03。
2.5 线性
试剂盒在[2%,14%]的线性范围内分析性能应符合如下要求:
2.5.1 线性相关系数(r)≥0.990;
2.5.2 相对偏差:(5%,14%]范围内,相对偏差不超过10%;
2.5.3 绝对偏差:[2%,5%]范围内,绝对偏差不超过0.5%。
2.6 测量精密度
2.6.1 重复性
用高低两个浓度样本重复测试,所得结果的变异系数(CV)应≤10.0%。
2.6.2 批间差
试剂盒的批间相对极差(R)应≤15.0%。
2.7 准确度
相对偏差:采用国家标准品(BW3625)糖化血红蛋白成分标准物质(高)测试试剂盒,相对偏差不超过±15%。
2.8 稳定性
2℃~8℃避光贮存,有效期为12个月,取过有效期后一个月内的试剂盒进行检测,试剂盒应仍能符合2.1、2.3、2.4、2.5、2.6.1、2.7要求。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求lepu

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量测定人血清中的糖化血红蛋白的含量。
1.1 规格试剂1:30mL×1,试剂2a:9.5mL×1, 试剂2b:0.5mL×1,前处理液:50mL×2;试剂1:12mL×1,试剂2:4 mL×1;试剂1:60mL×3,试剂2:60mL×3;试剂1:60mL×1,试剂2:20mL×1;试剂1a:16.8mL×1,试剂1b:7.2mL×1,试剂2:10mL×1,前处理液:30mL×1;试剂1a:33mL×2,试剂1b:14.1mL×2,试剂2:19mL×2,前处理液:60mL×2;试剂1a:15.4mL×1,试剂1b:6.6mL×1,试剂2:8mL×1,前处理液:30mL×1;试剂1a:15mL×1,试剂1b:5mL×1,试剂2:5.5mL×1,前处理液:20mL×1;试剂1a:3.5mL×3,试剂1b:4.0mL×1,试剂2:3.5mL×2,前处理液:15mL×1;试剂1a:3.5mL×6,试剂1b:4.0mL×2,试剂2:3.5mL×4,前处理液:15mL×2。
1.2主要组成成份试剂1主要成分:试剂2a主要成分:试剂2b主要组分:前处理液主要成分:2.1 外观试剂1:无色透明溶液;试剂2:无色透明溶液;前处理液:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在660nm处测定试剂空白吸光度,应≤1.5;2.4 分析灵敏度测试6%的被测物时,吸光度变化(ΔA)应≥0.020。
艾威德糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)说明书

糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)说明书【产品名称】糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)【包装规格】a)试剂1:1×30mL;试剂2a:1×9.5mL;试剂2b:1×0.5mL;试剂3:2×50mLb)试剂1:2×30mL;试剂2a:2×9.5mL;试剂2b:2×0.5mL;试剂3:4×50mL【预期用途】用于体外定量测定人体血中糖化血红蛋白的含量。
HbA1c主要用于糖尿病的长期控制评价和治疗监测,可提示测试前30~90天的平均血糖水平。
测定糖化血红蛋白常用于糖尿病等病症的辅助诊断[1]。
【检验原理】HbA1c的测定是利用抗原、抗体反应直接测定总Hb中HbA1c的百分含量的方法。
样品中总Hb和HbA1c与胶乳有相同的非特异性吸附而固相化,当加入HbA1c的特异性单克隆抗体后形成胶乳-HbA1c-鼠抗人HbA1c单克隆抗体的复合物,此复合物由于羊抗鼠抗体而形成凝集,凝集量因胶乳表面固相化的HbA1c量的不同而不同。
通过测定其吸光度并与HbA1c百分浓度的标准曲线比较后即可求出样品中HbA1c所占Hb的百分比含量。
【主要组成成分】试剂1主要组分缓冲液15mmol/L胶乳0.13%试剂2a主要组分缓冲液15mmol/L试剂2b主要组分羊抗鼠抗体0.08mg/mL鼠抗人单克隆抗体0.05mg/mL试剂3主要组分溶血剂0.5%注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为18个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/ CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/ BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求shijiwode
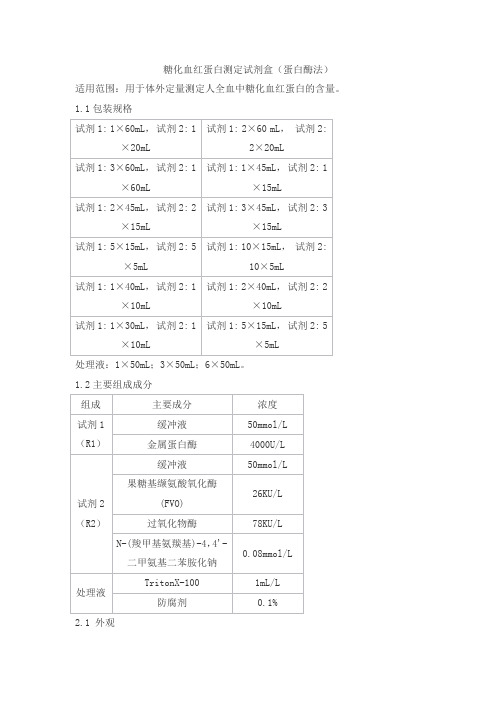
糖化血红蛋白测定试剂盒(蛋白酶法)
适用范围:用于体外定量测定人全血中糖化血红蛋白的含量。
1.1包装规格
处理液:1×50mL;3×50mL;6×50mL。
1.2主要组成成分
2.1 外观
试剂1为无色或浅黄色澄清液体,试剂2为黄色或黄绿色液体,处理液为无色液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量
不少于瓶签标示量。
2.3 试剂空白
在700nm处测定试剂空白吸光度≤1.5。
2.4 分析灵敏度
测试5.0%的被测物时,吸光度变化(ΔA)≥0.0019。
2.5 准确度
检测三个水平国家标准物质(GBW09181、GBW09182、GBW09183)中的任两个水平,分别重复检测3次,检测值与标示值相对偏差不超过±10%。
2.6 线性
2.6.1在[1.8,12]%区间内,线性相关系数r≥0.990;
2.6.2在[1.8,
3.5]%区间内,线性绝对偏差不超过±0.35%;(3.5,12]%区间内,线性相对偏差不超过±10%。
2.7 重复性
检测高、中、低三个浓度水平的样本,变异系数CV不大于10%。
2.8 批间差
随机抽取三批试剂盒对同一份样品进行重复测定,相对极差不超过±10%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
糖化血红蛋白(HbA1c)质控品产品技术要求runnuosi

糖化血红蛋白(HbA1c)质控品
适用范围:该产品与上海华臣生物试剂有限公司生产的糖化血红蛋白(HbA1c)测定试剂盒配套使用,用于临床检验糖化血红蛋白项目实验室内部质量控制。
1.1规格
1测试/盒、2测试/盒、3测试/盒。
1.2主要组成成分
表1 试剂盒装量及组成
质控品范围具有批特异,详见“质控品信息单”。
2.1外观
质控品为冻干品,外观呈疏松块状物。
2.2质控品赋值有效性
质控品的实测浓度在标示范围内。
2.3瓶间差
变异系数CV≤8%。
2.4 残余含水量
不高于3%。
2.5稳定性
a)效期稳定性:2℃~8℃贮存有效期12个月。
取失效期的产品进行检测外,结果应符合2.1、2.2、2.3、2.4的要求。
b)复溶稳定性:复溶后10℃~30℃可稳定8小时。
取复溶8小时后的产品检测测量准确度,结果应符合2.2的要求。
糖化血清蛋白(GSP)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)产品技术要求sainuopu

糖化血清蛋白(GSP)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)适用范围:用于体外定量测定人体血清中糖化血清蛋白的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:1×8L,试剂2:1×2L;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×1ml,2×1ml(单水平),1×3ml,2×3ml(单水平)。
质控品(选配,冻干品):1×1ml,1×3ml。
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1无色至浅红黄色液体;试剂2:无色至浅红黄色液体。
校准品:冻干品,溶解后为无色至淡黄色液体。
质控品:冻干品,溶解后为无色至淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、600nm波长、1cm光径条件下,试剂空白吸光度应不大于0.1。
2.4 分析灵敏度测定浓度为600μmol/L的样本时,吸光度变化值(ΔA)应不小于0.05。
2.5 线性范围在(50,1000)μmol/L范围内,线性相关系数r不小于0.996。
在(150,1000)μmol/L范围内的线性相对偏差不大于±10%;在(50,150]μmol/L范围内线性绝对偏差不大于±15.0 μmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求senmeixikema

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量检测全血中糖化血红蛋白的浓度。
1.1规格a) 试剂1:1×30ml,试剂2:1×10ml,前处理液:1×90ml;b) 试剂1:2×45ml,试剂2:2×15ml,前处理液:3×90ml;c) 试剂1:2×16.8ml,试剂2:2×5.6ml,前处理液:1×100ml;d) 试剂1:2×150ml,试剂2:2×50ml,前处理液:8×100ml;e) 试剂1:2×30ml,试剂2:1×10ml,前处理液:1×90ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液;前处理液应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1在600nm处测定试剂空白吸光度,应<1.5;2.3.2在700nm处测定试剂1和试剂2混合后的空白吸光度,应<1.5。
2.4 分析灵敏度2.4.1 测定HbA1c浓度为 800ml/dl的样品,吸光度变化(ΔA)应不低于0.03;2.4.2 测定Hb浓度为1000mg/dL的样品,吸光度变化(ΔA)应不低于0.05。
2.5 线性2.5.1在[3%,16%]范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[6%,16%]的样品,相对偏差应不超过±15%;测试浓度[3%,6%) 的样品,绝对偏差应不超过±0.9%。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度用国家标准物质[BW3625、GBW09181、GBW09182任选一种]对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±10%。
糖化血红蛋白(HbA1c)测定试剂盒(酶法)产品技术要求上泰

1.性能指标1.1外观外观应符合以下要求:a)试剂盒应组分齐全,完整,液体无渗漏;包装标签文字符号应清晰。
b)样本处理夜:无色液体。
c)试剂1(R1):淡黄色至黄色液体。
d)试剂2(R2):黄色至棕黄色液体。
e)校准品/质控品:红色冻干粉。
1.2装量液体试剂装量要求不低于标示量。
1.3分析灵敏度测试浓度为6%的样本时,吸光度差值△A 应≥0.020。
1.4线性范围1.4.1 糖化血红蛋白浓度在[4,12]%范围内,线性相关系数r≥0.990。
1.4.2 在[4,5] %范围内,线性绝对偏差应不超过±0.5%;在(5,12]%范围内,线性相对偏差应不超过±10%。
1.5精密度1.5.1日间重复性测试两个不同浓度水平的样本,变异系数CV 结果均应≤3%。
1.5.2日内重复性测试两个不同浓度水平的样本,变异系数CV 结果均应≤3%。
1.6批间差三个不同批号试剂盒测试相同样本,相对极差R 应≤10%。
1.7准确度相对偏差应不超过±10%。
1.8分析特异性当胆红素≤15mg/dL、脂肪乳≤0.5%、葡萄糖≤4000mg/dL、抗坏血酸≤12mg/dL、血红蛋白≤2.1g/dL、尿酸≤30mg/dL,尿素≤80mg/dL,类风湿因子≤200IU/mL、氰酸钠≤3000mg/dL、阿司匹林≤3000mg/dL 时,对HbA1c 试剂检测结果的偏差影响在±10%以内。
1.9校准品/质控品水分含量水分含量应不超过5%。
1.10校准品正确度量值传递的正确度应符合E≤1。
n1.11质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.12校准品/质控品均匀性应不大于8%。
1.12.1瓶内均匀性:CV瓶内应不大于10%。
1.12.2瓶间均匀性:CV瓶间1.13校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
糖化血红蛋白(HbA1c)测定试剂盒(免疫荧光层析法)产品技术要求注册版

医疗器械产品技术要求编号:糖化血红蛋白(HbA1c)测定试剂盒(免疫荧光层析法)1. 产品型号/规格及其划分说明1.1 型号规格25人份/盒1.2 组成试剂盒主要由测试卡、样本缓冲液、信息卡组成。
测试卡:由荧光垫(包被有荧光标记的Hb鼠源抗体)、硝酸纤维素膜(包被有HbA1c鼠源抗体、Hb鼠源抗体)、吸水纸、PVC底板组成;样本缓冲液:主要成分磷酸盐缓冲液;信息卡:记载本批次试剂的标准曲线信息。
1.3 适用范围用于定量检测人全血中糖化血红蛋白(HbA1c)的含量,临床上主要用于糖尿病的辅助诊断和血糖水平的监控。
1.性能指标1.1外观试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
测试卡的外观应符合下列要求:a)测试卡应平整、边缘无毛刺;b)测试卡外观整齐、色泽均匀、不能有色斑或污渍。
1.2物理检测1.2.1试纸条宽度试纸条宽度应不小于 2.5mm。
1.2.2液体移行速度液体移行速度应不小于10mm/min。
1.3试剂装量HbA1c 样本缓冲液装量为1.00mL,相对偏差不超过±5.0%。
1.4准确度分别测定(6.0±0.6)%和(8.0±0.8)%的HbA1c 参考品,相对偏差应不超过±10.0%。
1.5线性范围在所规定的线性范围[4.0%,14.0%]内:a)线性相关系数(r)应不小于0.9900;b)[4.0%,6.0%]区间内,线性绝对偏差(D i)应不超过±0.6%。
(6.0%,14.0%]区间内,线性相对偏差(R i)应不超过±10.0%。
1.6重复性抽取同一批次试剂盒,分别测定(6.0±0.6)%和(8.0±0.8)% HbA1c 参考品,变异系数(CV)应不大于10.0%。
1.7批间差抽取3 个不同批次试剂盒,分别测定(6.0±0.6)%和(8.0±0.8)% HbA1c 参考品,批间相对极差(R)应不大于15.0%。
糖化血红蛋白分析仪产品技术要求普门科技

性能指标
2.1 结果报告单位 糖化血红蛋白(HbA1c)以 IFCC 单位(mmol/mol)以及衍生的 NGSP 单位(%)
报告。 2.2 外观
分析仪外观应符合下列要求: a) 仪器表面应色泽均匀、无磕碰、无划痕,表面涂镀层无明显剥落、擦伤、 露底及污垢; b) 标志、标签应清晰可见,所有紧固件连接应牢固可靠,不得有松动; c) 显示器显示字体应清晰。 2.3 准确度 用参考物质作为样本进行检测,分析仪测定结果的相对偏差应在±8%区间内。 2.4 线性 在4%-15%的分析仪检测区间内,检测结果的线性相关系数r应不小于0.9900。 2.5 重复性 检测样本浓度为4.0%~6.5%(20.2mmol/mol~47.5mmol/mol)的样本,分析 仪重复测量结果变异系数CV应不大于3.0%。 2.6 携带污染率 分析仪的携带污染率应不大于3.0%。 2.7 稳定性 开机稳定后 8h 内,检测同一正常样本结果的相对偏差应不超过±3.0%。 2.8 分析仪功能 a) 显示功能:液晶显示器显示中文引导菜单,操作、提示信息和测试结果, 测试结果用 SI 国际单位表示。 b) 存储功能:GH-900Plus 系统可存储≥4000 个标本数据(包含测试曲 线),GH-900 系统可存储≥2000 个标本数据(包含测试曲线)。 c) 进样盘功能:系统支持全自动 28 位进样盘,每个进样盘支持不少于 2 种 规格的采血管。
2.13 温度准确度与波动度 混育杯模块设定温度值为 51℃,准确度应不超过±1℃,波动度不大于 1℃。
层析柱模块设定温度值在 25℃,准确度应不超过±1℃,波动度不大于 1℃。 2.14 加样准确度与重复性
样本 10μL 加样准确度误差不超过±10%,变异系数不超过 15%。 2.15 网络安全
糖化血红蛋白(HbA1c)测定试剂盒(酶法)产品技术要求利德曼

糖化血红蛋白(HbA1c)测定试剂盒(酶法)适用范围:本产品用于体外定量测定人全血中糖化血红蛋白的含量。
1.1规格溶血剂:1×50ml、试剂1a(R1a):1×23ml、试剂1b(R1b):1×10mL、试剂2(R2):1×15mL;溶血剂:2×50ml、试剂1a(R1a):1×46ml、试剂1b(R1b):2×10mL、试剂2(R2):2×15mL;溶血剂:1×60ml、试剂1a(R1a):1×40ml、试剂1b(R1b):2×10mL、试剂2(R2):1×12mL;溶血剂:1×60ml、试剂1a(R1a):2×15ml、试剂1b(R1b):2×15mL、试剂2(R2):1×12mL。
溶血剂:1×100ml、试剂1a(R1a):1×46ml、试剂1b(R1b):1×20mL、试剂2(R2):1×30mL;溶血剂:1×40ml、试剂1a(R1a):2×9.2ml、试剂1b(R1b):2×4mL、试剂2(R2):2×6mL;溶血剂:1×100ml、试剂1a(R1a):5×9.2ml、试剂1b(R1b):5×4mL、试剂2(R2):5×6mL;溶血剂:2×100ml、试剂1a(R1a):10×9.2ml、试剂1b(R1b):10×4mL、试剂2(R2):10×6mL。
1.2组成:试剂盒由溶血剂、试剂1a(R1a)、试剂1b(R1b)和试剂2(R2)组成。
溶血剂:CHES:20mmol/L (pH7.4);Brij 35:10g/L;R1a:MES缓冲液:10mmol/L;金属蛋白酶4KU/L;R1b:2-(4-碘代苯)-3-(2,4-二硝基苯基)-5-(2,4-二硫代苯)-2H-四唑盐,单钠盐:2mmol/L;R2:Tris-HCl:300mmol/L;过氧化物酶:78KU/L;DA64:0.1mol/L;果糖基氨基酸氧化酶:26KU/L。
糖化血红蛋白(HbA1c)测定试剂盒产品标准(高效液相色谱法)技术要求
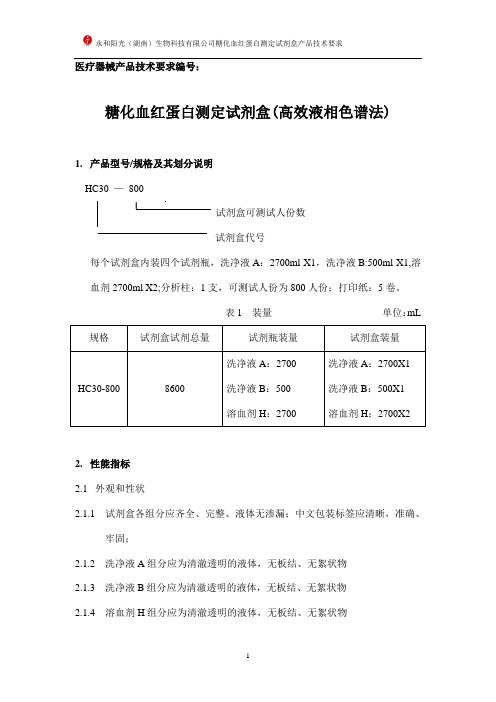
医疗器械产品技术要求编号:糖化血红蛋白测定试剂盒(高效液相色谱法)1.产品型号/规格及其划分说明HC30 —800试剂盒可测试人份数试剂盒代号每个试剂盒内装四个试剂瓶,洗净液A:2700ml X1,洗净液B:500ml X1,溶血剂2700ml X2;分析柱:1支,可测试人份为800人份;打印纸:5卷。
表1 装量单位:mL 规格试剂盒试剂总量试剂瓶装量试剂盒装量HC30-800 8600 洗净液A:2700洗净液B:500溶血剂H:2700洗净液A:2700X1洗净液B:500X1溶血剂H:2700X22.性能指标2.1外观和性状2.1.1试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰,准确、牢固;2.1.2洗净液A组分应为清澈透明的液体,无板结、无絮状物2.1.3洗净液B组分应为清澈透明的液体,无板结、无絮状物2.1.4溶血剂H组分应为清澈透明的液体,无板结、无絮状物2.2 净含量应符合表2要求。
表2净含量要求组分允许范围洗净液A 2500~2800mL/瓶洗净液B 400~600mL/瓶溶血剂H 2500~2800mL/瓶2.3 准确度用参考物质测定,测量值相对参考物质真值偏差≤±8.0%。
2.4 最低检测限不低于4%的检测限。
2.5 线性在4%-17%的范围内,其线性系数r≥0.990。
2.6批内精密度用低值和高值质控品测量一批试剂,各重复测定10次,所得结果的变异系数CV%≤2%。
2.7 批间差用低值和高值质控品测量三批试剂,批间差≤3%。
2.8 热稳定性37℃环境温度下放置3天,检测外观、准确度、线性、批内精密度和批间差,应符合2.1~2.7的相关规定。
3. 检测方法3.1 外观和性状在明亮灯光下,以正常视力目测检查,应符合2.1规定。
3.2 实验仪器YH-30糖化血红蛋白分析仪。
3.3 样品处理吸取10μL 有溯源的全血样本和1.5mL 溶血剂加入样品杯中充分稀释。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求haomai

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:本试剂适用于体外定量测定全血中糖化血红蛋白(HbA1C)浓度。
1.1包装规格1.2主要组成成分本试剂由试剂1a(R1a)、试剂1b(R1b)、试剂2(R2)和溶血剂(BUF)组成。
试剂1(R1):R1a:2-(N-吗啡啉)乙磺酸缓冲液(MES) 50mmol/L蛋白酶15KU/LR1b:2-(N-吗啡啉)乙磺酸缓冲液(MES) 50mmol/L亚硝酸钠10.9g/L试剂2(R2):果糖基缬氨酸氧化酶(FVO) 8KU/L 过氧化物酶(POD)10KU/LN-(2-羟基-3-磺丙基)-3-5-二甲氧基苯胺,钠盐(HDAOS) 0.04g/L溶血剂(BUF) :十二烷基磺酸钠2.0g/L2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1a 为无色澄清液体,R1b为淡黄色液体;R2为黄绿色液体,液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、700nm波长、1cm光径条件下,吸光度≤0.4。
2.4 分析灵敏度浓度为5.5%的样本,吸光度差值△A>0.01。
2.5 准确性相对偏差应不大于10%。
2.6 重复性用不同浓度的两个样本进行检测,各重复检测10次,其批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在(3,16)%范围内,线性相关系数r应不低于0.990;2.7.2 在(3,16)%范围内相对偏差不超过±10%。
2.8 批间差用三个批号的试剂盒测定同一份样本,试剂盒批间相对极差应不超过10%。
2.9 稳定性试剂盒在2~8℃避光保存,可稳定14个月。
取到效期后的样品检测试剂空白吸光度、分析灵敏度、准确度、重复性、线性范围应分别符合2.3、2.4、2.5、2.6、2.7的要求。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求jiuqiang

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量测定人全血中的糖化血红蛋白的百分比。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色到黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为浅褐色到黄褐色澄清液体,目测不得有任何沉淀及絮状悬浮物;溶血剂为无色到黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为红色粉末状物质,复溶后为红色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为红色粉末状物质,复溶后为红色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A700nm下试剂空白吸光度应≤0.7000。
2.4 准确度测定国家标准物质GBW09181、GBW09182、GBW09183,测定结果与标示值的相对偏差应不超过±10%。
2.5 分析灵敏度样本浓度为6.00%时,吸光度差值△A应≥0.0200。
2.6 线性区间在[4.00%,12.00%]区间内,测定线性相关系数r≥0.990,在[4.00%,8.00%]区间内测定的绝对偏差应不超过±0.80%,在(8.00%,12.00%]区间内测定的相对偏差应不超过±10.00%。
2.7 测量精密度2.7.1 重复性使用高、低不同浓度的样本重复测定10次,其测定值的变异系数(CV%)应不大于3.00%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10.00%。
2.8 瓶间差校准品、质控品的瓶间差应≤10.00%。
2.9 质控品赋值有效性使用质控品进行测定,所得结果应在质控范围内。
2.10 稳定性2.10.1 试剂稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1、2.9的要求。
糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)产品技术要求百奥泰康

糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)适用范围:该试剂盒用于体外定量测定人全血中糖化血红蛋白的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)、试剂3(R3)、校准品(选配)和质控品(选配)组成。
1.2.1试剂组成试剂1:甘氨酸缓冲液≥15.0mmol/L 胶乳≥0.10% 试剂2:甘氨酸缓冲液≥60.0mmol/L 羊抗鼠IgG抗体≥0.08g/L鼠抗人HbA1c单克隆抗体≥0.05g/L试剂3:磷酸盐缓冲液≥50.0mmol/L 1.2.2 校准品组成水平1:糖化血红蛋白目标浓度:0.0%水平2:糖化血红蛋白目标浓度:6.0%水平3:糖化血红蛋白目标浓度:10.0%水平4糖化血红蛋白目标浓度:14.0%水平5糖化血红蛋白目标浓度:16.0%该校准品为水基质冻干品1.2.3 质控品组成水平1缓冲液糖化血红蛋白目标浓度:5%水平2缓冲液糖化血红蛋白目标浓度:8%该质控品为水基质冻干品2.1 外观a) R1应为白色胶乳溶液。
b) R2应为无色至淡黄色溶液。
c) R3应为无色溶液,无混浊,无未溶解物。
d) 校准品应为白色至淡红色固体。
e) 质控品应为白色至淡红色固体。
2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于1.200。
2.4 分析灵敏度HbA1c试剂盒测定浓度10%的被测物时,吸光度差值(ΔA)应不小于0.050。
2.5 准确度测定参考物质,测定结果的相对偏差不超过±10%。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.6.3 校准品及质控品批内瓶间差测试校准品及质控品,当浓度不大于1.0%时,测定结果与标示值绝对差值应不大于0.5%;当浓度大于1.0%时,瓶间差应不大于5%。
2.7 线性在[2.0,14.0]%范围内,HbA1c试剂盒的线性相关系数r应不低于0.9900;在[2.0,6.0]%范围内绝对偏差应不超过0.9%,在(6.0,14.0]%范围内相对偏差应不超过±15%。
糖化血红蛋白A1c(GHbA1c)ELISA试剂盒

糖化血红蛋白A1c(GHbA1c)ELISA试剂盒糖化血红蛋白A1c(GHbA1c)ELISA试剂盒产品规格:96T/48T。
供应商:上海乔羽生物有限公司上海乔羽有限公司,有elisa试剂盒,抗体,培养基糖化血红蛋白A1c(GHbA1c)ELISA试剂盒计算以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
糖化血红蛋白A1c(GHbA1c)ELISA试剂盒试剂盒组成1 30 倍浓缩洗涤液20ml×1 瓶;2 酶标试剂6ml×1 瓶3 酶标包被板12 孔×8 条;4 样品稀释液6ml×1 瓶5 显色剂A 液6ml×1 瓶;6 显色剂B 液6ml×1/瓶7 终止液6ml×1 瓶;8 标准品(48ng/ml)0.5ml×1 瓶9 标准品稀释液1.5ml×1 瓶;10 说明书1 份11 封板膜2 张;12 密封袋1糖化血红蛋白A1c(GHbA1c)ELISA试剂盒ELISA技术原理:以免疫学反应为基础,将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合起来.1. 抗原或抗体的固相化及抗原或抗体的酶标记。
2. 结合在固相载体表面的抗原或抗体仍保持其免疫学活性。
3. 酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
4. 受检标本与固相载体表面的抗原或抗体起反应。
再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。
5. 此时固相上的酶量与标本中受检物质的量呈一定的比例。
6. 加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
测定方法具有很高的敏感度(pg-ng/ml 水平),并且重复性好。
糖化血红蛋白(HbA1c)测定试剂盒(酶法)产品技术要求mairui

1 性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
样本处理液应为澄清透明的液体,无沉淀、悬浮物和絮状物。
校准品应为冻干粉。
2.2净含量
液体试剂的净含量应不少于标示值。
2.3线性范围
试剂盒在3%~16%范围内:
a)线性相关系数r 应不小于0.9900;
b)当样本结果不大于8%时,线性绝对偏差应不大于±0.8%;当样本结果大于8%时,线性相对偏差应不大于±10.0%。
2.4测量精密度
2.4.1重复性
变异系数:CV 应不大于 5.0%。
2.4.2批间差
相对偏差:R 应不大于10.0%。
2.5准确度
测定校准品,测定结果与靶值的相对偏差应不大于±10.0%。
2.6分析特异性
葡萄糖浓度在1000 mg/dL 内、抗坏血酸浓度在30 mg/dL 内、内源性酯浓度在2000 mg/dL 内、胆红素浓度在50 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
2.7校准品均一性
试剂盒校准品的均一性:CV 应不大于 5.0%。
2.8生物安全性
校准品的HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
1。
糖化血红蛋白(GLY HBA1C)测定试剂盒(柱层析法)产品技术要求lideman

糖化血红蛋白(GLY/HBA1C)测定试剂盒(柱层析法)
适用范围:本产品用于体外定量测定人全血中糖化血红蛋白的含量。
1.1包装规格
40人份/盒
1.2 主要组成成分
阳离子树脂:1×120mL;
溶血剂:缓冲液 0.02mol/L PH=7.4 ,稳定剂20mL;
层析柱:40个;
校准品: 1mL;冻干。
2.1 外观
阳离子树脂:带有细小颗粒无色液体;溶血剂:无色。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 线性
在[2%,10%]线性范围内,线性相关系数r ≥0.990。
浓度在[2%,10%]范围内的相对偏差应不超过±10% 。
2.4 重复性
变异系数CV应小于10 % 。
2.5 批间差
不同批号之间测定结果的相对极差应小于10 % 。
2.6 准确度
用参考物质(JCCRM411-2(JDS lot4)BCR405)作为样本进行检测,其测量结果的相对偏差应不超过±10%。
2.7 稳定性
原包装试剂,在2℃~8℃下有效期为24个月,取失效期的试剂盒检测其线性、重复性、准确度应分别符合2.3、2.4、2.6的要求。
2.8校准品溯源
校准品溯源至参考物质(JCCRM411-2(JDS lot4)BCR405)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
糖化血红蛋白(HbA1c)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)
适用范围:用于体外定量测定人体全血中糖化血红蛋白的含量。
1.1试剂盒包装规格
溶血剂:1×30ml,试剂1:1×16ml,试剂2:1×7ml,试剂3:1×10ml;
溶血剂:1×50ml,试剂1:1×23ml,试剂2:1×10ml;试剂3:1×14ml。
校准品(选配,冻干品):2×0.5ml(两水平);2×1ml(两水平)。
1.2试剂盒主要组成成分
2.1 外观
液体三试剂:试剂1无色至浅黄色液体;试剂2无色至浅黄色液体;试剂3无色至黄色液体。
溶血剂:无色澄清液体。
校准品:全血冻干品。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度
在37℃、700nm波长、1cm光径条件下,试剂空白吸光度应不大于0.6。
2.4 分析灵敏度
测定浓度为5%样本时,吸光度变化值(ΔA)应不小于0.03。
2.5 线性范围
在(4%,10%)范围内r不小于0.990。
在(5%,10%)范围内线性相对偏差不大于±15%,在(4%,5%]线性范围内绝对偏差不大于±0.75%。
2.6 重复性
重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于8%。
2.7 批间差
不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度
相对偏差:相对偏差应不超过±15%。
2.9 瓶间差(均一性)
校准品瓶间变异系数(CV%)不大于5%。
2.10含水量(冻干品)
校准品水分含量不大于8%。
2.11校准品溯源性
依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至IRMM生产的有证参考物质(BCR405)。
2.12稳定性
2.12.1复溶稳定性
校准品开瓶复溶后,复溶物在10℃~30℃室温密封避光保存,可以稳定4小时,第5小时检测,测量结果与靶值的相对偏差应在±10%以内。
校准品开瓶复溶后,
复溶物在2℃~8℃密封避光保存,可以稳定24小时,在第25小时检测,测量结果与靶值的相对偏差应在±10%以内。
2.12.2效期稳定性
试剂盒在2℃~8℃下有效期为15个月,取失效期的试剂盒进行检测,试验结果满足2.3、2.4、2.5、2.6、2.8的要求。
