离子晶体、分子晶体、金属晶体、原子晶体
物质结构教案课件

物质结构教案课件一、教学目标1. 知识与技能:了解物质结构的基本概念和组成;掌握原子、分子、离子、原子团等基本粒子的构成;理解离子晶体、分子晶体、金属晶体和原子晶体的结构特点;能够运用物质结构的知识解释一些实际问题。
2. 过程与方法:通过观察和分析模型的结构,培养学生的观察能力和思维能力;通过实验和观察,培养学生的实验操作能力和科学探究能力;通过实例分析,培养学生的应用能力和问题解决能力。
3. 情感态度与价值观:培养学生对物质结构的兴趣和好奇心;培养学生珍惜资源、保护环境的意识;培养学生科学思维和创新精神。
二、教学重点与难点1. 教学重点:物质结构的基本概念和组成;原子、分子、离子、原子团等基本粒子的构成;离子晶体、分子晶体、金属晶体和原子晶体的结构特点。
2. 教学难点:离子晶体、分子晶体、金属晶体和原子晶体的结构特点的理解和运用;对物质结构相关实际问题的解决。
三、教学准备1. 教具:模型和图片;实验器材;课件和教案。
2. 学具:笔记本;彩色笔;实验报告册。
四、教学过程1. 导入:通过展示一些常见物质的图片,引发学生对物质结构的兴趣和好奇心;引导学生思考物质结构的组成和特点。
2. 讲解:使用模型和图片,讲解原子、分子、离子、原子团等基本粒子的构成;讲解离子晶体、分子晶体、金属晶体和原子晶体的结构特点;通过实例分析,让学生理解物质结构在实际问题中的应用。
3. 实验:安排学生进行一些简单的实验,观察和分析实验结果,加深对物质结构的理解;引导学生通过实验操作,培养实验操作能力和科学探究能力。
4. 总结:对本节课的内容进行总结,强调重点和难点;鼓励学生提出问题,解答学生的疑问。
五、作业布置1. 完成实验报告册的相关内容;2. 复习本节课的知识点,准备下一节课的学习;3. 选择一个实际问题,运用物质结构的知识进行分析和解答。
六、教学评估1. 课堂观察:观察学生在课堂上的参与程度和表现;注意学生对物质结构知识的理解和运用情况。
离子晶体

①Cs+的配位数是8 ,构成 立方(正六面)体。Cl-的 配位数也是8。 ②每个Cs+ 周围最近且等距离的Cs+有6个(上, 下,左,右,前,后) 构成 正八面 体。
CaF2型晶体结构模型 ①Ca2+的配位数是8:
Ca2+ 周围8个F-成立方体;
F-的配位数是4:
①熔点1070 ℃,易溶于水,水溶液能导电 ②熔点10.31 ℃,液态不导电,水溶液导电 ③熔点112.8 ℃,沸点444.6 ℃,能溶于CS2 ④熔点97.81 ℃,质软,导电,密度0.97 g·cm-3 ⑤熔点-218 ℃,难溶于水 ⑥熔点3900 ℃,硬度很大,不导电 ⑦难溶于水,固态时导电,升温时导电能力减弱 ⑧难溶于水,熔点高,固体不导电,熔化时导电
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NaCC+ll--
ClNa+ Cl-
Cl-
Na+
每个NaCl晶胞,平均占有 Na+ Na+:12×1/4+1=4
Cl-:8×1/8+6×1/2=4
离子化合物的化学式为离子最简个数比
3、常见离子晶体的总结
①Na+的配位数(等距离的Cl-)是6(上,下,左,右,前, 后),构成 正八面 体;同样,Cl-的配位数也是6。 ②每个Na+周围与它最近且等距离的Na+有12个 (三个平面各4个)。
性 熔、沸点
较高
较低
很高
质 导电性 溶解性
熔融或水溶 液中能导电
一般易溶 于水
不导电,部分 溶于水导电
部分溶 于水
不导电,个 别为半导体
不溶于任 何溶剂
晶体分类及特点

晶体分类及特点
晶体类型分为:离子晶体,原子晶体,分子晶体,金属晶体。
离子晶体
由阳离子和阴离子通过离子键结合而成的晶体。
常见离子晶体:强碱、活泼金属氧化物、大部分的盐类。
原子晶体
晶体中所有原子都是通过共价键结合的空间网状结构。
原子晶体的特点:由于共价键键能大,所以原子晶体一般具有很高的熔、沸点和很大的硬度,一般不导电不溶于常见溶剂。
常见原子晶体:金刚石、单晶硅、碳化硅(金刚砂)、二氧化硅、氮化硼(BN)等。
特征
(1)自然凝结的、不受外界干扰而形成的晶体拥有整齐规则的几何外形,即晶体的自范性。
(2)晶体拥有固定的熔点,在熔化过程中,温度始终保持不变。
(3)单晶体有各向异性的特点。
(4)晶体可以使X光发生有规律的衍射。
宏观上能否产生X光衍射现象,是实验上判定某物质是不是晶体的主要方法。
四种晶体类型

晶体,一般包括离子晶体、分子晶体、原子晶体、金属晶体四种类型。
一、依据构成晶体的微粒和微粒间的作用判断(1)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
(2)原子晶体的构成微粒是原子,微粒间的作用是共价键。
(3)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
(4)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
二、依据物质的分类判断(1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅等。
(4)金属单质是金属晶体。
三、依据晶体的熔点判断。
(1)离子晶体的熔点较高。
(2)原子晶体的熔点很高。
(3)分子晶体的熔点低。
(4)金属晶体多数熔点较高,但有少数熔点相当低。
四、依据导电性判断。
(1)离子晶体溶于水及熔融状态时能导电。
(2)原子晶体一般为非导体。
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
(4)金属晶体是电的良导体。
五、依据硬度和机械性能判断。
(1)离子晶体硬度较大、硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
高中化学常见晶体

高中化学常见晶体篇一:高中化学----总结:四大晶体总结:四大晶体晶体类型离子晶体原子晶体分子晶体金属晶体概念离子间离子键原子间共价键分子间分子力金属离子和e金属键晶体质点阴、阳离子原子分子金属离子原子和e作用力离子键共价键分子间力金属键物理性质熔沸点较高很高很低一般高少数低硬度较硬很硬硬度小多数硬少数软溶解性易溶于水难溶任何溶剂相似相溶难溶导电性溶、熔可硅、石墨可部分水溶液可固、熔可实例盐MOH MO C Si SiO2 SiC HX XOn HXOn 金属或合金1.各种晶体中的化学键⑴离子晶体: 一定有离子键,可能有共价键(极性键、非极性键、配位键)⑵分子晶体:一定没有离子键,可能有极性键、非极性键、配位键; 也可能根本没有化学键。
⑶原子晶体:一定没有离子键,可能有极性键、非极性键.⑷金属晶体: 只有金属键2、物质熔沸点高低比较规律(1)晶体内微粒间作用力越大,熔沸点越高,只有分子晶体熔化时不破坏化学键。
(2)不同晶体(一般情况下):原子晶体>离子晶体>分子晶体熔点:上千度~几千度近千度~几百度多数零下最多几百度(3)相同条件下一般地说熔沸点:固态>液态>气态2、物质熔沸点高低比较规律(4)同种晶体离子晶体:比较离子键强弱,离子半径越小,电荷越多,熔沸点越高MgOMgCl2NaClKClKBr原子晶体:比较共价键强弱(看键能和键长)金刚石(C) 水晶(SiO2) SiC Si分子晶体:比较分子间力(和分子内的共价键的强弱无关)1)组成和结构相似时,分子量越大熔沸点越高F2<Cl2<Br2<I2; HCl< HBr <HI; CF4< CCl4 < CBr4 < CI4;N2<O2 ; 同系物熔沸点的比较2)同分异构体:支链越多熔沸点越低正戊烷异戊烷新戊烷金属晶体:比较金属键,金属原子半径越小,价电子数越多,熔沸点越高。
晶体结构(共78张PPT)

山东大学材料科学基础
共价键结合,有方 向性和饱和性,键 能约80kJ/mol
Si,InSb, PbTe
金属键结合, 无方向性,配 位数高,键能 约80kJ/mol
Fe,Cu,W
范得华力结合 ,键能低, 约 8-40 kJ /mol
Ar,H2,CO2
熔点高
强度和硬度由中到 高,质地脆
闪锌矿〔立方ZnS〕结构 S
Zn
属于闪锌矿结构的晶体有β-SiC,GaAs,AlP,InSb
山东大学材料科学基础
•
•
•
•
萤石〔CaF2〕型结构
立方晶系Fm3m空间群,
a0=0.545nm, Z=4。 AB2型化合物, rc/ra>0.732〔0.975〕 配位数:8:4
Ca2+作立方紧密堆积,
F-填入全部四面体 空隙中。 注意:所有八面 体空隙都未被占据。
山东大学材料科学基础
钙钛矿〔CaTiO3〕结构
Ti
ABO3型
立方晶系:以
•
一个Ca2+和3个
O2-作面心立方
Ca
密堆积,
Ti4+占1/4八面体C空aT隙iO3。晶胞 配位多面体连接与Ca2+配位数
Ti4+配位数6,rc/ra=0.436(0.414-0.732)
Ca2+配位数12,rc/ra=0.96
O2-配位数6;
取决温度、组成、掺杂等条件,钙钛矿结构呈现立方、
四方、正交等结构形式。
山东大学材料科学基础
许多化学式为ABO3型的化合物,其中A与B两种阳 离子的半径相差颇大时常取钙钛矿型结构。在钙钛矿 结构中实际上并不存在一个密堆积的亚格子,该结构 可以看成是面心立方密堆积的衍生结构。较小的B离 子占据面心立方点阵的八面体格位,其最近邻仅是氧 离子。
金属晶体分子晶体原子晶体离子晶体

金属晶体、分子晶体、原子晶体和离子晶体金属晶体:由金属键形成的单质晶体。
金属单质及一些金属合金都属于金属晶体,例如镁、铝、铁和铜等。
金属晶体中存在金属离子(或金属原子)和自由电子,金属离子(或金属原子)总是紧密地堆积在一起,金属离子和自由电子之间存在较强烈的金属键,自由电子在整个晶体中自由运动,金属具有共同的特性,如金属有光泽、不透明,是热和电的良导体,有良好的延展性和机械强度。
大多数金属具有较高的熔点和硬度,金属晶体中,金属离子排列越紧密,金属离子的半径越小、离子电荷越高,金属键越强,金属的熔、沸点越高。
例如周期系IA族金属由上而下,随着金属离子半径的增大,熔、沸点递减。
第三周期金属按Na、Mg、Al顺序,熔沸点递增。
根据中学阶段所学的知识。
金属晶体都是金属单质,构成金属晶体的微粒是金属阳离子和自由电子(也就是金属的价电子)。
分子晶体:分子间以范德华力相互结合形成的晶体。
大多数非金属单质及其形成的化合物如干冰(CO2)、I2、大多数有机物,其固态均为分子晶体。
分子晶体是由分子组成,可以是极性分子,也可以是非极性分子。
分子间的作用力很弱,分子晶体具有较低的熔、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态,例如O2、CO2是气体,乙醇、冰醋酸是液体。
同类型分子的晶体,其熔、沸点随分子量的增加而升高,例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;非金属元素的氢化物,按周期系同主族由上而下熔沸点升高;有机物的同系物随碳原子数的增加,熔沸点升高。
但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。
分子组成的物质,其溶解性遵守“相似相溶[1]”原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性的有机溶剂,例如NH3、HCl极易溶于水,难溶于CCl4和苯;而Br2、I2难溶于水,易溶于CCl4、苯等有机溶剂。
根据此性质,可用CCl4、苯等溶剂将Br2和I2从它们的水溶液中萃取、分离出来。
四种晶体类型

相应的电子构型变化: 2s 2 2p 6 3s 1 —— 2s 2 2p 6 ,3s 2 3p 5 —— 3s 2 3p 6 形成稀有气体原子结构的稳定离子。
第二步 靠静电吸引, 形成化学键 。 体系的势能与核间距之间的关系如图所示:
V
0 Vr0 r0 r
纵坐标的零点 当 r 无穷大时,即两核之间 无限远时的势能。
§4.3 金属晶体
§4.4 原子晶体 §4.5 分子晶体
§4.6 离子极化
§4.1 晶体的特征 4.1.1 晶体的特征
4.1.2 晶格和晶胞 4.1.3 晶格类型
4.1.4 晶体类型
4.1.1 晶体的特征
晶体 固体
非晶体——无定型物质 两者有何区别?
晶体 (1) 具有整齐规则的几何外形 (2) 在一定压力下具有固定 的熔点 (3) 具有各向异性 无定型物质 外形不规则 没有固定熔点 各向同性
出一套离子半径数值,被称为 Pauling 半径 。
一般教材上两套数据均列出。但在比较半径
大小和讨论变化规律时,多采用 Pauling 半径 。 (2) 离子半径的变化规律
a ) 同主族从上到下,电子层增加,核对外层电 子的引力减小,具有相同电荷数的离子半径增加。 Li + < Na + < K + < Rb + < Cs + b) F- < Cl- < Br- < I- 同周期的主族元素,从左至右阳离子半径随
(5) (18+2)e-构型: 基态离子价电子层最外层有2个电子,次 外层有18个电子。例如: Ti+、 Sn2+、Pb2+、 Bi3+、Sb3+等。
晶体的五种类型

晶体的五种类型晶体是由原子或者分子沿着一定规律排列而成的具有长程有序结构的固体物质。
晶体的类型多种多样,根据其结构和性质的不同,可以将晶体分成五种类型:离子晶体、共价晶体、金属晶体、分子晶体和非晶态材料。
1.离子晶体离子晶体是由阴阳离子组成的晶体,其特点是具有良好的电解质性质。
这类晶体的结构稳定,通常具有高熔点和硬度,是常见的岩石和矿石。
典型的离子晶体包括氯化钠(NaCl)、氧化镁(MgO)和硫酸钙(CaSO4)等。
离子晶体的性质主要由其中阳离子和阴离子的相互排列和结合方式所决定。
2.共价晶体共价晶体是由共价键连接的原子或者分子构成的晶体,其特点是硬度大,熔点高,化学性质稳定。
典型的共价晶体包括金刚石(碳)、硅化铝(Al2O3)和碳化硅(SiC)等。
共价晶体的结构稳定,常用作磨料、切割工具和高温材料等。
3.金属晶体金属晶体是由金属原子以金属键连接而成的晶体,其特点是导电性好、变形性高、具有典型的金属性质。
金属晶体的结构通常为紧密堆积,具有良好的韧性和延展性,是制造工程材料、电子材料和建筑材料的重要基础。
典型的金属晶体包括铁(Fe)、铜(Cu)和铝(Al)等。
4.分子晶体分子晶体是由分子之间的范德华力或氢键连接而成的晶体,其特点是化学性质多变,易溶于溶剂。
分子晶体的结构通常不规则,具有良好的可溶性和透明性,是重要的有机功能材料和药物。
典型的分子晶体包括碘化银(AgI)、萘(C10H8)和苯酚(C6H5OH)等。
5.非晶态材料非晶态材料是指由无序排列的原子或者分子构成的非晶体,其特点是没有明显的长程有序结构,通常具有非晶态固体的性质,如良好的可塑性和韧性。
非晶态材料的结构通常为玻璃状或胶状,常用作包装材料、光学材料和电子材料。
典型的非晶态材料包括玻璃、橡胶和塑料等。
总之,晶体的类型多种多样,每种类型的晶体都具有其独特的结构和性质。
通过研究不同类型的晶体,可以更好地理解晶体的结构和形成机制,为材料科学和工程技术的发展提供重要的理论和实践基础。
化学选修二晶体种类及相关知识(思维导图)

晶体物态固态晶态 以晶体形式存在 非晶态以非晶体形式存在液态特例:离子液体熔点不高的仅由离子组成的液体物质液体物质不一定由分子组成液晶态熔点至澄清点温度范围内物质聚集状态 各向异性(晶体),流动性(液体)塑晶态一定温度条件下保持固态晶体典型特征但有一定塑性气态特例:等离子体由电子,阳离子和电中性粒子组成的整体上呈 电中性的气态物质气体物质不一定由分子组成晶体特点本质特征原子在三维空间里呈周期性有序排列 自范性本质原因原子在三维空间里呈周期性有序排列晶体能自发呈现多面体外形的性质 条件晶体生长的速率适当各向异性物理性质如强度,导热性,光学性质等制备途径熔融态物质凝固生长速率适当 溶质从溶液中析出 KH2PO4单晶气态物质凝华 化学气相沉积制备钻石 判别X射线衍射实验最为可靠的科学方法熔点固定,熔化过程中温度不变 各向异性测试晶体某些性质具有各向异性折光率测试描述晶胞:描述晶体结构的基本单元无隙 相邻晶胞间没有间隙 并置晶胞平行排列,取向相同晶胞的原子计数:均摊法方法沸点 比较一般:共价晶体>离子晶体>分子晶体,金属晶体沸点区间广先分类,每一类下具体讨论晶体类型结构图法 结构图与已知的某种晶体类似,则晶体类型相同 物质种类见”各种晶体常见物质类别“计算 方法晶体密度计算顺序:晶胞原子计数--物质的量--晶胞质量-- 晶胞体积--晶体密度由关系式得出各参量关系,从中解得待求量共价晶体微观空间里没有分子微粒间作用力:共价键键长越短,键能越大,键越强 物理性质熔点高,硬度大熔化时克服共价键任何情况不导电 难溶于任何溶剂举例 晶体B,金刚石分子晶体定义:只含分子的晶体特性熔点低,硬度小范德华力越大,熔点越高,含氢键的高 范德华力:分子量,极性烷烃类碳原子数越多,支链越少,熔点越高原因:靠分子间作用力相互吸引作用力 范德华力/氢键种类所有的非金属氢化物,部分非金属单质,部分非金属氧化物; 几乎所有的酸;绝大多数有机物(AlCl3)金属晶体构成微粒:原子 微观空间没有分子作用力:金属键概念 金属阳离子和自由电子间 存在的强的相互作用特点无饱和性,方向性强弱金属原子半径越小,价电子数越多,金属键越强 成键粒子金属阳离子与自由电子结构等径圆球密堆积面心六方最密堆积体心立方堆积描述电子气理论 延展性,导电性,导热性,光泽性性质特征性质 金属键越强,金属熔点越高,硬度越大合金改性离子晶体构成微粒:阴阳离子作用力:主要离子键强弱 离子半径越小,电荷数越高, 离子键越强性质 无方向性,饱和性,为静电作用特点离子晶体中可能存在共价键,氢键物理性质熔点高,硬度大,脆 离子键越强,熔沸点越高不导电,溶于水/熔融导电导电是化学变化无延展性 错动使得同性离子相互排斥 溶解性易溶于极性溶剂,难溶于非极性溶剂结构NaCl,CsCl,ZnS,CaF2四种主要类型过渡晶体特点四种晶体都有过渡类型离子/共价离子键百分数举例石墨层内共价键,层间范德华力sp2杂化形成平面六元并环结构硬度低,层间可相对滑动熔点高于金刚石。
晶体结构基础知识

添加标题
添加标题
添加标题
添加标题
晶体结构决定了晶体的物理性质和 化学性质
晶体结构可以分为金属晶体、原子 晶体、离子晶体和分子晶体等类型
晶体结构的特点
晶体结构由原子、分子或离 子按照一定的规则排列而成
晶体结构具有周期性、对称 性和重复性
晶体结构的种类包括金属晶 体、原子晶体、分子晶体和
离子晶体
晶体结构的研究对于理解物 质的物理性质、化学性质和
晶体对称性 包括对称操 作和对称元 素
对称操作包 括旋转、反 射、倒转等
对称元素包 括对称中心、 对称面、对 称轴等
晶体对称性 是晶体结构 的重要特征 决定了晶体 的物理性质 和化学性质
05 晶体结构的物理性质
光学性质
晶体的光学性质与其结构有关 晶体的光学性质包括折射率、色散、双折射等 晶体的光学性质可以用于鉴定晶体的种类和结构 晶体的光学性质可以用于研究晶体的生长和缺陷
地质学:研究晶体结构与地质构造的 关系
环境科学:研究晶体结构与环境污染 的关系
医学领域
药物研发:通 过晶体结构分 析药物与蛋白 质的相互作用 优化药物设计
疾病诊断:通 过晶体结构分 析蛋白质的结 构变化辅助疾
病诊断
药物筛选:通 过晶体结构分 析药物与蛋白 质的结合能力 筛选有效药物
药物设计:通 过晶体结构分 析药物与蛋白 质的结合位点 设计新型药物
电学性质
导电性:晶体的导电性取决于其内部电子的移动能力 介电常数:晶体的介电常数决定了其对电场的响应能力 光电效应:晶体的光电效应是指晶体在光照下产生的电荷效应 压电效应:晶体的压电效应是指晶体在受到压力时产生的电荷效应
热学性质
热膨胀系数:晶体的热膨胀 系数与其晶体结构有关不同 晶体的热膨胀系数不同
原子晶体、分子晶体、离子晶体的比较 PPT

3.物理性质:①熔沸点低[破坏分子间的作用力],硬度小。
②一般不导电,在固态和熔融状态下也不导电
③溶解性一般符合“相似相溶规律”
二、常见的晶体结构分析:
(一)干冰: 1.分子堆积方式: 分子密堆积(只含范德华力) 2.均摊法计算CO2分子数:
顶角—— 8个 面心—— 6个 1个晶胞中CO2分子数= 8×18+6×12= 4 3.每个CO2分子周围离该分子距离最近且相等的 CO2分子有:12个 [同层+上层+下层]×4=12 (二)冰:
配位数: 8 配位空间构型:正六面体
离其最近的Cs+的个数为: 6
[上、下、左、右、前、后]
2.Cl-为中心:离其最近的Cs+的个数为: 8
配位数:8 配位空间构型:正六面体
离其最近的Cl-的个数为:6
3.均摊法计算1个晶胞中:
Cs+个数:8×18= 1
Cl-个数:1
二、三种常见的离子晶体的结构:
2.晶胞的结构:——均摊法 结合《课本》P64/图3-8
体心粒子—— 完全属于该晶胞
面心粒子—— 有12属于该晶胞
棱心粒子—— 有14该晶胞
顶角粒子—— 有18属于该晶胞
二、晶胞:
3.晶胞中微粒个数的计算:
1个金属铜晶胞
的原子数
=8×18+6×12= 4
X2Y
ACB3
DE
4.晶胞的基本类型:
简单立方
③熔点: ④能使X-
有固定的熔 射线产生衍
沸点
射
最科学的
鉴别依据
⑤均一性:组成和密度一致 ⑥对称性: ⑦稳定性: 晶格能
一、晶体:
5.形成途径: ①熔融状态物质凝固(注意凝固的速率适当)
高二化学离子晶体

3、分类 依据:构成晶体的粒子种类及粒子间的相互作用。 离子晶体 结构—决定—性质
晶 体
分子晶体 原子晶体 金属晶体
注:作用力越强,晶 体的熔沸点越高,晶 体的硬度越大 共价键 金属键
二、离子晶体
1、定义: 离子间通过离子键结合而成的晶体。
2、构成微粒:阴离子、阳离子
3、粒子间作用力:离子键 4、常见的离子晶体: 强碱、部分金属氧化物、绝 大部分盐。 5、物理性质 (1)熔沸点较高,硬度较大,难挥发难压缩。
(2)晶体不导电,水溶液或者熔融状态下均导 电。
【反馈练习】 1 .下列性质中,可以证明某化合物内一定
存在离子键的是( D
A.晶体可溶于水 B.具有较高的熔点
每个Cs+周围同时吸引着8个Cl-
每个Cl-周围同时吸引着8个Cs+
6个 每个Cs+周围与它最近且距离相等的Cs+共有___ 6 个 每个Cl-周围与它最近且距离相等的Cl- 共有____
Cs+
5 4 1 3 6 2
晶体之所以具有规则的几何外形,是因 其内部的质点作规则的排列,实际上是晶体 中最基本的结构单元重复出现的结果。 我们把晶体中重复出现的最基本的结构 单元叫晶体的基本单位—— 晶胞 晶胞对组成晶胞的各质点(晶格点)的占 有率如何呢(以立方体形晶胞为例)?
A B
C
化学式: ABC3
;
AST 外汇 外汇开户 外汇代理
joq169fhk
情,同时也传达了单位对支持花开啤酒经销商、各界领导和朋友的感激之情和热切的期望。不一会儿,单位接待经销商的豪华大巴陆续 到场了,大厅里渐渐地热闹起来了,大家相互打招呼问侯,整个大厅充满了热情欢快的笑语声。上午10点,大会准时开始,首先由江苏 花开啤酒单位董事长、总经理赵树春发表简短贺辞,然后是销售商代表发言,紧接着赵树春亲自为销量前十名的销售商颁奖,酒宴和歌 舞节目同时开始。只听见台上男节目主持人用激昂的声音讲道:“在这不平凡的一年里,我们战胜了‘非典’,在2004年,我们力争达 到销售花开啤酒9万吨。”女节目主持人接道:“展望2004年,我们充满了信心。下面,请欣赏歌伴舞《花开啤酒,今天是个好日子》” 大厅中充满了甜美的歌声和欢快的舞蹈:唉—— 开心的锣鼓敲出年年的喜庆好看的舞蹈送来天一原欢腾阳光的油彩涂红了今天的日子 哟生活的花朵是我们的笑容唉—— 今天是个好日子心想的事儿都能成明天是个好日子打开了家门咱迎春风„„在歌舞声中,赵树春携 全体高层领导一桌一桌给大家敬酒,与每一位经销商、业务员碰杯、祝福。最热闹的高潮是抽奖环节,由工作人员把每个经销商的编号 放进抽奖箱,然后由海涛州质量技术监督局、泰港区以及花开啤酒领导来依次抽奖。抽奖时整个会场一会儿鸦雀无声,一会儿欢笑声、 欢呼声响彻整个大厅,被抽到的经销商个个欣喜若狂,没有被抽到的经销商也个个欢呼鼓掌。快乐就是最好的奖品,大家就图个参与、 图个气氛、图个热闹。一位抽到真丝软缎绣花被子的南京经销商领奖时带着戏谑的表情说道:“花开啤酒是用柔软的太空棉被给我加包 袱呀,我想今年无论如何也要干到6000吨,不然怎么对得起赵总呢?”大家哄堂大笑。此刻,《鹰》的主题曲在大厅里回荡:雄鹰飞吧 飞吧,飞向高空中。雄鹰唱吧唱吧,歌声回响在蓝天。飞翔吧,歌唱吧。飞翔吧,歌唱吧。雄鹰快快飞,飞向高空中。雄鹰飞了飞了, 飞到高空中。唱着愉快的歌儿,歌声回响在蓝天。多自由,多快活。多自由,多快活。唱着愉快的歌,飞舞在蓝天„„8.10P花开啤酒 作为今年刚开发出来的新品种,不管是从口味上还是从商标设计上都深深地吸引了经销商,而且8.10P的花开啤酒名字还有来头,确实 是费了一番不小的脑筋。至于详细情况还得表一表,借此使读者了解一下啤酒开发过程中所历经的沟沟坎坎。刚开始开发这个产品时, 单位要求开发出来的产品要与众不同,不仅从啤酒口感风味上要体现出来,外包装也要推陈出新。作为新品研发小组组长的马启明在苦 苦思索,当时市场上大部分是80P啤酒,从名字上能不能动动歪脑筋。因为在江苏及其周边,其它单位是以80P淡爽啤酒为主,能不能定 为8.10P?虽然只是浓度
离子晶体+分子晶体+原子晶体综合复习
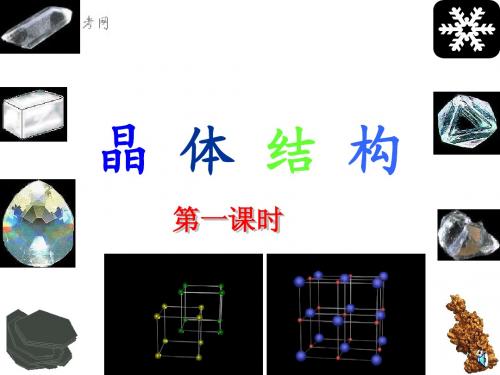
H2Te SbH3
NH3
H2S
HCl PH3 SiH4 ×
H2Se AsH3 HBr
HI
×
GeH4
SnH4
×
-100
-125 -150 CH4
×
2
3
4
5
周期
一些氢化物的沸点
三、氢键
N、O、F原子与H原子之间的相互作用。
化学键> >氢键>分子间作用力 含有氢键的物质熔化、汽化时需要破坏
氢键和分子间作用力,所以NH3、H2O、
温度/℃ 250 200
沸点
I2
150
100 50 100 150Br 2
熔点
I2
0
-50 -100 -150
50
Cl2
Br2 200 250
相对分子质量 Cl2
-200
-250
F2 F2
卤素单质的熔、沸点与 相对分子质量的关系
沸点/℃
100 75 50 25 0 -25 -50 -75 HF
H2O
一、离子晶体 1、定义: 阴、阳离子间通过离子键结合
而成的晶体叫做离子晶体。
2、构成离子晶体的微粒及微粒间的作用力: 微 粒:阴阳离子
作用力: 离子键。 3、离子晶体包括:强碱、绝大多数盐、低价
金属氧化物。
4、离子晶体的特征:
①无单个分子存在;NaCl 、CsCl不表示分子式。
②熔沸点较高,硬度较大,难以压缩。
③固态不导电,水溶液或者熔融状态下均导电。
5、离子键强弱取决于: 离子半径、离子所带的电荷 离子半径越小、离子所带的电荷越 多,离子键越强。 6、离子键强弱决定:
离子晶体的硬度、熔沸点。(熔化时破坏 或削弱离子键)
晶体结构基本知识

rO2-=140pm为标准
同一离子的离子半径在不同类型的晶体结构中因作 用力不同而有差异。 温度会影响离子半径的大小。 目前测定的离子半径是在统一温度下,以NaCl晶体 构型(配位数是6)为标准,对其余晶体构型的离子半径作 一定的校正。 常见的单原子离子半径数据:
哥儿智密特半径、泡林半径、夏农半径。
二、金属键的本质 1、电子气(自由电子)理论
价键理论在金属晶体中的应用。
金属晶体由金属原子、金属离子以及在 金属晶体中自由运动的电子组成。
3-4-2 金属晶体的堆积模型
把金属晶体看成是由直径相等的圆球状金属 原子在三维空间堆积构建而成的模型叫做金属晶 体的堆积模型。 金属晶体堆积模型有三种基本形式——体心 立方堆积、六方最密堆积和面心立方最密堆积。
和各向异性。
3-1-2 晶体的微观特征——平移对称性
平移对称性:在晶体中,相隔一定距离,总有 完全相同的原子排列出现。这种呈现周期性的 整齐排列是单调的,不变的。 晶体的宏观对称性是晶体的微观对称性的体现。 非晶态物质不具有平移对称性。
3-2 晶胞 3-2-1 晶胞的基本特征(P41) 晶格:组成晶体的质点(分子、原子、离子)以 确定位置的点在空间作有规则的排列,这些点群 具有一定的几何形状,称为结晶格子。 晶格结点:每个质点在晶格中所占有的位置 称为晶格的结点。 晶胞(unit cell):晶体结构中具有代表性的 最小重复单位。
多原子离子的热化学半径:151页表3-5。 原子半径与离子半径的关系: 阳离子半径小于其原子半径,阴离子半径大于其原 子半径。
3-5-2 离子键
定义:阴阳离子通过静电作用力形成的化 学键。
1、离子键的特点: a、离子键的本质是静电作用力; b、离子键没有方向性;
离子晶体、分子晶体、原子晶体和金属晶体的比较
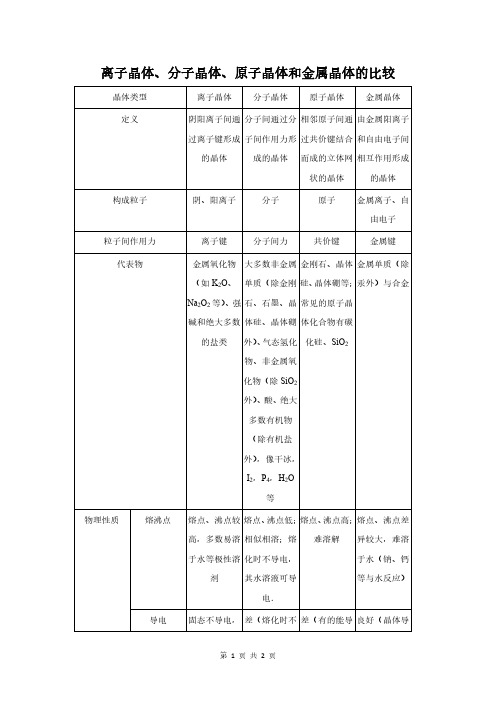
离子晶体、分子晶体、原子晶体和金属晶体的比较晶体类型离子晶体分子晶体原子晶体金属晶体定义阴阳离子间通过离子键形成的晶体分子间通过分子间作用力形成的晶体相邻原子间通过共价键结合而成的立体网状的晶体由金属阳离子和自由电子间相互作用形成的晶体构成粒子阴、阳离子分子原子金属离子、自由电子粒子间作用力离子键分子间力共价键金属键代表物金属氧化物(如K2O、Na2O2等)、强碱和绝大多数的盐类大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外),像干冰,I2,P4,H2O等金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、SiO2金属单质(除汞外)与合金物理性质熔沸点熔点、沸点较高,多数易溶于水等极性溶剂熔点、沸点低;相似相溶;熔化时不导电,其水溶液可导电.熔点、沸点高;难溶解熔点、沸点差异较大,难溶于水(钠、钙等与水反应)导电固态不导电,差(熔化时不差(有的能导良好(晶体导熔化或溶于水导电导电,其水溶液可导电.)电,如晶体硅,但金刚石不导电.)电,熔化时也导电)导热不良不良不良良好硬度较硬而脆硬度小硬度大硬度差异较大决定熔点、沸点高主要因素离子键强弱分子间作用力大小共价键强弱金属键强弱熔化时键的变化离子键断开,共价键一般不断开不断键共价键断开金属键减弱。
如何判别晶体类型

如何判别晶体类型1、根据物质的分类判断①离子晶体---金属氧化物如K2O、Na2O2等、强碱如NaOH、KOH等和绝大多数的盐类是离子晶体②分子晶体---卤素、氧气、氢气等大多数非金属单质除金刚石、石墨、晶体硅、晶体硼外、稀有气体、所有非金属氢化物、多数非金属氧化物除SiO2外、含氧酸几乎所有的酸、绝大多数有机物的晶体都是分子晶体③原子晶体常见的---某些非金属单质:金刚石、晶体硅Si 、晶体硼B,某些非金属化合物:二氧化硅SiO2 、碳化硅SiC 、 Si3N4、BN、 AlN、 Al2O3 等④金属晶体---金属单质除汞外与合金2、依据组成晶体的微粒及微粒间的作用判断1离子晶体的微粒是阴、阳离子,微粒间的作用是离子键;2分子晶体的微粒是分子,微粒间的作用为分子间作用力;3原子晶体的微粒是原子,微粒间的作用是共价键;4金属晶体的微粒是金属阳离子和自由电子,微粒间的作用是金属键;3. 依据晶体的熔点判断1离子晶体的熔点较高,常在数百度至一千余度;2分子晶体熔点低,常在数百度以下至很低温度;3原子晶体熔点高,常在一千度至几千度;4金属晶体熔点高低皆有;4. 依据导电性判断1离子晶体水溶液及熔化时能导电;2分子晶体为非导体,而分子晶体中的电解质如酸和部分非金属气态氢化物溶于水,使分子内的化学键断裂形成自由离子也能导电;3原子晶体一般为非导体,但有些能导电,如晶体硅半导体;4金属晶体是电的良导体;5. 依据硬度和机械性能判断1离子晶体硬度较大或略硬而脆;2分子晶体硬度小且较脆;3原子晶体硬度大;4金属晶体多数硬度大,但也有较低的,且具有延展性;石墨可以看成混合型晶体或过渡晶体;因为石墨中C原子间为共价键连接而层与层间为分子间作用力连接小结:四种晶体类型与性质的比较物质熔沸点高低的比较首先判断物质的状态:固体>液体>气体如I2>Hg>O21不同晶型的物质的熔沸点高低顺序一般是:原子晶体>离子晶体>分子晶体;同一晶型的物质,则晶体内部结构微粒间的作用越强,熔沸点越高;2原子晶体要比较共价键的强弱,一般地说,原子半径越小,形成的共价键的键长越短,键能越大,其晶体熔沸点越高;如熔点:金刚>碳化硅>晶体硅;键长C - C < C – Si < Si – Si 键能C – C > C – Si > Si - Si3离子晶体要比较离子键的强弱;一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔沸点就越高,如熔点:MgO>MgCl2>NaCl>CSCl4分子晶体:a、组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高,如熔沸点:O2>N2,HI>HBr>HCl, I2 > Br2 > Cl2 > F2;b、组成和结构不相似的物质,分子极性越大,其熔沸点就越高,如熔沸点:CO>N2;C、在同分异构体中,一般地说,支链数越多,熔沸点越低,如熔沸点:正戊烷>异戊烷>新戊烷;同分异构体的芳香烃及其衍生物,其熔沸点高低顺序是邻>间>对位化合物;5金属晶体中金属离子半径越小,离子电荷数越多,其金属阳离子与自由电子间的作用越强,金属熔沸点就越高;正戊烷,异戊烷,新戊烷CH3-CH2-CH2-CH3 正丁烷CH3-CH-CH3 异丁烷 | CH3。
高中化学知识总结离子晶体、分子晶体和原子晶体

离子晶体、分子晶体和原子晶体[学法指导]在学习中要加强对化学键中的非极性键、极性键、离子键、晶体类型及结构的认识与理解;在掌握粒子半径递变规律的基础上,分析离子晶体、原子晶体、分子晶体的熔点、沸点等物理性质的变化规律;并在认识晶体的空间结构的过程中,培养空间想象能力及思维的严密性和抽象性。
同时,关于晶体空间结构的问题,很容易与数学等学科知识结合起来,在综合题的命题中具有广阔的空间,因此,一定要把握基础、领会实质,建立同类题的解题策略和相应的思维模式。
[要点分析]一、晶体固体可以分为两种存在形式:晶体和非晶体。
晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体。
气体、液体和非晶体在一定条件下也可转变为晶体。
晶体是经过结晶过程而形成的具有规则的几何外形的固体。
晶体中原子或分子在空间按一定规律周期性重复的排列,从而使晶体内部各个部分的宏观性质是相同的,而且具有固定的熔点和规则的几何外形。
NaCl晶体结构食盐晶体金刚石晶体金刚石晶体模型钻石C60分子二、晶体结构1.几种晶体的结构、性质比较2.几种典型的晶体结构:(1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。
(2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的离子个数比为1:1。
(3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展,键角都是109°28',最小的碳环上有六个碳原子。
(4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有两个碳原子。
片层间存在范德华力,是混合型晶体。
熔点比金刚石高。
(5)干冰(如图6):分子晶体。
(6)SiO2:原子晶体,空间网状结构,Si原子构成正四面体,O原子位于Si-Si键中间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
即Si原子与O原子的个数比为1∶2。
二、物质熔沸点高低判断的方法
1.原子晶体中原子间键长越短,共价键越稳定,物质熔沸点越高,反熔沸点越高,反之越低。
3.分子晶体中分子间作用力越大,物质熔沸点越高,反之越低。其中组成和结构相似的分子,相对分子质量越大,分子间作用力越大。(但这不包括具有氢键的分子晶体其熔沸点出现反常得高的现象,
5.原子晶体的熔点高低与其内部的结构密切相关:对结构相似的原子晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就高。
二、分子晶体
1.分子晶体定义:分子间通过分子间作用力构成的的晶体称为分子晶体。
(1)构成分子晶体的粒子是分子,粒子间的相互作用是分子间作用力
(2)原子首先通过共价键结合成分子,分子作为基本构成微粒,通过分子间作用力结合成分子晶体。
2. 分子晶体的类别:多数非金属单质(除了金刚石、晶体硅、晶体硼、石墨等),多数非金属氧化物(如干冰、CO、冰等)、非金属气态氢化物(如NH3,CH4等)、稀有气体、许多有机物等。
3.常见的分子晶体的晶体结构
(1)碘晶体的晶胞是长方体,碘分子除了占据长方体的每个顶点外,在每个面上还有一个碘分子。
⑵CsCl型
CsCl型离子晶体中,每个离子被8个带相反电荷的离子包围,阴离子和阳离子的配位数都为8。常见的CsCl型离子晶体有铯的卤化物(氟化物除外)、TlCl的晶体等。
⑶ZnS型
ZnS型离子晶体中,阴离子和阳离子的排列类似NaCl型,但相互穿插的位置不同,使阴、阳离子的配位数不是6,而是4。常见的ZnS型离子晶体有硫化锌、碘化银、氧化铍的晶体等。
(3)大多数离子晶体易溶于极性溶剂(如水)中,难溶于非极性溶剂(如汽油、煤油)中。当把离子晶体放在水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
四、金属晶体
由金属键形成的单质晶体。金属单质及一些金属合金都属于金属晶体,例如:镁、铝、铁和铜等。金属晶体中存在金属离子(或金属原子)和自由电子,金属离子(或金属原子)总是紧密地堆积在一起,金属离子和自由电子之间存在较强烈的金属键,自由电子在整个晶体中自由运动,金属具有共同的特性,如金属有光泽、不透明,是热和电的良导体,有良好的延展性和机械强度。
(2)干冰:干冰晶体是一种立方面心结构,每8个CO2分子构成立方体,且在六个面的中心又各占据1个CO2分子。每个CO2分子周围,离该分子最近且距离相等的CO2分子有12个(同层4个,上层4个,下层4个)。
(3)冰:冰晶体主要是水分子依靠氢键形成的,由于氢键具有一定的方向性,中央的水分子与周围四个水分结合,边缘的四个水分子也按同样的规律再与其他的水分子结合。 这样每个水分子中的每个氧原子周围都有四个氢原子,氧原子与其中的两个氢原子通过共价键结合,而与属于其他水分子的另外两个氢原子靠氢键结合在一起。可以看出,由于氢键的方向性和饱和性使水分子不能采取紧密堆积,这种排列中,分子的间距比较大,有很多空隙,类似于蜂巢结构,比较松散。因此水由液态变成固态时,密度变小
答案:BC
[例2]关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
解析:金属晶体无阴离子,B项错误;C、D项不确切,如钨的熔点(3410℃)比硅(1410℃)高,汞的熔点(-60℃)比冰的熔点(0℃)低。
三.解题方法——类比法
[例1]下列叙述正确的是
A.同主族金属的原子半径越大,熔点越高
B.稀有气体原子序数越大,沸点越高
C.分子间作用力越弱,分子晶体的熔点越低
D.同周期元素的原子半径越小,越易失去电子
解析:根据周期表中元素性质递变规律,同主族金属原子半径自上而下增大,而熔点自上而下降低,A项不正确;零族稀有气体原子序数自上而下增大,相对分子质量也在增大,分子间作用力也随之增大,熔沸点也越来越高,故B、C两项正确;同周期从左到右,原子半径越来越小,失电子越来越难,D项不正确。
3.氯化钠晶体的晶体结构
氯化钠晶体可视为不等径圆球的密堆积,即将氯化钠晶体看成是由Cl-紧密堆积排列,Na+填入六个Cl-构成的空隙中形成的。
在氯化钠晶体中,钠离子与氯离子通过离子键相结合,每个钠离子与和它紧邻的6个氯离子相连,每个氯离子与和它紧邻的6个钠离子相连,钠离子和氯离子在三维空间上交替出现,并延长形成氯化钠晶体 。
组成比为1∶1的离子晶称为AB型离子晶体,它是离子晶体中最简单的一类。AB型离子晶体最常见结构有NaCl型、CsCl型和ZnS型。
⑴NaCl型
NaCl型离子晶体中,每个离子被6个带相反电荷的离子包围,阴离子和阳离子的配位数都为6。常见的NaCl型离子晶体有碱金属元素(铯除外)的卤化物、银的卤化物(碘化银除外)、碱土金属元素(铍除外)的氧化物、硫化物和硒化物的晶体等。
氯化钠晶胞为面心立方结构,当有一个Cl-处于立方体的中心,另有12个Cl-处于棱上,同时有8个Na+位于顶点、6个Na+位于面心的位置,用切割法可求出该晶胞中实际拥有的离子数目,
Cl-为;1+12×1/4=4 Na+为:8×1/8+6×1/2=4
因此在一个晶胞中实际拥有的Na+与Cl-的个数均为4个,即氯化钠晶体中没有氯化钠分子,NaCl只是代表氯化钠晶体中钠离子的个数和氯离子的个数为1:1 ,是氯化钠组成的化学式。
离子晶体、分子晶体、金属晶体、原子晶体
一、原子晶体
1.原子晶体定义:相邻原子之间以共价键相结合而形成空间网状结构的晶体称为原子晶体。
2.常见的原子晶体:金刚石、晶体硅、晶体硼、二氧化硅、碳化硅等
3.原子晶体的物理性质:
答案:A
(1)离子晶体硬而脆。离子晶体中,阴阳离子间有较强的离子键,离子键表现出较强的硬度,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
(2)离子晶体不导电,熔化或溶于水后能导电。离子晶体中,离子键较强,离子不能自由移动,因此离子晶体不导电。当升高温度时,阴、阳离子获得足够能量,克服了离子间的相互作用,成了自由移动的离子,在外界电场作用下,离子定向移动而导电。离子化合物溶于水时,阴、阳离子受到水分子作用变成了自由移动的离子(或水合离子),在外界电场作用下,阴、阳离子定向移动而导电。
原子晶体中的原子以较强共价键相连接,因此在晶体中,原子不遵循紧密堆积原则;原子晶体一般熔点都很高,硬度都很大,这是由于原子晶体熔化时必须破坏其中的共价键,而共价键的键能相对较大,破坏它们需要很多的能量。另外原子晶体还具有难溶于水,固态时不导电等性质。
4.常见的几种原子晶体的结构:
⑴金刚石
在金刚石晶体里,每个碳原子都被相邻的4个碳原子包围,以共价键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。这些正四面体结构向空间发展,构成一个坚实的、彼此联结的空间网状晶体(如右图)。金刚石晶体中所有C-C键长相等,键角相等(均为109028’);晶体中最小碳环由6个C组成且六者不在同一平面内;晶体中每个C参与了4条C-C键的形成,而在每条键中的贡献只有一半,故C原子个数与C-C键数之比为1:(4×1/2)=1:2。
三,离子晶体
1.定义:离子晶体是阴阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。例如:氯化钠、氯化铯、氧化镁等晶体都属于离子晶体。
2.离子晶体的简单结构类型
离子晶体以紧密堆积方式,阴阳离子尽可能接近,向空间无限扩展,形成晶体。阴阳离子的配位数比较大,故晶体中不存在单个分子。
4.金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子的静电作用越强,金属键越强,熔沸点越高,反之越低。
5.晶体的类型不同时一般规律为:
原子晶体>离子晶体>金属晶体>分子晶体但需注意金属晶体的熔沸点差别很大。如W的熔沸点甚至高于有些原子晶体,而Hg的熔点则很低,常温下呈液体状态。
4.分子晶体的物理性质
(1)由于分子间作用力很弱,分子晶体气化或熔融时,克服分子间的作用力,不破坏化学健,所以分子晶体一般具有较低的熔点和沸点,较小的硬度,有较强的挥发性。
(2)由于分子晶体的构成微粒是分子,所以分子晶体在固态或熔融状态时都不导电。
(3)不同分子晶体在溶解度上差别很大,并且同一分子晶体在不同的溶剂中溶解度也有很大的差别,如碘易溶于CCl4等有机溶剂,不易溶解于水,分子晶体在溶剂中溶解情况一般符合“相似相溶”的经验性规律,非极性溶质一般能溶于非极性溶剂、极性溶质一般能溶于极性溶剂。
一、确定晶体的化学式常用的两种方法
1.比例法
从给定的立方体型晶胞出发,计算晶体中不同原子或离子的个数比,
可按以下方法:①处于顶点上的原子或离子,
同时为8个晶胞共有,
④处于内部的原子或离子,则完全属于该晶胞,每个原子或离子按1计入给定晶胞。
2.平均分配法
每个硅氧四面体的中心Si原子与4个O原子以共价键相结合,而每个O原子又与2个Si原子结合,故1个O原子被2个中心Si原子均分,每个O原子给中心Si原子提供的原子数为12个,
