聚合物的溶液性质
第三章 高分子的溶液性质

3、高分子溶液的混合自由能 ΔFM= ΔHM-TΔSM=RT(n1ln φ1+n2ln φ2+ χ1n1φ2) 溶液中溶剂的化学位变化和溶质的化学位变化Δμ1、 Δμ2
分别为:
Δμ1 =RT[lnφ1+(1-1/x)φ2+χ1φ22] Δμ2 = RT[lnφ2+(x-1)φ1+xχ1φ12] lnp1/p10= Δμ1/RT= ln(1-φ2)+(1-1/x)φ2+χ1φ22 注意:由高分子溶液蒸汽压p1和纯溶剂蒸汽压p10的测量
4、混合溶剂, δ混= Φ1 δ1 + Φ2 δ2,有时混合溶剂的溶
解能力强于纯溶剂。
第二节 高分子溶液的热力学性质
理想液体的概念:溶液中溶质分子间、溶剂分子 间和溶剂溶质分子间的相互作用能均相等,溶 解过程没有体积的变化,也没有焓的变化。 理想溶液实际上是不存在的,高分子溶液与 理想溶液的偏差在于两个方面:一是溶剂分子 之间、高分子重复单元之间以及溶剂与重复单 元之间的相互作用能都不相等,因此混合热不 为零;二是高分子具有一定的柔顺性,每个分 子本身可以采取许多构象,因此高分子溶液中 分子的排列方式比同样分子数目的小分子溶液 的排列方式多,即其混合熵高于理想溶液的混 合熵。
2、对于真实的高分子在溶液中的排斥体积分为两部分:外排 斥体积和内排斥体积。外排斥体积是由于溶剂与高分子链段的 作用能大于高分子链段之间的作用能,高分子被溶剂化而扩张, 使两个高分子不能相互靠近而引起的;内排斥体积是由于高分 子有一定的粗细,链的一部分不能同时停留在已为链的另一部 分所占据的空间所引起的。当溶液无限稀释时,外排斥体积可 以接近零,而内排斥体积永远不为零。如果链段比较刚性或链 段之间排斥作用比较大,则内排斥体积为正;相反,链相互接 触的两部分体积可以小于它们各自的体积之和,则内排斥体积 为负。这种内排斥体积为负的链称为坍陷线团。
phys_book

=1
[η ] =
()
M
2 32
(5-8)
(r )
θ
2 12
⎤ ⎡1 = ⎢ [η ]θ ⋅ M ⎥ ⎦ ⎣φ0
聚合物的热性能------------------------------------------------------------------------------115
实验三十 第五单元
聚合物材料的维卡软化点的测定---------------------------------------------------124 高聚物熔体流动特性的测定-----------------------------------------------------127 塑料熔体流动速率的测定--------------------------------------------------------131 Q 表法测定聚合物的介电系数和介质损耗------------------------------------135 聚合物电阻的测定------------------------------------------------------------------138
聚合物的简易鉴定-------------------------------------------------------------------------143
实验三十五 聚合物的定性鉴别-------------------------------------------------------------------143 附录------------------------------------------------------------------------------------------------------------150 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ 塑料、 橡胶、 纤维的缩写语---------------------------------------------------------------------150 常用溶剂的纯化方法---------------------------------------------------------------------------151 聚合物沉淀分级常用的溶剂和沉淀剂------------------------------------------------------153 常用溶剂的物理常数 -------------------------------------------------------------------------157 常见聚合物的物理常数 ----------------------------------------------------------------------165 与[η]关系[η]=KM 参数表-------------------167 常见聚合物特性粘度-分子量 (Mr)
溶液聚合实验报告

溶液聚合实验报告溶液聚合实验报告引言:溶液聚合是一种重要的化学反应,它在化工领域有广泛的应用。
本实验旨在通过合成聚合物的方法,研究溶液聚合的原理和过程,并探讨不同条件下对聚合物性质的影响。
实验部分:1. 实验材料和仪器本实验所需材料有:苯乙烯、苯乙烯单体、过硫酸铵、聚乙烯醇等。
实验所用仪器有:反应釜、搅拌器、温度计等。
2. 实验步骤(1) 准备反应釜:将反应釜清洗干净,并加入适量的苯乙烯单体。
(2) 添加引发剂:将适量的过硫酸铵溶解在适量的水中,然后将溶液加入到反应釜中。
(3) 开始聚合反应:启动搅拌器,将反应釜加热至一定温度,保持一定时间。
(4) 结束反应:停止加热,将反应釜冷却至室温。
(5) 收集产物:将聚合物从反应釜中取出,进行干燥和称重。
结果和讨论:1. 聚合物的形态和性质经过实验,我们得到了一种聚苯乙烯聚合物。
观察聚合物的形态,可以发现它呈现出固体的形态,具有一定的透明度和韧性。
这是因为苯乙烯单体在聚合过程中发生了链式聚合反应,形成了大分子量的聚合物链。
2. 聚合反应的影响因素我们在实验中探究了聚合反应的温度、引发剂浓度和反应时间对聚合物性质的影响。
(1) 温度:我们将反应温度分别设定为50℃、70℃和90℃,发现随着温度的升高,聚合物的分子量增加,形成的聚合物链更长,聚合物的透明度和韧性也增加。
(2) 引发剂浓度:我们将引发剂浓度分别设定为0.1%、0.3%和0.5%,发现随着引发剂浓度的增加,聚合物的分子量也增加,聚合物链更长,聚合物的透明度和韧性增加。
(3) 反应时间:我们将反应时间分别设定为1小时、2小时和3小时,发现随着反应时间的延长,聚合物的分子量增加,聚合物链更长,聚合物的透明度和韧性增加。
结论:通过本实验,我们了解了溶液聚合的原理和过程。
聚合反应的温度、引发剂浓度和反应时间对聚合物性质有明显的影响。
在实际应用中,我们可以通过调节这些条件来控制聚合物的性质,以满足不同的需求。
聚合物溶液流变曲线-定义说明解析

聚合物溶液流变曲线-概述说明以及解释1.引言1.1 概述概述部分:聚合物溶液流变曲线是研究聚合物溶液在流动状态下的流变特性的重要曲线之一。
通过对聚合物溶液在不同条件下的流变曲线进行研究和分析,可以更好地了解聚合物溶液的流动行为、流变特性和变形规律,为工程应用和科研研究提供重要参考。
在本文中,我们将对聚合物溶液流变曲线进行全面的介绍和分析,包括其概念、特点、影响因素以及实际应用。
同时,我们也将对聚合物溶液流变曲线的研究现状和未来发展进行展望和总结,以期为相关领域的学者和工程技术人员提供一定的参考和借鉴。
1.2 文章结构文章结构部分:本文将首先对聚合物溶液流变曲线进行概述,介绍其基本概念和特点。
随后将探讨影响聚合物溶液流变曲线的因素,包括溶剂、浓度、温度等。
最后将阐述流变曲线的实际应用,包括在材料工程、医药制备等领域的具体应用案例。
通过对这三个方面的深入探讨,将为读者提供全面的了解和认识,从而更好地理解和应用聚合物溶液流变曲线。
1.3 目的:本文旨在深入探讨聚合物溶液的流变性质,并重点分析聚合物溶液流变曲线的特点、影响因素及实际应用。
通过对聚合物溶液流变曲线的研究,可以更好地了解聚合物在溶液中的流动行为,为工程应用和科研实验提供理论支持和参考依据。
同时,本文旨在为相关领域的研究人员和工程师提供有益的信息和思路,促进聚合物溶液流变曲线研究的进一步发展和应用。
2.正文2.1 聚合物溶液流变曲线概述聚合物溶液的流变性质是指在外加剪切力作用下,其流动行为随时间而变化的性质。
聚合物溶液的流变性质通常通过流变曲线来描述。
流变曲线是描述聚合物溶液剪切应力与剪切速率之间关系的曲线图。
在流变曲线中,通常有剪切应力与剪切速率等参数。
剪切应力是指施加在流体上的力,而剪切速率则是相对于流体内部不同层间的速度差。
当施加的剪切力增加时,剪切应力和剪切速率之间的关系可以呈现出多种不同的形态,如线性、非线性等。
根据流变曲线的形态,可以对聚合物溶液的流变性质进行评估。
碳酸钠对聚合物溶液性质的影响

碳酸钠对聚合物溶液性质的影响唐艳丽;蒲万芬;吕炜;姜峰;贺艳艳;李柯苇【摘要】为研究Na2CO3对聚合物溶液性质的影响,对含Na2CO3的聚合物溶液进行黏度、剪切流变测试、水动力学尺寸测量以及岩心驱替实验.实验结果表明,随着Na2CO3浓度的增加,KYPAM溶液黏度减小,AP-P4溶液黏度先降后增.将Na2CO3加入到含Ca2+(质量浓度500 mg/L)的聚合物溶液中,KYPAM和AP-P4溶液黏度随着Na2CO3浓度的增加而增加,其中AP-P4的黏度增加较大,Na2CO3浓度为55 mg/L时,AP-P4黏度增加67%.聚合物流变测试表明,含Na2CO3的KYPAM溶液的稠度系数K均大于不含Na2CO3的体系,其流变指数n均小于不含Na2CO3的体系.注入水配制相同浓度的KYPAM溶液,加Na2CO3的聚合物水动力学尺寸平均粒径比不含Na2CO3聚合物增加78%;加Na2CO3的聚合物的阻力系数和残余阻力系数比不含Na2CO3的体系更高,其分别为55.00、5.5和34.13、3.38.因此Na2CO3可以作为一种提高含Ca2+聚合物黏度的添加剂使用.【期刊名称】《精细石油化工》【年(卷),期】2016(033)005【总页数】6页(P29-34)【关键词】Na2CO3;黏度;流变性;阻力系数;残余阻力系数【作者】唐艳丽;蒲万芬;吕炜;姜峰;贺艳艳;李柯苇【作者单位】西南石油大学化学化工学院,四川成都610500;西南石油大学石油与天然气工程学院,四川成都610500;中石油玉门油田分公司勘探开发研究院,甘肃酒泉735000;西南石油大学石油与天然气工程学院,四川成都610500;西南石油大学石油与天然气工程学院,四川成都610500;西南石油大学地球科学与技术学院,四川成都610500【正文语种】中文【中图分类】TE39聚合物驱油是一种重要的提高采收率方法,随着聚合物驱油规模的扩大,配制聚合物体系所需水量增加。
高分子溶液性质

多分散性:聚合物通常由一系列相对分子量不同
的大分子同系物组成的混合物,用以表达聚合物
的相对分子量大小并不相等的专业术语叫多分散
性。
整理课件
9
①高分子与溶剂分子尺寸相差大。两者的分 子运动速度存在差异,溶剂分子能比较快 的渗透进入高聚物,而高分子向溶剂扩散 速度却慢的多,结果是溶剂先进入高聚物 内部,使高分子体积膨胀,即溶胀,然后 是高分子均匀分散在溶剂中,形成完全溶 解的分子分散的均相体系。
高分子溶液性质
整理课件
1
第一节 概述
一、高分子溶液 1.高分子溶液:高聚物以分子状态分散在溶液中所
形成的混合物。 举例:PVC溶于THF /NR 溶于甲苯 2.浓溶液与稀溶液 高分子溶液性质随浓度不同有很大变化,据此将高
分子溶液分为浓溶液和稀溶液。 稀溶液:一般认为高分子溶液的浓度在5%以下者
内聚 E能 H VRT
CED
Hv RT v~
Hv :摩尔蒸发热
整理课件
47
④高聚物由于不能汽化(降解先于汽化),所 以高聚物的溶度参数不能采用上述方法求得。 通常用下面几种方法:
整理课件
48
a.Small估算法
2 v ~ E 1 2 E v ~ v ~ 1 2F v ~v ~ F i M 0 F i
整理课件
35
二、溶剂的选择
聚合物溶剂的选择,目前尚无很成熟 的理论,但在长期的生产实践和科学 研究中已总结出一些规律,这些规律 对聚合物溶剂的选择有一定的指导意 义。
1.极性相近原则
这是低分子化合物溶解时总结出来的一 个规律,在一定程度可指导高聚物选择 溶剂。即极性弱的高聚物溶于极性弱的 溶剂,极性强的高聚物溶于极性强的溶 剂。
高分子物理 高分子的溶液性质

? V? ? [( 12
? 1 ? ? 2 )2 ? (? 1 ? ? 2 )2 ]
? 2 ? P? 2
? 2 ? d? 2
? ω是指极性部分的溶度参数,Ω是指非极性
部分的溶度参数,P是分子的极性分数,d是 非极性分数 。
? 三、混合溶剂的溶度参数
? M ? ? A? A ? ? B? B
? ① △HM >0
? ② δ1 和δ2 越接近, △H 越小,则越能满
足 △FM <0的条件,能自发溶解
4. 非极性聚合物溶度参数的确定
? ①查表 ? ②实验测定——稀溶液粘度法 ? ③计算(F:基团的摩尔引力常数)
? Fi ? Fi
?2 ?
i
V
?i M0
?
V——重复单元的摩尔体积
M0——重复单元的分子量 ρ——密度
能量。
? ③溶液中高分子链段是均匀分布的(即链段
占有任意一个格子的几率相等)
3.2.1. 高分子的混合熵 ? SM
解取向高分子
? ? ? ? S解取向 ?
高分子本体
? SM*
高分子溶液
溶剂
低分子溶液
——溶剂分子 ——溶质分子
高分子溶液
——溶剂分子 ——溶质分子
? 根据统计热力学可知体系的熵 S与体系的微
? 4.溶剂依赖性
3.1.2 聚合物溶剂选择
一、溶解过程在恒温恒压下自发进行的条件:
△FM= △HM-T △SM<0
? 通常△SM>0 。所以△FM的大小主要取决于
△HM 的正负与大小。
? 1. 极性高聚物在极性溶剂中,高分子与溶
剂分子强烈作用,溶解时放热,△HM<0 , 使 △FM<0 ,所以溶解能自发进行。
聚合物的溶液性质
7.1 聚合物的溶液性质高分子溶液在高分子工业和科学研究中占有很重要的地位。
一般将浓度低于5%的称为稀溶液。
如用于测定分子量及其分布的溶液、高分子絮凝剂、高分子减阻剂等都是稀溶液;而纺丝用的溶液(>15%)、涂料与胶粘剂(>60%)等都是浓溶液。
对于稀溶液,人们的研究已经比较深入,已能定量或半定量地描述其性质;但对浓溶液,限于它的复杂性,人们的研究着重于应用方面,至今还没有很成熟的理论。
7.1.1分子间相互作用和溶度参数聚合物溶解在溶剂中形成溶液的过程,实质上是溶剂分子进入聚合物,拆散聚合物分子间作用力(称为溶剂化)并将其拉入溶剂中的过程。
聚合物分子间、溶剂分子间以及聚合物与溶剂分子间这三种分子间作用力的相对大小是影响溶解过程的关键的内在因素。
所以首先要讨论这些分子间作用力。
分子间作用力包括取向力、诱导力、色散力和氢键力,前三者又称为范德华力。
取向力是极性分子的永久偶极之间的引力,诱导力是极性分子的永久偶极与它在其他分子上引起的诱导偶极之间的相互作用力,色散力是分子瞬间偶极之间的相互作用力。
氢键力是极性很强的原子上的氢原子(带正电性),与另一电负性很大的原子上的孤对电子相互吸引而形成的一种键,例如:范德华力对一切分子都存在,没有方向性和饱和性,作用力约比化学键小1~2个数量级。
氢键力则具有方向性和饱和性,键能虽也比化学键小,但比范德华力大,因而氢键力的存在对于高分子的性质起很大的作用。
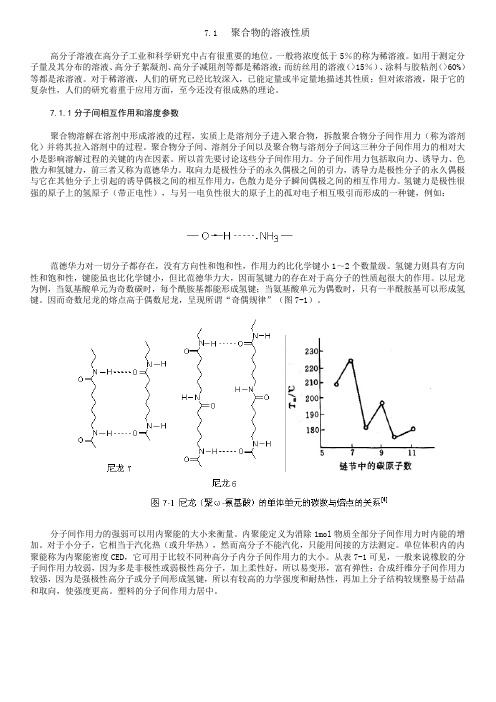
以尼龙为例,当氨基酸单元为奇数碳时,每个酰胺基都能形成氢键;当氨基酸单元为偶数时,只有一半酰胺基可以形成氢键。
因而奇数尼龙的熔点高于偶数尼龙,呈现所谓“奇偶规律”(图7-1)。
分子间作用力的强弱可以用内聚能的大小来衡量。
内聚能定义为消除1mol物质全部分子间作用力时内能的增加。
对于小分子,它相当于汽化热(或升华热),然而高分子不能汽化,只能用间接的方法测定。
单位体积内的内聚能称为内聚能密度CED,它可用于比较不同种高分子内分子间作用力的大小。
聚合物常见四种状态

聚合物常见四种状态在化学领域中,聚合物是由重复单元结构组成的大分子化合物,具有多种形态和性质。
根据聚合物内部结构的排列方式和相互作用,聚合物可以存在不同的状态。
在本文中,我们将介绍聚合物的常见四种状态:无序状态、结晶状态、玻璃态和溶液状态。
1. 无序状态无序状态指的是聚合物分子内部结构的排列没有明显的规律性。
在这种状态下,聚合物分子呈现出随机排列的特征,没有明显的长程有序性。
无序状态的聚合物通常具有均匀的外观和物理性质,如塑料材料中的大部分非晶态聚合物。
2. 结晶状态结晶状态是指聚合物分子内部呈现出有序的晶体结构。
在结晶状态下,聚合物分子以规则的晶格排列,形成结晶性材料。
这种状态下的聚合物通常具有良好的机械性能和热稳定性,如聚乙烯、聚丙烯等。
3. 玻璃态玻璃态是一种特殊的非晶态状态,聚合物在此状态下呈现出类似玻璃的特性。
玻璃态的聚合物分子没有明显的晶格结构,但又不像无序态那样具有完全的随机性。
玻璃态的聚合物通常表现出高度的刚性和脆性,如聚甲基丙烯酸甲酯等。
4. 溶液状态溶液状态是指聚合物在溶剂中形成的一种状态。
在此状态下,聚合物分子被溶剂包围并分散在其中,形成均匀的溶液体系。
溶液状态的聚合物通常表现出高度的流动性和可加工性,如聚合物溶液用于涂料、胶黏剂等领域。
总的来说,聚合物存在多种状态,每种状态都具有独特的结构和性质。
通过调控聚合物的状态,可以实现对其性能的调整和优化,为不同领域的应用提供了丰富的选择。
随着对聚合物状态理解的不断深入,人们将能够更好地利用聚合物材料的潜力,推动材料科学和工程领域的发展。
1。
高温条件下聚合物溶液的特征及模型表示

高温条件下聚合物溶液的特征及模型表示聚合物是一种分子量较大、由许多重复单元组成的化合物。
在高温条件下,聚合物溶液和一般溶液有着许多不同的特征。
本文将介绍这些特征,以及一些常用的模型表示。
一、特征1.体积效应。
当温度升高,聚合物溶解度降低,导致相对分子质量低,聚合量减少,体积变小。
同时,聚合物分子在溶液中的展开程度增加,使得溶液体积增大。
这种相对分子质量和溶液体积之间的反向关系称为“体积效应”。
2.扩散速度。
在聚合物的高分子量情况下,聚合物分子在溶液中移动的速度较慢,扩散速度也较慢。
同时,由于分子量较大,聚合物分子与溶剂分子间的相互作用较强,也限制了分子的扩散速度。
3.黏度。
高分子量使得溶液的黏度增加。
此外,黏度还受到聚合物的分子量、化学结构和溶剂分子间作用力的影响。
4.热力学性质。
聚合物在溶液中的热力学性质也与温度密切相关,包括热容、热传导等。
此外,也受到聚合物的分子量、化学结构和溶剂分子间作用力的影响。
二、模型表示模型的准确性与可适用性需要进行平衡。
以下是一些常用的模型表示:1.范式模型。
范式模型是一种简单的理论模型,通常用于建立聚合物分子量和溶液黏度之间的关系。
这种模型只考虑范式结构和链的间隔效应,并不考虑溶质的相互作用。
2.Flory-Huggins模型。
Flory-Huggins模型是一种比较流行的溶液理论模型,用于描述溶解在高分子聚合物中的小分子溶质的热力学行为。
3.高分子链扩散特性模型。
这种模型是用于研究高分子链的扩散特性的,通常基于弛豫时间、动力学因素以及聚合物的结构和力学性质等因素。
它也可以解释扩散速度随分子量增加而减少的现象。
4.Doi-Edwards模型。
Doi-Edwards模型是一种流动溶液动力学模型,适用于聚合物分子的流变学研究。
它将聚合物分子视为连续的高分子链,并将高分子的运动与溶液中的流体机械性能联系起来。
总之,高温下聚合物溶液的特征和模型表示分别从体积效应、扩散速度、黏度和热力学性质等方面进行了介绍。
第3章高分子溶液性能详解

研究高分子溶液性质的意义及特点 高分子溶液:聚合物以分子状态分散在溶剂中所形成的均相 混合物 根据浓度分为: C<1%-----极稀溶液 1%<C<5%----稀溶液 C>5%----浓溶液 高,稳定性不好 低,稳定性好
稀溶液和浓溶液的本质区别在于稀溶液中单个大分子链 线团是孤立存在的,相互之间没有交叠;而在浓厚体系中, 大分子链之间发生聚集和缠结。
高分子溶液
天然橡胶(非极性):溶于汽油,苯,己烷,甲苯(非极性溶剂) PS(弱极性):溶于甲苯,苯(非极性)和氯仿,苯胺(弱极性) PMMA(极性):溶于丙酮(极性) PVA(极性):溶于水(极性) PAN(强极性):溶于DMF(二甲基甲酰胺 ),乙腈 (强极性)
高分子溶液
(2)溶剂化原则:即溶剂分子通过与高分子链的相互作用 可把链分离而发生溶胀,直到溶解。 溶剂化作用要求聚合物和溶剂中,一方是电子受体(亲 电性),另一方是电子给体(亲核性),两者相互作用产生 溶剂化。 常见的亲电性基团:
3.高分子溶液是处于热力学平衡状态的真溶液;
4.高分子溶液的行为与理想溶液有很大的偏差;
高分子溶液
高分子溶液的特征是什么 把它与胶体溶液或低分子真溶液作比较,如何证明 它是一种真溶液. 解:从下表的比较项目中,可看出它们的不同以及高分子溶液的特征: 比较项目 高分子溶液 胶体溶液 真溶液 分散质点的尺寸 大分子10-10—10-8m 胶团10-10—10-8m 低分子<10-10m 扩散与渗透性质 扩散慢,不能透过半透膜 扩散慢,不能透过半透膜 扩散 快,可以透过半透膜 热力学性质平衡, 稳定体系,服从相律 不平衡,不稳定体系 平衡,稳定 体系,服从相律 溶液依数性 有,但偏高 无规律 有,正常 溶解度 有 无 有 溶液粘度 很大 小 很小 主要从热力学性质上,可以判断高分子溶液为真溶液.
高分子溶液特点

高分子溶液特点高分子溶液是指由高分子聚合物和溶剂组成的混合物。
高分子溶液具有以下特点:1. 高分子溶液具有高粘度。
由于高分子聚合物分子量大,溶液中高分子链的数量较多,因此高分子溶液的粘度较高。
这使得高分子溶液在流动时阻力较大,流动性较差。
2. 高分子溶液具有高浓度。
高分子溶液中高分子聚合物的含量较高,溶液的浓度较大。
高浓度的高分子溶液在溶剂中形成较为稠密的网络结构,使得溶液的物理性质发生明显变化。
3. 高分子溶液具有非牛顿流动性质。
高分子溶液的流动性质不符合牛顿流体的流动规律,即剪切应力与剪切速率成正比。
高分子溶液的流动性质受到溶液浓度、分子量、分子形态等因素的影响,其流动性质随剪切速率的变化而变化。
4. 高分子溶液具有渗透压效应。
高分子溶液中高分子聚合物的存在会导致溶液的渗透压增加。
渗透压是溶液中溶质分子浓度的一种表现形式,高分子聚合物的溶液具有较高的渗透压,可以引起溶剂分子的流动,产生渗透现象。
5. 高分子溶液具有胶溶性。
高分子聚合物在溶剂中可以形成胶体溶液,即高分子溶液中高分子链相互交织形成三维网络结构。
高分子溶液的胶溶性使得其具有一定的黏弹性和凝胶特性。
6. 高分子溶液的性质受溶剂的选择影响较大。
不同的溶剂对高分子溶液的物理性质和溶解度有着显著影响。
溶剂的选择可以改变高分子溶液的粘度、流动性、溶解度等性质。
7. 高分子溶液的性质可通过调控溶液中高分子聚合物的分子量、浓度和分子结构来改变。
高分子聚合物的分子量越大,溶液的粘度越高;溶液中高分子聚合物的浓度越大,溶液的黏弹性越明显;高分子聚合物的分子结构不同,溶液的流动性质和凝胶特性也会有所不同。
总结起来,高分子溶液具有高粘度、高浓度、非牛顿流动性质、渗透压效应、胶溶性等特点。
这些特点使得高分子溶液在许多领域具有广泛应用,如涂料、胶黏剂、医药、食品等。
通过合理调控高分子聚合物的性质和溶液条件,可以实现高分子溶液的特定应用需求。
聚合物的溶液性质

第一单元聚合物的溶液性质实验一聚合物的逐步沉淀分级法一、实验目的(1)用逐步沉淀法对聚甲基丙烯酸甲酯进行分级,得到分子量分布的信息。
(2)掌握沉淀分级法的基本原理和操作方法。
二、实验原理聚合物是具有不同分子量的同系物的混合物,由于聚合物的性能具有明显的分子量依赖性,所以在研究多分散聚合物的性质时,需先把试样中分子量相同或相近的部分从混合物中分离出来,这一分离过程就是分级,它是利用聚合物溶解度的分子量依赖性将试样分成若干个分子量不同的级分样品,再经过数据处理,得到原始样品的分子量分布。
聚合物凝聚态是许多分子依靠高分子之间的相互作用(内聚力)凝聚在一起而形成的,存在于高分子之间每个作用点的作用力(范德华力)尽管与化学键相比要小得多,但是由于聚合物的分子量大,每一个高分子链与邻近链之间的次价力作用点的数目却很大,作用力的总和远远超过了高分子主链上每一个单键的强度。
要使链单元间相互吸引而凝聚在一起的高分子在溶剂中溶解,必须把各个高分子链相互分开,变成稀溶液中一个个孤立的高分子。
溶剂的作用是把一个个高分子拆开来,实际过程是高分子固体吸收溶剂胀大,然后溶解。
胀大就是溶胀,所以当良溶剂跑到高分子线团型面以后,就好像高分子链单元之间作用有相斥的力,该斥力把一个个高分子链拆开了。
这种斥力实际是溶剂分子与高分子链单元间的相互作用,也使良溶剂里高分子表现为线团的扩张。
当溶剂变劣,线团的扩张程度要变小,甚至不扩张,这是由于溶剂分子与高分子链单元间的相互作用(相当于链单元间的相斥力)减小,而高分子闭的内聚力逐渐显得重要,同一高分子链的链单元之间的相互作用使得线团收缩,而不同高分子链的链单元之问的相互作用使线团相互吸引,最后链单元间相互作用变成吸引的,使高分子链凝聚起来,溶液就发生了分相。
沉淀分级法就是通过改变溶液条件(逐步降温或逐步加入沉淀剂)来逐渐减小溶剂分子与高分子链单元间的相互作用,当这种作用不能克服高分子间的相互作用时,高分子链将凝聚起来,直至形成沉淀从溶液中分离出来。
聚合物溶液

定律,但是对高分子溶液来说,扩散系数还有浓度依赖性和分
子量依赖性,而fick定律并未考虑这点,所以下面引入zimm模 型来描述秲溶液中高分子的平秱扩散现象
15
聚合物稀溶液
高分子在溶液中的扩散
zimm模型 在稀溶液中,聚合物链中单元间的流体力学相互作用非常强,在 扩张体积内,单元与溶剂间的流体力学相互作用也非常强。当聚 合物发生移动时,它实际上拖拽着其扩张体积内的溶剂一起运动, 而zimm模型将链的扩张体积看作一个穿过其周围溶剂运动的固体, 所以其为描绘稀溶液中聚合物运动学的最佳模型 zimm模型中分子链的扩散系数公式:
3
汇报提纲
聚合物溶液概述 聚合物的溶解
聚合物秲溶液
聚合物浓溶液
聚合物的分子量及分子量分布的测定
4
聚合物的溶解
聚合物的溶解
溶胀
由于聚合物分子与溶剂分子大小相差悬殊,溶剂分子向聚合物渗透 快,而聚合物分子向溶剂扩散慢,结果溶剂分子向聚合物分子链间
的空隙渗入,使之体积胀大,但整个分子链还不能做扩散运动
10
聚合物稀溶液
几个概念介绍
聚合物溶液的θ 状态
1 2 1 =RT 1 2 2
E
在一定温度和溶剂条件下,聚合物与溶剂间的相互作用参 数 1 / 2 时, E 0 聚合物溶液的热力学行为与理想溶 1 1 液相同, 此状态称为 θ 状态, 此时的温度称为 θ 温度, 此溶剂称为 θ 溶剂
聚合物秲溶液
聚合物浓溶液
聚合物的分子量及分子量分布的测定
9
聚合物稀溶液
几个概念介绍
流体力学相互作用
光敏感遥爪聚合物——聚4-乙烯基吡啶的制备及其溶液性质

lwe i g t e a i t f h q e s s l t n t e p l me ie ls g a u l omp c e n h e r f o r h cdi o e a u ou o u i , h o y n y t o rm c l r d a l c e y a t d a d t e d g ee o
cu o mar — o t iig diuf e C— — - i c nann s ld s( S S C)a h i r n f ra e ti h r s n e o uvp o p ie n i s a c an ta se g n n te p e e c fti tIh s hn r b
LU XioYa I a — CHEN Mig Qig n — n
(co lfC e cl n t i n ier g Jag a nvri, ui 1 1 2Ja gu rv c, . hn ) S h o hmi dMae a E gnei , i n nU i sy W x 42 , i s o i ePR C ia o aa rl n n e t 2 n P n
Ab ta t A n v Ip oos n i e tlc ei p Ime —一c u -o tiig p l 4vn lyiie C s rc: o e h t.e s i ee h l 0y r— o mai c nann oy -iy r n )( - t v c r n ( p d P VP w spe ae sn -iyp r iea n me, z di -uyo i AIN sa n itra d 4 ) a rp rdu i 4v l i n sa mo o r a o iob trnl g n yd s e( B )a nii o, n t a
高分子物理-高分子的溶液性质

• 一、高分子溶液:高聚物以分子状态分散在溶剂中所形成
的均相混合物称为高分子溶液。
• 稀溶液:浓度在1%以下的,粘度很小而且很稳定,
在没有化学变化的条件下其性质不随时间而变。
• 亚浓溶液:高分子线团互相穿插交叠,整个溶液中
的链段分布趋于均一。
• 浓溶液:纺丝溶液,浓度一般在15%以上,其粘度
• ② δ1 和δ2 越接近, △H 越小,则越能满
足 △FM <0的条件,能自发溶解
4. 非极性聚合物溶度参数的确定
• ①查表 • ②实验测定——稀溶液粘度法 • ③计算(F:基团的摩尔引力常数)
Fi Fi
2
i
V
i M0
V——重复单元的摩尔体积 M0——重复单元的分子量 ρ——密度
4. 高分子溶液与理想溶液的偏差
• ①高分子间、溶剂分子间、高分子与溶剂分
子间的作用力不可能相等,因此溶解时,有 热量变化 。
• ②由于高分子由聚集态→溶剂中去,混乱度
变大,每个分子有许多构象,则高分子溶液 的混合熵比理想溶液要大得多。
二、 Flory-Huggins高分子溶液理论
Flory和Huggins从液体的似晶格模型出发,用 统计热力学的方法,推导出了高分子溶液的 混合熵,混合热和混合自由能的关系式。
• 推导中的假设:
• ①溶液中分子的排列也象晶体一样,是晶格
排列,每个溶剂分子占一个格子,每个高分 子占有相连的x个格子。所有高分子具有相 同的聚合度
• ②高分子链是柔性的,所有构象具有相同的
能量。
• ③溶液中高分子链段是均匀分布的(即链段
占有任意一个格子的几率相等)
3.2.1. 高分子的混合熵 SM
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.1 聚合物的溶液性质高分子溶液在高分子工业和科学研究中占有很重要的地位。
一般将浓度低于5%的称为稀溶液。
如用于测定分子量及其分布的溶液、高分子絮凝剂、高分子减阻剂等都是稀溶液;而纺丝用的溶液(>15%)、涂料与胶粘剂(>60%)等都是浓溶液。
对于稀溶液,人们的研究已经比较深入,已能定量或半定量地描述其性质;但对浓溶液,限于它的复杂性,人们的研究着重于应用方面,至今还没有很成熟的理论。
7.1.1分子间相互作用和溶度参数聚合物溶解在溶剂中形成溶液的过程,实质上是溶剂分子进入聚合物,拆散聚合物分子间作用力(称为溶剂化)并将其拉入溶剂中的过程。
聚合物分子间、溶剂分子间以及聚合物与溶剂分子间这三种分子间作用力的相对大小是影响溶解过程的关键的内在因素。
所以首先要讨论这些分子间作用力。
分子间作用力包括取向力、诱导力、色散力和氢键力,前三者又称为范德华力。
取向力是极性分子的永久偶极之间的引力,诱导力是极性分子的永久偶极与它在其他分子上引起的诱导偶极之间的相互作用力,色散力是分子瞬间偶极之间的相互作用力。
氢键力是极性很强的原子上的氢原子(带正电性),与另一电负性很大的原子上的孤对电子相互吸引而形成的一种键,例如:范德华力对一切分子都存在,没有方向性和饱和性,作用力约比化学键小1~2个数量级。
氢键力则具有方向性和饱和性,键能虽也比化学键小,但比范德华力大,因而氢键力的存在对于高分子的性质起很大的作用。
以尼龙为例,当氨基酸单元为奇数碳时,每个酰胺基都能形成氢键;当氨基酸单元为偶数时,只有一半酰胺基可以形成氢键。
因而奇数尼龙的熔点高于偶数尼龙,呈现所谓“奇偶规律”(图7-1)。
分子间作用力的强弱可以用内聚能的大小来衡量。
内聚能定义为消除1mol物质全部分子间作用力时内能的增加。
对于小分子,它相当于汽化热(或升华热),然而高分子不能汽化,只能用间接的方法测定。
单位体积内的内聚能称为内聚能密度CED,它可用于比较不同种高分子内分子间作用力的大小。
从表7-1可见,一般来说橡胶的分子间作用力较弱,因为多是非极性或弱极性高分子,加上柔性好,所以易变形,富有弹性;合成纤维分子间作用力较强,因为是强极性高分子或分子间形成氢键,所以有较高的力学强度和耐热性,再加上分子结构较规整易于结晶和取向,使强度更高。
塑料的分子间作用力居中。
表7-1 一些高聚物的内聚能密度聚合物CED/J·cm-3聚乙烯260a聚异丁烯272丁苯橡胶276聚丁二烯276天然橡胶280聚苯乙烯306聚甲基丙烯酸甲酯347聚醋酸乙烯酯368聚氯乙烯381聚对苯二甲酸乙二醇酯477尼龙66 774聚丙烯腈992a.聚乙烯虽然内聚能小,但不能用作橡胶,因为易结晶。
其实,聚合物的分子间作用力更常用另一个物理量——溶度参数表示。
溶度参数δ定义为内聚能密度的平方根,即,单位为。
δ是一个可以加和的物理量,未知聚合物的δ可以用所组成的各基团的贡献值加和进行估算(见第11章的11.1),而混合溶剂或混合聚合物的δ也可以按体积分数进行加和计算,公式如下:δ混=φ1δ1 + φ2δ2式中:δ混、δ1和δ2分别为混合物、组分1和组分2的溶度参数;φ1和φ2为组分1和组分2的体积分数。
测定δ的方法是间接的粘度法和溶胀度法。
所谓粘度法,是用一系列不同δ的溶剂溶解待测聚合物,分别测定溶液的粘度。
当聚合物的δ与溶剂的δ相等时,分子链在该溶液中充分舒展(图7-2),粘度最大。
因而粘度最大的溶液,其溶剂的δ即可作为待测聚合物的δ。
所谓溶胀度法,是用交联聚合物在不同δ的溶剂中达溶胀平衡后测定溶胀度(溶胀后体积除以溶胀前体积),溶胀度最大的溶剂的δ即可作为待测聚合物的δ。
7.1.2溶剂的选择“相似相溶”原则(包括极性相似和结构相似)是人们在长期研究小分子物质溶解过程中总结出来的经验规律。
在一定程度上也适用于聚合物-溶剂体系。
例如聚苯乙烯是非极性的,可溶于苯、甲苯等非极性溶剂,而聚乙烯醇是极性的,可溶于水和乙醇中。
但这一规律比较笼统,有时并不可靠。
聚合物溶剂的选择原则主要可以采用“溶度参数相近相溶”原则。
实践证明,对于非极性的非晶态聚合物与非极性溶剂混合时,当聚合物δ2与溶剂的δ1相近,即时能够溶解,否则不溶解。
例如天然橡胶(δ2=17.4),可溶于甲苯(δ1=18.2)和四氯化碳(δ1=17.6),但不溶于乙醇(δ=26.5)和甲醇(δ=30.2)中。
这一原则适用于混合溶剂,例如丙酮(δ=20.0)和环己烷(δ=16.7)都不是聚苯乙烯(δ=18.6)的良溶剂,但按体积比1:1混合后(δ混=18.4)能与聚苯乙烯很好相溶。
对于非极性的结晶聚合物与非极性溶剂,即使δ相近,也必须在接近T m的温度下使结晶熔融后才能溶解,这是因为δ的概念中没有考虑熔融热这一部分额外的能量。
图7-3给出了常见溶剂和聚合物的δ。
小知识溶度参数与粘接强度要将聚合物粘接起来,人们可能首先想到的是环氧树脂等通用胶粘剂。
其实有针对性地选择聚合物的良溶剂,通常就能收到很好的粘接效果。
例如尼龙袜子破了,可以剪一块旧料用甲酸补上;聚氯乙烯鞋底的裂缝,可以用环己酮粘住;有机玻璃(聚甲基丙烯酸甲酯)制品断了,可以用氯仿接起来。
溶剂越良,粘接效果越好。
图7-4表明,选择胶粘剂时也要考虑胶粘剂中高分子成分的δ是否与被粘物的δ相匹配。
要选择PET(δ=21.9)的胶粘剂,只有当胶粘剂的δ接近于δ=21.9,才有最好的粘接效果(以剥离强度表示)。
对于极性聚合物,以上规律还要修正才能使用。
Hansen提出一个“三维溶度参数”的概念,认为溶度参数由色散力、极性力(包括取向力和诱导力)和氢键力三个分量组成,即式中,下标d、p、h分别代表色散力、极性力和氢键力组分。
对于极性聚合物不仅要求溶剂的总δ相近,而且还要求δd、δp和δh也分别相近,才能相溶。
例如聚丙烯腈是强极性聚合物,但它不溶于δ与之相近的乙醇、乙酸等溶剂中,因为它们极性较弱。
而在二甲基甲酰胺、乙腈、二甲亚砜等强极性溶剂中才能溶解。
三维溶度参数可以在手册上更直观地表示,可以用一个直角坐标来直观地表示高聚物和溶剂的δd、δp和δh。
比如对于聚苯乙烯(δd=17.6,δp=6.1,δh=4.1),发现凡是落在以聚苯乙烯为圆心,半径为5的球(称为溶度球)内的溶剂,均可以溶解(图7-5)。
聚苯乙烯是较易溶的聚合物,一般聚合物的溶度球半径约为3.0。
7.1.3分子量及其分布测定方法7.1.3.1端基分析法如果线性高分子的化学结构明确,而且链端带有可以用化学或物理方法分析的基团,则只要测得一定重量样品中端基的数目,就可以计算样品的数均分子量。
例如尼龙6的结构中一头是氨基,一头是羧基,因而可以用碱滴定羧基,也可以用酸滴定氨基。
计算式如下:式中:m为试样质量(g);n t为被滴定端基的摩尔数。
如果试样中有x个端基,公式成为:因而对于支化高分子,如果用其他方法测定了数均分子量,则可以反过来应用公式求得支化点的数目(它等于x-2)。
端基分析是一个绝对方法。
它只适用于分子量小于2×104的聚合物。
因为分子量太大时,端基数很少,测定精度变差。
7.1.3.2膜渗透压法如果在溶液与纯溶剂之间有一个半透膜,膜的孔只允许溶剂分子透过而不许溶质分子透过,就组成一个最简单的渗透计(图7-6)。
若开始时两边液面一样高,溶剂池中溶剂分子可透过半透膜向溶液扩散,而溶液池中的溶剂分子也可向溶剂池扩散。
但单位时间内向溶液扩散的分子数目比向溶剂扩散的分子数目多,使溶液稀释,溶液池液面上升,两毛细管液柱差所产生的压力就是渗透压π。
达平衡时,向两边扩散的溶剂分子数目相等,渗透压趋于恒定值。
[18]在一定温度下,渗透压与溶液浓度c和聚合物分子量有关,存在如下关系:以π/c对c作图,可得一直线,由截距可求,由斜率可得A2,A2称为第二维利系数。
A2是高分子间以及高分子与溶剂间相互作用大小的一种量度。
对于良溶剂,A2>0,此时高分子线团舒展(图7-2);对于不良溶剂,A2<0,此时高分子线团紧缩(发生沉淀);A2=0为临界状态,称为θ状态,此时的溶剂为θ溶剂,温度为θ温度。
膜渗透压法是一种绝对的方法,所得分子量是数均分子量。
膜渗透压法适用的分子量范围是3×104~1.5×106。
分子量太低,小分子量部分也能穿过半透膜而使结果不准;分子量太高,则π值减小,实验精度降低。
显然传统的渗透压计要达到渗透平衡的时间很长(10~20小时),但现代的快速自动平衡渗透压计只需5~10min,已解决了这个问题。
7.1.3.3气相渗透法(VOP法)在一恒温的密闭容器中充满某种溶剂的饱和蒸气,将1滴溶液分别悬挂在处于饱和蒸气气氛的两根热电偶的头部。
由于溶液中溶剂的蒸气压较低,就会有溶剂分子从饱和蒸气相凝聚到溶液滴上,并放出凝聚热,使溶液滴的温度升高到T,而溶剂滴的温度仍是环境温度T0,于是两液滴间产生温差。
经过一段时间后ΔT不再上升而达到一个相对稳定值,这个状态称为“定态”。
达定态后ΔT与溶液中溶质的摩尔分数成正比。
式中:A为常数;n1、n2分别为溶剂和溶质的摩尔数。
由于对于稀溶液n1 >> n2,所以式中:M1、M2为溶剂、溶质的分子量;m1、m2为溶剂、溶质的质量;c为溶液的浓度,单位为g/Kg溶剂。
由于温差与输出到检测器的电信号ΔG成正比,因而有:K为仪器常数,与仪器、溶剂种类及温度有关,可以预先通过一个已知分子量的标样(如联苯甲酰210.22、八乙酰蔗糖678.6等)来标定。
对于高分子溶液,必须考虑浓度依赖性。
式中:A2v为由VOP法测得的第二维利系数,与上述A2有同样物理意义。
外推到c=0,由截距可求。
可以证明VOP法测得是数均分子量,测定上限为2.5×104,分子量过高时温差太小,不易测准。
因为需要标定K,所以本方法是一种相对的方法。
7.1.3.4光散射法当光束进入介质时,除了入射光方向外,其他方向上也能看见光的现象称为光散射(图7-8)。
光散射是介质内由于分子热运动所引起的光学不均匀性产生的。
对于纯溶剂来说,是由于密度的局部涨落引起的;对于高分子溶液来说,除了密度的局部涨落外,还有浓度的局部涨落(图7-9)。
因而高分子溶液的散射光强度远比溶剂的散射光强度大得多。
散射光强度除了与溶剂浓度有关外,还与溶质分子量有关,分子量越大,散射光强度越大,因而光散射可用来测定分子量。
对于高分子溶液,利用瑞利(Rayleigh)公式并考虑到浓度的影响,其光散射的基本公式为:式中:θ――散射角,为入射光与散射光之间的夹角Rθ――瑞利比,定义为,其中r为检测点到散射体的距离,I0为入射光强度,I(θ)为散射光强度c――溶液的浓度 M――分子量――均方末端距λ′――空气中光的波长A2――第二维利系数 K――常数由于左式包含两个变量,即c和θ,只有当c和θ都等于零时才能求出分子量,同时还可从斜率求得均方末端距和A2。
