2005年华南理工大学物理化学考研试题及参考答案
华南理工大学《物理化学》64-2试卷

2.理想气体等温过程的 Δ A A.>Δ G B.<Δ G C.=Δ G D.不能确定
3.理想气体从状态 I 经自由膨胀到状态 II,可用哪个热力学函数来判断过程的自 发性? A.Δ H B.Δ G C.Δ S D.Δ U
4.在标准压力下,用水蒸汽蒸馏法提纯某不溶于水的有机物时,系统的沸点: A.必低于 373.2K C.取决于水与有机物的相对数量 B.必高于 373.2K D.取决于有机物的分子量大小
C. △G=△A+△pV=△A+nR△T =△A C. 一般过程只能用熵来判断 A 因水和有机物都有一定的蒸气压, 故系统的沸点低于水的沸点
0.25 2 =2
1
△G1 = △G2 + △G3 , —z1F E1 = —z2F E2 —z3F E3
E3=2 E1-E2 = 2×0.337V - 0.521V = 0.153V
5.已知温度为 T 时反应 2NH3 = N2 + 3H2 的标准平衡常数为 0.25,那么在同温下, 反应
1 2
N2 +
3 2
H2 = NH3 的标准平衡常数为 B. 1 C. 2 D. 4
A.0.5
6. 298K 时,Cu2+ + 2e— = Cu Cu+ + 则反应 Cu2+ + e— = A.-0.153V e— = Cu
E1 ADVANCE \ll6 E2 ADVANCE \ll6
O ADVANCE \l5
O ADVANCE \l5
ADVANCE \l6
= 0.337V
O ADVANCE \l5
ADVANCE \l6
= 0.521V
2005年华南理工大学物理化学考研试题及参考答案

8、 一般药物的有效期可通过升温时测定一定时间的分解率来确定, 例如某药物分解 30% 即无效。今在 50℃、60℃测得该药物每小时分解 0.07%、0.16%。已知浓度改变不影响每小 时该药物分解的百分数。 (1) 求此药物分解反应的活化能 Ea。 (2) 此药物在 25℃保存,试问有效期有多长? (12 分)
单分子层吸附
;
表面均匀
; 被吸
吸附与脱附同时达到平衡 。(8 分)
5 、 氧气 和 乙 炔 气 溶 于 水 中 的 亨 利 系 数 分 别 是 7.93 107 Pakgmol 1 和 2.43106 Pakgmol 1,由亨利定律系数可知,在相同条件下, 乙炔 在水中的溶解度大于 水中的溶解度。 (4 分) 氧气 在
pr=0.9929p=0.9929×101.325kPa=100.6kPa
附加压力 p= 2/r =(2×0.0589/107)Pa=1178kPa 气泡逸出的条件: pr> p 外+p=101.325kPa+1178kPa=1279kPa 所以无法逸出。
~2~
10、1.0mol 理想气体由 500K、1.0MPa ,反抗恒外压绝热膨胀到 0.1MPa 达平衡,然后 恒容升温至 500K,求整个过程的 W、Q、△U 和△H。已知 CV,m =20.786JK1mol 1。(12 分) (本题原题有错漏) 解:系统状态变化:(500K,1.0MPa,V1)→(T2,0.1MPa,V2) →(500K,p3,V2) 对恒外压绝热过程: U=W=p2(V2V1)= p2V2+0.1p1V1
=[8.315×323.15×333.15×ln(2.287)/10] Jmol1=74.05kJmol 1 (2) ln(k25/ k50)= Ea(T2T1)/RT1T2=74050×(25)/(8.315×323.15×298.15)= 2.311
05_华理_物理化学_答案

团结力量大——恩波、翔高强强联手,共同打造上海考研专业课金牌培训机构!
2、丁二稀(A)的二聚反应 2A(g) → A2 (g)为二级反应。当温度由 326℃降至 306℃时,反应速率
降低一半,试计算该反应的活化能。 [试题解析] 本题考查有关化学动力学方面的计算
1、
A(g) ⎯⎯→ B(g) + D(g)
总压
反应前:
p
A0
转化量:
−Δp
0
Δp
0
Δp
p t0 Δp
反应后: p = p − Δp
=
h
2/3
8mV
222
n +n +n
x
y
z
=
7h
2/3 ,即
4mV
222
n x
+n y
+n z
= 14 ,因此三个平动量子数只能分别等于 1,2 和 3,根据排列组合可知,该能级上可能
3
的量子态数为 P = 6 ,即 g = 6 。
3
t
12、摩尔电导率
Λ
∞ m
是电解质溶液浓度无限稀释时的摩尔电导率。(很小,无限稀释,等于零)
θ2
p /p co2
θ2
θ
p /p p /p
co
O2
θ2
100kPa / p
=
θ2
θ
1kPa / p 5kPa / p
华南理工大学2005年考研高分子化学与物理试题

四、计算题(7分)
四、计算题(7分)
在等摩尔的己二酸和己二胺的缩聚体系中加入苯甲酸,在反应程度为99.5%时制得分子量为10,000的聚合物,试计算三种反应物的摩尔比应为多少?
高分子物理部分
一、释下列基本概念(每题2分,共20分)
C.聚乙炔、聚对苯二甲酸乙二酯、聚乙烯。
四、填空题(在空格上填入正确的答案,每个答案1分,共10分)
1.随着聚合物结晶度的提高,其弹性模量;随着结晶聚合物分子量的增加,其熔点;随着聚合物交联程度的提高,其弹性模量。
2.橡胶的高弹性的特点是:(1)弹性模量很,而形变量很;(2)形变需要;(3)形变时有效应。
三、问答题(28分)
(一)苯乙烯和氯乙烯的自由基聚合中,试比较并扼要说明下列问题(8分):
1.两种聚合物的序列结构
2.链终止方式
3.聚合物的支化程度
4.自动加速现象
(二)某一单体能够进行聚合,试说明如何从实验上判断其聚合反应机理是自由基聚合还是逐步聚合。(6分)
(三)烯类单体的自由基聚合中,欲缩短聚合周期又要保证质量,你认为可采取哪些有效措施?其理论依据是什么?(8分)
7.很多阴离子聚合反应都比相应自由基聚合反应有较快的速率,这是因为
和。
8.线型缩聚的必要条件是;体型缩聚的必要条件是。
二、选择题(16分)
1.下列单体在常用的聚合温度(40 ~ 70C)下进行自由基聚合时,分子量与引发浓度基本无关,而仅决定于温度的是()。
A.乙酸乙烯酯B.氯乙烯C.丙烯腈
2.单体的相对活性是由Q、e值来决定的,而在大多数情况下,只决定于()。
B.在越低温度下结晶,熔点越高,而且熔限越宽;
华工物化试题精解

T=J(J+1)h2/82kR02
=1*2*(6.6*10-34)2/{8*3.1422*1.38×10-23*(35*10-3/6.022*1023)*(1.988×10-10)2}
=0.3480K
4.某化学反应在恒压、绝热和只做膨胀功的条件下进行,系统的温度由T1升高至T2,则此过程的焓变_______零;如果这一反应在恒温T1、恒压和只做膨胀功的条件下进行,则其焓变______零。
华南理工大学《物理化学》试卷(80学时)
专业班级________姓名________学号_________分数_______
华南理工大学化学学院葛华才老师解答,有错请留言,谢谢!
一、选择题(共10题,每题2分,20分)
1.含有非挥发性溶质B的水溶液,在101.325kPa和270.15K时开始析出冰,已知水的Kf=1.86K.kg.mol-1,Kb=0.52K.kg.mol-1,该溶液的正常沸点是:()
相图和冷却曲线见下图。
(3)可得到MgCu2。根据杠杆规则有
m(MgCu2)(0.25-0.1606)=(1kg-m(MgCu2))(0.33-0.25)
得m(MgCu2)=0.472kg
2.气态正戊烷和异戊烷的fGm(298.15K)分别为–194.4 kJ.mol-1,-200.8 kJ.mol-1;液体的饱和蒸气压分别为:
(C)反应级数由二级变为一级(D)反应级数由一级变为二级,k由小变大
[答]C
r=k1k2cA2/(k-1cA+k2)=kcA,k=k1k2cA/(k-1cA+k2)
cA→∞,k=k1k2/k-1;cA→0,k=k1cA
8.下列系统中为非胶体的是( )
华南理工大学《物理化学》考研试题及参考答案

华南理工大学2002年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试后本卷与答题纸一同交回)科目名称:物理化学(含物理化学实验)适用专业:化学工程、化学工艺、工业催化、环境工程1. 在绝热的条件下,将0.4mol某理想气体从200kPa压缩到1000kPa时,温度从300K 上升到900K,求该过程的W、△H、△S、△U、△G,判断过程的性质并指出判据,已知:该理想气体在300K和200kPa时的摩尔熵为S m=205J·K-1·mol-1,定压摩尔热容为C p,m =3.5R(12分)解:分析过程:(p1=200kPa,V1,T1=300K) →(p2=1000kPa,, V2, T2=900K)绝热Q=0理想气体△U = nC V,m△T = n(C p,m-R)△T△H = nC p,m△T故W =△U -Q过程熵△S = nC p,m ln(T2/ T1)+nR ln(p1/ p2)△G =△(H-TS) =△H-(T2S2-T1S1) =△H-(T2△S-S1△T)过程绝热,所以只能用△S判断过程的方向。
注意:本题非恒外压,功一般由热力学第一定律式计算W =△U -Q。
2. 298K时,反应N2O4(g)=2NO2(g) 的平衡常数Kθ=0.155,标准摩尔焓为57.24kJ·mol-1(假定温度对反应焓的影响可以忽略不计)。
(共10分)求(1) 373K时反应的平衡常数Kθ。
(2) 298K,总压为pθ时N2O4的离解度。
(3) 298K,总压为pθ,离解前N2O4和N2(惰性气体)物质的量为1:1时N2O4的离解度。
解:本题主要利用等压方程求不同温度下的平衡常数,以及与组成关系。
(1) 等压方程:ln(K2θ/ K1θ)= (T2-T1)∆r H mθ/R(T2T1)(2)N2O4(g) =2NO2(g)t=0 1mol 0 molt=∞时n 1-x2x n总=1+x分压(1-x) pθ/( 1+x) 2x pθ/( 1+x)K1θ=[2x/( 1+x)]2/[(1-x)/( 1+x)] =4x2/(1-x2)可求出x=(3)N2O4(g) =2NO2(g) N2t=0 1mol 1molt=∞时n1-x2x1mol n总=2+x分压(1-x) pθ/( 2+x) 2x pθ/( 2+x)K1θ=[2x/( 2+x)]2/[(1-x)/( 2+x)] =4x2/(2-x-x2)可求出x=3. 水的蒸汽压与温度之间可用如下关系式表示: lg (p /Pa) =-A /T +B若已知水在77℃时的饱和蒸汽压为41.847kPa ,求:(1) 常数A ,B 的值以及水的摩尔蒸发焓;(2) 在多大外压下水的沸点可以改变为101℃;(共8分)解:(1) 给出的关系式实际上为克-克方程的不定积分式。
华工考研试题材料物理化学

,考试作弊将带来严重后果!华南理工大学硕士研究生入学考试《材料物理化学》试卷1. 考前请将密封线内各项信息填写清楚;所有答案请直接答在试卷上(或答题纸上);.考试形式:闭卷;选择题(40分)(1)体心立方堆积的的空间利用率为( C )(A)74% (B)52%(C)68% (D)46%(2)面心立方晶体中具有最小面间距的晶面是( C):(A)(100)(B)(110)(C)(111)(D)(001)(3)尖晶石(MgAl2O4)型晶体中,O2-做面心立方最紧密堆积,Mg2+填入( B )(A)四面体空隙的半数(B)四面体空隙的八分之一(C)八面体空隙的半数(D)八面体空隙的八分之一(4)今有AX、BX和CY三种离子化合物,离子半径分别为:r X =0.181nm,rY=0.130nm,rA=0.095nm,rB=0.169nm,rC=0.034nm。
这三种化合物的阳离子配位数大小顺序排列是( A ):(A)BX>AX>CY (B)AX>CY>BX(C)BX>CY>AX (D)CY>BX>AX(5)下列硅酸盐矿物,属于链状结构的是( D )(A)顽火辉石Mg2[Si2O8] (B)绿柱石 Be3Al2[Si6O13](C)镁橄榄石Mg2[SiO4] (D)叶腊石Al2[Si4O10](OH)2(6)一个片状晶体,其化学式为KF·AlF3·BaO·MgO·Al2O3·5MgSiO3,这一结构与哪类晶体有关:B(A)滑石(B)白云母(C)叶蜡石 (D) 高岭石(7) 非化学计量化合物Cd 1+x O ,由于在化学组成上偏离化学计量而产生的晶格缺陷类型为( B )(A )负离子空位 (B )间隙正离子 (C )正离子空位 (D )间隙负离子 (8)、对于螺位错,其位错线方向、伯氏矢量方向与位错运动方向是( D ) (A )平行,平行 (B )垂直,平行 (C )平行,垂直 (D )垂直,垂直(9)若有一个变价金属氧化物XO ,在还原气氛下形成阴离子缺位型非化学计量化合物,金属元素X 和氧原子数之比为X :O=1.1:1,则其化学式应为( C )(A )X 1.1O (B )XO 0.90 (C )XO 0.91 (D )XO 1.(10)一种玻璃的化学组成为24mol%Na 2O12%mol%Al 2O 364mol%SiO 2,桥氧分数为( B )(A )2.12 (B )3.73 (C )2.94 (D )0.27(11)下列性能哪个不是玻璃的特性( B ) (A )各向同性 (B )熔点确定(C )介稳性 (D )物理、化学性质随成分连续变化(12)当液体(L )与固体(S )相接触,固相不被液体所润湿,则两相的表面张力关系为 ( D )(A )γSV -γSL >γLV (B )γSV -γSL <γLV (C )γSV >γSL (D )γSV <γSL(13)凸表面、平表面和凹表面的饱和蒸汽压存在以下关系( A ) (A )凸表面最高 (B )凹表面最高 (C )平表面最高 (D )三者一样高(14)晶界扩散系数D g ,体积扩散系数D b ,表面扩散系数D s 间的关系是:( D )(A )D g >D b >D s ; (B) D S >D b >D g ; (C) D b > D g >D s ; (D) D s >D g >D b(15)杨德(Jander )方程式1/32[1(1)]J G k t --=是固相反应( B )阶段的动力学方程。
华南理工大学2001 05年物理化学二真题与解答

华南理工大学2001 05年物理化学二真题与解答华南理工大学2001-05年物理化学二真题与解答华南理工大学2000年修读硕士学位研究生入学考试《物理化学》试题(适用专业:应化类含制糖工程,化工类,未注明的为两类共用题)1.苯的正常沸点为353k,摩尔汽化焓为30.77kj?mol-1,现将353k,标准压力下的1摩尔液态苯向真空等温冷却为同温同压的苯蒸汽(设立为理想气体)。
a.计算该过程苯吸收的热量和做的功;b.求过程的?g和?s;c.求环境的熵变;d.可以采用何中帕累托推论过程的性质。
(12分后)2.已知288.15k时纯水的饱和蒸汽压为1705pa,现将1molnaoh溶解在4.559mol水中,测得该溶液的饱和蒸汽压596.5pa,求:a.溶液中水的活度;b.在纯水中和在溶液中,水的化学势的差值。
(应化类搞,10分后)3.有关金刚石和石墨在298k时的热力学数据如下表所示:chm/(kj2mol-1)sm/(j2k-12mol-1)密度/kg2dm-3金刚石-395.32.433.513石墨-393.45.692.260求:a.298k时,由石墨转化为金刚石的?rgmǎb.298k时,由石墨转化为金刚石的最小压力。
(10分)??g=?g1+?g2+?g3=0vppㄊdp??g2??v金dp?0pp?p金假设(v金-v石)与p无关,得:(v金-v石)(p-p)=-g24.对mno-feo二组分系统,已知mno和feo的熔点分别为1785℃(v?v石)dpg2pê1370℃;在1430℃时,所含40%和70%feo(质量%)两固溶体间出现转回熔变化,与其均衡的液相共同组成为85%feo;在1200℃,两个固溶体的共同组成为36%feo和74%feo。
a.a.试绘制出高系统的波谱;b.b.指出个区域和三相线对应的相态和自由度;c.c.当一不含74%feo的二相组分系统,由1650℃缓慢热至1100℃时,做出加热曲线,详述其相态的变化。
华南理工物理化学试卷
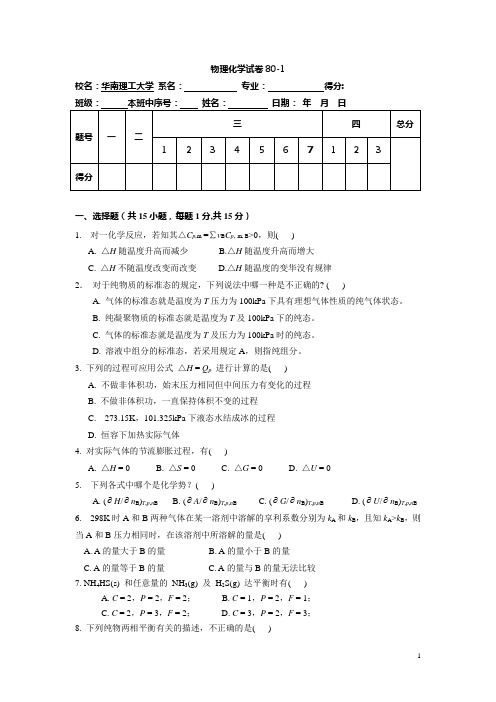
物理化学试卷80-1校名:华南理工大学系名:专业:得分:一、选择题(共15小题,每题1分,共15分)1. 对一化学反应,若知其△C p,m=∑v B C p,m, B>0,则( )A. △H随温度升高而减少B.△H随温度升高而增大C. △H不随温度改变而改变D.△H随温度的变华没有规律2.对于纯物质的标准态的规定,下列说法中哪一种是不正确的? ( )A. 气体的标准态就是温度为T压力为100kPa下具有理想气体性质的纯气体状态。
B. 纯凝聚物质的标准态就是温度为T及100kPa下的纯态。
C. 气体的标准态就是温度为T及压力为100kPa时的纯态。
D. 溶液中组分的标准态,若采用规定A,则指纯组分。
3. 下列的过程可应用公式△H = Q p进行计算的是( )A. 不做非体积功,始末压力相同但中间压力有变化的过程B. 不做非体积功,一直保持体积不变的过程C. 273.15K,101.325kPa下液态水结成冰的过程D. 恒容下加热实际气体4. 对实际气体的节流膨胀过程,有( )A. △H = 0B. △S = 0C. △G = 0D. △U = 05. 下列各式中哪个是化学势?( )A. (∂H/∂n B)T,p,n BB. (∂A/∂n B)T,p,n BC. (∂G/∂n B)T,p,n BD. (∂U/∂n B)T,p,n B6. 298K时A和B两种气体在某一溶剂中溶解的享利系数分别为k A和k B,且知k A>k B,则当A和B压力相同时,在该溶剂中所溶解的量是( )A. A的量大于B的量B. A的量小于B的量C. A的量等于B的量 C. A的量与B的量无法比较7. NH4HS(s) 和任意量的NH3(g) 及H2S(g) 达平衡时有( )A. C = 2,P = 2,F = 2;B. C = 1,P = 2,F = 1;C. C = 2,P = 3,F = 2;D. C = 3,P = 2,F = 3;8. 下列纯物两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B.熔点将随压力增加而升高C.蒸气压将随温度升高而加大D.升华温度将随压力增大而升高9. 在一定的温度下,一定量的 PCl 5(g) 在一密闭容器中达到分解平衡。
05-09年华南理工大学分析化学考研试题[1]
![05-09年华南理工大学分析化学考研试题[1]](https://img.taocdn.com/s3/m/2190aa1810a6f524ccbf857e.png)
第
1 页
C. m=0.01mg,%E=99.9 ; D. m=0.03mg,%E=95 10、下列选择参比溶液的原则,哪个是不正确的? A. 若仅为待测物有吸收,可选用纯溶剂; B. 若待测物、显色剂等有吸收,可选用不加待测液而其它试剂都加的空白溶液; C. 若待测物、显色剂、缓冲剂等都有吸收,可选择它们都加的空白溶液; D. 若待测物、显色剂、缓冲剂等都无色,可选用蒸馏水做参比。 11、可以减小随机误差的方法是: A. 对仪器进行校准; B. 做空白试验; C. 增加平行测定次数; D. 做对照试验。 12、为提高 A、B 两组分的分离度,可采用增加柱长的方法,若分离度增加一倍,柱 长应为原来的: A. 两倍; B. 四倍; C. 六倍; D. 八倍。 13、用离子选择电极采用标准加入法进行定量分析时,加入的标准溶液要求: A. 体积要小,其浓度要高; B. 体积要小,其浓度要低; C. 体积要大,其浓度要高; D. 体积要大,其浓度要低。 14、使用朗伯——比耳定律的前提条件之一为入射光必须是: A. 复合光; B. 平行单色光; C. 可见光; D. 紫外光。 15、用 HCl 滴定 Na2CO3 时,第一理论终点[H+]的计算式为: A. C.
第
4
页
14、F 检验法,若两组数据有显著性差异则 F 计 F 表。F 检验计算式是:F 计= 。 15、在分光光度计中,常因波长范围不同而选用不同材料的容器,现有下面三种材料 的容器,各适用于哪个光区: A. 石英比色皿用于 ;B. 玻璃比色皿用于 ; C. 氯化钠窗片吸收池用于 。 16、 如用 KHC8H4O4 测定 NaOH 溶液的准确浓度, 这种确定浓度的操作, 称为______。 而此处 KHC8H4O4 称为 物质。 17、一般常量滴定分析的误差要求为+0.1%,一般滴定时的浓度也不低于 0.010mol/L。 则 EDTA 配位滴定中滴定反应的实际条件常数至少应为 。 18、在 Na2C2O4 标定 KMnO4 时,由于反应速度不够快,因此滴定时溶液要维持足够 酸度和温度,但酸度和温度过高时,又会发生 。 19、欲配制 250mL 0.008000mol/L K2Cr2O7 溶液,应称取 K2Cr2O7(其摩尔质量为 克。 294.19g/mol) 20、以正确的有效数字表示下列计算结果 0.1000 × (25.00 − 24.90) × 246.47 w(x) = × 100% 1.000 × 1000 = 21、某饮用水中含有痕量 Cu2+,取水样 1000 mL,让其通过阳离子交换树脂,然后用 5mL HCl 完 全 洗 脱 , 经测 定 此 方 法 的 回收 率 为 98%, 此 方 法 的富 集 倍数 是 。 22、正态分布函数中的两个参数分别为 和_____。 (共 五、计算题: 共 9 题,总 60 分) 计算题: ( 1、在 20.0 mL 0.150 mol/L FeCl3 的盐酸溶液中加入 10.0 mL 乙醚,一起振荡。水相中 剩余的 Fe(III)用络合滴定法测定,耗去 0.0200 mol/L EDTA 10.0 mL。问铁的萃取 率和分配比分别为多大?(5 分) 2、有一 KMnO4 标准溶液,已知其浓度为 0.1025mol/L,求其 TFe/KMnO4 和 TFe3O4/KMnO4。 如果称取试样 0.2508g,溶解后将溶液中的 Fe3+还原成 Fe2+,然后用 KMnO4 标准 溶液滴定,用去 25.33mL,求试样中含铁量,分别以%Fe 和%Fe3O4 表示之。已知: MFe=55.85,MFe3O4=231.54。 分) (8 3、计算在 1mol/L HCl 介质中用 Fe3+滴定 Sn2+的反应平衡常数及滴定至化学计量点 时的电势。已知: E 0 Fe 3+ / Fe 2 + = 0.68V
华南理工大学《物理化学》64-1试卷

华南理工大学《物理化学》64-1试卷华南理工大学《物理化学》64-1试卷专业________ 班级编号______ 姓名分数一、选择题( 共10题, 15分)1. 下列的过程可应用公式△H = Q进行计算的是( ) (2分)A. 不做非体积功,始末态压力相同但中间压力有变化的过程B. 不做非体积功,一直保持体积不变的过程C. 273.15K,pθ下液态水结成冰的过程D. 恒容下加热实际气体2. 苯和甲苯在恒温恒压条件下混合形成理想液体混合物,其△mix S ( ) (1分)A. >0B. <0C. =0D. ≠03.N2(g)、O2(g)系统中加入一种固体催化剂,可生成一种气态氮氧化物,则系统的自由度为( ) (2分)A. A. 1B. 2C. 3D. 44. 纯水的表面张力为γ1,某溶质的表面张力为γ2 ,且γ2> γ1,制成水溶液后,溶质的表面浓度为c s,本体浓度为c,则( ) (2分)A. c s> cB. c s< cC. c s= cD. c s= 05. 在400 K时,液体A和B的蒸气压分别为40 kPa和60 kPa,两者组成理想液体混合物。
当气-液平衡时,溶液中A的摩尔分数为0.6,则在气相中B的摩尔分数应为( ) (2分)(A) 0.31 B. 0.40 C. 0.50 D. 0.606. 电解CuSO4溶液时,当通过溶液的电量为2F时,则在阴极上将析出Cu的量为( ) (1分)(A) 0.5 mol B. 1 mol C. 1.5 mol D. 2 mol7. 同外压恒温下,微小液滴的蒸气压比平面液体的蒸气压:( ) (1分)(A) 大 B. 一样 C. 小 D. 不定8. 在相图上,当系统处于下列哪一点时只存在一个相? ( ) (1分)(A) 恒沸点 B. 熔点 C. 临界点 D. 低共熔点9.反应A → 2B在温度T时的速率方程为d c B / d t = k B c A,则此反应的半衰期为:A.ln2/k B B.21n2/k B C.k B ln2 D.2k B ln210.下列哪一种不属胶系统统的电动现象? ( ) (1分)A.电导B.电泳C.电渗D.沉降电位二、填空题( 共6题,10分)1. 1.稀溶液的依数性计算公式有__________, __________, __________, __________。
2003年华南理工大学 《物理化学》考研试题及参考答案(理工)

华南理工大学2003攻读硕士学位研究生入学考试试卷物理化学部分(与化工原理合一门课程)(试题已由葛华才老师整理求解,有错请告知!)1. 1mol 水在100℃、101.325kPa下正常气化, 已知水的正常蒸发焓为40.64 kJ . mol-1,求此过程的Q、W、∆U、∆H、∆S、∆G。
(15分)解:Q=∆H=n∆Vap H m= 1mol×40.64 kJ . mol-1= 40.64kJ (注:若题目未给出蒸发焓,可以不算出数值)∆S= ∆H/T= 40.64kJ/373.15K= 108.9J . K-1(可逆相变过程)∆G=0W= -p[V(g)-V(l)]≈-pV(g) = -nRT= -1mol×8.3145J . K-1 . mol-1×373.15K=-3103J∆U=Q+W= 40.64kJ-3103J = 37.54kJ2. 已知反应2NaHCO3(s) = Na2CO3(s) + H2O(g) + CO2(g)温度为50℃、100℃时系统的平衡总压分别为3950Pa、96300Pa。
设反应的∆r H m与温度无关,试求:(1) 计算50℃时该反应的K、∆r G m。
(2) 计算该反应的∆r H m。
(3) 计算NaHCO3(s)的分解温度。
(15分)解:(1) 设平衡总压为p,则2NaHCO3(s)= Na2CO3(s) + H2O(g) + CO2(g)平衡p/2 p/2K=p[H2O(g)] p [CO2(g)]/ p2 = (p / p)2/4 =(3950Pa/Pa)2/4=0.∆r G m= -RT ln K= -8.3145J . K-1 . mol-1×323.15K×ln(0.)= 21089 J . mol-1(2) T’=373.15K时,K‘= (p’ / p)2/4 =(96300Pa/Pa)2/4=0.2318∆r H m= [RT’T/(T’-T)]ln(K’/ K)=[8.3145J . K-1 . mol-1×373.15K×323.15K/(373.15K-323.15K)]×ln(0.2318/0.)=J . mol-1=128.1 kJ . mol-1(3) 若分解温度即为平衡总压p =Pa 时对应的温度T”,此时 K“= (p ”/ p )2/4 =(Pa/Pa)2/4=0.2567利用等压方程ln (K ”/ K ) = (∆r H m / R )(1/T -1/T”)即 ln(0.2567/0.)=(kJ . mol -1/8.3145J . K -1 . mol -1)(1/323.15K -1/T ”) T ”= 374.06K3.硫酸在常压下与水可形成3种水合物,其相图如右。
历年华南理工大学629物理化学(一)考研真题试卷与真题答案

历年华南理工大学629物理化学(一)考研真题试卷与真题答案历年华南理工大学629物理化学(一)考研真题试卷与真题答案一、考试解读:part 1 学院专业考试概况:①学院专业分析:含学院基本概况、考研专业课科目:629物理化学(一)的考试情况;②科目对应专业历年录取统计表:含华工相关专业的历年录取人数与分数线情况;③历年考研真题特点:含华南理工大学考研专业课629物理化学(一)各部分的命题规律及出题风格。
part 2 历年题型分析及对应解题技巧:根据华工629物理化学(一)考试科目的考试题型(计算题、简答题等),分析对应各类型题目的具体解题技巧,帮助考生提高针对性,提升答题效率,充分把握关键得分点。
part 3 近年真题分析:最新真题是华工考研中最为珍贵的参考资料,针对最新一年的华南理工大学考研真题试卷展开深入剖析,帮助考生有的放矢,把握真题所考察的最新动向与考试侧重点,以便做好更具针对性的复习准备工作。
part 4 2020考试展望:根据上述相关知识点及真题试卷的针对性分析,提高2020考生的备考与应试前瞻性,令考生心中有数,直抵华工考研的核心要旨。
part 5 华南理工大学考试大纲:①复习教材罗列(官方指定或重点推荐+拓展书目):不放过任何一个课内、课外知识点。
②官方指定或重点教材的大纲解读:官方没有考试大纲,高分学长学姐为你详细梳理。
③拓展书目说明及复习策略:专业课高分,需要的不仅是参透指定教材的基本功,还应加强课外延展与提升。
part 6 专业课高分备考策略:①考研前期的准备;②复习备考期间的准备与注意事项;③考场注意事项。
part 7 章节考点分布表:罗列华工考研专业课试卷中,近年试卷考点分布的具体情况,方便考生知晓华工考研专业课试卷的侧重点与知识点分布,有助于考生更具针对性地复习、强化,快准狠地把握高分阵地。
二、华南理工历年考研真题与部分答案:2000年华南理工大学物理化学考研真题试卷2001年华南理工大学物理化学考研真题试卷2002年华南理工大学物理化学考研真题试卷2003年华南理工大学329物理化学(一)考研真题试卷2004年华南理工大学329物理化学(一)考研真题试卷2005年华南理工大学329物理化学(一)考研真题试卷2006年华南理工大学329物理化学(一)考研真题试卷2007年华南理工大学329物理化学(一)考研真题试卷2008年华南理工大学629物理化学(一)考研真题试卷2009年华南理工大学629物理化学(一)考研真题试卷2010年华南理工大学629物理化学(一)考研真题试卷2011年华南理工大学629物理化学(一)考研真题试卷2012年华南理工大学629物理化学(一)考研真题试卷2013年华南理工大学629物理化学(一)考研真题试卷2014年华南理工大学629物理化学(一)考研真题试卷2015年华南理工大学629物理化学(一)考研真题试卷2016年华南理工大学629物理化学(一)考研真题试卷2017年华南理工大学629物理化学(一)考研真题试卷2018年华南理工大学629物理化学(一)考研真题试卷2000年华南理工大学物理化学考研真题答案解析2001年华南理工大学物理化学考研真题答案解析2002年华南理工大学329物理化学(一)考研真题答案解析2003年华南理工大学329物理化学(一)考研真题答案解析2004年华南理工大学329物理化学(一)考研真题答案解析2005年华南理工大学329物理化学(一)考研真题答案解析2006年华南理工大学329物理化学(一)考研真题答案解析2007年华南理工大学329物理化学(一)考研真题答案解析2008年华南理工大学629物理化学(一)考研真题答案解析2009年华南理工大学629物理化学(一)考研真题答案解析2010年华南理工大学629物理化学(一)考研真题答案解析2011年华南理工大学629物理化学(一)考研真题答案解析2012年华南理工大学629物理化学(一)考研真题答案解析2013年华南理工大学629物理化学(一)考研真题答案解析2014年华南理工大学629物理化学(一)考研真题答案解析2015年华南理工大学629物理化学(一)考研真题答案解析2016年华南理工大学629物理化学(一)考研真题答案解析2017年华南理工大学629物理化学(一)考研真题答案解析此真题试卷与真题答案摘自致远华工考研网。
华南理工大学 物理化学考研试题及参考答案

华南理工大学2001年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试后本卷与答题纸一同交回)科目名称:物理化学(含物理化学实验)适用专业:化学工程、化学工艺、工业催化、环境工程1. C6H6在100kPa时的熔点为5℃,摩尔熔化焓为9916J·mol-1,C p,m(l)=126.8J·K-1·mol-1,C p,m(s)=122.6J·K-1·mol-1。
求100kPa、–5℃下1 mol过冷C6H6凝固成固态C6H6的Q、△U、△H、△S、△A、△G,假设凝固过程的体积功可以忽略不计。
(12分)解:涉及过程如下:∆H= ∆H1+ ∆H2+ ∆H3= C p,m(l)(T’-T) +∆H2+C p,m(s)(T-T’)=9916 J·mol-1+(122.6-126.8)×(268-278) J·mol-1= 9958 J·mol-1恒压Q= ∆H= 9958 J·mol-1∆U= ∆H- ∆pV ≈∆H=9958 J·mol-1∆S= ∆S1+ ∆S2+ ∆S3= C p,m(l)ln(T’/T) +∆H2/T’+C p,m(s)ln(T/T’)= ∆H2/T’+[C p,m(s)-C p,m(s)]ln(T/T’)=9916 J·mol-1/278K+(122.6-126.8)ln(268/278) J·K-1·mol-1= 35.8 J·K-1·mol-1∆G≈∆A= ∆H- T∆S = 9958 J·mol-1-268K×35.8 J·K-1·mol-1 = 363.6 J·mol-12. 卫生部规定汞蒸气在1m3空气中的最高允许含量为0.01mg。
已知汞在20℃的饱和蒸气压为0.160Pa,摩尔蒸气发焓为60.7kJ·mol-1(设为常数)。
华南理工大学2005年考研电介质物理学试题

2.写出下列参数的定义式:(20分,每空2分)
⑴电子极化率e为_____________________。
⑵克劳休斯-莫索缔方程:_________________________。
⑶热离子极化建立过程的弛豫时间为_________________。
⑵平行板电容器充电以后,极板上的电荷面密度σ0=1.77×10-6库/米2,将两极板电源断开后,填入εr=8的电介质。计算在电场作用下真空和电介质中的E、P、D各为多少?(12分)
⑶画出在均匀电场E0中,放入电介质球体后,电介质内外的E线和D线。(6分)
⑸详细分析气体介质的碰撞电离理论。解释气体介质发生自持放电的条件。(18分)
⑹如何判断晶体是具有自发极化的铁电晶体?在钛酸钡和钛酸钙晶体中,哪一种晶体具有导致自发极化的可能?哪种没有?为什么?(10分)
三、综合题(25分)
⑴试求出在标准状态下,He的相对介电系数。(已知He的极化率为αe=0.22×10-40法·米2)(7分)
⑶由异号离子组成的晶体,在电场作用下,正、负离子发生相对位移而产生了感应电矩,这种极化称为_____________。极性电介质的分子具有固有电矩,在电场作用下,固有电矩沿电场方向的转向而产生的极化,称为____________。
⑷介质中自由载流子的移动,可以被缺陷和不同介质的分界面所俘获,形成空间电荷的__________,使得介质中电荷分布不均匀,从而产生_________,称之为_____________________。
⑺弗伦克尔缺陷和肖特基缺陷在晶体中的浓度分别是:___________________和_____________________。
华南理工大学本科生物理化学考试题目

02 本四物理化学上册期末考试试卷2005 年9 月25 日一、单项选择题(本题48 分,共24 题)1. 在恒温恒压下,反应体系的自由能变与反应进度的关系式是:( )(A) ΔG=( . G/ . ξ)T,p;(B) ΔG=( . H/. n)T,p;(C) ΔG=( ξ/p) . . T,p;(D) ΔG=( . H/. ξ)T,p。
2. 水的三相点为:( )(A) 101325Pa,273.15K;(B) 101325Pa,273.16K;(C) 610Pa,273.15K;(D) 610Pa,273.16K。
3. 二元理想液态混合物,其沸点之间的关系为T b*(A)>T b*(B),当气液达到平衡时,蒸汽压为p,则有:( )(A) p=p A*+p B*;(B) p<p A,p>p B;(C) p>p A,p<p B;(D)无法确定它们之间的关系。
4. 把一块冰放在热容为20J/K 的玻璃容器内,若把容器中空气和冰作为体系,则该体系为: ( )(A)敞开体系; (B)封闭体系; (C)孤立体系; (D)绝热体系。
5. 下列关于卡诺热机的效率η的叙述中正确的是:( )(A)两热源的温差越大,η越大;(B)低温热源的温度越低,η越小;(C)两热源的温差越小,越大;(D)高温热源的温度越高,η越小。
6. 克拉佩龙方程中的ΔH m代表的意义是:( )(A) 代表摩尔蒸发热;(B) 摩尔升华热;(C) 摩尔凝聚热;(D) 以上相变热都适用。
7. 在298K 时,要从浓度为m 的大量氨溶液(氨的平衡蒸气压是0.03atm)中分离出1mol、1atm 下的氨气,则至少需做非体积功为:(A)8687J (B)2477.6J (C)10713.6J (D)5758.4J8. 下列叙述中,违背卡诺原理的是:( )(A)提高热机效率的方法是增大温度差;(B)由它可以引出不等式Q1/T1+Q2/T2< 0;(C)卡诺热机效率与工作物质无关;(D)可逆循环的热温商之和等于零。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
葛华才整理并解答.
2005 年《物理化学》(二) 参考答案
△U1=△H1△pV=△H1△nRT=44.01kJ.mol11×8.315×298 J.mol 1=41.53kJ.mol 1 4. (1)请简要回答胶体系统的主要特征是什么 ? 胶体系统能在一定程度上稳定存在的主要 原因是什么?(6 分) (2) 反应 Ba(SCN)2+K2SO4→2KSCN+BaSO4,在 K2SO4 稍过量的情况下, 生成 BaSO4 溶胶, 试写出 BaSO4 溶胶的胶团结构表示式。(4 分) 解答:(1) 主要特征:高度分散,多相,热力学上的不稳定系统。胶体系统能够稳定存在的主 要原因与胶粒带电有关。 (2) K2SO4 为稳定剂,胶团结构为 [(BaSO4)m nSO42 . (2nx)K+]x . xK+ 或 [(BaSO4)m nSO42 . 2(nx)K+]2x . 2xK+
= cBRT=(0.1976×1000×8.315×298.2)Pa=4.90×105Pa
(3) 已知水在 100℃时的蒸气压 pA=101.325Pa,求 25℃时的蒸气压 p,利用克克方程 ln(p/101.325kPa)= (40670/8.315)(1/298.151/373.15)
1 H2O(l, 1 mol, 298K, p )
ΔH
H2O(g, 1 mol, 298K, p=101325Pa) ↑△H4
↓△H2
ΔH
3 H2O(l, 1 mol, 298K, p*) H2O(g, 1 mol, 298K, p*=3168Pa )
忽略压力对液体的影响:△H2≈0,△S2≈0, 平衡相变过程:△H3 =44.01kJ.mol 1 △S3=△H3/T=44.01kJ.mol 1/298K=147.7 J. K1.mol 1 气相变压过程:△H4 =0 △S4= Rln( p/p*)=[8.315×ln(101325/3168)] J. K1.mol 1=28.81 J. K1.mol 1 因此 △H1=△H2+△H3+△H4=(0+44.01+0) kJ.mol 1= 44.01kJ .mol 1 △S1=△S2+△S3+△S4=(0+147.728.81) J. K1.mol 1= 118.9J. K1.mol 1 △G1=△H1T△S1=(44.010.298×118.9) kJ.mol 1=8.578 kJ.mol 1
华南理工大学 2005 年攻读硕士学位研究生入学考试试卷
(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回) 科目名称:物理化学(二) 适用专业:材料物理与化学 材料学 环境工程 化学工程 化学工艺 生物化工 应用化学 工业催化 能源环境材料及技术 生物医学工程 说明:题目有个别改动并标准化。答案有错时请告知葛华才老师:ge1963@
ΔrG m =ΔrH m TΔrS m = (44.130.298×128.51) kJ . mol1 = 5.834kJ . mol 1
K=exp(ΔrG m /RT)=exp(5834/(8.315×298))=0.09495
(2) ΔrG m =ΔrH m TΔrS m = (44.130.500×128.51) kJ . mol 1 = 20.125kJ . mol 1
K=exp(ΔrG m /RT)=exp(20125/(8.315×500))=126.6
(3) ΔrG m =ΔrH m TΔrS m =0
T=ΔrH m ΔrS m =(44130/128.51)K=343.4K
3.已知水在 25℃时的饱和蒸气压为 3168Pa,摩尔汽化焓为 44.01kJ.mol 1,现有 1mol 水 在 25℃、101325Pa 下变为同温同压的水蒸气。计算此过程ΔH,ΔU,ΔS,ΔG(设水蒸气可视 为理想气体;对于凝聚系统而言,无相变情况下,压力变化对 H,U,S,G 的影响可忽略不 计)。(15 分) 解:设计如下过程:(非平衡相变过程通常设计成与一个平衡相变过程相关的路径)
C2H5OH(l)
ΔfH m /(kJ . mol 1)
C2H4(g) 52.26 219.6
H2O(l) 285.83 69.91
277.7 161
Sm /(J . mol 1 . K 1)
假设ΔrH m ,ΔrS m 不随温度而衡常数 K。
1. 在 25℃、1kg 纯水中,溶解不挥发性溶质 B 22.2g,构成一稀溶液,B 在水中不电离, 此溶液的密度为 1010 kg . m3。已知 B 的摩尔质量为 111.0g . mol 1,水的沸点升高常数 Kb 为 0.52K . mol 1 . Kg,纯水在正常沸点 100℃时摩尔汽化焓为 40.67kJ . mol 1,可视为一常数。求: (1) 此稀溶液的沸点升高值。 (2) 此稀溶液 25℃时的渗透压。 (3) 此稀溶液 25℃时的饱和蒸气压。(15 分) 解:(1) bB=(22.2/111.0)mol . kg1= 0.200mol . kg1 Tb=KbbB =0.52×0.200K=0.104K (2) cB=(22.2/111.0)mol/(1022.2g/1010 g . dm3)=0.1976mol . dm3
~1~
(3) 反应的转折温度。(15 分)
=(52.26285.83+277.7) kJ . mol 1= 44.13kJ . mol 1 解:(1) ΔrH m
ΔrS m =(219.6+69.91161) J . mol1 . K 1 =128.51 J . mol 1 . K 1
p=3.747kPa pA= pA* xA =3.747kPa×(1000/18.02)/(1000/18.02+22.2/111.0)=3.734kPa
2. 乙醇脱水可制备乙烯,其反应为:C2H5OH(l)= C2H4(g)+H2O(l),已知各物质 298K 时
的 ΔfH m ,S m 如下:
