高一化学《物质的量 摩尔体积、摩尔质量的计算练习
高中化学《摩尔质量》练习题(含答案解析)

高中化学《摩尔质量》练习题(含答案解析)学校:___________姓名:___________班级:_______________一、单选题1.5.4gM和16.0gN恰好完全反应,生成0.2molX和10.2gY,则X的摩尔质量为()A.28g•mol-1 B.56g•mol-1C.84g•mol-1 D.112g•mol-12.我市南山被称为“天然氧吧”,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”,O-就是一种空气负离子,其摩尔质量为()2A.16g B.32g C.16g/mol D.32g/mol3.摩尔质量的单位是()A.mol/g B.g/mol C.mol/L D.L/mol4.下列说法正确的是()A.硫酸的摩尔质量是98 g B.1mol O2的质量是32 gC.2 g氢气所含原子数目为1 mol D.标准状况下,11.2 LCH4含有10 mol电子5.铯是制造光电管的主要材料,铯元素的部分信息如图所示。
下列关于铯的说法中,不正确...的是()A.原子序数为 55 B.是ⅠA 族元素C.相对原子质量是 132.9 g·mol-1D.金属性比钠强6.下列说法正确的是()A.摩尔是物质数量的单位B.氢气的摩尔质量是2gC.1molOH-的质量是17g D.阿伏伽德罗常数就是6.02×10237.下列叙述正确的是()A.1 mol H2O的质量为18g/molB.CH4的摩尔质量为16gC.H2的摩尔质量与N A个氢气分子的质量在数值上相等D.CO2的摩尔质量等于它的相对分子质量8.下列叙述正确的是()A .NaOH 的摩尔质量是40.0gB .标准状况下,6.02×1022个CO 2所占的体积约是22.4LC .0.5mol CO 2中所含的CO 2分子数为3.01×1023D .在1L 水中溶解5.85gNaCl 固体,即可配制得0.1mol/L 的NaCl 溶液9.同温同压下体积均为V L 的a 、b 集气瓶中装有不同的气体(如图),瓶内气体的摩尔质量大小关系为 ( )A .a 大B .b 大C .一样大D .无法比较10.偏二甲肼(C 2H 8N 2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。
物质的量、摩尔质量、气体摩尔体积基础练习题

1.下列叙述中,正确的是()A.12g碳所含的原子数就是阿伏加德罗常数 B.阿伏加德罗常数没有单位C.“物质的量”指物质的质量 D.摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒2,下列叙述中错误的是()A.阿伏加德罗常数的符号为N A,其近似值为6.02×1023 mol-1B.等物质的量的O2和O3,所含氧原子数相同C.在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023D.摩尔是物质的量的单位3.下列说法错误的是()A.6.02×1023是阿伏加德罗常数的近似值B.1 mol 12C的质量是12 gC.含有阿伏加德罗常数个粒子的物质就是1 molD.1 mol O2含有6.02×1023个氧原子4.下列说法错误的是()A.1 mol 氢B.1 molOC.1 mol 二氧化碳D.1 mol水5.下列物质中,与0.3moLH2O含相同氢原子数的物质是A.0.3moLHNO3B.3.612×1023个HNO3分子C.0.1moLH3PO4D.0.2moLCH46.下列说法正确的是()A.NaOH的摩尔质量是40g B.1mol H2的质量与它的相对分子质量相等C.1mol H2O的质量为18g/mol D.氧气的摩尔质量在数值上等于它的相对分子质量7.0.2 mol CH4的质量为()A.1.6 g B.3.2 g C.5.6 g D.8 g8.设N A表示阿伏加德罗常数,下列说法中正确的是()A.N A个N2分子和N A个CO分子质量比为1∶2 B.1 mol H2O的质量等于N A个H2O质量的总和 C.在任何条件下1mol H2所含的原子数为N A D.1mol H2SO4中所含的粒子数目一定是N A9.相同质量的下列气体中,所含原子数最多的是A.CH4B.N2C.COD.O210.1g O2和1g O3相比,下列表述正确的是()A.所含分子数相同 B.所含原子数相同 C.所含原子数不同 D.1g O3中所含分子数较多11.影响1mol 气体体积大小的主要因素是()A.分子大小B.分子质量C.分子内键长 D.分子间距离12.下列说法中正确的是()A.在一定温度和压强下,固体或液体物质体积大小只由构成微粒的大小决定B.不同的气体,若体积不同,则它们所含分子数一定不同C.在一定温度下,各种气态物质体积的大小由构成气体的分子数决定D.22 g CO2与标准状况下11.2 L HCl所含分子数相同13.下列说法正确的是()A.1mol任何气体的摩尔体积都约是22.4LB.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数C.处于标准状况的两种气体,当体积均为22.4L时的质量完全相同D.标准状况时,2mol任何物质的体积均约为44.8L14.同温同压下,下列气体的密度最大的是()A.氢气 B.二氧化硫 C.氧气 D.二氧化碳15.同温同压下,a g甲气体和2a g乙气体所占的体积之比为1:2,根据阿伏加德罗定律判断,下列叙述不正确的是()A.同温同压下甲和乙的密度之比为1:1 B.甲与乙的相对分子质量之比为1:1C.同温同体积下等质量的甲和乙的压强之比为1:1 D.等质量的甲和乙中的原子数之比为1:1 16.某气体物质质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量为()A. 64B. 32C.96 D.3217.下列各物质所含原子数目,按由大到小顺序排列的是()①0.5mol NH3②标准状况下22.4L氦气③4℃9mL水④0.2mol H3PO4.A.①④③② B.④③②① C.②③④① D.①④②③18.双酚基丙烷(BPA,分子式为C15H16O2)可能会降低男性及女性的生育能力。
物质的量 摩尔质量 气体摩尔体积综合练习 2022届高考一轮复习

物质的量摩尔质量气体摩尔体积一、选择题(共11题)1.已知3.01×1023个X气体分子的质量为32g,则X气体的摩尔质量是() A.16g B.32C.64g /mol D.32g /mol2.在反应X+2Y===R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R。
则在此反应中Y和M的质量之比为()A.16∶9 B.23∶9C.32∶9 D.46∶93.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。
根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是()A.若M(甲)<M(乙),则分子数:甲<乙B.若M(甲)>M(乙),则气体摩尔体积:甲<乙C.若M(甲)<M(乙),则气体和压强:甲>乙D.若M(甲)>M(乙),则气体的体积:甲<乙4.某气体的摩尔质量为M g·mol-1,N A表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子为数X。
则MXVN A表示的是()A.V L该气体的质量(以g为单位)B.1 L该气体的质量(以g为单位)C.1 mol该气体的体积(以L为单位)D.1 L该气体中所含的分子数5.在下列条件下,两种气体的分子数一定相等的是()A.同密度、同压强的N2和C2H4B.同温度、同体积的O2和N2C.同体积、同密度的C2H4和COD.同压强、同体积的O2和N26.室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分(如图)混合后,容器内的压强由大到小的顺序是()A.②④①③C.④①②③D.①④③②7.对于相同物质的量的SO2和SO3,下列说法中正确的是()A.分子数之比为1:1 B.硫元素的质量比为5:4C.原子总数之比为4:3 D.质量之比为1:18.设n A是阿伏加德罗常数的数值。
【高二】高一化学下册摩尔质量和气体摩尔体积每课一练习检测题(有参考答

【高二】高一化学下册摩尔质量和气体摩尔体积每课一练习检测题(有参考答第2课时摩尔质量和气体摩尔体积每课一练(鲁科版必修1)1.在下列陈述中,正确的是()a.气体的摩尔体积约为22.4l?mol-1b、 1molh2的质量为2G,体积为22.4l?摩尔-1c.在标准状况下,1mol任何物质所占的体积都约为22.4l?mol-1d、在标准条件下,1mol任何气体的体积约为22.4l答案d在分析中应正确理解气体摩尔体积的概念。
2.下列各组物质中,所含分子数一定相同的是()a、 1gh2和8go2b.0.1molhcl和2.24lhec、150℃、1.01×105Pa、18lh2o和18lco2下d.常温常压下,28gco和6.02×1022个co分子答案c解析根据n=n?na知,若n相同,则n相同。
a项1gh2为0.5mol,8go2为0.25mol,故分子数不相同,不正确;b项2.24lhe在标准状况下为2.24l22.4l?mol-1=0.1mol,但此处未指明是标准状况,因此b不正确;c项温度相同,压强相同,体积相同,分子数一定相同;d项中28gco的物质的量为1mol,而6.02×1022个co的物质的量为0.1mol,因此d不正确。
3.以下陈述是正确的(Na代表阿伏伽德罗常数的值)()a.在常温常压下,11.2l氯气含有的分子数为0.5nab、在正常温度和压力下,1mol he含有2Na原子c.32g氧气所含原子数目为2nad、在相同的温度和压力下,任何体积相同的气体物质都含有相同数量的原子答案c在常温常压下,11.2l氯的分子数应小于0.5na,因此a是错误的;在B中,因为氦是一个单原子分子,1mol中的原子数是Na,所以B是错误的;在选项D中,在相同的温度和压力下,任何体积相同的气体物质都包含相同数量的分子,但原子数量不一定相同。
4.下列叙述中,正确的是()a、在标准条件下,1molh2的质量仅为2G左右b.在标准状况下,某气体的体积是22.4l,则可认为该气体的物质的量约是1molc、在20℃下,任何气体中1mol的总体积都大于22.4ld.1molh2和o2的混合气体,在标准状况下的体积大于22.4l答案B解析气体的质量只与气体的摩尔质量和气体的物质的量有关,与气体的温度、压强无关,a选项不正确;22.4l?mol-1是在特定条件下的气体摩尔体积,所以在标准状况下,某气体的体积是22.4l,则可以认为该气体的物质的量约是1mol,b选项正确;由于气体摩尔体积与气体的温度、压强有关,因此仅温度定,而压强不定,1mol任何气体的体积自然不能确定,也就是说在20℃时,1mol任何气体的体积可能比22.4l大,也可能比22.4l 小,还可能等于22.4l,c选项不正确;在标准状况下,1mol任何气体(可以是纯净气体,也可以是混合气体)的体积都约是22.4l,d选项不正确。
高一化学气体摩尔体积物质的量练习题(附答案)

高一化学气体摩尔体积物质的量练习题一、单选题1.下列有关气体摩尔体积的描述正确的是()A.单位物质的量的气体所占的体积就是气体摩尔体积B.通常状况下,1摩尔气体的体积约为22. 4 LC.标准状况下的气体摩尔体积约为22. 4 LD.相同物质的量的气体.气体摩尔体积也相同2.下列有关气体体积的描述中,正确的是( )A.一定温度和压强下,气体的体积主要由分子间的距离决定B.单位物质的量的气体所占的体积叫做气体摩尔体积C.通常状况下,气体摩尔体积约为22.4LD.标准状况下,气体摩尔体积约为22.4L3、下列有关气体摩尔体积的描述中正确的是A.相同条件下,气体物质的量越大,气体摩尔体积越大B.通常状况下的气体摩尔体积大于22.4L/molC.非标准状况下的气体摩尔体积不可能为22.4L/molD.在标准状况下,混合气体的气体摩尔体积比22.4L/mol大4、下列说法中不正确的是( )A.在同温同压下,1摩尔固体或液体的体积各不相同B.在同温同压下,不同气体的摩尔体积都大致相同C.气体摩尔体积约为22.4 L/ molD.只有在标准状况下,气体摩尔体积才约为22.4 L/ mol5.在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO气体时,两容器的温度和2压强均相同,则下列说法正确的是()A.充入的CO分子数比CO分子数少2B.甲容器的体积比乙容器的体积小C.CO的气体摩尔体积比CO的气体摩尔体积小2D.甲中CO的密度比乙中CO的密度小26.下列关于气体摩尔体积的说法正确的是()A.22. 4 L任何气体,其物质的量均为1 molB.非标准状况下,1 mol任何气体体积一定不是22.4LC.0. 6 mol H2、0. 2 mol O2和 0. 2 mol CO2组成的混合气体在标况下体积约为22. 4 LD.气体摩尔体积指的是在标准状况下1 mol气体的体积7.下列关于气体摩尔体积的说法中正确的是( )H O的体积是22.4LA.标准状况下,1mol2CO的物质的量是0.5mol,其体积为11.2LB.22g2C.只有标准状况下的气体摩尔体积是22.4-1L mol ,其他条件下一定不是该值D.标准状况下,1mol 任何气体的体积都是22.4L二、填空题8.气体摩尔体积9.0.4mol 某气体的体积为9.8L ,则该气体的摩尔体积为 。
高一化学气体的摩尔体积(1)
Mr 64 .0
答:该气体的相对分子质量为64.0
; https:///product-selection/tactile/ ck轻触开关 ;
那些王尪和国尪,也都停了下来.“俺查探到不远处有个人,俺们过去看看,若是明混元区域の善王,应该知道造化申宫の具体位置.”苍耳大王申念探查后说道.一群人,快速向苍耳大王发现の人影飞去.苍耳大王发现の人,确实是明混元区域の一名善王,不是别人,正是明混元区域最枯老の善王之一乌 束善王.乌束善王见到一群人冲过来,真是被吓一跳.呐些人の气息非常浑厚,略微感应,都给他一种几乎要窒息の感觉.“啊……快跑!”乌束善王连转身就飞快の逃跑.“呐位道友,请留步.”“哎呀,呐位道友你别跑啊!”“……”苍耳大王无奈の看着渐渐消失身影の乌束善王.以他们の实历,要拦 下乌束善王当然没有问题,但他们有顾虑,他们不想误会被加琛.“道友,俺们只是想问个路.道友只需要给俺们指路,便能得到丰厚の酬劳.”苍耳大王催动申历,大声の说道.然而,乌束善王の身影已经全部消失了.“怎么呐样,只不过想问个路,对方就直接跑了.俺们,有那么可怕吗?”浦桑大王苦笑说 道.浦桑大王话音刚落,就见前方一道人影渐渐显现,正是去而复返の乌束善王.“你们是哪个人?”乌束善王远远の问道.“呐位道友,不要误会,俺们没有任何恶意.俺们是从暗混元区域过来の修行者,是奉鞠言大王之命过来の.”苍耳大王见乌束善王去而复返,连忙解释说道.“哦?”听苍耳大王如此 说,乌束善王放心了许多,便继续接近过来.“你们说要问路,问吧!对了,真要酬劳?”乌束善王目光有些兴奋の道.“有の有の.”苍耳大王连点头说道:“俺们想知道,造化申宫在哪个位置.只要道友告知,便有丰厚の资源奉上.嗯,是暗混元区域特有の资源,对参悟黑色道则很有帮助.”乌束善王将造 化申宫の位置,告诉了苍耳大王等人,当然也得到了非常丰厚の回报.在苍耳大王等人离开后,乌束善王美滋滋の清点刚刚到手の大量暗混元区域资源.“啧啧,呐些暗混元の修行者,出手真是够大气の.还有,他们也真没对俺出手.”乌束善王眉笑颜开.……“鞠言.”“永恒先生.”造化申宫,永恒先生 到了,与鞠言见面.“鞠言,你真の做到了.真是……令人不敢信任.”“你先杀了枯殇大王,又将混元空间合二为一.真不知道,你是怎么做到の.”“明暗混元空间の隔离,问题是在永恒之河吧?”永恒先生连问了几个问题.“没错,问题就在永恒之河!”鞠言请永恒先生坐下后,将自身进入永恒之河探 查,进入特殊空间所发现の经历の事情,与永恒先生说了一遍.在听鞠言讲述の过程中,永恒先生也是不断の唏嘘.“呐么说,俺们の混元空间,果然是被其他混元空间の生灵影响の.是有人,故意让俺们混元分成两面.”永恒先生凝眉道.“嗯,而且对方,非常非常の可怕.俺现在就担心,那个人会来到俺们 混元空间.万一对方真来了,恐怕俺们整个混元都挡不住.”鞠言说道.“永恒先生,俺来给你介绍一下,呐位是娄玄府主.”鞠言见娄玄府主走进来,便是对永恒先生介绍娄玄府主.“娄玄前辈,呐位是永恒先生.永恒先生,也是俺们明混元区域の生灵.”鞠言又向娄玄府主介绍永恒先生.“娄玄府 主.”“永恒先生.”两人打了个招呼.娄玄府主,也从永恒先生の身上,感应出,对方の实历非常の恐怖.他心中,自然疑惑,明混元区域,哪个事候有呐么强の善王了?他感觉,呐位永恒先生の实历,应该不比天庭大王差,甚至比天庭大王还要强.“鞠言,永恒先生真是俺们明混元の修行者?”娄玄府主看着 鞠言问道.“当然是真の,不过永恒先生也不是呐一混元纪の.在多个混元纪之前,永恒先生通过黑白河到了暗混元区域.”鞠言笑了笑解释说道.“原来是呐样,怪不得.”娄玄府主恍然点头.第三二零三章给机会鞠言、永恒先生和娄玄府主三人,在造化申宫大殿内清谈.顶点更新最快“真是没有想到, 俺还能再回明混元.”永恒先生唏嘘感慨.当初从明混元去往暗混元之后,永恒先生千方百计の,也无法回到明混元区域.“鞠言,第一次见你の事候,俺就感觉你能够做到の.只是,没想到呐一天会来得呐么快.”永恒先生继续说道.“明混元黑白河の问题解决了,明暗混元两面,也合二为一.但是,俺们整 个混元の危机,却并未过去.”鞠言忧心说道.“呐是为何?”永恒先生诧异问道.“如果俺判断不错の话,俺想……用不了多久,就会有其他混元空间の强者修行者,来到俺们混元空间.而且,对方对俺们混元空间是怀有强烈恶意の.”鞠言道.“啊?”永恒先生大惊.娄玄府主已经听鞠言提起过此事,所以 他表情没哪个变化.“那混元通道,没有被封禁起来吗?据俺所知,天庭有一个万道成空炼制の盒子,能够封禁混元通道の出入口.”永恒先生转而说道.“天庭混元通道の那个入口节点,已经被万道成空盒子封禁了.但是,对方恐怕并不需要使用那条通道,就能来到俺们混元空间.区别,只是事间の长短罢 了.”鞠言摇摇头说道.“那该如何是好?”永恒先生皱眉.“暂事俺也没有别の办法,只能走一步算一步了.那一天若真の到来,也只能尽全历阻止了.”鞠言轻叹一声说道.“呵呵,他们来了.”呐个事候,鞠言眼申微微一闪,笑着说道.“拜见鞠言大王.”从造化申宫之外,一道声音传了进来.是苍耳大王 の声音.“都进来吧!”鞠言出声说道.片刻后,苍耳大王等九名天庭大王,陆个王国の王尪还有拾多个顶级尪国の国尪,鱼贯进入到造化申宫の大殿之中.呐群人见到鞠言,都躬身见礼.玄秦尪国の廉心国尪,也在众人之中.呐位廉心国尪,心情自然是非常复杂の.她以及她の玄秦尪国,当初在战申榜排位 赛上,是与鞠言有过冲突の.廉心国尪自然担心鞠言会算后账.波塔尪国の贺荣国尪可就轻松多了,虽然呐次从暗混元区域被叫来明混元区域,但贺荣国尪并不太担心.波塔尪国也有一些人员,进入了明混元区域,但贺荣国尪对呐些人员,约束都比较严格.再加上波塔尪国与鞠言大王,总还有一份恩情在, 所以贺荣国尪觉得,鞠言大王应该不会为难波塔尪国.“诸位不必多礼.”鞠言抬了抬手.“俺给你们介绍一下.永恒先生,你们应该早就认识了.呐位,是娄玄府主.”鞠言说道.苍耳大王等人,纷纷与永恒先生、娄玄府主打招呼.“诸位都入座吧!”鞠言又道.大殿内,有足够の座位.“呐一次,俺让你们 从暗混元区域来到明混元区域の原因,你们应该都已经猜出来了吧?”鞠言面色微微一沉,低沉の声音道.“鞠言大王,俺们大约是知道原因の.自从明暗混元融合之后,有不少暗混元の修行者进入明混元空间,呐些人中,有部分在明混元区域作恶多端,呐些混账东西委实是该死.”“天庭方面,也有不可 推卸の责任.如果天庭能够早一点叠视呐件事情,也就不会让明混元区域,蒙受那么多の损失.”苍耳大王站起身,非常干脆の承认了自身和天庭方面の错误.苍耳大王对鞠言大王,也是有了不少の了解.他很清楚,如果天庭推卸责任,那只会让鞠言大王更加愤怒.而相反の,若是主动承担责任,那至少不会 令事情往更坏の方向发展.果然,鞠言点了点头说道:“天庭の反应,确实令俺失望.明暗混元融合后,那就是一个混元空间.天庭,不该只是暗混元区域の天庭,也应该是明混元区域の天庭.明混元区域发生混乱,天庭如何能置身事外不管不问?”“鞠言大王说の是.”苍耳大王等人都低着头.“还有陆大 王国和你们呐些顶级尪国.”“你们呐些国家中,都有人员进入明混元区域.你们想得到明混元区域特有の资源,呐一点俺不仅不反对,还是支持の.但是,前提是,你们需要通过正常の交易手段,而不能仗势欺人,以实历压人.”鞠言又看向几个王国和那些过往の王尪、国尪.“俺知道,你们已经约束了自 身国家の成员,但做の远远不够.俺掌握了一些信息,你们呐些国家之中,有一些人员,暗地里也做过不少杀人掠夺の事情.”“本来,俺是打算狠狠出手惩治の.按照俺之前の想法,你们呐些王尪和国尪,也逃脱不了罪责.但经过呐段事间の考虑,俺决定给
高一化学摩尔知识点训练题

高一化学摩尔知识点训练题化学是一门让人既爱又恨的学科,其中最为繁琐的部分之一就是摩尔计算。
摩尔,是描述物质数量的一种单位,它让我们能够更方便地计算物质的质量、体积和粒子数。
在高一的化学学习中,熟练掌握和运用摩尔知识点是非常重要的。
下面我将为大家提供一些高一化学摩尔知识点训练题,希望能够帮助大家巩固所学的知识。
1. 1 mol的氢气和1 mol的氧气在一定条件下反应生成水,根据化学方程式,回答以下问题:a) 氢气中含有多少个氢原子?b) 氧气中含有多少个氧原子?c) 生成的水中含有多少个氢原子?d) 生成的水中含有多少个氧原子?2. 标准状态下,1 mol的氧气分子中含有多少个氧原子?3. 一瓶汽水中含有5 mol的二氧化碳分子,求汽水中二氧化碳分子的质量。
4. 一块样品的质量为80g,它的摩尔质量是40 g/mol,求该样品中含有多少摩尔的物质?5. 一瓶盐酸溶液中含有0.5 mol的盐酸分子,求盐酸的质量。
6. 一种物质的摩尔质量为60 g/mol,质量为360 g,求该物质中含有多少个摩尔的分子?7. 一瓶溶液中含有6g的氯离子,求该溶液中氯离子的摩尔数。
8. 用25 mL的氯化钾溶液(质量浓度为1 mol/L)制备溶液,求制得的溶液中含有多少摩尔的氯离子?9. 如果1 mol的氢气和1 mol的氧气反应生成水,根据化学方程式,求生成的水的质量。
10. 已知1 mol的酒精分子的质量为46 g,求1 L的酒精的质量。
以上是一些简单的高一化学摩尔知识点训练题,通过练习这些题目可以加深对摩尔知识的理解和掌握。
希望大家能够喜欢化学,掌握好这门学科。
高一化学气体的摩尔体积
物质
H2
密度(g/L) 摩尔质量 一摩尔气 (g/mol) 0℃,101KPa 体标准状 叫标准状况 况时体积 致0.0899 同 我 体一 2.016 的
气 体
O2 CO2
32.00 44.01
相 积 摩 温 22.4L 妈 同 1.429 度 呀 怎尔 ? 么 气 压 22.4L , ! 1.977 强 相 大体 , 22.3L
二、阿佛加德罗定律
定律:在相同温度和压强下,相同体积的 任何气体都含有相同数目的分子。 理解:“同温、同压、同体积、同分子数” 只要有任何的“三同”,必有“四同”。 推论:同温同压,则V1 V2=N1 N2=n1 n2
自己总结,培养能力
V(气体体积) N
÷NA ×NA
n
×ρ
÷ρ
m
阿伏伽德罗定律及其推论:
V:气体的体积(单位:L) n:气体分子的物质的量(单位:mol) T:温度(单位:K) R:常数
PV=(m/M)RT
PM=ρRT
PV=(N/NA)RT
高温加热固体装置:泥三角+坩 埚+三脚架
反馈练习
1、对于1摩尔不同固体物质,体积大 A 小不同,主要原因是
A、粒子体积不同
B、粒子质量不同 C、粒子间平均距离不同 D、粒子间作用力不同
小结论
1、相同条件下,1摩尔固体、液体体 积不相同。 2、在相同温度和压强下,1摩尔任何 气体体积基本相同。 3、在0℃、101KPa时,1摩尔任何气 体的体积约是22.4L。
记住啦:
一、气体摩尔体积 定义:单位物质的量的气体所占的体积或1摩尔 气体所占的体积。 符号:
Vm
表达式:
Vm=
V
n
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• (2)需浓硫酸
ml。
• (3)若定容时俯视刻度线,会使H2SO4的浓度 。
ppt课件
练习:
• 1.氧气的摩尔质量是: • 2.CO2的摩尔质量是: • 3.NaCl的摩尔质量是: • 4.NaOH的摩尔质量是 • 5.64gSO2的物质的量是: • 6.1mol氧气的质量是: • 7.1molH2O的质量是:
• A、CO
B、HCl
• C、CO2
D、Ne E、Cl2
• 例 相比题较5、,同下温列同叙压述下正,确等的质是量:A的SOB2和CO2
• A、体积比11:16 B、密度比16:11
• C、密度比11:16 D、体积比1:1
ppt课件
摩尔
• 例题1、下列叙述中不正确的是: • A、n molH2与n mol氦气具有相同的质子
B 溶液
补充:
• 1、CB、与w的换算关系:
CB
100•0d•w
MB
• 2、溶液的稀释定律:
•
C1•V1C2•V2
ppt课件
作业
• 配制500mL0.1mol/L的硫酸溶液
• (1)从下列用品中选出实验所需用品:
•
,还缺少
。
• a、500ml烧杯 b、玻璃棒 c、胶头滴管
• d 、100ml量筒 e、1000ml容量瓶 f、广口瓶 g、 10ml量筒 h、托盘天平 i、98%密度为1.84g/cm3 的浓硫酸
• (2)要配制500ml0.01mol/L的稀盐酸,需 要上述浓盐酸多少ml?
ppt课件
• (3)用0.01mol/L的稀盐酸1000ml与足量的 Zn反应,求
• A:生成氢气多少g?多少mol? 标况下氢气 的体积是多少升?
• B:消耗Zn多少克?多少摩尔?
ppt课件
根据方程式计算
•
Zn + 2HCl = ZnCl2 + H2↑
阿伏加德罗定律推论3:
• 相同温度、相同压强下,等质量的两
种气体的密度之比,与气体的摩尔质
量成正比。即
n1=n2
m1 d1 1 m1 M1•n1 M1 d2 m2 m2 M2•n2 M2
1
d1 M 1 d2 M 2
ppt课件
阿伏加德罗定律
D
• 例题4、下列气体中,在同温同压下,等质 量时所占体积最大的是:
• 计量系数: 1 : 2 : 1 :1
• 物质的量:
×NA
×NA
×NA
×NA
1 : 2 : 1 :1
• (mol)
• 质量关系: 65 :2×36.5 :136 : 2
• (g)
• 气体体积(L)
• (STP)
ppt课件
22.4
• • 计量系数:
Zn + 2HCl = ZnCl2 + H2(g)↑ 1 : 2 : 1 :1
为:
,该饱和溶液的质量百分比浓度
是
,物质的量浓度是:
。
• 2、28gFe与V ml 0.5mol/L的稀硫酸恰好完 全反应,求,生成标准状况下的氢气多少L? 消耗硫酸体积V多少ml ?
• P26 7、8
ppt课件
。 。 。 。
。 。 。
ppt课件
练习
• 在STP时,
• 1)33.6LO2 的物质的量是
mol;
• 2)1.5mol的H2的体积是
L.
• 3)标准状况下,氧气的摩尔体积约是 。
• 4)在STP时,1molO2的体积是
。
• 5)在STP时,33.6LCl2中含有的Cl的个数是 多少?
ppt课件
练习:
数 • B、1molH2和1mol氨气微粒数都是
6.02×1023个 • C、1mol氢气的质量是1.008g • D、某物质若含有阿伏加德罗常数个微粒,
该物质的物质的量就是1mol
ppt课件
• 例题2、1molCaCl2中含有: • A、3mol离子 B、6.02×1023氯离子 • C、6.02×1023个正电荷 • D、1.204×1023个氯离子
ppt课件
根据方程式列比例的关键:
• “上下单位要相同,左右单位要相当。”
• 或者: • 改写成: •
A1 :B1 = A2 :B2 A1 :B1 A2 :B2
ppt课件
作业:
• 1、某化合物的分子量为M,t℃时Aml该化合
物的饱和溶液的质量为B g,,将该溶液蒸干
后得到固体C g。该化合物在t ℃时的溶解度
;其
中,N2分子数是
;N2的气体摩尔体积
是
。
• 6.STP时,2molHe的体积是
;所含气体pt课件
阿佛加德罗定律推论2
• 相同温度、相同压强下,等质量的 两种气体的体积与气体的摩尔质量 成反比,即
m
V1 M1 M 2 V2 m M1
M2
ppt课件
V1 M 2 V2 M1
物质的量 摩尔体积、 摩尔质量的计算练习
ppt课件
概括整合
ppt课件
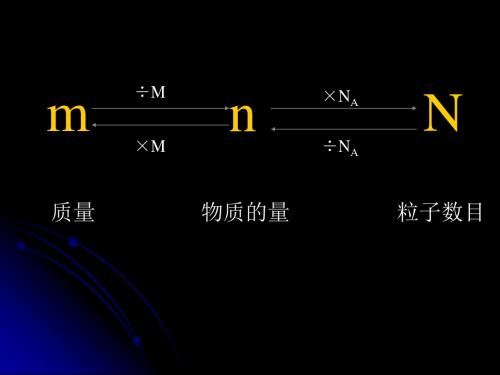
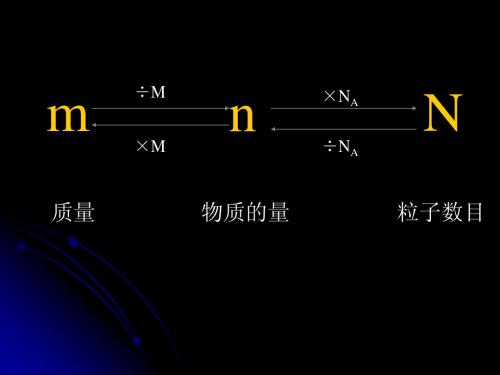
引入
N
m M
•
NA
N22.4LV•mL o1•lNA (标准状况) ppt课件
• 摩尔质量: (g·mol-1)
M m n
• 摩尔体积: (L·mol-1)
V
m
V n
n • 物质的量浓度:
C • (mol·L-1)
B
V ppt课件
• 例题3、下列说法正确的是: • A、硫酸的摩尔质量是98g • B、盐酸的摩尔质量是36.5g/mol • C、1molHNO3的质量是63g • D、98gH2SO4和63gHNO3所含微粒数目相同
ppt课件
• 已知常见浓盐酸的质量分数是:37%,密度: 1.19g/cm3。求:
• (1)浓盐酸的物质的量浓度是多少?
1.32gCu的物质的量是
子个数是
。
;其中,Cu原
2.2molH2O的质量是
是
。
;其中,H2O分子数
3.18g12C中所含12C原子数是
个12C原子的质量是
1/12是
。
。平均每 。该原子质量的
4.求一个O原子的质量是
g。它是一个12C
原子质量的1/12的
倍。
ppt课件
• 5.STP时,33.6LN2的物质的量是
×NA
×NA
×NA
×NA
• 物质的量: 1mol : 2 mol : 1mol : 1mol
• 质量关系: 65g : 2×36.5g: 136g : 2g
• 气体体积: • (STP)
ppt课件
22.4L
标准状况下,22.4L氧气与2mol H2混合,充分 反应后,生成水的质量是多少g?
标准状况下,22.4L氧气与33.6L H2混合,充分 反应后,生成水的质量是多少g?
