无机化学--原电池和电极电势
化学反应中的电极电势与电池电动势实例

化学反应中的电极电势与电池电动势实例在化学反应中,电极电势和电池电动势是两个重要的概念。
电极电势指的是在电化学反应中,电极与溶液中某种溶质之间建立的电势差。
而电池电动势则是指整个电池中两个电极之间的电势差。
本文将结合实例介绍化学反应中的电极电势与电池电动势的概念与相关原理。
实例一:铜与铁电池在铜与铁电池中,铜离子是从铜电极溶解产生的,这个反应可以表示为:Cu(s) → Cu²⁺(aq) + 2e⁻而在铁电极上,则是铁离子发生还原反应:Fe²⁺(aq) + 2e⁻ → Fe(s)根据这两个半反应的标准电极电势可以计算出它们之间的电势差。
在标准状态下,铜电极的标准电极电势为+0.34V,而铁电极的标准电极电势为-0.44V。
所以,在这个铜与铁电池中,电池电动势可以计算为:Ecell = E(铜) - E(铁) = +(0.34V) - (-0.44V) = +0.78V这个正值表示铜与铁电池是一个可行的电池反应,并且产生正向的电势差。
这意味着当铜与铁电池连接成电路时,电子会从铁电极流向铜电极,而离子则会在溶液中迁移,从而产生电流。
实例二:锌与铜电池在锌与铜电池中,锌离子会溶解,并且金属锌会被氧化为锌离子,这个反应可以表示为:Zn(s) → Zn²⁺(aq) + 2e⁻与之相对应的是铜电极上的还原反应:Cu²⁺(aq) + 2e⁻ → Cu(s)通过比较这两个半反应的标准电极电势,可以计算出锌与铜电池的电动势。
在标准状态下,锌电极的标准电极电势为-0.76V,而铜电极的标准电极电势为+0.34V。
因此,锌与铜电池的电动势可以计算为:Ecell = E(锌) - E(铜) = (-0.76V) - (+0.34V) = -1.1V这个负值表示锌与铜电池是一个不可行的电池反应,不能产生正向的电势差。
因此,在锌与铜电池中,电子从铜电极流向锌电极,但离子却会在溶液中迁移,从而产生反向的电流。
高中化学竞赛辅导无机化学6.2电极电势知识点素材
§6-2 电极电势Electrode Potential一、法拉第电解定律(Faraday’s Electrolysis Laws)第一个系统研究电解的是美国大化学家Davy,而对电解进行定量研究的是他慧眼的学生和助手Faraday。
Davy在科学上的功绩固然伟大(发现了金属钠、钾),但是比那些发现更有价值的是他从书铺的工人中提拔了伟大的科学家法拉第。
法拉第在1832年做了电解实验:1.法拉第第一电解定律:电解时,在电极上产生物质的质量与通过电解池的电量成正比。
2.电子数与电荷数的关系:1mol电子为6.022⨯1023个电子,1个电子的电量为1.602⨯10-19 库仑,则1mol 电子所带的电量为6.022⨯1023⨯1.602⨯10-19= 96472 (C) ≌96500 (C) = 1F。
所以电解过程中,对于有n mol电子转移的反应,消耗的电量为Q = I (安培)⨯t (秒) = nF。
3.法拉第第二电解定律:每通过96500库仑的电量(精确值为96487库仑),就有1个克mol e在电解过程中,相当于接受或给出1mol电子的物质的质量,称为一个克当量。
它在数值上等于该物质的氧化──还原当量。
4.法拉第电解定律的近代观点叙述:电解时,当一个法拉第电量(1F)通过电解槽时,在阳极(anode)上发生了氧化反应并产生一个克当量的氧化产物;在阴极(cathode)上发生了还原反应并产生一个克当量的还原产物。
二、电极电位(电极电势)(Electrode Potential)In principle, the energy released in a spontaneous redox reaction can be used toperform electrical work. This task is accomplished through a voltaic, (or galvanic), cell, a device in which electron tra nsfer takes place through an external pathway rather than directly between reactants.1.原电池(Galvanic cell)(1) 组成(composition):原电池的负极(negative pole)──氧化反应(oxidation),原电池的正极(positive pole)──还原反应(reduction)a.金属──金属离子电极:Zn2+── Zn Cu2+── Cu,选择金属本身作电极;b.气体──离子电极:Cl2── Cl-,选择惰性金属或碳棒作电极; c.金属──金属难溶盐或氧化物──阴离子电极:Hg-Hg2Cl2|Cl-,Ag-AgCl | Cl-。
无机化学6.2 电极电势的应用

+1.695
+1.23
•各物种氧化值降低的方向从左向右排列
•横线上的数字表示电对的电极电势,横线左端是电对的氧化态, 右端是电对的还原态。
拉蒂莫尔图的应用:
1. 计算不相邻物种之间的Eө(Ox/Red)
E ө(A/B) E ө(B/C)
A
B
C
E ө(A/C)
A + n1e- B B + n2 e- C A + n3e- C
解:反应 Cu2+ + Zn = Zn2+ + Cu 正极的电极反应 Cu2+ +2 e- = Cu 负极的电极反应 Zn = Zn2+ + 2 e-
E ө =0.337V E ө = -0.763V
Eө = E 0(正极)- Eө(负极)=0.337V - (-0.763V) = 1.100V
lg K nE 2 1.100V 37.2 0.0592V 0.0592V
原电池(1) C ∣ C+ ‖ A+∣ A 原电池(2) C ∣ C+ ‖ B+∣ B 原电池(3) B ∣B+ ‖ A+∣ A
E ө(Ox / Red)代数值越小,该电极上越容易 发生氧化反应, 还原型物质的还原能力(失去电子 能力)越强,是较强的还原剂;氧化型物质的氧化 能力弱。
E ө(Ox / Red)代数值越大,该电极上越容易发 生还原反应,表明氧化型物质的氧化能力(得到电子 能力)越强,是较强的与氧化剂; 还原型物质还原 能力越弱;
——判断物质氧化还原能力的相对强弱
4 氧化还原反应的方向
r Gm = -nFE池 = nF( E 正 - E 负 )
无机化学:氧化还原与电极电势

解:
+2
2Fe
2+
(C1)
+Cl2 (100kPa)
0
→2Fe
+3 3+
(C2)
ቤተ መጻሕፍቲ ባይዱ
+ 2Cl (C3)
-1
-
氧化反应:Fe2+(C1) - e- → Fe3+(C2) 还原反应:Cl2 (100kPa) + 2e- → 2Cl- (C3)
负极
正极
(-)Pt | Fe3+(C2), Fe2+(C1) ||Cl-(C3) |Cl2(P), Pt(+)
Cu2+ + 2e- → Cu Zn - 2e- → Zn 2+
Ox + ne = Red 共轭关系 HB H+ + B共轭酸碱对
Red - ne = Ox
一个氧化还原反应就是两对氧化还原电对物质之 间的电子转移反应 ne a Ox1 + b Red2 → c Red1 + d Ox2 包含氧化剂的电对称为氧化剂电对; 包含还原剂的电对称为还原剂电对。
氧化数降低的过程称为还原
氧化数升高的物质为还原剂
H2 + Cl2 →
0
0
氧化数升高
+1
氧化数降低
2HCl-1
Cl2 H2
氧化数降低
发生还原反应
氧化剂 氧化数升高 还原剂
发生氧化反应
三、氧化还原电对
任何一氧化还原反应都是由两个半反应组成的,一个 是氧化剂被还原的半反应,另一个是还原剂被氧化的 半反应。 氧化数
总的电池反应:
2e 2+ Cu + Zn
《无机化学》第五章 氧化还原反应和电化学基础

二、氧化还原反应方程式的配平
1. 氧化值法
配平原则:氧化剂中元素氧化值降低的总数等 于还原剂中元素氧化值升高的总数。
配平步骤: (1)写出反应方程式,标出氧化值有变化 的元素,求元素氧化值的变化值。
(2)根据元素氧化值升高总数和降低总数相等 的原则,调整系数,使氧化值变化数相等。
(3)用观察法使方程式两边的各种原子总数相 等。
酸表。
(4)E是电极处于平衡状态时表现出来的特
征,与反应速率无关。
(5)E仅适用于水溶液。
5.饱和甘汞电极:
Hg | Hg2Cl2(s) |KCl (饱和)
Hg2Cl2 (s) + 2e
2Hg(l) +2Cl-
E (Hg2Cl2/Hg)=0.245V
三、 影响电极电势的因素
1.影响 因素
(1)电极的本性:即电对中氧化型或还 原型物质的本性。
还原型:在电极反应中同一元素低氧化值的物质。)
电对:氧化型/还原型
例:MnO2 +4H+ + 2e
Mn2+ +2H2O
电对:MnO2 / Mn2+
(2)E与电极反应中的化学计量系数无关。
例:Cl2 + 2e 1/2Cl2 + e
2Cl- E(Cl2/Cl-)=1.358V Cl-
(3)电极反应中有OH- 时查碱表,其余状况查
(3)分别配平两个半反应,使等号两边的原子 数和电荷数相等。
(4)根据得失电子数相等的原则,给两个半 反应乘以相应的系数,然后合并成配平的离子 方程式。
(5)将离子方程式写成分子方程式。
离子电子法配平时涉及氧原子数的增加和减 少的法则:
氧化还原反应-无机化学

刘晓瑭
6
例:(1)检验司机是否酒后开车的反应:
3CH3C-1H2OH+2C+6r2O72- +16H+=3CH3+C3 OOH+4+C3r3++11H2O
氧化剂: Cr2O72- 还原剂:CH3CH2OH CH3CH2OH被Cr2O72-氧化成CH3COOH,表现出还原性; Cr2O72-被CH3CH2OH还原成Cr3+,表现出氧化性。
❖单质:氧化数为零。 ❖氢:氧化数一般为+1;
在金属氢化物(如 NaH)中为-1。 ❖氧:氧化数一般为-2;
在过氧化物(如H2O2、NaO2等)中为-1; 在超氧化物(如KO2)中为-0.5; 在含氟氧键时(OF2)为+2。 ❖离子:简单离子的氧化数等于其电荷数;
复杂离子中各元素氧化数代数和等于其电荷数。
2020/11/5
刘晓瑭
15
理解氧化数的概念应注意:
(1)氧化数与化合价、共价键数不同: 氧化数表示的是单质或化合物中原子的形式电荷数。
离子化合物:元素的氧化数 = 原子所带的电荷数 共价化合物:元素的氧化数 = 电子偏移的对数
化合价是指某元素的一个原子与一定数目的其它 元素的原子相结合的个数,表示的是一个原子结合 其它原子的能力。
氧化还原反应-无机化学
7.1基本概念
7.1.1 氧化与还原 7.1.2 原电池 7.1.3 电极电势和电动势
2020/11/5
刘晓瑭
4
1.氧化还原的定义
氧化——失去电子的过程; 还原——得到电子的过程; 还原剂——失去电子的物质; 氧化剂——得到电子的物质; 氧化还原反应——有电子得失的反应。 表示为:
无机化学第4章 氧化还原反应

∵ E- =E (H+/H2) = 0.000V
∴ E = E+ = E待测
例如:测定Zn2+/Zn电极的标准电极电势 将Zn2+/Zn与SHE组成电池
(-)Pt,H2(100kPa)|H+(1mol· -3)||Zn2+(1mol· -3)|Zn(+) dm dm 298.15K时, E = -0.76V E (Zn2+/Zn) = -0.76V 又如:测定Cu2+/Cu电极的标准电极电势 将Cu2+/Cu与SHE组成电池
1. 标准氢电极(SHE)
电极反应:
2H+(aq) + 2e
电对:H+/H2 电极电势(规定):
H2(g)
H+ 标准氢电极装置图
E (H+/H2)= 0.000V
电极符号:
Pt ,H2(100kPa) | H+ (1.0mol· -3) dm
2. 电极电势的测定
将标准氢电极与待测电极组成电池: ( - )标准氢电极 || 待测电极( + ) E = E+ - E-
Cr2O72- (c1), Cr3+(c3) ,H+(c2) | Pt (+)
例题4-1 将下列氧化还原反应设计成原电池, 并写出它的原电池符号。 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O 解: 原电池的正极: Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O 负极: Fe2+ = Fe3+ + e-
有关原电池电极电势的几点注意事项

有关原电池电极电势的几点注意事项有关原电池电极电势的几点注意事项有关原电池电极电势的几点注意事项智霞,潘勤鹤,张才灵(海南大学材料与化工学院,海南海口570228)摘要:由于无机化学教材中介绍的概念物理量较多,而且有不同的表现形式,导致学生学习时抓不住它们的联系与区别,容易产生混淆。
本文针对标准电极电势及其相关热力学量这一知识点,通过系统的总结分析这一知识点,使其系统化、条理化,便于学生理解和掌握。
关键词:标准摩尔吉布斯自由能;电极电势;电极基金项目:教育部新世纪优秀人才支持计划(NECT-11-0929),海南省自然科学基金项目(214020)通讯作者:潘勤鹤。
无机化学是四大基础化学之一,是理工、农林、海洋等学科的一门基础必修课,一般在大学一年级开设,为大学生学好专业课做准备。
通过对基础化学知识的学习,便于大学生将化学的理论和方法应用于专业的学习和解决相关的问题。
然而无机化学的知识点很多,包含有基本原理的化学热力学,关于微观粒子的物质结构,以及酸碱和氧化还原反应和电化学。
氧化还原和电化学在无机化学是很重要一章[1]。
而这章中主要讨论的是电化学,电化学是研究电能和化学能之间的相互转化的科学,它是化学的一个重要领域。
在本章的教学中发现如果不能很好地解决原电池的基本理论的介绍和分析会导致学生混乱。
本文针对这章中同学们容易混淆和犯错的几个知识点进行分析,以便能更好地掌握和理解,从而达到知识点的融会贯通。
一、电化学与热力学的关系G为吉布斯自由能,是状态函数,体现体系的量度性质,具有加和性。
在恒温恒压过程中,体积所做的非体积功的最大限度,是自由能的减少值,且只有在可逆过程中,这种非体积功的最大值才得以实现。
也就是说自由能减少的方向是恒温恒压下,无非体积功的反应自发进行的方向[1]。
根据热力学吉布斯自由能在恒温恒压情况下:dG=dU+pdV-TdS (1)由热力学第一定律得:dU=δQR-δWm=TdS-pdV-δWf (2)将(2)式代入(1)式得:dG=-δWf即:体系的吉布斯自由能减少等于体系在恒温恒压下所做的最大的非体积功,若非体积功只有可逆电池的'电功一种,这里的可逆电池需要具备两个条件:第一,电极必须是可逆的;第二,要求通过电极的电流无限小,电极反应在接近电化学平衡的条件下进行。
无机化学-电池电动势和电极电势
标准甘汞电极(NCE) 1.0 mol / L +0.2828
饱和甘汞电极(SCE) 饱和溶液 +0.2438
温度校正,对于SCE,t ℃时的电极电势为:
t= 0.2438- 7.6×10-4(t-25) (V)
电池符号: (-) Hg,Hg2Cl2(s)︱KCl (1 mol·dm-3) Mn+ (1 mol·dm-3 ) M (+)
氧化半反应: H2 - 2e = 2H+ 还原半反应: Cl2 + 2 e = 2Cl– 总反应: H2 + Cl2 = 2H+ + 2Cl–
2. 题中给出总反应方程式,要能够写出电池符号和半反应
例题:试以中和反应 H+ (aq) + OH–(aq) = H2O(l)为电池反应, 设计成一种原电池反应(用电池符号表示),分别写出电极半 反应,并求出它在25℃时的标准电动势。
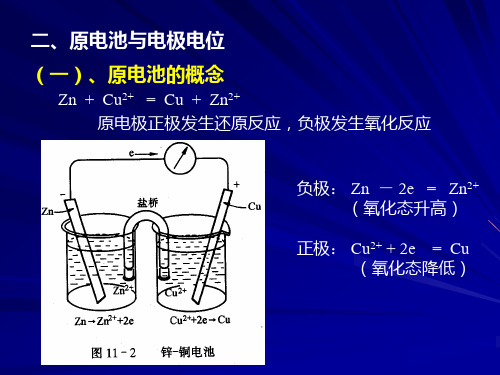
二、原电池与电极电位 (一)、原电池的概念
Zn + Cu2+ = Cu + Zn2+ 原电极正极发生还原反应,负极发生氧化反应
负极: Zn - 2e = Zn2+ (氧化态升高)
正极: Cu2+ + 2e = Cu (氧化态降低)
盐桥(Salt bridge)
通常内盛饱和 KCl 溶液或 NH4NO3 溶液(以琼胶 作成冻胶)。
作用: ● 让溶液始终保持电中性 ,使电极反应得以继续进行 ● 消除原电池中的液接电势(或扩散电势)
(二)、原电池的表达式
(-) Zn|Zn2+ (C1) ‖ Cu2+ (C2)|Cu (+)
1、负极写在左边,正极写在右边 2、用∣表示电极与离子溶液之间的物相界面 3、不存在相界面,用,分开。 4、用表示盐桥 5、在有气体参加的电池中还要表明气的压力,溶液要表 明浓度。
无机化学-氧化还原反应与电极电势

腐蚀类型
包括均匀腐蚀、点蚀、缝 隙腐蚀和应力腐蚀等。
防护措施
采用涂层、电镀、合金化 等手段,降低金属与环境 之间的反应速率,延长金 属使用寿命。
电池的工作原理
原电池
将化学能转化为电能的装置,由正负两个电极和 电解质组成。
电解池
将电能转化为化学能的装置,通过外电源迫使电 子和离子分别在正负电极上聚集。
氧化还原反应基础
氧化与还原的定义
氧化
失去电子的过程,物质从较低氧化态变为较高氧化态。
还原
得到电子的过程,物质从分子在氧化还原反应中的氧化态。
规则
单质中各元素的氧化数为0;在化合物中,氢的氧化数为+1,氧的氧化数为-2;在 化合物中,正价元素取正值,负价元素取负值。
02
判断氧化还原反应 的方向
电极电势的相对大小可以用来判 断氧化还原反应自发进行的方向。
03
计算电子转移数
根据电极电势的变化,可以计算 氧化还原反应中电子转移的数量。
电极电势与反应自发性的关系
电极电势差值决定反应方向
当电极电势差值大于0时,反应自发向正向进行;当电极电势 差值小于0时,反应自发向逆向进行。
电极电势与反应速率的关系
电极电势的大小影响氧化还原反应的速率,电极电势越高, 反应速率越快。
04
氧化还原反应的配平与计算
氧化还原反应的配平方法
观察法
通过观察反应物和生成物的化合 价变化,找出化合价变化的原子 个数,从而确定反应物和生成物 的系数。
离子-电子法
适用于溶液中的氧化还原反应, 通过列出反应物和生成物的离子 方程式,根据得失电子守恒原则 配平。
电池种类
包括干电池、铅酸蓄电池、锂离子电池等,每种 电池的工作原理和特点不同。
天津大学无机化学第四章电极电势

Zn(s)
Zn2+ + 2e-
(a) 电势差 E = V2 – V1
这种产生在金属和它的盐溶夜之间的电势
差,叫金属的电极电势。
19
这种产生在金属和它的盐溶夜之间的电势差, 叫金属的电极电势。
Cu
Cu2+ + 2e-
Cu(s)
(b) 电势差 E = V1’ – V2’
V1’ V2’
–++ – –++ – –++ – –++ –
电极电势 E/V 0.2445
0.2830
0.3356
30
4.2.4 原电池的电动势与平衡常数关系
在恒温、恒压,原电池输出的最大电功 We 等于电池反应过程中吉布斯自由能变的减小。
–DG = We
We = zFE
F = 96500 J·V-1·mol–1
– DG = z F E
DG θ = – z F E θ
37
当 c(H+) = 10 mol·L-1 时 E(MnO4-/Mn2+ ) = 1.60 V
可见, MnO4- 氧化能力随酸度的增加而 增加。所以在酸性溶液中氧化能力强,而在 中性、碱性溶液中氧化能力减弱。
38
2MnO4 + 5SO32 + 6H+ 2Mn2++ 3H2O+ 5SO42
36
② 酸度
例: 电极反应 MnO4- + 8H+ + 5e- Mn2+ + 4H2O 已知: Eθ(MnO4-/Mn2+ ) = 1.51V
c(MnO4- ) = c(Mn2+) = 1.0 molL-1
无机化学原电池计算

无机化学原电池计算(总3页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除无机化学原电池的有关计算1.将铜片插入0.10 molL -1 Cu (NO 3)2溶液中构成原电池的半电池,再将银片插入硝酸银溶液中构成另一个半电池,在银半电池中加入过量的HBr 以产生AgBr 沉淀,并使溴离子浓度[Br -]=0.10 molL -1 。
在上述条件下原电池的电动势 E =0.22 v ,Ag 电极为负极 。
计算 AgBr 的溶度积 Ksp ,并写出电池反应式 。
(已知:Θ(Ag + / Ag) = 0.80 v ,Θ(Cu 2+ / Cu) =0.34 v )解: (Cu 2+ / Cu)=Θ(Cu 2+ / Cu) + 20591.0lg [Cu 2+] =0.34 + 20591.0lg 0.10 =0.31 (v) (Ag + / Ag) =Θ(Ag + / Ag) + 0.0591 lg [Ag +]∵ [Ag +]=][ Br Ksp AgBr =10.0AgBrKsp∴ (Ag + / Ag) =0.80 + 0.0591 lg10.0AgBrKsp而 E = (Cu 2+ / Cu) - (Ag + / Ag)0.22 = 0.31 - (Ag + / Ag) (Ag + / Ag) =0.31 - 0.22= 0.09 (v)则 0.09 = 0.80 + 0.0591 lg10.0AgBr KspAgBr Ksp =9.7×10-142.某氢氧燃料电池,其电池反应为:2 H 2 (g) + O 2 (g) = 2 H 2O ( l )电极反应在碱性溶液中进行,写出该电池反应的两个半反应 ,确定正 、负极 ;计算反应的标准吉布斯函数变ΔrG m Θ ,电池的电动势 E Θ ,电池反应的标准平衡常数 K Θ。
(已知:Δ f G m Θ (298 K ,H 2O ,l ) =-237.2 kJ · mol -1 )解:正极反应 O 2 + 2 H 2O + 4 e - = 4 OH -负极反应 2 H 2 + 4 OH - - 4 e - = 4 H 2O① + ② 即得电池反应式 2 H 2 (g) + O 2 (g) = 2 H 2O ( l )Δ rG m Θ = 2×Δ f G m Θ (298 K ,H 2O ,l )=2×(-237.2) =-474.4 (kJmol -1 )Δ rG m Θ =-n F E ΘE Θ =5.9644.474⨯--=1.23 (v) lg K Θ=0591.0θnE =0591.023.14⨯=83.25 K Θ=1.78×10833.现有下列两个电极:① 金属银插在AgBr 的饱和溶液中;② 氢电极 2H p =100 kPa ,溶液中 [HAc]=0.1 mol ·L -1。
无机化学 氧化还原反应

E 与反应计量系数无关,无加和性 与反应式的书写方向无关
Fe3+ + e-=Fe2+ E = 0.771 V 2Fe3++ 2e-=2Fe2+ E = 0.771 V, 而非0.771×2 Fe2+ - e- =Fe3+ E = 0.771V, Fe2+ =Fe3+ + e- 而非 - 0.771 V
第六章 氧化还原
PLEASE ENTER YOUR TITLE HERE
第一节 氧化还原反应 第二节 电池的电动势和电极电势 第三节 氧化还原平衡 第四节 影响电极电势的因素 第五节 元素电势图
电负性:元素的原子在分子中吸引电子能力的相对大小
元素电负性的周期性变化与金属性、非金属性的一致
金属-金属离子电极
金属-金属难溶盐-阴离子电极
氧化还原电极
气体-离子电极
三、常用电极类型氧Leabharlann 还原电对: Ag+ / Ag
电极组成式: Ag+(c) | Ag(s)
电极反应:
由金属板插入到该金属的盐溶液中构成
01
03
02
04
例:银电极
1.金属-金属离子电极
将金属表面涂渍上其金属难溶盐的固体,然后浸入到与该电解质具有相同阴离子的溶液中构成的电极
(1) 两个半电池反应分别为: 正极 MnO4-+ 8H+ + 5e-=Mn2+ + 4H2O 负极 H2O2=2H+ + O2 + 2e- (2)电极组成为: 正极 MnO4- (c1), Mn2+ (c2), H+ (c3) | Pt (s) 负极 H+ (c4), H2O2 (c5) | O2 (p) | Pt (s) (3)电池组成式为: (-) Pt |O2 (p) | H2O2 (c5), H+ (c4)‖MnO4- (c1), Mn2+(c2), H+(c3) | Pt (+)
无机化学—第四章电化学

选用标准氢电极作为比较标准 规定它的电极电势值为零.
即 j (H+/H2)= 0 V
19
2-1 标准电极电势
标准氢电极
j (H+/H2)= 0 V
H2←
H2(100kpa) →
Pt →
←H+(1mol·L-1)
20
2-1 标准电极电势
准态时反应自发进行的方向。
电对
j /V
Pb2+/Pb Sn2+/Sn
>
-0.126V -0.136V
反应自发向右进行
38
非标准态时:先根据Nernst方程求出j(电对), 再计算电动势E 或比较j (电对)。
例 试判断下列反应:Pb2++ Sn Pb + Sn2+,在c(P
b2+) /c(Sn2+)=0.1/1.0 时反应自发进行的方向。
EE
RT ln cG nF cA
c g cD c a cB
c d c b
平衡时: E
=0
cG c g cD c d cA c a cB c b K
平衡时 E 0.05917 lg K 0
(298K):
n
lg K nE 0.05917
(4.3b) 17
§4-2 电极电势
18
2-1 标准电极电势
j 越大,电对中氧化态物质的氧化能力越强,
还原态物质的还原能力越弱
强氧化剂对应弱还原剂 弱氧化剂对应强还原剂
类似酸碱共轭关系 酸 === 质子 + 碱
氧化还原反应的规律:
较强
较强
无机化学第六章氧化还原总结

298.15K,忽略 离子强度时
0.0592 n
lg
Ox Red
n 为电极反应中转移的电子数; 式中: [Ox ]为电极反应中氧化型一侧各物质浓度幂的乘积
注意
[Red]为电极反应中还原型一侧各物质浓度幂的乘积
1)纯液体、固体不出现在方程式中。气体用分压(p/p) 表示;(p以kPa为单位, p=100kPa)
已知 (Cl2 / Cl-) = 1.36 V, 当[ Cl- ] = 10 mol·L-1 , p(Cl2) = 1.0 kPa 时, (Cl2 / Cl-) 的值是 ( 1.24V )
I2 + 2e- 2I-
(I2/ I )
(I2/ I )
0.0592 1 2 lg [ I ]2
0.535
利用 ´计算 的 Nernst 方程:
/ 0.0592 lg cOx
n
cRe d
2、氧化还原滴定曲线计算(电极电势)
(1)计量点前——根据被滴定电对计算
(2)化学计量点sp
SP
n11 '
n1
n22 '
n2
适用于对称电对——电极反应中 氧化型、还原型前的系数相同。
(3)计量点后——根据滴定剂电对计算
AgI /Ag :
AgI + e- Ag + I- ;
Cl2/Cl- :
Cl2 + 2e- 2Cl-
(-)Ag ︱ AgI (s) | I- (c1) ‖Cl- (c2)︱Cl2 (P ) ,Pt (+)
:写出反应 I2 + 2S2O32- = 2I- + S4O62- 所对应的原电池符号: 解:根据反应式可知:
无机化学 电极电势

(-)Pt, Cl2(p) Cl-(c) 2Cr2O7 (c1), H+(c2), Cr3+(c3) Pt(+)
原电池的表示方法课堂练习
2H2 + O2 → 2H2O
电极反应
H2 - 2e- → 2H+ 氧化 O2 + 4H+ + 4e- → 2H2O 还原
原电池符号
(-) Pt, H2(p1) | H+(c1) || H+(c1), H2O | O2(p2), Pt(+)
氧化还原电对:
由同一种元素的氧化型物质和还原型物质构成
氧化还原电对表示方法 氧化型物质/还原型物质 如 Cu2+/Cu Zn2+/Zn
H+/H2
Sn4+/Sn2+
2.原电池的表示方法 (-)Zn| Zn2+(c1) Cu2+(c2)|Cu(+)
注 若组成电极物质中无金属时, 意 应插入惰性电极 惰性电极: 如Pt ,石墨 能导电而不参与电极反应的电极 Fe3+(c1),Fe2+(c2) | Pt (+) (-) Pt, Cl2(p) | Cl-(c)
常用电对的标准电极电势(298.15K)
电对 电极反应 Li+/Li Li+ + e- Li K+/K K+ + e K Zn2+/Zn Zn2+ + 2eZn H+/H2 2H+ + 2eH2 Cu2+/Cu Cu2+ + 2eCu O2/H2O O2+4H+ + 4e2H2O Cl2/ClCl2 + 2e2ClF2/HF(aq) F2+2H+ + 2e2HF(aq) XeF/Xe(g) XeF + eXe(g) + FE /V -3.040 -2.924 -0.7626 0 0.340 1.229 1.229 3.053 3.4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§5.2 原电池和电极电势
lyon
一、原电池、电池符号
原电池
将锌片放在硫酸铜溶液中,可以看到硫酸铜溶液的蓝色逐渐 变浅,析出紫红色的铜,表明Zn与CuSO4溶液之间发生了氧化还
原反应:
Zn CuSO 4 ZnSO 4 Cu
Zn与Cu2+之间发生了电子转移。但这种电子转移不是电子 的定向移动,不能产生电流。反应中化学能转变成热能,并在溶 液中耗散掉了。
双垂线“||”表示。
⑷注明温度和压力(如不写明,一般指298K、100kPa) 和溶液浓度。
⑸若电极反应中无金属导体,需用惰性电极Pt电极或C
电极,它只起导电作用,而不参与电极反应
6
常用电极的类型
(1)金属-金属离子电极
把金属片(棒)插入含有该金属离子的溶液中所构成的电极。
电极符号通式为: M∣Mn+ 电极反应通式为:Mn+ + ne = M(s)
原电池中,电子有锌极流向铜极,说明锌极的电极电势低于铜 极的电极电势。而电极电势的不同是由于物质的氧化还原能力不同而
引起的。
15
标准电极电势
单个电极的电极电势的绝对值至今仍无法被测定。通常选用标准氢电极 (SHE)作为基准。
c(H+) =1mol/L硫 酸溶液
标准氢电极
电极反应:
2H (aq) 2e H 2 g
电极符号
Ag-AgCl (s)∣Cl - (c)
9
(4)氧化还原电极
惰性电极(Pt或石墨)插入含有同一元素两种不同氧化数的离 子的混合溶液中而构成的电极。
电极反应 电极符号
2 Fe3 (aq) e Fe (aq)
Pt∣Fe 3+ (c1), Fe 2+ (c2)
10
【例】根据下列电池反应写出相应的电池符号 ⑴ H2+2Ag+ ⑵ Cu+Fe3+ 2H++2Ag Cu2+++(c)
电极符号
8
(3)金属-金属难溶盐(或氧化物)
金属表面涂覆该金属的难溶盐(或氧化物),然后浸入含有该 难容物阴离子的溶液中而构成的电极,其优点是电极电势比较稳定,
又容易制备。
AgCl s e Ag s Cl (aq) 电极反应
电势称为标准电极电势,用符号 ө 表示,单位为V。
用该电极与标准氢电极组成的原电池,测定该原电池的电动 势,由电流方向判断正负极,再根据下式求出待测电极的标准电
极电势。
E = + -
解 ⑴(-)Pt|H2(g)|H+(c1)||Ag+(c2)|Ag(+)
⑵(-)Cu|Cu2+(c1)||Fe3+(c2),Fe2+(c3)|Pt(+)
11
二、电极电势
双电层理论
当将金属放入它的盐溶液中时,金属晶体中的金属离子由于本身的 热运动以及受极性溶剂分子的吸引,有离开金属进入溶液的趋势。
M s M n (aq) ne
13
这种由于双电层的作用在金属和它的盐溶液之间产生的电位差, 就称为金属的电极电势,表示为:
M /M )
n
单位为V 当外界条件一定时,电极电势的大小只取决 于电极的本性。
14
原电池的电动势
原电池正负极之间的平衡电势差就是原电池的电动势,用 符号E表示,单位为V。
E =+ -
Zn 2e Zn 2 Cu 2 2e Cu
(氧化反应) (还原反应)
原电池反应:
Zn Cu 2 Zn 2 Cu
原电池中与电解质溶液相连的导体,称为电极。 在电极上发生的氧化或还原反应则称为电极反应或半 电池反应; 两个半电池反应合并构成的原电池总反应称电池反应。
金属越活泼,溶液越稀,溶解成离子的倾向越大
溶液中的Mn+由于受到金属表面电子的吸引,有从溶液向金属表面 沉积的趋势。
M n (aq) ne M s
金属越不活泼,溶液越浓,这种倾向越大 两种倾向速率相等时,建立动态平衡
n M s M (aq) ne
若该氧化还原反应在特定装置内进行时,会发现当电路接通 后,检流计指针发生偏转。
保证盐桥两侧 溶液为电中性, 维持电路的回 路 电 子 流 入 , 正 极 , 还 原 反 应
电 子 流 出 , 负 极 , 氧 化 反 应
这种借助于氧化还原反应自发产生电流 的装置称为原电池。
因此,锌片为负极,铜片为正极,其反应为: 负极: 正极:
电对: H+ / H2
电极电势(标准氢电极的电极电势为零)
ө(H+ / H2) = 0.000 0V
电极符号:
Pt | H2(105Pa) | H+(1molL-1 )
标准电极电势的测定
若参加电极反应的物质均处于标准态(温度为25℃,气体的
分压为100KPa,液态或固态物质皆为纯物质,组成电极的离子 浓度均为1mol/L)下,这时的电极称为标准电极,对应的电极
4
原电池符号
原电池装置可简单的用电池符号来表示,如Cu-Zn原
电池可表示为:
(-) Zn∣Zn2+ (c1)‖Cu2+ (c2)∣Cu (+)
5
正确书写原电池符号的规则如下:
⑴负极写在左边,正极写在右边。
⑵金属材料写在外面,电解质溶液写在中间。 ⑶相接界面用实垂线“|”或“,”隔开,盐桥的符号用
如:
电极反应
Zn 2 2e Zn
电极符号 Zn(s) | Zn 2+ (c)
(2)气体- 离子电极
气体与其离子成平衡的电极,其构成需要一个固体导电体—— 惰性电极(Pt或石墨),插入含有该离子的溶液中。惰性电极只起
吸附气体和传递电子的作用,不参与电极反应。
电极反应
2H (aq) 2e H 2 g
12
n M s M (aq) ne
锌电极的双电层
M失去电子的倾向>Mn+获得 电子的倾向,平衡时,金属 表面带负电,金属表面附近 的溶液带正电,金属与溶液 间产生电势差。
铜电极的双电层
M失去电子的倾向<Mn+获得 电子的倾向,平衡时,金属 表面带正电,金属表面附近 的溶液带负电,金属与溶液 间产生电势差。
