分子荧光光度法基本原理
分子荧光光谱原理

首次建立了辣椒及辣椒素对照 品的三维荧光指纹图谱; 研究 表明,不同品种辣椒具有各自 特征的指纹图类型和特征指纹; 三维荧光指纹图谱可用来作为 鉴别辣椒品种和评价辣椒素含 量的有效手段
荧光光谱在食品中的应用
检测农药残留与污染物
同步荧光分析中,诺氟沙星、盐酸洛美沙星和乳酸左氧氟沙星三种 药物光谱重叠严重在 pH =2.87 的 BR 缓冲溶液中,波长差 Δλ =190nm 时,诺氟沙星、盐酸洛美沙星和乳酸左氧氟沙星的测量线 性范围分别为 0.016~0.40、0.01~0.336 和 0.01~0.336μg / mL; 检出限分别为0.0126、0.006 和 0.0072μg / mL。 采用恒能量同步荧光光谱法测定苯并芘 多环芳烃具有高荧光量子产率,可利用三维荧光光谱法进行测定
分子荧光光谱的特点
信息量大 灵敏度高
荧光不受来 自激发光的本底 的干扰,灵敏度 大大高于紫外可见吸收光谱, 测量用量很,方 法简便。 荧光光谱能提供较 多的参数,如激发 谱、发射谱、峰位、 峰强度、荧光寿命、 荧光偏振度等;还 可以检测一些紫外可见吸收光谱检测 不到的时间过程。
多元素测定
原子荧光 是向各个方向 发射的,便于 制作多道仪。
L/O/G/O
分子荧光光谱应用原理
荧光是受光激发的分子从第一激发单重态的最低振动 能级回到基态所发出的辐射,通常发生于具有刚性结构和 平面结构π 电子共轭体系的分子中。随着 π 电子共轭度和 分子平面度的增加,荧光强度随之增大,光谱相应红移, 其荧光光谱的形状和强度也相应发生变化,因此荧光光谱 是提供具有共轭结构的分子的组分分布与浓度大小的有效 测试手段之一。
分子荧光光谱分析的特点
虽然原子荧光光谱分析法有以上优点,但由于荧光 淬灭效应,以致在测定复杂基体的试样及高含量样品时, 尚有一定困难。此外,散射光的干扰也是原子荧光分析 中的一个麻烦问题。因此,原子荧光光谱分析法在应用 方面尚不及原子吸收光谱法和原子发射光谱法广泛,但 可作为这两种方法的补充。
仪器分析课件12荧光分析法

ex = 356nm em = 404nm
f = 0.36
16
2. 分子的刚性
• 同样具有*跃迁的长共轭分子中,刚性分子 增加了共平面性, 越大, 长移。
f = 0.2
-O
O
COO-
C H2
f = 1.0
-O
O
O
COO- 荧光素钠
17
原来不发生荧光的,如:8-羟基喹啉
消除干扰,提高选择性、灵敏度
脉冲激光
样品
干扰 组分
44
3. 同步荧光分析
固定,同时扫描激光光谱和发射光谱 若: = em - ex
Fsp = KcFem Fex 提高灵敏度和选择性
混合物的同步荧光光谱( =3nm)
45
4. 胶束增敏荧光
CH3(CH2)11OSO3-Na+ 非极性疏水基团 极性亲水基团 增加溶解度 增加荧光效率 增加荧光的稳定性
• 荧光分析法的灵敏度高于紫外-可见分光光度法
荧光法
F=Kc
紫外法 A lg T lg I
I0
36
二、定量分析方法
1. 工作曲线法
用空白溶液调零 用标准溶液调满刻度
F cx
c1
c2 c3 c4 c5
20 40 60 80 100%
16 32 48 64 80%
37
2. 比例法(对比法)
光
强
荧光光谱 横坐标em, 度
纵坐标 发射光强度
400
500
(nm)
8
溶液荧光光谱通常具有如下特征
斯托克斯位移 荧光光谱的形状与激发波长无关 荧光光谱与激发光谱的镜像关系
荧光光度分析法

26
浓度测定 1、如何进行校准和浓度测定 如何进行校准和浓度测定 按以下步骤,调整仪器,以便获取数据 第1步: 点击视图中的开始 开始(Stare)按扭,指向程序 开始 程序 (Program)→Cary Eclipse , 然后选择扫描 扫描(Scan)即显示扫描功能框。 扫描 第2步: 点击设置 设置(Set up),进入设置 设置(Set up)对话框, 设置 设置 指定检测方法的参数
荧光光度分析法
1
一、基本原理
1.荧光的定义 1.荧光的定义 在紫外光或波长较短的可见光照射 后,一些物质会发射出比入射光波长更 --------荧光 荧光。 长的光 --------荧光。以测量荧光的强度 和波长为基础的分析方法叫做荧光光度 和波长为基础的分析方法叫做荧光光度 分析法。 分析法。
2
4
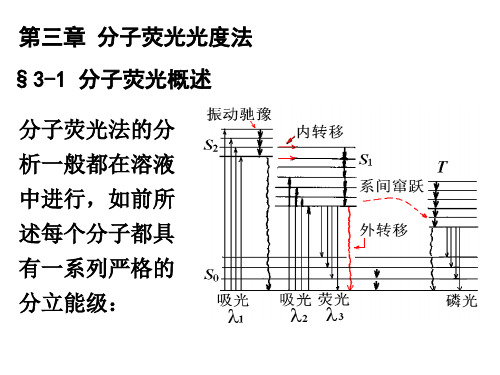
分子内的光物理过程
VR 2 1 v=0 S2 2 1 v=0 S1 ic VR isc
A1、A2. 吸收 、 F. 荧光 P. 磷光 ic. 内转化 isc. 体系间窜跃 VR. 振动松弛 VR 2 1 v=0 T1
ic A2 A1 F P
isc
3 2 1 v=0 S0
5
6
3. 荧光强度与浓度的关系
11
二、Varian Cary Eclipse 荧光 分光光度计的特点
1. 硬件及硬件的主要特点 ⑴ 高能闪烁光源-----氙灯 高能闪烁光源-----氙灯 由于荧光物质的荧光强度与 激发光源的强度成正比,Eclipse采用了无须预 激发光源的强度成正比,Eclipse采用了无须预 耗能12 但脉冲输出能量却高达75 热、耗能12 W 但脉冲输出能量却高达75 KW 的闪烁氙 Xe) 并利用电子技术控制, 的闪烁氙(Xe)灯,并利用电子技术控制,使其 仅在发出测量指令后才闪烁。 仅在发出测量指令后才闪烁。这一设计给荧光 分析者带来极大的方便. 分析者带来极大的方便.
分子荧光光谱法

菲
线状环结构比非线状 结构的荧光波长长
• 芳香族化合物因具有共轭的不饱和体系, 芳香族化合物因具有共轭的不饱和体系, 多数能发生荧光 • 多环芳烃是重要的环境污染物,可用荧光 多环芳烃是重要的环境污染物, 法测定 • 3,4 - 苯并芘是强致癌物 , 苯并芘是强致癌物
λ ex = 386 nm λem = 430 nm
(二)荧光与有机化合物结构的关系
物质只有吸收了紫外可见光,产生π 物质只有吸收了紫外可见光,产生π → π*,n → π* 跃迁, 跃迁,产生荧光 跃迁相比,摩尔吸收系数大10 π → π*与n → π*跃迁相比,摩尔吸收系数大102~103, 寿命短 跃迁常产生较强的荧光, π → π*跃迁常产生较强的荧光, n → π*跃迁产生的 荧光弱
1. 电子自旋状态的多重性
大多数分子含有偶数电子,基态分子每一个轨道 大多数分子含有偶数电子, 中两个电子自旋方向总是相反的↑↓ 中两个电子自旋方向总是相反的↑↓ ,处于基态单 重态。 当物质受光照射时, 重态。用 “S0” 表示 ;当物质受光照射时,基态 分子吸收光能产生电子能级跃迁, 分子吸收光能产生电子能级跃迁,由基态跃迁至 更高的单重态,电子自旋方向没有改变, 更高的单重态,电子自旋方向没有改变,净自旋 = 0 .这种跃迁是符合光谱选律的 第一激发单重态 S1
VR S2 IC VR S1 ISC
VR:振动驰豫 : IC:内部转换 : ISC:系间窜跃 :
T1
S0 吸光 吸光
S0
3. 荧光光谱的产生—辐射去激 荧光光谱的产生—
处于S 处于S1或T1态的电子返回S0态时,伴随有发光现 态的电子返回S 态时, 象,这种过程叫辐射去激 发光 S0 S1或T1 荧光: (1)荧光: 当电子从第一激发单重态S 当电子从第一激发单重态S1的最低振动能级回到基 态S0各振动能级所产生的光辐射叫荧光 荧光是相同多重态间的允许跃迁,产生速度快, 荧光是相同多重态间的允许跃迁,产生速度快, 10-9~10-6s,又叫快速荧光或瞬时荧光,外部光源停 又叫快速荧光或瞬时荧光, 止照射, 止照射,荧光马上熄灭 无论开始电子被激发至什么高能级,它都经过无辐 无论开始电子被激发至什么高能级, 射去激消耗能量后到S 的最低振动能级,发射荧光, 射去激消耗能量后到S1的最低振动能级,发射荧光, 荧光波长比激发光波长长。 荧光波长比激发光波长长。 λ 荧>λ激
分析化学第11章--荧光分析法

概述 基本原理 定量分析方法 荧光分析技术及应用
11.1 概述
1.光致发光:物质受到光照射时,除 吸收某种波长的光之外还会发射出比 原来所吸收光的波长更长的光,这种 现象称为光致发光。
2.荧光(fluorescence):物质分子接受 光子能量被激发后,从激发态的最低 振动能级返回基态时发射出的光。
低一些。 2.荧光的产生 1)激发过程: 基态分子 hv 激发单重态(s1*,s2*)
激发三重态
2)激发态能量传递途径
传递途径
辐射跃迁
无辐射跃迁
荧光 磷光 系间跨越内转换 外转换 振动弛豫
1.无辐射跃迁
a.振动驰豫(vibrational relexation):
处于激发态各振动能级的分子通过 与溶剂分子的碰撞而将部分振动能 量传递给溶剂分子,其电子则返回 到同一电子激发态的最低振动能级 的过程。
2)电子能态的多重性:
M=2S+1
S:总自旋量子数。S=s1+s2 对于 S=1/2 +(-1/2)=0
M=2S+1=1
对应基线单重态;
对于激发态
s1=1/2,s2=1/2,
S=1/2+1/2=1, M=2×1+1=3 三重态
• 单重态与三重态的区别 1)电子自旋方向不同; 2)激发三重态的能量稍
8-羟基喹啉
8-羟基喹啉镁
弱荧光
强荧光
刚性和共面性增加,可以发射荧光或增 强荧光。
c.位阻效应
NaO3S
N(CH3)2
NaO3S
N(CH3)2
1-二甲氨基萘-7-磺酸钠 f=0.75
1-二甲氨基萘-8-磺酸钠 f =0.03
分子荧光分光光度法实验技术

标准样品设置
2019/12/31
待测样品设置
2019/12/31
空白校零
2019/12/31
开始测定
2019/12/31
2019/12/31
2019/12/31
重新计算
2019/12/31
2019/12/31
九、荧光光度计使用注意事项:
1、比色皿使用之前应清洗干净。若比色皿很脏, 清洗方法为:先将比色皿置于铬酸洗液中浸泡半 小时左右,再用蒸馏水洗净,凉干留用。
2019/12/31
一、荧光分析法
物质的基态分子受一激发光源的照 射,被激发至激发态后,在返回基态时, 发射出与吸收光波长相等或较长的荧光。 若物质分子用X射线或红外光激发,则分 别产生X射线荧光或外光荧光。
2019/12/31
一、荧光分析法
通常所指的分子荧光是指紫外-可见光 荧光,即利用某些物质受到紫外光照射后, 发射出比吸收的紫外光波长相等或更长的 紫外荧光或可见荧光,通过测定物质分子 产生的荧光强度进行分析的方法称为荧光 分析。
2019/12/31
七、荧光分光度计的性能
可检测荧光、磷光及生物发光 扫描速度快,可达24000 nm/分,数据采
集速率达80次/秒 波长范围:190-1100 nm 光谱带宽:1.5、2.5、5、10和20 nm五档
切换 具有液体池和固体池,并具有自动控温设备。
2019/12/31
5、罩上仪器罩,打扫室内卫生,并在仪器使用登 记本上填写使用记录。
2019/12/31
操作软件包
2019/12/31
定性分析操作
2019/12/31
预扫描
2019/12/31
2019/12/31
第三章 分子荧光光度法
测器,检测方向与激发光成直角。
由光源发射的光经激发单色器得到所需的激发波 透光强度为I;荧光物质被激发后,发射荧光F。 为消除入射光的影响,荧光测量通常在与激发光 成直角的方向上进行。
长I0,经样品池后,一部分光能被荧光物质吸收,
第二发射单色器的设置是为了消除可能共存的
其它光线的干扰,如散射光以及溶液中其它杂 质所发生的荧光,以获得所需要的荧光,让其 作用于检测器上,得到相应的电信号,经放大 后作记录。 §3-5 分子荧光光度法的特点及应用
一.荧光光度法的特点 1.灵敏度
与紫外—可见光度法比较,荧光法检测是在
黑背景下进行,所以其灵敏度要高出2∼4个
数量级,测定下限为0.1∼0.001g/mL。
2.选择性强
荧光法既能依据特征发射又能依据特征吸收
来检定物质。如某几个物质的发射光谱相
似,则可从激发光谱的差异来区分;而如果
它们的激发光谱相同,则可通过发射光谱将
激发光谱和荧光发射
光谱的特点:
(1)荧光发射光谱与激
发波长无关,如前所述,
无论引起物质激发的波
长是1还是2,但荧光
发射波长都为3。
这是由于分子吸收了不同能量的光子可由基 态激发到不同的电子激发能级而产生几个吸收
带;由于较高激发态可通过内转换及振动弛豫
回到第一激发态的几率很高,远远大于由高能
决定于第一电子激发态中各振动能级的分布状况;
三.荧光和分子结构的关系 产生荧光的分子必须具备下列条件: (一)物质分子必须具有与所照射的光辐射相同频
率的吸收结构,才能吸收激发光。
(二)吸收了与其本身特征频率相同的能量之后, 必须具有一定的荧光效率。 荧光效率也称为荧光量子产率,表示物质发 射荧光的本领,为发出荧光量子数和吸收激发 光量子数的比值。
荧光分光光度法测定多维葡萄糖粉中维生素B2的含量实验报告

荧光分光光度法测定多维葡萄糖粉中维生素B2的含量一.实验目的1.学习荧光分光光度法测定多维葡萄糖粉中维生素B2的分析原理。
2.掌握荧光分光光度计的操作技术和测定多维葡萄糖粉中维生素B2的方法。
二.实验原理1.荧光光度法原理(1)常温下,处于基态的分子吸收一定的紫外可见光的辐射能成为激发态 分子,激发态分子通过无辐射跃迁至第一激发态的最低振动能级,再以辐射跃迁的形式回到基态,发出比吸收光波长长的光而产生荧光。
在稀溶液中,荧光强度IF 与物质的浓度c 有以下的关系: bcI I F εφ0303.2=当实验条件一定时,荧光强度与荧光物质的浓度成线性关系: Kc I F =这是荧光光谱法定量分析的理论依据。
(2)荧光分析法的特点:a. 与紫外-可见分光度法比较,荧光分析法具有更高的灵敏度。
b. 选择性好。
荧光法既能依据发射光谱,又能依据吸收光谱来鉴定物质。
c. 所需试样量少、操作方法简便。
(3)荧光光谱激发光谱:固定测量波长(选最大发射波长),化合物发射的荧光强度与照射光波长的关系曲线。
激发光谱曲线的最高处,处于激发态的分子最多,荧光强度最大。
发射光谱:固定激发光波长(选最大激发波长), 化合物发射的荧光强度与发射光波长关系曲线。
固定发射光波长进行激发光波长扫描,找出最大激发光波长,然后固定激发光波长进行荧光发射波长扫描,找出最大荧光发射波长。
激发光波长和发射荧光波长的选择是本实验的关键。
(4)荧光分析仪器常用的荧光分析仪器由激发光源、单色器、液槽、检测器和显示记录器五部分构成,如下图所示:荧光分析仪器与分光光度计比较主要差别有两点: a.荧光分析仪器采用垂直测量方式,以消除透射光的影响;b.荧光分析仪器有两个单色器,能够获得单色性较好的激发光并消除其它杂 散光干扰。
2. 荧光光度法测定多维葡萄糖粉中维生素B2的含量维生素B 2(又叫核黄素,VB 2)是橘黄色无臭的针状结晶,其结构式为:H HO HO HO HNH H HOHNC NHNOOH 3CH 3C维生素B 2易溶于水而不溶于乙醚等有机溶剂,在中性或酸性溶液中稳定,光照易分解,对热稳定。
分子荧光法测定蒽

分子荧光法测定蒽一、 实验目的1. 掌握荧光光度分析法的基本原理和方法以及荧光激发光谱和发射光谱的关系;2. 掌握荧光光谱仪的基本组成及使用方法;3. 掌握荧光光谱定量分析的基本方法。
二、 实验原理处于基态的荧光物质分子吸收与其对应的特征电子能级相一致的光能后,将跃迁到能量较高的电子激发态。
处于较高电子激发态的分子,经振动弛豫、内转换等非辐射方式跃迁到单重激发态的最低振动能级,然后在10-9~10-7s 的短时间内发射光子返回基态,产生分子的荧光发射光谱。
每种荧光物质都具有特征的荧光激发光谱和荧光发射光谱,通常荧光发射光谱和它的激发光谱呈镜像对称关系。
对同一物质的稀溶液而言,荧光强度I f 与该物质的浓度c 有如下关系:lc I I f εϕ0f 303.2=当入射光强度I 0和吸光光程l 一定时,上式可简写为:Kc I =f 。
式中K 为常数。
因此,在低浓度下,荧光物质的荧光强度与浓度成线性关系,可利用标准曲线法对低浓度荧光物质进行定量分析。
三、 仪器与试剂仪器:荧光分光光度计(光谱仪)。
容量瓶若干。
试剂:10 mg·L -1蒽标准储备液。
四、 实验步骤1. 测量溶液的配制准确移取10 mg·L -1蒽标准储备液0.5、1、1.5、2和2.5mL 于5个50mL 容量瓶中,分别加入无水乙醇稀释至刻度,所得溶液浓度分别为0.1、0.2、0.3、0.4和0.5 mg·L -1。
2. 激发光谱和发射光谱的绘制开启仪器,预热10分钟,预扫描确定最佳激发波长和发射波长,在最佳发射波长下绘制激发光谱;在最佳激发波长下绘制发射光谱。
改变不同的激发光波长,观察激发光波长对荧光发射光谱的影响。
3. 不同浓度下荧光光谱的绘制分别对浓度为1.00、2.00、3.00、4.00和5.00 mg·L -1的蒽的无水乙醇溶液扫描荧光光谱,并进行比较,观察浓度对荧光光谱的影响。
4. 蒽样品的定量分析(1)标准系列溶液荧光强度的测定分别由稀到浓测定浓度为0.1、0.2、0.3、0.4和0.5 mg·L -1的蒽的无水乙醇溶液的荧光强度。
荧光分光光度法

荧光分光光度计的结构与操作
1 2 3
荧光分光光度计的结构
荧光分光光度计由光源、单色器、样品池、检测 器等部分组成,各部分协同工作完成荧光光谱的 测量。
荧光分光光度计的操作步骤
操作步骤包括样品准备、仪器调试、参数设置、 数据采集与分析等,操作时应严格按照仪器说明 书进行。
荧光分光光度计的维护与保养
为了保持仪器的性能和延长使用寿命,应定期对 仪器进行维护和保养,如清洁光学元件、检查电 路连接等。
荧光分光光度法
目录
CONTENTS
• 荧光分光光度法简介 • 荧光分光光度法的基本原理 • 荧光分光光度法的实验技术 • 荧光分光光度法的应用实例 • 荧光分光光度法的挑战与展望
01 荧光分光光度法简介
CHAPTER
定义与原理
定义
荧光分光光度法是一种基于荧光物质与激发光的相互作用, 通过测量荧光光谱来研究荧光物质性质的分析方法。
利用荧光染料标记DNA或RNA,通过 荧光光谱法检测基因表达和突变,以 及DNA和RNA的定量分析。
在环境监测领域的应用
污染物检测
荧光分光光度法可用于检测水体、土壤和空气中的有 害物质,如重金属、农药、酚类化合物等。
饮用水安全
通过荧光光谱法检测饮用水中的消毒副产物,确保饮 用水安全。
生态毒理学研究
荧光光谱的定量分析方法
荧光光谱的定量分析原理
荧光光谱的定量分析基于荧光物质浓度与荧 光强度之间的线性关系,通过测量荧光强度 可以推算出荧光物质的浓度。
荧光光谱的定量分析方法
定量分析方法包括标准曲线法、内标法、外标法等 ,应根据实验需求选择合适的分析方法。
荧光光谱的定量分析误差 来源
误差来源包括仪器误差、样品不均匀性、操 作误差等,应采取相应措施减小误差,提高 分析精度。
现代生物仪器分析第三章 分子荧光光谱法

第二节 荧光分析的原理
(一)荧光发生机理 物质的基态分子受一激发光源的照射, 被激发至激发态,在返回基态时,产生 波长与入射光相同或较长的荧光。 通过测定物质分子产生的荧光强度进行
分 析 的 方 法 称 为 荧 光 分 析 (fluorescence analysis)。
1、分子的激发态
荧光和磷光这两种光致发光过程的机理不同, 可从实验观察激发态分子寿命的长短来加以区 别: 对于荧光来说,当激发光停止照射后,发光 过程几乎立即停止(在10-9~10-6秒,荧光寿 命fluorescence life time )。 磷光则将持续一段时间(在10-3~10秒)。
荧光分析法发展简史
2、分子荧光和磷光的产生
分子在室温时基本上处于电子能级的基态。当吸 收了紫外—可见光后,基态分子中的电子只能跃 迁到激发单线态的各个不同振动—转动能级,根 据自旋禁阻规律,不能直接跃迁到激发三重态的 各个振--转能级。 处于激发态的分子是不稳定的,它可能通过辐射 跃迁和无辐射跃迁等分子内的去活化过程释放多 余的能量而返回至基态,发射荧光是其中的一条 途径。
世界上第一次记录荧光现象是16世纪 西班牙的内科医生和植物学家 N.Monardes。 1575年他提出在含有一种木头切片的 水溶液中,可观察到极可爱的天蓝色。
1852年,stokes在考察奎宁和叶绿素的 荧光时,用分光光度计观察到其荧光的 波长比入射光的波长稍微长些,从而导 入了荧光是光发射的概念。 18工作。应用铝—桑色素配 合物的荧光进行铝的测定。 19世纪以前,荧光的观察是靠肉眼进行 的,直到1928年,才由Jette和West完成 了第一台荧光计。
激发单重态与激发三重态的性质不同
分子发光分析

荧光强度和荧光光谱不同
26
27
3、荧光猝灭
定义:荧光物质分子与溶剂分子或其它溶质分子
的相互作用引起荧光强度降低的现象 碰撞猝灭荧激光发分单子重以态无的辐荧射光跃分迁子的与方猝式灭回剂到分基子态相碰撞
静态猝灭 荧光物质分子与猝灭剂分子生成非荧光
的络合物
类型 转入三重态的猝灭 溶解氧与荧光物质 发生电子转移反应的猝灭 猝灭剂与荧光物质
2. 荧光与有机化合物结构的关系 (1)跃迁类型
实验证明,对于大多数荧光物质,首先经历 激发,然后经过振动弛豫或其他无辐射 跃迁,再发生 跃迁而得到荧光。 (2)共轭效应 实验证明,容易实现激发 的芳香族化合物 容易发生荧光,增加体系的共轭度荧光效率一般 也将增大,主要是由于增大荧光物质的摩尔吸光 系数,有利于产生更多的激发态分子
4
2.分子内的光物理过程
其中S0、S1和S2分别表示分子的基态、第一和第二电子激发的单重态
T1和T2则分别表示分子的第一和第二电子激发的三重态。
V=0、1、2、3、…表示基态和激发态的振动能级。
5
非辐射能量传递过程;
S1
S2
T1
S0 吸光1
吸光2
振动弛豫:
在同一电子能级 中,电子由高振 动能级转至低振 动能级,而将多 余的能量以热 的
1.如何获得较强的磷光
磷光发射:电子由第一激发三重态的最低振动能级
→基态, T1 → S0跃迁;
电子由S0进入T1的可能过程:( S0 → T1禁阻跃迁)
增加试样的刚性:
低温冷冻
固体磷光法:
吸附于固相载体(滤纸)
分子缔合物的形成:
加入表面活性剂等
重原子效应:
加入含重原子的物质,如银盐等
紫外可见分光光度法与分子荧光光度法的比较

紫外可见分光光度法与分子荧光光度法的比较定义:紫外可见分光光度法:根据被测量物质分子对紫外-可见波段范围(150~800纳米)单色辐射的吸收或反射强度来进行物质的定性、定量或结构分析的一种方法;分子荧光光度法:利用物质吸收较短波长的光能后发射较长波长特征光谱的性质,对物质定性或定量分析的方法。
可以从发射光谱或激发光谱进行分析。
组成部件:紫外可见分光光度法:①辐射源。
必须具有稳定的、有足够输出功率的、能提供仪器使用波段的连续光谱,如钨灯、卤钨灯(波长范围350~2500纳米),氘灯或氢灯(180~460纳米),或可调谐染料激光光源等。
②单色器。
它由入射、出射狭缝、透镜系统和色散元件(棱镜或光栅)组成,是用以产生高纯度单色光束的装置,其功能包括将光源产生的复合光分解为单色光和分出所需的单色光束。
③试样容器,又称吸收池。
供盛放试液进行吸光度测量之用,分为石英池和玻璃池两种,前者适用于紫外到可见区,后者只适用于可见区。
容器的光程一般为 0.5~10厘米。
④检测器,又称光电转换器。
常用的有光电管或光电倍增管。
⑤显示装置。
这部分装置发展较快。
较高级的光度计,常备有微处理机、荧光屏显示和记录仪等,可将图谱、数据和操作条件都显示出来。
分子荧光光度法:激发光源、单色器、样品池、检测器和记录显示部分。
1. 光源能发射紫外到可见区波长的光、强度大、稳定。
常用的有溴钨灯、高压汞灯、氙灯。
2. 单色器,两个单色器。
3. 样品池通常用石英制成。
4. 检测器:光电倍增管。
常见类型:紫外可见分光光度法:1.单光束。
简单,价廉,适于在给定波长处测量吸光度或透光度,一般不能作全波段光谱扫描,要求光源和检测器具有很高的稳定性。
2.双光束自动记录,快速全波段扫描。
可消除光源不稳定、检测器灵敏度变化等因素的影响,特别适合于结构分析。
仪器复杂,价格较高。
3.双波长。
将不同波长的两束单色光(λ、λ1 ) 快束交替通过同一吸收池而后到达检测器。
荧光分光光度计(分子荧光)

荧光分光光度计(分子荧光)Fluores_cence •1楼1、基本原理在室温下分子大都处在基态的最低振动能级,当受到光的照射时,便吸收与它的特征频率相一致的光线,其中某些电子由原来的基态能级跃迁到第一电子激发态或更高电子激发态中的各个不同振动能级,这就是在分光光度法中所述的吸光现象。
跃迁到较高能级的分子,很快通过振动弛豫、内转换等方式释放能量后下降到第一电子激发态的最低振动能级,能量的这种转移形式,称为无辐射跃迁。
再由第一电子激发态的最低振动能级下降到基态的任何振动能级,并以光的形式放出它们所吸收的能量,这种光便称为荧光。
荧光分析法具有灵敏度高、选择性强、需样量少和方法简便等优点,它的测定下限通常比分光光度法低2~4个数量级,在生化分析中的应用较广泛。
荧光分析法是测定物质吸收了一定频率的光以后,物质本身所发射的光的强度。
物质吸收的光,称为激发光;物质受激后所发射的光,称为发射光或荧光。
如果将激发光用单色器分光后,连续测定相应的荧光的强度所得到的曲线,称为该荧光物质的激发光谱(ex citation spectrum)。
实际上荧光物质的激发光谱就是它的吸收光谱。
在激发光谱中最大吸收处的波长处,固定波长和强度,检测物质所发射的荧光的波长和强度,所得到的曲线称为该物质的荧光发射光谱,简称荧光光谱(fluorescence spectrum)。
在建立荧光分析法时,需根据荧光光谱来选择适当的测定波长。
激发光谱和荧光光谱是荧光物质定性的依据。
某些物质的分子能吸收能量而发射出荧光,根据荧光的光谱和荧光强度,对物质进行定性或定量的方法,称为荧光分析法(fluoresc ence analysis)。
对于某一荧光物质的稀溶液,在一定波长和一定强度的入射光照射下,当液层的厚度不变时,所发生的荧光强度和该溶液的浓度成正比,这是荧光定量分析的基础。
2、检测荧光的仪器测定荧光可用荧光计和荧光分光光度计,其二者的结构复杂程度不同,但其基本结构是相似的。
分子荧光光谱法(原理和方法)

概述
分子荧光光谱法(Molecular fluorescence spectroscopy )又称
为荧光光谱法或荧光分析法.是以物质所发射的荧光强度 与浓度之间的线性关系为依据进行的定量分析,以荧光光 谱的形状和荧光峰对应的波长进行行的定性分析.
荧光团杂化纳米二氧化硅微球
化合物
C6H5OH C6H5O— C6H5NH2
+ C6H5NH3
相对荧光 强度 18 10 20
0
荧光分光光度计
荧光分光光度计既可用于定量分析, 也可用于测绘激发光谱和荧光光谱
。荧光分光光度计既可用于定 量分析,也可用于测绘激发光谱 和荧光光谱。第一单色器选择激 发光波长(>250nm的 紫外光)故称为激发单色器 第二单色器(荧光单色器) 与激发光入射方向垂直, 并选择荧光波长,可提高方法的选择性和准确度。
1. 激发
在室温下物质分子大部分处于基态的最低振动能级且电子自旋配对为单重
态.当吸收一定频率的电磁辐射发生能级跃迁时,可上升到不同激发态
的各振动能级,其中多数分子上升至第一激发单重态这一过程约需10-
15秒.
激发
2 去活化过程
激发态分子的失活: 激发态分子不稳定,它要以辐射 或无辐射跃迁的方式回到基态
对于很稀的溶液,投射到样品溶液上的被吸收的激发光不到2%时, 即εbc<=0.05时,上式的第二项后的各项可以忽略不计。则
F = φI0[1-(1-2.303 εbc)]=2.303 φ I0 εbc
当I0一定时 并且浓度C很小时,荧光强度与荧光物质浓度成正比
F = K·C
(K = 2.303 φ I0 εb)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
400
450
500 nm
蒽的激发光谱和荧光光谱
三、物质分子结构与荧光的关系
(一)荧光效率(φf) 激发态分子中以发射荧光的光量子数目和 分子吸收激发光的光量子总数之比:
φf =
发射荧光的光量子数目 吸收激发光的光量子总数
[ φf∈(0,1)]
激发态的分子有几种途径可以回到基态, 荧光去 激发比其它去激发快 ,才可以观 察到荧光发射。
(二) 荧光和磷光的产生 激发态分子在极短的时间内回到 去活化过程: 基态的过程 。
无辐射跃迁
途径 体系跨越 -----最常见 辐射跃迁
1. 无辐射跃迁
振动驰豫 内转换 体系跨越 外转换
① 振动驰豫 较高能级分子与其它分子(样品或溶剂) 碰撞,能量变为热能。 ② 内转换和体系跨越 当两个相邻电子能级相距较近以致其振 动能级重叠,电子由较高电子能级以无辐射 跃迁方式至低一级电子能级,称为内转换。
(3)镜像规则 通常荧光发射光谱与它的吸收光谱(与 激发光谱形状一样)成镜像对称关系。 镜像规则的解释:
基态上的各 振动能级分布 与第一激发态 上的各振动能 级分布类似。
基态上的零振动能级与第一激发态的二 振动能级之间的跃迁几率最大,相反跃迁也 然。
荧光激发光谱
荧光发射光谱
200
250
300
350
620
3.激发光谱与发射光谱的关系 (1)Stokes位移 激发光谱与发射光谱之间的波长差值。 发射光谱的波长比激发光谱的长,振动弛豫 消耗了能量。 (2)发射光谱的形状与激发波长无关 电子跃迁到不同激发态能级,吸收不同 波长的能量(如能级图 2 , 1),产生不同 吸收带,但均回到第一激发单重态的最低振 动能级再跃迁回到基态,产生波长一定的荧 光(如’2 )。
电子由激发单重态向激发三重态(S1*→T1*) 的无辐射跃迁称为体系跨越。
内转换
S2*→S1*
T2*→T1*
体系跨越 S1*→T1*
③ 外转换 受激分子与溶剂或其它溶质分子间的相 互作用和能量转移。
外转换使分子的荧光或磷光减弱甚至消 失,这一现象称为“熄灭”或“淬灭”。 2. 辐射跃迁 ---- 荧光和磷光
荧光效率越大, 分子产生荧光的能力越大。
分子产生荧光必须具备的条件: (1)具有合适的结构(共轭刚性平面结构) (2)具有一定的荧光量子产率
(二)分子结构与荧光
1. 跃迁类型
* → 的荧光效率高,系间跨越过 程的速率常数小,有利于荧光的产生。
2. 长共轭效应
提高共轭程度有利于增加荧光效率 并产生红移。
- 共轭程度 ↗, φf ↗ , 荧光强度↗,λ
↗。
H3C CH3 CH3 CH3 CH 2OCOCH 3
CH3
维生素A
当激发光波长为 λex 327nm时,产生的 荧光为λem 510 nm。
3. 分子的刚性和共平面性 刚性 ↗
荧光物质分子
共轭程度 ↗
共平面性 ↗ 荧光效率↗
可降低分子振动,减少与溶剂的相互作用, 故具有很强的荧光。如荧光素和酚酞有相似结 构,荧光素有很强的荧光,酚酞却没有。
基态单重态(S0) 3) 处于基态单重态的电子对,其中一个电 子被激发到某一较高能级时,受激电子 的自旋仍然与处于基态的电子配对,称 为激发单重态(S) 激发单重态(S)
4) 处于基态单重态的电子对,其中一个电 子被激发到某一较高能级时,两个电子 的自旋相互平行,称为激发三重态(T)
激发三重态(T) 激发单重态的平均寿命大约10-8s,而激发 三重态的平均寿命大10-4~1s以上; 由基态单重态向激发三重态跃迁(S0→T*) 属于禁阻跃迁,而由基态单重态跃迁到激发 单重态( S0→S*)是允许跃迁。
(3) 溶液的pH值 弱酸或弱碱性化合物,溶液pH的影响较 大,需要严格控制。
NH 3
+
OHH+ pH 7--12
NH2
OHH
+
NH -
pH < 2
pH > 13
无荧光
蓝色荧光
无荧光
(4) 荧光熄灭剂
与荧光物质分子发生相互作用引起荧光 熄灭的物质。 如:X- 、重金属离子、O2、-NO2、 重氮化合物、-COOH、等。 自熄灭 待测物浓度过大时,会发生分子间碰 撞,使荧光强度减弱,称为自熄灭。
激发光谱曲线的最高处,处于激发态的
分子最多,荧光强度最大。
2.荧光光谱(或磷光光谱) 固定激发光波长 (选最大激发波长), 化合物发射的荧光(
或磷光强度)与发射
光波长关系曲线(图
中曲线II或III)。
荧光发射光谱 荧光激发光谱
磷光光谱
200
260 320 380 440 500 560 室温下菲的乙醇溶液荧(磷)光光谱
内转换 振动驰豫 无辐射跃迁
S2
S1
体系跨越
T1
外转换
S0
吸收λ1 吸收λ2 荧光λ 3 磷光λ 4
二、激发光谱与荧光光谱
1.荧光(磷光)的激发光谱曲线
测定荧光(磷光)强度的仪器装置示意图 固定测量波长(选最大发射波长),化合 物发射的荧光(磷光)强度与照射光波长的关 系曲线 (图中曲线I ) 。
处于电子激发态的分子(S1*或 T1*)通过
光发射回到电子基态,称为辐射跃迁。
S1* → S0 T1* → S0 ---- 荧光 ---- 磷光
讨论:
① ES1* S0 ET1* S0
② λ荧<λ磷
③ 强度 F 磷 < F 荧
④ τ 荧 = 10-6 ~10-9 s , τ磷 = 10-4 ~ x s
基本原理
Principles 一、分子荧光的发生过程 (一)分子的能级与电子能级的多重性
ቤተ መጻሕፍቲ ባይዱ
1. 分子的能级跃迁
① 每个分子具有严格分立的能级。
② 基态分子吸收了特征频率能量后,从低能
级向高能级跃迁,即处于不同的激发态。
Ej hv ΔE = Ej – Ei = hv
Ei
2. 分子的激发态 1)基态时,电子在各原子或分子轨道中成 对存在。在某一给定轨道中的两个电子 具有相反的自旋(自旋配对)。 2)所有电子自旋都配对的分子电子态叫基 态单重态(S0)
4. 取代基效应 芳环上有推电子基,使荧光 ↗ 。 芳环上有吸电子基,使荧光 ↘。
推电子基: —OH、 —NH2、 —NR2等
吸电子基: —NO2、 —COOH等
引入高原子序数原子(Br、I) 到 π 电
子体系,荧光减弱,磷光增强。
四、影响荧光的外界因素 (1) 温度的影响 荧光强度对温度变化敏感,温度增加, 外转换去活的几率增加,荧光效率↘ 。 (2) 溶剂的影响 除一般溶剂效应外,溶剂的极性、氢键、 配位键的形成都将使化合物的荧光发生变化。 极性↗,荧光↗。 重原子溶剂(CBr4、C2H5I),荧光 ↘。
