2020届高考化学总复习提升方案——分布系数图和溶液中粒子浓度关系
第33讲-粒子浓度关系曲线之分布系数图像(学案)
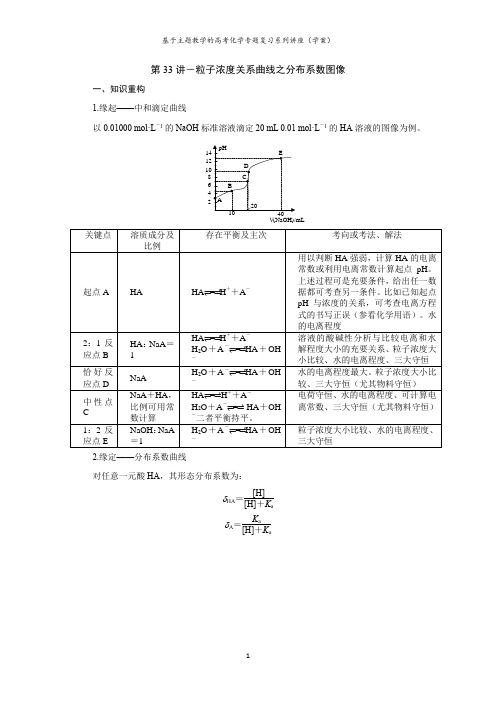
第33讲-粒子浓度关系曲线之分布系数图像一、知识重构1.缘起——中和滴定曲线以0.01000 mol·L-1的NaOH标准溶液滴定20 mL 0.01 mol·L-1的HA溶液的图像为例。
V(NaOH)/mL2.缘定——分布系数曲线对任意一元酸HA,其形态分布系数为:δHA=[H] [H]+K aδA=K a [H]+K a2.743.744.745.746.740.250.500.751.00pHδHA cA c -HAc 和Ac -的分布分数与溶液pH 的关系对任意一元碱BOH ,其形态分布系数为:δBOH =[OH][OH]+K b =K w K bK wK b+[H]δB =K b [OH]+K b =[H]K wK b+[H]对任意二元酸H 2A ,其形态分布系数为:δH2A =[H]2[H]2+K a1[H]+K a1K a2δHA =K a1[H][H]2+K a1[H]+K a1K a2δA =K a1K a2[H]2+K a1[H]+K a1K a20.250.500.751.00246pHδH 2C 2O 4HC 2O 4-C 2O 42-草酸三种形式的分布分数与pH 的关系二、重温经典1.(2020年全国卷II 第26题)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ与pH 的关系如图(b)所示。
[δ(X)=c (X)c (HClO)+c (ClO -),X 为HClO 或ClO −]HClO 的电离常数K a 值为__________。
10080604020 5 6 7 8 9 10ApH δ(%)HClO ClO¯图(b)1.【答案】10-7.5【解析】取图像(b )中两条曲线的交点,pH =7.5,c(HClO)=c(ClO -),代入K a =10-7.5。
2.(2020年海南卷第12题)某弱酸HA 溶液中主要成分的分布分数随pH 的变化如图所示。
2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第29讲溶液中“粒子”浓度关系课件

与NaCl,④CH3COONa与NaHCO3,⑤CH3COONa与NaHSO3。下列各
项排序正确的是(
)
A.pH:②>④>⑤>③>①
B.c(CH3COOH):①>③>⑤>④>②
C.c(CH3COO-):②>③>④>⑤>①
+
3+
+
C.0.1 mol·L-1明矾溶液:c(SO2−
4 )>c(K )>c(Al )>c(H )>c(OH
-)
D . 0.1 mol·L - 1 的 NaHCO3 溶 液 : c(Na + ) = c(HCO−
3 )+c(H CO3 )
2
+2c(CO2−
)
3
答案:C
题组二 混合溶液中微粒浓度大小比较
②消去没有参与变化的K+得质子守恒式:c(H+)+c(H2S)=c(OH-)+
c(S2-)。
对点题组训练
题组一 单一溶液中的粒子浓度关系
1.HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1NaA溶液中,
离子浓度关系正确的是(
)
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
答案:A
4.室温下,取20 mL 0.1 mol·L-1某二元酸H2A,滴加0.2 mol·L-1
NaOH溶液。已知:
H2A===H++HA-,HA-⇌H++A2-。
下列说法不正确的是(
)
A.0.1 mol·L-1 H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1
B.当滴加至中性时,溶液中c(Na + )=c(HA - )+2c(A2 - ),用去
2020届高考化学专题复习——第十七辑结合图像判断溶液中粒子浓度的变化

2020届高考化学专题复习——第十五辑结合图像判断溶液中粒子浓度的变化■高考必备结合图像分析电离平衡、水解平衡、溶解平衡,判断离子浓度的关系是全国卷考查的重点,常考图像类型总结如下:1.一强一弱溶液的稀释图像(1)相同体积、相同浓度的盐酸、醋酸加水稀释相同的倍数,醋酸的pH大加水稀释到相同的pH,盐酸加入的水多(2)相同体积、相同pH值的盐酸、醋酸加水稀释相同的倍数,盐酸的pH大加水稀释到相同的pH,醋酸加入的水多(3)pH与稀释倍数的线性关系(1) H Y 为强酸、HX 为弱酸(2) a 、b 两点的溶液中:c(X 「) = c(Y 「)(3) 水的电离程度:d>c>a=b(1) M OH 为强碱、ROH 为弱碱(2) c (ROH)>c(MOH)(3) 水的电离程度:a>b2.Kw 和Ksp 曲线⑴双曲线型不同温度下水溶液中c(H 。
与c(OH 「)的变化曲线常温下,CaSO 4在水中的沉淀溶解平衡曲线区 p =9x 10「6]cCOH-ymolL-1«线,10____1 1 〜10-7 10-6 c(H+)/mol LT约J-T4 x KT 'c(SO ;)/molL-i(1)A 、C 、B 三点均为中性,温度依次升高,电依次增大(l)a 、c 点在曲线上,a-c 的变化为增大 c(SO 「),如加入Na 2SO 4固体,但&p 不变(2)D 点为酸性溶液,E 点为碱性溶液,K w =1X10T4(2)b 点在曲线的上方,Q>Ksp ,将会有沉淀生成(3)AB 直线的左上方均为碱性溶液,任意一(3)d 点在曲线的下方,Q<Ksp,则为不饱和点:c(H +)<c(OH )溶液,还能继续溶解CaSO 4(2)直线型(pM —pR 曲线)pM 为阳离子浓度的负对数,pR 为阴离子浓度的负对数①直线AB 上的点:c(M2+) = c(R2「);② 溶度积:CaSO4>CaCO3>MnCC)3;③ X 点对CaSCU 要析出沉淀,对CaCO 3是不饱和溶液,能继续溶解CaCO 3:④Y 点:c(S0?)>c(Ca2+),二者的浓度积等lOf Z 点:c(CC)T)<c(Mn2+),二者的浓度积]0-10.63.酸碱中和滴定氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点局突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下pH = 7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不是pH = 7(强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<7)4.分布系数图及分析[分布曲线是指以pH 为横坐标、分布系数(即组分的平衡浓度占总浓度的 分数)为纵坐标的关系曲线]随着pH 增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。
2024年新人教版高考化学一轮复习讲义(新高考版) 第9章 第55讲 溶液中“粒子”浓度关系

(4)室温下,将浓度均为 0.10 mol·L-1 的 H2C2O4 和 NaHC2O4 溶液等体积混合(pH= 1.68,H2C2O4 为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2O24-)+c(OH-) 答案 √ (5)0.1 mol·L-1Na2C2O4 溶液与 0.1 mol·L-1HCl 溶液等体积混合(H2C2O4 为二元弱酸): 2c(C2O24-)+c(HC2O- 4 )+c(OH-)=c(Na+)+c(H+)
归纳 总结
(3)质子守恒 电解质溶液中,由于电离、水解等过程的发生,往往存在质子(H+)的转 移,转移过程中质子数量保持不变,称为质子守恒。 质子守恒的书写技巧: ①正盐溶液,用水溶液中得失质子相等比较简便。如Na2S水溶液中的质 子转移情况图示如右: 由图可得Na2S水溶液中质子守恒式: c(H+)+2c(H2S)+c(HS-)=c(OH-)
(二)巧用“三个守恒”,明确浓度关系
写出下列溶液中粒子守恒关系式
(1)Na2CO3溶液 ①元素质量守恒:_c_(_N__a+__)=__2_[_c_(_C_O_23_-_)_+__c_(H__C_O_- 3_)_+__c_(_H_2_C_O__3)_]__。 ②电荷守恒:_c_(_N_a_+_)_+__c_(_H_+_)_=__c_(_H_C_O__- 3_)+__c_(_O_H__-_)_+__2_c_(C__O_23_-_)__。 ③质子守恒:_c_(_O_H_-__)=__c_(_H_+__)+__2_c_(_H_2_C_O__3)_+__c_(_H_C_O__- 3_)___。
(4)0.2 mol·L-1 NH4HCO3 溶液(pH>7):c(NH+ 4 )>c(H2CO3)>c(HCO- 3 )>c(NH3·H2O) 答案 × c(NH+4 )>c(HCO-3 )>c(H2CO3)>c(NH3·H2O) (5)室温下,0.1 mol·L-1 NH4Fe(SO4)2 溶液中存在:c(NH+4 )+3c(Fe3+)>2c(SO24-) 答案 × c(NH+4 )+3c(Fe3+)<2c(SO24-)
高考化学总复习之溶液中的微粒浓度关系(共21页PPT)(共21张PPT)

HCO3– + OH– HCO3–+ H2O H2CO3 + OH–
∴ c(Na+ ) = 2 [c(CO32–) + c(HCO3–) + c(H2CO3) ]
∴ c(OH– ) = c(H+)+ c(HCO3–) + 2c(H2CO3)
真题选6 (2019年江苏高考 14题 C),判断是否正确 C. 0.2mol·L−1氨水和0.2mol·L−1NH4HCO3溶液等体积混合:
c(NH3·H2O)+c(CO3 2− )+c(OH−) = 0.3mol·L−1+ c(H2CO3)+c(H+)
c(H2CO3)+c(HCO3-)+c(CO32-)= 0.1 mol·L−1 3c(H2CO3)+3c(HCO3-)+3c(CO32-)= 0.3mol·L−1 ——① c(NH4+)+c(NH3∙H2O) = 4[c(H2CO3)+c(HCO3-)+c(CO32-)] c(NH4+)+c(H+) = c(HCO3-)+2c(CO32-)+c(OH-)
溶质:NaHC2O4
水解平衡:HC2O4-+H2O
H2C2O4+ OH-
Kh =
=
=
=1.85 10-13
HC2O4-电离平衡: Ka2 =5.4×10−5
真题选3. (2019年江苏高考14题 B)
B √.0.2mol·L−1NH4 HCO3溶液 (pH > 7)
c(NH4+) > c(HCO3 −)> c(H2CO3) > c(NH3·H2O)
2020届北京高三化学“粒子”浓度关系判断提升学生的模型认知素养

2020届北京高三化学 “粒子”浓度关系判断 提升学生的模型认知素养素养说明:“粒子”浓度关系判断是高考中的必考点。
近年来常以弱酸、弱碱及二元弱酸为素 材,创设情境,通过表、图等形式展现。
通过电离平衡,水解平衡两大理论基点,结合三大守 恒规律、两主判断数学建模突破问题的关键点,从而提升学生的模型认知素养。
1 •解读“二”问题一一三种守恒规律 (1)电荷守恒 ——溶液呈电中性要点一一阴、阳离子要找全,离子所带电荷数目要弄清 如NaHCO 3溶液J c(Na +) + c(H +) = c(OH 一) + c(HCO 3) + 2(C O 3_)易错点:CO 2_前的系数2为CO 3-所带电荷数目(2)物料守恒一一由于电离或水解,粒子的种类发生变化,但变化前后元素的原子个数守恒。
要点一一化学式关系要明确,相关微粒要找全,溶液体积是否变化要弄清。
如 0.1 mol •—1 Na 2CO 3 溶液中 c(Na) = 2c(CO 3—)总水解后相关微粒为 CO 3_、HCO 3、H 2CO 3? C (HCO 3)+ C (H 2CO 3) + C (co 3_)= ?c(Na +)易错点:①N&CO 3溶液中物料守恒式中,“2表示c(Na +)为含碳元素微粒浓度和的2倍 ②以具体浓度值表达物料守恒式时要注意溶液体积是否变化。
⑶质子守恒一一水电离出的c(H +)与c(OH 「)相等①Na 2S 溶液②NaHCO 3溶液较复杂,可通过电荷守恒、物料守恒导出。
易错点:H +、OH 「的来源 2. 解读“〉、<”问题一一两弱、两主理论 电离理论(1) 弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶 液中:NH 3H 2O 、NH ;、OH -浓度的大小关系是 C (NH 3 H 2O)>C (OH _)>C (NH+)。
(2) 多元弱酸的电离是分步进行的,其主要是第一级电离 (第一步电离程度远大于第二步电离)阳离子Na 、H 阴离子 HCO 3、CO 2、OH =>c(OHH/IH S )+2r(H.S)如在H2S溶液中:H2S、HS「、S2-、H+的浓度大小关系是C(H2S)>C(H +)>C(HS「)>C(S2)水解理论(1)弱电解质离子的水解是微弱的(水解相互促进的情况除外),水解生成的微粒浓度很小,本身浓度减小的也很小,但由于水的电离,故水解后酸性溶液中c(H+)或碱性溶液中c(OH一)总是大于水解产生的弱电解质的浓度。
高中化学高考总复习 8.29 溶液中“粒子”浓度关系

题组强化训练·形成关键能力 题组一 单一溶液中的粒子浓度关系 1.HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1NaA溶液中, 离子浓度关系正确的是( ) A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+) C.c(Na+)+c(OH-)=c(A-)+c(H+) D.c(Na+)+c(H+)=c(A-)+c(OH-)
答案:A
答案:D
题组三 “多曲线”图像中微粒浓度的分析与比较 5.25 ℃时,用0.25 mol·L-1 NaOH溶液分别滴定同浓度的三种稀酸 溶液,滴定曲线如图所示。下列判断不正确的是( ) A.同浓度的稀酸中:c(A-)>c(B-)>c(D-) B.滴定至P点时,溶液中:c(B-)>c(HB) C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-) D.当中和百分数达到100%时,将三种溶液混合后:c(HA)+c(HB) +c(HD)=c(OH-)-2c(H+)
答案:A
解析:由电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因c(CH3COO -)>c(Na+),则c(H+)>c(OH-);由元素质量守恒:c(CH3COOH)+c(CH3COO-)= 0.2 mol·L - 1 , 因 c(CH3COO - ) > c(Na + ) = 0.1 mol·L - 1 , 则 c(CH3COO - ) > c(CH3COOH)。
4.室温下,取20 mL 0.1 mol·L-1某二元酸H2A,滴加0.2 mol·L-1 NaOH溶液。已知:H2A===H++HA-,HA-⇌H++A2-。
下列说法不正确的是( ) A.0.1 mol·L-1 H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1 B.当滴加至中性时 ,溶液中c(Na+)=c(HA-)+2c(A2-),用去 NaOH溶液的体积小于10 mL C.当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有 c(A2-)=c(H+)-c(OH-) D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA-) +2c(A2-)
高三二轮复习:溶液中粒子浓度的关系-高考化学二轮专题复习课件

C.c(CH3COO-):②>④>③>①
D.溶液中c(H+):①>③>②>④
解析:④中还存在能水解的HCO3-,故④的碱性强于③,A错误;由于④中两种阴离子水解相 互 抑 制 ,故水 解 生 成的醋 酸 分 子比 ③ 中 的 少,B错 ; ④ 中 CH3COO-浓度 比 ③中 的大 , ② 中 CH3COO-的水解受到NaOH的强烈抑制,使得溶液中CH3COO-的浓度最大,①中两种溶液混合 后恰好反应生成醋酸,醋酸为弱电解质,故其电离程度较小,溶液中CH3COO-的浓度最小,C正 确;②的溶液碱性最强,即②中c(H+)最小,D错误。
根据电荷守恒可知,浓度相等的两溶液中,阴、阳离子总浓度=2c(Na+)+2c(H+),由于水解程度:
NaX>NaY,则两溶液中c(H+)不同,故两溶液中离子总浓度不相等,故D错误。
2、(2020·衡水中学三调)常温下10 mL浓度均为0.1 mol·L-1的HX和HY两种一 元酸溶液加水稀释过程中的pH随溶液体积变化曲线如图所示。则下列说法不
【例3】将0.4 mol/LNH4Cl溶液和0.2 mol/LNaOH溶液等体积混合后,溶液中下列微粒的物
质的量关系正确的是:( D )
A 、c(NH4+)+ c(NH3·H2O) =2c(Na+)=0.4 mol/L B、 c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+) C、 c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O) >c(H+) D、 c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
2020届高三化学总复习热点专题突破05“粒子”浓度关系判断

2c(S2-
)
+
2c(HS
-
)+
2c(H转移情况图示如下:
由图可得
Na 2S 水溶液中质子守恒式:
+
-
-
+
c(H 3O )+ 2c(H2S)+ c(HS )= c(OH )或 c(H )+ 2c(H 2S)
+
c
(HS
-
)
=
c(OH
-
)
。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。
(4) 质子守恒: ______________________________________________________________ 。
【解析】
NaHCO
3
+
===Na
+
HCO
-
3
(完全电离
),
HCO -3 + H2 O
H
2CO
3+
OH
-
(主要
),
-
HCO 3
+
H
+
CO
2- 3
(
次要
)
,
+
4
+
Cl
-
(完全电离
)
NH
+
4
+
H
2O
+
NH 3·H 2O+ H (微弱 )
H 2O
H + + OH
-
(极微弱
)
【答案】
(1)Cl
-
、
NH
+
4
、
H
+
、
OH
-、
NH
3
·H
2O
、
H
2O
-
+
+
2020高考化学一轮复习7.5专题研究溶液中粒子浓度关系学案(含解析).doc

2020高考化学一轮复习7.5专题研究溶液中粒子浓度关系学案(含解析)第5课时专题研究溶液中粒子浓度关系判断电解质溶液中的粒子浓度关系是近几年高考的必考题型,一般在选择题中作为压轴题呈现。
因综合性强、难度大且常考常新,成为考生失分的重灾区。
要想攻克此难关,需巧妙利用平衡观念和守恒思想建立起等量关系,进行分析,比较即可。
1.电离平衡→建立电离过程是微弱的意识弱电解质弱酸、弱碱、水的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力。
如在稀醋酸溶液中存在-+H +,-+H+,溶液中粒子浓度由大到小的顺序cCH3COOH>cH+>cCH3COO->cOH-。
2.水解平衡→建立水解过程是微弱的意识弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。
如稀的CH3COONa溶液中存在CH3COONaCH3COO-+Na+,CH3COO-++OH-,++OH-,溶液中,cNa+>cCH3COO->cOH ->cCH3COOH>cH+。
1.等式关系1电荷守恒电解质溶液中所有阳离子所带正电荷总数与所有阴离子所带负电荷总数相等。
如NaHCO3溶液中电荷守恒cNa++cH+=cHCO+cOH-+2cCO。
2物料守恒电解质溶液中由于电离或水解因素,离子会发生变化变成其他离子或分子,但离子或分子中某种特定元素原子的总数不变。
如在NaHCO3溶液中,nNa∶nC=1∶1,推出cNa+=cHCO+cCO+cH2CO3。
3质子守恒质子守恒是指电解质溶液中的分子或离子得到或失去的质子的物质的量相等。
质子守恒也可根据电荷守恒和物料守恒联合求出。
如NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3·H2O、OH-、CO为失去质子后的产物,故有cH3O++cH2CO3=cNH3·H2O+cOH-+cCO。
[提醒] 电荷守恒式中不只是各离子浓度的简单相加如2cCO的化学计量数2代表一个CO带有2个负电荷,不可漏掉。
2020届高考化学总复习提升方案分布系数图和溶液中粒子浓度关系

2020届高考化学总复习提升方案——分布系数图及溶液中粒子浓度关系【考情分析】借助分布系数图判断电解质溶液中粒子浓度的关系,是高考常考题型,其中不同题考江苏化学14阶段粒子浓度关系的判断是近几年高考的热点和亮点。
如2018HNaOH溶液滴定查13卷过程中微粒的物质的量浓度关系;2017全国ⅠCO422题考查二元122017全国Ⅱ卷题考查二元酸与NaOH溶液反应过程中粒子关系;变化粒子关系等,该类题目的解题关键是正确判断溶液中溶质的成分及pH酸随其量的关系,以及离子的电离程度和水解程度的大小。
该题型一般综合性强、难度较大,能够很好考查学生的分析推理能力,复习备考中应特别关注。
奠定思维方向一、透析分布曲线为纵(即组分的平衡浓度占总浓度的分数)分布曲线是指以pH为横坐标、分布系数坐标的关系曲线。
一元弱酸(以CHCOOH为例)二元酸(以草酸HCO为例)4322-δδ分Oδ为HCOH为C分布系数、为COOH为CH分布系数,δ42024301122--COOCH分布系数布系数、δ分布系数OC为4322随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。
根据分布系数可以书写一定pH 时所发生反应的离子方程式的微粒分布系数和酸的分pH根据在一定条件下可以存在多种溶质微粒。
pH同一.时的平衡浓度pH析浓度,就可以计算各成分在该构建思维基点二、熟悉两大理论→建立电离过程是微弱的意识电离平衡1.的电离是微弱的,且水的电离能力远远小于弱酸和弱弱酸、弱碱、水)弱电解质(+-,CHCOOH+酸溶液中:CHCOOH如碱的电离能力。
在稀醋33+-COOH)>,在溶液中,粒子浓度由大到小的顺序:HOOH c+H(CH32-+-)。
c(OH c(CHCOO )c(H>)>32.水解平衡→建立水解过程是微弱的意识弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程-+-+COO,COONa===CHCOOCH+Na溶液中,度。
高中化学专题07 第13题 水溶液中的离子平衡(知识过关)-2020年高考化学二三轮复习题型大突破系
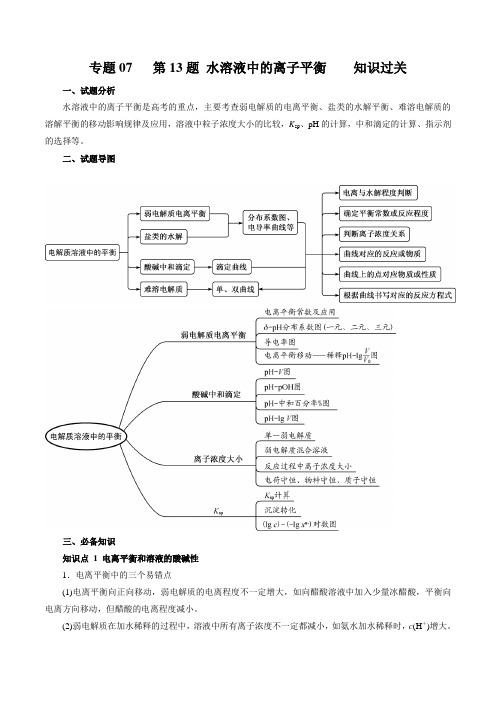
专题07 第13题水溶液中的离子平衡知识过关一、试题分析水溶液中的离子平衡是高考的重点,主要考查弱电解质的电离平衡、盐类的水解平衡、难溶电解质的溶解平衡的移动影响规律及应用,溶液中粒子浓度大小的比较,K sp、pH的计算,中和滴定的计算、指示剂的选择等。
二、试题导图三、必备知识知识点1 电离平衡和溶液的酸碱性1.电离平衡中的三个易错点(1)电离平衡向正向移动,弱电解质的电离程度不一定增大,如向醋酸溶液中加入少量冰醋酸,平衡向电离方向移动,但醋酸的电离程度减小。
(2)弱电解质在加水稀释的过程中,溶液中所有离子浓度不一定都减小,如氨水加水稀释时,c(H+)增大。
(3)由水电离出的c(H+)=1.0×10-13 mol·L-1的溶液不一定呈碱性。
2.水的电离和溶液的酸碱性(1)水的电离①任何条件下,水电离出的c(H+)=c(OH-);常温下,离子积常数K W=1.0×10-14。
②酸、碱抑制水的电离,能水解的正盐、活泼金属(如Na)则促进水的电离。
(2)溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
①当电离能力大于水解能力时,如何判断溶液酸碱性举例:a.CH3COOH的电离程度大于CH3COO-的水解程度,所以等浓度的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性;b.NH3·H2O的电离程度大于NH+4的水解程度,等浓度的NH3·H2O和NH4Cl溶液等体积混合后溶液显碱性。
②当水解能力大于电离能力时,如何判断溶液酸碱性举例:HClO的电离程度小于ClO-的水解程度,所以等浓度的HClO与NaClO溶液等体积混合后溶液显碱性。
③酸式盐溶液的酸碱性主要取决于酸式酸根的电离能力和水解能力哪一个更强。
如在NaHCO3溶液中,HCO-3的水解能力大于电离能力,故溶液显碱性;而在NaHSO3溶液中,HSO-3的电离能力大于水解能力,故溶液显酸性。
新高考化学通用版总复习一轮课件模块2第六单元高考素能提升十一用守恒思想破解溶液中粒子浓度关系

c(OH-)>c(H2AsO- 4 )>c(AsO34-) C.向 H3AsO4 溶液滴加 NaOH 溶液至中性时 c(Na+)=
2c(HAsO24-)+3c(AsO34-) D.AsO34-第一步水解的平衡常数的数量级为 10-3
解析:根据反应量的关系,a 点恰好消耗完 H+,溶质为 (NH4)2SO4 与 Na2SO4,b、c、d 三点溶液均含有 NH3·H2O, (NH4)2SO4 可以促进水的电离,而 NH3·H2O 抑制水的电离,b 点溶液呈中性,所以 a 点水的电离程度最大,A 错误;等体积 混合,浓度减半,a 点溶质为(NH4)2SO4 与 Na2SO4,根据物料守 恒,c(NH+ 4 )+c(NH3·H2O)=c(SO24-)=0.05 mol·L-1,B 错误;b 点溶液显中性,溶质为(NH4)2SO4、Na2SO4 和 NH3·H2O,NH+ 4 会 水解,离子浓度大小关系为 c(Na+)>c(SO24-)>c(NH+ 4 )>c(OH-)= c(H+),C 错误;b 点溶液为中性溶液,溶质为(NH4)2SO4、Na2SO4 和 NH3·H2O,再加入 NaOH 溶液,发生的离子反应为 NH+ 4 + OH- NH3·H2O,D 正确。
高考素能提升十一 用守恒思想破解溶液 中粒子浓度关系
素养说明:判断电解质溶液中的粒子浓度关系是近几年高 考的重点题型。因综合性强、难度大且常考常新,成为考生失 分的重灾区。要想攻克此难关,需巧妙利用平衡观念和守恒思 想建立起等量关系,进行分析比较。从题点来看,单独考粒子 浓度比较有淡化的趋势,但是以图象为载体分析某点或某条件 时粒子浓度比较是近几年命题新趋势,复习时要多多归纳。本 部分充分体现了考生的“证据推理与模型认知”的化学素养。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届高考化学总复习提升方案——分布系数图及溶液中粒子浓度关系【考情分析】借助分布系数图判断电解质溶液中粒子浓度的关系,是高考常考题型,其中不同阶段粒子浓度关系的判断是近几年高考的热点和亮点。
如2018江苏化学14题考查NaOH溶液滴定H2C2O4过程中微粒的物质的量浓度关系;2017全国Ⅰ卷13题考查二元酸与NaOH溶液反应过程中粒子关系;2017全国Ⅱ卷12题考查二元酸随pH变化粒子关系等,该类题目的解题关键是正确判断溶液中溶质的成分及其量的关系,以及离子的电离程度和水解程度的大小。
该题型一般综合性强、难度较大,能够很好考查学生的分析推理能力,复习备考中应特别关注。
一、透析分布曲线奠定思维方向分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
一元弱酸(以CH3COOH为例) 二元酸(以草酸H2C2O4为例)δ0为CH3COOH分布系数,δ1为CH3COO-分布系数δ0为H2C2O4分布系数、δ1为HC2O-4分布系数、δ2为C2O2-4分布系数随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。
根据分布系数可以书写一定pH时所发生反应的离子方程式同一pH条件下可以存在多种溶质微粒。
根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH 时的平衡浓度二、熟悉两大理论构建思维基点1.电离平衡→建立电离过程是微弱的意识弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力。
如在稀醋酸溶液中:CH3COOH CH3COO-+H+,H2O OH-+H+,在溶液中,粒子浓度由大到小的顺序:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)。
2.水解平衡→建立水解过程是微弱的意识弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。
如稀的CH3COONa溶液中,CH3COONa===CH3COO-+Na+,CH3COO-+H2O CH3COOH+OH-,H2O H++OH-,溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。
三、把握三大守恒明确定量关系1.电荷守恒在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性。
2.物料守恒(原子守恒)在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变,符合原子守恒。
3.质子守恒在水溶液中由水电离出的H+和OH-总数相等。
四、抓准五个关键点形成思维模型以室温时用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1 HA溶液为例。
滴定曲线关键点离子浓度关系原点(点0) 原点为HA的单一溶液,0.1 mol·L-1 HA溶液pH>1说明HA是弱酸;c(HA)>c(H+)>c(A-)>c(OH-)反应一半点(点①) 两者反应生成等物质的量的NaA和HA混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)中性点(点②) 此时溶液pH=7,溶液是中性,酸没有完全被中和,c(Na+)=c(A-)>c(HA)>c(H+)=c(OH-)恰好完全反应点(点③) 此时二者恰好完全反应生成NaA,为强碱弱酸盐,溶液显碱性,c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)过量点(点④) 此时,NaOH溶液过量,得到NaA与NaOH 等物质的量的混合液,溶液显碱性,c(Na+)>c(OH-)>c(A-)>c(H+)考点指导1单一溶液中离子浓度关系【典例1】(安徽理综)室温下,下列溶液中粒子浓度关系正确的是()A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O-4)+2c(H2C2O4)C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO2-3)+c(OH-)D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)解析A项,由于S2-+H2O HS-+OH-、HS-+H2O H2S+OH-、H2O H++OH-,故离子浓度关系应为c(Na+)>c(OH-)>c(HS-)>c(H2S),错误;B项,符合电解质溶液中质子守恒关系,正确;C项,根据电荷守恒有c(Na+)+c(H+)=c(HCO-3)+2c(CO2-3)+c(OH-),错误;D项,根据物料守恒,离子浓度的关系应为c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+1-),2c(Cl错误。
答案 B【对点训练】1.常温下,浓度均为0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是()A.氨水中,c(NH+4)=c(OH-)=0.1 mol·L-1B.NH4Cl溶液中,c(NH+4)>c(Cl-)C.Na2SO4溶液中,c(Na+)>c(SO2-4)>c(OH-)=c(H+)D.Na2SO3溶液中,c(Na+)=2c(SO2-3)+c(HSO-3)+c(H2SO3)解析氨水为弱碱溶液,只能部分电离出氢氧根离子,结合电荷守恒c(NH+4)+c(H+)=c(OH-)可得:c(NH+4)<c(OH-)<0.1 mol·L-1,A错误;NH4Cl溶液中,铵根离子部分水解、氯离子浓度不变,则溶液中c(NH+4)<c(Cl-),B错误;Na2SO4溶液显中性,c(OH-)=c(H+),结合电荷守恒可得:c(Na+)=2c(SO2-4),溶液中离子浓度大小为c(Na+)>c(SO2-4)>c(OH-)=c(H+),C正确;根据亚硫酸钠溶液中的物料守恒可得:c(Na+)=2c(SO2-3)+2c(HSO-3)+2c(H2SO3),D错误。
答案 C2.(2018·郴州质检)已知NaHSO3溶液显酸性,NaHCO3溶液显碱性,现有浓度均为0.1 mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S元素或C元素),其中正确的一组是()A.c(Na+)>c(HRO-3)>c(H+)>c(RO2-3)>c(OH-)B.c(Na+)+c(H+)=c(HRO-3)+c(RO2-3)+c(OH-)C.c(H+)+c(H2RO3)=c(RO2-3)+c(OH-)D.c(Na+)=c(HRO-3)+c(H2RO3)+2c(RO2-3)解析A项,NaHCO3溶液显碱性,说明HCO-3的水解程度大于电离程度,离子浓度大小为c(Na+)>c(HCO-3)>c(OH-)>c(H+)>c(CO2-3),A错;B项,根据电荷守恒得,c(Na+)+c(H+)=c(HRO-3)+2c(RO2-3)+c(OH-),B错;C项,根据质子守恒得(可联合电荷守恒和物料守恒得到),c(H+)+c(H2RO3)=c(OH-)+c(RO2-3),C正确;D项,根据物料守恒得c(Na+)=c(RO2-3)+c(HRO-3)+c(H2RO3),D错。
答案 C考点指导2混合溶液及反应过程中离子浓度关系【典例2】(四川理综)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是()A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=K w1×10-9mol/LC.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/LD.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)解析实验①反应后溶液的pH=9,即溶液显碱性,说明HA为弱酸,二者等浓度等体积混合恰好反应生成KA,A-水解,A项正确;实验①反应后的溶液中,由电荷守恒式c(H+)+c(K+)=c(A-)+c(OH-)知,c(K+)-c(A-)=c(OH-)-c(H +),B项错误;因为HA为弱酸,如果与等体积等浓度的KOH溶液混合,溶液显碱性,若溶液显中性,则在两溶液体积相等的条件下,HA溶液的浓度应大于0.2 mol/L,所以实验②反应后的溶液中,c(A-)+c(HA)>0.1 mol/L,C项正确;实验②反应后溶液显中性,根据电荷守恒式c(H+)+c(K+)=c(A-)+c(OH-),且c(H+)=c(OH-),则c(K+)=c(A-),即c(K+)=c(A-)>c(H+)=c(OH-),D项正确。
答案 B【思维建模】酸、碱中和型离子浓度的关系【对点训练】3.向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol<n(CO2)≤0.015 mol时发生的反应是:2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3。
下列对应关系正确的是()选项n(CO2)/mol 溶液中离子的物质的量浓度A 0 c(Na+)>c(AlO-2)+c(OH-)B 0.01 c(Na+)>c(AlO-2)>c(OH-)>c(CO2-3)C 0.015 c(Na+)>c(HCO-3)>c(CO2-3)>c(OH-)D 0.03 c(Na+)>c(HCO-3)>c(OH-)>c(H+)解析A项,NaAlO2与NaOH的混合溶液,由电荷守恒有:c(Na+)+c(H+)=c(AlO-2)+c(OH-),有c(Na+)<c(AlO-2)+c(OH-),错误;B项,通入CO2,先与NaOH反应:2NaOH+CO2===Na2CO3+H2O(若NaAlO2先反应生成Al(OH)3溶于NaOH),此时为NaAlO2与Na2CO3的混合溶液,因AlO-2水解程度大(由题给反应可知AlO-2结合H+能力强于CO2-3),有c(CO2-3)>c(AlO-2),错误;C项,继续通CO2,发生题给反应:2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3,当n(CO2)=0.015 mol,此时为Na2CO3溶液,有c(CO2-3)>c(HCO-3),错误;D项,继续通CO2发生反应:Na2CO3+CO2+H2O===2NaHCO3,当n(CO2)=0.03 mol,此时为NaHCO3溶液,因HCO-3水解程度大于电离程度,溶液呈碱性,正确。
