第四讲镍氢二次电池材料分解
镍氢二次电池简述

世上无难事,只要肯攀登镍氢二次电池简述镍氢电池是由贮氢合金负极,镍正极,氢氧化钾电解液以及隔板等组成的可充电电池,它与镍镉电池的本质区别只是在于负极材料的不同。
这种电池的电压和镍镉电池完全相同,为1.2 伏,因此它可以直接用在使用镍镉电池的器件上。
镍氢电池的设想在七十年代开始有人提及,大量的研究集中在八十年代,工业化生产从九十年代初期开始。
作为负极材料的贮氢合金是由A 和B 两种金属形成的合金,其中A 金属(La,Ti,Zr 等)可以大量吸进氢气,形成稳定的氢化物。
而B 金属(Ni,Co,Fe,Mn 等)不能形成稳定的氢化物,但氢很容易在其中移动。
也就是说,A 金属控制着氢的吸藏量,而B 金属控制着吸放氢气的可逆性。
按照合金的晶体结构,贮氢合金可分为AB5 型,AB2 型,AB 型,A2B 型,固溶体型等,其中主要使用稀土金属的是AB5 型合金。
AB5 型贮氢合金主要由镧系元素和镍组成,同时少量添加铝,锰,钴等。
那么,是不是所有的贮氢合金都能作镍氢电池的负极材料呢?并非如此,目前主要是稀土系AB5 型合金在镍氢电池中实际应用。
可以作为电极材料的条件主要有:1.耐氧化性要大,在浓碱电解液中化学稳定性要好。
2.在较宽的温度范围内,具有较大的电化学容量。
3.催化活性要高,电极反应的可逆性要好。
4.随着吸放氢循环产生的劣化要少。
5.初期活化的次数要少。
作为负极材料的AB5 型贮氢合金,最初研究使用的是LaNi5 合金,由于价格上的问题,逐渐改用了MmNi5 系合金,在实用化过程中又使用少量铝,锰,钴等置换镍。
目前,镍氢电池的生产企业主要集中在日本。
下表列出了日本主要镍氢电池厂家及其工厂所在地和月产能力。
其中松下电池工业,东芝电池,三洋电机三家企业的生产量就占日本总产量的。
第四讲镍氢二次电池材料分解

产品特性
• • • • • 广泛性:适用于任何地方、任何装置 长寿电池:循环使用1000周期以上 即用性:本身带电几乎等于干电池 可长期保存:理想的“待机王” 卓越性能:5倍于普通干电池
2.3 Ni/MH电池的应用
笔记本电脑与镍氢电池
混合动力车与镍氢电池
混合动力车与镍氢电池
三、镍氢电池的结构与原理
2019/2/19
39
四、镍氢电池结构材料
民用的镍氢电池属于低压镍-氢电池,以Ni(OH)2 作为正极,以贮氢合金作为负极,氢氧化钾碱性水溶 液为电解液。 正极材料:氢氧化镍; 负极材料: 贮氢合金; 电解质:主要采用氢氧化钾。 其它材料:还有一些相关高分子材料,比如电池隔膜 材料、密封材料、粘结剂等,这些材料的优劣对电池 的自放电、充放电循环性能和使用寿命、电池的稳定 性等也起着至关重要的作用。
二、 镍氢(Ni/MH)电池
2.1、常用镍氢电池的种类
镍氢扣式充电电池系列
镍氢方形电池可充电电池系列
20
常 用 小 型 镍 氢 电 池
2019/2/19
13
镍氢可充电池组系列
镍氢9V可充电池系列
动力型镍氢电池(组)
2019/2/19 14
2.2 Ni/MH电池的概况 镍氢电池是由贮氢合金负极,镍正 极,氢氧化钾电解液以及隔板等组成 的可充电电池,它与镍镉电池的本质 区别只是在于负极材料的不同。这种 电池的电压和镍镉电池完全相同,为 1.2伏,因此它可以直接用在使用镍 镉电池的器件上。镍氢电池的设想在 七十年代开始有人提及,大量的研究 集中在八十年代,工业化生产从九十 年代初期开始。
二次电池简介
一次电池或原电池:电池能放电,当电池电力用尽时无 法再充电的电池。 市场卖的碱性电池,锰锌电池,水银电池,都是一 次性电池。一次电池又称原电池,只能用来放电且在放 电后,不能用一般的充电方法获得复原的电池,它只能 将化学能一次性地转化为电能,不能将电能还原回化学 能。
《二次电池材料》课件

目录
• 二次电池简介 • 二次电池材料种类 • 二次电池材料的性能特点 • 二次电池材料的制备工艺 • 二次电池材料的未来发展与挑战
01
二次电池简介
二次电池的定义与分类
总结词
二次电池是一种可以充电和放电的电池,通常由正极、负极、电解液和隔膜组成。根据不同的分类标准,二次电 池可以分为多种类型。
负极材料
1 2
石墨
成本低、稳定性好、循环寿命长,是最常用的负 极材料。
硅复合材料
具有高能量密度和良好的电化学性能,是下一代 负极材料的研究重点。
3
钛酸锂(Li4Ti5O12)
具有高安全性、快速充电能力和长寿命等特点, 常用于动力电池领域。
电解液
锂盐
如LiPF6、LiBF4等,是电解液的主要成分,对电 池的电化学性能有重要影响。
04
二次电池材料的制备工艺
固态法
总结词
固态法是一种制备二次电池材料的方法,通过将原料粉末混合、压制成型、烧结等步骤,制备出电池 正负极材料。
详细描述
固态法是将原料粉末混合均匀后,通过压制成型或造粒技术制成一定形状的电极材料。在烧结过程中 ,原料粉末发生物理和化学变化,形成晶体结构,从而获得所需性能的电极材料。固态法具有工艺简 单、成本低、易于控制等优点,是制备二次电池材料常用的方法之一。
02
二次电池材料种类
正极材料
磷酸铁锂(LiFePO4)
01
具有高能量密度、稳定性好、寿命长等优点,是当前最常用的
正极材料之一。
钴酸锂(LiCoO2)
02
能量密度高、循环性能好,常用于消费电子产品。
镍钴锰酸锂(LiNiCoMnO2)
储氢材料的分类及镍氢电池的机理

储氢材料分类狭义上讲,储氢材料[8]是一种能与氢反应生成金属氢化物的物质;但是它与一般金属氢化物有明显的差异。
即储氢材料必须具备高度的反应可逆性(可反复进行吸储氢和释放氢的可逆反应),而且,此可逆循环的次数(循环寿命)必须足够多,循环次数超过5000次。
实际上,它必须是能够在适当的温度、压力下大量可逆的吸收和释放氢的材料。
对于理想的金属储氢材料应具备以下条件:1.在不太高的温度下,储氢量大,释放氢量也大;2.氢化物的生成热一般在-46 ~ -29 kJ/mol H2之间;3.原料来源广,价格便宜,容易制备;4.经多次吸、放氢,其性能不会衰减;5.有较平坦和较宽的平衡压力平台区,即大部分氢均可在一持续压力范围内放出;6.易活化,反应动力学性能好。
就目前发表的资料看,储氢材料尚无明确的、公认的分类方法,本文把它分为以下4类:(1) 金属(或合金)储氢材料氢几乎可以同周期表中的各种元素反应,生成各种氢化物或氢化合物。
但并不是所有金属氢化物都能做储氢材料,只有那些能在温和条件下大量可逆的吸收和释放氢的金属或合金氢化物才能做储氢材料用。
例如:目前以开发的具有实用价值的金属型氢化物有稀土系AB5型;锆、钛系Laves相AB2型;钛系AB型;镁系A2B型;以及钒系固溶体型等几种。
金属与氢反应的实验模型如图1-1所示。
图1-1 合金储氢材料与H2反应示意图Fig.1-1 The reaction chart of metal with H2(2) 非金属储氢材料从目前的研究的情况分析,能够可逆的吸放氢的非金属材料[9,10]仅限于碳系材料、玻璃微球等非金属材料,是最近几年刚发展起来的新型储氢材料。
例如碳纳米管、石墨纳米纤维、高比表面积的活性炭、玻璃微球等。
这类储氢材料均属于物理吸附模型,是一种很有前途的新一代储氢材料。
(3) 有机液体储氢材料某些有机液体[11,12],在合适的催化剂作用下,在较低压力和相对高的温度下,可做氢载体,达到贮存和输送氢的目的。
《二次电池材料》课件

3 安全性
电池的安全性是至关重要的,一种理想的二次电池材料应该具有低风险的热失控和短路 发生概率。
二次电池材料的研究进展
新材料的发展
科学家们正在积极研发新型二次电池材料,以提 高电池性能、延长循环寿命和减少成本。
《二次电池材料》PPT课 件
这份PPT课件将带你了解什么是二次电池材料,它们的用途和重要性,以及 二次电是指可重复充放电的电池中使用的物质。了解这些材料的性质和特点对研发更先进的二次 电池至关重要。
二次电池工作原理
1
电池反应机制
2
充电时,正极材料通过氧化还原反应
释放电子,负极材料则吸收电子。放
电时,反应反转。
3
充放电过程
二次电池通过充电将电能储存,然后 通过放电释放储存的能量。这个循环 可以多次重复。
电性能优化
为了提高电池的性能和循环寿命,需 要研究和优化材料的特性,如容量、 电导率和界面稳定性。
常见二次电池材料
钴酸锂
钴酸锂被广泛用作锂离子电池的正极材料。它具有高充放电效率和较高的能量密度。
磷酸铁锂
磷酸铁锂是一种持久性电池材料,能够提供稳定的电流输出,适合用于电动车等应用。
锰酸锂
锰酸锂具有良好的循环稳定性和大容量,是一种常用于可穿戴设备和移动电源的电池材料。
二次电池材料的性能要求
1 容量
二次电池材料的容量决定了电池可以储存和释放的能量量。高容量的材料能提供更长的 续航时间。
2 循环寿命
制备方法改进
改善二次电池材料的制备方法可以提高生产效率、 优化材料性能并减少对环境的影响。
结论
二次电池材料在当今社会中发挥着重要作用,影响着电动汽车、可再生能源 储存等领域的发展。未来的发展趋势是发掘更多的新材料和提高电池性能。
镍氢电池

镍氢电池的定义常见二次电池性能对比镍氢电池的工作原理转变成NiOOH,负极则发生水分解反应,合金充电时,正极Ni(OH)2镍氢电池的电极反应过充电时,由于正极上的Ni(OH)2已全部转变成NiOOH,电极反应变成为电解水的析氧反应,O2扩散到负极,在储氢合金的催化作用下得到电子形成OH-。
过放电时,正极上的NiOOH已全部转变成Ni(OH)2,水在镍电极上被还原生成H2,生成的H2在储氢合金上消耗掉。
过充过放时的电极反应1. Ni(OH)2的晶型2. Ni(OH)2的制备方法化学沉淀法粉末金属法电解法树脂交换法3. Ni(OH)2的添加剂Co添加剂稀土添加剂4. 影响Ni(OH)2的因素5. 纳米Ni(OH)21.氢气的储存方法2.储氢合金的性能评价(1) 储氢合金的热力学性能氢与储氢合金接触时首先形成含氢固溶体(α相),当氢的吸收达到饱和后,固溶体与氢反应生成金属氢化物(β相)。
横坐标表示固相中的储氢量,纵坐标表示氢压。
当温度T1不变时,随着氢压的增加,氢溶于金属的数量逐渐变大,金属吸氢,形成固溶体(α相)。
当达到氢在金属中的极限溶解度A点时,α相转变成β相,继续加氢,系统压力不变,氢在恒压下被金属吸收,所有α相都转变成β相,到达B点。
AB段为两相的共存区,这段曲线呈平直状,称为平台区,相应的压力称为平衡压力,该段横坐标代表了有效储氢量。
当温度升高时,平台上上方移动,平台变短。
因此,低温有利于吸氢,高温有利于放氢。
(2)储氢合金的电化学性能3. 储氢合金的类型是不是所有储氢合金都能用作用于MH-Ni电池的负极材料呢?显然不是,MH-Ni电池负极材料的储氢合金应满足以下条件:1. 电极基体材料2. 隔膜隔膜的性能指标有外观、厚度、电阻、吸碱率、干湿强度、耐腐蚀能力、吸液速度及杂质含量等,其中电阻是关键指标。
3. 电解液4. 导电剂5. 胶黏剂。
20120520 镍氢电池基本知识ppt

三、表征镍氢等二次电池的主要技术参数
AA1400 循环寿命
1400 1200 1000
Capacity
800
600
400
200
0 0 50 100 150 200 250 300 350 400 450 500
Cycle numbers
三、表征镍氢等二次电池的主要技术参数
5、电池高倍率放电性能
5.1 电池高倍率特性表征 (C或者It)
1650 1500 1350 1200 1050
20، و 0، و -10، و -20، و
Voltage
900 750 600 450 300 150 0 0 2 4 6 8 10 12
Dischage duration (min)
六、镍氢电池的主要分类与选用原则
6.1 镍氢电池主要分类方法:
A:按放电倍率分类 (IEC标准): 低倍率型 (L):(≤ 0.5 C) 中倍率型 (M):(≤ 3.5 C) 高倍率型 (H):(≤ 7.0 C) 超高高倍率型: (X):(≥ 7.0 C) B:按放电倍率分类 (凯恩分类方法): 低倍率型 :(≤ 1.0 C) 中倍率型: (≤ 5.0 C) 高倍率型: (≤ 10.0 C) 超高高倍率型: (≥10.0 C)
1.4 1.2 1.0
Voltage
0.8 0.6 0.4 0.2 0.0 0 30 60 90 120 150 180
Storage days at 50 centi陷
爆炸:任何条件下严禁发生
短路及微短路:一定比例
一般单体千分之几到万分之几
正常使用条件下漏液:
能量 密度 高倍率放 自放电 电特性 环境 兼容性
镍氢电池的结构工作原理

镍氢电池的结构工作原理
镍氢电池是一种典型的二次电池,它由正极、负极、电解质和隔膜组成。
正极:正极由镍氢化合物制成,其中的活性物质是镍氢化物(NiMH)。
这种材料可以与氢气发生反应,在充电时将氢气储存为氢氧根离子(OH-)。
在放电时,氢氧根离子会转化为水。
负极:负极由金属氢化物制成,其中的活性物质是锑氢化物(SbH3)。
在充电时,锑氢化物会释放出氢气,而在放电时则会接收氢气。
电解质:电解质一般使用氢氧化钾(KOH),它能够提供离子导电的环境。
隔膜:隔膜的作用是防止正负极直接接触,防止短路,并允许离子的交换。
工作原理:
1. 充电:在充电时,外部电源提供直流电,正极上的氢氧根离子(OH-)被氧化成氧气,负极上锑氢化物(SbH3)发生还原反应,释放出氢气。
氧气和氢气会分别在正负极的表面反应,将氢氧根离子和氢气转化为氢氧根离子(OH-)和水,并储存在电池中。
2. 放电:在放电时,电池外部形成电路,氢氧根离子(OH-)在正极上发生还原反应,转化为水,同时释放出电子,电子通过外部电路流动至负极。
负极上的
锑氢化物(SbH3)被氢气氧化,同时接收电子,转化为锑氢化物。
整个充放电过程中,镍氢电池通过氢气与氢氧根离子的转化,实现了电能与化学能的转换。
镍氢电池的循环使用可重复多次,具有高能量密度、低自放电率、无污染等优点。
《镍氢二次电池》教程

镍氢二次电池序\前言序氢是元素周期表中的第一号元素。
平常说到氢,包含氢元素(hydrogen)和氢单质(H2)两个方面。
在历史上把氢的发现归功于英国科学家卡文迪什(Henry Cavendish),他在1776年发表的论文中谈到了氢气的制备与性质。
177年,法国著名化学家拉瓦锡(Antoine Laurent Lavoisier)通过实验证明水是由氢和氧组成的,并把元素氢定名为hydrogen,即"水素"。
氢是宇宙中最丰富的物种,在地壳中其丰度也是较高的。
在自然界中,氢气单质较为少见,主要以化合态形式存在(如水、有机物等)。
氢作为能源的最早文字记载大概出现在1870年古尔斯·费恩(Gulesverne)所写的一本科学幻想小说《神秘岛》中,他在书中写道:"我相信总有一天可以用水来作燃料,组成水的氢和氧可以单独地或合在一起来使用,这将为热和光提供无限的来源,所供给光和热的强度是煤炭所无法达到的......水将是未来的煤炭。
"费恩在那时就已经认识到化石燃料资源是有限的,使用化石燃料的年代将告终结。
20世纪上半叶,人类已经将氢气用于充装飞船,并进行把氢气或液氢作燃料的实验。
20世纪60年代,氢氧燃料电池发展起来,并发现具有可逆吸放氢特性的LaNi5、TiFe、M92Ni 等储氢合金。
至1970年,许多科学家已经意识到要解决能源危机和化石燃料对环境造成的污染问题,必须开发新能源与可再生能源,并预见氢能将是未来的能源之一。
氢能作为一种可再生能源,具有资源丰富、燃烧热值高、燃烧或电化学反应产物无环境污染等优点。
现在科学家们则要探讨如何迎接"氢能经济"时代的到来。
随着社会文明和科学技术的进步,各种小型和动力电池已经在民用、军事、宇航等领域得到广泛应用并发挥重要作用。
对于解决汽车尾气排放污染的电动车辆更加依赖于综合性能优良的电池的成功开发。
作为新型二次电池之一的镍/金属氢化物二次电池,是一种高能绿色环保电池,它以Ni(oH)2作正极活性物质,储氢合金作负极活性物质,电解液采用KOH水溶液,实现了可逆充放电使用。
Ni-MH_(镍氢)电池的原理演示文稿

1.1 一次电池与二次电池有哪些异同点?
1.1.1 一次电池只能放电一次,二次电池 可反复充放电循环使用。 1.1.2 可充电电池在放电时电极体积和结 构 ag asggggggggggggggggggggggggggggggggg ggggggggggggggggggggggggggggggggggg ggggggggggggggggggggggggggggggggggg gg。
1.4化学电池的分类及比较:
1.5 镍氢电池的结构组成及电化学 原理是什么?
正极片(含活性物质Ni(OH)2、 导电剂、导电泡沫镍 等) 负极片(含活性物质储氢合金粉、导电铜网) 隔 膜 ( PPgggggggggggggggggggggggggggggggggggggg gggggggggggggggggggggggggggggggggggggggggg gggggggggggggggggggggggggggggggggggggggggg ggggggggggg
1.8电池包装组合及设计的目的是什么?
1.美观品牌(印字商标的设计) 2.电池电压的限制要获得较高电压需串 联多只电池 3.保护电池防止短路延长电池使用寿命 4.尺寸的限制 5.便于运输如纸箱纸盒的设计等 6.特殊功能的设计如防水特殊外型设计 等
1.9IEC规定的可充电电池的标识方法是什么? 根据IEC标准镍氢电池的标识由5 部分组成 1. 电池种类KR—镍镉电池,HF—镍氢圆形电池, HR—镍氢方形电池 2. 电池尺寸资料包括圆形电池的直径高度,方形电 池的高度宽度厚度,数值之间用斜杠隔开,单位 mm 3. 放电特性符号L表示适宜放电电流倍率在0.5C以 内 M 表示适宜放电电流倍率在0.5-3.5C以内 H 表示适宜放电电流倍率在3.5-7.0以内 X 表示电池能在7-15C高倍率的放电电流下工作
镍氢电池知识

镍氢电池基本知识及特点简介一:镍氢电池的特点和二次电池的简介镍氢电池是以镍氧化物作为正极,储氢金属作为负极,碱液主要为氢氧化钾作为电解液制成的电池;这种电池是早期镍镉电池的替代产品,相对于镍镉电池来说,镍氢电池具有更加引人注目的优势;它大大减少了镍镉电池中存在的“记忆效应”,这使镍氢电池的使用更加方便,循环使用寿命更加长久;此外,镍氢电池还具有电容量高、放电深度大、耐过充和过度放电、充电时间短等明显的优点;下面列出目前使用的四种可充电池化学反应式;电池标称电压:电池标称电压:电池标称电压:电池标称电压:上述电池中,铅酸电池的电解液为硫酸H2SO4,镍镉与镍氢电池的电解液均为氢氧化钾KOH,锂离子电池的电解液则为含有锂盐的有机液体或固态高分子电解质;镍镉与镍氢电池使用相同的正电极,即氧化镍的氢氧化物NiOOH;镍氢电池的负极为镧系元素A与镍B形成的储氢材料,有AB5和AB2两种化学物;镍氢电池的充放电反应可视为氢离子H+在正、负电极间的来回运动;锂离子电池的正电极材料在上面反应式中以锂钴氧化物LixCoO2为例的,事实上,这类材料的发展方兴未艾,包括锂锰、锂镍、锂锡及锂钒等氧化物,而锂离子电池的充放电反应则是锂离子Li+在正、负电极间的来回运动;总言之,二次电池均靠氧化还原反应来实现,在充电时将电能储存为化学能,然后在放电时将化学能转换为电能;二、影响镍氢电池性能的几个因素影响镍氢电池性能的因素有很多,包括正/负极板的基材,贮氢合金的种类,活性物质的颗粒度,添加剂的类别和数量,以及制作工艺、电解液、隔膜、化成工艺等许多方面;下面就添加剂Co、电解液、隔膜以及化成工艺等对电池性能的影响这几方面进行一下简要的探讨;1、正极添加CoO对电极性能的影响将钴添加到NiOH2电极中,主要是以形成高导电性之CoOOH,在活化阶段充电过程中,被氧化成CoOOH,从而提高极片的导电性,由于此反应不可逆,因此添加Co对电极的容量并无贡献;在NiOH2电极中添加钴能增加其质子导电性和电子导电性,从而提高正极活性物质的利用率,改善充放电性能和增大析氧过电位,从而降低充电电压提高充电效率;但是过量的钴添加不但导致电池成本增加,还将降低放电电位;添加量对正极利用率的影响:添加极少量的2Wt%表面未经预氧化的CoO 即可获得较高的正极活性物质利用率,在5Wt%-10Wt%范围内可获得最佳的效果;在加入量高于10Wt%后,电池容量反而有所下降,这是由于添加量太高,减少了活性物质的填充量,则电池容量不可能提高,而且亦加大正极制作成本;钴加入量对电池大电流放电性能的影响:钴的加入对改善电池大电流放电性能具有很好的效果,加入量越多,大电流放电性能越好,但加入量过多,成本亦升高越多,且电池容量下降,合适的比例为5Wt%-10Wt%;钴在电活化期间第一次充电,由于CoOH2的氧化电位比NiOH2的氧化电位低,这导致在Ni OH2转化为NiOOH之前便形成稳定的CoOOH,既大大降低了颗粒之间的接触电阻,也大大提高了颗粒与基体的导电性;如果放电结束后电压不明显低于,则CoOOH不再参与电池后续反应,这样负极就获得了对应于提供的这一总电荷的预先充电;如果随后放电使正极的可用容量已耗尽,但由于预先充电的缘故,负极仍然有放电储备,它在一定程度上可以避免电池充电末期负极大量析氢,并保证氢气复合效率;电解液对电池性能的影响电解液作为电池的重要组成部分,它的组成、浓度、数量的多少以及杂质的种类和数量都将对电池的性能产生至关重要的影响;它直接影响电池的容电量、内阻、循环寿命、内压等性能;通过对比发现,电解液一般采用大约7mol/l的KOH溶液也有以一定NaOH 代替KOH的,当然电解液中也有加入少量其他成分如LiOH等的,但对一些杂质诸如碳酸盐、氯化物、硫化物等均要求较高;电池的正、负极片只有在电解液中才能发生电化学反应;对于一颗封口的成品电池来说,其中的空间是一定的;若电解液太多,会造成封口气室空间变小而使电池在充放电过程中的内压上升;另一方面,电解液太多造成堵塞隔膜孔,阻止了氧气的传导,不利氢气迅速复合,也会使电池的内压上升并可能氧化极片致使极片钝化容量下降,内压的上升可能造成电池漏液、爬碱、使得电池失效;但若电解液太少,会使得极片不能完全浸渍到电解液,从而电化学反应不完全或者说极片的某些部分不能发生电化学反应,使得电池容量达不到设计要求,内阻变大,循环寿命变短;应该注意电解液的浓度,以减少浓差电阻;为何电池在贮存和使用过程中循环会出现内阻升高和放电容量降低以及充电效率降低呢原因是多方面的:首先,添加剂Co在贮存和使用过程中会往极片的深层扩散或者说迁移,从而导致极片表面的Co含量降低,从而使得极片表面的接触电阻增大表现为内阻上升,从而降低充电效率和析氧过电位,最终导致放电容量下降;其次,在循环过程中,极片被电解液腐蚀,导致极片粉末松散、脱落或者说接触不好粒子与粒子、粒子与基材之间导致内阻升高,以及过度充/放电致使极片受到损伤;其三,可能是由于极片膨胀,把隔膜中的电解液挤干和吸出,由于电化学反应总是从表面开始进行而后再向深层发展,因此导致电化学反应不完全,导致放电容量下降;并由于电解液的匮乏,致使内阻升高浓差电阻和离子传导电阻/迁移电阻升高,充电电位升高,放电电位下降;其四,可能是由于电解液中的水份在循环或储存一段时间之后,以某种目前尚不清楚的形式存在,如结晶水、被范德华力束缚、被氢键等力所束缚,而不能参与电化学反应即升高了电解液的浓度,致使电化学过程中离子传导困难,内阻升高,充电电位升高,放电电位下降,最终导致放电容量下降;最后,也可能是由于电池在循环或储存过程中,电解液被重新分配、扩散和渗透到极片的深层中去,致使电极表面的电解液量下降,而电化学反应总是从表面开始进行而后再向深层发展,因此导致电化学反应不完全从而出现一系列的问题;当然,电池在使用过程中过度充/放电,致使电池洩压,氢气/氧气在洩出的同时带出电解液,从而使得电解液干涸,也是重要原因之一;解剖开贮存和使用过的电池,会发现电池内部的极板和隔膜纸干燥目视,也许是以上所述原因之一或几个因素共同作用的结果;隔膜对电池性能的影响隔膜作为电池的正、负极之间的隔离板,首先其必须具备良好的电绝缘性,其次由于它于电解液中处于浸湿状态,其必须具备良好的耐碱性;并且要有良好的透气性等;因此我们应当选用在较宽广温度范围内-55℃-85℃保持电子稳定性、体积稳定性和化学稳定性,对电子呈高阻,对离子呈低阻,便于气体扩散尽量薄的隔离板;隔膜性能的好坏在很大程度上将影响电池的循环寿命和自放电状况;隔膜在循环过程中逐渐干涸是电池早期性能衰退的主要原因;隔膜的吸碱量、保液能力和透气性是影响电池的循环寿命的关键因素;隔膜的亲水性可保证良好的吸碱量和保液能力;而憎水性可提高隔膜的透气性;隔膜变干与下列因素有关:1)隔膜本身性质的变化如:吸液速度和保液能力变差;2)极片在充放电过程中发生膨胀将隔膜中电解液挤出和吸出;3)电极表面活性和气体复合能力变差,电池过充时正极产生的氧气未能快速复合掉,造成电池内压升高,达到一定压力后从安全阀洩压而造成电解液损失;电池的自放电也与隔膜有关;有人认为:镍氢电池中镍电极的活性物质与氢气发生反应是MH-Ni电池自放电的主要原因微短路也是原因之一:NiOOH+1/2H2→NiOH2其中的氢气是由于过充电静置后,储氢合金释放出其中的部分氢原子复合而成,因此我们需要有较好透气性的隔膜板,此处的透气性并不是指通透气体而是指能通透协带氢或氧原子的离子的透气性;电池不过充或不充饱可降低漏电率,目前不少厂商的电池充饱电后静置30天持电率可超过70%常温常压状态;当然,隔膜纸除了以上所述的条件外,还应当具有足够的机械强度和韧性,以保证电池在卷绕和极片膨胀时不至于断裂;热和电活化对电池性能的影响采用封口化成工艺的镍氢电池在活化初期及大倍率充电时内压过高,造成电池漏液爬碱,容量下降,寿命缩短,安全性能变差,而且化成时间较长;对封口的镍氢电池进行热处理即热活化,可以对其性能进行改善,尤其是对内压的改善;其本质原因是:热处理的过程中,负极中的贮氢合金表面在强碱性电解液的作用下,较快地偏析出大量的镍原子族即形成富镍层,镍原子族均匀分散在其它疏松金属氧化物和氢氧化物或其水合物中,在镍原子族的催化作用下,过充时正极所产生的氧扩散到负极表面,并与贮氢合金中的氢反应,重新化合成水,改善贮氢合金的消氧机能,降低电池内压;另外,热处理时可降低电解液的表面张力,促成电解液的均匀分布,有利于电化学反应的均匀进行;热活化的时间、温度不同对电池性能的影响也不同,时间太短达不到预期效果;时间太长则浪费时间,效率太低;温度太低反应速度过慢,温度太高可能会导致电池短路,极片膨胀厉害,影响电池性能;一般以50-80℃为宜,2-8小时比较合适;电活化过程初期,首先发生的反应是CoO+OH-=CoOOH此反应为不可逆反应,由此使得正极片的导电性大大增强因NiOH2基本不导电而且NiOOH的导电性也较差,从而降低电池的内阻和充电电压,提高充电效率和放电容量;因此可以让负极预先充电,具有充电储备;而后期的电活化只是对电极进行充放电即NiOH2与NiOOH之间来回转化,通过这种来回转化晶型转换,在极片表面不断产生新鲜表面,使得电化学不断反应进行下去;在后期的电活化中,只要电池电压不低于,钴就不参与反应;为提高化成效率,一般以三个充/放电循环为好,充/放电电流应由小逐渐变大为佳;三、镍氢电池内压高与自放电的分析镍氢电池内压高原因分析镍氢电池内压高是指电池在充电过程中尤以大电流快充电时明显电池内部产生很多气体,造成电池内部压力升高;内压高会引起很多不好结果出现;比如:漏液气、爬碱、隔膜干枯、电池寿命缩短;镍氢电池在充电时的电化学反应为:正极:6NiOH2 –6e + 6OH-→ 6NiOOH + 6H2O ①负极:LaNi5 + 6H++6e→ L aNi5H6②正极在充电过程中到充电末期会发生析氧的反应2H2O+ 4e → O2+4H+ ③产生的游离氧透过隔膜与负极的LaNi5H6发生水合反应2LaNi5H6 + 3O2+6e → 2LaNi5+ 6H2O ④这样正极产生的氧气被负极复合成水,电池内部总的气压不会上升,维持平衡;为防止电池充电过程中内压升高,有利于反应④式有效进行,在设计电池时一般将负极容量设计成正极的倍,同时在正极中添加5 Wt %~10 Wt %的CoO粉,达到维持电池内压均衡的目的;尽管如此,由于追求高容量和大功率等性能,电池设计时不可避免的尽量在有限的空间内填充过多的活性物质,使多孔电极的孔隙率不同程度的降低,影响隔膜的透气性能,使氧气不能快速的透过隔膜与负极复合,因而电池内压升高;负极的合金粉材料也是影响镍氢电池内压的一个主要因素;主要原因是MH 合金的压力平台不穩定,需調整組分及P-C-T曲線;镍氢电池的自放电分析自放电又称荷电保持能力,它是指在开路状态下,电池储存的电量在一定环境条件下的保持能力;一般而言,自放电主要受制造工艺、材料、储存条件的影响,自放电是衡量电池性能的主要参数之一;通常电池储存温度越低,自放电率也越低,但也应注意温度过低或过高均有可能造成电池损坏无法使用; 一般地说,常规电池要求储存温度范围为-20至45℃;电池充满电开路搁置一段时间后,一定程度的自放电属于正常现象;IEC标准规定的镍镉及镍氢电池的自放电检测方法为,将充满电的电池在温度为20±5℃,湿度为65±20%条件下,开路搁置28天后,以电流放电到只,其放电容量与电池容量的比值即为荷电保持率电池自放电的基本类型:1、物理自放电;2、化学自放电;1、物理自放电:指由物理原因引起的自放电,电池发生自放电时,电子从电池负极流向电池正极形成电子电流与电解液中的离子电流形成电流回路;物理自放电的特点:①受温度影响小;②能导致电池最终开路电压为零;2、化学自放电:指由化学原因引起的自放电,电池发生自放电时,在电池的正极和负极之间没有电流形成;化学自放电的特点:①受温度影响较大;②受电池荷电状态影响较大;③化学自放电不能导致电池电压为零;引起电池自放电的原因及其特点1、隔膜①隔膜的隔离性能差●抗拉强度差●均匀性差②电子绝缘性能差③隔膜自放电的特点●物理自放电或化学自放电●整批出现●自放电程度接近2、极片①极片掉粉●极片掉粉自放电的特点A、物理自放电B、整批出现C、自放电程度接近D、拆开电池脱粉明显②卷绕错位3、集流体①集流体有毛刺②极耳焊接处有批锋③集流体自放电特点●物理自放电●个别出现●自放电程度严重●出现短路电池●拆开电池现象不明显4、杂质①电解液中杂质②极片活性物质中有杂质●正极活性物质自分解●负极活性物质自分解●极片活性物质自放电特点A、化学自放电B、整批出现C、自放电程度与荷电态有关③隔膜溶出物④杂质自放电特点●化学自放电●整批出现●自放电程度接近●拆开电池现象不明显5、其它原因①外部微短路②隔膜沉积导电物质自放电的危害1、自放电导致电池使用时间缩短;2、自放电导致电池寿命的提前终止3、自放电导致电池组内部各电池荷电量不等,对电池组的使用寿命极为不利五、MH-Ni电池的主要性能参数的定义额定容量:指在一定放电条件下,电池放电至终止电压时放出的电量;IEC 标准规定MH-Ni电池在20±5℃环境下,以充电16小时后以放电至时所放出的电量为电池的额定容量;倍率:指电池以1个单位额定容量下的电流为基准,当用某一个电流进行充电或放电时,与之对应的电流比值,我们就叫这个电流为XC;例如:AA2000mAh电池,1个单位额定容量下的电流是2000mA, 当用400mA、2000mA、4000mA进行充电或放电时,与之对应的电流比值为、1、2,我们就叫这个电流为C、1 C、2C;内阻:指电池充放电时,电池遇到的来自电池内部的阻抗;电池的内阻包括欧姆内阻和极化电阻;欧姆内阻是各组成部分的电子导电阻力,离子导电阻力及接触阻力,与电极结构和装配工艺有关;极化电阻是电极反应形成的,与电极反应的本质及电池材料有关;电池的内阻越小,电池工作输出电流时,造成电池内部的压降就越小,电池将输出较高的工作电压和较大的电流,输出能量和容量就越多;自放电:电池充足电后,在放置一段时间未使用的情况下,容量降低或损失的现象叫做“自放电”;循环寿命:充电电池经历一次充电和放电过程,称为一个循环或叫一个周期,在一定的充放电制度下,电池容量下降到某一规定值之前,电池所能耐受的循环次数,称之为充电电池的循环寿命;六、电池生产、使用的注意事项及问答1、电池充电:一般在0°C至40°C的环境温度下进行电池充电;充电过程的环境温度会影响电池的充电效率,所以在20°C至30°C下充电会达到最好的充电效率;在低于0°C下充电时,电池内的气体吸收反应将不正常,结果导致电池内压升高,这会促使电池排气阀启动释放出碱性气体,最终致使电池性能不断下降;在高于40°C下充电时,电池充电效率将下降,电池充电不完全并会缩短电池工作时间,而且会导致电池漏碱;严禁对电池进行反向充电对电池进行反向充电会引起电池内部气压急剧上升,这会促使电池排气阀启动释放碱性电解液,导致电池性能快速下降,还会出现电池膨胀和电池破裂的现象;应避免过充电,反复的过充电会导致电池性能下降;过充电是指对是已经充満电的电池再继续充电;2、电池放电:电池放电应在0°C至45°C的环境温度下;放电电流的大小将影响电池的放电效率,电池在至2CmA范围内电池的放电效率会比较理想;在温度低于0°C和高于45°C时,电池的放电容量将会下降,容量的下降会导致电池性能降低;应避免过放电,因为过放电深度放电会损坏电池的特性,所以在放电过程中要记住关闭电源开关,同时要避免电池长期与用电设备连接,在运输过程中不要将电池放入设备中一起运输;3、电池贮存:电池应贮存在干燥、低湿度、没有腐蚀性气体和温度在-20°C 至45°C的地方;当电池贮存在高湿度、温度低于-20°C或高于45°C的地方时,电池的金属部件会被侵蚀,电池还会因内部有机部件的膨胀和收缩导致碱液泄漏;因为长期贮存会加速电池的自放电和降低反应活性,所以长期贮存温度还应严格控制在10°C至30°C比较适合长期贮存;当在长期贮存后对电池进行第一次充电时,由于电池内部反应活性的降低会导致电池电压偏高和容量减少;为了使电池回复原始容量,应对这种情况下的电池进行反复多次的小电流充电和放电;当电池需要贮存一年以上时,要保证至少每一年对电池进行一次充放电,这样可防止电池漏碱和因电池自放电而导致的电池性能下降;4、不同容量的电池组合在一起使用会出现什么问题如果将不同容量或新旧电池混在一起使用,有可能出现漏液,零电压等现象;这是由于充电过程中,容量差异导致充电时有些电池被过充,有些电池未充满电,放电时有容量高的电池未放完电,而容量低的则被过放;如此恶性循环,电池受到损害而漏液或低零电压;5、电池出现零电压或低电压的可能原因是什么1) 电池遭受外部短路或过充,反充强制过放;2) 电池受高倍率大电流连续过充,导致电池极芯膨胀,正极直接接触短路;3) 电池内部短路,或微短路,如:正负极片有毛刺穿透隔膜纸接触短路,正负极片放置不当,造成极片接触短路,或正极片接触钢壳短路,负极掉料进隔膜纸,隔膜纸本身有缺陷,正极极耳接触负极片短路;6、电池对环境有什么影响现今几乎所有电池均不含汞,但重金属仍然是汞电池,可充电镍镉电池,铅酸电池的必要组成部分;如果处置不当,且数量较多的话,这些重金属将对环境产生有害的影响;7、电池鼓底凸肚甚至漏液的可能原因时什么1) 电池被过充,特别是高倍率大电流连续过充2) 电池被强制过放8、电池使用时有哪些注意事项1) 仔细阅读电池说明书,使用所推荐的电池;2) 检查电器及电池的接触件是否清洁,必要时用湿布擦干净,干燥后按正确极性方向装入;3) 无成人监护时,不要让儿童更换电池,小型电池如AAA应放在儿童不能拿到的地方;4) 不要将新,旧电池或不同型号电池混用;5) 不要试图用加热,充电或其它方法使一次电池再生;6) 不要将电池短路;7) 不要加热电池或将电池丢入水中;8) 不要拆卸电池;9) 用电器使用后应断开开关;10) 应当从长期不使用的用电器具中取出电池;11) 电池应保存在阴凉,干燥无阳光直射处;9、环境温度对电池性能有何影响在所有的环境因素中,温度对电池的充放电性能影响最大,在电极/电解液界面上的电化学反应与环境温度有关,电极/电解液界面被视为电池的心脏;如果温度下降,电极的反应率也下降,假设电池电压保持恒定,放电电流降低,电池的功率输出也会下降;如果温度上升则相反,即电池输出功率会上升,温度也影响电解液的传送速度温度上升则加快,传送温度下降,传送减慢,电池充放电性能也会受到影响;但温度太高,超过45,会破坏电池内的化学平衡,导致副反应;镍镉镍氢电池的放电效率在低温会有显著的降低如低于-15,而在-20时,碱液达到起凝固点,电池充电速度也将大大降低;在低温充电低于0会增大电池内压并可能时安全阀开启;为了有效充电,环境温度范围应在530之间,一般充电效率会随温度的升高而升高,但当温度升到45以上,高温下充电电池材料的性能会退化,电池的循环寿命也将大大缩短;10、什么是短路,对电池性能有何影响11、12、电池外两端连接在任何导体上都会造成外部短路,电池类型不同,短路有可能带来不同严重程度的后果;如:电解液温度升,内部气压升高,等气压值如果超过电池盖帽耐压值,电池将漏液;这种情况严重损坏电池;如果安全阀失效,甚至会引起爆炸;因此切勿将电池外部短路;。
镍氢电池材料

镍氢电池材料随着现代电子和通信技术的发展,对可充电蓄电池的需求量越来越大,性能要求越来越高,人们迫切要求得到一种具有高容量、长循环寿命、无毒副作用和廉价的可充电蓄电池。
最初使用的可充电电池主要以铅酸和镍-镉电池为主,但它们均存在着容量低和环境污染问题。
因此急需开发高容量、具有良好综合性能、无环境污染的二次充电电池,开发这种高性能电池是建立在这种高性能材料的基础上的。
1969年,荷兰飞利浦公司的研究人员发现金属间化合物LaNi5在室温下具有大量可逆吸放氢气的特性,从而引发了科研工作者对这类材料的深入研究。
由于储氢合金在电化学吸放氢过程中无电极消耗、无环境污染、因此Ni-MH电池的应用被竞相开发在各领域中应用,成为发展新一代可充电电池的重点研究对象。
1970年E.W.Justi等首先用LaNi5储氢材料来制作可逆氢电极,但由于在合金表面形成了氧化物钝化膜及随后合金分解成La(OH)3和Ni使合金容量显著下降,电极的循环寿命很短。
1984年Willem发现用Co替代部分Ni虽然会使LaNi5的容量下降,但循环寿命会显著提高,并通过研究得到了具有长循环寿命的La0.8Nd0.2Co2.4Si0.1合金,其1000次循环后的容量下降只有30%。
这些研究结果促进了在合金替换和制造工艺方面的广泛研究。
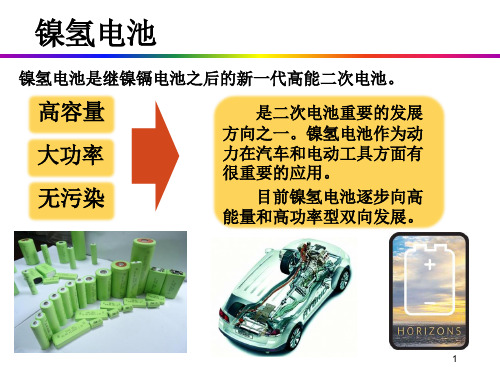
在这些研究的基础上,镍氢电池于1988年进入实用化阶段,Ni-MH电池是继镍镉电池之后的新一代高能二次电池。
作为新型镍氢电池其工作原理如下图所示。
充电时,在外电流的作用下,正极Ni(OH)2脱出H+,Ni+2氧化成Ni+3,Ni(OH)2转变为NiOOH。
脱出H+通过电解质溶液进入负极与电子结合成为氢原子,并与负极的储氢合金结合成为金属氢化物。
放电时,金属氢化物中的氢原子释放出点子转变为H+并从金属氢化物脱出,脱出的H+通过电解质溶液进入正极与NiOOH反应形成Ni(OH)2。
1. 正极材料镍氢电池的正极活性材料为Ni(OH)2。
镍氢电池制作工艺

镍氢电池制作工艺镍氢电池是一种常见的二次电池,其制作工艺主要包括以下步骤:1.配料:将正极活性物质(如镍氧化物或镍钴氧化物)与铝箔、聚合物粘合剂混合,形成正极浆料。
将负极活性物质(如氢化物)与碳材料、聚合物粘合剂混合,形成负极浆料。
2.涂布:将正极浆料均匀地涂布在铝箔上,形成正极片。
将负极浆料均匀地涂布在铜箔上,形成负极片。
3.碾压:通过碾压将正、负极片上的浆料压实,增加其密度,提高电池的能量密度和寿命。
4.分切:将正、负极片按照一定的尺寸分切成小片,方便后续的卷绕和组装。
5.卷绕:将正、负极片按照一定的顺序卷绕在一起,形成电池的雏形。
6.注入:将适量的电解质(如氢氧化钾)注入到电池中,起到传输氢气和导电的作用。
7.封口:将电池的开口处封住,防止氢气泄漏。
8.检测:通过电池检测设备对电池进行性能检测,如电压、内阻、容量等方面的测试。
9.包装:对检测合格的电池进行包装,以保护电池并提高其安全性。
在制作过程中,还需要注意以下几点:1.在配料过程中,要控制好各成分的粒度和比例,以保证电池的性能和稳定性。
2.在涂布过程中,要保证涂布的均匀性和一致性,防止出现电极片上的活性物质分布不均的现象。
3.在碾压过程中,要控制好压力和温度,以保证电极片的密度和结构稳定性。
4.在分切过程中,要采用高精度的切割设备,保证切割尺寸的准确性和一致性,从而保证电池组装时的稳定性和一致性。
5.在卷绕过程中,要采用先进的设备和技术,保证卷绕的精度和质量,防止出现电极片错位、断裂等问题。
6.在注入过程中,要保证注入的量和均匀性,防止出现电解质分布不均或局部过量等现象。
7.在封口过程中,要采用可靠的密封技术和材料,保证电池的气密性和安全性。
8.在检测过程中,要采用先进的测试设备和标准化的检测方法,以保证电池的性能和质量符合要求。
9.在包装过程中,要根据电池的类型和用途选择合适的包装材料和技术,保证电池的安全性和可靠性。
总之,镍氢电池制作工艺需要多方面的技术和设备的支持,只有在各个制作环节都得到充分保障的情况下,才能制造出高性能、高稳定性和长寿命的镍氢电池产品。
镍氢电池简介
10Leabharlann 1.1 MH-Ni 电池的基本原理
1.1.4 MH-Ni电池过充电时内部气体与物质的循环
在上面的反应中,假设镍氢电池本身过充电时负极是不析出氢气的。但 是如果电池化成不好,或储氢合金本身质量不好,使得金属氢化物电极表面 催化性能差,充电效率与充电容量将受到很大影响。充电量达到一定程度时, 负极产生氢气,氢气在正极上消耗或者被负极吸收的速度慢,这样,电池过 充时,电池内压就会增大,最终使电池漏液失效。 对于理想的镍氢电池,必须有性能非常好的金属氢化物电极以降低电池 的内压,增强负极符合氧气的能力。
Re(OH)3的形成: 正极析出的氧气 与合金粉末形成 Re(OH)3
Re(OH)3的增长: 随着充放电次数 的增加, Re(OH)3不 断增加,合金吸氢量 减少,电池内氢压增 大。
氢气泄漏和电解质溶 液损失: 氢压增加到一定 程度之后,氢气泄漏, 电解液损失,电池容 量减小。
18
储氢合金
在MH-Ni电池中,负极材料以储氢合金为活性物质, 因而负极又称为储氢电极(MH电极)。储氢合金在充电 和放电过程中,伴有吸氢和放氢反应,设计电极表面电化 学及体相扩散过程。特别是在大电流或高温工作时,储氢 电极对电池的综合性能有着极为重要的影响。
MH x xOH
0 0.49V
充电 放电
负极:
0 = 0.829V
xNi(OH )2 M
充电 放电
电池总反应:
MH x xNiOOH
4
0 1.319V
1.1 MH-Ni 电池的基本原理
从上述公式中得到什么?
2镍氢电池.

密封镍氢电池是新型的二次电池, 无论它的独特外形还是高达 4MPa 的内部压力都使人感到新奇。
镍氢电池由氢氧化镍正极,储氢合金负极,隔膜纸,电解液, 钢壳,顶盖,密封圈等组成。在圆柱形电池中,正负极用隔膜 纸分开卷绕在一起,然后密封在钢壳中的。在方形电池中,正 负极由隔膜纸分开后叠成层状密封在钢壳中。
NiOOH+H2O+e-Ni(OH)2+OH-
E(V) +0.490 -0.820 1.319 +0.401 -0.829 +1.23
1/2H2 + OH- H2O + e1/2H2 + NiOOH Ni(OH)2 2OH- 2e- + 1/2O2 +H2O 2H2O + 2e- 2OH- + H2 氧氢化学复合 1/2O2 + H2 H2O 不发生 H2O + e- OH- +1/2H2 1/2H2 + OH- e- + H2O 不产生
工作原理
• 其正极为氧化镍,负极为氢电极。它的 工作状态可以划分为3种:正常工作状态 、过充电状态和过放电状态。在不同工 作状态下,电池内部发生的电化学反应 是不同的。
表:镍氢电池的电极反应及对应的标准电位 工作状态 镍电极 正常 氢电极 总反应 镍电极 过充电 氢电极 电池反应 总反应 镍电极 过放电 (反极) 氢电极 总反应 电 极 反 应
Hale Waihona Puke 镍氢电池的应用前景• 镍氢电池的前景十分 乐观,随着研究工作 的进展,最终将在航 天领域内取代镉镍电 池
长期不用的电池保存和恢复方法 镍镉电池和镍氢电池特性不同,保存方法不同。 镍镉电池应将电用完保存,所以一般新镍镉电池是 基本没有电的,需要自己来充。采用正确的充电方 法,大概需要充放3-5次才能将电池恢复到最佳状 态。 镍氢电池要长期保存前,应该充电到80%左右保存。 因此新的镍氢电池有一些电,因为厂家已经预充电, 防止运输周转时间太长,而电池没电受到影响。长 期保存的镍氢电池用的时候,先将余电用完,再用 正确方法充放2-3次就可以恢复到最佳状态。
镍氢电池负极材料.

主要成分为稀土储氢合金 研究领域的重要方面之一。众所周知, 为了改善 AB5 型稀土系储氢合金的综合性能, 人们尝试了 各种替代元素来取代合金中的Ni 元素, 其中, Co 元素的作用主要是提高合金的循环寿命。但Co 是一种价格比较高的金属, Co 在合金中的含量 在很大程度上影响着合金的成本。
镍氢电池负极材料
什么叫镍氢电池?
镍氢电池是指Ni(OH)2为正极、储氢合金粉为负 极的二次电池。 正极采用镍氢氧化合物Ni(OH)2 负极采用储氢合金粉 电解质为溶解有KOH、LiOH、NaOH等碱性无机溶 液。 隔膜为PE、PP或尼龙
镍氢电池结构图
镍氢电池
负极
正极
镍氢电池特点
• 高能量密度 • 可快速充放 • 大电流放电特性 • 长循环寿命 • 电化学特性稳定 • 无污染,环保 • 无记忆效应
随合金中Co 含量的降低, 合金寿命 有所下降, 但最高容量有所提高, 对 活化性能影响不大。随合金中Al 含 量的增加, 合金最高容量和活化性 能变差, 寿命略有增加。
在研究范围内, 随着LaPCe 比的降低, 合金的最 高容量有所下降, 但幅度较小, 而循环寿命和电压 平台却有较大幅度的提高, 因而在一定范围内提 高合金Ce 的含量可以弥补由于Co 含量的下降所 引起的寿命下降。同时随合金中LaPCe 比的降低, 合金的韧性和合金的抗化学及电化学腐蚀性能得 到改善, 从而提高合金循环寿命。
应用领域
• 动力电池系列 • 个人护理系列 • 灯具系列 • 无绳电话系列 • 仪表 • 民用电池系列 • 医疗器械
镍氢电池主要材料-负极
贮氢合金
炭黑
铜网
MH 金属灰色粉末
黑色粉末
棕红色 99.99%铜
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2H2O + 2e- 2OH- + H2 氧氢化学复合 电池反应 1/2O2 + H2 H2O 总反应 镍电极 不发生 H2O + e- OH- +1/2H2 1/2H2 + OH- e- + H2O 不产生
-0.829 -0.829 0
过放电 (反极)
氢电极 总反应
电池的记忆效应
镍镉电池使用过程中,如果电量没有全部放完就开始 充电,下次再放电时,就不能放出全部电量。比如, 镍镉电池只放出80%的电量后就开始充电,充足电后, 该电池也只能放出80%的电量,这种现象称为记忆效 应。
23
3.2 工作原理
镍氢电池是以氢氧化镍作为正极,储氢 合金作为负极,氢氧化钾溶液做电解液。
它的工作状态可以划分为3种:正常工作状态、 过充电状态和过放电状态。在不同工作状态下, 电池内部发生的电化学反应是不同的。
• 它的工作状态可以划分为3种:正常工作状 态、过充电状态和过放电状态。在不同工 作状态下,电池内部发生的电化学反应是 不同的。
B.按电解质性质分类 按电解质性质可分为酸性电池(铅酸电池)、 碱性电池(氢镍电池)、中性电池、有机 电解质电池(锂离子电池,如Li-MnO2)、非 水无机电解质电池(Li-SOCL2锂-亚硫酰氯)和 固体电解质电池。
C.按活性物质的保存方式分类 按活性物质的保存方式可以分为:活性物质 保存在电极上面,其中有一次电池和二次 电池两种;活性物质保存在电池之外,使 用时通入电极,这类有非再生型燃料电池 和再生型电池。
二次电池简介
一次电池或原电池:电池能放电,当电池电力用尽时无 法再充电的电池。 市场卖的碱性电池,锰锌电池,水银电池,都是一 次性电池。一次电池又称原电池,只能用来放电且在放 电后,不能用一般的充电方法获得复原的电池,它只能 将化学能一次性地转化为电能,不能将电能还原回化学 能。
化学能 电能
二次电池或蓄电池:电池的充放电反应是可逆的。 放电时通过化学反应可以产生电能。通以反向电流 (充电)时则可使体系回复到原来状态,即将电能以 化学能形式重新储存起来。
第四讲 镍氢二次电池材料
目
录
• 一、电池的分类 • 二、 镍氢(Ni/MH)电池 • 三、镍氢电池的结构与原理 • 四、镍氢电池结构材料 • 五、 常见问题分析
பைடு நூலகம்
一、电池的分类
A.按工作性质分类: (1)原电池:又称一次电池。如:锌-锰干 电池、锌-汞电池、锂电池。 (2)蓄电池:又称二次电池,如:铅酸电池、 镉-镍电池、氢-镍电池、锂离子电池 (3)贮备电池:又称“激活电池”,使用前 临时注入电解液或用其它方法使电池激活。 如:镁-银电池、铅-高氯酸电池 (4)燃料电池:该类电池又称“连续电池”, 即将活性物质连续注入电池,使其连续放 电的电池。如:氢-氧燃料电池、肼-空气燃 料电池
二、 镍氢(Ni/MH)电池
2.1、常用镍氢电池的种类
镍氢扣式充电电池系列
镍氢方形电池可充电电池系列
2019/2/19
镍氢圆柱形可充电池系列
12
常 用 小 型 镍 氢 电 池
2019/2/19
13
镍氢可充电池组系列
镍氢9V可充电池系列
动力型镍氢电池(组)
2019/2/19 14
2.2 Ni/MH电池的概况 镍氢电池是由贮氢合金负极,镍正 极,氢氧化钾电解液以及隔板等组成 的可充电电池,它与镍镉电池的本质 区别只是在于负极材料的不同。这种 电池的电压和镍镉电池完全相同,为 1.2伏,因此它可以直接用在使用镍 镉电池的器件上。镍氢电池的设想在 七十年代开始有人提及,大量的研究 集中在八十年代,工业化生产从九十 年代初期开始。
电池全部放完电后,极板上的结晶体很小。电池部分 放电后,氢氧化亚镍没有完全变为氢氧化镍,剩余的 氢氧化亚镍将结合在一起,形成较大的结晶体。结晶 体变大是镍镉电池产生记忆效应的主要原因。
化学能
电能
典型的二次电池体系
Ni/Cd电池、Ni/MH电池和LIB电池主要性能对比
一次电池与二次电池的有哪些异同点?
• 一次电池只能放电一次,二次电池可反复 充放电循环使用 • 二次电池在放电时电极体积和结构之间发 生可逆变化,因此设计时必须调节这些变 化,而一次电池内部则简单得多,因为它 不需要调节这些可逆性变化 • 一次电池的质量比容量和体积比容量均大 于一般充电电池,但内阻(0.2-0.5Ω)远 比二次电池大,因此负载能力较低 • 另外,一次电池的自放电远小于二次电池。
表:镍氢电池的电极反应及对应的标准电位 工作状态 镍电极 正常 氢电极 总反应 镍电极 过充电 氢电极 电 极 反 应
NiOOH+H2O+e-Ni(OH)2+OH-
E(V) +0.490 -0.820 1.319 +0.401 -0.829 +1.23
1/2H2 + OH- H2O + e1/2H2 + NiOOH Ni(OH)2 2OH- 2e- + 1/2O2 +H2O
产品特性
• • • • • 广泛性:适用于任何地方、任何装置 长寿电池:循环使用1000周期以上 即用性:本身带电几乎等于干电池 可长期保存:理想的“待机王” 卓越性能:5倍于普通干电池
2.3 Ni/MH电池的应用
笔记本电脑与镍氢电池
混合动力车与镍氢电池
混合动力车与镍氢电池
三、镍氢电池的结构与原理
2.3 Ni/MH电池的优点
与Ni/Cd电池相比,Ni/MH电池具有以下显著优点:
(1)较低的成本 (2) 能量密度高,同尺寸电池,容量是Ni/Cd电池的1.5—2倍。 (3)无镉污染,所以Ni/MH电池又被称为绿色电池: (4)良好的快充性能 (5)电池工作电压也为1.2 V,与Ni/Cd电池有互换性。 (6)循环寿命长 (7)无记忆效应 (8)广泛的温度使用范围 (9)耐过充放电能力强,安全性能好
3.1、镍氢电池结构
镍氢电池由氢氧化镍正极,储氢合金负 极,隔膜纸,电解液,钢壳,顶盖,密封圈 等组成。 在圆柱形电池中,正负极用隔膜纸分开 卷绕在一起,然后密封在钢壳中的。在方形 电池中,正负极由隔膜纸分开后叠成层状密 封在钢壳中。
2019/2/19
22
2019/2/19
Prof. Guoyou GAN,Faculty of MSE,KMUST
