肠毒性大肠杆菌的绿色荧光蛋白转化及表达研究
荧光蛋白基因在大肠杆菌中的表达与检测

绿色荧光蛋白基因在大肠杆菌中的表达与检测一、背景介绍1.绿色荧光蛋白1955年,Davenport和Nicol 在太平洋海里的一种发光生物—维多利亚水母(Aequorea victoria)中发现并发表了荧光蛋白的生物发光现象,但是对生物发光现象的机理并不了解。
1962年,日本科学家下村修在水母中纯化鉴定出了一种能催化化学发光的蛋白质分子并将其命名为aequorin,aequorin能将化学能转化为光能,从而产生出波长为470nm的蓝色光(lmax=470nm),但是水母发出的光是独有的绿色,因此水母发光的蛋白质并非aequorin。
与此同时,发现和分离了一个受紫外线激发能发出绿色荧光的蛋白质—绿色荧光蛋白(GFP)。
1971年,Morin和Hastings提出了GFP这个名称。
1985到1992年间,科学家Douglas Prasher 测定完成了aequorin 和GFP的基因和蛋白质序列,并通过蛋白质序列分析和核磁共振分光术(NMR spectroscopy)确定了GFP发光位点。
1994年,美国科学家钱永健开始改造GFP,目前所用的大多数是钱永健实验室改造后的变种,有的荧光更强,有的可激活、变色。
1996年,解析得到了GFP的晶体结构,它的发光过程是也在日后的应用中得到了解答。
纵观整个过程,从1961年到1974年,下村修的研究遥遥领先,却很少有人注意。
在1974年以后,特别是八十年代后,绿色荧光蛋白的研究得到了广泛的重视和发展。
绿色荧光蛋白,分子质量约为28kDa,由238个氨基酸构成,第65~67位氨基酸(Ser-Tyr-Gly)形成发光团,经共价键连接而成对羟苯甲基咪唑烷酮,它可以被光激发产生荧光,是主要发光的位置。
绿色荧光蛋白分子的形状呈圆柱形,就像一个桶,发光的基团位于桶中央,因此,它可形象地比喻成一个装有色素的“油漆桶”。
其发光团的形成不具有物种专一性,发出的荧光稳定,且不需要依赖其他基质而发光。
实验五 用IPTG诱导大肠杆菌表达重组绿色荧光蛋白

实验五用IPTG诱导大肠杆菌表达重组绿色荧光蛋白一、目的要求1.学习和掌握重组蛋白在大肠杆菌中表达的原理和实验技术;2.观察大肠杆菌在诱导过程中的形态。
二、原理pET 系统是有史以来在E.coli 中克隆表达重组蛋白的功能最强大的系统。
目的基因被克隆到pET 质粒载体上,受噬菌体T7强转录及翻译(可选择)信号控制;表达由宿主细胞提供的T7 RNA 聚合酶诱导。
T7 RNA 聚合酶机制十分有效并具选择性:充分诱导时,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几个小时,目的蛋白通常可以占到细胞总蛋白的50%以上。
尽管该系统极为强大,却仍能很容易地通过降低诱导物的浓度来削弱蛋白表达。
降低表达水平可能可以提高某些目的蛋白的可溶部分产量。
该系统的另一个重要优点是在非诱导条件下,可以使目的基因完全处于沉默状态而不转录。
用不含T7 RNA聚合酶的宿主菌克隆目的基因,即可避免因目的蛋白对宿主细胞的可能毒性造成的质粒不稳定 (详见I. F.部分)。
如果用非表达型宿主细胞克隆,可以通过两种方法启动目的蛋白的表达:用带有受λpL 和 pI 启动子控制的T7 RNA 聚合酶的λCE6噬菌体侵染宿主细胞,或者将质粒转入带有受lacUV5 控制的T7 RNA聚合酶基因的表达型细胞。
在第二种情形下,可以通过在细菌培养基中加入IPTG 来启动表达。
尽管有时(例如非毒性目的蛋白) 可以直接将目的基因克隆到表达型宿主细胞中,但这种策略并不是通用做法。
两种T7 启动子以及多种拥有不同抑制本底表达水平的宿主细胞共同构成了一个极为灵活而有效的系统,使各种目的蛋白得以最优化表达。
三、试剂与器材试剂:LB培养基、IPTG、氨苄青霉素、草酸铵结晶紫染色液,路哥氏(Lugol)碘液,95%乙醇,0.5%沙黄染色液。
器材:摇床、显微镜等。
四、操作步骤A、诱导许多研究表明细胞生长速率严重影响外源蛋白的表达,因此必须对接种菌量、诱导前细胞生长时间和诱导后细胞密度进行控制。
绿色荧光蛋白在大肠杆菌中的克隆表达

实验用品
PEGFP -N3模板、菌株E. coli DH5 α、E. coli BL21 、质粒 pET28a 、 限制性内切酶 EcoRⅠ、 Hind Ⅲ、T4 DNA连接酶、1 kb DNA ladder
DNA 凝胶回收试剂盒及质粒小提试剂盒、DNA 纯化试剂盒及 IPTG、 PCR用试剂、卡那霉素、琼脂糖及 PCR 合成引物等、蛋白胨、酵母浸出 粉、琼脂粉等。
转化 筛选及复筛及酶切验证
PCR检测 IPTG诱导表达
SDS-PAGE检测目的蛋白
包涵体检测 分离纯化
电泳检测 酶切
pET28a质粒酶切位点选择
实验用品及方法介绍
方法介绍
研究绿色荧光蛋白在大肠杆菌体内的基因克隆和表达。通过质粒重 组形成所需要的重组质粒pET-28a-GFP,将重组质粒导入大肠杆菌 体内,通过酶切、PCR及用IPTG诱导检测是否在大肠杆菌体内诱导 表达成功。根据电泳结果及荧光现象得出结论,重组质粒在大肠杆
目
1 实验背景
2 实验用品及方法介绍
录
3 实验流程
4 实验原理
5 具体实验步骤
6 实验结果预测
7 参考文献
实验背景
200810月8日,瑞典皇家科学院宣布,2008年诺贝尔化学奖由 日本科学家下村修、美国科学家马丁·沙尔菲和美籍华裔科学 家钱永健获得,他们三人在发现和研究绿色荧光蛋白(GFP)方 面取得了突出成就。
目前应用较多的是GFP的突变体—增强型绿色荧光蛋白(简称EGFP)。 EGFP将GFP的第64位氨基酸苯丙氨酸突变成为亮氨酸,从而发射出的荧光 强度比GFP大6倍以上。
所以,EGFP比GFP更适合作为报告基因来研究基因表达、调控、细胞 分化及蛋白质在生物体内的定位和转运等
EGFP在大肠杆菌Ecoli中的表达与检测

contents
一 二 三 四 五
背景介绍 实验流程 实验步骤 预期结果 参考文献
第几章
一、背景介绍
1、绿色荧光蛋白(GFP) 2、质粒 3、大肠杆菌表达载体及表达系统 4、SDS-PAGE原理及蛋白分离与检测
一 1 - 绿色荧光蛋白
生物学研究
生态学研究
医学研究
一 2 - 质粒
2.1 pEGFP-N3质粒
一 2 - 质粒
2.1.1 pEGFP-N3质粒描述
pEGFP-N3 encodes a red-shifted variant of wild-type GFP (1–3) which has been optimized for brighter fluorescence and higher expression in mammalian cells. (Excitation maximum = 488 nm; emission maximum = 507 nm.) pEGFP-N3 encodes the GFPmut1 variant (4) which contains the double-amino-acid substitution of Phe-64 to Leu and Ser-65 to Thr. The coding sequence of the EGFP gene contains more than 190 silent base changes which correspond to human codon-usage preferences (5). Sequences flanking EGFP have been converted to a Kozak consensus translation initiation site (6) to further increase the translation efficiency in eukaryotic cells. The MCS in pEGFP-N3 is between the immediate early promoter of CMV (PCMV IE) and the EGFP coding sequences. Genes cloned into the MCS will be expressed as fusions to the N terminus of EGFP if they are in the same reading frame as EGFP and there are no intervening stop codons. SV40 polyadenylation signals downstream of the EGFP gene direct proper processing of the 3' end of the EGFP mRNA. The vector backbone also contains an SV40 origin for replication in mammalian cells expressing the SV40 T-antigen. A neomycin resistance cassette (Neor), consisting of the SV40 early promoter, the neomycin/kanamycin resistance gene of Tn5, and polyadenylation signals from the Herpes simplex virus thymidine kinase (HSV TK) gene, allows stably transfected eukaryotic cells to be selected using G418. A bacterial promoter upstream of this cassette expresses kanamycin resistance in E. coli. The pEGFP-N3 backbone also provides a pUC origin of replication for propagation in E. coli and an f1 origin for single-stranded DNA production.
荧光蛋白基因在大肠杆菌中的表达与检测

1μL 1μL 0.2μL
12.3μL 20μL 5min 45s 45s 120s 10min 无限制
}
29次循环
PCR扩增完后可进行琼脂糖凝胶电泳检测看是否有目的基 因。
6.目的基因的诱导表达——IPTG诱导表达
1.取含有重组质粒pET-28a的BL21(DE)菌株的单菌落,接种于 20mL含100μg/mL卡那霉素的LB液体培养基,37℃培养过夜。同 时取只含质粒载体pET-28a的BL21(DE)菌株的单菌落做实验对照。 2.分别取过夜培养物100μL接种于10mL含100μg/mL卡那霉素的 LB液体培养基(实验组转接两瓶),37℃恒温培养1~2h。当细菌 浓度A600达到0.4~0.6时,分别取出样品1mL作为IPTG诱导前的样 品,其余样品中添加100mmol/L的IPTG至终浓度为2mmol/L,其 中一瓶实验组不加IPTG的对照。继续培养,分别在1、2、3h和过 夜培养后各取1mL样品,作为诱导后的样品。
GFP各种突变体
GFP工作原理
• GFP形状呈圆柱形,如一个桶,负责发光的基团位于桶中 央,因此,GFP可形象地比喻成一个装有色素的“油漆桶”。 装在“桶”中的发光基团对蓝色光照特别敏感。当它受到蓝 光照射时,会吸收蓝光的部分能量,然后发射出绿色的荧 光。利用这一性质,生物学家们可以用绿色荧光蛋白来标 记几乎任何生物分子或细胞,然后在蓝光照射下进行显微 镜观察。原本黑暗或透明的视场马上变得星光点点——那 是被标记了的活动目标。
所用器材:
恒温水浴锅、EP管、微量移液器、PCR仪、His-Tag亲 和纯化柱等。
所用培养基:
LB培养基、麦康凯培养基
时间安排:
第一天:PCR获得目的基因,验证; 第二天:目的基因、pET-28a质粒双酶切,连接; E.coliBL21(DE)感受态细胞的制备; 第三天:重组质粒的转化; 第四、五天:重组子的筛选与验证:酶切验证和PCR验 证; 第六天:目的基因诱导表达; 第七天:目的蛋白的检测; 第八天:目的蛋白的纯化。
化学生物学综合创新设计实验——大肠杆菌中表达绿色荧光蛋白

3 试 剂与 仪 器
31 试剂 . 高保真 Tq酶 ,N P , T 卡那霉 素, a d T sI G, P 氯 化钙 ,4D A连接酶 , T N 限制性内切酶 Bm 和 Hn I a HI idI I
( a a a , 脂糖 , 乙啶 ,C 纯化试剂 盒 ( m g i TK R )琼 溴 PR O eaBo
18 6
江
西
农
业
学
报
2 3卷
显微镜检测表达情况。
t ,N P t ( . m 1 ,0 ue x d T s L 2 0m o) 1 B fr , L 2x X f2 普通 Tq a 酶 02 ( . U , . 25 )去离子水 1. 。反应条件 同4 1 33 . 中条件。将反应后产物进行琼脂糖凝胶 电泳检测 , 如果
验步骤。
收稿 日期 : 1 —0 2 1 6—2 0 5 ‘
笔者在任课教师 以往从事科研 的基础上 一 设计 ,
了该综 合 创 新 实 验 , 绿 色 荧 光 蛋 白基 因 将 插 入 p T 8 表达系统 , E 2a 进行绿色荧光蛋 白表达 , 并使用荧光
基金项 目: 国家水体污染控制与治理科技重大专项 (09 X 72 — 0 ) 河南农业大学博士启动项 目(00 1 1 。 20 Z 0 43 03 ; 3 307 ) 作者简介 : 赵仲麟(9 O )男 , 1 一 , 辽宁鞍山人 , 8 讲师 , , 博士 主要从事化学生物学及分子生物学的科研与教学工作。 通讯作者: 袁超。
江西农 业学报 2 1 ,3 8 :6 0 1 2 ( ) 17~18 6
AeaAgiu ua in x t rc h reJa g i
化 学生 物 学综 合创 新 设计 实验
绿色荧光蛋白(GFP)的基因克隆及表达

绿色荧光蛋白(GFP)的基因克隆及表达摘要绿色荧光蛋白(GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
采用PCR技术,对实验室提供的质粒pEGFP-N1中的目的基因进行扩增。
所得PCR产物和质粒pET-28b经过BamH I和Nde I双酶切后,用琼脂糖凝胶电泳法检测酶切产物的酶切情况并回收凝胶,再利用T4DNA连接酶将目的基因与载体连接起来,得到重组质粒。
将重组质粒导入克隆菌E. coli DH5a中培养扩增,提取阳性菌落质粒进行重组子鉴定,进而导入表达菌E. coLi BL-21大肠杆菌感受态细胞中,经IPTG诱导目的基因表达产生绿色荧光蛋白。
关键词:绿色荧光蛋白 PCR 基因克隆表达1.前言1.1绿色荧光蛋白(green fluorescent protein,GFP)绿色荧光蛋白是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
当受到紫外或蓝光激发时,GFP 发射绿色荧光[1]。
1.2 GFP 的结构GFP中央是一个圆柱形水桶样结构,如图二。
长420 nm,宽240 nm,由11 个围绕中心α螺旋的反平行β折叠组成,荧光基团的形成就是从这个螺旋开始的,桶的顶部由3个短的垂直片段覆盖,底部由一个短的垂直片段覆盖,对荧光活性很重要的生色团则位于大空腔内。
发色团是由其蛋白质内部第65-67位的Ser-Tyr-GLy自身环化和氧化形成。
1.3 GFP的研究应用GFP可标记细胞和蛋白质,具有广泛的应用前景。
GFP及其突变体已被广泛应用于基因表达调控、蛋白质空间定位、生物分子之间相互作用、转基因动物]2[等方面。
基于新型功能荧光蛋白的光学分子成像技术的发展,为在活细胞乃至活体动物内研究基因表达和蛋白质功能提供了更多的选择空间。
GFP还用于观察微生物、发育机理研究、细胞筛选、免疫学等方面。
本实验是利用实验室提供的质粒pEGFP-N1,其结构如图三所示。
其上有所用酶的酶切位点。
绿色荧光蛋白基因在大肠杆菌中的克隆与表达

/view/992207.ht m /view/2261117.h tm 郝福英 周先碗 朱玉贤 主编《基础分子生物 学实验》 北京大学出版社 2010年11月第 一版
实验仪器 实验材料 实验试剂
将pET-28a-GFP重组质粒转化入表达菌株 · 制备BL21(DE3)菌株的感受态细胞
10uL BL21(DE3)菌液接入3mL LB液体培养基,摇床培养过夜
二次活化:1:50比例接入新的试管摇床培养2h
1.5mL冰上10min
4 度,4000r/min离心2min收集细胞
涂平板: a)分别取50、100、150uL加入重组质粒的感 受态细胞悬液涂布于含抗生素的平板 b)抗生素板+IPTG+100uL重组质粒的感受态 细胞悬液 c)对照组感受态细胞100uL+抗生素平板 d)正面向上放置片刻,后37度倒置培养20h
重组阳性克隆菌接至3mL LB(Kan)液体培养基中,37度 培养16h 过夜菌1:50比例接种至4支试管中(每支试管含3mL LB(Kan)),扩大培养2h,测量A600值为0.5,停止 分别使用IPTG(最后总浓度为1mmol/L)诱导 0,2,4h 离心并照相
丝氨酸-酪氨酸-甘氨酸 生色基团 蛋白质折叠,生色基团得以“亲密接触”, 经环化形成咪唑酮,并发生脱水反应。但此 时还不能发射荧光,只有当有分子氧存在的 条件下,发生氧化脱氢,方能导致绿色荧光蛋 白发色团的“成熟”,形成可发射荧光的形 式。
蓝光、绿光与黄光 基因克隆 变体
分子标记 药物筛选 融合抗体 生物传感器 信号传导
标记!
真核细胞表达载体,pEGFP-N3载体上携带 有EGFP蛋白表达基因 很强的复制能力 高效的功能强大的启动子SV40和PCMV 多克隆位点 具有neo基因,可以采用G418来筛选已成 功转染了该载体的靶细胞
转化绿色荧光大肠杆菌(余梓棋、黄少凯、黄剑宇)
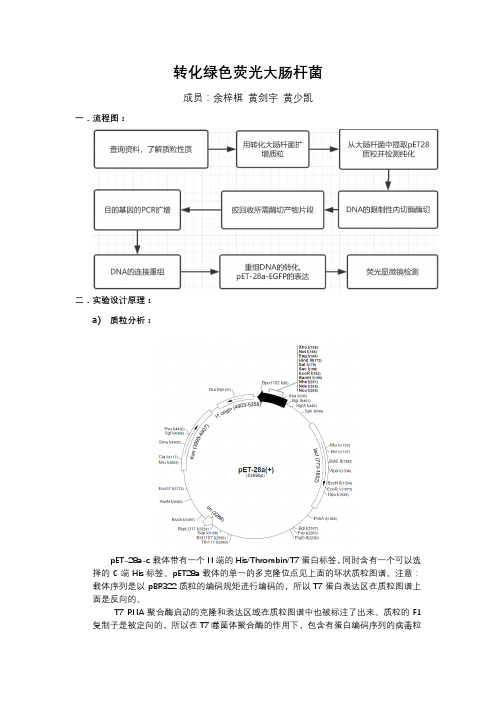
转化绿色荧光大肠杆菌成员:余梓棋黄剑宇黄少凯一.流程图:二.实验设计原理:a)质粒分析:pET-28a-c载体带有一个N端的His/Thrombin/T7蛋白标签,同时含有一个可以选择的C端His标签。
pET28a载体的单一的多克隆位点见上面的环状质粒图谱。
注意:载体序列是以pBR322质粒的编码规矩进行编码的,所以T7蛋白表达区在质粒图谱上面是反向的。
T7 RNA聚合酶启动的克隆和表达区域在质粒图谱中也被标注了出来。
质粒的F1复制子是被定向的,所以在T7噬菌体聚合酶的作用下,包含有蛋白编码序列的病毒粒子能够产生,并启动蛋白表达,同时蛋白表达将被T7终止子序列的作用下终止蛋白翻译。
pEGFP-N3为真核质粒,带有kan抗性基因,目标基因为EGFP蛋白基因。
选择酶切位点时,两个位点之间需包含该蛋白基因,不可切断。
根据需要,在多克隆位点中可选择EcoRⅠ——XhoⅠ,EcoRⅠ——XbaⅠ等酶切位点,同时为了简化实验步骤,选择两种酶的buffer相适宜的酶:Not I --BamH I。
b)DH5α:大肠杆菌DH5α是一种诱变菌株,主要表现对外源DNA的免疫缺乏。
是用于基因工程的菌种,相比于正常菌种缺少了一定的免疫机制。
DH5a复制稳定。
c)BL21 是蛋白酶缺陷株,表达出来的蛋白不会被降解,适合做蛋白表达。
BL21生长要比DH5a快,这是他们的又一区别,在高密度发酵BL21表达蛋白时,需要控制它的表达条件,使得高密度且高表达。
d)为了达到最佳的效果,我们的方案是先在DH5α上构建质粒载体然后转入BL21中表达。
三.实验材料a)实验器材i.自动PCR仪ii.震荡台iii.离心机iv.4摄氏度冷藏柜b)实验材料i.pET28aii.pEGFP-N3质粒iii.限制核酸内切酶1.Not I --BamH I2.双酶切体系,buffer选择酶试剂盒配套或使用通用缓冲液iv.大肠杆菌DH5αv.大肠杆菌BL21vi.冰水vii.恒温水浴锅viii.缓冲体系等四.实验步骤a)制备大肠杆菌DH5α感受态细胞。
绿色荧光蛋白(GFP)基因的克隆、表达和粗提取

绿色荧光蛋白(GFP)基因的克隆、表达和粗提取欧阳学文南方医科大学预防医学(卫生检验检疫)摘要目的:研究绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达,以及对其进行粗提取。
方法:从E.coli DH5ɑ中用碱提取质粒的方法提取质粒pEGFPN3和质粒pET28a。
然后用质粒DNA的琼脂糖凝胶电泳对已经提取的产物进行电泳,确定从大肠杆菌中成功提取了质粒。
再用限制性内切酶BamHI和NotI对成功提取的质粒进行酶切,并对酶切后的质粒进行琼脂糖凝胶电泳,用以确定已经提取了GFP基因。
将含有GFP基因的质粒转化到感受态细胞E.coli BL21中,用LB培养基对转化后的E.coli进行扩大培养。
用IPTG诱导GFP基因表达可以看到浅绿色菌落。
最后对绿色荧光蛋白进行粗提取。
结论:本实验有助于学生掌握最基本的分子生物学实验技术,为进一步的实验奠定基础。
关键词:绿色荧光蛋白基因克隆重组表达转化粗提取目录1 前言32 实验目的43 实验设备44 材料及试剂55 实验操作步骤55.1操作流程55.2质粒DNA的分离与纯化65.2.1 质粒的培养65.2.2 质粒的DNA的碱提取法65.2.3 质粒DNA的鉴定与纯化75.3酶切及连接85.3.1 双酶切85.3.2 回收酶切产物(采用DNA回收试剂盒进行回收)8 5.3.3 连接95.4大肠杆菌感受态细胞的制备及转化95.4.1 LB(LuriaBertain)液体和固体培养基的配制(参考附录)95.4.2.感受态细胞的制备 (CaCl2法)95.4.3 转化涂板105.5GFP蛋白的诱导表达105.6绿色荧光蛋白的粗提取11参考文献11附录121LB培养基的配制:122.溶液Ⅰ123.溶液Ⅱ124.溶液Ⅲ(100ML)125.DN ASEFREE RN ASE A136.TE缓冲液(P H8.0)137.20×TBE138.G ENE F INDER溴酚蓝上样缓冲液139.PEGFPN3质粒全图谱1310.P ET28A质粒全图谱141 前言绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
绿色荧光蛋白(GFP)基因的克隆和表达(新手详细注释版)

绿色荧光蛋白(GFP)基因的克隆和表达背景知识绿色荧光蛋白( green fluorescent protein , GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
当受到紫外或蓝光激发时, GFP 发射绿色荧光。
它产生荧光无需底物或辅因子。
发色团是其蛋白质一级序列固有的。
GFP 由 3 个外显子组成,长 2.6kb ;GFP 是由 238 个氨基酸所组成的单体蛋白 ,相对分子质量为27. 0kMr ,其蛋白性质十分稳定,能耐受 60℃处理。
1996 年 GFP 的晶体结构被解出,蛋白质中央是一个圆柱形水桶样结构,长 420 nm,宽 240 nm,由 11 个围绕中心α螺旋的反平行β 折叠组成,荧光基团的形成就是从这个螺旋开始的,桶的顶部由3 个短的垂直片段覆盖,底部由一个短的垂直片段覆盖,对荧光活性很重要的生色团则位于大空腔内。
发色团是由其蛋白质内部第 65-67 位的 Ser-Tyr-Gly 自身环化和氧化形成 .实验一质粒DNA 的分离与纯化一、实验目的掌握一种最常用的质粒 DNA 提取方法:碱裂解法。
该法用于从小量培养物中抽提质粒 DNA ,比较方便、省时,提取的质粒 DNA 质量较高,可用于 DNA 的酶切、 PCR 甚至测序。
二、基本原理质粒是一类在细菌细胞内发现的独立于染色体外,能够自主复制的稳定的遗传单位。
迄今为止,从细菌中分离得到的质粒都是环型双链 DNA 分子,分子量范围从 1kb 到200kb 。
质粒 DNA 可持续稳定地处于染色体外的游离状态,但在一定条件下又会可逆地整合到寄主染色体上,随着染色体的复制而复制,并通过细胞分裂传递到后代。
在大多数情况下质粒 DNA 复制中的酶体系和细菌染色体复制10-200 个拷贝。
当宿主细胞的蛋白时所用的酶是相同的。
有些质粒复制受宿主细胞复制作用的严格限制,因此每个细胞中只含一个或几个拷贝,称为严谨型质粒,有的质粒的复制受宿主细胞的控制不严,称为松弛型质粒,它们在每个细胞中的数目可达质合成受到抑制时(例如经氯霉素处理),细菌染色体虽不再增加,但松弛型质粒 DNA 可继续被复制,以至每个细胞内的拷贝数可以增至一千到几千。
绿色荧光蛋白_GFP_研究进展

酶活性及产量成为可能。
迄今为止,国外对纳豆激酶基因的研究仅限于Nadamura 等人利用鸟枪法得到了NK 基因,并将NK 基因重组到pUC19质粒上,转化到E.coli H B101受体菌中,该基因工程菌发酵产物具有胞外蛋白酶活性,但没有检测其溶栓活性。
至于对纳豆激酶基因表达及表达产物的研究还未见报道。
但与纳豆激酶同源性很高的枯草杆菌蛋白酶E 和枯草杆菌蛋白酶amylosacchariticus 都已有基因克隆的报道。
Y oshim otoT 等人利用穿梭质粒载体pHY 300P LK 克隆amylosac 2chariticus 基因,转化到四种不同的枯草杆菌中(ISW1214,M1111,I A510,I A274),发现转化菌株(ISW1214/PTH1)的蛋白水解酶的产率比宿主菌和基因供给菌分别提高20倍和4倍(Y oshim oto T ,1988年)[5]。
Mark L 等人将枯草杆菌蛋白酶E 基因克隆到穿梭载体pBS42上,转化枯草杆菌,表达的丝氨酸蛋白酶活性是野生型的5倍(Mark L ,1984年)[6]。
W ong 等人通过质粒整合和噬菌体pBS1转导绘制了枯草杆菌蛋白酶E 基因图谱。
研究表明,克隆化的枯草杆菌蛋白酶基因只在静止生长期表达,并且受δ37启动子的控制(Maria Y,1984年)[7]。
H T akagi 等人[8]将枯草杆菌蛋白酶E 基因克隆到嗜热表达载体上,实现了在嗜热杆菌中的表达。
近年来,我国掀起对纳豆激酶的研究和开发热潮,纳豆激酶的药用价值日益突出,我国学者渴望利用基因工程菌生产纳豆激酶,致使对纳豆激酶基因的克隆、表达、纯化及表达产物的产量和活性方面的研究取得了很大进展。
已经从不同菌株(枯草杆菌,纳豆杆菌,解淀粉芽孢杆菌)中克隆了纳豆激酶成熟肽基因,包括前导肽和成熟肽的纳豆激酶原基因,以及包括启动子、前导肽、信号肽和成熟肽的纳豆激酶全基因。
分别重组到温控型和诱导型质粒载体上,实现了在大肠杆菌、枯草杆菌和酵母菌中的表达。
分子生物学实验设计实验

分子生物学实验设计实验分子生物学实验设计实验题目:在大肠杆菌中表达绿色荧光基因(EGFP)学院:生命科学学院专业:生态学教师:吴传芳姓名/学号:余光辉/20方成/20一、实验目的在大肠杆菌中表达绿色荧光蛋白二、实验流程三、实验试剂、材料及步骤(一)质粒DNA的提取1.原理碱裂解法是一种应用最为广泛的制备质粒DNA的方法,其基本原理为:当菌体在NaOH和SDS溶液中裂解时,蛋白质与DNA发生变性,当加入中和液后,质粒DNA分子能够迅速复性,呈溶解状态,离心时留在上清中;蛋白质与染色体DNA不变性而呈絮状,离心时可沉淀下来。
经过苯酚、氯仿抽提,RNA酶消化和乙醇沉淀等简单步骤去除残余蛋白质和RNA,所得纯化的质粒DNA已可满足细菌转化、DNA片段的分离和酶切、常规亚克隆及探针标记等要求2.试剂LB培养液:胰蛋白胨(Tryptone)10g,酵母提取物(Yeastextract)5g,NaCl5g,琼脂(固体培养基)15g,用1NNaOH调pH7.5。
溶液Ⅰ:50mmol/L葡萄糖,10mmol/EDTA-Na,25mmol/LTris-HCl(pH8.0)溶液Ⅱ:0.4mol/LNaOH,2%SDS临用前1:1配制。
溶液Ⅲ:5mol/L醋酸钾60ml冰醋酸11.5ml双蒸水28.5ml卡那霉素(20mg/mL)抽提液(饱和酚:氯仿:异戊醇=25:24:1)无水乙醇70%乙醇TE缓冲液或ddH2O培养含有pET28a质粒和pEGFP-N3质粒的大肠杆菌收集裂解细菌、分离纯化质粒DNApET-28a-EGFP的表达及观察重组DNA的转化及重组子的鉴定质粒DNA的限制性内切酶酶切及重组DNA琼脂糖凝胶电泳检测3.材料含质粒pET-28a和pEGFP-N3菌液1.5ml塑料离心管EP管架微量取液器和取液器吸头常用玻璃器皿4.实验步骤(1)将带有质粒pET-28a和pEGFP-N3的大肠杆菌接种在液体培养基中(加氨苄青霉素50g/mL),37℃培养过夜(2)取培养菌液1.5mL置Eppendorf小管中,10000rpm2min,弃上清液(3)加入100L溶液I,漩涡器上充分混匀,在室温下放置10min(4)加入200L新配制的溶液Ⅱ,轻轻翻转2~3次,使之混匀,冰上放置5min(5)加入150L冰冷的溶液Ⅲ,加盖后温和颠倒数次使混匀,产生白色絮状物,冰上放置15min (6)10000rpm5min,取上清液于另一干净的离心管中(7)向上清液中加入等体积(约400L)酚/氯仿/异戊醇(25:24:1,v/v),振荡混匀,10000rpm10min,将上清液转移至新的离心管中(8)加入等体积(约370L)氯仿/异戊醇(24:1),混匀,离心2min,取上清液于新离心管中(9)向上清液加入2倍体积无水乙醇,混匀,-200C放置1h (10)12000rpm5min,倒去上清液,把离心管倒扣在吸水纸上,吸干液体(11)加0.8mL70%乙醇,离心1min,倒去上清液,真空抽干或室温自然干燥30min(12)加30LddH2O,-200C保存备用5.注意(1)饱和酚(取下层)单独吸200L,氯仿:异戊醇(24:1)吸200L(2)制备质粒过程中,所有操作必须缓和,不要剧烈振荡(特别是加入溶液II和III),以避免机械剪切力对DNA的断裂作用(二)DNA琼脂糖凝胶电泳检测1.原理在质粒提取的过程中,由于操作原因,提取的质粒可能有三种:线性DNA、开环DNA、闭环超螺旋DNA。
绿色荧光蛋白(GFP)原核表达分析

石河子大学分子生物学实验结课论文绿色荧光蛋白(GFP)原核表达分析学生姓名学号专业年级、班级指导教师所在学院中国·新疆·石河子2016年1月绿色荧光蛋白(GFP)原核表达分析摘要:本实验主要探讨目的蛋白(GFP)在大肠杆菌中的表达的情况以及鉴定目的蛋白形成的是包涵体还是可溶性蛋白。
本实验先对菌液进行培养、活化、然后采用IPTG分别对其不同时间点的诱导,用SDS-PAGE来确定目的蛋白的可溶性及其分子量,掌握GFP 诱导不同时间的表达情况的检测方法。
关键词:绿色荧光蛋白;SDS-PAGE;原核表达1 前言1.1实验目的掌握聚合酶链式反应(PCR)的原理和操作方法;了解重组载体的构建方法;锻炼学生查阅文献资料、设计与优化实验的能力;加强学生对化学生物学中常用研究方法的认知。
1.2实验背景绿色荧光蛋白(green fluorescent protein GFP) 是源于多管水母属等海洋无脊椎动物的发光蛋白,其在蓝光或紫外光下可发出明亮的绿色荧光,可以作为报告基因检测蛋白的特异性表达或进行细胞定位研究。
与以往lacZ、CAT 等报告基因相比,有很多无可比拟的优越性: GFP 不具有种属依赖性,在多种原核和真核生物细胞中都表达;荧光强度高,稳定性高;不需要反应底物与其他辅助因子,受蓝光激发产生绿色荧光,尤其适用于体内的即时检测;另外GFP 分子量小,易于融合,适用于多种转化方式,对受体无毒害,安全可靠;并且通过替换一些特殊氨基酸,可以使之产生不同颜色的光,从而适应不同的研究需要。
正是由于GFP 检测具有高灵敏度,操作简单,无需使用同位素等优点,近年来广泛用于基因的表达与调控、蛋白质的定位、转移以及相互作用、信号传递、转染与转化,以及细胞的分离与纯化等研究领域。
绿色荧光蛋白还在监测目的基因表达、研究细胞内物质代谢及追踪细胞系的分化等方面有着广泛应用。
采用GFP作为标记基因,可直接收集转化细胞供实验,缩短了筛选时间、减少对细胞活性的影响并可作为活体标记,为研究发育的基因调控和分子机制提供了一种简洁有效的手段。
绿色荧光蛋白(EGFP)克隆并在大肠杆菌表达

绿色荧光蛋白(EGFP)克隆并在大肠杆菌表达详细项目实施计划书生物技术1001班①EGFP基因完整的序列: ATGGTGAGCAAGGGCGAGGAGCTGTTCACCGGGGTGGTGCCCATCCTGGTCGAGCTGGACGGCGACGTA AACGGCCACAAGTTCAGCGTGTCCGGCGAGGGCGAGGGCGATGCCACCTACGGCAAGCTGACCCTGAAG TTCATCTGCACCACCGGCAAGCTGCCCGTGCCCTGGCCCACCCTCGTGACCACCCTGACCTACGGCGTG CAGTGCTTCAGCCGCTACCCCGACCACATGAAGCAGCACGACTTCTTCAAGTCCGCCATGCCCGAAGGC TACGTCCAGGAGCGCACCATCTTCTTCAAGGACGACGGCAACTACAAGACCCGCGCCGAGGTGAAGTTC GAGGGCGACACCCTGGTGAACCGCATCGAGCTGAAGGGCATCGACTTCAAGGAGGACGGCAACATCCTG GGGCACAAGCTGGAGTACAACTACAACAGCCACAACGTCTATATCATGGCCGACAAGCAGAAGAACGGC ATCAAGGTGAACTTCAAGATCCGCCACAACATCGAGGACGGCAGCGTGCAGCTCGCCGACCACTACCAG CAGAACACCCCCATCGGCGACGGCCCCGTGCTGCTGCCCGACAACCACTACCTGAGCACCCAGTCCGCC CTGAGCAAAGACCCCAACGAGAAGCGCGATCACATGGTCCTGCTGGAGTTCGTGACCGCCGCCGGGATC ACTCTCGGCATGGACGAGCTGTACAAGTA②PCR引物引物序列(5’-3’)酶切位点描述Pl GAC GGATCC ATGGTGAGCAAGGGCGAGGABamHI5’GFP geneP2GCC GAATTC TTACTTGTACAGCTCGTCCATG EcoR I 3’GFP gene实验使用的EGFP蛋白取自原核-真核穿梭质粒pEGFP-NB3B的蛋白质编码序列。
绿色荧光蛋白在大肠杆菌中的表达分子实验设计

绿色荧光蛋白在大肠杆菌中的表达张历涵2013141241098彭千2013141241068一、质粒转化入感受态细胞并培养1、原理实验室提供的质粒首先要转入大肠杆菌进行培养与增殖,制备出感受态的细胞,我们就可以方便的将需克隆的质粒导入其中,使其繁殖,就能获得大量质粒。
所谓感受态,是指细菌生长过程中的某一阶段的培养物,只有某一生长阶段中的细菌才能作为转化的受体,能接受外源DNA而不将其降解的生理状态。
感受态形成后,细胞生理状态会发生改变,出现各种蛋白质和酶,负责供体DNA 的结合和加工等。
细胞表面正电荷增加,通透性增加,形成能接受外来的DNA 分子的受体位点等。
本实验为了把外源DNA(重组质粒)引入大肠杆菌,就必须先制备能吸收外来DNA分子的感受态细胞。
2、实验步骤2.1 DH-5α和BL-21感受态细胞的制备(1)将0~4 ℃保存的DH-5α和BL-21菌种分别接种在LB液体培养基中37 ℃下250 r/min过夜培养16 h 。
(2)将分别接种过夜菌:LB按1:50的比例接种于2 mL的LB液体培养基中,37 ℃活化培养2~3 h至OD=0.3~0.5 。
(3)取1.5 mL菌液转入EP管中,置于冰上10 min, 然后于4 ℃下5000 r/min 离心5 min。
弃上清液,沉淀加入0.1 mL预冷的0.1 mol/L CaCl2缓和悬菌。
冰上放置15-30 min后,4 ℃下5000 r/min离心10 min。
(4)弃上清液,沉淀用0.1 mL预冷的0.1 mol/L CaCl2(含15%甘油)缓和悬菌,放在-20 ℃冰箱内保存。
2.2 感受态细胞的转化(1)取制备好的感受态细胞100 μl,冰上解冻,均匀悬浮。
(2)加入2 μl酶连产物,轻轻混匀,冰上静置10-30 min。
(3)42 ℃水浴中热击70 sec后,冰上放置2 min。
(4)加入200 μl LB液体培养基,37 ℃,50-100 rpm振荡培养1 h。
绿色荧光蛋白(GFP)基因的克隆与表达

分子生物学综合实验论文题目:绿色荧光蛋白(GFP)的基因克隆及表达中国·黄石2010年12月绿色荧光蛋白(GFP)基因的克隆与表达胡丽丹(湖北师范学院生命科学院0803班湖北黄石 43500)摘要:绿色荧光蛋白(GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
用碱裂解法提取的的质粒pEGFP-N3和pET-28α经过Bam HI和Not I双酶切连接后,得到pET-28α-pEGFP-N3重组质粒。
取部分的重组质粒做酶切实验,验证重组质粒的存在性,剩下的重组质粒导入表达菌 E. coLi BL-21大肠杆菌感受态细胞中。
重组有GFP基因的E. coLi BL-21,在含有1μL/mL的卡纳霉素的LB培养基上培养。
当A600达到0.7时,用终浓度为0.8mM 的异丙基硫代-β-D-半乳糖苷(IPTG)诱导培养3小时,离心得到下层绿蓝色沉淀物即可。
关键词:绿色荧光蛋白 GFP 基因的克隆荧光蛋白水母CLoning and Expression of Green FLuorescent Protein GeneHU Li-Dan( Class three Grade eight,College of Life Sciences department,Hubei Normal university ,Huangshi 435000)Abstract:Green fluorescent protein(GFP),one kind of bioluminenscent proteins ,hasbeen found existing in the internal of Coelenterates,such as fellyfish,polyp and coral pEGFP-N3 and pET-28αwas harvested by sodium dodecylsulfate(SDS) alkaline process extraction and Agarose Gel Electrophoresis.After treating the two targeted plasmids with Bam HI and Not I,the recombinant plasmid,namely pET-28α-pEGFP-N3, can be retrieved by furthermore Agarose Gel Electrophoresis. Taking slight recombinant plasmid proves that recombinant plasmid does exist by dienzyme cutting(Bam H I and Not I).The recombinant plasmid lefting would be transported to E. coLi BL-21the competent cells. E. coLi BL-21containing recombinant GFP gene was grown overnight in LB solid medium containing kanamycin (Final concentration: 1 μL/mL). When absorbance at 600 nm value was 0.7, isopropyL β-D-thiogalactopyranoside was added to 0.8 mM and the incubation was continued an addition 3 h.Key words:Green fluorescent protein Fellyfish Genetic Cloning Fluorescin目录1.前言:01.1绿色荧光蛋白(GREEN FLUORESCENT PROTEIN,GFP)01.1.1 GFP研究背景01.1.2 GFP研究应用11.2基因的克隆与表达22.实验试剂及实验仪器:42.1实验试剂与材料:52.2实验仪器:63.实验方法63.1质粒提取方法:63.2琼脂糖凝胶电泳及回收:83.3酶切及连接:93.4E. CO L I DH5Α或E. CO L I BL21感受态制备及转入:113.5酶切验证重组质粒:123.6GFP基因的表达133.6.1活化菌种133.6.2扩大培养133.6.3 IPTG诱导GFP基因的表达134.结果与分析134.1质粒提取过程中现象与结果:134.2琼脂糖凝胶电泳144.3E. CO L I DH5Α或E. CO L I BL21感受态制备及转入结果:154.4酶切验证重组质粒154.5GFP基因的表达结果:165.讨论:165.1提取质粒出现图六的原因是:165.2琼脂糖凝胶电泳出现图七、图八原因:175.3E. CO L I DH5Α或E. CO L I BL21感受态制备及转入出现图九、十原因:17 5.4酶切验证重组质粒出现图十一原因:195.5GFP基因的表达结果如图十二、十三原因:196.参考文献20前言:1.1绿色荧光蛋白(green fluorescent protein ,GFP )1.1.1 GFP 研究背景绿色荧光蛋白是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
绿色荧光蛋白的诱导表达与观察(1)

实验试剂与仪器
1. 2. 3. 4. 5. 6. 7. LB液体培养基(卡那抗性) pET28-GFP菌液(BL21菌株) IPTG 低温摇床 分光光度计 离心机 荧光显微镜
实验步骤
1. 将2 ml pET28-GFP菌液转接至50 ml LB液体培养基中,37℃振荡摇菌2-3小时; 2. 分光光度计测菌液OD值,当OD值达到0.4-1之间时可进行诱导; 3. 向菌液中加入25 ul IPTG母液(1 M/L)至终浓度为0.5mM; 4. 28 ℃ 诱导过夜。 5. 第二天离心收集菌体于-20 ℃保存。
3. 表达载体pET-28a
4. 荧光显微镜是以紫外线为光源, 用以照射被检物体, 使之发出 荧光, 然后在显微镜下观察物体的形状及其所在位置。荧光显微 镜用于研究细胞内物质的吸收、运输、化学物质的分布及定位等。 5.最早出现的绿色荧光蛋白(green fluorescent protein,GFP)是由下 村修等人在1962年在一种学名Aequorea victoria的水母中发现,之 后又在海洋珊瑚虫中分离得到了第二种GFP。其中水母GFP是由238 氨基酸组成的单体蛋白质,分子量约27KD,GFP荧光的产生主要是 在氧气存在下,分子内第67位的甘氨酸的酰胺对第65位丝氨酸的羧 基的亲核攻击形成第5位碳原子咪唑基,第66位酪氨酸的α-2β键脱 氢反应之后,导致芳香团与咪唑基结合,这样GFP分子中就形成对 羧基苯甲酸唑环酮生色团发出荧光。
绿色荧光蛋白的诱导表达与观察
实验目的
1. 掌握在大肠杆菌中诱导蛋白表达的实验方 法和实验方法
2. 了解原核表达的原理和荧光显微镜的工作 原理
实验பைடு நூலகம்理
1. E . coli 表达系统 E . coli 是重要的原核表达体系。在重组基因转化 入E . coli 菌株以后,通过温度的控制,诱导其在宿主 菌内表达目的蛋白质(绿色荧光蛋白),并通过荧光 显微镜进行观察。 2. 外源基因的诱导表达 提高外源基因表达水平的基本手段之一,就是将 宿主菌的生长与外源基因的表达分成两个阶段,以减 轻宿主菌的负荷。常用的有温度诱导和药物诱导。本 实验采用异丙基硫代-β-D-半乳糖昔(IPTG)诱导外源 基因表达。不同的表达质粒表达方法并不完全相同, 因启动子不同,诱导表达要根据具体情况而定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K 88下 游 引 物 序 列 :5′-AA TTG CTACG TTCAG CG GAGC-3′
K 99上游引物序列 :5′-AAAAACACTGCTAG C-3′ K 99下游引物序列 :5′-AGTAG TAAA TA CG CC-3′ 50 μL PCR反应体系中包含 10 ×PCR buffer;200 μm o l /L dNTP;50 p m ol 引物 P1 和 P2;5 U 的 T aq DNA 聚合酶 , M g2 +浓度为 2 mm o l /L. K88 PCR 循环参数 为 :96 ℃预变性 4 m in;然后进入 94℃ 60 s, 57℃ 60 s, 72℃ 60 s, 共 30 个循环 ;最后 72℃延伸 8 m in. K 99PCR 循环参数 与 K88 相 比 , 除了 复性的 温度 由 57℃改 为 55℃外 , 其余均 相同. 1. 3%的 琼脂糖 凝胶 电泳检 测 PC R 产物 . (6)标记菌株的血清型鉴定 将转化 3代的菌落和原始菌株与标准 K88 、K 99因 子血清做玻片凝集试验 , 鉴定其血清型. (7)转化前菌株和未转化菌株的生长曲线测定 取过夜培养物 , 按 1%接菌量置于新鲜的 LB液体 培养基 , 于 37 ℃ , 150 r /m in振荡 培养. 每隔 1 h 取 样 , 用紫外分光光度计测 OD 600 吸收值 , 重复 2 次. 以 时间为横坐标 , OD 600值为纵坐标做图 , 绘制生长曲线.
1. 2 实验方法
(1)质粒提取方法 挑取紫外灯下发绿色荧光的质 粒宿主菌 DH 5α 的单菌落 , 于 10 m L 含 100 μg mL -1 Am p的 LB液体 培养基中 , 37℃振荡培养过夜. 碱裂解法提取质粒 [ 4] . 提取的质粒用 0. 8%琼脂糖电泳检测纯度. (2)感受态细胞的制备 在 NA 液 体 中 摇 床震 荡 培 养 ETEC 至 O D600 为 0. 6, 取菌液冰浴 10 m in, 8 000 r /m in 4℃离心收集菌 体. 冰预冷的无菌水洗菌体 4次 , 最后将菌体 重悬于 10%甘油中 , - 70℃冰箱保存备用. (3)电击转化 2 mm 电转化杯冰上预冷后 , 分别加入 100 μL 感 受态细胞和 50 ng质粒 , 冰浴 10 m in后进行电击转化 , 电击条件为 2. 5 kV , 200 Ψ, 25 μF. 电击结束立即加入 900 μL 的 NA 培养基 , 混匀并转入 1. 5 mL 的 Eppendorf管中 , 于 37℃、120 r /m in的摇床上振荡培养 2 h, 取 100 μL菌液涂布在 NA +100 μg m L- 1Am p +6 m g mL -1阿拉伯糖 (a ra)筛选培养基上 , 并置于 37℃培 养箱培养 16 h. (4)转化子的荧光检测 将筛选培养基上长出的菌落 , 紫外灯照射检测绿 色荧光. 用接种环挑取稀释后的菌液置于载波片上 , 常 规压片 , 荧光显微镜观察. (5)标记菌株的 PCR鉴定
收稿日期 :2005-12-27 基金项目 :福建省发展和改革委员会重大产业技术开发专项
(2004-4-7)资助 作者简介 :朱红梅 (1981 -), 女 , 硕士研究生. *通讯作者 :fz liubo@163. com ;htzhou@ jingx ian. xmu. edu. cn
3 讨 论
近年来 , 国内外对 ETEC 的分子结构 、致病机理及 免疫防治研究进展迅速 ,取得了一些结果. 一般认为
O 抗原 K 抗原
表 1 菌株血清鉴定结果 Tab. 1 The se ro log ical identification results of stra ins
K88
K88-pG LO
products o f K88 and K 88 -pG LO M. M arker(100bp ladder); 1. the am plifica tion strand o f K 88 ; 2. the am plifica tion strand o f K 88 -pG LO
图 4 K99 、K99 -pG LO PCR 产物电泳分析图谱 F ig. 4 E lectrophoresis analysisfor the PCR am p lification
光显微镜检测均发现转 化菌株发出绿色的荧光 , 表明 gfp 基因得到稳定 、高效的表达. 进一步通过 PCR 分子鉴定 、血清型 鉴定 、微生物学特性分析均表明 , 转化菌株与原始菌株是一致的. 该转化菌 株将为研究 肠毒性大 肠杆菌的 致病机 理及益
生素的筛选提供有效的 手段.
关键词 :肠毒性大肠杆菌 ;绿色荧光蛋白 ;遗传转化 中图分类号 :Q 943. 2 文献标识码 :A 文章编号 :0438-0479(2006)S-0043-04
第 45卷 增刊 2006年 5月
Jou
rn
厦 门大学学 al of X iam en U
报 (自 然 科 学 版 ) nive rsity (Na tu ra l Scien
ce)
V o .l 45 Sup. M ay 2006
肠毒性大肠杆菌的绿色荧光蛋白转化及表达研究
produc ts of K99 and K99 -pGLO , M. M arker(100bp ladde r); 1. the am plification strand o f K99 ; 2. the am plification strand o f K99 -pG LO
图 5 K88 、 K88 -pG LO 生长曲线图 F ig. 5 The grow th g raph o f K88 and K 88 -pG LO
提取转化菌株及原始菌株基因组 DNA, 进行菌毛 结构基因的 PCR 扩增. K88 、K88 -pG LO 基因组 DNA 上 都扩增得到大小约为 800 bp的预期片段 (图 3);K 99 、 K 99-pG LO 基因组 DNA 上都扩增到大小约为 500 bp的 预期片段 (图 4). PCR鉴定结果表明转化后的宿主菌 与原始菌具有基因背景上的一致性.
细 菌 基 因 组 DNA的 提 取 方 法 参 照 少 量 制 备
44 厦门大学学报 (自然科学版 ) 2006年
DNA[ 5] 的 操作 步 骤 , 0. 8%琼 脂 糖电 泳 鉴 定基 因 组 DNA. 参考李鹏 [ 6] 的研究 , 根据发表的 K88 及 K 99菌毛 结构基因序列 , 分别合成 2对特异性引物.
K99
O138
O138
O101
K88
K88
K99
K 99 -pGLO O 101 K 99
增刊 朱红梅等 :肠毒性大肠杆菌的绿色荧光蛋白转化及表达研究 45
图 3 K88 、K 88 -pG LO PCR产物电泳分析图谱 F ig. 3 E lectropho resis analysis for the PCR am p lification
2. 3 转化子的血清型鉴定
血清学鉴定结果 (见表 1)表明 , 所转化菌株 K88 pG LO 、 K99 -pG LO 与未转化的宿主菌 K 88 、K99血清型一 致.
2. 4 未转化菌株和转化菌株的生长曲线比较
转化菌株与原始菌株的对照生长曲线如图 5、6所 示. 未转化菌株和转化菌株的生长状况一致. 显著性分 析表明转化菌株与原始菌株的差异不显著 (p >0. 05).
阿拉伯糖调控蛋白和 gfp基因. 蛋白胨为上海生工 BB I公司产品 , 酵母抽提物为
OXO ID 公司. dNTP s、TaqDNA 聚合酶 、购自上海生工 ; 100 bp DNA L adde r购自 B io labs.
BECKMAN 冷冻离心机 , B io-Rad Gene , OLYM PUS荧光显微镜.
肠毒素性大肠杆菌 (En tero tox igenic E scherich ia coli. , ETEC )是一类引起人和幼畜 (初生仔猪 、犊牛 、羔 羊及断奶仔猪 )腹泻的重要病原菌 , 初生幼畜被 ETEC 感染后 , 常因剧烈水样腹泻和迅速脱水而死亡 , 发病率 和死亡率均很高 , 是目前的研究热 点之一 [ 1] . 猪源产 肠毒素 性 大 肠杆 菌 的 黏附 素 抗 原 主 要 有 K 88 , K 99 , 98 7P.
本研究利用 gfp基因标记 ETEC, 希望获得 g fp 基 因稳定表达 、特性稳定的发光标记菌株 , 为进一步研究 ETEC 侵染途径及治病机理奠定基础 , 同时也方便益 生素的筛选及效果评价.
1 材料与方法
1. 1 材 料
肠毒性 大肠 杆 菌 菌 株 C83905 (K88 ac), C 83529 (K99)由福建省农科院畜牧兽医研究所提供. 质粒 pG LO 购自 B io-Rad公司 , 有 Am p (氨卞青霉素 )抗性和
2 结果与分析
2. 1 转化菌株荧光检测
电击转化后筛选培养基上长出的菌落 , 肉眼直接观 察呈绿色 , 用紫外光照射则发出强烈绿色荧光 (图 1). 用荧光显微镜观察 , 可看到清晰的绿色发光的杆状细 菌. 标记菌落分别命名为 K88 -pG LO 、K99 -pG LO (图 2).
2. 2 转化菌株分子鉴定
图 6 K99 、 K99 pG LO 生长曲线图 F ig. 6 The grow th g raph of K99 and K99 -pG LO
ETEC 属非侵袭性细菌[ 7] , 细菌进肠道后 , 借助位于细 菌表面的菌毛上的定居因子 (CFA a)粘附在宿主小肠 上皮细胞表面 , 细菌繁殖并分泌毒素 (耐热肠毒素 LT (heat stable enterotox in)和 或/ 不耐热 肠毒素 ST (hea t labile enterotoxin), 毒素进入细胞导致水钠代谢混乱 , 造成分泌性腹泻 ;但也有研究表明 , ETEC的致病机理 可能更复杂 , 仍有许多不明之处 [ 8] , 例如该菌 是否具 有侵袭性 , 毒素能否进入或影响肠道其它部位组织或 细胞 , 对 LT 与 ST 的作用部位问题一直未解决 [ 9] . 陈 清等[ 10] 通过切片观察到主要在空肠和回肠组织病变 , 有明显的炎症反应. 用免疫组织化学技术对毒素的定 位进行了观察 , 表明 LT 和 ST 除分布于粘膜上皮细胞 表层外 , 也分布于肌层细胞 , 甚至浆膜层 , 分布弥漫. 提 出一个假设 , LT 和 ST 能够通过细胞间隙进入上皮下 的粘肌层及肌层 , 作用于肌细胞. LT 或 ST 甚至可进入 血流 , 导致毒血症发生.
